Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение тканей высокой чистоты из развивающихся семян ячменя
В этой статье
Резюме
Здесь мы представляем протокол ручного выделения высокой чистоты и контроля качества эмбриона, эндосперма и материнских тканей семян во время всего развития семян ячменя.
Аннотация
Понимание механизмов, регулирующих развитие семян зерновых, имеет важное значение для селекции растений и повышения урожайности. Тем не менее, анализ семян злаков представляет собой сложную задачу из-за крошечного размера, жидкого характера некоторых тканей и тесных межтканевых связей. Здесь мы демонстрируем подробный протокол вскрытия эмбриона, эндосперма и материнских тканей семян на ранних, средних и поздних стадиях развития семян ячменя. Протокол основан на ручном препарировании тканей с помощью тонкозаостренных инструментов и бинокулярного микроскопа с последующим контролем чистоты на основе плоидного анализа. Семенные материнские ткани и эмбрионы являются диплоидными, в то время как эндосперм представляет собой триплоидную ткань. Это позволяет контролировать чистоту образца с помощью проточной цитометрии. Дополнительные измерения показали высокое качество выделенных из таких образцов РНК и их пригодность для высокочувствительного анализа. В заключение, этот протокол описывает, как практически препарировать чистые ткани из развивающихся зерен культурного ячменя и, возможно, других зерновых.
Введение
Семена представляют собой сложные структуры, состоящие из нескольких тканей материнского и дочернего происхождения1. Зерновые злаки представляют собой особый тип семян, большая часть которых состоит из эндосперма, специализированной триплоидной ткани, которая защищает и питает эмбрион. Зерновые обеспечивают около 60% мировых продовольственных ресурсов и являются наиболее ценным продуктом растениеводства2. Знание молекулярных процессов, контролирующих развитие семян зерновых, важно из-за их экономического значения и центральной роли в воспроизводстве растений 1,3.
Ячмень культурный (Hordeum vulgare subsp. vulgare; 2n = 2x = 14; 1C = 5,1 Gbp) является четвертой по значимости зерновой культурой в мире. Он используется в качестве корма для животных, продуктов питания и биотехнологии4. Кроме того, это также классическая модель зерновых культур умеренного пояса, имеющая растущее значение5. Геномные ресурсы ячменя включают генетические карты, коллекции сортов, местных сортов и мутантов, высококачественные сборки геномов и аннотации, а также транскриптомные данные основных стадий развития 5,6,7. Также гены ячменя используются для генетического улучшения других злаковых культур. Устойчивость к абиотическим стрессам, таким как засуха и засоление, специфические патогены и высокое содержание полезных соединений (например, β-глюкана) делают ячмень ценным источником признаков для селекции пшеницы8.
Развитие семян начинается с внесения удобрений в день опыления (DOP). DOP определяется путем оценки морфологии стигмы и пыльников в соответствии со шкалой Уоддингтона (W10.0)9. Колоски с неопыленными цветками характеризовались компактными (неразветвленными) рыльцем и зелеными пыльниками, тогда как опыленные колосы содержали удлиненные шипы, расширенное и широко разветвленное рыльце, вздутую семяпочку, раскрытые пыльники и свободную пыльцу. Цветы в DOP представляли собой промежуточный фенотип. Пыльники имели желтый цвет, легко разрушались и затем выделяли пыльцу. Рыльце имело широко распространенные сигматические ветви пестика (рисунок 1В).
Развитие семян ячменя включает три частично перекрывающиеся стадии 1,10. I стадия (0 – 6 дней после опыления; DAP) запускается двойным оплодотворением, типичным для которого является пролиферация клеток и отсутствие синтеза крахмала; стадия II (7 – 20 DAP) включает дифференцировку и большой прирост биомассы, сопровождающийся получением крахмала и молекул хранения белка; III стадия (после 21 DAP) соответствует созреванию семян, снижению массы путем высыхания и наступлению периода покоя. В качестве альтернативы фазы называются ранней, средней и поздней, соответственно11.
Зерно ячменя покрыто шелухой, которая состоит из леммы, палеи и чешуи12. У большинства генотипов ячменя шелуха плотно обволакивает сухие семена. Само семя состоит из эмбриона, эндосперма и материнских тканей семени (рисунок 1А). Диплоидный эмбрион возникает в результате оплодотворения яйцеклетки одним ядром сперматозоида. В полностью развитом семени зародыш состоит из зародышевой оси с колеоризой, окружающей корешок, колеоптил, заключающей меристему побега и первичные листья, и щитка (семядолей)1,10,13,14. Триплоидный эндосперм является результатом оплодотворения диплоидной центральной клетки вторым ядром сперматозоида. Пролиферация эндосперма начинается с синцитиальной (ценоцитарной) стадии, когда делящиеся ядра выталкиваются на периферию центральной вакуолью. В конце синцитиальной фазы микротрубочки образуют радиальную сеть вокруг ядер и указывают на образование антиклинальной клеточной стенки и начало клеточной трансформации эндосперма. Дифференцировка эндосперма происходит одновременно с целлюляризацией и приводит к образованию пяти основных тканей: крахмалистого эндосперма, транспортных клеток, слоев алейрона и субалейрона, а также области, окружающей эмбрион. Материнские ткани семени представляют собой многослойную диплоидную структуру материнского происхождения, содержащую околоплодник и семенные оболочки10,12. Материнские ткани семян включают нуцеллярную проекцию на дорсальной стороне зерна, которая выполняет функцию, связанную с транспортом, и встраивается в эндосперм на более позднихстадиях развития семени.
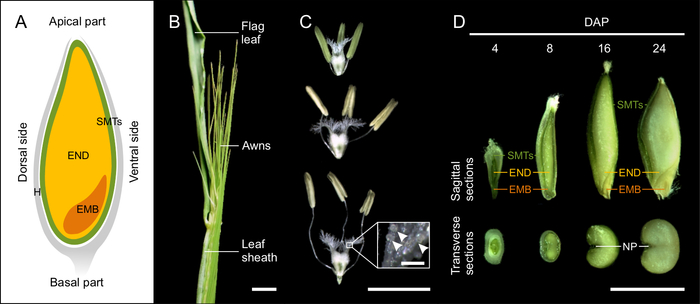
Рисунок 1: Развитие семян ячменя. (А) Схематический рисунок зерновых культур на сагиттальном плане с указанием семенных материнских тканей (СМТ, зеленый), эндосперма (ЭНД, желтый), эмбриона (ЭМБ, оранжевый) и лузги (Н, серый). (Б) Морфология колоса ячменя вблизи основания ячменя. Масштабная линейка = 1 см. (C) Морфология рыльца и пыльников на стадиях до, во время и после опыления. На врезке показана деталь рыльца с пыльцевыми зернами (стрелками). Масштабная линейка = 5 мм, врезная планка = 200 мкм. (D) Сагиттальные и поперечные срезы 4, 8, 16 и 24 семян DAP. (НП, нуцеллярная проекция) Масштабная линейка = 5 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.
Недавний прогресс в высокопроизводительной геномике предоставляет инструменты для изучения развития отдельных тканей семян. Однако основным препятствием для достижения этой цели является компактная структура и плотная адгезия тканей семян1. Нами был разработан протокол высокочистого препарирования тканей семян из развивающихся семян ячменя с возможностью последующего использования для высокочувствительных анализов, таких как секвенирование РНК. Кроме того, представленный протокол можно легко адаптировать под другие злаки.
протокол
1. Выращивание растений
ПРИМЕЧАНИЕ: Учитывая, что одно растение ячменя обычно имеет от 5 до 6 кустов и только средние 5-6 колосков каждого колоса должны использоваться для вскрытия, то максимальный урожай с одного растения составляет 72 семени для двухрядных и 216 семян для шестирядных сортов.
- Чтобы прорастить семена ячменя, приготовьте чашку Петри, обитую тремя слоями целлюлозной папиросной бумаги, покрытой одним слоем фильтровальной бумаги. Увлажните его дистиллированной водой, чтобы не было лишней воды, выложите семена на поверхность и закройте чашку Петри. Фильтровальная бумага предотвращает прорастание корней через целлюлозную ткань. Проращивайте семена в течение 3 дней при температуре 25 °C в темноте.
ПРИМЕЧАНИЕ: В качестве альтернативы можно прорастить семена, поместив их непосредственно во влажную почвенную смесь (см. шаг 1.2). - Переложите пророщенные семена с видимым корешком и побеги размером около 5 см в торфяные горшочки размером 5 см х 5 см со смесью почвы и песка (3:1, v/v). Регулярно поливайте. Через 10 дней пересадите растения в горшки размером 12 см х 12 см, наполненные той же почвенной смесью.
- Выращивать растения в климатической камере в контролируемом длинносуточном режиме (16 ч сутки 20 °С, 8 ч ночью 16 °С; интенсивность света 200 мкм м-2 с-1; влажность 60%).
ПРИМЕЧАНИЕ: Яровой ячмень требует примерно 8-10 недель от посева до начала цветения, без необходимости яровизации. Озимому ячменю требуется 7-8 недель яровизации (короткий день, 8 ч день 4 °C, 16 ч ночь 4 °C; интенсивность света 200 мкм м-2 с-1; влажность 85%) для начала цветения.
2. Определение опыления
ПРИМЕЧАНИЕ: Точное определение опыления необходимо для правильной оценки прогресса развития. Ячмень является самоопыляющимся видом. Для определения дня опыления (DOP) мы проводили мониторинг дня самоопыления. Этот признак специфичен для сорта, но начавшееся выступание ости ости из влагалища листьев является хорошим индикатором приближения к DOP (рис. 1B).
- Откройте створку-влагалище, прикрывающую колос. С помощью тонкозаостренного пинцета проверьте пыльники и завязь внутри колосков в центральной части колоса. Колоски с желтыми пыльниками и «пушистым» рыльцем опыляются в течение нескольких часов16 и рассматриваются как DOP (рисунок 1B).
- Срежьте колосок возле кончика последнего колоска, а также удалите флажный лист и верхнюю часть ости. Затем срежьте верхнюю 1/3 шелухи в каждом колоске. Это высушивает пыльники и приводит к более синхронному их раскрытию и выпуску пыльцы.
- Накройте шип пакетиком с пергамином с идентификатором шипа, номером растения и определенной датой DOP. Это также предотвращает перекрестное опыление, которое может поставить под угрозу конкретные эксперименты.
- Запишите информацию в табличный редактор. Используйте следующую формулу для расчета дня после опыления (DAP), когда должна произойти изоляция тканей.
xDAP = DOP + x
x = ожидаемый DAP
ПРИМЕЧАНИЕ: Значения должны иметь формат 'Data'. - Для вскрытия тканей семян соберите шипы на DAP в соответствии с подготовленным табличным календарем.
3. Вскрытие тканей семян
ПРИМЕЧАНИЕ: Следующие шаги следует выполнить с помощью стереомикроскопа. Перед вскрытием удалите корпуса с помощью пинцета. Обратите внимание, что корпуса становятся более сухими и прилипшими примерно с 16 DAP. Чтобы сохранить физиологические условия и избежать высыхания растительного сырья во время вскрытия, смочите образцы, поместив их в каплю 1x PBS (137 мМ NaCl, 2,7 мМ KCl, 10 мМ Na2HPO4, 1,8 мМ KH2PO4, pH = 7,4). Используйте новую затравку для препарирования каждой ткани, чтобы избежать деградации ДНК, РНК или белка из-за увеличенного времени сбора образца. Для выделения РНК из препарированного материала используйте только материалы и химикаты, не содержащие РНКазы. Не превышайте общее время диссекции 15 минут для одного образца, состоящего, как правило, из тканей, рассеченных из 5-10 зерен, чтобы свести к минимуму деградацию РНК.
- Перед вскрытием тканей удалите остатки корпусов с помощью тонкозаостренного пинцета. Увлажнение 1× PBS в течение 1 минуты способствует удалению сухих остатков колоска.
- Поместите очищенное семя на чашку Петри с каплей 1× PBS и препарируйте отдельные части с помощью тонкозаостренного пинцета, тонкой иглы и микрокапиллярной пипетки. Несколько иная стратегия применяется для рассечения отдельных тканей: семенных материнских тканей (шаг 3.3), эмбриона (этап 3.4) и эндосперма (этап 3.5).
- Диссекция семени материнских тканей
- Рассечение из семян до 8 DAP
- Поместите семя на тыльной стороне и аккуратно разрежьте семя вдоль продольной оси, а с помощью пинцета снимите материнские ткани семени, за исключением последнего слоя, граничащего с эндоспермом, от апикальной до базальной части.
- Соберите материнские ткани семян от 5 до 10 семян в пробирку объемом 1,5 мл с 50 мкл 1× PBS, выбросьте буфер с помощью пипетки, дважды промойте ткань 100 μл PBS, удалите излишки буфера с помощью пипетирования и закройте пробирку и заморозьте в жидком азоте или используйте непосредственно для измерения проточной цитометрии плоидности. Количество материала достаточно, как правило, для одного последующего применения (например, для выделения РНК или измерения проточной цитометрической плоидности).
- Вскрытие из семян после 8 DAP
- Поместите семя на тыльной стороне, аккуратно разрежьте посередине вентральной стороны семени материнские ткани и постепенно снимайте ткань вокруг всего семени, включая нуцеллярную проекцию. Для каждого последующего применения соберите и промойте ткань от 5 до 10 семян, как описано в шаге 3.3.1.
- Рассечение из семян до 8 DAP
- Вскрытие эмбриона
- Вскрытие из семян при 8 DAP и моложе
- Поместите семя на спинную сторону и срежьте прикорневую часть 1/3 семени. Аккуратно разделите отделенную часть пополам и отпустите зародыш. Для каждого последующего применения соберите и промойте зародыши от 10 до 20 семян, как описано в 3.3.1.
- Вскрытие из семян после 8 DAP
- Поместите семя на дорсальную сторону и удалите материнские ткани семени из базальной части вентральной стороны. Тонким слоем эндосперма по периметру эмбриона аккуратно потревожите тонким игольчатым или тонкозаостренным пинцетом и извлеките зародыш. Для каждого последующего применения соберите и промойте зародыши из 5 семян, как описано в 3.3.1.
- Вскрытие из семян при 8 DAP и моложе
- Диссекция эндосперма
- Вскрытие синцитиального эндосперма из 4 семян DAP.
- Поместите семя на дорсальную сторону и удалите семенные материнские ткани, за исключением последнего слоя клеток, граничащих с эндоспермом. Аккуратно проколите слой в середине вентральной стороны тонкой иглой, и отсосите синцитиальный эндосперм капиллярным действием с помощью микрокапиллярной пипетки.
- Для каждого последующего применения соберите жидкие эндоспермы от 10 до 15 семян в новую пробирку объемом 1,5 мл с буфером, подходящим для запланированного последующего анализа (т.е. 1x PBS, буфер для выделения РНК, буфер для проточной цитометрии). Объем буфера должен отражать протокол для планируемого последующего применения. Заморозьте в жидком азоте.
- Диссекция целуляризующегося эндосперма от 5 до 8 семян DAP
- Поместите семя на тыльной стороне и удалите все материнские ткани семени и эмбрион. Для каждого последующего применения соберите и промойте эндосперм от 10 до 15 семян в новую пробирку объемом 1,5 мл с 1x PBS и заморозьте в жидком азоте.
- Вскрытие целуляризованного эндосперма из семян после 8 DAP
- Поместите семя на тыльную сторону, удалите все материнские ткани семени и зародыш. Для каждого последующего применения соберите и промойте эндосперм из одного семени в каждой пробирке, как описано в шаге 3.3.1.
- Вскрытие синцитиального эндосперма из 4 семян DAP.
- Пробирки с изолированным материалом хранить при температуре -80 °C до использования.
ПРИМЕЧАНИЕ: Протокол может быть приостановлен здесь.
4. Контроль чистоты тканей с помощью проточной цитометрии
ПРИМЕЧАНИЕ: Чистота образца может быть проверена с помощью проточной цитометрии перед выделением РНК. Правильная калибровка прибора имеет решающее значение для анализа биологических образцов. Оптика проточного цитометра/плоидного анализатора должна быть отрегулирована с помощью калибровочных шариков (флуоресцентно окрашенных полистирольных микросфер, высокооднородных по размеру и интенсивности флуоресценции) до достижения максимальной пиковой резкости, обычно достигающей коэффициента вариации (CV) < 2%. Ткани семян злаков содержат в основном популяции G1, G2 и эндоредуплицированных ядер; Поэтому рекомендуется использовать логарифмическую шкалу. Начните с ткани листа, которая содержит в основном ядра G1 и служит для контроля базальной плоидии.
- Используйте свежеподготовленные образцы, хранящиеся на льду (см. шаг 3.3.1) или замороженную ткань, как описано17.
ПРИМЕЧАНИЕ: Поскольку весь образец DAP < 8 используется для проточной цитометрии, это представляет собой только косвенный контроль. Мы рекомендуем исследователям провести несколько выделений и измерений до достижения высокой доли чистых образцов (>90%), прежде чем приступать к выделению РНК с < 8 образцами DAP. - Высвободите ядра из образцов 4 и 8 DAP (для других образцов см. шаг 4.4) путем гомогенизации тканей с помощью 5-10 оборотов пластикового пестика в пробирке объемом 1,5 мл, содержащей 300 мкл буфера Отто I (0,1 М моногидрата лимонной кислоты, 0,5% (v/v) Tween 20, отфильтрованного через фильтр 0,22 мкм)18.
- Фильтруйте сырую суспензию через нейлоновую сетку толщиной 50 мкм в пробирку для анализа проточной цитометрии и добавьте 600 мкл буфера Otto II (0,4 M Na2HPO4·12H2O), содержащего 2 мкг мл-1 DAPI (4',6-диамидино-2-фенилиндол)18 для окрашивания ДНК.
- Поместите все остальные ткани (включая 16 эмбрионов DAP или старше) на чашку Петри, содержащую 500 μл буфера Отто I и гомогенизированную путем измельчения лезвием бритвы. Отфильтруйте суспензию, как описано в шаге 4.3, и добавьте 1 мл буфера Otto II, содержащего DAPI.
ПРИМЕЧАНИЕ: Манипуляции с острым лезвием бритвы с двумя лезвиями требуют особого внимания. Чтобы снизить риск получения травмы, доступны бритвенные лезвия с одной кромкой или специальные держатели для лезвий. - Оцените содержание ядерной ДНК в образце с помощью проточного цитометра. Для анализа чистоты образца требуется не менее 2000 частиц на образец.
5. Выделение РНК и измерение качества
- Используйте замороженную ткань для предотвращения деградации РНК эндогенными рибонуклеазами. Из семян, материнских тканей и образцов эмбрионов выделяют РНК с помощью коммерчески доступных наборов или реагента TRIzol19. Из-за высокого содержания крахмала в тканях эндосперма изолировать общую РНК из всех образцов с использованием коммерческих протоколов экстракции РНК на колонке для проблемных тканей (например, Spectrum Plant Total RNA Kit) с помощью обработки ДНКазы I на колонке20.
- Измеряйте концентрацию и целостность РНК с помощью специального протокола для электрофореза в РНК-геле или биоанализатора Agilent 2100.
ПРИМЕЧАНИЕ: Интактная общая РНК имеет четкие полосы/пики 18S и 25S рРНК размером около 1,9 и 3,7 кб соответственно. Полоса 25S рРНК должна быть примерно в два раза интенсивнее, чем полоса 18S рРНК.
Результаты
Для проведения тканеспецифического транскриптомного анализа развития семян ячменя нами был разработан протокол выделения тканей высокой чистоты. Протокол основан на ручном препарировании эмбриона, эндосперма и семени материнских тканей из очищенных (после ручног?...
Обсуждение
Здесь мы представляем протокол, который позволяет выделять ткани семян ячменя высокой чистоты. Хотя он был разработан и испытан для ячменя, его можно легко адаптировать для других членов племени Triticeae , таких как пшеница, овес, рожь или тритикале27. Нач...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим доктора Яна Врану и доктора Махмуда Саида за обслуживание проточных цитометров, Еву Яхнову за приготовление буферов, Марию Зайфертову за список материалов и Зденку Бурсову за уход за растениями. Эта работа была поддержана в основном грантом Чешского научного фонда 18-12197S. Кроме того, А.. была поддержана стипендией Й. Е. Пуркине от Чешской академии наук и проектом ЕФРР «Растения как инструмент устойчивого глобального развития» (No 100). CZ.02.1.01/0.0/0.0/16_019/0000827).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 um filter | Merck | SLGSV255F | |
| 1.5 ml Eppendorf tube | Sarstedt | 72.690.001 | |
| 4',6-diamididno-2-phenylindole | Invitrogen | D21490 | |
| 50 um nylon mesh | Silk a Progrers | uhelon 120 T | |
| Agilent 2100 Bioanalyzer | Agilent | G2939BA | |
| Bulb Assembly | Drummond Scientific Company | 1-000-9000 | |
| Calibration beads | Invitrogen | A16502 | |
| Cellulose tissue paper | |||
| Citric acid monohydrate | Penta | 13830-31000 | |
| Climatic chamber | Weiss Gallenkamp | ||
| DNase I | Sigma Aldrich | DNASE70 | |
| Filter paper | Fagron | ||
| Fine-pointed tweezers | Fine Science Tools | 11254-20 | |
| Flow cytometer | Sysmex-Partec | ||
| Flow cytometry tube | Sarstedt | 55.484 | |
| Freezer | |||
| Glassine bag | |||
| KCl | Lachner | 30076-AP0 | |
| KH2PO4 | Litolab | 100109 | |
| Liquid nitrogen | Linde | ||
| Microcapillary pipette | Fivephoton Biochemicals | MGM 1C-20-30 | |
| Minutien Pins | Fine Science Tools | 26002-20 | |
| Na2HPO4 | Lachema | ||
| Na2HPO4.12H2O | Lachner | 30061-AP0 | |
| NaCl | Lachner | 30093-AP0 | |
| Peat pots | Jiffy | 5x5 cm | |
| Petri dish | |||
| Pin Holder | Fine Science Tools | 26016-12 | |
| Plastic pestle | p-Lab | A199001 | |
| Pots | 12x12 cm | ||
| Razor blade | Gillette | ||
| RNAse zap | Invitrogen | AM9780 | |
| Sand | |||
| Scissors | Fine Science Tools | 14060-11 | |
| Soil | |||
| Spectrum Plant Total RNA Kit | Sigma Aldrich | STRN50 | |
| Stereomicroscope | Olympus | ||
| Tween 20 | Sigma Aldrich | P2287 | |
| TRIzol reagent | Invitrogen | 15596026 | |
| RNA 6000 Pico Kit | Agilent | 5067-1513 |
Ссылки
- Sreenivasulu, N., et al. Barley grain development: Toward an integrative view. International Review of Cell and Molecular Biology. 281, 49-89 (2010).
- Baik, B. K., Ullrich, S. E. Barley for food: Characteristics, improvement, and renewed interest. Journal of Cereal Science. 48 (2), 233-242 (2008).
- Langridge, P., Stein, N., Muehlbauer, G. J. Economic and Academic Importance of Barley. The Barley Genome. , 1-10 (2018).
- Mascher, M., et al. A chromosome conformation capture ordered sequence of the barley genome. Nature. 544 (7651), 427-433 (2017).
- Pseudomolecules and annotation of the second version of the reference genome sequence assembly of barley cv. Morex V2. Morex Available from: https://edal.ipk-gatersleben.de (2019)
- Rapazote-Flores, P., et al. BaRTv1.0: An improved barley reference transcript dataset to determine accurate changes in the barley transcriptome using RNA-seq. BMC Genomics. 20 (1), 968 (2019).
- Molnár-Láng, M., Linc, G., Szakács, &. #. 2. 0. 1. ;. Wheat-barley hybridization: The last 40 years. Euphytica. 195 (3), 315-329 (2014).
- Waddington, S. R., Cartwright, P. M., Wall, P. C. A quantitative scale of spike initial and pistil development in barley and wheat. Annals of Botany. 51 (1), 119-130 (1983).
- Sabelli, P. A., Larkins, B. A. The development of endosperm in grasses. Plant Physiology. 149 (1), 14-26 (2009).
- Dante, R. A., Larkins, B. A., Sabelli, P. A. Cell cycle control and seed development. Frontiers in Plant Science. 5, 1-14 (2014).
- Rodríguez, M. V., Barrero, J. M., Corbineau, F., Gubler, F., Benech-Arnold, R. L. Dormancy in cereals (not too much, not so little): About the mechanisms behind this trait. Seed Science Research. 25 (2), 99-119 (2015).
- Sreenivasulu, N., et al. Gene expression patterns reveal tissue-specific signaling networks controlling programmed cell death and ABA-regulated maturation in developing barley seeds. Plant Journal. 47 (2), 310-327 (2006).
- Olsen, O. A. Nuclear endosperm development in cereals and Arabidopsis thaliana. Plant Cell. 16, 214-227 (2004).
- Thiel, J., et al. Different hormonal regulation of cellular differentiation and function in nucellar projection and endosperm transfer cells: A microdissection-based transcriptome study of young barley grains. Plant Physiology. 148 (3), 1436-1452 (2008).
- Weschke, W., et al. Sucrose transport into barley seeds: Molecular characterization of two transporters and implications for seed development and starch accumulation. Plant Journal. 21 (5), 455-467 (2000).
- Staszak, A. M., Rewers, M., Sliwinska, E., Klupczyńska, E. A., Pawłowski, T. A. DNA synthesis pattern, proteome, and ABA and GA signalling in developing seeds of Norway maple (Acer platanoides). Functional Plant Biology. 46 (2), 152-164 (2019).
- Otto, F. Chapter 11 DAPI staining of fixed cells for high-resolution flow cytometry of nuclear DNA. Methods in Cell Biology. 33, 105-110 (1990).
- Fisher Scientific. . Procedural guidelines. , (2020).
- Spectrum TM. . Plant Total RNA Kit. , (2020).
- Nowicka, A., et al. Dynamics of endoreduplication in developing barley seeds. Journal of Experimental Botany. , eraa453 (2020).
- Chen, J., et al. Dynamic transcriptome landscape of maize embryo and endosperm development. Plant Physiology. 166 (1), 252-264 (2014).
- Zhang, S., Laurie, A. E., Ae, W., Meng, L., Lemaux, P. G. Similarity of expression patterns of knotted1 and ZmLEC1 during somatic and zygotic embryogenesis in maize (Zea mays L.). Springer. 215 (2), 191-194 (2002).
- Doll, N. M., et al. Transcriptomics at maize embryo/endosperm interfaces identifies a transcriptionally distinct endosperm subdomain adjacent to the embryo scutellum. Planta. 32 (4), 833-852 (2020).
- Yi, F., et al. High temporal-resolution transcriptome landscape of early maize seed development. Plant Cell. 31 (5), 974-992 (2019).
- Gómez, E., et al. The maize transcription factor myb-related protein-1 is a key regulator of the differentiation of transfer cells. Plant Cell. 21 (7), 2022-2035 (2009).
- Bewley, J. D., Black, M., Halmer, P. The encyclopaedia of seeds: Science, technology and uses. CABI. , (2006).
- Liew, L. C., et al. Temporal tissue-specific regulation of transcriptomes during barley (Hordeum vulgare) seed germination. Plant Journal. 101 (3), 700-715 (2020).
- Pirrello, J., et al. Transcriptome profiling of sorted endoreduplicated nuclei from tomato fruits: how the global shift in expression ascribed to DNA ploidy influences RNA-Seq data normalization and interpretation. Plant Journal. 93 (2), 387-398 (2018).
- Sreenivasulu, N., et al. Transcript profiles and deduced changes of metabolic pathways in maternal and filial tissues of developing barley grains. Plant Journal. 37 (4), 539-553 (2004).
- Bian, J., et al. Transcriptional dynamics of grain development in barley (Hordeum vulgare L). International Journal of Molecular Sciences. 20 (4), 962 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены