Method Article
Подготовка образцов опорных пленок в просвечивающей электронной микроскопии с использованием опорного флотационного блока
В этой статье
Резюме
Пробоподготовка для криоэлектронной микроскопии (крио-ЭМ) является существенным узким местом в рабочем процессе определения структуры данного метода. Здесь мы приводим подробные методы использования простого в использовании, трехмерно напечатанного блока для подготовки опорных пленок для стабилизации образцов для передачи ЭМ-исследований.
Аннотация
Определение структуры с помощью криоэлектронной микроскопии (крио-ЭМ) быстро выросло в последнее десятилетие; однако пробоподготовка остается существенным узким местом. Макромолекулярные образцы идеально визуализируются непосредственно из случайных ориентаций в тонком слое стекловидного льда. Тем не менее, многие образцы невосприимчивы к этому, и денатурация белка на границе раздела воздух-вода является общей проблемой. Чтобы преодолеть такие проблемы, вспомогательные пленки, включая аморфный углерод, графен и оксид графена, могут быть нанесены на сетку, чтобы обеспечить поверхность, которую могут заполнять образцы, уменьшая вероятность частиц, испытывающих вредные эффекты границы раздела воздух-вода. Однако нанесение этих деликатных опор на сетки требует осторожного обращения, чтобы предотвратить поломку, загрязнение воздуха или обширные этапы стирки и очистки. В недавнем отчете описывается разработка простого в использовании флотационного блока, который облегчает смачиваемую передачу опорных пленок непосредственно в образец. Использование блока сводит к минимуму количество необходимых этапов ручного обращения, сохраняя физическую целостность опорной пленки и время, в течение которого может накапливаться гидрофобное загрязнение, гарантируя, что тонкая пленка льда все еще может быть создана. В данной статье представлены пошаговые протоколы подготовки углеродных, графеновых и графенокислых опор для ЭМ-исследований.
Введение
За последнее десятилетие прорывы, главным образом в детекторной технологии, но также и в других технических областях, способствовали последовательному существенному увеличению разрешения, при котором биологически значимые системы могут быть визуализированы с помощью просвечивающей электронной микроскопии (ТЭМ)1,2. Несмотря на то, что крио-ЭМ уже позволяет разрешать структуры высокого разрешения всего от 50 мкг белка с помощью анализа одной частицы (SPA), крио-ЭМ образец и подготовка сетки остаются основными узкими местами3,4,5. Образцы SPA состоят из макромолекул, распределенных примерно случайным образом в слое стекловидного льда. Лед должен быть как можно более тонким, чтобы максимизировать разницу контрастов между частицами и растворителем. Биологические макромолекулы более стабильны (то есть с меньшей вероятностью теряют свою родную структуру) в более толстом льду, потому что они остаются лучше сольватированными. Более того, часто обнаруживается, что частицы гораздо лучше распределены по полю зрения во льду, намного толще, чем размер частиц6, и часто могут вообще не находиться в отверстиях в углеродных пленках.
Кроме того, более толстые слои льда уменьшают вероятность того, что молекулы будут близки к границе раздела воздух-вода из-за высокого отношения поверхности к объему, и было подсчитано, что использование стандартных методов погружения-замораживания для крио-ЭМ исследований приводит к адсорбции ~ 90% частиц к границе раздела воздух-вода7. Более толстый лед приводит к нежелательно высокому фону из-за увеличения событий рассеяния внутри растворителя и сопутствующего затухания сигнала6,7. Поэтому необходимо добиться как можно более тонкого слоя стекловидного льда; в идеале слой должен быть лишь немного толще частицы. Задача исследователя, которая должна быть преодолена для каждого отдельного образца, нанесенного на сетку, заключается в том, чтобы подготовить образцы, достаточно тонкие для высококонтрастной визуализации, сохраняя при этом структурную целостность частиц в их образце. Адсорбция белка к границе раздела воздух-вода сопровождается несколькими, обычно вредными, эффектами.
Во-первых, связывание белков с этим гидрофобным интерфейсом часто вызывает денатурацию белка, которая протекает быстро и, как правило, необратима8,9. Исследование, проведенное с использованием дрожжевой синтазы жирных кислот, показало, что до 90% адсорбированных частиц являются денатурированными10. Во-вторых, данные исследования, сравнивающего распределение ориентации наборов данных рибосом 80S, собранных либо на аморфном углероде11, либо без поддержки12, показали, что граница раздела воздух-вода может вызвать серьезную предпочтительную ориентацию, ставящую под угрозу 3D-реконструкцию объема13. Методы уменьшения взаимодействия частиц с интерфейсом воздух-вода включают дополнение морозильного буфера поверхностно-активными веществами (такими как моющие средства), использование опорных пленок, захват аффинности или строительные леса подложек и ускоренное время погружения. Использование поверхностно-активных веществ связано с собственными проблемами, поскольку некоторые образцы белка могут вести себя неидеально в их присутствии, в то время как субстраты для захвата сродства и строительных лесов обычно требуют инженерных индивидуальных поверхностей сетки и стратегий захвата. Наконец, хотя существует много исследований по разработке быстро погружающихся устройств14,15,16, они требуют оборудования, которое, как правило, не является широко доступным.
Хотя стандартная сетка ТЕА для биологических крио-ЭМ уже имеет перфорированную аморфную углеродную фольгу17, существует ряд протоколов для генерации дополнительных опорных пленок и их передачи в сети ТЕА. Использование этих пленок является давно устоявшимся методом стабилизации образцов18. Аморфные углеродные опоры образуются путем испарения и осаждения на кристаллических листах слюды19, из которых слои могут быть перенесены на сетки, при этом полезность флотационных опор является полезным инструментом, установленным в предыдущих отчетах20. Хлопья оксида графена, обычно приготовленные с использованием модифицированной версии метода Hummers21, использовались в качестве предпочтительной опорной структуры по сравнению с аморфным углеродом для их снижения фонового сигнала, а также способности иммобилизовать и стабилизировать макромолекулы22. В последнее время возрождается интерес к использованию графена в качестве опорной пленки ТЭМ из-за его механической стабильности, высокой проводимости, крайне низкого вклада в фоновый шум23, а также появления воспроизводимых методов генерации макроскопически больших площадей монослойного графена24 и переноса его в сетки ТЭМ25 . По сравнению с аморфным углеродом, который подвергается движениям, вызванным пучком, аналогично или хуже, чем лед, не имеющий опорной пленки11,12,17, графен показал значительное снижение индуцированного пучком движения крио-ЭМ изображений12.
Однако, в то время как гидрофилизированный графен защищал синтазу жирных кислот от межфазной денатурации воздух-вода, авторы этого исследования отметили, что графен загрязнился во время подготовки образца, вероятно, из-за сочетания загрязнения атмосферными углеводородами и реагента, используемого для гидрофилизации решеток10. Действительно, несмотря на многие превосходные качества графена, его широкому использованию по-прежнему препятствует дериватизация, необходимая для снижения его гидрофобности12, что в конечном итоге химически сложно и требует специального оборудования. В настоящем документе описываются протоколы получения аморфных опор для образцов углерода, оксида графена и графена с использованием трехмерного (3D) печатного блока флоатации образца27 для непосредственной передачи опорных пленок с подложек, на которых они были сгенерированы, в сетки ТЕА (рисунок 1). Ключевым преимуществом использования такого устройства является смачиваемая передача пленок, сводя к минимуму гидрофобное загрязнение опор и, следовательно, необходимость дальнейшей обработки, а также уменьшая количество потенциально опасных ручных этапов обработки. Эти подходы являются недорогими в реализации и, следовательно, широко доступны и применимы для крио-ЭМ-исследований, где необходима поддержка образцов.
протокол
1. Общая подготовка сетей ТЕА перед передачей поддержки
- Используя пару чистых, тонких пинцетов, поднимайте и погружайте решетки ТЭМ последовательно в двойную дистиллированную воду (ddH2O) или сверхчистую воду на 10-15 с, а затем этилацетат на 10-15 с.
ПРИМЕЧАНИЕ: Здесь использовались пинцеты отрицательного действия, косые кончики. - Поместите пинцет, с сеткой, все еще в захвате, в одну сторону, чтобы высушить на воздухе в течение ~ 5 минут.
- Плазменная очистка сеток, чтобы очистить поверхность от любых загрязнений, накопленных через воздух или этапы промывки.
ПРИМЕЧАНИЕ: Здесь плазменная очистка производилась в течение 10-15 с в воздухе с радиочастотной мощностью 25 Вт.
2. Общее приготовление растворов реагентов
- Раствор уранилацетата (UAc) (2% мас./об.)
- Заверните пробирку объемом 50 мл в фольгу, заполните 50 мл сверхчистой воды и добавьте 1 г порошка UAc.
ПРИМЕЧАНИЕ: UAc является светочувствительным и выпадает в осадок с течением времени при воздействии. Поскольку UAc радиоактивен и токсичен, поддерживайте высокий уровень чистоты. При наиболее серьезной опасности, возникающей при вдыхании или проглатывании, следует проявлять особую осторожность, чтобы предотвратить любую возможность вдыхания мелких частиц. Перчатки всегда должны быть надеты при обращении или взвешивании солей урана. Маски и очки настоятельно рекомендуются. Соли урана должны быть утилизированы в соответствии с юридическими требованиями, установленными для радиоактивных опасностей в пределах государства. - Оставьте раствор помешивать в течение 1 ч, чтобы весь UAc растворился. Хранить при температуре 4°C.
- Перед использованием отфильтруйте 1 мл раствора пятна в небольшой флакон с помощью фильтра 0,22 мкм для удаления оставшихся кристаллов ацетата.
- Заверните пробирку объемом 50 мл в фольгу, заполните 50 мл сверхчистой воды и добавьте 1 г порошка UAc.
- Суспензия оксида графена (GrOx)
- Пипетка 2,5 мкл GrOx в пробирку объемом 1,5 мл (конечная концентрация 1%). Пипетка 2,5 мкл 10% (мас./об.) н-додецил-β-D-мальтозида (DDM) моющего средства с GrOx и осторожно перемешивается (0,1% (мас./об.) конечной концентрации).
- Добавьте 245 мкл сверхчистой воды в смесь GrOx-DDM и немедленно энергично вращайтесь в течение 5 мин. Используйте суспензию GrOx в течение 1 ч после приготовления, энергично вихрьте в течение не менее 1 мин перед немедленным использованием.
- Раствор хлорида железа(III) (FeCl3) (10% мас./об.)
- Тщательно взвесьте 5 г FeCl3 в весовой лодке. Перевести в измерительный цилиндр объемом 100 мл, содержащий 35 мл ddH2O и магнитный перемешивание.
- Поместите на магнитную перемешивающую пластину и растворите FeCl3, добавив ddH2O к конечному объему 50 мл. Процедите раствор FeCl3 через шприцевой фильтр 0,8 мкм в чистую бутылку для хранения.
ПРИМЕЧАНИЕ: FeCl3 является коррозионным и раздражающим веществом; мыть руки и другие открытые участки с мягким мылом и водой перед едой, питьем или курением и при уходе с работы. Обеспечьте хорошую вентиляцию в зоне процесса, чтобы предотвратить образование пара. Не дышите туманом, парами, брызгами. Перчатки необходимо всегда носить при обращении или взвешивании соли. Маски и очки настоятельно рекомендуются при использовании.
3. Буферный обмен для углеродных опорных пленок на слюде для подготовки отрицательно окрашенных образцов с использованием опорного флотационного блока
- Промывка и плазменная очистка сеток ТЭМ.
ПРИМЕЧАНИЕ: Здесь использовались 300-сетчатые дыроуглеродистые медные сетки, как описано выше в разделе 1. - Пипетка 10-12 мкл образца в буферную обменную скважину (с малыми каналами) флотационного блока и 10-12 мкл 2% раствора UAc (см. раздел 2.1) для отрицательного окрашивания в соседнюю небуферную обменную скважину.
ПРИМЕЧАНИЕ: Скважина имеет объем 10 мкл; однако отрегулируйте объем образца таким образом, чтобы на поверхности жидкости образовался выпуклый мениск, чтобы обеспечить надлежащее плавание пленки. Низкий объем образца может привести к разрушению пленки. - Аккуратно нарежьте два небольших кусочка слюды с предварительно нанесенной углеродной пленкой сверху. Убедитесь, что фрагменты слюды достаточно широкие, чтобы поместиться в скважине (ширина 3,4 мм) и длиннее длины скважины (3,45 мм), так что фрагмент будет сидеть на колодце, пока плавает углерод, и есть достаточно места для обработки фрагмента пинцетом.
ПРИМЕЧАНИЕ: Чтобы справиться с карбоном, используйте плоский пинцет с длинным наконечником отрицательного действия. При вырезании фрагментов слюды режьте одиночными движениями для поддержания целостности углеродной пленки. - Погружайте слюду в скважину с приблизительным углом 45° до тех пор, пока слюда не сядет на рампу скважины и на поверхности жидкого образца не будет наблюдаться слой углерода.
- После первоначальной инкубации на образце (обычно от 20 с до 20 мин в зависимости от адгезии образца; оптимизируйте этот период на основе экспериментальных потребностей) извлекайте лист слюды очень медленно, чтобы восстановить углеродную пленку и свести к минимуму остаточное удержание вязкого образца.
- Осторожно промойте слюду, постукивая по нижней поверхности (неуглеродистой стороне) фильтровальной бумагой для удаления лишней жидкости, а затем замените углерод, несущий образец, на отрицательное пятно путем нанесения на противоположный колодец (т.е. погрузить слюду, как на этапе 3.4), содержащий 2% раствор UAc.
ПРИМЕЧАНИЕ: В этой точке следует наблюдать углеродный слой, плавающий поверх раствора пятна. - Восстановите плавающий углеродный слой с помощью дырявой углеродной стороны промытой и очищенной плазмой эм-сетки. Оставьте сетки сушиться на воздухе до тех пор, пока не будет получена визуализация на ТЕА. В идеале, накройте сетки во время процесса сушки, чтобы избежать загрязнения воздуха.
4. Применение опорного флотационного блока для приготовления теа-сеток с оксидным покрытием графена
- Мойка и плазменная очистка сеток ТЭМ с использованием медных 300-сетчатых глиноуглеродистых медных решеток, как описано выше (раздел 1).
- Пипетка 10-12 мкл суспензии GrOx (см. раздел 2.2) в 4 небуферные обменные скважины вдоль флотационного блока. Пипетка 10-12 мкл ddH2O или сверхчистая вода попадает в оставшиеся 4 буферные обменные скважины блока.
ПРИМЕЧАНИЕ: Этого объема воды должно быть достаточно, чтобы образовался небольшой выпуклый мениск, поднимающийся над высотой блока. - Осторожно нанесите 4 сетки на суспензию GrOx каждой скважины в течение 1 мин, гарантируя, что дырявая сторона, покрытая углеродом, вступает в контакт с раствором. Через 1 мин тщательно восстановите каждую сетку, сдвинув пинцет в канавку пинцета каждого небуферного обменного колодца.
- Очень осторожно и ненадолго прикоснитесь медной, не покрытой углеродом стороной каждой сетки к ddH2O в соседнем колодце. Затем осторожно и аккуратно прижмите сетку, каплями воды вниз, к листу фильтровальной бумаги.
ПРИМЕЧАНИЕ: Смывание воды приведет к протягиванию суспензии GrOx через сетку капиллярным действием. Крайне важно избегать погружения сетки в ddH2O, поэтому контакт должен быть очень коротким. Когда сетка поднимается, капля воды должна удерживаться на нижней стороне сетки. Следите за тем, чтобы не перемещать сетку на фильтровальной бумаге, так как это может нарушить оседание хлопьев GrOx. - Оставьте сетки в пинцете сушиться на воздухе до подготовки с образцом. В идеале, накройте сетки во время процесса сушки, чтобы избежать загрязнения воздуха.
5. Применение опорного флотационного блока для подготовки образцов на монослойно-графеновых пленках
- Промывайте сетки ТЕА, как описано выше (раздел 1), но опуская плазменную очистку.
ПРИМЕЧАНИЕ: Здесь использовались 300-сетчатые дыряво-углеродные золотые решетки, но другие немедные сетки или сетки из медного сплава также практичны. - Для нанесения сеток графеном непосредственно переходят из графена, выращенного на медных (Cu-графеновых) подложках, в крио-ЭМ сетки, как описано ранее25.
- Поместите четыре промытые сетки поверх Cu-графенового листа (10 мм × 10 мм), нанесенного на стеклянный слайд, и накройте каждую сетку каплей изопропанола (5-10 мкл), чтобы обеспечить тесный контакт между монослойным графеном и сеткой.
ПРИМЕЧАНИЕ: Убедитесь, что дырявая сторона решеток, покрытая углеродом, контактирует с графеновым листом. - Когда изопропанол полностью испарится (обычно 2 ч), поместите Cu-графеновый лист с сетками на 10% (мас./об.) раствор FeCl3 (см. раздел 2.3) в стеклянную чашку Петри и оставьте травиться при комнатной температуре на ночь. Накройте тарелку, чтобы избежать загрязнения воздуха.
ПРИМЕЧАНИЕ: После завершения травления только монослой графена останется плавающим на растворе FeCl3 - это должно быть видно на глаз при подходящем освещении. - Используйте петлю диаметром, превышающим размер сетки TEM, чтобы ловить сетки, плавающие на графеновом монослое, и аккуратно переложите на стеклянную чашку Петри, содержащую ddH2O для мытья.
ПРИМЕЧАНИЕ: Будьте предельно осторожны при ловле сетки, чтобы избежать удара о стенки чашки Петри, что может привести к разрыву или изгибу графеновой пленки. - Промыть еще два раза в воде рыболовными сетками и перенести в чистую чашку Петри, содержащую ddH2O, чтобы удалить весь остаточный FeCl3. Наконец, переложите сетки в чашку Петри, содержащую буфер образцов, до подготовки образца и погружения-замораживания.
ПРИМЕЧАНИЕ: Покрытая графеном сторона сеток должна постоянно смачиваться, чтобы избежать воздействия загрязняющих веществ в воздухе.
- Поместите четыре промытые сетки поверх Cu-графенового листа (10 мм × 10 мм), нанесенного на стеклянный слайд, и накройте каждую сетку каплей изопропанола (5-10 мкл), чтобы обеспечить тесный контакт между монослойным графеном и сеткой.
- Пипетка образца (10-12 мкл) в небуферный обменный колодец флотационного блока. Когда образец будет готов в блоке, выберите сетку с графеновым покрытием из буферного раствора, используя пару чистых пинцетов, и поместите на поверхность колодца, содержащего образец.
- После соответствующего инкубационного периода (1-5 мин в зависимости от образца; оптимизировать в соответствии с экспериментальными потребностями) выберите сетку с парой чистых морозильных пинцетов и приступайте к промоктыванию и витрификации.
Результаты
Решетки ТЕА, подготовленные с помощью аморфных углеродных опор, обычно покрываются по всей поверхности сетки. Хотя разрушение углеродной пленки происходит в некоторых случаях вместе с некоторым взъерошиванием (рисунок 2A), большое количество квадратов сетки являются нетронутыми и, следовательно, широко применимы для целей отрицательного окрашивания. Основным фактором, влияющим на целостность опоры, является толщина углерода, которая определяется при испарении углерода. Аналогичным образом, с помощью этого протокола GrOx обычно достигается хорошее покрытие по всей сетке (рисунок 2B). Одного применения суспензии GrOx в течение 1 мин достаточно, чтобы обеспечить несколько участков с несколькими слоями, которые легко увидеть из-за чешуйчатых краев. Сетки GrOx могут быть быстро приготовлены из сырья и обеспечивают высокую защиту образца. Тем не менее, чешуйчатые края, неполное покрытие и взъерошивание чаще видны с сетками GrOx, чем для других методов, из-за природы хлопьев GrOx.
Хотя целостность графеновой опорной пленки, как и аморфного углерода, зависит от процесса осаждения, области, которые хорошо покрыты, отображают характерную дифракционную картину однослойного графена. Важно отметить, что, сохраняя графеновые опорные пленки смачиваемыми, образцы могут быть извлечены из блока флоатации после инкубационного периода, а данные собраны таким образом, чтобы поддаваться анализу на одну частицу. Этот метод не требует какой-либо другой обработки графена для смачивания, тем самым устраняя потребность в дорогостоящем оборудовании для придания графену гидрофильной, и лучше всего готовить опорные пленки незадолго до пробоподготовки и замораживания сетки (рисунок 2C).
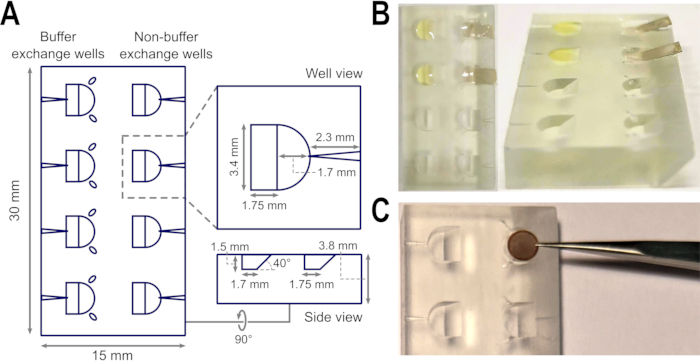
Рисунок 1: Конструкция и применение образца блока флоатации во время подготовки опорной пленки. (A) Схема верхнего, колодезного и бокового видов флотационного блока, включая измерения формы, глубины и наклона. Показана канавка для отдыха кончиков пинцета, а также каналы для вставки игл. (B) Аморфные углеродные слои могут легко плавать на поверхности буфера, содержащегося в скважинах флотационного блока, с помощью рампы, т.е. С) Ширина скважин подходит для размещения одной сетки ТЕА, в то время как канавки пинцета уменьшают необходимость неоправданно высвобождать и подбирать сетки на этапах подготовки, но предлагают определенный путь для восстановления сеток без риска изгиба в случае высвобождения сеток. Изображения в B изменены с 27. Аббревиатура: TEM = просвечивающая электронная микроскопия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Типичные примеры образцов опорных пленок, приготовленных с использованием флотационного блока. Квадрат сетки (слева) и изображение (справа) показаны для (А) аморфного углерода, (В) оксида графена и (С) графеновых опорных пленок, приготовленных с использованием блока флотации. Аморфная углеродная опора использовалась при подготовке рибосом 70S для отрицательного окрашивания, тогда как оксид графена и графеновые опоры использовались при подготовке рибосом 70S для крио-ЭМ. Изображения в форматах A и C изменены с 27. Шкала для квадрата сетки A = 10 мкм; шкала для квадратов сетки B и C = 5 мкм; шкалы масштаба для видов изображений A-C = 50 нм. Аббревиатура: крио-ЭМ = криоэлектронная микроскопия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
В данной работе представлены протоколы обработки как аморфных углеродных, так и графеновых пленок для крио-ЭМ пробоподготовки с использованием блока флоатации образца27. Файл STL для блока поддержки находится в свободном доступе из общедоступного репозитория Thingiverse [www.thingiverse.com/thing:3440684] и может быть напечатан на 3D-принтере с помощью любого подходящего стереолитографического принтера из подходящей смолы. Использование углеродных пленок, покрывающих сетку ТЕА, обычно включает в себя размещение углерода на образце28. Такой подход к приготовлению отрицательных пятнистых решеток сводит к минимуму воздействие воздуха во время обработки опор, тем самым уменьшая загрязнение и денатурацию белка. Приготовление решеток с использованием плавающего углерода в небольших скважинах выгодно для плавания на большей площади поверхности, т. е. на водяной бане или чашке Петри, и в этом случае механическая стрижка углерода происходит гораздо легче.
UAc может быть трудно приобрести из-за действующих правил охраны труда и техники безопасности на момент публикации. Доступны многие другие широко используемые, нерадиоактивные, отрицательные окрашивающие реагенты, и протоколы их приготовления были описаны ранее29. Хотя альтернативные пятна не использовались с этим блоком поддержки флоатации, маловероятно, что в этих протоколах будут какие-либо различия, кроме оптимизации времени инкубации с образцом (этап 3.5), который уже по своей сути зависит от образца. Ключевым шагом в этом протоколе подготовки поддержки GrOx является шаг 4.4, выделенный примечанием, чтобы предотвратить контакт воды и раствора GrOx по краю сетки. Неправильное смешивание воды и растворов GrOx препятствует однонаправленному оседанию хлопьев GrOx капиллярным действием. Наличие хлопьев GrOx по обе стороны углеродной фольги приводит к образованию толстых слоев, что сводит на нет преимущества использования GrOx в качестве почти однослойной опоры, а также улавливания воды между хлопьями, что вызывает загрязнение пригодных для использования областей дополнительными слоями льда. Подготовка поддержки оксида графена относительно легко достигается с помощью капель раствора на гибкой полиолефиновой пленке. Однако при выполнении таким образом легче случайно загрязнить медную сторону сетки путем неправильного обращения с ошибками; использование флотационного блока снижает вероятность такого развития событий.
Наконец, в этом документе представлен протокол для подготовки покрытых графеном сеток, который позволяет избежать любой предварительной обработки графена, чтобы сделать его гидрофильным, тем самым снижая его стоимость и повышая его доступность. Поддержание смачиваемой пленки на протяжении всей подготовки образца и применение образца in situ в блоке непосредственно перед замораживанием является достаточным для создания подходящих слоев льда для крио-ЭМ с однородным распределением образцов. В целом, протоколы, представленные здесь, сводят к минимуму контакт образца с интерфейсом воздух-вода, тем самым уменьшая денатурацию проб и поддерживая загрязнение. Для трех опорных пленок, используемых в этих подходах, однородное распределение образцов может быть достигнуто по сеткам наряду с визуализацией неповрежденных, хорошо сохранившихся одиночных частиц.
Раскрытие информации
Авторам не известно о каких-либо конфликтах интересов в отношении данной работы.
Благодарности
Авторы хотели бы поблагодарить всех членов Секции структурной и синтетической биологии в Имперском колледже Лондона, которые помогли протестировать эти методы, а также Гарри Барнетта в Имперском колледже Advanced Hackspace и Пола Симпсона в Центре структурной биологии. CHSA поддерживается стипендией сэра Генри Дейла, совместно финансируемой Wellcome Trust и Королевским обществом (206212/Z/17/Z).
Материалы
| Name | Company | Catalog Number | Comments |
| Basic Plasma Cleaner (230 V) | Harrick Plasma | PDC-32G-2 | |
| Dumont tweezers N5A INOX. | Dumont Swissmade | 0302-N5A-PO | |
| Dumont tweezers NGG INOX. | Dumont Swissmade | 0102-NGG-PO | |
| Ehtylacetate | Sigma-Aldrich | 270989-250ML | |
| Fishing Loops 10 μL | VWR | 612-9353 | |
| Graphene Oxide 2 mg/mL | Sigma-Aldrich | 763705-25ML | |
| Iron (III) chloride | Sigma-Aldrich | 31232-250MG | |
| Mica Sheets 75 mm x 25 mm x 0.15 mm | Agar Scientific | AGG250-1 | We usually coat mica with a target carbon film thickness of 2 nm |
| Monolayer Graphene on Cu | Graphenea | N/A | 10 mm x 10 mm, pack of 4 |
| n-dodecyl β-D-maltoside (DDM) | GLYCON Biochemicals GmbH | D97002-C | |
| Quantifoil R1.2/1.3 300 mesh copper grids | Enzo Life Sciences | JBS-X-101-Cu300 | |
| Quantifoil R2/1 300 mesh copper grids | Enzo Life Sciences | JBS-X-102-Cu300 | |
| Quantifoil R2/1 300 mesh gold grids | Electron Microscopy Sciences | Q350AR1 | |
| Scissors | Agar Scientific | AGT577 | |
| Uranyl Acetate | TAAB Laboratories Equipment | U001 | |
| Vitrobot Mark IV | FEI | N/A | |
| Whatman filter paper 55 mm | GE Healthcare Life Sciences | 1441-055 | |
| Whatman filter paper 70 mm | GE Healthcare Life Sciences | 1441-070 |
Ссылки
- Frank, J. Advances in the field of single-particle cryo-electron microscopy over the last decade. Nature Protocols. 12 (2), 209-212 (2017).
- Lyumkis, D. Challenges and Opportunities in Cryo-EM Single-Particle Analysis. Journal of Biological Chemistry. 294 (13), 5181-5197 (2019).
- Elmlund, D., Elmlund, H. Cryogenic Electron Microscopy and Single-Particle Analysis. Annual Review of Biochemistry. 84 (1), 499-517 (2015).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Arnold, S. A., et al. Miniaturizing EM Sample Preparation: Opportunities, Challenges, and "Visual Proteomics". Proteomics. 18 (5-6), 1700176 (2018).
- Wu, S., Armache, J. P., Cheng, Y. Single-particle cryo-EM data acquisition by using direct electron detection camera. Microscopy. 65 (1), 35-41 (2016).
- Noble, A. J., et al. Routine single particle CryoEM sample and grid characterization by tomography. eLife. 7, 34257 (2018).
- Grimm, R., Typke, D., Bärmann, M., Baumeister, W. Determination of the inelastic mean free path in ice by examination of tilted vesicles and automated most probable loss imaging. Ultramicroscopy. 63 (3-4), 169-179 (1996).
- Glaeser, R. M. Proteins, interfaces, and cryo-EM grids. Current Opinion in Colloid and Interface Science. 34, 1-8 (2018).
- D'Imprima, E., Floris, D., Joppe, M., Sánchez, R., Grininger, M., Kühlbrandt, W. Protein denaturation at the water-air interface and how to prevent it. eLife. 8, 400432 (2019).
- Bai, X. C., Fernandez, I. S., McMullan, G., Scheres, S. H. W. Ribosome structures to near-atomic resolution from thirty thousand cryo-EM particles. eLife. 2013 (2), 00461 (2013).
- Russo, C. J., Passmore, L. A. Controlling protein adsorption on graphene for cryo-EM using low-energy hydrogen plasmas. Nature Methods. 11 (6), 649-652 (2014).
- Naydenova, K., Russo, C. J. Measuring the effects of particle orientation to improve the efficiency of electron cryomicroscopy. Nature Communications. 8 (1), 8-12 (2017).
- Jain, T., Sheehan, P., Crum, J., Carragher, B., Potter, C. S. Spotiton: A prototype for an integrated inkjet dispense and vitrification system for cryo-TEM. Journal of Structural Biology. 179 (1), 68-75 (2012).
- Razinkov, I., et al. A new method for vitrifying samples for cryoEM. Journal of Structural Biology. 195 (2), 190-198 (2016).
- Feng, X., et al. A Fast and Effective Microfluidic Spraying-Plunging Method for High-Resolution Single-Particle Cryo-EM. Structure. 25 (4), 663-670 (2017).
- Ermantraut, E., Wohlfart, K., Tichelaar, W. Perforated support foils with pre-defined hole size, shape and arrangement. Ultramicroscopy. 74 (1-2), 75-81 (1998).
- Adrian, M., Dubochet, J., Lepault, J., McDowall, A. W. Cryo-electron microscopy of viruses. Nature. 308 (5954), 32-36 (1984).
- Fujiyoshi, Y. The structural study of membrane proteins by electron crystallography. Advances in Biophysics. 35, 25-80 (1998).
- Koning, R. I., Oostergetel, G. T., Brisson, A. Preparation of flat carbon support films. Ultramicroscopy. 94 (34), 183 (2003).
- Hummers, W. S., Offeman, R. E. Preparation of Graphitic Oxide. Journal of the American Chemical Society. 80 (6), 1339 (1958).
- Pantelic, R. S., Meyer, J. C., Kaiser, U., Baumeister, W., Plitzko, J. M. Graphene oxide: A substrate for optimizing preparations of frozen-hydrated samples. Journal of Structural Biology. 170 (1), 152-156 (2010).
- Pantelic, R. S., et al. Graphene: Substrate preparation and introduction. Journal of Structural Biology. 174 (1), 234-238 (2011).
- Li, X., et al. Large-area synthesis of high-quality and uniform graphene films on copper foils. Science. 324 (5932), 1312-1314 (2009).
- Regan, W., et al. A direct transfer of layer-area graphene. Applied Physics Letters. 96 (11), 2008-2011 (2010).
- Brilot, A. F., et al. Beam-induced motion of vitrified specimen on holey carbon film. Journal of Structural Biology. 177 (3), 630-637 (2012).
- de Martín Garrido, N., et al. Direct transfer of electron microscopy samples to wetted carbon and graphene films via a support floatation block. Journal of Structural Biology. 213 (1), 107677 (2021).
- Valentine, R. C., Shapiro, B. M., Stadtman, E. R. Regulation of Glutamine Synthetase. XII. Electron Microscopy of the Enzyme from Escherichia coli. Biochemistry. 7 (6), 2143-2152 (1968).
- Scarff, C. A., Fuller, M. J. G., Thompson, R. F., Iadaza, M. G. Variations on negative stain electron microscopy methods: Tools for tackling challenging systems. Journal of Visualized Experiments. (132), e57199 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены