Method Article
Быстрое замораживание с использованием сэндвич-морозильного устройства для хорошей ультраструктурной консервации биологических образцов в электронной микроскопии
В этой статье
Резюме
Здесь мы покажем, как использовать сэндвич-морозильное устройство для быстрого замораживания биологических образцов, включая бактерии, дрожжи, культивируемые клетки, изолированные клетки, ткани животных и человека и вирусы. Мы также покажем, как подготовить образцы к ультратонкому сечению после быстрого замораживания.
Аннотация
Химическая фиксация была использована для наблюдения за ультраструктурой клеток и тканей. Однако этот метод не обеспечивает адекватного сохранения ультраструктуры клеток; обычно наблюдаются артефакты и извлечение содержимого клеток. Быстрое замораживание является лучшей альтернативой для сохранения клеточной структуры. Сэндвич-замораживание живых дрожжей или бактерий с последующим замораживанием-замещением было использовано для наблюдения за изысканной природной ультраструктурой клеток. В последнее время сэндвич-замораживание культивируемых клеток или тканей человека также используется для выявления ультраструктуры клеток и тканей.
Эти исследования до сих пор проводились с помощью устройства для замораживания сэндвичей ручной работы, и применение к исследованиям в других лабораториях было ограничено. Недавно было изготовлено новое устройство для замораживания сэндвичей, которое в настоящее время коммерчески доступно. В настоящей работе показано, как использовать сэндвич-морозильное устройство для быстрого замораживания биологических образцов, включая бактерии, дрожжи, культивируемые клетки, изолированные клетки, ткани животных и человека и вирусы. Также показана подготовка образцов к ультратонкому сечению после быстрого замораживания и процедуры замораживания-замещения, встраивания смолы, обрезки блоков, разрезания ультратонких срезов, восстановления сечений, окрашивания и покрытия сеток опорными пленками.
Введение
Электронная микроскопия является мощным инструментом для изучения ультраструктуры клеток. Химическая фиксация с помощью обычных процедур обезвоживания была использована для наблюдения за ультраструктурой клеток и тканей. Однако этот метод не обеспечивает адекватного сохранения ультраструктуры клеток, и обычно наблюдаются артефакты и извлечение клеточного содержимого. Быстрое замораживание и замораживание-замещение клеток и тканей являются лучшими альтернативами для сохранения клеточной структуры.
Три основных метода были использованы для быстрого замораживания клеток1:1) погружение-замораживание выполняется путем погружения образцов в охлажденный криоген, такой как пропан, и использовалось с начала 1950-х годов2; 2) замораживание холодного металлического блока осуществляется путем быстрого нанесения клеток и тканей на металлический блок, охлажденный жидким азотом или жидким гелием3,4; и 3) замораживание под высоким давлением осуществляется путем замораживания клеток и тканей жидким азотом под высоким давлением5,6,7.
Сэндвич-замораживание - это тип погружения-замораживания, осуществляемого путем зажима тонких биологических материалов между двумя медными дисками и быстрого замораживания их путем погружения в жидкий пропан8,9,10. В этом методе очень тонкие образцы (толщиной в несколько микрометров) быстро охлаждаются криогеном с использованием металла, который имеет хорошую теплопроводность с обеих сторон. Таким образом, этот метод эффективно отводит тепло от образцов, что дает возможность стабильно замораживать клетки без повреждения кристаллами льда. Сэндвич-замораживание споследующим замораживанием-замещением живых дрожжей и бактериальных клеток выявляет естественную ультраструктуру клеток10,11, 12,13, 14,15,16.
Недавно было признано, что этот метод полезен для сохранения четких клеточных изображений глутаровых альдегид-фиксированных микроорганизмов17,18,19,20,21,22,23,24,культивируемых клеток25,26,27и клеток и тканей человека1,28 . Хотя эти исследования были проведены с использованием устройства для замораживания сэндвичей ручной работы29,а применение других исследований в других лабораториях было ограничено, новое устройство для замораживания сэндвичей (SFD) было изготовлено28 и в настоящее время коммерчески доступно.
В настоящей статье показано, как использовать SFD для быстрого замораживания биологических образцов, включая бактерии, дрожжи, культивируемые клетки, изолированные клетки, ткани животных и человека и вирусы. Также показана подготовка образцов к ультратонкому сечению после быстрого замораживания, а также процедуры замораживания-замещения, встраивания смолы, обрезки блоков, разрезания ультратонких срезов, восстановления срезов, окрашивания и покрытия сеток опорными пленками.
протокол
ПРИМЕЧАНИЕ: Протокол исследования для образцов человека был одобрен Комитетом по этике биомедицинских исследований Высшей школы медицины Университета Тиба (3085). Тетроксид осмия является опасным химическим веществом; с ним следует обращаться в перчатках в вытяжном капюшоне. На фиг.1 показано сэндвич-морозильное устройство и необходимые инструменты28. На рисунке 2 показаны материалы, необходимые для проведения экспериментов по замораживанию сэндвичей. Стеклянные флаконы заполняют ацетоном, содержащим тетроксид осмия, и держат при -80°C до использования(рисунок 2B). Медные диски имеют диаметр 3 мм, без отверстий, имеют букву с одной стороны и коммерчески доступны(рисунок 2C).
1. Быстрое замораживание клеточных суспензий для замораживания-замещения
ПРИМЕЧАНИЕ: Вся процедура показана на рисунке 3.
- Клетки
- Используйте клеточные суспензии бактерий, дрожжей(рисунок 2А),культивируемых клеток и изолированных клеток для замораживания сэндвичей.
ПРИМЕЧАНИЕ: Могут быть использованы как живые, так и глутароальдегидно-фиксированные клетки28.
- Используйте клеточные суспензии бактерий, дрожжей(рисунок 2А),культивируемых клеток и изолированных клеток для замораживания сэндвичей.
- Получение жидкого пропана
ПРИМЕЧАНИЕ: Используйте криоглавы и очки при работе с жидким азотом. Поскольку пропан взрывоопасен, следует соблюдать осторожность, чтобы не использовать пожары в одной комнате, а окна должны быть открыты.- Заполните контейнер с жидким азотом SFD жидким азотом(рисунок 4A). Заполните контейнер с жидким пропаном жидким пропаном, введя газ пропан с помощью тонкого сопла(рисунок 4B,C). Ускорьте затвердевание пропана с помощью охлаждаемого металлического стержня(рисунок 1 и рисунок 4D,E).
- Подготовка медных дисков
- Поместите медные диски на скользящее стекло без буквенной стороной вверх(рисунок 2D)и обработайте тлеющим разрядом при 10 Па, 400 вольт, 1 мА в течение 30 с(фиг.4F,G),чтобы сделать поверхность диска гидрофильной с помощью ионного распылительного аппарата30.
- Сэндвичинг и погружная заморозка клеточной суспензии
- Переложите клеточную суспензию в 2-мл центрифужную трубку(фиг.5А)и центрифугу при 2,900 × г в течение 10 с при комнатной температуре(Фиг.5В,С). Удалите супернатант и приостановите гранулу, чтобы получить толстую суспензию (см. обсуждение).
- Поместите небольшое количество суспензии ячейки (~0,02 мкл) на медный диск(рисунок 5D-F),накройте его другим медным диском(рисунок 5G)и подберите диски пинцетом(рисунок 5H).
ПРИМЕЧАНИЕ: Чтобы измерить ~0,02 мкл клеточной суспензии, наблюдают 0,1 мкл капель суспензии под стереомикроскопом и делят их на капли, которые составляют1/5 этой суммы. - Сделайте лунку в центре из твердого пропана с тонким металлическим стержнем(рисунок 5I). Установите пинцет в SFD и быстро заморозьте их, нажав кнопку впрыска аппарата(рисунок 5J,K).
ПРИМЕЧАНИЕ: Следует позаботиться о том, чтобы не высушить образцы и не уложить два диска полностью друг на друга (в противном случае их отсоединение станет очень трудным на следующем этапе).
- Сэндвичинг и погружение-замораживание тканей животных и человека
- Используют ткани животных и человека (~0,5 мм х 0,5 мм х 1,5 мм), закрепленные в 2,5% глутар-0,1 М фосфатного буфера (рН 7,4)(Рисунок 6А,В). Нарежьте их на участки толщиной от 0,1 до 0,2 мм лезвием бритвы под стереомикроскопом(рисунок 6C,D).
- Поместите небольшую каплю (~0,02 мкл) раствора глутаральдегида на медный диск(рисунок 6E,F). Затем используйте пинцет, чтобы поместить кусочек ткани в глутаровый альдегид на медный диск(рисунок 6G,H)и покрыть его другим медным диском(рисунок 6I-K).
- Быстро замораживают диски с тканями в плавящемся пропане SFD, как описано в разделе 1.4(Рисунок 5J,K).
ПРИМЕЧАНИЕ: Поскольку глутаровый альдегид является опасным химическим веществом, с ним следует обращаться в перчатках в вытяжном капюшоне. Ткани не следует промывать буферами при размещении на медном диске, а хранить в растворе глутаралальдегида, поскольку глутаровый альдегид обладает антимерзающим эффектом1.
- Используют ткани животных и человека (~0,5 мм х 0,5 мм х 1,5 мм), закрепленные в 2,5% глутар-0,1 М фосфатного буфера (рН 7,4)(Рисунок 6А,В). Нарежьте их на участки толщиной от 0,1 до 0,2 мм лезвием бритвы под стереомикроскопом(рисунок 6C,D).
- Замораживание-замещение ацетоном осмия
- Переведите диски в жидкий азот в рабочей ванне(рис. 7А,В). Используя пару пинцетов, охлажденных в жидком азоте, отсоедините диски друг от друга, чтобы обнажить образец(рисунок 7C-E).
- Поместите диски с ячейками в стеклянный флакон(рисунок 7F),который заполнен 1 мл ацетона, содержащего 2% тетроксида осмия(рисунок 2B),который был помещен в жидкий азот и затвердел(рисунок 4H).
- Переложите диски в морозильную камеру и держите их при -80°C в течение 2-4 дней для замораживания-замещения ячеек(рисунок 3). Замочите использованный пинцет в воде комнатной температуры, чтобы согреть их(рисунок 7G)для замораживания следующих образцов.
ПРИМЕЧАНИЕ: Пинцет для обработки образца должен быть теплым (комнатная температура), поскольку холодный пинцет может заморозить образец до быстрого замерзания, что приведет к образованию кристаллов льда.
- Подогрев и встраивание образцов
- Постепенно доводят образцы до комнатной температуры (2 ч при -20°С, 2 ч при 4°С и 15 мин при комнатной температуре, Фиг.3 и Фиг.8А)и переносят диски в 2-мл пластиковые трубки, которые заполнены 1 мл ацетона(Фиг.3 и Фиг.8В,С).
- Готовят эпоксидную смолу путем смешивания реагентов в одноразовом пластиковом контейнере с помощью мешалки(рисунок 8D-F).
- Замените ацетон на стадии 1.7.1 последовательно на 30% смолу (в ацетоне), 60% смолу и 90% смолу при комнатной температуре в течение 1 ч каждая. Затем замените 90% смолу на 100% смолу при 37°C в течение ночи. Наконец, встраиваем образцы в 100% смолу(рисунок 8G-J)в кремниевую форму для встраивания и полимеризуем их при 60°C в течение 24 ч(рисунок 3).
ПРИМЕЧАНИЕ: Образцы должны оставаться прикрепленными к медным дискам на протяжении всей процедуры (для облегчения сечения). Использование вращающегося или встряхивающего аппарата не рекомендуется во время процесса встраивания, поскольку они мало способствуют проникновению смолы в клетку. Более того, вибрация от аппарата иногда заставляет образцы отделяться от медных дисков. Инкубация при 37°C в течение ночи ускорит проникновение смолы в ячейку за счет тепловой энергии (смола не полимеризуется, потому что не содержит ускорителя).
- Обрезка образцов блоков
- Извлеките полимеризованные блоки из кремниевых встраивающих форм(рисунок 9А). Напишите номер образца на блоке(рисунок 9B).
- Извлеките медные диски из блока с помощью лезвия бритвы(рисунок 9C,D)и обрежьте образцы, встроенные в поверхность блока, до 0,7 мм х 0,7 мм с помощью ультразвукового лезвия обрезки(рисунок 9E)и лезвий бритвы(рисунок 9F-H)под стереомикроскопом31.
- Установите блок в держатель образца ультрамикротома(рисунок 9I)и плавно орежьте поверхность блока алмазным обрезным ножом(рисунок 9J,K).
- Резка ультратонких профилей
- Снимите блок с ультрамикротома(рисунок 10А)31,установите его в стереомикроскоп и обрежьте далее до 0,2 мм х 0,3 мм лезвием бритвы(рисунок 10B,C).
- Нанесите неопрен на сетки, чтобы сделать их клейкими(рисунок 10D). Установите блок обратно на ультрамикротом, накройте ультрамикротом пластиковую крышку(рисунок 10E)31и вырежьте срезы толщиной 50-70 нм(рисунок 10F-H).
- Извлеките срезы с помощью петли(рисунок 10I),смонтируйте их на 300 или 400 сетчатых медных сетках, обработанных неопреном, и высушите их(рисунок 10J).
- Окрашивание срезов и наблюдение под электронным микроскопом
- Устанавливают сетки с прорезями в канавке полусиликоновой трубки(фиг.11А)31,и замачивают в растворе уранилацетата и цитрате свинца на 3 мин каждая для окрашивания(фиг.11В-Е)32.
- Для дрожжевых и грибковых образцов поместите сетки на фильтровальную бумагу (4 мм х 4 мм), подберите их пинцетом и накройте плазмополимеризованной нафталиновой пленкой33 на поверхностиводы (фиг.11F,G). Вставьте сетки в электронный микроскоп и наблюдайте при 100 кВ(рисунок 11H,I).
2. Быстрое замораживание вирусов и макромолекул
- Приготовление жидкого этана
ПРИМЕЧАНИЕ: Используйте криоглавы и очки при работе с жидким азотом. Поскольку этан взрывоопасен, следует соблюдать осторожность, чтобы не использовать огонь в одной комнате, а окна должны быть открыты. Этан используется, потому что он испаряется в электронном микроскопе, а пропан нет.- Заполните контейнер с жидким азотом SFD жидким азотом. Заполните контейнер с жидким этаном жидким этаном, введя газ этан через тонкое сопло.
- Подготовка и быстрая заморозка микросетей и образцов
- Сделать обе грани микросетей гидрофильными, обработав их тлеющим разрядом (10 Па, 400 В, 1 мА) с помощью ионно-напыляющего аппарата30.
- Поместите микросеть в SFD и нанесите 2 мкл вируса или макромолекулярной суспензии (1 мг белка / мл) на микросети. Удалите лишнюю жидкость с помощью фильтровальной бумаги и быстро заморозьте микросеть, нажав кнопку впрыска аппарата.
- Установка замороженной микросети в криотрансферный держатель и наблюдение под электронным микроскопом
- Перенесите замороженные микросети в жидкий азот, установленный в криотрансферный держатель, предварительно охлажденный при температуре жидкого азота, и наблюдайте под электронным микроскопом при низкой температуре34.
Результаты
Живые клетки микроорганизмов в суспензии собирали центрифугированием, зажимали между двумя медными дисками, быстро замораживали СФД, замещали, внедряли в эпоксидную смолу, ультратонкое сечение, окрашивали и наблюдали под электронным микроскопом, следуя описанным выше процедурам. На рисунке 12 показаны ультратонкие срезы кишечной палочки (бактерии, рисунок 12A,B)16 и Saccharomyces cerevisiae (дрожжи, рисунок 12C)15. Обратите внимание, что изображения очень четкие и показывают естественную морфологию.
Глутаральдегид-фиксированные клеточные суспензии культивируемых клеток и изолированных клеток животных собирали и быстро замораживали с помощью SFD, замещали замораживанием и наблюдали под электронным микроскопом, следуя процедурам, описанным выше. На фиг.13 показаны ультратонкие срезы культивируемых клеток(Фиг.13А-С)1,28 и изолированные клетки брюшной полости мыши(Рисунок 13D)28. На рисунке 14 показаны ультратонкие участки кожи человека(Рисунок 14A-D)и пышное пальто(Рисунок 14E)1. Обратите внимание, что изображения также очень четкие и показывают естественную морфологию. На фиг.15 показаны частицы ядра вируса гепатита В, быстро замороженные с помощью SFD и наблюдаемые криоэлектронной микроскопией34. Как и в случае с другими клетками, изображения очень четкие и показывают естественную морфологию.
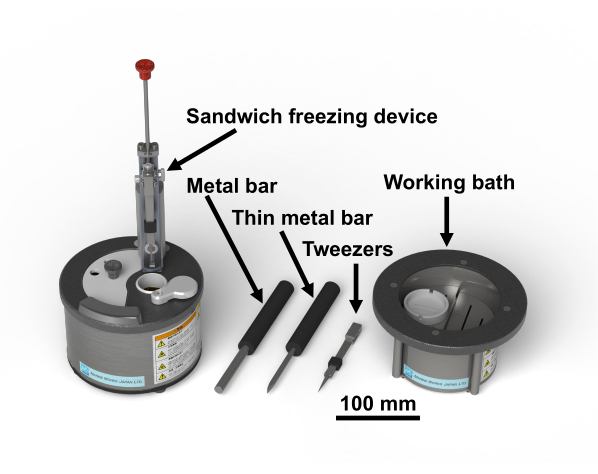
Рисунок 1:Сэндвич-морозильное устройство28 и необходимые инструменты. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2:Материалы, необходимые для проведения экспериментов по замораживанию сэндвичей. (A) Образец: Световая микрофотография Saccharomyces cerevisiae (дрожжей). Шкала бар = 10 мкм. (B) Стеклянные флаконы (10 мл), содержащие 1 мл ацетона с 2% тетроксида осмия. (C) Медные диски, показывающие поверхность без буквы (слева) и поверхность с буквой (справа). Шкала стержня = 3 мм. Сканирующая электронная микроскопия. (D) Медные диски без буквенной стороны вверх были размещены на стеклянной горке с двухсторонней клейкой лентой (*). Шкала стержня = 3 мм.(E)Обоюдоострая бритва и сломанная обоюдоострая бритва для нарезки тканей животных и человека, однолезвийная бритва для обрезки блоков и измельченная доска для нарезки тканей животных и человека. (F) Пинцет с экструдированным пенополистиролом для защиты пальцев от холода. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
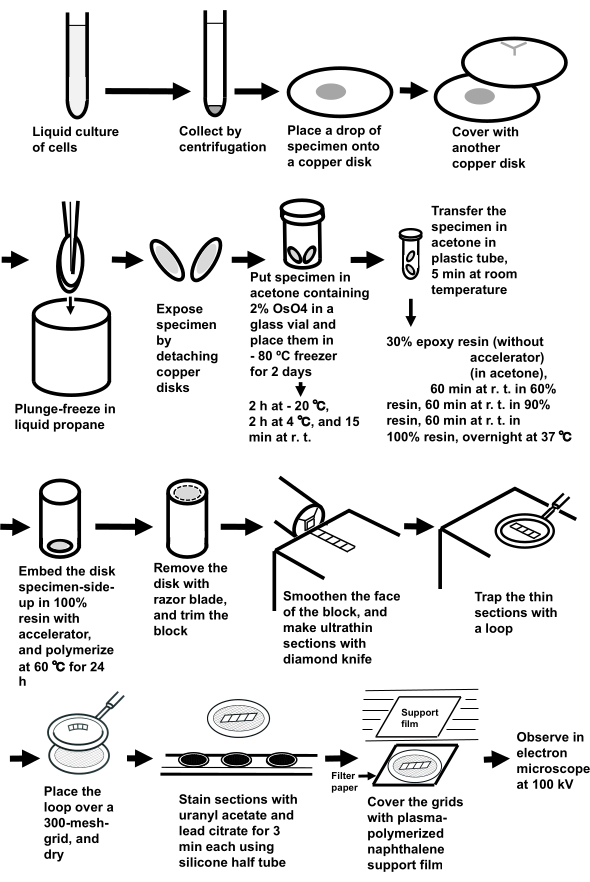
Рисунок 3:Подготовка образца клеточной суспензии методом сэндвич-замораживания. Сокращения: r.t. = комнатная температура. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4:Приготовление жидкого пропана, медных дисков и фиксатора. ( А )Жидкийазот (стрелка) заливали в контейнер с жидким азотом сэндвич-морозильного устройства. (B)Газ пропан вводили в контейнер с жидким пропаном через тонкое сопло. (C) Жидкий пропан (стрелка). (D)Металлический стержень (стрела) использовался для охлаждения жидкого пропана для ускорения затвердевания жидкого пропана. (E)Затвердевший пропан (стрелка). (F)Ионный распылительный аппарат (стрела) для придания медным дискам гидрофильного состояния с тлеющим разрядом. (G) Тлеющий разряд. (H) Стеклянные флаконы, помещенные в жидкий азот в рабочей ванне. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5:Быстрое замораживание клеточной суспензии (дрожжей) с помощью сэндвич-морозильного устройства. (А)Перенос культуры дрожжей в центрифужную трубку. (B) Микроцентрифуга. (C) Гранула Saccharomyces cerevisiae в центрифужной трубке (стрелка). (D)Перенос образца с помощью микропипетки из трубки центрифуги. (E)Размещение образца на медном диске. (F) Небольшая капля образца на медном диске (стрелка). (G)Покрытие образца другим медным диском. (H) Подбор двух дисков пинцетом. (I)Изготовление колодца в твердом пропане с использованием тонкого металлического стержня. (J)Погружение-замораживание образца нажатием кнопки впрыска. (K) Замораживание завершено. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6:Подготовка образца тканей человека (кожи). (А, Б) Кожная ткань человека, закрепленная в глутаральдегиде в чашке Петри. Шкала стержня = 5 мм. (C, D) Ткани (стрелка) нарезали с помощью двух обоюдоострых бритв на измельченной доске. (E, F) Небольшую каплю раствора глутаральдегида (стрелку) помещали на медный диск. (G, H) Кусочек кожной ткани помещали на медный диск с помощью пинцета. (I)Другой диск использовался для покрытия медного диска кожной тканью. (J) Сэндвич-диски были подобраны пинцетом. (K) Зажатые диски аккуратно удерживались пинцетом. Обратите внимание на зазор между кончиками пинцета (стрелкой), поддерживаемый во избежание раздавливания тканей. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 7:Перенос образца в жидкий азот и отсоединение дисков. (А) Перенос дисков (стрелка) в жидкий азот в рабочей ванне. (B) Диски из жидкого азота (стрелка). Пинцетпомещали в жидкий азот для охлаждения их в рабочей ванне. (D, E) Отсоединение медных дисков (стрелок) с помощью пинцета. (F) Перенос диска (стрелки) в стеклянный флакон пинцетом. (G) Согревание пинцета в воде для замораживания следующего образца. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 8:Подогрев и встраивание образцов. (А) Образцы в стеклянных флаконах при комнатной температуре. (B) Перенос дисков (стрелка) в пластиковую трубку объемом 2 мл пинцетом. (C) Медные диски (стрелка) в ацетоне в пластиковой трубке. (D) Измерение смол с помощью инъекционной трубки (стрелка). (E) Перенос смолы в одноразовый стаканчик (стрелку). (F) Смешивание смолы с помощью мешалки. (G) Небольшое количество смолы помещали в отверстия силиконовой формы для встраивания. (H) Избыток смолы в сетках был удален фильтровальной бумагой. (I, J) Медные диски с образцами помещали в нижнюю часть отверстий встраиваемой формы стороной образца вверх. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 9:Обрезка блока образца. (А) Извлечение полимеризованных блоков из встраиваемых форм. (B) Номер образца был написан на блоке. (C, D) Медный диск извлекали из блока бритвой. Шкала для (D) = 1 мм. (E-G) Образец был отделан ультразвуковым режущим лезвием и лезвием бритвы. Шкала для (G) = 1 мм. (H) Высокое увеличение (G). Отдельным светлым пятном является клетка. Клетки были встроены в один слой10. Шкала стержня = 10 мкм. (I-K) Поверхность блока была разрезана гладко с помощью алмазного обрезного ножа. Шкала для (K) = 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 10:Резка ультратонких сечений. (A) Блок образца был удален из микротома31. (B, C) Образец был дополнительно обрезан лезвием бритвы. Шкала для (C) = 0,5 мм. (D) Неопрен был нанесен на сетки, чтобы они прилипли. (E) Ультрамикротом был покрыт пластиком, чтобы избежать воздушного потока во время ультратонкого сечения. (F) Лодка с алмазным ножом была заполнена водой. (G, H) Ультратонкие сечения были разрезаны до толщины 70 нм. Шкала для (H) = 1 мм. (I, J) Срезы извлекались с помощью петли и затем высушивались. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 11:Окрашивание секций. (A) Сетки были размещены в канавке полусилиновой трубки. (B) Их вымачивали в уранилацетате для окрашивания. (C) Использованный уранилацетат собирали на самозапечатывающейся восковой пленке. (D) Сетки промывали струей воды и(E),а затем вымачивали цитратом свинца. (F)Плазменно-полимеризованная нафталиновая пленка плавала на воде и(G)использовалась для покрытия сетки, размещенной на фильтровальной бумаге размером 4 мм х 4 мм. (H)Сетка была помещена в держатель образца и(I)наблюдалась в электронном микроскопе. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
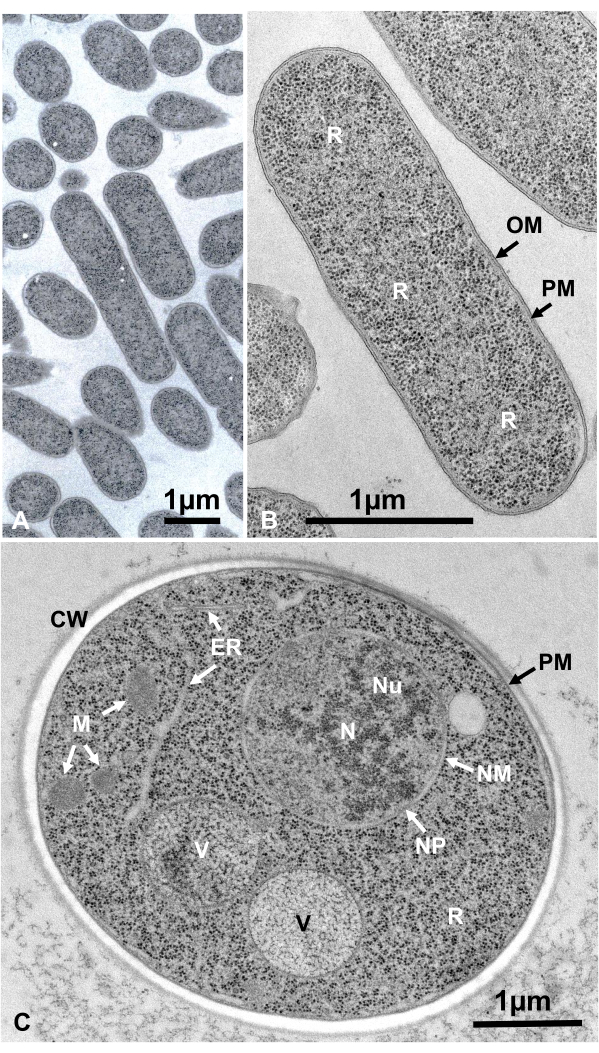
Рисунок 12:Ультратонкие срезы кишечной палочки (бактерии, А, В) и Saccharomyces cerevisiae (дрожжи, С). (A) Обратите внимание, что образцы встроены плотно и однородно и не имеют деформации. (B, C) Мембранные структуры показывают четкую и гладкую морфологию, а рибосомы достаточно ясны, чтобы каждую частицу можно было перечислить16. (C)Дрожжевые ядра и вакуоли имеют истинную форму круга, которая может быть их естественной морфологией. Матрица митохондрий показывает электронно-плотный вид, который может быть характерен для живых клеток, которые фиксируются быстрым замораживанием. Шкала стержней = 1 мкм. Сокращения: CW = клеточная стенка; ER = эндоплазматический ретикулум; NM = ядерная мембрана; NP = ядерные поры; OM = наружная мембрана; ТЧ = плазматические мембраны; R = рибосомы; N = ядро; M = митохондрии. (B)воспроизводится из Yamada et al.16 с разрешения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
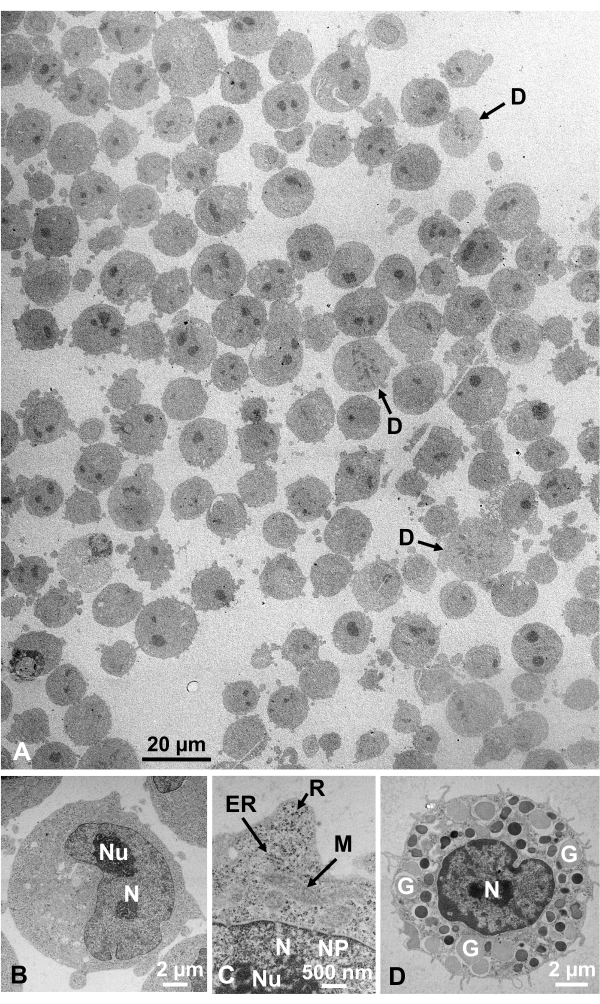
Рисунок 13:Ультратонкие срезы. (A-C) K562 культивируемые клетки. (D) Изолированная тучная клетка от мыши. (A) Обратите внимание, что образцы встроены плотно и однородно и не имеют деформации. Шкала bar = 20 мкм. (B-D) При большом увеличении отчетливо наблюдаются ядро, ядро, ядерная мембрана, ядерные поры, эндоплазматический ретикулум, митохондрии, рибосомы и гранулы. Шкала стержней = 2 мкм(B),500 нм(C),2 мкм(D). Сокращения: N = ядро; Nu = ядрышко; NM = ядерная мембрана, NP = ядерные поры; ER = эндоплазматический ретикулум; M = митохондрии; R = рибосомы; G = гранулы; D = делящиеся клетки. (A)воспроизводится из Yamaguchi et al.1 с разрешения. (B-D) воспроизводятся из Yamaguchi et al.28 с разрешения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
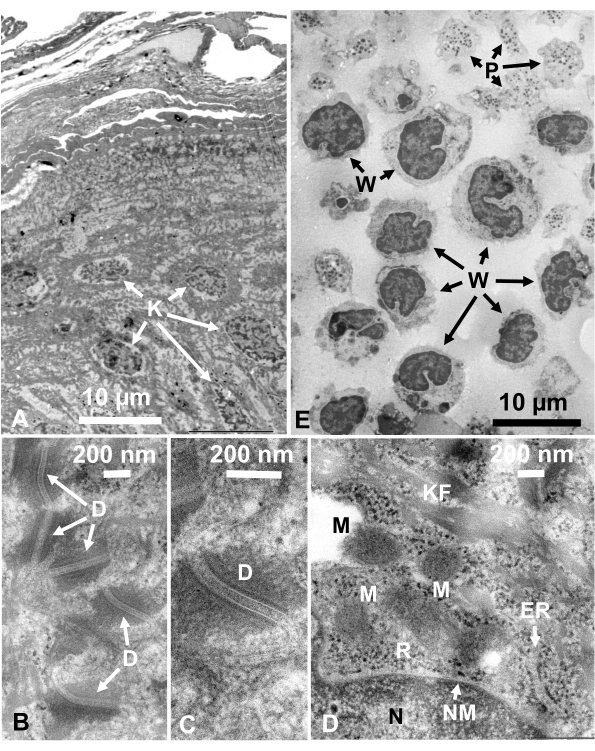
Рисунок 14:Ультратонкие срезы. (A-D) кожа человека и (E) пышная шерсть. (А-Е) Обратите внимание, что изображения тканей и клеток четкие и естественные и показывают хороший контраст, хотя участки очень тонкие (50 нм). Матрица митохондрий показывает плотный внешний вид, который похож на плотные митохондриальные матрицы быстро замороженных живых клеток(D). Шкала стержней = 10 мкм (A, E), 200 нм (B-D). Сокращения: D = десмосомы; ER = эндоплазматический ретикулум; К = кератиноцит; KF = кератиновые волокна; M = митохондрии; N = ядро; NM = ядерная мембрана; P = тромбоциты; R = рибосомы; W = белые кровяные тельца. Воспроизводится из Yamaguchi et al.28 с разрешения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
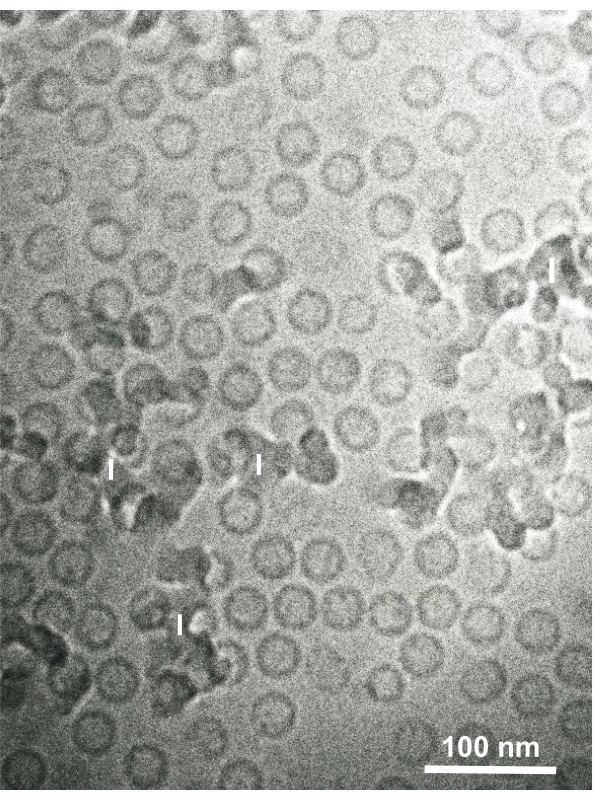
Рисунок 15:Частицы ядра вируса гепатита В (HBV) быстро замораживаются жидким этаном с помощью сэндвич-морозильного устройства и наблюдаются с помощью криоэлектронной микроскопии. Сферические полые частицы являются частицами ядра HBV. Шкала = 100 нм. Сокращения: HBV = вирус гепатита В; I = лед. Воспроизводится из Yamaguchi et al.28 с разрешения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Следующее обсуждение основано на более чем 120 экспериментах по замещению замораживания-замораживания сэндвичей на более чем 1000 образцах и более чем 70 экспериментах по плюнг-замораживанию-криоэлектронной микроскопии на более чем 75 образцах, проведенных в течение 36 лет.
Успешность хорошей заморозки путем замораживания сэндвичей
Скорость успеха в достижении хорошей заморозки зависит от образцов. Клетки Saccharomyces cerevisiae (дрожжи), культивируемые в среде YPD (1% дрожжевого экстракта, 2% пептона, 2% декстрозы), дали почти 100% успех для хорошей заморозки без образования кристалловльда 10,11,15,35,36. Другие виды дрожжей, в том числе Shizosaccharomyces37,38,39,Cryptococcus14,40,41,42,43,44,45, Exophiala13,41,46,47,48, 49, Fusarium50,51,52, Aureobasidium53, Candida54,55, Fellomyces56, Aspergillus57и Trichosporon, также показали хорошую заморозку. Бактерии, в том числе Mycobacterium58,59 и E. coli16,также показали хорошую заморозку. Культивируемые клетки и изолированные клетки животных показали хорошую заморозку как для живых, так и для глутаровых альдегид-фиксированных клеток1,25, 26,27,60. Глутаровые фиксированные ткани животных и человека, нарезанные до толщины от 0,1 до 0,2 мм, также показали хорошую заморозку большую частьвремени 1,28.
Условия для хорошей заморозки
Используйте только клетки в соответствующей стадии роста и состоянии. Клетки в культуре должны находиться в экспоненциальной фазе. Нанесите очень небольшое количество клеточных суспензий концентрированных образцов (для S. cerevisiae,~0,02 мкл 3-5 ×10 9 клеток/мл) на медный диск. Фиксированные глутаровым альдегидом срезы тканей животных или человека также должны быть очень маленькими (предпочтительно 0,3 мм х 0,3 мм х 0,1 мм). Поскольку разрезать срезы тканей толщиной 0,1 мм сложно, нарежьте много тканей и выберите тонкие и полупрозрачные ломтики. Работайте быстро, но осторожно, и не дайте образцам высохнуть. При подборе сложенных медных дисков пинцетом не нажимайте на диски слишком сильно, чтобы избежать раздавливания клеток и тканей. Загрузка образцов является наиболее важным шагом для успешного замораживания, и требуемые условия такие же, как и условия для хорошего замораживания для замораживания под высоким давлением. Читателям стоит обратиться к отличному обзору McDonald61.
Другие области применения
В этой статье представлены электронные микроснимки бактерии, дрожжей, культивируемых клеток, изолированных клеток животных, тканей человека и вирусных частиц. Мы наблюдали хорошее замерзание морских водорослей, закрепленных глутаровым альдегидом. Однако клеточные структуры живых пресноводных зеленых водорослей были разрушены образованием кристаллов льда. Смешивание клеток с 20% бычьим сывороточным альбумином (BSA) гарантировало, что ультраструктура хорошо сохранилась без повреждения кристаллами льда. Использование 20% BSA также было полезно для сохранения ультраструктуры клеток стебля гриба. Продолжаются эксперименты по замораживанию растительных клеток и тканей путем нанесения 20% BSA. Хотя сканирующая электронная микроскопия образцов с замораживанием-замораживанием-замораживанием не была предпринята, наблюдение за хорошо сохранившимися клеточными структурами сообщалосьранее 9.
Примечания по методу замораживания сэндвичей
Близкая к нативной ультраструктура клеток лучше всего наблюдается при быстром замораживании и замораживании-замещении живых клеток. Образования кристаллов льда с SFD можно избежать, ограничив толщину ячеек до ≤30 мкм1. Фиксация тканей глутаровым альдегидом часто дает лучшее сохранение клеточной структуры для наблюдения за суспензионными культивируемыми клетками, поскольку фиксация глутарового альдегида делает клеточную структуру более жесткой и предотвращает возможные ультраструктурные изменения при сборе и центрифугировании живыхклеток1. Фиксация глутаральдегида также позволяет увеличить глубину замерзания до 0,2 мм1,аналогично тому, что достигается методом замораживания под высоким давлением (HPF). Поэтому машина HPF может быть заменена на SFD для глубокой заморозки тканей животных и человека.
Поскольку глутаральдегидно-фиксированные ткани могут храниться более 2 лет28,замораживание сэндвичей может быть выполнено в соответствии с удобством пользователя. Фиксация тканей глутаральдегидом также облегчает сечение тканей, потому что ткани становятся более жесткими с фиксацией. В отличие от машины HPF, SFD может использоваться для быстрого замораживания вирусов для криоэлектронной микроскопии, а также для бактерий и эукариотических клеток. Более того, по сравнению с машиной HPF, SFD небольшой, портативный, менее дорогой и может быть приобретен большим количеством лабораторий. Мы надеемся, что эти особенности SFD помогут большему количеству лабораторий достичь своих исследовательских целей28.
Особенности естественной морфологии клеток
Клеточные структуры находятся в своем естественном состоянии, если они показывают следующий вид: Мембранные структуры наружной мембраны(Рисунок 12А,В),плазматическая мембрана(Фиг.12В,С); Рисунок 13А-D; и рисунок 14E),ядерная оболочка (рисунок 12C, рисунок 13B-Dи рисунок 14D-E),митохондрии(рисунок 12C, рисунок 13Cи рисунок 14D)и вакуоли(рисунок 12C)показывают гладкие контуры. Ядро и вакуоли почти круглые(рисунок 12С). Рибосомы показывают четкий электронно-плотный вид диаметром ~20 нм(рисунок 12B,C); Рисунок 13C; и рисунок 14D). Цитоплазма электрон-люцентная(рисунок 12B,C; Рисунок 13C; и рисунок 14D).
Влияние фиксации глутаральдегида на морфологию клеток
Фиксацию глутаральдегида выполняли для тканей животных или человека перед замораживанием сэндвича для получения ультраструктуры без кристаллов льда. Микроснимки, полученные этим методом, показывают изысканно четкие изображения, аналогичные тем, которые получаются при быстром замораживании живых тканей(рисунок 14)1. Исследования дрожжевых клеток, глубоководных микроорганизмов и культивируемых клеток показывают, что деформация ультраструктуры в основном обусловлена фиксацией тетроксида осмия и обезвоживанием этанолом при комнатной температуре1,17,18,28. Смолл также сообщил, что, хотя фиксация глутаральдегида не разрушает организацию актина в культивируемых фибробластах, фиксация тетроксида осмия и обезвоживание ацетоном или этанолом при комнатной температуре разрушают актин организации62.
Следовательно, должно быть проведено детальное изучение влияния фиксации глутарового альдегида на морфологию клеток. Оно разработал метод криофиксации in vivo, при котором живые ткани быстро замораживаются без остановки кровоснабжения63. Ткани были заморожены и встроены в эпоксидную смолу, и наблюдались ультратонкие срезы. Электронные микроскопические изображения показали наиболее близкую к нативной ультраструктуру живых тканей по сравнению с теми, которые были получены путем химической фиксации-обычного обезвоживания и быстрого замораживания свежих нефиксированных тканей. Поэтому может быть интересно сравнить ультраструктуру, полученную путем фиксации глутаральдегида-замораживания (настоящий метод), и ультраструктуру, полученную путем криофиксации-замораживания in vivo, для изучения эффектов фиксации глутаральдегида.
Учет окружающей среды и повышение эффективности экспериментов
Мы используем пластиковые трубки по 2 мл для замены смолы. Одного мл разбавленной смолы достаточно для каждого этапа замены. Использованные пластиковые трубки могут быть выброшены после каждого эксперимента. Это может сэкономить время и силы для мытья стеклянных флаконов, когда они используются для замены смолы. Кроме того, раствор уранилацетата может быть использован многократно для окрашивания сечения32. После окрашивания срезов раствор уранилацетата можно сохранить и повторно использовать. Поскольку уранилацетат является радиоактивным веществом, его повторное использование помогает избежать образования отходов и способствует защите окружающей среды.
Плазменно-полимеризованная нафталиновая пленка
Плазменно-полимеризованная нафталиновая пленка представляет собой трехмерно полимеризованную углеродную пленку, изготовленную из газа нафталина методом плазменной полимеризации под тлеющим разрядом33. Пленка устойчива к электронной бомбардировке и химическим веществам, очень чиста, прозрачна против электронов и имеет плоскую поверхность и аморфную структуру. Таким образом, плазменно-полимеризованная нафталиновая пленка, которая коммерчески доступна, превосходна и рекомендуется в качестве опорной пленки.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Никакой
Материалы
| Name | Company | Catalog Number | Comments |
| Sandwich Freezing Device | Marine works Japan, Ltd, Yokosuka, Japan | MW-SFD-01 | with metal bar, thin metal bar, tweezers, and working bath |
| 10 mL glass vials | - | Scintillation counter vials for fixative | |
| Acetone | - | ||
| Osmium tetroxide | Nisshin EM Co. Ltd., Tokyo | 3004 | 0.1 g |
| Deep freezer | Sanyo Co. Ltd., Osaka | MDF-C8V1 | |
| Copper disk | Nisshin EM Co. Ltd., Tokyo | - | Refer to this paper |
| Slide glass | - | ||
| Double-sided adhesive tape | - | ||
| Single-edged razor blade | Nisshin EM Co. Ltd., Tokyo | - | Feather, FAS-10 |
| Double-edged razor blade | Nisshin EM Co. Ltd., Tokyo | - | Feather, FA-10 |
| Shredded board | Nisshin EM Co. Ltd., Tokyo | 428 | |
| Tweezers | Nisshin EM Co. Ltd., Tokyo | - | Several pairs |
| Tweezers with polystyrene foam | - | One pair | |
| Glutaraldehyde | Nisshin EM Co. Ltd., Tokyo | 3052 | |
| Liquid nitrogen | - | ||
| Propane gas | - | Cryogen | |
| Ion sputter apparatus | Hitachi high technologies, Tokyo | Hitachi E102 | |
| Micropipette | - | For 1 mL, 200 μL, and 2 μL | |
| Microcentrifuge | Tomy digital biology Co. Ltd., Tokyo | Capsulefuge, PMC-060 | |
| Stereomicroscope | Nikon Co. Ltd., Tokyo et al. | - | SMZ 645 |
| LED illumination for stereomicroscope | Nikon Co. Ltd., Tokyo et al. | SM-LW 61 Ji | |
| Disposable plastic container | - | 50 mL and 200 mL | |
| Ethane gas | - | Cryogen | |
| 2 mL Eppendorf tubes | - | For embedding | |
| Disposable plastic syringes | - | 1 mL, 5 mL, 10 mL, and 20 mL | |
| Magnetic stirrer | - | ||
| Epoxy resin | Nisshin EM Co. Ltd., Tokyo | 340 | Quetol 812 set |
| Silicon embedding mold | Nisshin EM Co. Ltd., Tokyo | 4217 | 7 mm in diameter, 13 mm deep |
| Incubater | - | For 37 °C and 60 °C | |
| Trimming stage | Sunmag Co. Ltd., Tokyo | - | Tilting mechanism equipped, Refer to this paper |
| LED illumination for trimming stage | Sunmag Co. Ltd., Tokyo | - | Refer to this paper |
| Ultrasonic Trimming Blade | Nisshin EM Co. Ltd., Tokyo | 5240 | EM-240, Refer to this paper |
| Ultramicrotome | Leica Microsystems, Vienna | Ultracut S | |
| Grids | Nisshin EM Co. Ltd., Tokyo | 2633, 2634 | 300 mesh, 400 mesh |
| 0.5% Neoprene W solution | Nisshin EM Co. Ltd., Tokyo | 605 | |
| Perfect Loop | Nisshin EM Co. Ltd., Tokyo | 2351 | Fot retrieving sections |
| Half Tube for section staining | Nisshin EM Co. Ltd., Tokyo | 463 | Refer to this pape |
| Super Support Film | Nisshin EM Co. Ltd, Tokyo | 647 | |
| Syringe filter | Toyo Roshi Kaisha, Ltd., Tokyo | DISMIC-03CP | Cellulose acetate, 0.45 μm |
| Transmission electron microscope | JEOL Co. Ltd., Tokyo | JEM-1400 |
Ссылки
- Yamaguchi, M., et al. Good ultrastructural preservation of human tissues and cultured cells by glutaraldehyde fixation, sandwich freezing, and freeze-substitution. Cytologia. 85 (1), 15-26 (2020).
- Gilkey, J. C., Staehelin, L. A. Advances in ultrarapid freezing for the preservation of cellular ultrastructure. Journal of Electron Microscopy Technique. 3 (2), 177-210 (1986).
- Van Harreveld, A., Crowell, J. Electron microscopy after rapid freezing on a metal surface and substitution fixation. The Anatomical Record. 149, 381-385 (1964).
- Aoki, N., Ito, M., Ejiri, S., Ozawa, H. Ultrastructure of human skin by a rapid freezing technique: structural preservation and antigenicity. Journal of Investigative Dermatology. 102 (3), 354-361 (1994).
- Moor, H., Steinbrecht, R. A., Zierold, K. Theory and practice of high pressure freezing. Cryotechniques in Biological Electron Microscopy. , 175-191 (1987).
- McDonald, K. L., Morphew, M., Vertkade, P., Muller-Reichert, T. Recent advances in high-pressure freezing: Equipment-and specimen-loading methods. Methods in Molecular Biology. 369, 143-173 (2007).
- Sosinsky, G. E., et al. The combination of chemical fixation procedures with high pressure freezing and freeze substitution preserves highly labile tissue ultrastructure for electron tomography applications. Journal of Structural Biology. 161 (3), 359-371 (2008).
- Costello, M. J. Ultra-rapid freezing of the biological samples. Scanning Electron Microscopy. , 361-370 (1980).
- Baba, M., Osumi, M. Transmission and scanning electron microscopic examination of intracellular organelles in freeze-substituted Kloeckera and Saccharomyces cerevisiae yeast cells. Journal of Electron Microscopy Technique. 5 (3), 249-261 (1987).
- Yamaguchi, M., Okada, H., Namiki, Y. Smart specimen preparation for freeze-substitution and serial ultrathin sectioning of yeast cells. Journal of Electron Microscopy. 58 (4), 261-266 (2009).
- Yamaguchi, M., et al. Electron microscopy of hepatitis B virus core antigen expressing yeast cells by freeze-substitution fixation. European Journal of Cell Biology. 47 (1), 138-143 (1988).
- Baba, M., Takeshige, K., Baba, N., Ohsumi, Y. Ultrastructural analysis of the autophagic process in yeast: detection of autophagosomes and their characterization. Journal of Cell Biology. 124 (6), 903-913 (1994).
- Yamaguchi, M., et al. The spindle pole body duplicates in early G1 phase in a pathogenic yeast Exophiala dermatitidis: an ultrastructural study. Experimental Cell Research. 279 (1), 71-79 (2002).
- Yamaguchi, M., Biswas, S. K., Ohkusu, M., Takeo, K. Dynamics of the spindle pole body of the pathogenic yeast Cryptococcus neoformans examined by freeze-substitution electron microscopy. FEMS Microbiology Letters. 296 (2), 257-265 (2009).
- Yamaguchi, M., et al. Structome of Saccharomyces cerevisiae determined by freeze-substitution and serial ultrathin sectioning electron microscopy. Journal of Electron Microscopy. 60 (5), 321-335 (2011).
- Yamada, H., et al. Structome analysis of Escherichia coli cells by serial ultrathin sectioning reveals the precise cell profiles and the ribosome density. Microscopy. 66 (4), 283-294 (2017).
- Yamaguchi, M., Ohkusu, M., Sameshima, M., Kawamoto, S. Safe specimen preparation for electron microscopy of pathogenic fungi by freeze-substitution after glutaraldehyde fixation. Japanese Journal of Medical Mycology. 46 (3), 187-192 (2005).
- Yamaguchi, M., et al. Improved preservation of fine structure of deep-sea microorganisms by freeze-substitution after glutaraldehyde fixation. Journal of Electron Microscopy. 60 (4), 283-287 (2011).
- Yamaguchi, M., et al. Prokaryote or eukaryote? A unique microorganism from the deep-sea. Journal of Electron Microscopy. 61 (6), 423-431 (2012).
- Yamada, H., Chikamatsu, K., Aono, A., Mitarai, S. Pre-fixation of virulent Mycobacterium tuberculosis with glutaraldehyde preserves exquisite ultrastructure on transmission electron microscopy through cryofixation and freeze-substitution with osmium-acetone at ultralow temperature. Journal of Microbiological Methods. 96, 50-55 (2014).
- Yamaguchi, M. An electron microscopic study of microorganisms: from influenza virus to deep-sea microorganisms. JSM Mycotoxins. 65 (2), 81-99 (2015).
- Yamaguchi, M., et al. High-voltage electron microscopy tomography and structome analysis of unique spiral bacteria from the deep sea. Microscopy. 65 (4), 363-369 (2016).
- Yamaguchi, M., Yamada, H., Uematsu, K., Horinouchi, Y., Chibana, H. Electron microscopy and structome analysis of unique amorphous bacteria from the deep sea. Cytologia. 83 (3), 337-342 (2018).
- Yamaguchi, M., Yamada, H., Chibana, H. Deep-sea bacteria harboring bacterial endosymbionts in a cytoplasm?: 3D electron microscopy by serial ultrathin sectioning of freeze-substituted specimen. Cytologia. 85 (3), 209-211 (2020).
- Yamaguchi, M., Takahashi-Nakaguchi, A., Aida, Y., Sato-Okamoto, M., Chibana, H. Convenient method for better preservation of fine structures of cultured macrophages and engulfed yeast cells by freeze-substitution fixation. Microscopy. 66 (3), 209-211 (2017).
- Aoki, S., et al. Shift in energy metabolism caused by glucocorticoids enhances the effect of cytotoxic anticancer drugs against acute lymphoblastic leukemia cells. Oncotarget. 8 (55), 94271-94285 (2017).
- Hirao, T., et al. Altered intracellular signaling by imatinib increases the anticancer effects of tyrosine kinase inhibitors in chronic myelogenous leukemia cells. Cancer Science. 109 (1), 121-131 (2018).
- Yamaguchi, M., et al. Sandwich freezing device for rapid freezing of viruses, bacteria, yeast, cultured cells, and animal and human tissues in electron microscopy. Microscopy. 70 (2), 215-223 (2021).
- Yamaguchi, M. Troubleshooting in specimen preparation of microorganisms. Kenbikyo. 42, 26-28 (2007).
- Yamaguchi, M., Aoyama, T., Yamada, N., Chibana, H. Quantitative measurement of hydrophilicity/hydrophobicity of the plasma-polymerized naphthalene film (Super support film) and other support films and grids in electron microscopy. Microscopy. 65 (55), 444-450 (2016).
- Yamaguchi, M., Chibana, H. A method for obtaining serial ultrathin sections of microorganisms in transmission electron microscopy. Journal of Visualized Experiments: JoVE. (131), e56235 (2018).
- Yamaguchi, M., Shimizu, M., Yamaguchi, T., Ohkusu, M., Kawamoto, S. Repeated use of uranyl acetate solution for section staining in transmission electron microscopy. Plant Morphology. 17 (1), 57-59 (2005).
- Yamaguchi, M., Tanaka, A., Suzuki, T. A support film of plasma-polymerized naphthalene for electron microscopy: method of preparation and application. Journal of Electron Microscopy. 41 (1), 7-13 (1992).
- Yamaguchi, M., et al. Cryo-electron microscopy of hepatitis B virus core particles produced by transformed yeast: comparison with negative staining and ultrathin sectioning. Journal of Electron Microscopy. 37 (6), 337-341 (1988).
- Yamaguchi, M., et al. Dynamics of hepatitis B virus core antigen in a transformed yeast cell: analysis with an inducible system. Journal of Electron Microscopy. 43 (6), 386-393 (1994).
- Yamaguchi, M., Miyatsu, T., Mizokami, H., Matsuoka, L., Takeo, K. Translocation of hepatitis B virus core particles through nuclear pores in transformed yeast cells. Journal of Electron Microscopy. 45 (4), 321-324 (1996).
- Sipiczki, M., Takeo, K., Yamaguchi, M., Yoshida, S., Miklos, I. Environmentally controlled dimorphic cycle in fission yeast. Microbiology. 144, 1319-1330 (1998).
- Sipiczki, M., et al. Role of cell shape in determination of the division plane in Schizosaccharomyces pombe: random orientation of septa in spherical cells. Journal of Bacteriology. 182 (6), 1693-1701 (2000).
- Encz, i. K., Yamaguchi, M., Sipiczki, M. Morphology transition genes in the dimorphic fission yeast Schizosaccharomyces japonicus. Antonie van Leeuwenhoek. 92 (2), 143-154 (2007).
- Kopecka, M., et al. Microtubules and actin cytoskeleton in Cryptococcus neoformans compared with ascomycetous budding and fission yeasts. European Journal of Cell Biology. 80 (4), 303-311 (2001).
- Yamaguchi, M., Biswas, S. K., Kita, S., Aikawa, E., Takeo, K. Electron microscopy of pathogenic yeasts Cryptococcus neoformans and Exophiala dermatitidis by high-pressure freezing. Journal of Electron Microscopy. 51 (1), 21-27 (2002).
- Ikeda, R., et al. Contribution of the mannan backbone of cryptococcal glucuroxylomannan and a glycolytic enzyme of Staphylococcus aureus to contact-mediated killing of Cryptococcus neoformans. Journal of Bacteriology. 189 (13), 4815-4826 (2007).
- Yamaguchi, M., et al. The spindle pole body of the pathogenic yeast Cryptococcus neoformans: variation in morphology and positional relationship to the nucleolus and the bud in interphase cells. Journal of Electron Microscopy. 59 (2), 165-172 (2010).
- Kozubowski, L., et al. Ordered kinetochore assembly in the human pathogenic basidiomycetous yeast Cryptococcus neoformans. MBio. 4 (5), 00614 (2013).
- Stepanova, A. A., Yamaguchi, M., Chibana, H., Vasilyeva, N. V. Ultrastructural aspects of cell components migration during budding in the yeast Cryptococcus leurentii. Problems in Medical Mycology. 18 (3), 24-29 (2016).
- Ohkusu, M., et al. Cellular and nuclear characteristics of Exophiala dermatitidis. Studies in Mycology. 43 (43), 143-150 (1999).
- Yamaguchi, M., Biswas, S. K., Suzuki, Y., Furukawa, H., Takeo, K. Three-dimensional reconstruction of a pathogenic yeast Exophiala dermatitidis cell by freeze-substitution and serial sectioning electron microscopy. FEMS Microbiology Letters. 219 (1), 17-21 (2003).
- Yamaguchi, M., et al. The spindle pole body of the pathogenic yeast Exophiala dermatitidis: variation in morphology and positional relationship to the nucleolus and the bud in interphase cells. European Journal of Cell Biology. 82 (10), 531-538 (2003).
- Biswas, S. K., Yamaguchi, M., Naoe, N., Takashima, T., Takeo, K. Quantitative three-dimensional structural analysis of Exophiala dermatitidis yeast cells by freeze-substitution and serial ultrathin sectioning. Journal of Electron Microscopy. 52 (2), 133-143 (2003).
- Takaya, N., et al. Cytochrome P450nor, a novel class of mitochondrial cytochrome P450 involved in nitrate respiration in the fungus Fusarium oxysporum. Archives of Biochemistry and Biophysics. 372 (2), 340-346 (1999).
- Zhou, Z., et al. Ammonia fermentation, a novel anoxic metabolism of nitrate by fungi. Journal of Biological Chemistry. 277 (3), 1892-1896 (2002).
- Takasaki, K., et al. Fungal ammonia fermentation, a novel metabolic mechanism that couples the dissimilatory and assimilatory pathways of both nitrate and ethanol. Role of acetyl CoA synthetase in anaerobic ATP synthesis. Journal of Biological Chemistry. 279 (13), 12414-12420 (2004).
- Kopecka, M., et al. Analysis of microtubules and F-actin structures in hyphae and conidia development in opportunistic human pathogenic black yeast Aureobasidium pullulans. Microbiology. 149, 865-876 (2003).
- Ueno, K., Namiki, Y., Mitani, H., Yamaguchi, M., Chibana, H. Differential cell wall remodeling of two chitin synthase deletants Δchs3A and Δchs3B in the pathogenic yeast Candida glabrata. FEMS Yeast Research. 11 (5), 398-407 (2011).
- Ikezaki, S., et al. Mild heat stress affects on the cell wall structure in Candida albicans biofilm. Medical Mycology Journal. 60 (2), 29-37 (2019).
- Gabriel, M., et al. The cytoskeleton in the unique cell reproduction by conidiogenesis of the long-neck yeast Fellomyces (Sterigmatomyces) fuzhouensis. Protoplasma. 229 (1), 33-44 (2006).
- Yoshimi, A., et al. Functional analysis of the α-1,3-glucan synthase genes agsA and agsB in Aspergillus nidulans: agsB is the major α-1,3-glucan synthase in this fungus. PLoS One. 8 (1), 54893 (2013).
- Yamada, H., Mitarai, S., Chikamatsu, K., Mizuno, K., Yamaguchi, M. Novel freeze-substitution electron microscopy provides new aspects of virulent Mycobacterium tuberculosis with visualization of the outer membrane and satisfying biosafety requirements. Journal of Microbiological Methods. 80 (1), 14-18 (2010).
- Yamada, H., Yamaguchi, M., Chikamatsu, K., Aono, A., Mitarai, S. Structome analysis of virulent Mycobacterium tuberculosis, which survives with only 700 ribosomes at density per 0.1 fl cytoplasm. PLoS One. 10 (1), 0117109 (2015).
- Shiratori, R., et al. Glycolytic suppression dramatically changes the intracellular metabolic profile of multiple cancer cell lines in a mitochondrial metabolism-dependent manner. Scientfic Reports. 9 (1), 18699 (2019).
- McDonald, K. L. Out with the old and in with the new: rapid specimen preparation procedures for electron microscopy of sectioned biological material. Protoplasma. 251 (2), 429-448 (2014).
- Small, J. V. Organization of actin in the leading edge of cultured cells: influence of osmium tetroxide and dehydration on the ultrastructure of actin meshworks. Journal of Cell Biology. 91 (3), 695-705 (1981).
- Ohno, S., Terada, N., Fujii, Y., Ueda, H., Takayama, I. Dynamic structure of glomerular capillary loop as revealed by an in vivo cryotechnique. Virchows Archiv. 427 (5), 519-527 (1996).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены