Method Article
Трехмерная биомиметическая модель нейробластомы in vitro с использованием скаффолдов на основе коллагена
* Эти авторы внесли равный вклад
В этой статье
Erratum Notice
Резюме
В этой статье перечислены шаги, необходимые для посева клеточных линий нейробластомы на ранее описанные трехмерные каркасы на основе коллагена, поддержания роста клеток в течение заранее определенного периода времени и извлечения каркасов для нескольких анализов роста и поведения клеток, а также последующих приложений, адаптируемых для удовлетворения ряда экспериментальных целей.
Аннотация
Нейробластома является наиболее распространенной экстракраниальной солидной опухолью у детей, на ее долю приходится 15% от общего числа смертей от рака у детей. Нативная опухолевая ткань представляет собой сложное трехмерное (3D) микроокружение, включающее слои раковых и доброкачественных клеток, окруженных внеклеточным матриксом (ВКМ). ECM обеспечивает физическую и биологическую поддержку и способствует прогрессированию заболевания, прогнозу пациента и терапевтическому ответу.
В данной работе описан протокол сборки 3D-системы на основе скаффолда для имитации микроокружения нейробластомы с использованием клеточных линий нейробластомы и скаффолдов на основе коллагена. Каркасы дополнены наногидроксиапатитом (нГА) или гликозаминогликанами (ГАГ), которые естественным образом обнаруживаются в высоких концентрациях в костях и костном мозге, наиболее распространенных метастатических участках нейробластомы. 3D-пористая структура этих каркасов обеспечивает прикрепление, пролиферацию и миграцию клеток нейробластомы, а также формирование клеточных кластеров. В этой 3D-матрице реакция клеток на терапию в большей степени отражает ситуацию in vivo .
Система культивирования на основе скаффолда может поддерживать более высокую плотность клеток, чем обычная двумерная (2D) клеточная культура. Таким образом, протоколы оптимизации для начальных номеров ячеек посева зависят от желаемых экспериментальных временных рамок. Модель контролируется путем оценки роста клеток с помощью количественного определения ДНК, жизнеспособности клеток с помощью метаболических анализов и распределения клеток в каркасах с помощью гистологического окрашивания.
Эта модель применяется для оценки профилей экспрессии генов и белков, а также для тестирования цитотоксичности с использованием обычных лекарств и микроРНК. Система 3D-культивирования позволяет точно манипулировать клеточными компонентами и компонентами ECM, создавая среду, более физиологически похожую на нативную опухолевую ткань. Таким образом, эта 3D-модель in vitro улучшит понимание патогенеза заболевания и улучшит корреляцию между результатами, полученными in vitro, in vivo на животных моделях и людях.
Введение
Нейробластома – это детский рак симпатической нервной системы, возникающий во время эмбрионального развития или ранней постнатальной жизни из-за трансформации клеток нервного гребня1. Это наиболее распространенная солидная экстракраниальная опухоль у детей, составляющая 8% злокачественных новообразований, диагностированных у пациентов в возрасте до 15 лет, и ответственная за 15% всех детских смертей от рака. Заболевание демонстрирует крайне неоднородное клиническое поведение из-за специфических хромосомных, генетических и эпигенетических изменений, а также гистопатологических особенностей.
Эти изменения способствуют агрессивности нейробластомы и неблагоприятным исходам у педиатрических пациентов. Таким образом, современные методы лечения оказываются неэффективными в долгосрочной перспективе почти для 80% пациентов с клинически агрессивнымзаболеванием, что подчеркивает тот факт, что лечение этой группы пациентов остается сложным. Вероятно, это связано с тем, что механизмы гетерогенности нейробластомы и метастазов до сих пор до конца не изучены. Тем не менее, в настоящее время широко распространено мнение, что микроокружение опухоли (TME) играет роль в прогрессировании многих видов рака; Тем не менее, он остается недостаточно изученным при нейробластоме 3,4.
Нативный TME представляет собой сложную 3D-микросреду, включающую раковые и доброкачественные клетки, окруженную ECM. ECM относится к бесклеточному компоненту ткани, который обеспечивает структурную и биохимическую поддержку своим клеточным резидентам и способствует прогрессированию заболевания, прогнозу пациента и терапевтическому ответу5. Это способствует прогрессированию заболевания из-за «динамической взаимности» или непрерывной двунаправленной коммуникации между клетками и ECM 6,7,8. По мере прогрессирования рака стромальный коллаген реорганизуется, часто в линейные паттерны, перпендикулярные границе раздела строма-рак, который раковые клетки используют в качестве миграционного пути к метастазированию 9,10,11.
Основными компонентами этого нативного функционального биологического каркаса являются волокнистая сеть коллагенов I и II типов и другие белки, включая эластин, гликопротеины, такие как ламинин, а также ряд протеогликанов и других растворимых компонентов12,13. Эти белки нативного ECM в настоящее время стали привлекательными природными биомолекулами для разработки 3D-моделей in vitro 3. Применение 3D-скаффолдов для культуры клеток in vitro становится все более популярным благодаря более глубокому физиологическому представлению TME по сравнению с традиционной 2D-монослойной культурой. Изготовленные 3D-каркасы способствуют прикреплению клеток, пролиферации, миграции, метаболизму и реакции на стимулы, наблюдаемые в биологических системах in vivo.
Основным компонентом этих 3D-каркасов является коллаген, который является ключевым игроком во многих нормальных биологических процессах, включая восстановление тканей, ангиогенез, морфогенез тканей, клеточную адгезиюи миграцию. 3D-матрицы на основе коллагена продемонстрировали свою надежную функциональность для моделирования ECM, выступая в качестве биомиметического микроокружения in vitro, обеспечивая при этом взаимодействие между клетками и ECM, а также миграцию и инвазию клеток. Эти 3D-матрицы также обеспечивают более точный анализ клеточного ответа на химиотерапевтические препараты, чем традиционная двумерная или «плоская» культура во многих моделях рака 14,15,16, включая нейробластому 17,18. Генетический анализ 3D-клеточных культур показал более высокую корреляцию с профилем тканей человека даже по сравнениюс животными моделями. В целом, краеугольным камнем этих 3D-скаффолдов является предоставление клеткам подходящей среды in vitro, которая повторяет нативную архитектуру тканей и способствует двунаправленным молекулярным перекрестным помехам8.
Для повышения сложности моделей на основе коллагена в процесс тканевой инженерии включаются другие распространенные компоненты ECM, что позволяет создавать более физиологически релевантные модели, отражающие нишевые TME различных тканей. Например, ГАГ, отрицательно заряженные полисахариды, присутствующие во всех тканях млекопитающих20, способствуют прикреплению, миграции, пролиферации и дифференцировке клеток. Хондроитин сульфат - это особый тип ГАГ, обнаруженный в костях и хрящах, который ранее использовался в тканевой инженерии для восстановления костей 21,22,23,24,25. Нано-гидроксиапатит (нГА) является основным неорганическим компонентом минерального состава костных тканей человека, составляя до 65% костной ткани по массе26 и поэтому широко используется для замещения и регенерации костной ткани27. Таким образом, ГАГ и нГА являются привлекательными композитами для реконструкции первичной нейробластомы ВКМ и моделирования наиболее распространенных метастатических участков нейробластомы, костного мозга (70,5%) и кости (55,7%)28.
Скаффолды, включающие эти компоненты ECM, были первоначально разработаны для применения в инженерии костной ткани с обширным анализом их биосовместимости, токсичности, а также остеокондуктивных и остеоиндуктивных свойств29,30. Они представляют собой пористые матрицы на основе коллагена, изготовленные с использованием методов сублимационной сушки для контроля их физических и биологических свойств. Коллагеновые каркасы, дополненные либо nHA (Coll-I-nHA), либо хондроитин-6-сульфатом (Coll-I-GAG), продемонстрировали успех в имитации первичного TME при раке молочной железы31 и метастазировании в кости при раке предстательной железы15, а также нейробластоме17. Технология сублимационной сушки, используемая для изготовления этих композитных каркасов, обеспечивает воспроизводимую однородность по размеру пор и пористости в пределах каркасов22,23,24. Вкратце, коллагеновая суспензия (0,5 мас.%) производится путем смешивания фибриллярного коллагена с 0,05 М уксусной кислотой. Для Coll-I-GAG 0,05 мас.% хрондоитин-6-сульфата, выделенного из акульего хряща, добавляют в коллагеновую суспензию при смешивании. Для композитных скаффолдов Coll-I-nHA наноразмерные частицы гидроксиапатита синтезируют, как описано ранее27, и добавляют в коллагеновую суспензию в соотношении 2:1 к весу коллагена в процессе смешивания. Все скаффолды физически сшиваются и стерилизуются с помощью дегидротермической обработки при 105 °C в течение 24 ч25. Цилиндрические скаффолды (диаметр 6 мм, высота 4 мм) получают с помощью биопсийного пуансона и могут быть химически сшиты 3 мМ N-(3-диметиламинопропил)-N'-этилкарбодиимида гидрохлорида и 5,5 мМ N-гидроксизукцинимида (EDAC/NHS) в дистиллированной воде (dH2O) для улучшения механических свойств конструкций30. Этот хорошо оптимизированный производственный процесс из двух коллагеновых каркасов создает каркасы с воспроизводимыми механическими свойствами, включая размер пор, пористость и жесткость (кПа). Скаффолды Coll-I-GAG и Coll-I-nHA имеют различные физические свойства, создавая различные условия окружающей среды. Свойства каждого каркаса приведены в таблице 1.
| Колл-и-ГЭГ | Колл-и-нХА | |
| Размер лесов (диаметр [мм] x высота [мм]) | 6 х 4 17 | 6 х 4 17 |
| Концентрация коллагена (мас. %) | 0,5 17 | 0,5 17 |
| Концентрация субстрата (мас. %) [на основе веса коллагена] | 0,05 15,17 | 200 17 |
| Средний размер пор (мм) | 96 22 | 96 – 120 29 |
| Пористость (%) | 99,5 23 См. | 98,9 – 99,4 27 |
| Жесткость (кПа) | 1,5 27 | 5,5 - 8,63 29 |
Таблица 1: Обзор механических свойств двух скаффолдов, принятых для изучения биологии нейробластомы.
В данной работе описан протокол сборки 3D-системы на основе скаффолда для лучшей имитации микроокружения нейробластомы с использованием клеточных линий нейробластомы и ранее описанных скаффолдов на основе коллагена, дополненных либо nHA (Coll-I-nHA), либо хондроитин-6-сульфатом (Coll-I-GAG). Протокол включает в себя последующие методы для анализа механизмов роста клеток нейробластомы в более физиологически релевантной среде с использованием ранее оптимизированных недорогих методов, адаптированных из 2D монослойной культуры Рисунок 1.
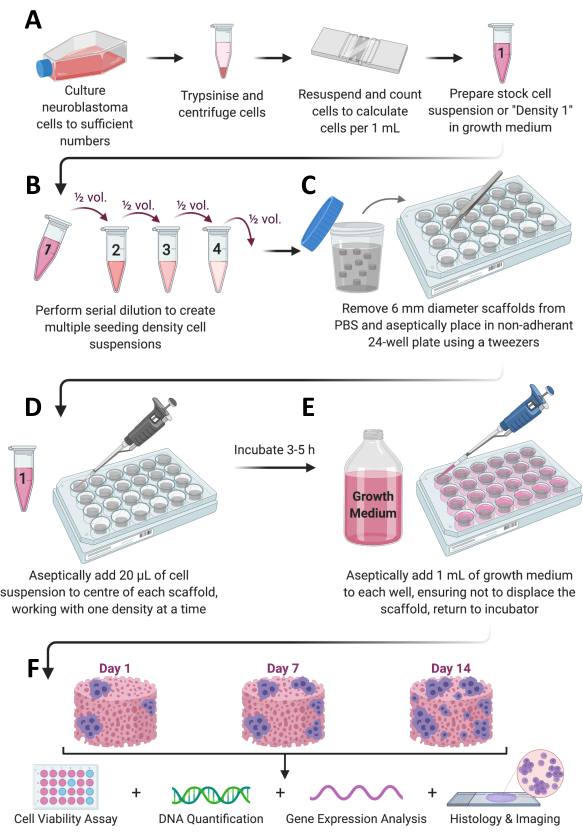
Рисунок 1: Общий рабочий процесс протокола. (А) Клетки выращивают до достаточного количества, расщепляют, подсчитывают и ресуспендируют в соответствующем объеме среды. (Б) Затем этот клеточный запас подвергают последовательному разведению для получения в общей сложности 4 клеточных суспензий различной плотности. (C) Каркасы на основе коллагена стерильно помещают в неадгезивные 24-луночные планшеты, и (D) 20 мкл клеточной суспензии добавляют в центр каждого каркаса и оставляют инкубироваться при 37 °C, 5%CO2 и влажности 95% в течение 3-5 ч. (E) Затем полная питательная среда (1 мл) медленно добавляется к каждому каркасу, и планшеты помещаются обратно в инкубатор, чтобы обеспечить рост клеток в течение желаемого периода времени. (F) В каждый заранее определенный момент времени извлекается несколько скаффолдов для оценки жизнеспособности и роста клеток, анализа экспрессии генов и гистологического окрашивания. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
протокол
1. Экспериментальный дизайн
ПРИМЕЧАНИЕ: Количество скаффолдов и ячеек, необходимых для каждого эксперимента, будет зависеть от масштаба эксперимента и может быть рассчитано с помощью инструментов, описанных в этом разделе по планированию эксперимента.
- Необходимое количество строительных лесов
- Определите общую временную шкалу экспериментов и интервалы оценки изменений в клеточной биологии (например, клеточного роста и метаболизма).
ПРИМЕЧАНИЕ: Например, экспериментальный период составляет 14 дней, с оценкой роста клеток каждые 7 дней. Таким образом, экспериментальными временными точками являются Дни 1, 7, 14, что дает в общей сложности 3 временные точки. - Затем определите количество экспериментальных приложений, которые будут применяться в каждый момент времени. Старайтесь выполнять одни и те же анализы в каждый момент времени, чтобы отслеживать изменения.
ПРИМЕЧАНИЕ: Типичный анализ роста клеток на скаффолдах включает анализ жизнеспособности клеток, количественное определение ДНК, гистологическое окрашивание и визуализацию, а также анализ экспрессии генов. Более подробно они будут рассмотрены в разделе 5. - Решите, когда использовать один и тот же каркас для нескольких последующих применений, например, после оценки жизнеспособности клетки с помощью соответствующего анализа, повторно использовать каркас для выделения ДНК/РНК (обсуждается в 5.1.11).
- Храните как минимум 3 биологических репликата для каждого применения, например, 3 скаффолда для жизнеспособности клеток и количественного определения ДНК, 3 для гистологии и 3 для анализа экспрессии генов. Так как это соответствует 9 шаблонам на момент времени, запланируйте использовать 27 скаффолдов для 3 временных точек.
- Наконец, умножьте это число на количество экспериментальных параметров или условий (например, оценка нескольких клеточных линий, начальной плотности посева, состава каркаса).
ПРИМЕЧАНИЕ: В этом протоколе оценивались 4 различные начальные плотности посева для одной клеточной линии, в результате чего требовалось 108 (27 скаффолдов х 4 условия) скаффолдов. Чтобы учесть человеческий фактор и обеспечить дополнительное покрытие, прибавьте к этому числу ~10%, например, если требуется 108 лесов, подготовьте 120 лесов.
- Определите общую временную шкалу экспериментов и интервалы оценки изменений в клеточной биологии (например, клеточного роста и метаболизма).
- Необходимое количество ячеек
ПРИМЕЧАНИЕ: Для посева клеток на цилиндрический каркас (диаметр 6 мм, высота 4 мм) на день 0 рекомендуется использовать объем клеточной суспензии объемом 20 мкл. Количество клеток на эти 20 мкл клеточной суспензии корректируется в соответствии с планом эксперимента, рассчитанным в разделе 1.1. Общая начальная плотность посева составляет 2 × 10,5 клеток на 20 мкл, что используется в качестве примера для приведенного ниже протокола.- Чтобы рассчитать общее количество клеток, необходимых для эксперимента, умножьте исходные 2 ×10,5 клеток на 20 мкл на количество необходимых скаффолдов.
ПРИМЕЧАНИЕ: Например, 30 скаффолдов, умноженные на 20 мкл, дают общий объем 600 мкл. Если для каждого каркаса требуется 2 × 10 5 ячеек, то 600 мкл суспензии содержат в общей сложности 6 × 10 6 ячеек (2 × 105 × 30), что дает конечную потребность в 6 × 106 ячеек в 600 мкл. Количество экспериментальных параметров будет диктовать общее количество необходимых ячеек. Таким образом, этот протокол описывает клеточную культуру с использованием многослойной колбы для клеточной культуры, которая может обрабатывать то же количество клеток, что и 10 традиционных колб размером 175см2.
- Чтобы рассчитать общее количество клеток, необходимых для эксперимента, умножьте исходные 2 ×10,5 клеток на 20 мкл на количество необходимых скаффолдов.
2. Приготовление каркасов на основе коллагена
ПРИМЕЧАНИЕ: Цилиндрические скаффолды Coll-I-nHA и Coll-I-GAG (диаметр 6 мм, высота 4 мм) изготавливаются по установленным методам 15,21,27. После химического сшивания в соответствии с ранее опубликованными методами17 скаффолды должны быть использованы в течение 1 недели.
- После изготовления лесов с требуемыми механическими свойствами убедитесь, что они полностью гидратированы и тщательно промыты в фосфатно-солевом буфере (PBS).
ПРИМЕЧАНИЕ: Обычно это занимает ~12 ч после сшивания скаффолдов и может быть выполнено в контейнерах для отходов тканевой культуры объемом 100 мл при 4 °C, с максимальным количеством 50 скаффолдов на контейнер и 2 мл PBS на каркас. - Храните каркасы в PBS при температуре 4 °C до использования.
3. Размножение клеток нейробластомы в многослойной колбе для клеточных культур
ПРИМЕЧАНИЕ: Оптимальная плотность посева для многослойной колбы может варьироваться. Для колбы, используемой в этом эксперименте, оптимальная плотность в соответствии с инструкциями производителя составляет 1 × 107 ячеек. Перед посевом многослойной колбы размножить клетки до плотности 1 × 107 клеток или выше в подходящей колбе для тканевой культуры (например, колбе для тканевой культуры T175см2 ). Чтобы засеять клетки в многослойную колбу (раздел 3.1), вырастить их до слияния 70-80%, собрать и подсчитать количество клеток на мл, обращаясь к шагам 3.2.16-3.2.20 для выполнения подсчета клеток. После того, как клеточная суспензия будет подсчитана, приступают непосредственно к посеву многослойной колбы. Работы с клеточными культурами необходимо проводить в ламинарном колпаке для поддержания стерильности.
- Посев многослойной колбы для клеточных культур
- Разогрейте 550 мл полной питательной среды (зависит от используемой клеточной линии) и 100 мл стерильного PBS на водяной бане с температурой 37 °C в течение 20 минут.
- Используя собранную клеточную суспензию, рассчитайте необходимый объем клеточной суспензии, необходимый для достижения оптимальной плотности посева 1 × 107 клеток, используя уравнение (1), где WANT относится к количеству клеток, необходимых для посева многослойной колбы, а HAVE относится к количеству клеток/мл в клеточной суспензии:
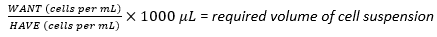 (1)
(1)
например.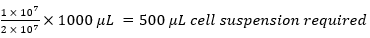
- Добавьте необходимый объем клеточной суспензии к 100 мл предварительно подогретой питательной среды.
- Возьмите новую многослойную колбу в колпачок, снимите крышку и держите колбу под углом 60°. Медленно пипеткой влейте все 100 мл клеточной суспензии в колбу вниз по скошенной стороне горлышка. Закройте колбу крышкой и положите ее на бок, чтобы ячейки равномерно распределились по слоям.
- Под углом 60° добавьте 400 мл предварительно подогретой питательной среды в многослойную колбу, медленно вливая или пипетируя вниз по наклонной стороне горлышка. Если горлышко заполнится, верните колбу в вертикальное положение или закройте колбу крышкой и положите ее на бок, прежде чем вернуться к заливке.
ПРИМЕЧАНИЕ: Наливайте медленно, чтобы избежать чрезмерного образования пузырьков. Осторожно постучите по колбе в вертикальном положении, чтобы все пузырьки поднялись наверх, и удалите их пипеткой объемом 10 мл. Убедитесь, что колба заполнена до нижней нити горлышка; Для этого добавьте еще медиума, если это необходимо. - Закройте многослойную колбу крышкой и инкубируйте ее с наклонным горлышком вниз при температуре 37 °C, 5%CO2 и влажности 95%.
- Проверяйте рост каждые 2-3 дня на предмет слияния. Чтобы проверить слияние двух нижних слоев многослойной колбы, рассмотрите их под 4-кратным объективом инвертированного микроскопа.
ПРИМЕЧАНИЕ: При посеве 1 × 107 клеток нейробластомы 10-слойной колбе обычно требуется одна неделя, чтобы слиться, хотя это может варьироваться в зависимости от используемой клеточной линии.
- Регламентное обслуживание ячеек в многослойной колбе
- Разогрейте 550 мл полной питательной среды (варьируется в зависимости от используемой клеточной линии), 50-100 мл трипсина и 300 мл стерильного PBS на водяной бане с температурой 37 °C в течение 20 минут.
- Проверьте многослойную колбу на 70-80% слияние.
- Поместите многослойную колбу в ламинарный колпак и выбросьте отработанную среду из колбы путем заливки. Первоначально наклоните колбу так, чтобы среда выливалась через воздушную заслонку в контейнер для отходов. Во время заливки поворачивайте колбу на 180° до тех пор, пока среда не будет стекать по наклонному горлышку колбы. Вращайте колбу вперед и назад вдоль этой оси, чтобы удалить оставшуюся жидкость.
- Промойте клетки, медленно добавляя 100 мл предварительно подогретого стерильного PBS вниз по наклонному горлышку. Закройте колбу крышкой, положите ее на бок, чтобы обеспечить равномерное распределение PBS, и поворачивайте колбу вперед и назад, чтобы промыть клетки.
- Утилизируйте промывку PBS таким же образом, как и в пункте 3.2.3. Повторите этапы стирки.
- Разведите 50 мл предварительно подогретого трипсина в 50 мл предварительно подогретого стерильного PBS. Добавьте 100 мл разбавленного раствора трипсина в многослойную колбу, крышку и положите колбу на бок, чтобы обеспечить равномерное распределение трипсина. Если клеточная линия обладает высокой адгезией, используйте 100 мл неразбавленного трипсина.
- Инкубируют колбу в течение 2-5 мин при температуре 37 °C, 5%CO2 и влажности 95%, контролируя отслоение клеток под микроскопом. При необходимости сильно постучите по колбе, чтобы облегчить отсоединение, или поместите ее обратно в инкубатор еще на одну минуту.
- Поместите многослойную колбу в ламинарный колпак и нейтрализуйте трипсин 100 мл питательной среды. Закройте колбу, положите ее на бок и покачайте вперед и назад, чтобы обеспечить полную нейтрализацию.
- Вылейте нейтрализованную клеточную суспензию в 4 конические центрифужные пробирки по 50 мл.
ПРИМЕЧАНИЕ: Если требуется полный сбор клеток, снова промойте многослойную колбу 100 мл стерильного PBS и перелейте ее в 2 центрифужные пробирки по 50 мл. - Центрифужируют клеточную суспензию в центрифужных пробирках объемом 50 мл при 340 × г в течение 3-4 мин до гранулирования клеток.
- Верните центрифужные пробирки в ламинарный колпак и осторожно удалите как можно больше надосадочной жидкости из каждой гранулы.
ПРИМЕЧАНИЕ: Гранула будет большой и относительно рыхлой, и, следовательно, ее можно легко сломать. - Добавьте 1-5 мл питательной среды к каждой грануле и ресуспендируйте ее, несколько раз пипетируя вверх и вниз.
- Смешайте 4 ресуспендированные гранулы в одной центрифужной пробирке объемом 50 мл, тщательно перемешайте их пипеткой и запишите общий объем.
- Сделайте соответствующее разведение клеточной суспензии для подсчета клеток так, чтобы каждый внешний квадрат на гемоцитометре содержал 30-100 клеток.
ПРИМЕЧАНИЕ: Подходящее начальное разбавление составляет 1:100; для этого пипетку 10 мкл клеточной суспензии помещают в свежую коническую центрифужную пробирку объемом 15 мл и разбавляют ее 990 мкл стерильного PBS. Пипеткой проведите смесь вверх и вниз несколько раз, чтобы тщательно перемешать. - Поместите центрифужную пробирку объемом 50 мл, содержащую запас клеток, в инкубатор во время подсчета.
- Взяв чистый гемоцитометр, положите на сетку чистый покровный листок, как показано на рисунке 2.
- Пипетку 10 мкл разведенной клеточной суспензии в камеру гемоцитометра. Если камера заполнится до того, как будут выданы все 10 мкл, прекратите пипетирование.
- Поместите гемоцитометр под 4-кратный объектив светового микроскопа. Отрегулируйте грубый и точный фокус, чтобы визуализировать ячейки.
- Подсчитайте количество ячеек в четырех внешних угловых квадратах камеры, как показано на рисунке 2. Сложите четыре числа и разделите на 4, чтобы вычислить среднее количество клеток на квадрат.
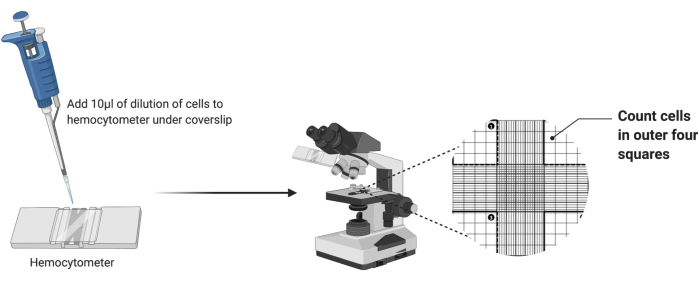
Рисунок 2: Подсчет клеток с помощью гемоцитометра. Десять микролитров клеточной суспензии добавляют в гемоцитометр под покровным стеклом. Затем камера помещается под 4-кратный объектив микроскопа, и подсчитывается количество ячеек в четырех внешних углах сетки. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
- Умножьте среднее количество на коэффициент разведения (например, 100) и умножьте это число на 10 000, чтобы получить количество клеток на мл с помощью уравнения (2).
 (2) См.
(2) См. - Рассчитайте общее количество клеток в исходном растворе, умножив его на общий объем запаса клеток (например, если 4 ресуспендированные гранулы вместе составили 20 мл раствора, умножьте количество клеток/мл на 20).
- Для поддержания многослойной колбы используйте уравнение (1), описанное на шаге 3.1.2, для расчета объема запаса клеток, необходимого для посева 1 × 107 клеток обратно в колбу, и выполните шаги 3.1.3-3.1.6 для повторного посева колбы. Если вы готовы засеять леса, переходите к следующему разделу.
4. Посев клеток нейробластомы на скаффолды
- Приготовьте суспензию ячеистой суспензии
ПРИМЕЧАНИЕ: В этом протоколе будут описаны шаги по созданию четырех различных плотностей посева клеток нейробластомы с коэффициентом умножения 2 между каждой плотностью. Таким образом, серийное разведение будет использоваться для создания еще трех клеточных суспензий из исходной суспензии. Работы с клеточными культурами необходимо проводить в ламинарном колпаке для поддержания стерильности.- Используйте уравнение (3) для вычисления объема клеток, необходимого из общего числа ячеек в многослойной колбе (подсчитанных в разделе 3.2.19) для приготовления первой плотности посева или суспензии клеточного запаса.
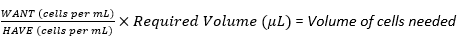 (3) См.
(3) См.
ПРИМЕЧАНИЕ: Например, если максимальная плотность посева составляет 6 × 10 5 ячеек на каркас, необходимых для 30 каркасов, при этом каждый каркас получает 20 мкл суспензии ячеек, то для суспензии ячеек стока потребуется 1,8 × 107 ячеек (6 × 105 ячеек × 30 каркасов) общим объемом 600 мкл (20 мкл × 30 каркасов).
По мере того, как будет производиться серийное разведение из этого препарата, эти цифры должны быть удвоены, т.е. 3,6 × 107 клеток в общем объеме 1200 мкл. Чтобы преобразовать это значение в WANT в клетках на мл; делим 3,6 ×10 7 на 1200 мкл и умножаем на 1000 мкл, давая 3 × 107 клеток на мл.

- Добавьте необходимый объем клеточного материала в стерильную центрифужную пробирку объемом 2 мл или 15 мл и доведите до конечного объема 1200 мкл с питательной средой. Обозначьте эту трубку как Плотность 1 (Плотность 1) (Рисунок 3).
- Используйте уравнение (3) для вычисления объема клеток, необходимого из общего числа ячеек в многослойной колбе (подсчитанных в разделе 3.2.19) для приготовления первой плотности посева или суспензии клеточного запаса.
- Выполняйте серийное разбавление для создания суспензий ячеек с множественной плотностью засева.
- Из плотности 1, приготовленной на шаге 4.1.1, приготовьте еще три плотности клеточной суспензии путем последовательного разведения, как показано на рисунке 3.
- Разбавьте каждую плотность в 2 раза в питательной среде. Сначала добавьте необходимый конечный объем (600 мкл из предыдущего примера) питательной среды в три стерильные центрифужные пробирки объемом 2 мл или 15 мл.
- Перелейте половину плотности 1 (600 мкл) в одну из пробирок, тщательно перемешав клеточную суспензию со средой для разбавления. Обозначьте эту трубку как Плотность 2.
- Перелейте половину плотности 2 (600 мкл) в следующую пробирку, тщательно перемешав клеточную суспензию со средой для разбавления. Обозначьте эту трубку как Density 3 (Плотность 3).
- Перелейте половину плотности 3 (600 мкл) в следующую пробирку, тщательно перемешав клеточную суспензию со средой для разбавления. Обозначьте эту трубку как Density 4 (Плотность 4).
- Выбросьте 600 мкл из плотности 4 так, чтобы все четыре препарата имели окончательный объем 600 мкл.
- В качестве отрицательного контроля добавляют 600 мкл питательной среды только в стерильную центрифужную пробирку объемом 2 мл. На рисунке 3 приведена схема процесса последовательного разбавления.
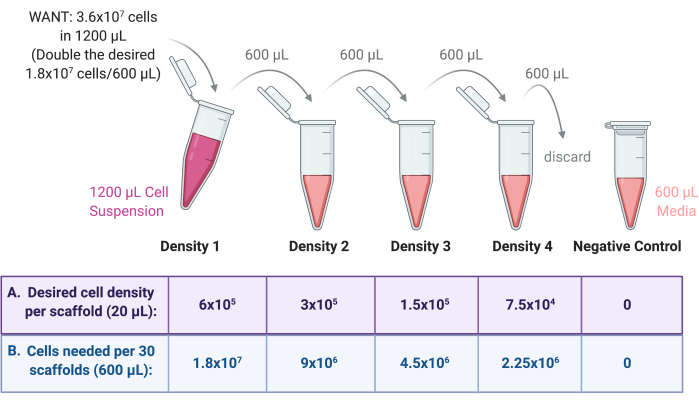
Рисунок 3: Серийное разведение клеточного материала для приготовления 4 суспензий для 4 различных плотностей посева строительных лесов. (A) Цифры могут быть скорректированы в соответствии с желаемой плотностью посева на каркас и (B) умножены на общее количество скаффолдов на плотность, при этом каждый каркас получает 20 мкл клеточной суспензии. В этом примере для плотности 1 требуется 6 × 105 ячеек на каркас, что эквивалентно 1,8 × 107 ячеек в 600 мкл для 30 каркасов. Это число удваивается, чтобы начать серийное разведение, так как затем 600 мкл переносится и разводится в 600 мкл питательной среды в следующей пробирке. Этот процесс продолжается до тех пор, пока не останется 4 клеточных суспензии с коэффициентом 2 между каждой. Отрицательный контроль производится путем добавления в пробирку только 600 мкл среды. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
- Добавление клеточных суспензий в строительные леса
ПРИМЕЧАНИЕ: Извлеките каркасы (хранящиеся в PBS) из холодильника и дайте им нагреться до комнатной температуры (RT), прежде чем добавлять ячейки.- Поместите строительные леса из PBS в зонт ламинарного потока.
- Используя стерильный пинцет, поместите каркасы в неприклеивающиеся 24-луночные планшеты по одному каркасу на лунку (Рисунок 1C). Осторожно приподнимите леса за углы и слегка прижмите их к стенке контейнера, чтобы удалить излишки PBS. Добавьте строительные леса в центр лунок кожей вниз (блестящий слой леса, обращенный вниз к пластиковым 24-луночным пластинам).
- Маркируйте 24-луночные планшеты с подробными сведениями о клеточной линии, соответствующих параметрах (например, плотности посева) и временных точках. Работайте с одной плотностью посева клеток за раз, сохраняя оставшуюся плотность в инкубаторе с температурой 37 °C до тех пор, пока она не будет готова к использованию.
- В ламинарном проточном колпаке с помощью пипетки P20 и стерильных наконечников осторожно добавьте 20 мкл соответствующей клеточной суспензии в центр каждого каркаса (рис. 1D). Тщательно храните клетки во взвешенном состоянии, хорошо перемешивая, добавляя клетки в каркасы. Следите за тем, чтобы подвеска оставалась на верхней части лесов и не соскальзывала на основание колодца, так как это не позволит прикрепить ячейку к лесам.
- После добавления клеток инкубируйте планшеты в течение 3-5 ч (37 °C, 5%CO2 и влажность 95%), чтобы большая часть клеток прикрепилась.
- После инкубации медленно и осторожно добавьте в каждую лунку по 1 мл предварительно подогретой питательной среды (рис. 1E). Используйте пипетку P1000 для добавления среды, чтобы обеспечить более медленное и контролируемое движение, предотвращая смещение каркасов. При работе с очень большим количеством каркасов используйте пипетку объемом 10 мл с пистолетом для пипетки, установленным на «падение» и «низкое значение».
- Инкубируйте 24-луночные планшеты в течение ночи (37 °C, 5%CO2 и 95% влажности).
- Обслуживание ячеек на строительных лесах
- После первых 24 ч прикрепления клеток (1-й день) переложите засеянные каркасы на новые неприлипшие 24-луночные планшеты и добавьте 1-2 мл свежей питательной среды.
ПРИМЕЧАНИЕ: На этом этапе удаляются клетки, упавшие на дно пластиковых 24-луночных пластин, вместо того, чтобы позволить им расти на каркасах. Реплики лесов, обозначенные как День 1, будут демонтированы через 24 часа, как описано в разделе 5; Следовательно, техническое обслуживание не распространяется на эти леса. - Контролируйте каркасы первоначально каждые 2-3 дня на предмет изменения цвета питательной среды. По мере того, как проходит время и клетки размножаются внутри каркасов, кормите клетки чаще.
- С помощью пистолета для пипетки объемом 10 мл в медленном режиме удалите 1 мл отработанной среды и выбросьте. При проведении экспериментов, требующих кондиционированной среды, отработанную среду биологических репликатов собирают в центрифужную пробирку объемом 15 мл, центрифугируют при 340 × г в течение 2 мин, чтобы гранулировать клеточный мусор, перелейте надосадочную жидкость в свежую пробирку и храните при -80 °C.
- Осторожно добавьте 2 мл предварительно подогретой питательной среды в каркасы, снова используя функцию капельного орошения на пипетке, и верните 24-луночный планшет в инкубатор (37 °C, 5%CO2 и влажность 95%). Повторяйте каждый раз, когда среда расходуется в течение желаемого периода роста.
- После первых 24 ч прикрепления клеток (1-й день) переложите засеянные каркасы на новые неприлипшие 24-луночные планшеты и добавьте 1-2 мл свежей питательной среды.
5. Извлечение лесов и их применение
ПРИМЕЧАНИЕ: В каждый момент времени можно использовать несколько приложений для мониторинга роста клеток на каркасах или оценки профилей экспрессии генов и белков. Условия извлечения скаффолда будут зависеть от выполняемого анализа, при этом несколько методов извлечения описаны в следующих подразделах и продемонстрированы на рисунке 4.
- Оценка жизнеспособности клеток в каркасах
- Стерилизуйте соответствующий реагент для анализа жизнеспособности клеток, отфильтровав его через стерильный фильтр 0,2 мкм в центрифужную пробирку в ламинарном колпаке. Предварительно подогрейте этот стерильный раствор вместе с полной питательной средой и стерильным PBS на водяной бане с температурой 37 °C.
- В ламинарном вытяжном шкафу используйте стерильный пинцет, чтобы перенести каркасы, подлежащие анализу, на свежую 24-луночную пластину. Подпишите табличку со всеми соответствующими деталями.
ПРИМЕЧАНИЕ: Выполняйте анализ в трех экземплярах. - Добавьте в каждую лунку 900 мкл предварительно нагретой питательной среды, а затем 100 мкл реагента для обеспечения жизнеспособности стерильных клеток. Включите отрицательный контроль, добавив 900 мкл среды и 100 мкл реагента для определения жизнеспособности стерильных клеток в лунку без каркаса. Установите крышку на планшет и осторожно покачайте планшет в течение ~3 минут, чтобы равномерно распределить разбавленный реагент жизнеспособности клеток по всей лунке. Инкубируйте планшет при температуре 37 °C, 5%CO2 и влажности 95%.
ПРИМЕЧАНИЕ: Время инкубации должно быть оптимизировано для каждой клеточной линии; Обратитесь к рекомендациям производителя. Для клеточных линий нейробластомы оптимальным представляется 4-6-часовая инкубация. - После инкубации достаньте тарелку из инкубатора и аккуратно покачайте ее в течение нескольких секунд.
- В ламинарном колпаке откройте новую полупрозрачную 96-луночную пластину. Из каждой лунки в 24-луночном планшете переносят инкубированную среду и реагент в три лунки 96-луночной планшетной пластины по 100 мкл на лунку, получая технические тройки.
ПРИМЕЧАНИЕ: Этот перенос оставит 700 мкл в лунках 24-луночного планшета. - Накройте 96-луночную пластину алюминиевой фольгой, чтобы защитить реагент жизнеспособности клеток от света.
- Удалите и выбросьте оставшиеся 700 мкл содержимого лунки из каждого каркаса в 24-луночном планшете. Вымойте каждый каркас дважды 1 мл стерильного PBS.
ПРИМЕЧАНИЕ: Все цвета не будут удалены со строительных лесов. Затем эти скаффолды можно использовать для дальнейших применений, например, для количественного определения ДНК, поместив их в 1 мл 1% Triton X-100 в 0,1 М растворе бикарбоната натрия (NaHCO3) и храня при -80 °C (см. раздел 5.2, рис. 4B). - Извлеките 96-луночный планшет из ламинарного колпака и измерьте поглощение каждой лунки на длинах волн 570 нм и 600 нм с помощью микропланшетного считывателя. Запишите значения поглощения на обеих длинах волн и следуйте инструкциям производителя, чтобы рассчитать процентное снижение жизнеспособности реагента клеток клетками.
- Стройте графики и статистически анализируйте результаты жизнеспособности клеток с помощью соответствующего программного обеспечения. Введите значения биологических трипликатов, чтобы получить полосы погрешности и указать вариабельность анализа.
- Чтобы изучить изменения жизнеспособности клеток в течение экспериментального периода, выполните тест одностороннего дисперсионного анализа (ANOVA) с многократным сравнением средних значений с использованием соответствующего биостатистического программного обеспечения.
- Укажите существенные различия между временными точками на графиках как ns (P>0,05), * (P≤0,05), ** (P≤0,01), *** (P≤0,001) и **** (P≤0,0001).
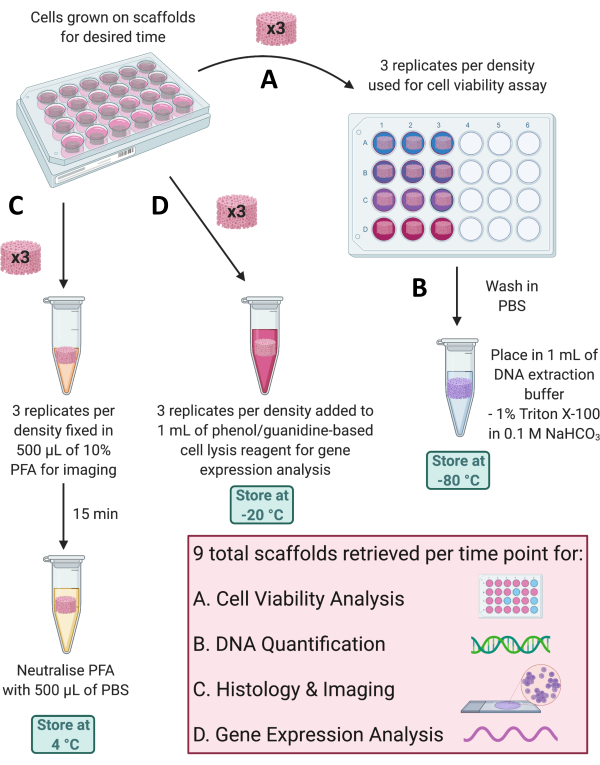
Рисунок 4: Извлечение скаффолдов для различных анализов в каждый момент времени. (A) Для анализа жизнеспособности клеток извлекаются три репликата каркаса. (B) Затем эти скаффолды могут быть промыты в PBS, помещены в 1% Triton X-100 в 0,1 М NaHCO3 и хранятся при -80 °C для количественного определения ДНК. (C) Еще три репликата фиксируют в 10% PFA в течение 15 мин, нейтрализуют в PBS и хранят при 4 °C для гистологического окрашивания и визуализации. (D) Наконец, 3 репликата добавляют к реагенту для лизиса клеток на основе фенола/гуанидина и хранят при -20 °C для анализа экспрессии генов. Сокращения: PBS = фосфатно-солевой буфер; PFA = параформальдегид. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
- Количественное определение ДНК из клеток в скаффолдах
ПРИМЕЧАНИЕ: Как упоминалось в примечании после шага 5.1.7, извлечение скаффолдов для количественного определения ДНК включает помещение каркасов в центрифужные пробирки объемом 2 мл, содержащие 1 мл 1% Triton X-100 в 0,1 м растворе NaHCO3 с последующим хранением при -80 °C. Прежде чем можно будет выполнить анализ ДНК, клетки должны пройти три цикла замораживания-оттаивания, чтобы соответствующим образом лизировать клетки нейробластомы и высвободить ДНК для количественного определения.- Удалите образцы, ранее хранившиеся в Triton X-100, при температуре -80 °C. Оставьте образцы при RT на 1-3 ч или до оттаивания.
- Вихрите образцы в течение 10-20 секунд и поместите образцы обратно при -80 °C на 18-24 ч или до полного замерзания. Повторите этот процесс в общей сложности для трех циклов замораживания-оттаивания.
- Чтобы максимизировать выход ДНК, используйте тканевый лизер для разрушения клеток в каркасах.
- Поместите металлический шарик в центрифужную пробирку объемом 2 мл, содержащую каркас в Triton X-100, и поместите пробирку в адаптер, чтобы встряхнуть образец со скоростью 50 колебаний в секунду в течение 2-3 минут.
ПРИМЕЧАНИЕ: Используйте центрифужные пробирки с круглым дном, так как металлический валик может застрять в пробирке с коническим дном.
- Поместите металлический шарик в центрифужную пробирку объемом 2 мл, содержащую каркас в Triton X-100, и поместите пробирку в адаптер, чтобы встряхнуть образец со скоростью 50 колебаний в секунду в течение 2-3 минут.
- Количественно определите ДНК в растворе Triton X-100 путем нанесения флуоресцентного двухцепочечного красителя ДНК (дцДНК) и измерьте излучение с помощью микропланшетного считывателя. Ознакомьтесь с рекомендациями производителя; соответствующим образом разбавить образцы в буфере трис-этилендиаминтетрауксусной кислоты (ТЭ) для получения 8 стандартов дцДНК путем последовательного разведения в буфере ТЭ (рисунок 5).
- В черных непрозрачных 96-луночных планшетах добавляют по 100 мкл каждого стандарта или образца в лунки в техническом трипликате.
- Разбавьте флуоресцентный краситель дцДНК в 200 раз в TE-буфере и добавьте 100 мкл к каждому стандарту/образцу с помощью многоканальной пипетки. Накройте тарелку фольгой и инкубируйте при RT в течение 5 минут.
- Измерьте и запишите флуоресценцию каждой лунки с длиной волны 520 нм. Следуйте рекомендациям производителя, чтобы рассчитать концентрацию ДНК в каждом образце.
ПРИМЕЧАНИЕ: Если известна средняя концентрация ДНК на клетку для используемой клеточной линии, значения концентрации ДНК могут быть преобразованы в номера клеток с помощью уравнения (4). (4) См.
(4) См. - Построение графиков и статистический анализ результатов количественной оценки ДНК с помощью соответствующего программного обеспечения. Введите значения биологических трипликатов, чтобы получить полосы погрешности и указать вариабельность анализа.
- Чтобы изучить изменения концентрации ДНК/количества клеток в течение экспериментального периода времени, выполните односторонний тест ANOVA с многократным сравнением средних значений с использованием соответствующего биостатистического программного обеспечения.
- Укажите существенные различия между временными точками на графиках как ns (P>0.05), * (P≤0.05), ** (P≤0.01), *** (P≤0.001) и **** (P≤0.0001).
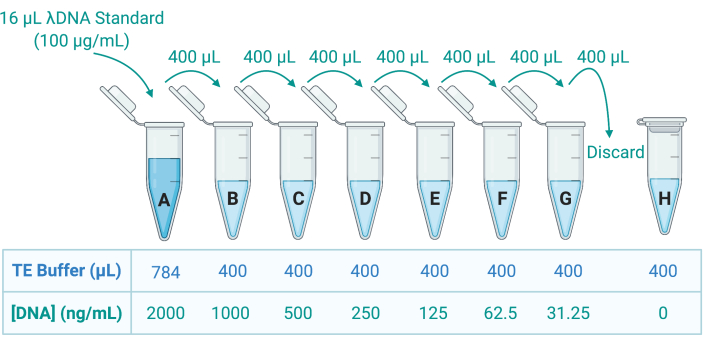
Рисунок 5: Подготовка восьми стандартов ДНК для генерации стандартной кривой. Исходный раствор λДНК предоставляется в концентрации 100 мкг/мл. Его разбавляют в 50-кратном буфере TE для создания стандартного А в концентрации 2000 нг/мл; Затем 400 мкл А переносят в пробирку В, содержащую 400 мкл ТЭ-буфера; Затем 400 мкл B переносят и разбавляют в 2 раза в C, и так далее до G. Стандарт H состоит только из TE-буфера и, следовательно, имеет концентрацию ДНК 0 нг/мл. Аббревиатура: TE = Tris-EDTA. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
- Подготовка скаффолдов к гистологическому окрашиванию
ПРИМЕЧАНИЕ: Скаффолды могут быть зафиксированы и окрашены для целей микроскопии и визуализации либо в виде целых скаффолдов для иммунофлуоресценции (IF), либо в виде фиксированных формалином срезов, залитых парафином (FFPE) для гистологического окрашивания или иммуногистохимии (IHC). Это позволяет качественно оценить проникновение и распределение клеток внутри скаффолдов и может быть использовано для оценки экспрессии белков.- Приготовьте 10% раствор параформальдегида (PFA) в PBS. Убедитесь, что раствора достаточно для конечного объема 500 мкл на каркас.
- Подогрейте этот раствор до 37 °C и добавьте 500 мкл в маркированные центрифужные пробирки объемом 2 мл для извлечения каркаса.
- Снимите каркасы с неприклеенных 24-луночных пластин (шаг 4.4.4) и поместите их в ламинарный колпак.
- Стерильным пинцетом перенесите каркасы в центрифужные пробирки с маркировкой, содержащие 10% PFA. Дайте каркасам закрепиться в растворе PFA в течение 15 минут. Нейтрализуйте PFA, добавив 500 мкл PBS в каждую пробирку, и храните при температуре 4 °C.
- Чтобы подготовить каркасы для автоматического процессора для обработки тканей, извлеките их из температуры 4 °C и с помощью пинцета поместите в пластиковые кассеты со всеми соответствующими деталями карандашом. Поместите все кассеты в металлический контейнер тканевого процессора.
- Начните 12-этапный протокол на тканях, чтобы зафиксировать, обезвоживать, очищать каркасы и инфильтрировать их парафином на ночь. Соберите кассеты с обработанными образцами.
- Затем вставьте каркасы в парафиновые восковые блоки, чтобы можно было провести микротомию скаффолдов на очень тонкие ломтики для окрашивания.
ПРИМЕЧАНИЕ: Особенно важно учитывать ориентацию скаффолдов при извлечении их из кассет и встраивании в воск, так как это повлияет на угол, под которым будут сделаны изображения. Это важно при оценке проникновения клеток в каркасы. - Включите восковой закладчик и холодную пластину; Поднимите крышку, чтобы проверить уровень воска. При необходимости дополните.
- Работая с одним образцом за раз, откройте кассету, снимите каркас и центрируйте его в пластиковой форме.
- Налейте горячий воск на образец, убедившись, что поддерживается правильная ориентация, и при необходимости отрегулируйте теплым пинцетом до того, как воск затвердеет. Налейте еще воска, чтобы заполнить форму.
- Поместите крышку кассеты с этикеткой на пластиковую форму и добавьте сверху воск. Поместите форму на холодную пластину, чтобы воск затвердел. Хранить в течение ночи при температуре 4 °C, чтобы убедиться, что парафин полностью затвердел перед микротомией.
- Чтобы подготовиться к микротомии, включите водяную баню с температурой 35 °C, сушильную пластину и микротом.
- Вставьте лезвие в держатель и затяните рычаг, чтобы зафиксировать его.
- Установите толщину обрезки и секции, обычно 5 мм для секций лесов.
- Извлеките каркас FFPE из формы, закрепите его в держателе на передней части микротома и осторожно обрежьте излишки воска по краям образца перед вырезанием секций.
- Начните врезаться в восковой блок, вращая рычаг микротома, обеспечивая плавное движение.
- Соберите лентообразные секции, около 3 секций каркаса за раз, и осторожно поместите их на водяную баню с температурой 35 °C, чтобы удалить морщины. Аккуратно отделите секции, находясь на водяной бане, с помощью пинцета.
- Используя стеклянные предметные стекла для микроскопа с полизиновым покрытием, поднимите каждую секцию из водяной бани так, чтобы она находилась в центре предметного стекла. Подпишите карандашом каждый слайд.
- Поместите предметные стекла на сушильную плиту или в сушильную печь с температурой 60 °C. После высыхания храните их при температуре 4 °C и приступайте к обязательному гистологическому или ИГХ-окрашиванию.
- Извлечение скаффолдов для анализа экспрессии генов
- Снимите каркасы с неприлипших 24-луночных пластин из инкубатора (шаг 4.4.4) и поместите их в ламинарный колпак.
- С помощью стерильного пинцета перенесите каркасы в центрифужные пробирки объемом 2 мл со свежей этикеткой.
- В вытяжном шкафу добавьте 1 мл реагента для лизиса клеток на основе фенола/гуанидина в каждую пробирку, чтобы лизировать клетки в каркасах и обеспечить извлечение высококачественной РНК.
- Храните пробирки при температуре -20 °C до тех пор, пока не будете готовы к экстракции РНК с помощью соответствующего набора. Используя стандартную количественную полимеразную цепную реакцию с обратной транскрипцией (ОТ-кПЦР)17, оценивают экспрессию генов в клетках скаффолдов.
Результаты
Описанная здесь модель каркаса на основе коллагена имеет множество применений, начиная от изучения биологии нейробластомы и заканчивая скринингом противоопухолевых препаратов в среде, которая физиологически более похожа на нативные опухоли, чем обычная 2D-клеточная культура. Перед проверкой данного исследовательского вопроса крайне важно получить полную характеристику клеточного прикрепления, пролиферации и инфильтрации в желаемые экспериментальные сроки. Условия роста будут зависеть от биологии каждой конкретной клеточной линии. Важно отметить, что для определения оптимальных условий и надежной производительности необходимо внедрить несколько методов оценки роста клеток.
Здесь жизнеспособность клеток нейробластомы, выращенных на скаффолдах, оценивали с помощью колориметрического анализа жизнеспособности клеток. Этот анализ можно проводить так часто, как это необходимо в течение всего периода эксперимента. Для описанного эксперимента оценка жизнеспособности клеток проводилась на 1, 7 и 14 сутки для двух клеточных линий нейробластомы, KellyLuc и IMR32, выращенных на скаффолдах Coll-I-nHA при 4 различных плотностях (рис. 6). Жизнеспособность в 1-й день была установлена в качестве базового уровня для сравнения всех последующих измерений. Скорость снижения жизнеспособности реагента отражает клеточную биологию и ростовые характеристики отдельных клеточных линий, в том числе скорость их пролиферации и метаболизма. Ожидалась корреляция между количеством клеток, засеянных на скаффолдах, и уровнем редукции. В этом эксперименте снижение жизнеспособности реагента клеток, как правило, увеличивалось с каждым моментом времени для обеих клеточных линий при всех плотностях, как и ожидалось.
Затем каждую плотность оценивали индивидуально для обеих клеточных линий, чтобы сравнить снижение в разные моменты времени. Для выявления значимых различий в редукции между временными точками был проведен односторонний ANOVA с тестом множественных сравнений Тьюки (рис. 7). Как для клеточных линий, так и для всех плотностей посева наблюдалось значительное увеличение (P<0,05) снижения реагента жизнеспособности клеток при сравнении 1-го и 14-го дней. Это указывало на значительное увеличение метаболически активных клеток, присутствующих на каркасах. Это увеличение не было значимым во всех случаях при оценке 7-дневных интервалов (1-й день против 7-го дня, 7-й день против 14-го дня), демонстрируя важность оптимизации плотности посева для достижения желаемого окна роста.
Для подтверждения результатов анализа жизнеспособности клеток рост клеток на скаффолдах также может быть косвенно измерен с помощью количественного определения дцДНК, извлеченной из скаффолдов, с помощью флуоресцентного окрашивания дцДНК (рис. 8A). Как и жизнеспособность клеток, количественное определение ДНК можно проводить так часто, как это необходимо в течение экспериментального графика. Тем не менее, этот анализ требует полного извлечения каркасов и прекращения роста клеток и поэтому должен быть учтен при планировании эксперимента, как обсуждалось в разделе 1. Для этого эксперимента количественное определение ДНК проводилось на 1, 7 и 14 день для двух клеточных линий нейробластомы, KellyLuc и IMR32, выращенных на каркасах Coll-I-nHA при 4 различных плотностях. Поскольку для этих клеточных линий известна средняя концентрация дцДНК на клетку, можно было получить количество клеток в образце из количественно выраженной ДНК (рис. 8B).
Количественное определение ДНК привело к более высокой вариабельности между биологическими репликатами, чем оценка жизнеспособности клеток, но, как правило, увеличивалось в каждый момент времени, при этом самые высокие уровни количественно определялись на 14-й день. Клетки IMR32, по-видимому, достигают большего количества клеток на скаффолдах Coll-I-nHA, на что указывает концентрация ДНК, чем клетки KellyLuc. Затем каждую плотность оценивали индивидуально для двух клеточных линий, чтобы сравнить снижение в разные моменты времени. Для выявления значимых различий в сокращении между временными точками был проведен односторонний ANOVA с тестом множественных сравнений Тьюки (рис. 8B).
Как для клеточных линий, так и для всех плотностей посева наблюдалось значительное увеличение (P<0,05) числа клеток при сравнении 1-го и 14-го дней, за исключением KellyLuc при плотности посева 4 (1 × 105 клеток/скаффолд), который не дал значительного увеличения ни в одном из временных точек. Как и в случае с результатами оценки жизнеспособности клеток, увеличение не было значимым во всех случаях при оценке 7-дневных интервалов (1-й день против 7-го дня, 7-й день против 14-го дня). При сравнении временных тенденций жизнеспособности клеток и количественной оценки ДНК были выявлены некоторые незначительные различия между двумя анализами. Тем не менее, в целом наблюдались схожие тенденции, при этом средние значения увеличивались между 7-дневными интервалами для большинства плотностей. Это демонстрирует важность мониторинга роста клеток с использованием более чем одного метода.
Затем была проведена визуальная оценка морфологии и распределения роста клеток на каркасах, включающая традиционное окрашивание гематоксилином и эозином (H&E), а также ВПХ. Ожидается, что различные модели роста отдельных клеточных линий приведут к различным пространственным расположениям на каркасах, включая различную степень проникновения в каркас и кластеризацию клеток. Скаффолды были зафиксированы формалином, залиты парафином и разрезаны на секции по 5 мм (рис. 9А), что подготовило скаффолды к различным методам визуализации, включая гистологическое окрашивание и ИГХ.
Рутинное окрашивание H&E применяли к клеткам Kelly, KellyCis83 и IMR32, выращенным на каркасах на основе коллагена, на 1-й, 7-й и 14-й день (рис. 9B). Это позволило визуализировать пространственную ориентацию клеток на двух каркасах на основе коллагена в течение 14-дневного периода. Цисплатин-чувствительные клетки Kelly и резистентные клетки KellyCis83 выращивали как на скаффолдах Coll-I-nHA (рис. 9B, i), так и на скаффолдах Coll-I-GAG (рис. 9B, ii). В соответствии с ранее опубликованными данными, клетки KellyCis83 росли с более высокой скоростью и проникали глубже в оба состава каркаса, чем менее инвазивная клеточная линия Келли. Окраска H&E другой клеточной линии нейробластомы, IMR32, выращенной на Coll-I-nHA, демонстрирует контрастную картину роста (рис. 9B, iii). Эта клеточная линия росла в больших, плотно упакованных кластерах на коллагеновых каркасах в течение 14-дневного периода. Светлопольная конфокальная микроскопия может быть использована для визуализации пористой архитектуры скаффолдов на основе коллагена (рис. 9C) благодаря автофлуоресценции коллагеновых волокон.
Мы окрашивали клетки фаллоидином, нацеленным на цитоскелетный актин, и ядерным контрокрашивателем, 4',6-диамидино-2-фенилиндолом (DAPI), чтобы отслеживать специфические клеточные черты на протяжении всего эксперимента. Обилие актина наблюдалось в клетках Kelly и KellyCis83 на скаффолдах Coll-I-GAG с использованием этого метода (рис. 9D). Эти результаты демонстрируют, как можно использовать несколько методов визуализации для получения пространственно разрешенной информации из клеток нейробластомы, выращенных на скаффолдах с использованием этого протокола. Такая характеристика паттернов роста клеток на каркасах на основе коллагена в течение определенного периода времени улучшит понимание и интерпретацию любых последующих биохимических анализов.
Экспрессия белка клетками, выращенными на каркасах на основе коллагена, может быть проанализирована для сравнения клеточной активности со сценариями in vivo . Ранее опубликованные данные изучали экспрессию хромогранина А (CgA) в качестве суррогатного секретируемого маркера нейробластомы клетками KellyLuc и KellyCis83Luc, выращенными в клеточных монослоях, а также на каркасах Coll-I-nHA и Coll-I-GAG (рис. 10). CgA оценивали в кондиционированных средах с помощью иммуноферментного анализа (ИФА) (рис. 10А). CgA секретируется с большей скоростью в более агрессивной химиорезистентной клеточной линии KellyCis83, чем в Kelly (рис. 10B, C). Это было значимо на 7-й день как на скаффолдах Coll-I-GAG, так и на скаффолдах Coll-I-nHA (P<0,05), в то время как для клеток, выращенных в виде монослоя с помощью обычной 2D-культуры, не было существенной разницы.
Эти результаты также подчеркивают ограниченные сроки эксперимента при выращивании клеток в монослое, когда только 7 дней роста оказываются осуществимыми, прежде чем клетки достигнут слияния. Рост клеток на скаффолдах преодолевает это ограничение, поскольку они могут поддерживаться в течение более длительного периода времени в более физиологически приемлемых условиях. Приведенная выше комбинация методов для получения информации о жизнеспособности клеток, содержании ДНК, морфологии и пространственном расположении клеток, а также профилях экспрессии облегчает оценку роста клеток нейробластомы на ряде каркасов на основе коллагена. Этот протокол также может быть легко адаптирован для удовлетворения конкретных экспериментальных требований и желаемых применений.
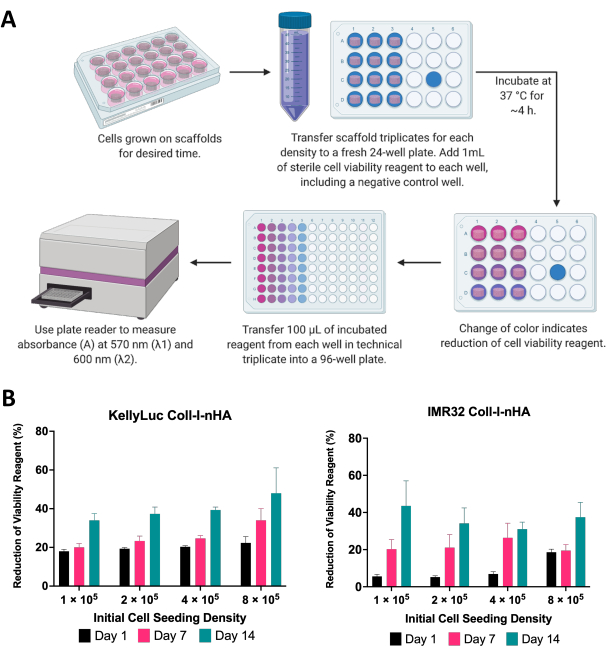
Рисунок 6: Анализ жизнеспособности клеток. (А) Общая процедура измерения жизнеспособности клеток нейробластомы на каркасах на основе коллагена с использованием колориметрического анализа жизнеспособности клеток. Инкубационный период необходимо оптимизировать для каждой новой клеточной линии, ссылаясь на рекомендации производителя. (B) Процентное снижение реагента жизнеспособности клеток клетками KellyLuc и IMR32, выращенными на каркасах Coll-I-nHA при четырех различных начальных плотностях посева, измеренных на 1, 7 и 14 день. Образцы оценивались в биологическом трикотате со столбцами погрешности, представляющими стандартное отклонение. Сокращения: nHA = наногидроксиапатит; Coll-I-nHA = коллагеновые каркасы, дополненные nHA. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
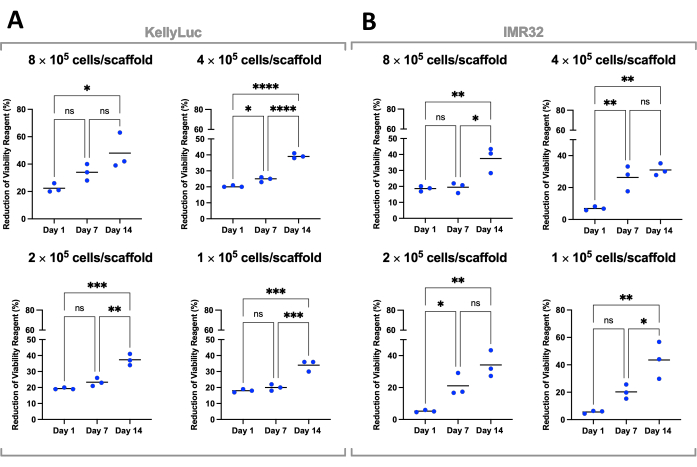
Рисунок 7: Жизнеспособность клеток по плотности посева для клеток, выращенных на Coll-I-nHA в течение 14-дневного периода. (А) КеллиЛюк; (В) ИМР32. Номера названных ячеек относятся к начальной плотности засева клеток на строительных лесах в день 0. Образцы оценивали в биологическом трипликате, обозначенном тройными баллами, где столбцы представляют среднее значение. Для выявления существенных различий в % снижения жизнеспособности клеток реагентом в трех временных точках, отмеченных на графиках (ns P > 0,05, * P ≤ 0,05, ** P ≤ 0,01, *** P ≤ 0,001, **** P ≤ 0,0001, **** P 0,0001). Сокращения: nHA = наногидроксиапатит; Coll-I-nHA = коллагеновые каркасы, дополненные nHA; ANOVA = дисперсионный анализ; ns = не значимо. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
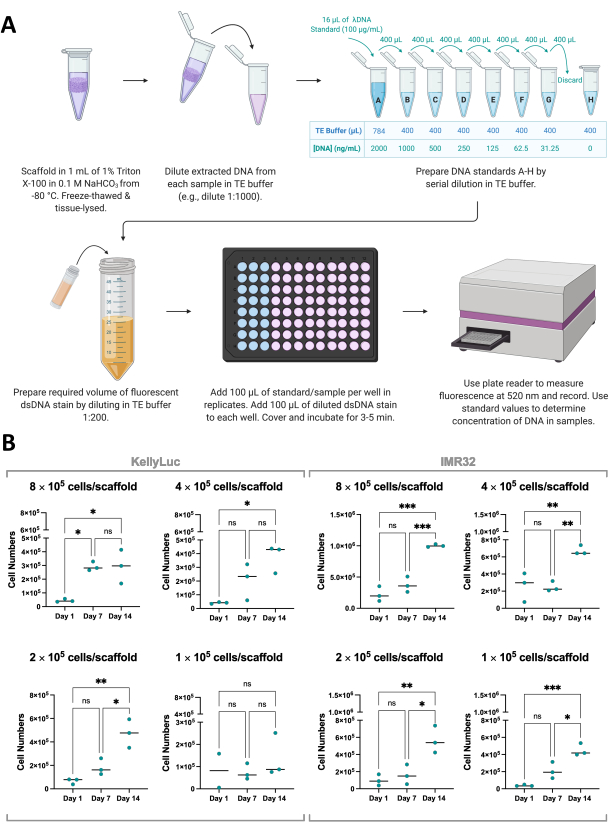
Рисунок 8: Количественное определение ДНК, выделенной из клеток в каркасах. (A) Процесс количественного определения дцДНК из клеток, выращенных на каркасах на основе коллагена, с использованием флуоресцентного окрашивания дцДНК. (B) Количество клеток из количественного анализа ДНК по плотности посева для клеток KellyLuc и IMR32, выращенных на Coll-I-nHA в течение 14-дневного периода. Номера ячеек с названиями относятся к начальной плотности посева клеток на скаффолды в день 0. Образцы оценивали в биологическом трипликате, обозначенном тройными баллами, где столбцы представляют среднее значение. Для выявления значимых различий в номерах ячеек в трех временных точках, отмеченных на графиках (ns P > 0,05, * P ≤ 0,05, ** P ≤ 0,01, *** P ≤ 0,001, **** P ≤ 0,0001). Сокращения: nHA = наногидроксиапатит; Coll-I-nHA = коллагеновые каркасы, дополненные nHA; дцДНК = двухцепочечная ДНК; TE = Трис-ЭДТА; ANOVA = дисперсионный анализ; ns = не значимо. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
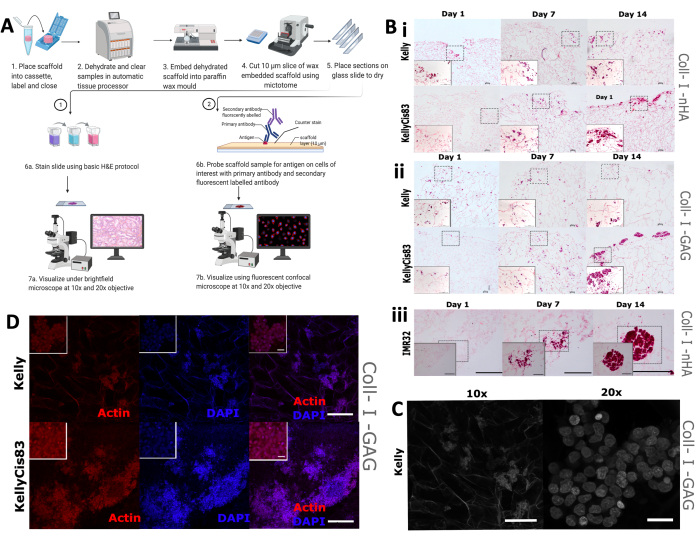
Рисунок 9: Этапы обработки тканей для иммуногистохимического анализа скаффолдов . (А) Схематическое изображение протокола обработки скаффолдов для анализа изображений. Этот процесс позволяет проводить рутинное гистологическое окрашивание и специфическое зондирование антител с использованием первичных антител и флуоресцентно меченных вторичных антител. (B) Репрезентативные изображения трех клеточных линий нейробластомы, подвергнутых окрашиванию H&E. Снимки H&E делаются на 1-й, 7-й и 14-й дни для отслеживания моделей роста в течение всего эксперимента. Масштабная линейка = 200 мкм. Пунктирные квадраты обозначают область, которая была выбрана для увеличенных в 20 раз изображений в левом нижнем углу. Масштабная линейка = 20 мкм. (i и ii) H&E клеточных линий нейробластомы Kelly и KellyCis83 (верхняя и нижняя панели, соответственно) на двух типах скаффолдов на основе коллагена. (iii) H&E клеточной линии IMR32, представляющей кластерный клеточный рост на каркасе Coll-I-nHA. (C) Репрезентативное изображение клеточной линии Келли, подвергнутое светопольной конфокальной микроскопии. Автофлуоресценция коллагена позволяет визуализировать пористый каркас. 10-кратная масштабная линейка = 200 мкм, 20-кратная масштабная линейка = 20 мкм. (D) Репрезентативное изображение встроенных скаффолдов с последующим анализом с помощью IHC с фаллоидином и DAPI при 10-кратном увеличении, масштабная линейка = 200 мкм. Меньшие внутренние квадраты представляют собой увеличенные изображения (в 20 раз), масштабная линейка = 20 мкм. Сокращения: nHA = наногидроксиапатит; Coll-I-nHA = коллагеновые каркасы, дополненные nHA; ГАГ = гликозаминогликан; Coll-I-GAG = коллагеновые каркасы, дополненные хондроитин-6-сульфатом; H&E = гематоксилин и эозин; ИГХ = иммуногистохимия; DAPI = 4′,6-диамидино-2-фенилиндол. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
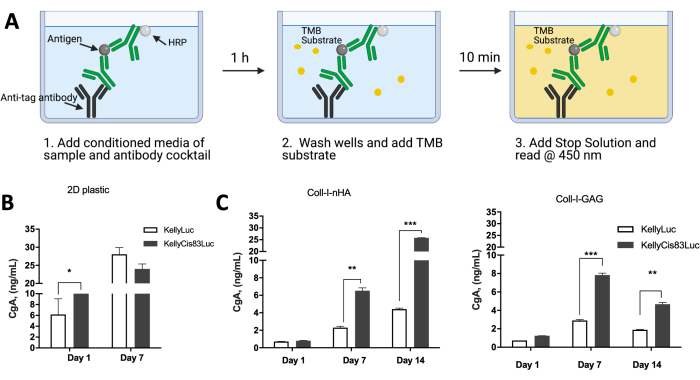
Рисунок 10: Экспрессия белка клетками нейробластомы, выращенными на 3D-каркасах на основе коллагена, по сравнению с 2D-пластиком. (A) Схема того, как ИФА CgA проводился на кондиционированных средах клеток, выращенных на 2D-пластике или 3D-каркасах на основе коллагена. (B) Уровни экспрессии белка CgA, взятые из кондиционированных сред клеток, выращенных на 2D пластиковом монослое. Поскольку ячейки достигали слияния через 7 дней, 14-дневная временная точка была нечитаемой. К 7-му дню приема пластика не было существенной разницы в уровнях CgA между клеточными линиями Kelly и KellyCis83. (C) ИФА CgA, проводимый с использованием кондиционированных сред клеток, выращенных на каркасах на основе коллагена, в течение 14 дней подряд. На 7-й день на обоих коллагеновых каркасах уровни CgA выше в более агрессивной клеточной линии KellyCis83, что подчеркивает более физиологически значимые уровни CgA в 3D-матрице по сравнению с 2D-монослоем. Эта цифра была изменена по данным Curtin et al.17. Сокращения: 3D = трехмерный; 2D = двумерный; CgA = хромогранин А; ИФА = иммуноферментный анализ; нХА = наногидроксиапатит; Coll-I-nHA = коллагеновые каркасы, дополненные nHA; ГАГ = гликозаминогликан; Coll-I-GAG = коллагеновые каркасы, дополненные хондроитин-6-сульфатом; ТМБ = 3,3',5,5'-тетраметилбензидин; HRP = пероксидаза хрена. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Обсуждение
3D-модель каркаса-раковой клетки зарекомендовала себя как ценный и универсальный инструмент для получения механистического представления о росте, жизнеспособности и инфильтрации клеток нейробластомы в упрощенном TME32. Описанная здесь 3D-модель нейробластомы имитирует минимальную ТМЭ и предоставляет более физиологически значимые данные, чем 2D-монослойная культура. Основным недостатком 3D-культуры клеток является повышенная сложность эксперимента и более длительные временные рамки. Здесь описан оптимизированный протокол посева, роста и поддержания клеток нейробластомы на каркасах на основе коллагена с последующим анализом и применением, что позволяет получить надежную характеристику роста клеток. Мы стремились получить представление об оптимальной плотности посева клеток для скаффолдов, чтобы создать предсказуемую и контролируемую среду для оценки лечения противоопухолевыми препаратами в кратчайшие 14-дневные экспериментальные окна. Комбинация всех этих описанных простых протоколов обеспечивает всестороннюю оценку роста клеток нейробластомы в системе культивирования in vitro на основе скаффолда.
Критические моменты в настройке протокола были подчеркнуты, чтобы позволить ученым быстро установить то же самое в своих лабораториях. Например, указанное время инкубации для лучшего выполнения колориметрического анализа жизнеспособности клеток позволяет глубже проникать реагенту в поры каркаса и достигать всех клеток. Кроме того, метод флуоресцентного окрашивания дцДНК надежен и прост; однако высвобождение ДНК из каркасов требует энергичного лизиса клеток, поскольку клетки «пойманы» в ловушку коллагеновых волокон.
Используя описанный простой количественный анализ ДНК, мы можем определить логарифмическую фазу роста на скаффолдах на основе коллагена для скрининга противоопухолевых препаратов с помощью этой модели. В описанных экспериментальных условиях использовали 4 исходные плотности посева клеток с общим 14-дневным периодом и временными точками анализа на 1-й, 7-й и 14-й дни. Мы определили, что клетки KellyLuc, посеянные в 4 × 105 клеток/каркас, имеют наиболее активное окно пролиферации между 7 и 14 днями. Эти данные о логарифмическом фазовом росте позволят надежно интерпретировать различные эксперименты по цитотоксичности клеток. Это исключает спекуляции о каком-либо снижении роста или гибели клеток в результате подавленного роста на 3D-пористой платформе, а не из-за токсичности лекарств. Жизнеспособность клеток также широко используется для оценки пригодности 3D-платформ для поддержки роста различных типов клеток33,34. Несмотря на то, что существует множество тестов для измерения жизнеспособности клеток, включая окрашивание живых/мертвых клеток, измерение АТФ, анализы пролиферации, мы обнаружили, что использование колориметрического анализа жизнеспособности клеток Alamar Blue является простым и эффективным методом для поддержки данных количественной оценки ДНК.
Комбинированное использование количественной оценки ДНК и жизнеспособности клеток предоставило дополнительные доказательства того, что в среднем оптимальная плотность посева клеток на каркасе для достижения непрерывного роста в течение 14-дневного периода составляет 2-4 × 105 клеток/каркас. Тем не менее, этот протокол может быть легко адаптирован для удовлетворения различных экспериментальных временных рамок, точек времени анализа и последующих приложений. Несмотря на то, что этот протокол описывает оценку роста монокультурных клеток нейробластомы на скаффолдах, каркасы легко могут быть изменены для использования в качестве платформы для совместного культивирования, описанного do Amaral et al., которые использовали коллаген-ГАГ-скаффолды для совместного культивирования кератиноцитов и фибробластов в исследовании заживления ран35.
Описанная 3D-модель позволяет визуализировать рост и инфильтрацию клеток с помощью различных известных методов, таких как иммунофлуоресценция и стандартная H&E. Важно визуализировать клетки наряду с характеристикой роста с помощью биохимических анализов из-за разнообразия морфологии клеток и моделей роста на каркасах. Понимание модели роста может дать представление о поведении роста и будущей реакции на противоопухолевые препараты. Например, рост IMR32 с использованием количественной оценки ДНК дает те же паттерны, что и Келли, хотя при визуализации с помощью H&E IMR32 растет в более крупных кластерах, чем Kelly, который показал более рассеянный рост (рис. 9). Эти различные модели роста клеточных линий в скаффолдах отражают клинический сценарий гетерогенности опухоли. Изучение ответа на противоопухолевые препараты с использованием панели клеточных линий с различной морфологией в 3D-скаффолдах повысит прогностическую ценность ответа пациента на одни и те же препараты.
Определение экспрессии гена или белка также может быть выполнено с помощью других подходов, таких как ОТ-кПЦР или ИФА, если интересующий белок секретируется. Суррогатный маркер прогрессирования нейробластомы хромогранин А (CgA)36 был использован для дополнительной характеристики роста клеток нейробластомы в 3D. Как описано в предыдущей работе17, секреция CgA увеличивалась по мере пролиферации клеток (рис. 10). В то время как монослойная клеточная культура не могла уловить это увеличение, поскольку пролиферация означала, что клетки достигали полного слияния в культуральных чашках, использование 3D-коллагеновых каркасов позволило провести длительную оценку секреции CgA.
Эта 3D-модель in vitro может не подходить для всех исследовательских вопросов по изучению биологии нейробластомы и ответа на терапию. Одним из ограничений является неравномерное проникновение клеток внутрь каркасов и образование клеточных кластеров различного размера, что зависит от данной клеточной линии и может привести к неконтролируемой диффузии питательных веществ и тестируемых препаратов. Эта особенность влияет на надежность терапевтического скрининга. Однако, несмотря на это ограничение, важно учитывать, что нативные опухоли также неоднородны по размеру и распределению раковых клеток и содержат много других типов клеток в опухолевой ткани. Для преодоления этого ограничения мы предлагаем использовать каждый клеточный каркас в качестве единой микроткани, для которой будут оптимизированы следующие параметры: (а) время инкубации для достижения реагентом жизнеспособности клеток клеток и клеточных кластеров, и (б) лизис клеток в буфере Triton X-100 путем предварительной обработки клеток на скаффолдах тканевым лизером для высвобождения ДНК клеток, содержащихся глубоко в каркасе.
Еще одним техническим ограничением данного протокола является отсутствие механических испытаний каждой партии вновь изготавливаемых лесов для данной модели. Тем не менее, использование надежного производственного процесса строительных лесов, которые были подробно охарактеризованы в отношении физических и химических свойств лесов, таких как модуль сжатия и растяжения, пористость и визуальная пористая структура, а также однородность, обеспечивает сохранение качества лесов на протяжении партий 21,24,27,30,37.
Таким образом, в данной работе представлен ряд простых методов анализа клеточного роста на каркасах на основе коллагена. Как временная шкала эксперимента, так и точки анализа могут меняться местами в зависимости от конкретных исследовательских вопросов. Этот протокол также может быть адаптирован к другим типам клеток. Результаты, показанные выше, свидетельствуют о том, как эта компиляция методов дала представление об оптимальной плотности посева для различных клеточных линий нейробластомы для создания непрерывного роста в течение 14 дней. Объединение результатов, полученных с помощью всех методов в этом протоколе, дает лучшее понимание роста клеток в 3D коллагеновом матриксе. Будущее использование этой модели, вероятно, будет включать в себя системы совместного культивирования, специфичные для нейробластомы TME, и тестирование различных новых противоопухолевых препаратов.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Эта работа была поддержана Национальным детским исследовательским центром (NCRC), Ирландским исследовательским советом (IRC) и Neuroblastoma UK. Иллюстрации были созданы с помощью BioRender.
Материалы
| Name | Company | Catalog Number | Comments |
| Cells | |||
| IMR-32 | ATCC | CCL-127 | |
| Kelly | ECACC | 82110411 | |
| KellyCis83 | Made in lab – derived from Kelly (Piskareva et al., 2015) | - | Increasing exposure to cisplatin. Cross resistance acquired |
| SH-SY5Y | ATCC | CRL-2266 | |
| Disposable | |||
| 0.22 µm syringe filter | Millex | SLHP033RS | |
| 1.5 mL Eppendorf tube | Eppendorf | 0030 120.086 | |
| 100 mL sterile Pot | Starstedt | - | |
| 10 mL plastic pipette | Cellstar | 607 180 | |
| 15 mL Falcon tube | Starstedt | 62.554.502 | |
| 25 mL plastic pipette | Cellstar | 760 180 | |
| 50 mL Falcon tube | Starstedt | 62.547.254 | |
| 5 mL plastic pipette | Cellstar | 606 180 | |
| 6 mm Biopsy punches | Kai Medical | BP-60F | |
| Aluminium foil | - | - | |
| Cover Slip | Menzel-Glaser | - | |
| HYPERflask | Corning | CLS10030 | |
| Microscope slides | Thermo Scientific | J1840AMNT | |
| Opaque black 96-well plate | Costar | 3915 | |
| Sterile P10 tips | Starlab | S1121-3810 | |
| Sterile P1000 tips | Starlab | S1122-1830 | |
| Sterile P20 tips | Starlab | S1123-1810 | |
| Sterile P200 tips | Starlab | S1120-8810 | |
| T-175 (175 cm2 flask) | Sarstedt | 83.3912 | |
| T-75 (75 cm2 flask) | Sarstedt | 83.3911.302 | |
| Translucent clear 96 well plate | Cellstar | 655180 | |
| Translucent non-adherent 24 well plates | Cellstar | 83.3922.500 | |
| Equipment | |||
| Autoclave | Astell | - | |
| Automatic tissue processor | Leica | TP1020 | |
| Centrifuge 5804 | Eppendorf | - | |
| Hemocytometer | Hausser Scientific | - | |
| Incubator | ThermoScientific | - | |
| Microtome | Leica | RM2255 | |
| Oven | Memmert | Calibrated by: Cruinn diagnostics Ltd | |
| P10 pipette | Gilson | ||
| P100 pipette | Gilson | ||
| P1000 pipette | Gilson | ||
| P20 pipette | Gilson | Calibrated by: Cruinn diagnostics Ltd | |
| P200 pipette | Gilson | Calibrated by: Cruinn diagnostics Ltd | |
| Paraffin section flotation bath | Electrothermal | MH8517 | Calibrated by: Cruinn diagnostics Ltd |
| Pipette electronic dispenser | Corning | StripipetterUltra | Calibrated by: Cruinn diagnostics Ltd |
| Plate cooler | Leica | EG1140C | Calibrated by: Cruinn diagnostics Ltd |
| Refrigerator -20 °C | Liebherr | - | |
| Refrigerator -80 °C | Liebherr | - | |
| Refrigerator 4 °C | Liebherr | - | |
| Seesaw Rocker | DLAb | SK-D1807-E | |
| Spectrophotometer – Victor3V Platereader | PerkinElmer | 1420 | |
| Tissue culture hood/Laminar flow hood | GMI | 8038-30-1044 | |
| Tissue Lyser | Qiagen | TissueLyser LT | |
| Tweezers | - | - | |
| Water bath | Grant | - | |
| Wax embedder | Leica | EG1140H | |
| Materials | |||
| 1 L Water | Adrona - Biosciences | 568 | |
| 1% Triton-X | Sigma Aldrich | 9002-93-1 | |
| 10x PBS tablets | Sigma Aldrich | P4417-100TAB | |
| 37% paraformaldehyde | Sigma-Aldrich | F8775 | |
| Alamar Blue Cell Viability Reagent | Invitrogen | DAL1100 | |
| Collagen- glycosaminoglycan scaffold | Tissue engineering research group (TERG) | ||
| Collagen-nanohydroxyapatite scaffold | Tissue engineering research group (TERG) | ||
| dH20 | Adrona - Biosciences | 568 | |
| Eosin | Sigma-Aldrich | E4009 | Made as per: (Cunniffe et al., 2010, Fitzgerald et al., 2015; O’Brien et al., 2005) |
| EtOH | Sigma-Aldrich | 1.00983.2500 | Made as per: (Cunniffe et al., 2010, Fitzgerald et al., 2015; O’Brien et al., 2005) |
| F12 | Gibco | 21765-029 | |
| FBS | Gibco | 10270-106 | |
| Hemaytoxylin | Sigma-Aldrich | HHS32-1L | |
| L-Glutamine | Gibco | 25030-024 | |
| MEM | Gibco | 21090-022 | |
| miRNA easy Kit | Qiagen | 217004 | |
| MNEAA’s | Gibco | 11140-035 | |
| Penicillin/streptomycin | Gibco | 015140-122 | |
| Qiazol | Qiagen | 79306 | |
| Quant-iT PicoGreen dsDNA Assay Kit | Invitrogen | P11496 | |
| RPMI | Gibco | 21875-034 | |
| Sodium bicarbonate | Sigma Aldrich | S7795-500G | |
| Tissue embedding Medium | Sigma | A6330-4LB | |
| Trypsin-EDTA | Gibco | 25300-054 | |
| Software | |||
| Excel | - | Excel 2016 | |
| ImageJ | - | - | |
| Prism | - | Version 9 |
Ссылки
- Davidoff, A. M. Neuroblastoma. Seminars in Pediatric Surgery. 21 (1), 2-14 (2012).
- Matthay, K. K., et al. Neuroblastoma. Nature Reviews Disease Primers. 2, 16078 (2016).
- Costard, L. S., Hosn, R. R., Ramanayake, H., O'Brien, F. J., Curtin, C. M. Influences of the 3D microenvironment on cancer cell behaviour and treatment responsiveness: a recent update on lung, breast and prostate cancer models. Acta Biomaterialia. , (2021).
- Borriello, L., Seeger, R. C., Asgharzadeh, S., Declerck, Y. A. More than the genes, the tumor microenvironment in neuroblastoma. Cancer Letters. 380 (1), 304-318 (2016).
- Walker, C., Mojares, E., Del Río Hernández, A. Role of extracellular matrix in development and cancer progression. International Journal of Molecular Sciences. 19 (10), 3028 (2018).
- Bissell, M. J., Hall, H. G., Parry, G. How does the extracellular matrix direct gene expression. Journal of Theoretical Biology. 99 (1), 31-68 (1982).
- Schultz, G. S., Davidson, J. M., Kirsner, R. S., Bornstein, P., Herman, I. M. Dynamic reciprocity in the wound microenvironment. Wound Repair and Regeneration. 19 (2), 134-148 (2011).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Provenzano, P. P., et al. Collagen density promotes mammary tumor initiation and progression. BMC Medicine. 6, 11 (2008).
- Provenzano, P. P., et al. Collagen reorganization at the tumor-stromal interface facilitates local invasion. BMC Medicine. 4, 38 (2006).
- Ouellette, J. N., et al. Navigating the collagen jungle: The biomedical potential of fiber organization in cancer. Bioengineering. 8 (2), 1-19 (2021).
- Kreger, S. T., Voytik-Harbin, S. L. Hyaluronan concentration within a 3D collagen matrix modulates matrix viscoelasticity, but not fibroblast response. Matrix Biology. 28 (6), 336-346 (2009).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Hume, R. D., et al. Tumour cell invasiveness and response to chemotherapeutics in adipocyte invested 3D engineered anisotropic collagen scaffolds. Scientific Reports. 8 (1), 12658 (2018).
- Fitzgerald, K. A., et al. The use of collagen-based scaffolds to simulate prostate cancer bone metastases with potential for evaluating delivery of nanoparticulate gene therapeutics. Biomaterials. 66, 53-66 (2015).
- Sapudom, J., Pompe, T. Biomimetic tumor microenvironments based on collagen matrices. Biomaterials Science. 6 (8), 2009-2024 (2018).
- Curtin, C., et al. A physiologically relevant 3D collagen-based scaffold-neuroblastoma cell system exhibits chemosensitivity similar to orthotopic xenograft models. Acta Biomaterialia. 70, 84-97 (2018).
- Gavin, C., et al. Neuroblastoma invasion strategies are regulated by the extracellular matrix. Cancers. 13 (4), 1-23 (2021).
- Ridky, T. W., Chow, J. M., Wong, D. J., Khavari, P. A. Invasive three-dimensional organotypic neoplasia from multiple normal human epithelia. Nature Medicine. 16 (12), 1450-1456 (2010).
- Casal, e. J., Crane, J. S. . Biochemistry, Glycosaminoglycans. , (2019).
- O'Brien, F. J., Harley, B. A., Yannas, I. V., Gibson, L. J. The effect of pore size on cell adhesion in collagen-GAG scaffolds. Biomaterials. 26 (4), 433-441 (2005).
- O'Brien, F. J., Harley, B. A., Yannas, I. V., Gibson, L. Influence of freezing rate on pore structure in freeze-dried collagen-GAG scaffolds. Biomaterials. 25 (6), 1077-1086 (2004).
- Haugh, M. G., Murphy, C. M., McKiernan, R. C., Altenbuchner, C., O'Brien, F. J. Crosslinking and mechanical properties significantly influence cell attachment, proliferation, and migration within collagen glycosaminoglycan scaffolds. Tissue Engineering. Part A. 17 (9-10), 1201-1208 (2011).
- Murphy, C. M., Haugh, M. G., O'Brien, F. J. The effect of mean pore size on cell attachment, proliferation and migration in collagen-glycosaminoglycan scaffolds for bone tissue engineering. Biomaterials. 31 (3), 461-466 (2010).
- Haugh, M. G., Jaasma, M. J., O'Brien, F. J. The effect of dehydrothermal treatment on the mechanical and structural properties of collagen-GAG scaffolds. Journal of Biomedical Materials Research - Part A. 89 (2), 363-369 (2009).
- Lowe, B., Hardy, J. G., Walsh, L. J. Optimizing nanohydroxyapatite nanocomposites for bone tissue engineering. ACS Omega. 5 (1), 1-9 (2020).
- Cunniffe, G. M., Dickson, G. R., Partap, S., Stanton, K. T., O'Brien, F. J. Development and characterisation of a collagen nano-hydroxyapatite composite scaffold for bone tissue engineering. Journal of Materials Science. Materials in Medicine. 21 (8), 2293-2298 (2010).
- DuBois, S. G., et al. Metastatic sites in stage IV and IVS neuroblastoma correlate with age, tumor biology, and survival. Journal of Pediatric Hematology/Oncology. 21 (3), 181-189 (1999).
- Ryan, A. J., Gleeson, J. P., Matsiko, A., Thompson, E. M., O'Brien, F. J. Effect of different hydroxyapatite incorporation methods on the structural and biological properties of porous collagen scaffolds for bone repair. Journal of Anatomy. 227 (6), 732-745 (2015).
- Tierney, C. M., et al. The effects of collagen concentration and crosslink density on the biological, structural and mechanical properties of collagen-GAG scaffolds for bone tissue engineering. Journal of the Mechanical Behavior of Biomedical Materials. 2 (2), 202-209 (2009).
- Cox, R. F., Jenkinson, A., Pohl, K., O'Brien, F. J., Morgan, M. P. Osteomimicry of mammary adenocarcinoma cells in vitro; increased expression of bone matrix proteins and proliferation within a 3D collagen environment. PLoS One. 7 (7), 41679 (2012).
- Nolan, J. C., et al. Preclinical models for neuroblastoma: advances and challenges. Cancer Letters. 474, 53-62 (2020).
- Sirivisoot, S., Pareta, R., Harrison, B. S. Protocol and cell responses in threedimensional conductive collagen gel scaffolds with conductive polymer nanofibres for tissue regeneration. Interface Focus. 4 (1), 20130050 (2014).
- Thevenot, P., Nair, A., Dey, J., Yang, J., Tang, L. Method to analyze three-dimensional cell distribution and infiltration in degradable scaffolds. Tissue Engineering. Part C-Methods. 14 (4), 319-331 (2008).
- do Amaral, R. J. F. C., et al. Functionalising collagen-based scaffolds with platelet-rich plasma for enhanced skin wound healing potential. Frontiers in Bioengineering and Biotechnology. 7, 371 (2019).
- Gkolfinopoulos, S., Tsapakidis, K., Papadimitriou, K., Papamichael, D., Kountourakis, P. Chromogranin A as a valid marker in oncology: Clinical application or false hopes. World Journal of Methodology. 7 (1), 9-15 (2017).
- O'Brien, F. J., et al. The effect of pore size on permeability and cell attachment in collagen scaffolds for tissue engineering. Technology and Health Care. 15 (1), 3-17 (2007).
Erratum
Formal Correction: Erratum: Three-dimensional In Vitro Biomimetic Model of Neuroblastoma using Collagen-based Scaffolds
Posted by JoVE Editors on 6/23/2022. Citeable Link.
An erratum was issued for: Three-dimensional In Vitro Biomimetic Model of Neuroblastoma using Collagen-based Scaffolds. The Authors section was updated.
The Authors section was updated from:
Ciara Gallagher*1,2,3
Catherine Murphy*1,2,3
Fergal J. O’Brien3,4,5
Olga Piskareva1,2,3,5,6
1Cancer Bioengineering Group, Department of Anatomy and Regenerative Medicine, RCSI University of Medicine and Health Sciences, Dublin, Ireland
2School of Pharmacy and Biomolecular Sciences, RCSI University of Medicine and Health Sciences, Dublin, Ireland
3Tissue Engineering Research Group, Department of Anatomy and Regenerative Medicine, RCSI University of Medicine and Health Sciences, Dublin, Ireland
4Trinity Centre for Bioengineering, Trinity College Dublin, Dublin, Ireland
5Advanced Materials and Bioengineering Research Centre (AMBER), RCSI and TCD, Dublin, Ireland
6National Children’s Research Centre, Our Lady's Children's Hospital Crumlin, Dublin, Ireland
* These authors contributed equally
to:
Ciara Gallagher*1,2,3
Catherine Murphy*1,2,3
Graeme Kelly4
Fergal J. O’Brien3,5,6
Olga Piskareva1,2,3,6,7
1Cancer Bioengineering Group, Department of Anatomy and Regenerative Medicine, RCSI University of Medicine and Health Sciences, Dublin, Ireland
2School of Pharmacy and Biomolecular Sciences, RCSI University of Medicine and Health Sciences, Dublin, Ireland
3Tissue Engineering Research Group, Department of Anatomy and Regenerative Medicine, RCSI University of Medicine and Health Sciences, Dublin, Ireland
4Department of Chemistry, Royal College of Surgeons in Ireland (RCSI), 123 St. Stephen’s Green, Dublin 2, Ireland
5Trinity Centre for Bioengineering, Trinity College Dublin, Dublin, Ireland
6Advanced Materials and Bioengineering Research Centre (AMBER), RCSI and TCD, Dublin, Ireland
7National Children’s Research Centre, Our Lady's Children's Hospital Crumlin, Dublin, Ireland
* These authors contributed equally
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены