Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оценка влияния пестицидов на личинок одиночных пчел
В этой статье
Резюме
В настоящем протоколе разъясняется способ подачи загрязненных пестицидами продуктов личинкам одиночных пчел Osmia excavata. Процедура исследует экотоксичность пестицида для личинок одиночных пчел.
Аннотация
Текущие оценки экологического риска пестицидов на опылителях в первую очередь учитывают только лабораторные условия. Для личинок одиночных пчел попадание в организм продуктов, загрязненных пестицидами, может увеличить смертность личинок, снизить скорость сбора и популяцию взрослых одиночных пчел в следующем году с демографической точки зрения. Но есть ограниченные исследования о влиянии пестицидов на личинок одиночных пчел. Поэтому понимание того, как пестициды влияют на личинки одиночных пчел, следует рассматривать как неотъемлемую часть оценки экологического риска пестицидов. В этом исследовании представлен метод воздействия на личинок одиночной пчелы, Osmia excavata, смертельных или сублетальных доз пестицидов, отслеживая увеличение веса личинок, продолжительность развития, способность к эклозии и конверсию эффективности потребления пищи в проглоченной пище. Чтобы продемонстрировать эффективность этого метода, личинок O. excavata кормили провизией, содержащей острые летальные и сублетальные дозы хлорпирифоса. Затем были исследованы вышеуказанные показатели обработанных личинок. Этот метод помогает прогнозировать и смягчать риск пестицидов для опылителей.
Введение
Опылители играют важнейшую роль в экосистемных услугах современного глобального сельского хозяйства. В то время как медоносные пчелы (Apis mellifera; Перепончатокрылые: Apidae) традиционно считаются основными экономическими опылителями сельскохозяйственных культур, недавние исследования показывают, что Osmia (Hymenoptera: Megachilidae) также очень важна для улучшения опыления для определенных культур, увеличения размера плодов и количества семян и уменьшения доли асимметричных плодов в коммерческих садах в разных частях мира1. Osmia excavata считается идеальным видом для опыления яблок, в основном в Азии, например, в северном и северо-западном Китае и Японии 2,3,4. Он может предоставлять услуги опыления для определенных культур с аналогичной или иногда с большей эффективностью. В этом отношении было показано, что они заменяют или работают в синергии с медоносными пчелами 4,5,6.
Биологические особенности O. excavata уникальны по сравнению с социальными пчелами. Его одновольтная, одиночная и гнездовая активность происходит в основном весной и в начале лета. Гнезда O. excavata обычно встречаются в ранее существовавших ямах, как правило, в сухостоях, полых растениях, соломенных трубках и бамбуковом стебле в естественном состоянии3. Взрослая особь O. excavata выходит из своего кокона, чтобы спариваться, собирать пыльцу и строить гнездо для откладывания яиц, которые начинают вылупляться через неделю. Оплодотворенные яйца развиваются в самок, в то время как неоплодотворенные яйца развиваются в самцов3. Самки распределены в нижней части пчелиной трубки, и соответствующие положения более значимы. Напротив, самцы находились в непосредственной близости от выхода из трубы с незначительными положениями7, поэтому самцы выходят первыми, а самки выходят позже. Самка смешивает пыльцу с небольшим количеством нектара во влажную каплю, единственный источник пищи для каждой личинки в клетке8.
В нескольких исследованиях сообщалось об уменьшении популяции насекомых-опылителейна 9,10. Широкое использование пестицидов было определено в качестве одного из основных факторов сокращения численности и разнообразия опылителей, а также может поставить под угрозу услуги по опылению11,12. Для уменьшения и смягчения неблагоприятного воздействия пестицидов необходимо провести оценку риска пестицидов для опылителей. Некоторые страны создали нормативно-правовую базу для обеспечения безопасности пчел от пестицидов, используемых13,14. Недавние исследования показали, что Осмия была более восприимчива к пестицидам, чем медоносные пчелы 1,15.
Интересно, что большинство оценок риска были сосредоточены на взрослых медоносных пчелах11,12; Мало исследований было проведено на O. excavata, особенно на личинках. Кроме того, смертность Осмии, непосредственно вызванная пестицидами, чаще всего считается16. Тем не менее, хронические токсичности, такие как увеличение веса личинок, продолжительность развития, модели кормления, способность к эклозии, последующее поведение взрослых и плодовитость, могут иметь тот же вред, что и острая смертельная токсичность, и часто игнорируются из-за отсутствия эффективного экспериментального метода для одиночных пчел17.
До настоящего времени для оценки воздействия пестицидов на личинок одиночных пчел использовались два метода: 1) соответствующее количество пестицида применялось в локализованном месте провизии без удаления яйца одиночных пчел 1,18,19,20; (2) замена положений искусственными пыльцево-нектарными смесями, содержащими определенное количество пестицида21. Тем не менее, существуют некоторые ограничения для вышеуказанных двух методов. Первый может измерять только острую токсичность, но не хроническую токсичность, потому что личинки проглотили всю дозу за короткий промежуток времени; последнее приведет к высокой смертности из-за манипуляций человека1. Здесь описан метод погружения для изучения экотоксичности пестицидов для O. excavata в строго контролируемых исследовательских условиях путем моделирования поведения личинок, питающихся остаточным пестицидом в условиях реальной среды. Метод данного исследования решает недостатки двух вышеуказанных методов и подходит для измерения воздействия опасного вещества на острую и хроническую токсичность.
протокол
1. Подготовка питательной трубки
- Проделайте отверстие (диаметр ~0,3 мм) в крышке центрифужной трубки объемом 2 мл с помощью электрического обмоточного утюга (см. Таблицу материалов). Используйте такую центрифужную трубку для поддержания личинки O. excavata и ее провизионной массы.
2. Приготовление пестицида
- Растворить технический пестицид (см. Таблицу материалов) в ацетоне, чтобы получить исходные растворы 1 х 104 мкг т.е. мл-1. Затем выполняют градиентные разведения раствора более чем на пять концентраций.
ПРИМЕЧАНИЕ: Хлорпирифос в 0,1, 0,2, 0,4, 0,8, 1,6, 3,2, 6,4 мкг и т.е. мл-1 был использован в этом исследовании.
3. Подготовка положений
- Приобретите пластиковые пчелиные трубки, содержащие провизию (см. Таблицу материалов) и недавно вылупившихся личинок O. excavata из программы массового выращивания.
ПРИМЕЧАНИЕ: Пестициды не использовались с 20 дней до цветения до всего периода цветения; результаты химического анализа показали, что обычно используемое содержание пестицидов в случайно выбранных пятидесяти положениях было ниже минимальных уровней испытаний. - Отделите провизию и личинок аккуратно с помощью мягкой щетки. Выбирайте личинок самок на основе размера резерва и положения ячейки в гнезде9. Затем поместите в чашки Петри (диаметром 60 мм) провизию однородного размера и отобранные личинки самок и отложите их для использования.
ПРИМЕЧАНИЕ: Пятьдесят положений были случайным образом выбраны для анализа содержания широко используемых пестицидов: хлорпирифоса, имидаклоприда, фендифенурона, фоксима, авермектина. Параметры мягкой кисти: (а) диаметр кисти: 0,3 мм, (б) длина кисти: 2 см, (в) длина пера: 18 см.
4. Обеспечение обработки пестицидами
- Замачивайте выбранные равномерно размеры (из стадии 3.2) в разбавленном пестициде (из стадии 2.1; хлорпирифос при 0,1, 0,2, 0,4, 0,8, 1,6, 3,2, 6,4 мкг и т.е. мл-1) в течение 10 с с использованием клетки. Замочите контрольный чек (CK) в 0,2% растворителе (ацетон в этом исследовании).
ПРИМЕЧАНИЕ: Существует три реплики на каждую концентрационную обработку, и каждая реплика состоит из 60 положений. Разница в дозировке каждого положения может быть уменьшена путем выбора пропорций одинакового размера. - Измерьте объем раствора пестицида до и после обработки провизии пестицидом. Затем рассчитайте погруженный объем инсектицида в каждой обработке, включая 60 массовых положений (Дополнительная таблица 1). Поместите провизию в отдельные центробежные трубки с отверстиями (начиная со стадии 1.1) после сушки на воздухе на стерильном рабочем столе.
ПРИМЕЧАНИЕ: Перед экспериментом поместите клетки, содержащие провизию, в раствор пестицида, а затем измерьте объем раствора пестицида до и после замачивания для устранения ошибки. - Перенесите личинок самок по отдельности на поверхность естественно высушенной провизии с помощью мягкой щетки.
ПРИМЕЧАНИЕ: Одна личинка в одной трубке.
5. Условия роста
- Загоните личинок O. excavata в камеру роста в темноте, относительная влажность 65%-75% и 25 ± 2 °C16.
6. Экспертиза результатов
- Тест на острую летальную токсичность
- Измерьте гибель личинок после помещения их на обработанные и контрольные (CK) положения в течение 48 ч.
ПРИМЕЧАНИЕ: Критерии гибели: когда личинки не реагировали на легкое прикосновение, используя мягкую щетку под лампами черного света22. Лампы черного света использовались для имитации темных условий роста личинок и избегания влияния света на личинок при проверке показателей роста. Для устранения человеческой ошибки также измеряли смертность с удалением личинок из провизии и без нее после 48 ч в контрольных группах. - Взвесьте 60 провизий до и после 48 часов испытаний по выращиванию насекомых, чтобы определить количество провизии, потребляемой каждой личинкой.
- Рассчитайте дозу пестицида в каждой концентрации, потребляемой каждой личинкой, в соответствии с процентом съеденного провизии и содержанием пестицидов в каждом продукте.
ПРИМЕЧАНИЕ: Уравнение для расчета дозы равно23: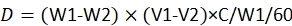
где D - потребляемая каждой личинкой доза пестицида; W1 - вес 60 провизий до инфузии пестицида; W2 - оставшийся вес 60 положений через 48 ч; V1 - объем пестицида перед погружением на 60 провизий; V2 - объем пестицида после погружения на 60 провизий; C - концентрация пестицида.
- Измерьте гибель личинок после помещения их на обработанные и контрольные (CK) положения в течение 48 ч.
- Испытание на сублетальную токсичность
- Взвесьте личинок перед испытаниями на выращивание и после 14 дней лечения, чтобы определить увеличение веса личинок.
- Наблюдайте за O. excavata ежедневно во время кокона под лампами черного света, чтобы измерить продолжительность развития личинок.
- Взвесьте оставшиеся порции провизии после 14 дней кормления обработанными и КФК провизиями для расчета расхода и эффективности конверсии проглоченной пищи (ECI)24.
- Изучите количество эклозий, снайперскивая коконы с помощью небольших ножниц, когда контрольные пчелы выходят во взрослых особей.
Результаты
Содержание широко используемых пестицидов, хлорпирифоса, имидаклоприда, фендифенурона, фосима, авермектина в провизии было меньше предела количественной оценки (0,01-0,02 мг кг-1) в контрольной группе; эти результаты исключали влияние остатков пестицидов на каждую обработку. Оценива...
Обсуждение
Для взрослых опылителей существует два основных метода измерения экотоксичности пестицидов. Одним из них является контактный метод, при котором пестицид наносится на проторакс взрослых насекомых; другим является метод желудочной токсичности, при котором взрослых опылителей кормят м...
Раскрытие информации
У авторов нет конфликта интересов, о которых можно было бы заявить.
Благодарности
Это исследование было поддержано Национальной ключевой программой исследований и разработок Китая (2017YFD0200400), Крупным научно-технологическим инновационным проектом (2017CXGC0214), Инновационной командой пчеловодческой промышленности провинции Шаньдун, Инновационным проектом сельскохозяйственной науки и техники Шаньдунской академии сельскохозяйственных наук (CXGC2019G01) и Инновационным проектом сельскохозяйственной науки и техники Шаньдунской академии сельскохозяйственных наук (CXGC2021B13).
Материалы
| Name | Company | Catalog Number | Comments |
| Abamectin | Jinan Lvba Pesticide Co. Ltd | ||
| Black-light lamps | Kanghua Medical Device Co., Ltd | ||
| Centrifugal tube box with 100 Wells | Shanghai Rebus Network Technology Co., Ltd | ||
| Centrifuge tube | Shanghai Rebus Network Technology Co., Ltd | 2 mL; Serve as bee tube | |
| Electric soldering iron | Kunshan Kaipai Hardware Electromechanical Co., Ltd | ||
| Electronic scale | Sartorius Scientific Instruments (Beijing) Co., Ltd | 3137510295 | |
| Graduated cylinder | Anhui Weiss Experimental Equipment Co. Ltd | ||
| Petri dishes (60 mm diameter) | Qingdao jindian biochemical equipment co., LTD | ||
| Pollen provision | Yantai Bifeng Agricultural Science and Technology Co. Ltd | ||
| Soft brush | Wengang Wenhai painting material factory | ||
| Solitary bees | Yantai Bifeng Agricultural Science and Technology Co. Ltd |
Ссылки
- Sgolastra, F., Tosi, S., Medrzycki, P., Porrini, C., Burgio, G. Toxicity of spirotetramat on solitary bee larvae, Osmia cornuta (hymenoptera: megachilidae), in laboratory conditions. Journal of Apicultural Science. 59 (2), 73-83 (2015).
- Wei, S. G., Wang, R., Smirle, M. J., Xu, H. L. Release of Osmia excavata and Osmia jacoti (Hymenoptera: Megachilidae) for apple pollination. TheCanadian Entomologist. 134 (3), 369-380 (2002).
- Men, X. Y., et al. Biological characteristics and pollination service of Mason bee. Chinese Journal of Applied Entomology. 55 (6), 973-983 (2018).
- Bosch, J., Kemp, W. P., Trostle, G. E. Bee population returns and cherry yields in an orchard pollinated with Osmia lignaria (Hymenoptera: Megachilidae). Journal of Economic Entomology. 99 (2), 408-413 (2006).
- Winfree, R., Williams, N. M., Dushoff, J., Kremen, C. Native bees provide insurance against ongoing honey bee losses. Ecology Letters. 10 (11), 1105-1113 (2007).
- Garibaldi, L. A., Steffan-Dewenter, I., Winfree, R. Wild pollinators enhance fruit set of crops regardless of honey bee abundance. Science. 339 (6127), 1608-1611 (2013).
- Bosch, J., Sgolastra, F., Kemp, W. P., James, R. R., Pitts-Singer, T. L. Life cycle ecophysiology of Osmia. mason bees used as crop pollinators. Bee Pollination in Agricultural Ecosystems. , 83-104 (2008).
- Liu, L., et al. Population investigation and restriction factors analyses of Osmia excavata Alfken in Jiaodong. Apiculture of China. 69 (9), 68-71 (2018).
- Biesmeijer, J. C., Roberts, S. P. M., Reemer, M. Parallel declines in pollinators and insect-pollinated plants in Britain and the Netherlands. Science. 313 (5785), 351-354 (2006).
- Potts, S. G., Biesmeijer, J. C., Kremen, C. Global pollinator declines: trends, impacts and drivers. Trends in Ecology & Evolution. 25 (6), 345-353 (2010).
- Chen, L., Yan, Q., Zhang, J., Yuan, S., Liu, X. Joint toxicity of acetamiprid and co-applied pesticide adjuvants on honeybees under semi-field and laboratory conditions. Environmental Toxicology and Chemistry. 38 (9), 1940-1946 (2019).
- Sgolastra, F., Medrzycki, P., Bortolotti, L., Renzi, M. T., Bosch, J. Synergistic mortality between a neonicotinoid insecticide and an ergosterol-biosynthesis-inhibiting fungicide in three bee species. Pest Management Science. 73 (6), 1236-1243 (2017).
- Bireley, R., et al. Preface: Workshop on pesticide exposure assessment paradigm for non-Apis bees. Environmental Entomology. 48 (1), 1-3 (2019).
- European Food Safety Authority. EFSA Guidance Document on the risk assessment of plant protection products on bees (Apis mellifera, Bombus spp. and solitary bees). EFSA Journal. 11 (7), 3295 (2013).
- Rundlof, M., et al. Seed coating with a neonicotinoid insecticide negatively affects wild bees. Nature. 521 (7550), 77-80 (2015).
- Yuan, R., et al. Toxicity and hazard assessment of six neonicotinoid insecticides on Osmia excavata (hymenoptera:megachilidae). Acta Entomologica Sinica. 61 (8), 950-956 (2018).
- Lin, Z., Meng, F., Zheng, H., Zhou, T., Hu, F. Effects of neonicotinoid insecticides on honeybee health. Acta Entomologica Sinica. 57 (5), 607-615 (2014).
- Gradish, A. E., Scott-Dupree, C. D., Cutler, G. C. Susceptibility of Megachile rotundata to insecticides used in wild blueberry production in Atlantic Canada. Journal of Pest Science. 85, 133-140 (2012).
- Hodgson, E. W., Pitts-Singer, T. L., Barbour, J. D. Effects of the insect growth regulator, novaluron on immature alfalfa leafcutting bees, Megachile rotundata. Journal of Insect Science. 11, 43 (2011).
- Konrad, R., Ferry, N., Gatehouse, A. M. R., Babendreier, D. Potential effects of oilseed rape expressing oryzacystatin-1 (OC-1) and of purified insecticidal proteins on larvae of the solitary bee Osmia bicornis. PLoS ONE. 3 (7), 2664 (2008).
- Abbott, V. A., Nadeau, J. L., Higo, H. A., Winston, M. L. Lethal and sublethal effects of imidacloprid on Osmia lignaria and clothianidin on Megachile rotundata (Hymenoptera: megachilidae). Journal of Economic Entomology. 101, 784-796 (2008).
- Yan, Z., Wang, Z. Sublethal effect of abamectin on 3rd instar larvae of Prodenia litura. Chinese Journal of Tropical Crops. 32 (10), 1945-1950 (2011).
- Song, Y., et al. Comparative ecotoxicity of insecticides with different modes of action to Osmia excavata (Hymenoptera: Megachilidae). Ecotoxicology and Environmental Safety. 212 (5), 112015 (2021).
- Chen, F. J., Wu, G., Ge, F., Parajulee, M. N., Shrestha, R. B. Effects of elevated CO2 and transgenic Bt cotton on plant chemistry, performance, and feeding of an insect herbivore, the cotton bollworm. Entomologia Experimentalis Et Applicata. 115 (2), 341-350 (2005).
- Cang, T., et al. Toxicity and safety evaluation of pesticides commonly used in strawberry production to bees. Zhejiang Agricultural Sciences. (4), 785-787 (2009).
- Cang, T., et al. Acute toxicity and safety assessment of chiral fipronil against Apis mellifera and Trichogramma ostriniae. Ecotoxicology. 7 (3), 326-330 (2012).
- Liu, X., Pan, W. Measures to ensure pollination effect and cocoon recovery rate of Osmia excavata in apple orchard. Northwest Horticulture. (3), 20-21 (2017).
- Meikle, W. G., Adamczyk, J. J., Weiss, M., Ross, J., Beren, E. Sublethal concentrations of clothianidin affect honey bee colony growth and hive CO2 concentration. Scientific Reports. 11 (1), 4364 (2021).
- Meikle, W. G., Adamczyk, J. J., Weiss, M., Ross, J., Beren, E. Sublethal concentrations of clothianidin affect honey bee colony behavior and interact with landscapes to affect colony growth. BioRxiv. , (2020).
- Wang, Y. F., et al. Combination effects of three neonicotinoid pesticides on physiology and survival of honey bees (Apis mellifera L). Journal of Environmental Entomology. 41 (3), 612-618 (2019).
- Kopit, A. M., Pitts-Singer, T. L. Routes of pesticide exposure in solitary, cavity-nesting bees. Environmental Entomology. 47 (3), 499-510 (2018).
- Cheng, Y., et al. Chronic oral toxicity of chlorpyrifos and imidacloprid to adult honey bees (Apis mellifera L). Asian Journal of Ecotoxicology. 11 (2), 715-719 (2016).
- Li, M., Ma, C., Xiao, L., Li, Z., Su, S. Effects of chlorpyrifos on behavior response of Apis mellifera and Apis cerana. Apicultural Science Association of China. , (2016).
- Cresswell, J. E. A meta-analysis of experiments testing the effects of a neonicotinoid insecticide (imidacloprid) on honey bees. Ecotoxicology. 20 (1), 149-157 (2011).
- Nauen, R., Ebbinghaus-Kintscher, U., Schmuck, R. Toxicity and nicotinic acetylcholine receptor interaction of imidacloprid and its metabolites in Apis mellifera (Hymenoptera; Apidae). Pest Management Science. 57 (7), 577-586 (2001).
- Colin, M. E., et al. A method to quantify and analyze the foraging activity of honey bees: relevance to the sublethal effects induced by systemic insecticides. Archives of Environmental Contamination and Toxicology. 47 (3), 387-395 (2004).
- Decourtye, A., et al. Comparative sublethal toxicity of nine pesticides on olfactory learning performances of the honeybee Apis mellifera. Archives of Environmental Contamination & Toxicology. 48 (2), 242-250 (2005).
- Williamson, S. M., Wright, G. A. Exposure to multiple cholinergic pesticides impairs olfactory learning and memory in honeybees. Journal of Experimental Biology. 216 (10), 1799-1807 (2013).
- Henry, M., et al. A common pesticide decreases foraging success and survival in honey bees. Science. 336 (6079), 348-350 (2012).
- Matsumoto, T. Reduction in homing flights in the honey bee Apis mellifera after a sublethal dose of neonicotinoid insecticides. Bulletin of Insectology. 66 (1), 1-9 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены