Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Идентификация гемолитической и фосфолипазной активности в сырых экстрактах из морских анемонов с помощью простых биоанализов
В этой статье
Резюме
Здесь мы описываем протокол получения экстракта сырого яда из морского анемона и выявления его гемолитической и фосфолипазной активности.
Аннотация
Состав яда морского анемона включает полипептидные и небелковые молекулы. Цитолитические компоненты обладают высоким биотехнологическим и биомедицинским потенциалом для разработки новых молекулярных инструментов. Яд морского анемона находится в железистых клетках эктодермы и субклеточных структур, называемых нематоцистами, оба из которых распределены по всему телу морского анемона. Эта характеристика подразумевает проблемы, потому что клетки и нематоцисты должны быть лизированы для высвобождения компонентов яда с другими нетоксичными молекулами. Поэтому сначала яд получают из сырого экстракта (смесь различных и разнообразных молекул и тканевого мусора). Следующим шагом является обнаружение полипептидов со специфической биологической активностью. Здесь мы описываем эффективную стратегию получения сырого экстракта морского анемона и биоанализа для выявления присутствия цитолизинов. Первый шаг включает в себя недорогие и простые методы (цикл перемешивания и замораживания-оттаивания) для высвобождения цитолизинов. Мы получили самую высокую цитолитическую активность и белок (~500 мг белка из 20 г сухого веса). Далее полипептидную сложность экстракта анализировали с помощью геля SDS-PAGE, детектирующего белки с молекулярной массой от 10 кДа до 250 кДа. В гемолитическом анализе мы использовали эритроциты овец и определяли HU50 (11,1 ± 0,3 мкг/мл). Напротив, наличие фосфолипаз в сыром экстракте определяли с помощью яичного желтка в качестве субстрата в твердой среде с агарозой. В целом, это исследование использует эффективный и недорогой протокол для приготовления сырого экстракта и применяет воспроизводимые биоанализы для идентификации цитолизинов, молекул с биотехнологическими и биомедицинскими интересами.
Введение
Морские животные являются богатым источником биологически активных соединений. В последние десятилетия состав яда морского анемона привлек научное внимание, поскольку он включает в себя разнообразие полипептидов с гемолитической, цитотоксической, ферментативной (фосфолипаза, протеаза, хитиназа) и нейротоксической активностью и ингибирующим действием на протеолитическую активность1. Кроме того, эти полипептиды являются потенциальными источниками для разработки молекулярных инструментов в биотехнологическом и терапевтическом использовании 2,3.
Существует мало сообщений о яде морского анемона и его молекулярных компонентах из-за сложности получения яда, даже выделения и характеристики токсинов. Методы экстракции, используемые в отчетах, включали лизис и опорожнение содержимого клеток, которые связаны и не связаны с производством яда1.
Особой характеристикой у всех книдарианцев является отсутствие системы производства и высвобождения яда, централизованной в единой анатомической области. Вместо этого нематоцисты представляют собой структуры, которые удерживают яд 4,5. Другие типы клеток, называемые клетками эпидермальной железы, также выделяют токсины и также распределяются по всему телу морских анемонов6.
Первой и наиболее важной проблемой в получении яда является генерация экстракта с достаточными манипуляциями в последующих процессах, без инактивации или деградации лабильных белков. Далее клетки должны быть лизированы, а компоненты — в данном случае полипептиды — должны быть эффективно и быстро экстрагированы, избегая протеолиза и гидролиза при одновременном устранении других клеточных компонентов7.
Для получения сырого экстракта морского анемона используются различные методы; некоторые из них связаны с принесением в жертву организма, в то время как другие позволяют сохранить его живым. Методы, которые подразумевают использование всего тела организма, позволяют высвобождать большинство токсинов из яда8, по сравнению с методами, которые поддерживают жизнь организмов, которые извлекают только некоторые компоненты яда9. Приготовление экстракта требует оценки присутствия и эффективности вещества, представляющего интерес, посредством специфического биоанализа, который включает в себя стратегии наблюдения фармакологических эффектов методами in vivo или in vitro 10.
Яд морского анемона содержит цитолитические полипептиды, порообразующие токсины (ПФТ)11 и фосфолипазы12; эти молекулы являются моделями в изучении белково-липидного взаимодействия, молекулярными инструментами в терапии рака и биосенсорами на основе нанопор3. Классификация ФФТ морских анемонов проводится по их размерам или молекулярной массе, от 5 кДа до 80 кДа. PFT 20 кДа, наиболее изученный и известный как актинопорины11, представляет особый интерес из-за его биомедицинского потенциала в разработке молекулярных инструментов для возможных применений в качестве противоопухолевых, противомикробных и нанопоровых биосенсоров. Другой цитолизин, включая фосфолипазы, в частности фосфолипазу A2 (PLA2)13, высвобождает жирную кислоту и гидролизует фосфолипиды, дестабилизируя клеточную мембрану. Благодаря такому механизму действия PLA2 обещает стать важной моделью для изучения и применения при воспалительных заболеваниях. Он может служить моделью для исследований поведения липидов в клеточной мембране14.
Здесь мы описываем эффективный протокол получения сырого экстракта из морского анемона Anthopleura dowii Verrill, 1869, и обнаружения гемолизинов и фосфолипаз. Оба являются релевантными токсинами, которые могут быть использованы в качестве шаблона для разработки новых молекулярных инструментов.
протокол
Морские анемоны были собраны в соответствии с руководящими принципами Национальной комиссии по аквакультуре, рыболовству и продовольствию федерального правительства Мексики (номер разрешения PPF / DGOPTA 07332.250810.4060). Комитет по биоэтике Института биотехнологии Национального автономного университета Мексики одобрил все эксперименты с морскими анемонами. Образец овечьей крови был приобретен в Центре практического обучения и исследований в области животноводства и здоровья (CEPIPSA, Национальный автономный университет Мексики).
1. Сбор организмов
- Собирают морского анемона A. dowii.
ПРИМЕЧАНИЕ: Здесь организмы были собраны во время периодов отлива в приливной зоне у побережья Энсенада-Баха, Калифорния, Мексика (рисунок 1A,B). - Транспортируйте организмы в лабораторию в контейнерах с морской водой (рисунок 1С).
- В лаборатории очистите организмы дистиллированной водой вручную, чтобы удалить крупные частицы субстрата, прилипшие к телу.
- Немедленно заморозьте организмы при -80 °C в ультра-морозильной камере в течение 72 ч.
- Поместите организмы в специальные стаканы для сублимационной сушки, с условиями лиофилизации -20 °C, 0,015 psi, на 48 ч.
- Хранить лиофилизированные организмы при -20 °C до использования.
2. Гидратация тканей
- Восстановите 20 г сухой массы лиофилизированных организмов с 60 мл (1/3 вт/об) 50 мМ натрийфосфатного буфера, рН 7,5 и 1 таблеткой ингибитора коктейля (Таблица материалов).
- В магнитной мешалке непрерывно перемешивайте образец при ~800 об/мин, 4 °C, в течение 12 ч.
3. Высвобождение токсинов
- Чтобы вызвать лизис клеток и сброс нематоцисты, заморозьте образец при -20 °C в течение 12 ч, а затем поместите контейнер в воду комнатной температуры (RT) до тех пор, пока он не оттает до 90%. Повторите эту процедуру три раза.
ПРИМЕЧАНИЕ: Образец не оттаивает на 100%; крайне важно поддерживать образец при температуре ~4 °C, чтобы предотвратить деградацию белка. - Наблюдайте за нематоцистой, разряженной под конфокальным микроскопом. Возьмите 10 мкл образца на слайде и поместите поверх него крышку. Наблюдайте под конфокальным микроскопом при 100-кратном и 60-кратном увеличении. Здесь краситель был не нужен.
- Обрабатывайте изображения, полученные в конфокальном микроскопе, в программном обеспечении ImageJ (версия 1.53c, Wayne Rasband, National Institutes of Health, США, https://imagej.nih.gov/ij).
- Если каналец внутри нематоцисты отматывается и находится снаружи, нематоцисты разряжаются; затем перейдите к следующему шагу. В противном случае проведите только еще один цикл замораживания-оттаивания.
- Чтобы осветлить экстракт, центрифугируйте образец при 25 400 х г в течение 40 мин, 4 °C, извлеките супернатант и снова центрифугируйте его. Повторите этот шаг 3-4 раза.
- Восстановите супернатант и выбросьте гранулу. Супернатант или сырой экстракт содержит компоненты яда (токсины) и другие клеточные молекулы, такие как липиды, углеводы и нуклеиновые кислоты.
4. Количественное определение общего белка
- Определите концентрацию белка в сыром экстракте с помощью коммерческого набора колориметрического анализа Брэдфорда15 (Таблица материалов).
- Разбавить реагент красителя (одну часть красителя четырьмя частями дистиллированной воды).
- Готовят раствор бычьего сывороточного альбумина (BSA) фракции V (Таблица материалов) в концентрации 1 мг/мл в фосфатном буфере (50 мМ фосфата натрия, рН 7,5).
- Подготовьте растворы, перечисленные в таблице 1 , в трех экземплярах.
- Энергично перемешайте каждый раствор в шейкере в течение 4 с.
- Инкубировать образцы в течение 5 мин на RT, не встряхивая.
- Измерьте поглощение (AU) при 595 нм.
- Постройте средние значения абсорбции BSA образца (AU против концентрации белка) и определите уравнение графика (уравнение 1).
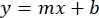 Уравнение 1
Уравнение 1
где y — поглощение, m — наклон линии, x — концентрация белка, а b — y-перехват. Чтобы рассчитать концентрацию сырого экстракта, решите для x следующим образом: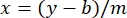 Уравнение 2
Уравнение 2
5. Определение сложности полипептидного яда
- Соберите стеклянный контейнер для вертикального гелевого электрофореза в соответствии с инструкцией.
- Готовят акриламидную смесь (30%): 29,2 г акриламида, 0,8 г бис-акриламида, конечный объем 100 мл. Отфильтруйте раствор с помощью мембраны 0,45 мкм. Хранить раствор в темном флаконе при температуре 4 °C. Затем подготовьте смесь для рассасывающего геля (табл. 2).
- Гель SDS-PAGE состоит из разрешающего геля и геля для укладки. Приготовьте гели в соответствии с объемами раствора, определенными в таблице 2. Во время приготовления убедитесь, что каждая смесь поддерживается при 4 °C, чтобы сократить время полимеризации.
ПРИМЕЧАНИЕ: Объем каждой смеси варьируется в зависимости от марки используемого оборудования; для данного протокола объемы соответствуют приготовлению 15% акриламидного геля толщиной 0,75 мм, для вертикальной камеры электрофореза (Таблица материалов). - После того, как акриламид полимеризуется, ~10 мин, добавляют смесь укладочного геля.
- Подготовьте смесь для укладки геля, сразу же добавьте ее на стеклянные пластины и поместите гребень для формирования колодцев для загрузки образцов.
- После того, как гель для укладки полимеризуется (~ 15 мин), снимите гребень и поместите стеклянный контейнер в камеру для вертикального электрофореза.
- Поместите 200 мл электродного буфера (0,25 M Tris, 0,192 M глицина, 0,1% SDS) в камеру электрофореза.
- Анализ сырого экстракта: Смешайте 30 мкг сырого экстракта с 5 мкл белкового нагрузочного буфера (25% глицерина, 15% додецилсульфата натрия, 25% 2-меркаптоэтанола, 0,125 мМ Tris pH 7, бромфенол-синего 0,1 мг/мл) для денатуры белков. Конечный объем должен составлять <50 мкл.
- Нагревать при 90 °C в течение 5 мин, охлаждать и центрифугу в течение 3 с при 1 400 х г.
- Загрузите образцы в колодцы укладочного геля. Загрузите стандартную молекулярно-весовую лестницу.
- Запускают электрофорез при константе 25 мА в течение 1 ч 30 мин.
- Извлеките стеклянные контейнеры из камеры электрофореза, чтобы продолжить окрашивание гелевых белков.
6. Белковое окрашивание
- Промойте гель в 50 мл дистиллированной воды, чтобы удалить мусор с буферного электрода.
- Выбросьте воду.
- Чтобы избежать диффузии белков геля, добавляют раствор для фиксации (60 мл этанола, 20 мл уксусной кислоты и 20 мл дистиллированной воды, конечный объем 100 мл). Инкубировать на RT в течение 40 мин с встряхиванием при 80 об/мин. Декантируйте раствор.
- Добавляют белковый сшивающий раствор (15 мл этанола, 0,25 мл глутаральдегида, 50 мл дистиллированной воды, конечный объем 65,25 мл) и инкубируют в течение 30 мин на РТ с встряхиванием при 80 об/мин. Удалите раствор.
- Вымойте гель 100 мл дистиллированной воды в течение 5 минут и удалите воду. Повторите эту процедуру четыре раза.
- Проводят белковое окрашивание 50 мл раствора Coomassie бриллиантового синего R-250 (40% метанол, 10% уксусная кислота, 50% дистиллированная вода, 0,1% краситель, конечный объем 100 мл), перемешивание при 60 об/мин в лабораторном ротационном генераторе при РТ в течение 15 мин.
- Восстановите раствор, который можно использовать для окрашивания других гелей.
- Для устранения избытка красителя добавляют очищающий раствор (40 мл метанола, 10 мл уксусной кислоты, 50 мл дистиллированной воды). Продолжайте помешивать (80 об/мин) при RT до тех пор, пока полосы (окрашенные белки) не визуализируются.
- Храните гель в 50 мл дистиллированной воды и сканируйте изображение в системе документирования геля.
7. Приготовьте раствор эритроцитов
- Извлеките 1 мл крови из яремной вены овцы.
- Извлеките иглу из шприца и немедленно слейте кровь в пробирку с 50 мл раствора Alsever (0,002 М лимонной кислоты, 0,07 М NaCl, 0,1 М декстрозы и 0,027 М цитрата натрия в качестве антикоагулянта, рН 7,4).
- Медленно переворачивайте раствор три раза.
- Хранить при температуре 4 °C для передачи в лабораторию.
- Центрифугу при 804 х г в течение 5 мин при 4 °С и выбросьте супернатант.
- Повторно суспендировать гранулу в 30 мл раствора Alsever. Добавьте раствор, сдвинув его по внутренним стенкам трубки и, используя пластиковую пипетку Пастера, медленно повторно суспендируйте клетки. Центрифуга снова при 804 х г в течение 5 мин, 4 °C. Повторяйте эту процедуру до тех пор, пока не прояснится супернатант.
- Добавить 15 мл раствора Alsever; медленно восстанавливайте гранулы пластиковой пипеткой Pasteur.
- Поддерживают конечный объем раствора Alsever для достижения концентрации 2 х 106 клеток/мл, приблизительно. Затем используйте камеру Нойбауэра или гемоцитометр для подсчета клеток.
ПРИМЕЧАНИЕ: Подсчитайте эритроциты в гемацитометрическом слайде (улучшенный Neubauer). Затвор представляет собой слайд размером 30 мм x 70 мм x 4 мм. Центр имеет две серебряные подножки (рисунок 2A) (одна верхняя и одна нижняя сетка), каждая 3 мм х 3 мм, и два канала по бокам сетки. Подсчет ячеек находится в угловом и центральном квадратах (красные квадраты на рисунке 2B). Оптимальная концентрация клеток для подсчета должна быть порядка 106 клеток. Центральная коробка имеет площадь поверхности 0,1см2, что эквивалентно 0,0001 мл. - Поместите крышку поверх слайда.
- Поместите 10 мкл образца между слайдом и крышкой и подождите, пока образец распределится.
- В оптическом микроскопе (увеличение 60x) выполните подсчет в первой квадратной коробке. Подсчитывайте только ячейки в центральной сетке и те, которые касаются верхнего или левого поля поля.
- Определите концентрацию клеток с помощью следующего уравнения:
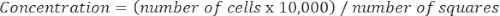 Уравнение 3
Уравнение 3
Если образец очень концентрированный и требуется разбавление, то используйте следующее уравнение: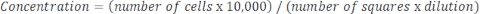 Уравнение 4
Уравнение 4
ПРИМЕЧАНИЕ: При взятии раствора эритроцитов для гемолиза медленно гомогенизируйте раствор пластиковой пипеткой Пастера. - Выполните действия в трех экземплярах, чтобы уменьшить количество ошибок.
8. Гемолизный анализ
- Готовят раствор смеси (в трех экземплярах), указанные в таблице 3 , в конических 96-луночных пластинах.
ПРИМЕЧАНИЕ: Медленно перемешайте эритроциты, чтобы сохранить однородную суспензию. - Инкубировать в течение 1 ч при 37 °C, не встряхивая.
- Центрифугировать пластину при 804 х г в течение 5 мин при 4 °C.
- Восстановите супернатант в другой 96-луночной плите с плоским дном.
- Если сырой экстракт содержит цитолизины, эритроциты будут лизироваться и высвобождать гемоглобин. Считывается поглощение при 415 нм.
- Рассчитайте процент гемолиза, используя следующее уравнение:
% Гемолиз = ((Acrude extract-AAlsever буфер) / (AH2O-AAlsever)) x 100
ПРИМЕЧАНИЕ: Экстракт Acrude, буфер AAlsever и AH2O соответствуют абсорбции эритроцитов с сырым экстрактом, абсорбции раствора Alsever и абсорбции дистиллированной воды, соответственно. - Выполняйте тест гемолиза до и после каждого цикла замораживания и оттаивания с 50 мкг общего белка из сырого экстракта.
- Определить количество циклов замораживания и оттаивания, необходимых для достижения 100% гемолитической активности.
- Рассчитать количество экстракта, который производит гемолиз в 50% эритроцитов (HU50); следовать тому же протоколу, описанному в таблице 3, увеличить количество сырой добычи морских анемонов и спроектировать участок с сигмоидальными корректировками с использованием соответствующего программного обеспечения (например, Origin, Table of Materials).
9. Анализ фосфолипазы
- Вымойте одно куриное яйцо с 1% SDS в дистиллированной воде.
- Отделите яичный желток от яичного белка в стерильных условиях.
- Приготовьте 50 мл 0,86% раствора NaCl и процедите через фильтр 0,22 мкм. Затем приготовьте раствор А: добавьте 12 мл яичного желтка и 36 мл 0,86% раствора NaCl.
- Приготовить раствор В: Смешать 300 мг агарозы в 50 мл буфера (50 мМ Tris, рН 7,5), процедить через фильтр 0,22 мкм. Разогрейте раствор в микроволновой печи до кипения. Охладить в теплой воде до 43-45°C.
- Подготовьте раствор C: Подготовьте 10 мМ CaCl2 и процедите его фильтром 0,22 мкм.
- Приготовить раствор D: 10 мг родамина 6 г в 1 мл дистиллированной воды.
- В стерильных условиях (ламинарный проточный колпак) добавьте 500 мкл растворов А и С к раствору В и 100 мкл раствора D, перемешайте и влейте 25 мл в каждую чашку Петри (90 х 15 мм).
- Дождитесь затвердевания раствора в стерильных условиях (30 мин).
- Сделайте лунки (~2-3 мм диаметром) с тонкой трубкой.
- Добавьте в общей сложности 20 мкл фосфатного буфера (отрицательный контроль) в одной лунке и 20 мкл определенной фосфолипазы (положительный контроль) в другой скважине.
- Поместите различные количества сырого экстрактного белка, 5, 15, 25, 35, 45 мкг, в оставшиеся скважины, каждая в конечном объеме 20 мкл.
- Подождите, пока агар адсорбирует все образцы (30 мин).
- Инкубировать при 37 °C в течение 20 ч.
- Если вокруг колодца образуется ореол, это свидетельствует об активности фосфолипазы. Измерьте ореол, образованный суппортом Вернье.
ПРИМЕЧАНИЕ: Выполните эксперимент в трех экземплярах (шаги из 9.1-9.14).
Результаты
Репрезентативные результаты протокола, использованные для получения сырого экстракта морского анемона, показали, что сочетание двух методов (перемешивание и циклы замораживания и оттаивания) приводило к эффективному разгрузке нематоцист, а общее количество белка составляло 500 мг (8 м?...
Обсуждение
Высокий спрос на новые соединения с применением в различных областях науки и промышленности привел к изучению яда. Яд представляет собой богатый источник молекул, который служит шаблоном для генерации новых молекулярных инструментов. Однако сложность этих ядов требует реализации и с?...
Раскрытие информации
Авторы заявляют, что у них нет конкурирующего интереса в отношении публикации данной статьи.
Благодарности
Эта работа была поддержана Программой апойо проекта исследований и инноваций в области технологий (PAPIIT) с номером гранта IT200819. Авторы выражают признательность Тому Масселману, Rock Paper Editing, LLC, за проверку английской грамматики этой рукописи; и техническая помощь Саманты Хименес (СИСЕСЕ, Энсенада) и Хуана Мануэля Барбосы Кастильо (Институт физики Селулара, УНАМ). Мы также благодарим д-ра Аугусто Сезара Лизаразо Чапарро (CEPIPSA) за получение овечьей крови. Мы особенно благодарим д-ра Хосе Санигера Блесу, ICAT-UNAM, за оборудование в его лаборатории для видеозаписи.
Материалы
| Name | Company | Catalog Number | Comments |
| 15 mL conical centrifuge tube | Corning | 430766 | |
| 2-Bromophenol blue | Sigma | B75808 | |
| 2-mercaptoetanol | Sigma-Aldrich | M6250-100ML | |
| 50 mL conical centrifuge tubes | Corning | 430828 | |
| Acetic Acid Glacial | J.T. Baker | 9515-03 | |
| Acrylamide | Promega | V3115 | |
| Agarose | Promega | V3125 | |
| Bisacrylamide | Promega | V3143 | |
| Bovine Serum Albumin Fraction V | Sigma | A3059-100G | |
| Bradford Protein Assays | Bio-Rad | 5000006 | |
| Calcium chloride | Sigma-Aldrich | C3306 | |
| Cell culture plates 96 well, V-bottom | Corning | 3894 | |
| Centrifuge | Eppendorf | 5804R | |
| Centrifuge tubes | Corning | CLS430829 | |
| ChemiDoc MP system | Bio-Rad | 1708280 | |
| Citric acid | Sigma-Aldrich | 251275 | |
| Clear flat.bottom 96-Well Plates | Thermo Scientific | 3855 | |
| Coomassie Brilliant Blue G-250 | Bio-Rad | #1610406 | |
| Coomassie brilliant blue R-250 | Bio-Rad | 1610400 | |
| Dextrose | J.T. Baker | 1916-01 | |
| Ductless Enclosure | Labconco | Vertical | https://imagej.nih.gov/ij ImageJ 1.53c |
| Gel Doc EZ | Bio Rad. | Gel Documentation System | |
| Glycerol | Sigma-Aldrich | G5516-4L | |
| Hemocytometer | Marienfeld | 650030 | |
| ImageJ (Software) | NIH, USA | Version 1.53c | |
| Incubator 211 | Labnet | I5211 DS | |
| Methanol | J.T. Baker | 9049-03 | |
| Mini-PROTEAN tetra cell | Bio-Rad | 1658000EDU | |
| Na2HPO4 | J.T. Baker | 3824-01 | |
| NaCl | J.T. Baker | 3624-01 | |
| NaH2PO4.H2O | J.T. Baker | 3818-05 | |
| Origin software | version 9 | To design the plot with sigmoidal adjustments | |
| Petridish | Falcon | 351007 | |
| Pipetman kit | Gilson | F167380 | |
| Precast mini gel | BioRad | 1658004 | |
| Prestained Protein Ladder | Thermo Scientific | 26620 | |
| Protease Inhibitor Cocktail | Roche | 11836153001 | |
| Protein Assay Dye Reagent Concentrate | Bio-Rad | 5000006 | |
| Rhodamine 6G | Sigma-Aldrich | 252433 | |
| SDS | Sigma-Aldrich | L4509 | |
| Sodium citrate dihydrate | JT Baker | 3646-01 | |
| Spectrophotometer | THERMO SCIENTIFIC | G10S UV-VIS | |
| Tris Base | Sigma-Aldrich | 77-86-1 | |
| Volt Power Supply | Hoefer | PS300B |
Ссылки
- Frazão, B., Vasconcelos, V., Antunes, A. Sea anemone (Cnidaria, Anthozoa, Actiniaria) toxins: an overview. Marine Drugs. 10 (8), 1812-1851 (2012).
- Jayathilake, J. M. N. J., Gunathilake, K. V. K. Cnidarian toxins: recent evidences for potential therapeutic uses. The European Zoological Journal. 87 (1), 708-713 (2020).
- Ramírez-Carreto, S., Miranda-Zaragoza, B., Rodríguez-Almazán, C. Actinoporins: From the structure and function to the generation of biotechnological and therapeutic tools. Biomolecules. 10 (4), 539 (2020).
- Fautin, D. G. Structural diversity, systematics, and evolution of cnidae. Toxicon. Official Journal of the International Society on Toxinology. 54 (8), 1054-1064 (2009).
- Moran, Y., et al. Analysis of soluble protein contents from the nematocysts of a model sea anemone sheds light on venom evolution. Marine Biotechnology. 15 (3), 329-339 (2013).
- Moran, Y., et al. Neurotoxin localization to ectodermal gland cells uncovers an alternative mechanism of venom delivery in sea anemones. Proceedings of the Royal Society B: Biological Sciences. 279 (1732), 1351-1358 (2012).
- Grabski, A. C. Advances in preparation of biological extracts for protein purification. Methods in Enzymology. 463, 285-303 (2009).
- Bulati, M., et al. Partially purified extracts of sea anemone Anemonia viridis affect the growth and viability of selected tumour cell lines. BioMed Research International. 2016, 3849897 (2016).
- Orts, D. J. B., et al. Biochemical and electrophysiological characterization of two sea anemone type 1 potassium toxins from a geographically distant population of Bunodosoma caissarum. Marine Drugs. 11 (3), 655-679 (2013).
- Hader, D., Erzinger, G. . Bioassays: Advanced Methods and Applications. , (2017).
- Anderluh, G., Macek, P. Cytolytic peptide and protein toxins from sea anemones (Anthozoa: Actiniaria). Toxicon: Official Journal of the International Society on Toxinology. 40 (2), 111-124 (2002).
- Nevalainen, T. J., et al. Phospholipase A2 in cnidaria. Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 139 (4), 731-735 (2004).
- Razpotnik, A., et al. A new phospholipase A2 isolated from the sea anemone Urticina crassicornis - its primary structure and phylogenetic classification. The FEBS Journal. 277 (12), 2641-2653 (2010).
- Dennis, E. A., Cao, J., Hsu, Y. -. H., Magrioti, V., Kokotos, G. Phospholipase A2 enzymes: Physical structure, biological function, disease implication, chemical inhibition, and therapeutic intervention. Chemical Reviews. 111 (10), 6130-6185 (2011).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Kwon, Y. -. C., Jewett, M. C. High-throughput preparation methods of crude extract for robust cell-free protein synthesis. Scientific Reports. 5, 8663 (2015).
- Eno, A. E., Konya, R. S., Ibu, J. O. Biological properties of a venom extract from the sea anemone, Bunodosoma cavernata. Toxicon: Official Journal of the International Society on Toxinology. 36 (12), 2013-2020 (1998).
- Morales-Landa, J. L., et al. Antimicrobial, antiprotozoal, and toxic activities of Cnidarian extracts from the Mexican Caribbean Sea. Pharmaceutical Biology. 45 (1), 37-43 (2007).
- Sánchez-Rodríguez, J., Cruz-Vazquez, K. Isolation and biological characterization of neurotoxic compounds from the sea anemone Lebrunia danae (Duchassaing and Michelotti, 1860). Archives of Toxicology. 80 (7), 436-441 (2006).
- de Oliveira, J. S., et al. Caissarolysin I (Bcs I), a new hemolytic toxin from the Brazilian sea anemone Bunodosoma caissarum: purification and biological characterization. Biochimica Et Biophysica Acta. 1760 (3), 453-461 (2006).
- Norton, R. S., et al. Purification and characterisation of proteins with cardiac stimulatory and haemolytic activity from the anemone Actinia tenebrosa. Toxicon: Official Journal of the International Society on Toxinology. 28 (1), 29-41 (1990).
- Gondran, M., Eckeli, A. L., Migues, P. V., Gabilan, N. H., Rodrigues, A. L. S. The crude extract from the sea anemone, Bunodosoma caissarum elicits convulsions in mice: possible involvement of the glutamatergic system. Toxicon: Official Journal of the International Society on Toxinology. 40 (12), 1667-1674 (2002).
- Dion, A. S., Pomenti, A. A. Ammoniacal silver staining of proteins: mechanism of glutaraldehyde enhancement. Analytical Biochemistry. 129 (2), 490-496 (1983).
- Ramírez-Carreto, S., et al. Identification of a pore-forming protein from sea anemone Anthopleura dowii Verrill (1869) venom by mass spectrometry. The Journal of Venomous Animals and Toxins Including Tropical Diseases. 25, 147418 (2019).
- Nelson, G. J. Studies on the lipids of sheep red blood cells. I. Lipid composition in low and high potassium red cells. Lipids. 2 (1), 64-71 (1967).
- Ramírez-Carreto, S., et al. Transcriptomic and proteomic analysis of the tentacles and mucus of Anthopleura dowii Verrill, 1869. Marine Drugs. 17 (8), 436 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены