Method Article
Выделение и идентификация мезенхимальных стволовых клеток костного мозга свиньи и их производных внеклеточных везикул
В этой статье
Резюме
В данной статье разработан метод выделения и идентификации мезенхимальных стволовых клеток костного мозга свиней (pBM-MSCs) и полученных из них внеклеточных везикул (EVs), обеспечивающий методологическую основу для доклинической оценки эффективности трансплантации BM-MSCs и их производных EV.
Аннотация
С развитием терапии стволовыми клетками в трансляционных исследованиях и регенеративной медицине мезенхимальные стволовые клетки костного мозга (БМ-МСК), как разновидность плюрипотентных стволовых клеток, пользуются популярностью благодаря их мгновенной доступности и доказанной безопасности. Сообщалось, что трансплантация БМ-МСК имеет большое значение для восстановления поврежденных тканей при различных заболеваниях, что может быть связано с модуляцией иммунных и воспалительных реакций через паракринные механизмы. Внеклеточные везикулы (ВВ), имеющие двухслойную структуру липидной мембраны, считаются основными медиаторами паракринных эффектов стволовых клеток. Признанные за их решающую роль в клеточной коммуникации и эпигенетической регуляции, ВВ уже были применены in vivo для иммунотерапии. Однако, как и в случае с материнскими клетками, большинство исследований эффективности трансплантации ВВ все еще остаются на уровне мелких животных, чего недостаточно для предоставления существенных доказательств для клинической трансляции. В данной работе мы используем центрифугирование с градиентом плотности для выделения клеток костного мозга (БМК) из костного мозга свиньи на начальном этапе, а затем получения БМ-МСК свиней (pBM-МСК) с помощью клеточной культуры, идентифицированной по результатам наблюдения под микроскопом, индуцированного анализа дифференцировки и проточной цитометрии. Кроме того, мы изолируем EV, полученные из pBM-MSCs, в надосадочной жидкости клеток с помощью ультрацентрифугирования, что успешно доказано методами просвечивающей электронной микроскопии (TEM), анализа отслеживания наночастиц (NTA) и вестерн-блоттинга. В целом, pBM-MSCs и их производные EV могут быть выделены и эффективно идентифицированы с помощью следующих протоколов, которые могут быть широко использованы в доклинических исследованиях эффективности трансплантации BM-MSC и их производных EV.
Введение
За последние 10 лет терапия стволовыми клетками обещала большую пользу пациентам, страдающим от различных заболеваний и травм, таких как травмы, респираторные и сердечно-сосудистые заболевания. По мере прогресса в этой области, мезенхимальные стволовые клетки костного мозга (БМ-МСК) постепенно завоевывают популярность у людей за их доступность и небольшое количество этических споров1, которые считаются золотым стандартом для клинических исследований, несмотря на другие типы клеток2. Методы лечения, основанные на МСК-БМ, также привлекательны для все большего числа исследователей благодаря их уникальной способности модулировать иммунные и воспалительные реакции и восстанавливать поврежденные ткани с помощью дифференцировки или паракринныхмеханизмов.
Внеклеточные везикулы (ВВ), как утверждает Международное общество внеклеточных везикул (ISEV)4, относятся к общим частицам с липидной бислойной структурой, которые естественным образом высвобождаются из клеток. С недавними открытиями различных компонентов, таких как белки, липиды и генетические материалы (например, микроРНК, мРНК, молекулы ДНК, а также длинные некодирующие РНК) в ВВ из различных типов клеток5, была признана их решающая роль в клеточной коммуникации и эпигенетической регуляции6. В качестве нового заменителя материнских клеток ВВ применяются в иммунотерапии и регенеративной медицине с исследованиями in vivo, которые служат основой для продолжающихся доклинических исследований и последующих клинических испытаний7.
Однако в настоящее время большая часть исследований по эффективности трансплантации БМ-МСК и их производных ВВ все еще остается на уровне мелких животных, которых недостаточно для получения необходимых доказательств для клинической трансляции. В связи с этим крайне актуальным является проведение доклинических исследований по трансплантации БМ-МСК и их производных ВВ на уровне крупных животных, таких как свиньи.
Сообщалось, что МСК присутствуют в чрезвычайно низком количестве в костном мозге, составляя всего от 0,01% до 0,001% от общегочисла клеток8. Однако для доклинического введения БМ-МСК требуется большое количество клеток (≥10,7 на животное)9; количество необходимых ВВ еще больше, средняя доза которых составляет 0,25 мг белка на килограмм массы тела у10 свиней. Для достижения этих больших цифр существует острая необходимость в безопасном и эффективном методе выделения и культивирования МСК из костного мозга свиньи для достижения их массивного расширения in vitro и последующего получения их ВВ с высокой концентрацией белка.
На сегодняшний день существуют различные методы выделения BM-MSC и производных от них EV. Современные методы выделения БМ-МСК включают прямую посадку клеток костного мозга (БМК)11, центрифугирование по градиенту плотности, сортировку молекулярных меток на поверхности клетки и скрининг проточной цитометрии. Сообщалось, что сортировка молекулярных меток на поверхности клетки и скрининг проточной цитометрии приводят к снижению скорости клеточной адгезии, увеличению смертности за 24 часа и ингибированиюпролиферации12, в то время как прямое культивирование BMC может привести к высокому количеству смешанных гемопоэтических клеток. Таким образом, центрифугирование с градиентом плотности в настоящее время широко используется для получения BM-MSC. Современные методы выделения EV из надосадочной жидкости клеток включают ультрацентрифугирование, ультрафильтрацию, осаждение полимеров и исключение размера13. По сравнению с другими методами, ультрацентрифугирование имеет преимущество в низкой стоимости, простоте использования и совместимости с подготовкой больших объемов без сложной предварительной обработки, что является «золотым стандартом» для разделения EV14. Тем не менее, существует большая неоднородность в реагентах и методах в различных лабораториях втечение процесса, что может ввести читателей в заблуждение. В данной статье подробно описывается ряд последовательных шагов по выделению pBM-MSC и полученных из них EV, а последующие результаты идентификации доказывают, что метод осуществим для получения pBM-MSC и их EV для дальнейшего анализа в доклинических исследованиях. Мы надеемся, что эта систематическая работа может послужить методологической основой для исследователей, занимающихся доклинической оценкой трансплантации pBM-MSCs и их производных EV, чтобы клинические испытания могли быть проведены как можно скорее.
протокол
Согласно Руководству по уходу и использованию лабораторных животных, опубликованному Национальным институтом здравоохранения США, все экспериментальные процедуры были одобрены Комитетом по институциональному уходу за животными и их использованию (IACUC), больницей Фувай, Китайской академией медицинских наук.
1. Предоперационная подготовка животных
- Приобретите взрослых самцов китайских минипигов (30 ± 5 кг) в возрасте около 12 месяцев из Института зоологии Китайской академии наук и разместите их в помещениях Экспериментального центра для животных больницы Фувай, по крайней мере, за 2 недели. Проводите предоперационные осмотры, такие как регулярные исследования крови, чтобы убедиться, что животные здоровы.
- Очистите и побрейте кожу в области бедер минипига за день до операции. Чтобы избежать аспирации, голодайте на мини-пиги в течение 12 ч перед экстракцией костного мозга.
2. Подготовка к выделению и культивированию клеток
- Используйте метод Перколла (1,130 г/мл) для выделения мезенхимальных стволовых клеток из костного мозга. Смешайте исходный раствор с 10-кратным концентрированным PBS в соотношении 9:1 для получения изотонической среды. Затем смешайте изотоническую среду с PBS в соотношении 3:2 для получения 60% раствора Percoll (1,077 г/мл), который можно использовать в качестве окончательного разделительного раствора для выделения pBM-MSCs.
- Приготовьте модифицированную среду Dulbecco's Medium (IMDM) от Iscove с 10% эмбриональной бычьей сывороткой и 1,0% пенициллин-стрептомицином для получения полноценной среды. Предварительно нагрейте всю среду и PBS на водяной бане при температуре 37 °C для последующего культивирования клеток.
3. Обезболивание животных
- Введите общую анестезию кетамином (10 мг/кг) и ксилазином (2 мг/кг) внутримышечно. Проводите эндотрахеальную интубацию быстро, когда у минипига медленное дыхание и меньшая активность конечностей, и сохраняйте спонтанное дыхание, чтобы предотвратить неудачную интубацию.
- Поддерживающую анестезию проводят путем ингаляции 2% изофлурана с кислородом (1,5 л/мин) в качестве газа-носителя. Во время анестезии контролируйте частоту сердечных сокращений, дыхание и насыщение крови крови кислородом в режиме реального времени.
4. Извлечение костного мозга из минипига
- Поместите минипига в боковое положение. Чтобы обеспечить достаточное количество костного мозга для последующей культивирования клеток, расположите точку пункции костного мозга в проксимальном отделе бедренной кости минипига (рис. 1). Перед проведением операции продезинфицируйте и подкините кожу области прокола.
- Подтяните кожу вокруг точки прокола недоминирующей рукой и проткните иглу биопсии костного мозга вертикально в этой точке доминирующей рукой. При ощущении контакта иглы с кортикальной костью осторожно поворачивайте ручку влево и вправо, чтобы просверлить иглу. При попадании иглы в полость костного мозга часто возникает ощущение потери сопротивляемости.
- После того, как прокол будет на месте, извлеките иглу стержня. Затем приложите одноразовый стерильный шприц объемом 50 мл к концу наружной иглы, и предварительно промойте внутреннюю стенку шприца гепарином.
- Медленно извлеките 20 мл костного мозга и осторожно переложите их в стерильную центрифужную пробирку объемом 50 мл.
- Когда процедура будет завершена, вытащите иглу и снимите простыню. Продезинфицируйте место прокола и прижмите его на 20 минут для гемостаза.
- Экстубируйте минипига после восстановления спонтанного дыхания. Когда он полностью придет в себя со свободным движением конечностей, верните минипига в клетку для продолжения кормления.
5. Выделение мезенхимальных стволовых клеток из костного мозга
- Добавьте равный объем разогретых ПБС в костный мозг и тщательно перемешайте их. Затем с помощью стерильной пипетки осторожно перенесите 20 мл разбавленного костного мозга выше уровня градиента плотности 60% раствора в соотношении 1:1 по объему в стерильную центрифужную пробирку объемом 50 мл.
- Центрифугируйте пробирку при 600 x g (ускорение (ACC) = 5, замедление (DEC) = 5) в течение 20 мин при комнатной температуре (RT).
ПРИМЕЧАНИЕ: После центрифугирования в пробирке образуются четыре фазы, включая фазу сыворотки, фазу мононуклеарной клетки, фазу среды с градиентом плотности и фазу осаждения сверху вниз. Фаза мононуклеарной клетки представляет собой тонкий флокулянтный слой между сывороткой и средой градиента плотности. Мезенхимальные стволовые клетки, полученные из костного мозга, находятся в этой фазе. - Наберите фазу мононуклеарной клетки в стерильную центрифужную пробирку объемом 15 мл и дважды промойте PBS при плотности 800 x g в течение 5 минут.
- Повторно суспендируйте промытые клетки в 2 мл готовой среды и посадите ресуспендированные клетки в колбу для культуры2 см размером 175 см с плотностью 3-5 x 105/мл.
ПРИМЕЧАНИЕ: Все вышеуказанные процедуры выделения мезенхимальных стволовых клеток можно увидеть на рисунке 2.
6. Культивирование мезенхимальных стволовых клеток in vitro
- Инкубировать колбу с культурой при температуре 37 °C в насыщенной увлажненной атмосфере с содержанием 5%СО2. Осторожно встряхивайте колбу с культурой каждые 24 часа, чтобы предотвратить адгезивный рост осажденных гемопоэтических стволовых клеток, и наблюдайте за ростом, морфологией и контаминацией клеток под микроскопом.
- Заменяйте питательную среду в первый раз через 3 дня, а затем меняйте среду каждые 2-3 дня. Когда клеточные колонии достигнут 80%-90% слияния, субкультивируйте клетки в соотношении 1:2.
7. Адипогенная, остеогенная и хондрогенная дифференцировка пБМ-МСК
- Адипогенный дифференцировочный анализ
- Приготовьте среду для адипогенной дифференцировки А (среда А) и В (среда В) для БМ-МСК в соответствии с инструкцией к набору. Конкретную информацию о наборе можно найти в Таблице материалов.
- Добавьте 1 мл 0,1% желатина в шестилуночную пластину и осторожно встряхните, чтобы она могла равномерно покрыть дно каждой лунки. Затем поместите планшет с шестью лунками в чистый стол или инкубатор сCO2 не менее чем на 30 минут.
- Через 30 минут отсадите желатин и добавьте по 2 мл общей готовой среды в каждую лунку. Затем посадите pBM-MSCs в шестилуночный планшет с плотностью ячеек 2 x 104 ячейки/см2. После этого инкубируйте тарелку при температуре 37 °C в насыщенной влажности 5%CO2.
- Когда клетки достигнут 100% слияния, осторожно удалите всю среду и добавьте по 2 мл среды А в каждую лунку планшета. Через 3 дня достаньте Medium A из тарелки и добавьте по 2 мл Medium B в каждую лунку.
- После выдержки в течение 1 дня удалите среду B и замените ее средой A для индукции. В соответствии с принципом «Среда А в течение 3 дней, среда В в течение 1 дня» используйте среду А и В последовательно для индукции.
- Наблюдайте за состоянием клеток каждый день в течение периода. Если клетки сжимаются или умирают в процессе индукции среды А, замените ее средой В до тех пор, пока состояние клеток не восстановится.
- Повторите процесс индукции и поддержания и подготовьтесь к окрашиванию, когда под микроскопом будет обнаружено достаточное количество липидных капель подходящего размера.
- Удалите среду для адипогенной дифференцировки в шестилуночном планшете и аккуратно промойте 1x PBS. Добавьте в каждую лунку по 2 мл 4% раствора параформальдегида и зафиксируйте на 30 мин при RT.
- Снимите фиксатор параформальдегида и промойте его 1x PBS два или три раза, чтобы убедиться, что фиксатор полностью удален. Добавьте 2 мл красителя Oil Red O в каждую лунку и окрашивайте в течение 30 минут при температуре RT.
- Удалите краситель Oil Red O и промойте 1x PBS два или три раза. Добавьте по 2 мл 1x PBS в каждую лунку, а затем наблюдайте за эффектом адипогенной дифференцировки под микроскопом.
- Остеогенный дифференцировочный анализ
- Подготовьте готовую среду для остеогенной дифференцировки в соответствии с инструкцией набора.
- Выполните шаги 7.1.2-7.1.3 для посадки и культивирования pBM-MSC.
- Когда клетки достигнут 70% слияния, осторожно удалите общую полную среду и добавьте 2 мл среды для остеогенной дифференцировки в каждую лунку планшета.
- Меняйте на свежую остеогенную среду для дифференцировки каждые 3 дня. Продолжайте индукцию в течение 2-4 недель и приготовьтесь к окрашиванию красителем Ализарин Ред при появлении явных кальциевых узелков во время остеогенеза.
- Удалите среду для остеогенной дифференцировки в шестилуночном планшете и аккуратно промойте 1x PBS. Добавьте в каждую лунку по 2 мл 4% раствора параформальдегида и зафиксируйте на 30 мин при RT.
- Снимите параформальдегидный фиксатор и промойте его 1x PBS два или три раза, чтобы убедиться, что фиксатор тщательно очищен. Добавьте 2 мл красителя Ализарин Красный в каждую лунку и окрашивайте на 10 минут при температуре RT.
- Удалите краситель Alizarin Red и умойтесь 1x PBS два или три раза. Добавьте в каждую лунку по 2 мл 1x PBS, а затем наблюдайте за эффектом остеогенной дифференцировки под микроскопом.
- Анализ хондрогенной дифференцировки
- Подготовьте премикс для хондрогенной дифференциации в соответствии с инструкцией набора.
- Перенесите 3-4 x 105 pBM-MSC в стерильную центрифужную пробирку объемом 15 мл. Центрифугируйте при 250 x g в течение 4 мин при 20 °C.
- Удалите надосадочную жидкость и добавьте 0,5 мл предварительной смеси для ресуспендирования гранулы, полученной центрифугированием на предыдущем этапе, а затем центрифугируйте при 150 x g в течение 5 минут при 20 °C. Повторите этот шаг, чтобы снова промыть клетки.
- Подготовьте всю среду для хондрогенной дифференцировки.
- Ресуспендируют клетку, полученную на предыдущем этапе, с помощью 0,5 мл полной среды и центрифугируют при 150 x g в течение 5 мин при 20 °C.
- Открутите крышку трубки центрифуги, чтобы облегчить газообмен. Поместите его в вертикальное положение в инкубатор при температуре 37 °C, 5%CO2 и насыщенной влажности.
- Когда кажется, что клетки агрегируются (обычно через 24-48 часов, в зависимости от фактической ситуации), поверните дно центрифугной трубки, чтобы хрящевые шарики отделились от дна и подвешивали в среде.
- Меняйте на свежую полноценную среду для хондрогенной дифференцировки каждые 2-3 дня. Продолжайте индукцию до тех пор, пока в трубке не сформируются хрящевые шарики диаметром 1,5-2 мм, а затем подготовьте срезы для окрашивания.
- Подготовьте парафиновые срезы хрящевых шариков в соответствии с обычными этапами патологических экспериментов. Добавьте синий краситель Alicia на очищенные от воска участки и окрашивайте при температуре 37 °C в течение 1 часа.
- Промойте предметное стекло проточной водой в течение 5 минут, а затем наблюдайте за окрашивающим эффектом Алисии голубой под микроскопом после высыхания.
8. Идентификация фенотипа клеток методом проточной цитометрии
- Когда клеточные колонии достигнут 80%-90% слияния в проходах 3-5, удалите питательную среду и дважды промойте клетки предварительно подогретыми PBS. Затем расщепляют клетки с 3-4 мл 0,25% трипсина/ЭДТА и инкубируют их при 37 °С в насыщенной увлажненной атмосфере с 5%СО2 в течение 2-3 мин до тех пор, пока они не будут отделены от дна колбы под микроскопом.
- Соберите клетки с готовой средой объемом 10 мл и переложите клеточную суспензию в стерильную центрифужную пробирку объемом 15 мл. Центрифугируйте клеточную суспензию при 800 x g в течение 5 мин при RT. Выбросьте надосадочную жидкость и промойте клетки 4 °C PBS.
- Ресуспендируйте клетки до 10 мл при 4 °C PBS. Клеточную суспензию делят на девять групп объемом 1 мл в каждой микропробирке объемом 1,5 мл, называемых отрицательным контролем, контролем изотипа FITC, контролем изотипа PE, контролем изотипа APC, группой CD105, CD29, CD90, CD14 и CD45 соответственно. Убедитесь, что количество клеток в каждой микропробирке находится в диапазоне от 1 x 105 до 1 x 106.
- Центрифугируйте суспензию при 800 x g в течение 5 мин при 4 °C и снова суспендируйте клетки в каждой микропробирке 100 мкл 4 °C PBS. За исключением отрицательной контрольной группы, добавьте в каждую микропробирку по 5 мкл соответствующего изотипа контроля (FITC, PE и APC Mouse IgG1 kappa Isotype Control) и антител (CD105, CD29, CD90, CD14 и CD45 Monoclonal Antibody) для проточной цитометрии в соответствии с порядком на шаге 8.3. Аккуратно перемешайте и выдерживайте в течение 1,5 часов при температуре 4 °C в темноте.
- Добавьте 1 мл PBS 4 °C в каждую микропробирку и центрифугируйте при 300 x g в течение 10 минут при 4 °C. Выбросьте надосадочную жидкость и добавьте 200 мкл 4 °C PBS для ресуспендирования клеток.
- Протестируйте не менее 10 000 клеток на проточной цитометрии после фильтрации клеточной суспензии16 и проанализируйте данные с помощью программного обеспечения проточной цитометрии.
9. Выделение внеклеточных везикул (ВВ), полученных из мезенхимальных стволовых клеток костного мозга свиньи
- Когда слияние pBM-MSCs достигнет 80%-90%, выбросьте надосадочную жидкость и промойте клетки PBS 2x. Затем добавьте 25 мл IMDM без сыворотки в каждую колбу для культур и продолжайте инкубацию при 37 °C во влажной атмосфере с содержаниемCO2 5% в течение 48 часов.
- Соберите надосадочную жидкость клеток (кондиционированная среда, КМ) в центрифужную пробирку объемом 50 мл и центрифугируйте при 300 x g в течение 10 минут при 4 °C для удаления клеточного мусора.
- Снова соберите надосадочную жидкость в другую центрифужную пробирку объемом 50 мл. Проводите изоляцию электромобилей как можно скорее после сбора надосадочной жидкости. При длительном хранении надосадочную жидкость храните в холодильнике при температуре -80 °C, чтобы предотвратить потерю электромобилей.
- Центрифугируйте надосадочную жидкость на стадии 9.3 при 2000 x g в течение 20 мин при 4°С.
- Перенесите надосадочную жидкость в стерильную пробирку, используемую для высокоскоростной центрифуги и центрифуги при давлении 16 500 x g в течение 30 минут при 4 °C.
- Снова перенесите надосадочную жидкость в ультрацентрифужную пробирку и центрифугируйте при давлении 120 000 x g в течение не менее 70 минут при 4 °C с помощью ротора с фиксированным углом наклона.
- Полностью выбросьте надосадочную жидкость. Добавьте 1 мл PBS 4 °C в каждую ультрацентрифужную пробирку и повторно суспендируйте осадок с помощью микропипетки. Смешайте раствор из той же группы в ультрацентрифужную пробирку, а затем добавьте 4 °C PBS, чтобы объем был больше 3/4 пробирки.
- Центрифугируйте при давлении 120 000 x g в течение 60 минут при 4 °C и максимально удалите надосадочную жидкость.
- Снова суспендируйте осадок со стерильным PBS и храните электромобили в холодильнике при температуре -80 °C.
ПРИМЕЧАНИЕ: Количество PBS для ресуспендирования может быть определено как 100 мкл для осадков из каждых двух колб с культурой размером 175см2 . Все вышеперечисленные шаги по изоляции электромобилей систематически показаны на рисунке 3 .
10. Идентификация ВВ с помощью просвечивающей электронной микроскопии (ПЭМ), анализа отслеживания наночастиц (NTA) и вестерн-блоттинга
- Поместите образец EVs на лед после его размораживания на водяной бане при температуре 25 °C, а затем разбавьте до половины предыдущей концентрации PBS для обнаружения NTA17.
- Нанесите пипеткой 10 мкл образца на медную сетку, дайте ему отстояться в течение 1 минуты и впитайте плавающую жидкость с помощью фильтровальной бумаги. Затем добавьте 10 μл фосфовольфрамовой кислоты в медную сетку, дайте ей постоять 1 минуту и впитайте лишнюю жидкость.
- После высыхания в течение нескольких минут на РТ проводят электронную микроскопию при условии ускорения напряжения 100 кВ18.
- Ресуспендируйте образец EVs с этапа 9.9 в буфере для лизиса RIPA (25 мМ Трис· HCl (pH 7,6), 150 мМ хлорида натрия [NaCl], 1% нонилфеноксиполиэтоксителанола (NP-40), 1% дезоксихолата натрия, 0,1% додецилсульфата натрия (SDS), 1 мМ фенилметансульфонилфторида (PMSF), 1x ингибитор протеазы) и определяют экспрессию специфических маркеров для EV, таких как Alix, TSG101, CD81 и CD63, с помощью вестерн-блоттинга19.
Результаты
Создание мезенхимальных стволовых клеток костного мозга свиньи
Мезенхимальные стволовые клетки, полученные из костного мозга свиней, были успешно выделены и культивированы in vitro, а морфология pBM-MSCs в разные дни показана на рисунке 4. В первичной культуре pBM-MSCs микроскопическое наблюдение показало, что адгезия клеток происходит через день после посадки, а адгезивные клетки обычно имеют круглую форму. Первичные pBM-МСК обычно оставались в фазе покоя в течение 3 дней после посадки, а пролиферация клеток начиналась на4-й день. Морфология клеток изменилась с круглого на веретенообразный, многосторонний или звездчатый тип после пролиферации, а ядра расположены центрально, с двойными ядрышками в некоторых клетках. Клеточные колонии образовывались через 7-9 дней после начала пролиферации клеток, а 80-90% слияние клеток достигалось через 12-14 дней. Микроскопическое наблюдение показало, что адгезивные клетки росли как разрозненные колонии и располагались в виде закрученного узора.
Пролиферация клеток значительно ускорялась после пассирования, и за неделю можно было достичь 80-90% слияния. Морфология клеток была гомогенной веретенообразной от второго прохода, напоминающей фибробласты, с соотношением длины к ширине примерно 2-3:1. Если бы клетки были дифференцированы, они могли бы казаться многоугольными или звездообразными. После пассирования клетки уже не росли разрозненными колониями, а равномерно и радиально в параллельном расположении.
Идентификация потенциала дифференцировки клеток путем окрашивания
В анализе адипогенной дифференциации окрашивание Oil Red O показало, что вокруг ядра появились круглые оранжево-красные капли липидов разного размера (рис. 5А); В анализе остеогенной дифференцировки окрашивание Ализарином красным показало красные узелки на поверхности клеток (рис. 5B), что было вызвано цветовой реакцией с солями кальция, осажденными остеобластами, дифференцированными из pBM-MSCs. В анализе хондрогенной дифференцировки окрашивание Алисии синим показало, что весь участок ткани был синим (рис. 5C), что было вызвано окрашиванием эндокислотного мукополисахарида в хрящевых шариках.
Идентификация фенотипа клеток методом проточной цитометрии
Были проведены анализы маркеров клеточной поверхности для создания фенотипа pBM-МСК. По результатам проточной цитометрии (рис. 6) три положительных маркера, таких как CD105, CD29 и CD90, были достоверно экспрессированы на поверхности pBM-МСК, составляя 96,5%, 99,8% и 92% соответственно (рис. 6A-C). Тем не менее, экспрессия CD14 и CD45 была отрицательной (рис. 6D, E). Между тем, результаты контроля соответствующих изотипов были отрицательными, что уже было наложено на рисунок, исключая возможность неспецифического связывания антител.
Идентификация ВВ, полученных из pBM-MSC, с помощью NTA, TEM и вестерн-блоттинга
Результат NTA показал, что средний размер частиц составил 126,9 нм, что было в пределах диапазона EV; кроме того, исходная концентрация образца EVs составляла 1,5 x 1010 частиц/мл, а точное значение, присвоенное размеру, можно найти на рисунке 7A. Диаграмма траектории частиц показана на рисунке 7B, иллюстрируя, что частицы находились в нерегулярном броуновском движении. Кроме того, дисковидные пузырьки, как классическая структура EV, можно было ясно увидеть под электронным микроскопом при увеличении в 50 000 раз (рис. 7C). Кроме того, экспрессия специфических маркеров для ВВ, таких как Alix, TSG101, CD81 и CD63, была обнаружена в образце с помощью вестерн-блоттинга (рис. 7D).
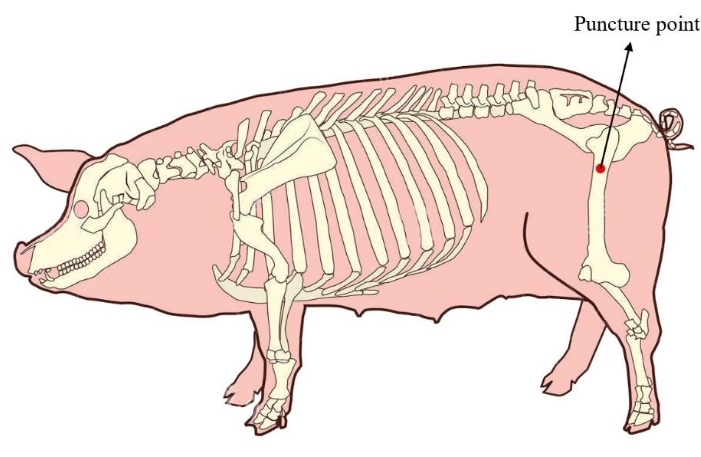
Рисунок 1: Точка прокола костного мозга минипига. Красной областью отмечена точка прокола извлечения костного мозга, расположенная в проксимальном отделе бедренной кости минипига. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
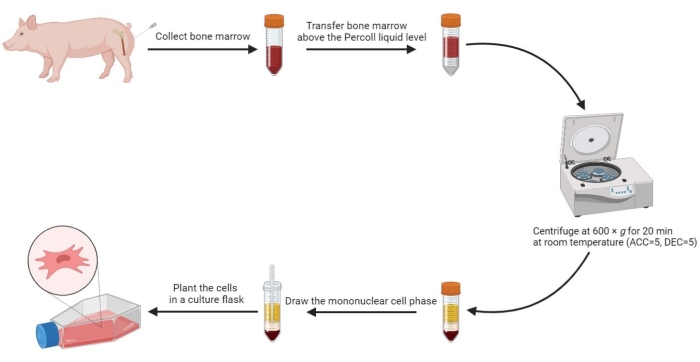
Рисунок 2: Выделение мезенхимальных стволовых клеток из костного мозга свиней. Процесс выделения мезенхимальных стволовых клеток из костного мозга свиньи показан на технологической схеме, а после центрифугирования с градиентом плотности четко проиллюстрированы четыре жидкие фазы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
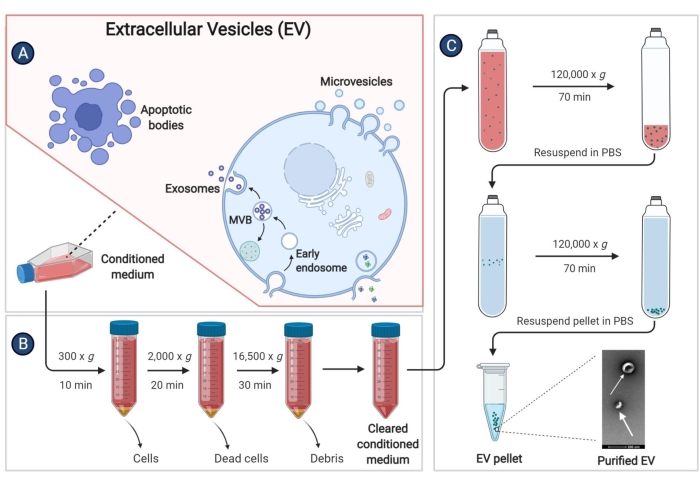
Рисунок 3: Изоляция EV, полученных из pBM-MSC. На принципиальной схеме показаны конкретные шаги по изоляции электромобилей от кондиционированной среды с помощью ультрацентрифугирования. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
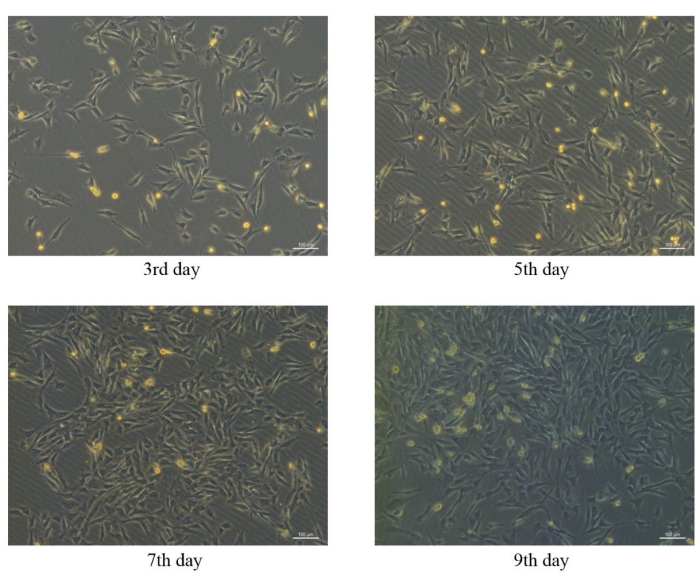
Рисунок 4: Морфологические характеристики pBM-MSCs в разные дни. Сходные морфологические характеристики pBM-MSC можно наблюдать на3-й,5-й,7-й и9-й день после посадки под 100-кратное микроскопическое поле, а клеточные колонии образовались на9-е сутки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5. Определение дифференцировочного потенциала pBM-MSCs методом окрашивания. (А) адипогенный, (В) остеогенный и (В) хондрогенный дифференцировочный анализ рБМ-МСК соответственно. По результатам окрашивания можно определить дифференцировочный потенциал pBM-MSCs. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
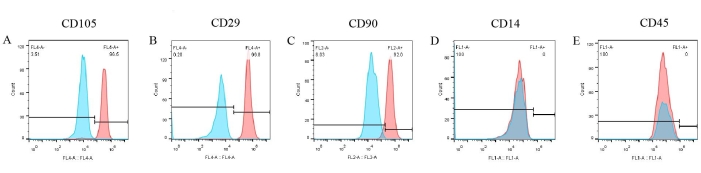
Рисунок 6: Результаты идентификации pBM-MSCs методом проточной цитометрии. CD105, CD29 и CD90 в значительной степени экспрессируются на поверхности pBM-МСК, составляя 96,5%, 99,8% и 92,0% соответственно, в то время как экспрессия CD14 и CD45 отрицательна. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
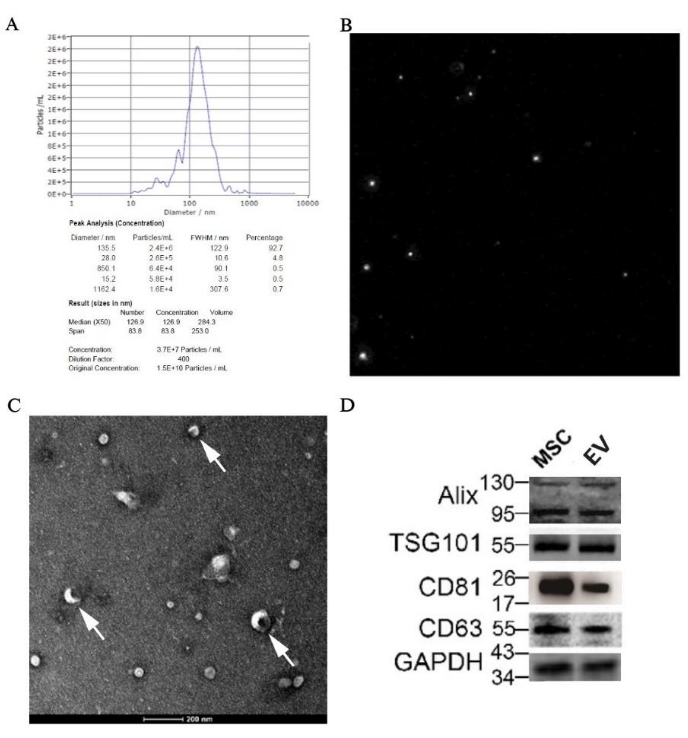
Рисунок 7: Результаты идентификации ВВ, полученных из пБМ-МСК, с помощью морфологии и молекулярной биологии. (А) результат НТА ВВ, полученных из пБМ-МСК, с графиком распределения частиц по размерам и (В) диаграммой траектории частиц, соответственно; (C) Изображение ПЭМ сделано с увеличением 50 000x, а белой стрелкой показана классическая структура дисковидных везикул. (D) Экспрессия специфических маркеров для ВВ методом вестерн-блоттинга. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Традиционная точка пункции костного мозга минипигов располагалась на гребне подвздошной кости20. Несмотря на то, что его легко обнаружить, объем экстракции костного мозга ограничен21 мл (всего около 5 мл в целом), поэтому трудно удовлетворить потребность в большом количестве расширений in vitro для трансплантации in vivo. В этом методе мы переместили точку пункции костного мозга в проксимальный отдел бедренной кости, и из этого участка можно извлечь не менее 20 мл костного мозга, что гарантирует достаточное количество pBM-MSCs для последующей культивирования клеток.
Двумя основными разделительными решениями, используемыми для выделения BM-MSC методом центрифугирования с градиентом плотности, являются Percoll и Ficoll. Percoll состоит из силиконизированного поливинилпирролидона (PVP), который является новым нетоксичным и не раздражающим центробежным разделителем градиента плотности. Низкая диффузионная константа Перколла приводит к относительно стабильному градиенту плотности; Таким образом, удовлетворительное разделение ячеек обычно может быть достигнуто в течение десятков минут при низких центробежных силах (200-1000 x g). Метод выделения pBM-MSCs с использованием метода Фиколла был описан ранее21. По сравнению с Фиколлом, Перколл постепенно стал использоваться благодаря своим преимуществам легкой изопроницаемости, низкой вязкости, нетоксичности и непричинности клеточной агрегации, что может дополнить существующие методы выделения pBM-MSCs.
При выделении и культивировании pBM-MSC нельзя игнорировать некоторые критически важные этапы. Во-первых, успешная стратификация различных жидких фаз после центрифугирования с градиентом плотности является ключом к выделению очищенных pBM-MSC. БМ-МСК, как тип мононуклеарных клеток костного мозга (БМ-МНК), имеют удельный вес, аналогичный удельному весу лимфоцитов и моноцитов, около 1,075 г/мл. Исходная плотность Перколла составляет 1,130 г/мл, и для успешного получения клеточного слоя, содержащего BM-МСК, после центрифугирования с градиентом плотности необходимо заранее сконфигурировать 60% раствор для разделения изотонического градиента плотности (1,077 г/мл) в соответствии с соотношением плотность-концентрация Перколла22. Кроме того, соответствующие условия центрифугирования также способствуют успешной стратификации. Учитывая низкую константу диффузии Перколла, мы центрифугировали извлеченный костный мозг при 600 x g в течение 20 мин при относительно низких уровнях ускорения/замедления (ACC = 5, DEC = 5), что позволило достичь хорошего эффекта стратификации. Во-вторых, соответствующая плотность посадки также имеет важное значение для клеточной культуры. Для того чтобы получить достаточное количество МСК (обычно более 107 на 9 животных) для последующей трансплантации, мы используем колбы для культуры 175 см2 для культивирования клеток. В предыдущем исследовании20 полученные BM-MNC обычно высаживали в колбы для культивирования при плотности 5 x 105/см2. Сообщалось, что после центрифугирования с градиентом плотности на каждые 5 мл костного мозга свиньи23 можно получить 2-3 x 107 BM-MNC. Таким образом, в этом протоколе мы рекомендуем высаживать общее количество BM-MNC, выделенных из каждого 20 мл свиного костного мозга, в колбу для культуры объемом 175см2 для получения подходящей плотности. В-третьих, следует избегать примесей во время выделения и культивирования pBM-MSCs. При вытягивании фазы мононуклеарной ячейки пипетку не следует вставлять в фазу Перколла, чтобы она не смешивалась с разделяющейся жидкостью. Кроме того, через 24 ч после посадки клеток колбу с культурой следует осторожно встряхнуть, чтобы уменьшить адгезию эритроцитов.
В процессе ультрацентрифугирования высокие уровни загрязнения белковых агрегатов и липопротеинов с помощью этого метода неизбежно ставят под угрозу количественную оценку и функциональный анализ EVs14. Чтобы максимально снизить загрязнение в процессе, при переносе надосадочной жидкости перед этапом ультрацентрифугирования необходимо каждый раз сохранять глубину 5 мм жидкости на дне. Между тем, после первого ультрацентрифугирования суспендирование гранулы в стерильном PBS и последующее повторное выполнение ультрацентрифугирования может эффективно снизить загрязнение липопротеинов.
Несмотря на то, что центрифугирование с градиентом плотности и ультрацентрифугирование широко используются для выделения BM-MSC и их производных EV соответственно, эти два метода также имеют свои ограничения. С одной стороны, метод Перколла является длительным и громоздким, и получение образца концентрата БМ с помощью устройства для концентрации клеток у постели больного сообщалось в качестве альтернативного метода выделения МСК24. С другой стороны, метод ультрацентрифугирования требует не только высококвалифицированных техников, но и дорогостоящего оборудования; Таким образом, совместное применение двух или более методов может представлять собой разумную стратегию для более эффективной изоляции EV25. Кроме того, идентификация pBM-MSC и производных от них EV также нуждается в улучшении. Например, в соответствии с международными критериями определения МСК26, экспрессия некоторых положительных или отрицательных маркеров, таких как CD73, CD34 и HLA-DR, до сих пор отсутствует в результатах идентификации фенотипов БМ-МСК методом проточной цитометрии в данном исследовании. Кроме того, несмотря на то, что были приняты меры для предотвращения загрязнения в процессе изоляции электромобилей, из-за ограничений нашей лаборатории мы не можем оценить чистоту образца электромобилей, чтобы улучшить последующую работу.
Данное исследование объединяет методы последовательного выделения pBM-MSC и их производных ВВ, что доказано последующими результатами идентификации на систематической основе. В частности, мы выделили ключевые операции в этой серии шагов, пояснив некоторые конкретные экспериментальные условия, которые могут в определенной степени решить проблему неоднородности, существующую в разных лабораториях во время этого процесса. Эта методическая работа может быть широко использована в доклинических исследованиях эффективности трансплантации МКМ-МСК и их производных ВВ, что может обеспечить экспериментальную базу с достаточным уровнем для клинических исследований.
Раскрытие информации
У всех авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Мы благодарим Ян Цзяньчжуна и Ван Сюэминя за их вклад в операцию по экстракции костного мозга. Эта работа была поддержана грантами Инновационного фонда медицинских наук CAMS (CIFMS) [номер гранта 2016-I2M-1-009], Национального фонда естественных наук Китая (No: 82070307; No: 81874461).
Материалы
| Name | Company | Catalog Number | Comments |
| 175 cm2 cell culture flask | Thermo Fisher | 159910 | used for cell culture |
| 0.25% Trypsin/EDTA | Thermo Fisher | 25200056 | used to digest cells |
| Adipogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90031 | used for adipogenic differentiation assay |
| Alix Monoclonal Antibody | Thermo Fisher | MA1-83977 | used to identify extracellular vesicles(Evs) by western blotting |
| APC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 17-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| CD105 (Endoglin) Monoclonal Antibody | Thermo Fisher | 17-1057-42 | used to identify pBM-MSCs by flow cytometry |
| CD14 Monoclonal Antibody | Thermo Fisher | MA1-82074 | used to identify pBM-MSCs by flow cytometry |
| CD29/IGTB1 Monoclonal Antibody | Thermo Fisher | MA1-19458 | used to identify pBM-MSCs by flow cytometry |
| CD45 Monoclonal Antibody | Thermo Fisher | MA5-28383 | used to identify pBM-MSCs by flow cytometry |
| CD63 Monoclonal Antibody | Thermo Fisher | 10628D | used to identify EVs by western blotting |
| CD81 Monoclonal Antibody | Thermo Fisher | MA5-13548 | used to identify EVs by western blotting |
| CD90 Monoclonal Antibody | Thermo Fisher | A15794 | used to identify pBM-MSCs by flow cytometry |
| Chondrogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90041 | used for chondrogenic differentiation assay |
| Fetal Bovine Serum | Gibco | 10099141C | used to prepare complete medium |
| FITC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 11-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Flow cytometry | BD | Accuri C6 | used for identification of cell phenotype |
| FlowJo software | BD | V10 | used to analyze data from flow cytometry |
| High-speed centrifuge tube (50 mL) | Beckman | 357003 | used for high-speed centrifugation |
| Iscove's Modified Dulbecco's Medium | Gibco | C12440500BT | used for cell culture |
| Low-temperature high-speed floor centrifuge | Avanti | J-26XPI | used for high-speed centrifugation to obtain clean conditioned medium |
| Nonyl phenoxypolyethoxylethanol (NP-40) | Sigma-Aldrich | NP40S | used for the composition of RIPA lysis buffer |
| Osteogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90021 | used for osteogenic differentiation assay |
| PE Mouse IgG1 kappa Isotype Control | Thermo Fisher | 12-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Percoll | Cytiva | 17089102 | used to isolate porcine bone marrow mesenchymal stem cells(pBM-MSCs) |
| Phenylmethanesulfonyl fluoride (PMSF) | Thermo Scientific | 36978 | used for the composition of RIPA lysis buffer |
| Phosphate Buffered Saline(10x) | Beyotime | ST476 | used to prepare isotonic Percoll solution |
| Phosphate Buffered Saline(1x) | Cytiva | AF29561133 | used to dilute Percoll and wash cells |
| Protease inhibitor (1x) | Thermo Scientific | A32955 | used for the composition of RIPA lysis buffer |
| sodium chloride | Sigma-Aldrich | S9888 | used for the composition of RIPA lysis buffer |
| sodium deoxycholate | Sigma-Aldrich | D6750 | used for the composition of RIPA lysis buffer |
| sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | used for the composition of RIPA lysis buffer |
| Transmission electron microscopy | Hitachi | HT7700 | used for electron microscopy imaging |
| Tris·HCl | Sigma-Aldrich | 93363 | used for the composition of RIPA lysis buffer |
| TSG101 Monoclonal Antibody | Thermo Fisher | MA1-23296 | used to identify EVs by western blotting |
| Ultracentrifuge (Type 50.2 Ti Rotor) | Beckman | optima L-100XP | used for ultracentrifugation to isolate exosomes |
| Ultracentrifuge tube (26.3 mL) | Beckman | 355654 | used for ultracentrifugation |
| ZetaVIEW | Particle Metrix | S/N 17-310 | used for Nanoparticle Tracking Analysis |
Ссылки
- Heslop, J. A., et al. Concise review: workshop review: understanding and assessing the risks of stem cell-based therapies. Stem Cells Translational Medicine. 4 (4), 389-400 (2015).
- Berebichez-Fridman, R., Montero-Olvera, P. R. Sources and clinical applications of mesenchymal stem cells: State-of-the-art review. Sultan Qaboos University Medical Journal. 18 (3), 264-277 (2018).
- Antebi, B., Mohammadipoor, A., Batchinsky, A. I., Cancio, L. C. The promise of mesenchymal stem cell therapy for acute respiratory distress syndrome. The Journal of Trauma and Acute Care Surgery. 84 (1), 183-191 (2018).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Farooqi, A. A., et al. Exosome biogenesis, bioactivities and functions as new delivery systems of natural compounds. Biotechnology Advances. 36 (1), 328-334 (2018).
- Lener, T., et al. Applying extracellular vesicles based therapeutics in clinical trials - an ISEV position paper. Journal of Extracellular Vesicles. 4 (1), 30087 (2015).
- Castro-Malaspina, H., et al. Characterization of human bone marrow fibroblast colony-forming cells (CFU-F) and their progeny. Blood. 56 (2), 289-301 (1980).
- vander Spoel, T. I. G., et al. Human relevance of pre-clinical studies in stem cell therapy: systematic review and meta-analysis of large animal models of ischaemic heart disease. Cardiovascular Research. 91 (4), 649-658 (2011).
- Gupta, D., Zickler, A. M., El Andaloussi, S. Dosing extracellular vesicles. Advanced Drug Delivery Reviews. 178, 113961 (2021).
- Mareschi, K., et al. Multipotent mesenchymal stromal stem cell expansion by plating whole bone marrow at a low cellular density: a more advantageous method for clinical use. Stem Cells International. , 920581 (2012).
- Van Vlasselaer, P., Falla, N., Snoeck, H., Mathieu, E. Characterization and purification of osteogenic cells from murine bone marrow by two-color cell sorting using anti-Sca-1 monoclonal antibody and wheat germ agglutinin. Blood. 84 (3), 753-763 (1994).
- Yang, D., et al. and perspective on exosome isolation - efforts for efficient exosome-based theranostics. Theranostics. 10 (8), 3684-3707 (2020).
- Li, P., Kaslan, M., Lee, S. H., Yao, J., Gao, Z. Progress in exosome isolation techniques. Theranostics. 7 (3), 789-804 (2017).
- Willms, E., Cabañas, C., Mäger, I., Wood, M. J. A., Vader, P. Extracellular vesicle heterogeneity: subpopulations, isolation techniques, and diverse functions in cancer progression. Frontiers In Immunology. 9, 738 (2018).
- Huang, P., et al. Combinatorial treatment of acute myocardial infarction using stem cells and their derived exosomes resulted in improved heart performance. Stem Cell Research & Therapy. 10 (1), 300 (2019).
- Akbar, N., Pinnick, K. E., Paget, D., Choudhury, R. P. Isolation and characterization of human adipocyte-derived extracellular vesicles using filtration and ultracentrifugation. Journal of Visualized Experiments: JoVE. (170), e61979 (2021).
- Jung, M. K., Mun, J. Y. Sample preparation and imaging of exosomes by transmission electron microscopy. Journal of Visualized Experiments: JoVE. (131), e56482 (2018).
- Menck, K., Bleckmann, A., Schulz, M., Ries, L., Binder, C. Isolation and characterization of microvesicles from peripheral blood. Journal of Visualized Experiments: JoVE. (119), e55057 (2017).
- Yang, Y. J., et al. Atorvastatin treatment improves survival and effects of implanted mesenchymal stem cells in post-infarct swine hearts. European Heart Journal. 29 (12), 1578-1590 (2008).
- Lee, W. -. J., et al. Isolation and cellular phenotyping of mesenchymal stem cells derived from synovial fluid and bone marrow of minipigs. Journal of Visualized Experiments: JoVE. (113), e54077 (2016).
- Lindqvist, R., Wilson, I. D. Food Microorganisms: Buoyant Density Centrifugation. Encyclopedia of Separation Science. , 2843-2849 (2000).
- Yao, Y. L., Zhang, H., Gong, D. J., Song, Z. G., Xu, Z. Y. Transfecting hyperpolarization-activated cyclic nucleotide-gated channel 2 gene into porcine bone marrow mesenchymal stem cells. Journal of Clinical Rehabilitative Tissue Engineering Research. 13 (49), 9673-9676 (2009).
- Hegde, V., et al. A prospective comparison of 3 approved systems for autologous bone marrow concentration demonstrated nonequivalency in progenitor cell number and concentration. Journal of Orthopaedic Trauma. 28 (10), 591-598 (2014).
- Gallet, R., et al. Exosomes secreted by cardiosphere-derived cells reduce scarring, attenuate adverse remodelling, and improve function in acute and chronic porcine myocardial infarction. European Heart Journal. 38 (3), 201-211 (2017).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены