Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение и количественная оценка вируса Эпштейна-Барра из клеточной линии P3HR1
В этой статье
Резюме
Этот протокол позволяет выделять вирусные частицы Эпштейна-Барра из клеточной линии P3HR1 человека при индуцировании вирусного литического цикла форболом 12-миристатом 13-ацетатом. ДНК впоследствии извлекается из вирусного препарата и подвергается ПЦР в режиме реального времени для количественной оценки концентрации вирусных частиц.
Аннотация
Вирус Эпштейна-Барра (EBV), официально обозначенный как вирус герпеса человека 4 (HHV-4), является первым изолированным опухолевым вирусом человека. Почти 90-95% взрослого населения мира инфицировано ВЭБ. С недавними достижениями в области молекулярной биологии и иммунологии применение экспериментальных моделей in vitro и in vivo обеспечило глубокое и значимое понимание патогенеза ВЭБ при многих заболеваниях, а также опухолегенеза, связанного с ВЭБ. Целью этого визуализированного экспериментального документа является предоставление обзора выделения вирусных частиц ВЭБ из клеток клеточной линии P3HR1 с последующей количественной оценкой вирусного препарата. Клетки P3HR1, первоначально выделенные из лимфомы Беркитта человека, могут продуцировать вирус P3HR1, который является штаммом ВЭБ типа 2. Литический цикл EBV может быть индуцирован в этих клетках P3HR1 путем обработки форболом 12-миристатом 13-ацетатом (PMA), давая вирусные частицы EBV.
Используя этот протокол для выделения частиц ВЭБ, клетки P3HR1 культивируют в течение 5 дней при 37 °C и 5% CO2 в полной среде RPMI-1640, содержащей 35 нг/мл PMA. Впоследствии питательную среду центрифугируют со скоростью 120 х г в течение 8 мин для гранулирования клеток. Затем вируссодержащий супернатант собирают и прядут вниз со скоростью 16 000 х г в течение 90 мин, чтобы гранулировать частицы ВЭБ. Затем вирусная гранула повторно суспендируется в полной среде RPMI-1640. За этим следует экстракция ДНК и количественная ПЦР в режиме реального времени для оценки концентрации частиц ВЭБ в препарате.
Введение
Вирус Эпштейна-Барра (EBV) является первым опухолевым вирусом человека, который был выделен1. EBV, формально называемый вирусом герпеса человека 4 (HHV-4)2, является частью подсемейства вируса гамма-герпеса семейства вирусов герпеса и является прототипом рода Lymphocryptovirus . Почти 90-95% взрослого населения мира инфицировано вирусом3. В большинстве случаев первоначальная инфекция происходит в течение первых 3 лет жизни и протекает бессимптомно, однако, если инфекция происходит позже в подростковом возрасте, она может привести к заболеванию, называемому инфекционным мононуклеозом4. ВЭБ способен инфицировать покоящиеся В-клетки, побуждая их становиться пролиферативными В-лимфобластами, в которых вирус устанавливает и поддерживает латентно инфицированное состояние5. ВЭБ может реактивироваться в любое время и, таким образом, привести к рецидивирующим инфекциям6.
За последние 50 лет связь между некоторыми вирусами и развитием злокачественных новообразований человека становится все более очевидной, и сегодня, по оценкам, от 15% до 20% всех видов рака человека связаны с вирусными инфекциями7. Вирусы герпеса, включая ВЭБ, являются одними из наиболее изученных примеров этих типов опухолевых вирусов8. Фактически, ВЭБ может вызывать многие типы злокачественных новообразований человека, такие как лимфома Беркитта (BL), лимфома Ходжкина (HL), диффузная крупная В-клеточная лимфома и лимфопролиферативные заболевания у иммунокомпрометированных хозяев 9,10. Было также показано, что ВЭБ связан с развитием системных аутоиммунных заболеваний. Некоторыми примерами этих аутоиммунных расстройств являются ревматоидный артрит (РА), полимиозит-дерматомиозит (PM-DM), системная красная волчанка (SLE), смешанное заболевание соединительной ткани (MCTD) и синдром Шегрена (SS)11. ВЭБ также связан с развитием воспалительного заболевания кишечника (ВЗК)12.
Многие из этих заболеваний могут быть изучены или смоделированы с использованием клеточной культуры, мышей или других организмов, инфицированных ВЭБ. Вот почему частицы ВЭБ необходимы для заражения клеток или организмов, будь то in vitro или in vivo модели 13,14,15,16, отсюда необходимость разработки метода, который позволяет выделять вирусные частицы при низких затратах. Протокол, описанный здесь, предоставляет рекомендации по простому способу надежного выделения частиц ВЭБ из относительно доступной клеточной линии и количественного определения частиц с использованием ПЦР в режиме реального времени, которая является экономически эффективной и легко доступной для большинства лабораторий. Это по сравнению с несколькими другими методами, которые были описаны для выделения ВЭБ из различных клеточных линий 17,18,19,20.
P3HR-1 представляет собой клеточную линию BL, которая растет в суспензии и латентно инфицирована штаммом EBV типа 2. Эта клеточная линия является продуцентом ВЭБ и может быть индуцирована для производства вирусных частиц. Целью этой рукописи является демонстрация метода, который позволяет выделить частицы ВЭБ из клеточной линии P3HR-1 с последующей количественной оценкой вирусного запаса, который впоследствии может быть использован как для экспериментальных моделей ВЭБ in vitro , так и in vivo .
протокол
ПРИМЕЧАНИЕ: ВЭБ следует рассматривать как потенциально биологически опасный материал и, таким образом, следует рассматривать в рамках сдерживания уровня 2 биобезопасности или выше. Следует надеть лабораторное пальто, а также перчатки. Если существует вероятность воздействия брызг, следует также рассмотреть вопрос о защите глаз. Следующая процедура должна проводиться в кабинете биологической безопасности.
1. Подсчет ячеек P3HR1
- Центрифугирование и повторное использование ячеек
- Перенесите клеточную суспензию с 100-мм культуральной пластины (или колбы Т-25) продолжающейся клеточной культуры P3HR1 при 80% слиянии в коническую трубку объемом 15 мл. Плотность посева клеток P3HR-1 составляет 1 х 106 клеток/мл. Поддерживать в полной культуральной среде RPMI (79% питательной среды RPMI, 20% фетальной бычьей сыворотки, 1% пен-стрептококкового антибиотика) при 37 °C и 5% CO2 и проходить каждые 3-4 дня.
- Центрифуга в течение 8 мин при 120 х г. После центрифугирования отбросьте надосадочный агент, повторно суспендируйте клеточную гранулу в 1 мл полной питательной среды RPMI и хорошо перемешайте (этот раствор будет называться суспензией А).
- Подготовка клеточной суспензии к подсчету
- Готовят разбавленную клеточную суспензию В путем смешивания 2 мкл клеточной суспензии А с 8 мкл питательной среды. Добавьте 10 мкл 0,4% трипан-синего цвета в суспензию B для получения суспензии C. Хорошо перемешайте препарат путем бережного пипетирования.
- Подсчет клеток с помощью гемоцитометра
- Поместите стеклянную крышку на гемоцитометр и загрузите 10 мкл суспензии С. Поместите гемоцитометр под легкий микроскоп и подсчитайте количество клеток, которые не окрашены в синий цвет в каждом из четырех квадрантов камеры гемоцитометра с помощью объектива 40x микроскопа (рисунок 1).
- Трипан синий окрашивает отмершие клетки в синий цвет; не учитывайте ни эти клетки, ни клетки, которые касаются любой из верхних, нижних, правых или левых границ каждого квадранта гемоцитометра.
- Рассчитайте концентрацию ячеек в мл по следующей формуле:
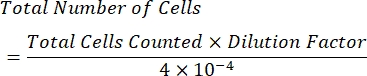
ПРИМЕЧАНИЕ: Количество подсчитанных квадрантов составляет четыре, а 10-4 мл - объем квадратов на гемоцитометре. Четыре квадранта, которые должны быть подсчитаны, представлены зеленым цветом на рисунке 1. Общее количество клеток, подсчитанных в формуле, представляет собой сумму чисел ячеек в квадрантах 1, 2, 3 и 4. Ячейки, представленные синим цветом на рисунке 1 , должны быть подсчитаны, в то время как ячейки красного цвета не должны учитываться, поскольку они касаются верхней, правой, нижней или левой границ квадранта.
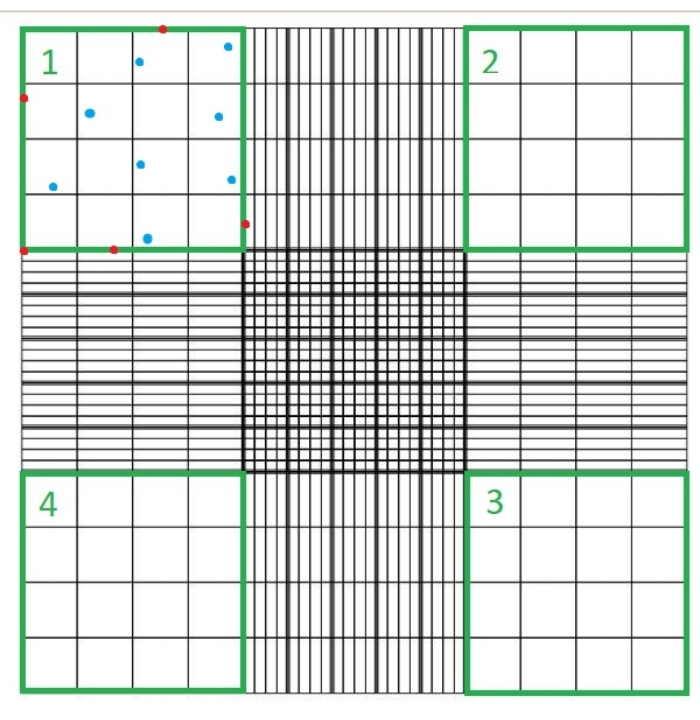
Рисунок 1: Подсчет клеток с помощью камеры гемоцитометра. Четыре квадранта подсчитываются с помощью светового микроскопа; эти квадранты представлены зеленым цветом. Общее количество клеток, подсчитанных в формуле, указанной на этапе 1.3.3 протокола, описанного здесь, представляет собой сумму числа клеток в квадрантах 1, 2, 3 и 4. Ячейки, указанные синим цветом, должны быть подсчитаны, в то время как ячейки красного цвета не должны учитываться, поскольку они касаются верхней, правой, нижней или левой границ квадранта Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Подготовка тарелки к культуре
- Поместите объем клеточной суспензии А в коническую трубку объемом 15 мл. Требуемый объем зависит от количества ячеек. Отрегулируйте объем таким образом, чтобы количество клеток составляло примерно 2,2 х 106 клеток для 100 мм культуральной пластины.
- Добавьте 5 мл полной питательной среды в пробирку, а затем перенесите содержимое пробирки на 100 мм культуральную пластину. Добавьте 80 мкл диметилсульфоксида (ДМСО) в культуральную пластину.
ПРИМЕЧАНИЕ: DMSO является светочувствительным, поэтому его следует хранить в светостойком контейнере или покрыть непрозрачным материалом, таким как алюминиевая фольга. - Добавьте в пробирку 350 мкл 1 мг/мл форбола 12-миристата 13-ацетата (ПМА). Конечная концентрация ПМА должна составлять 35 нг/мл, а ДМСО - 0,08%.
ВНИМАНИЕ: PMA токсичен, коррозионен и канцерогенен, поэтому с ним следует обращаться с особой осторожностью. PMA светочувствительна, поэтому ее следует хранить в светостойком контейнере или покрыть непрозрачным материалом, таким как алюминиевая фольга. - Добавьте 4,27 мл питательной среды, чтобы общий объем составил 10 мл. Перемешайте содержимое трубки путем наклона, затем перенесите содержимое на 100 мм культуральную пластину. Оставьте пластину в инкубаторе клеточной культуры на 5 дней при 37 °C, 5% CO2.
3. Индукция и выделение вирусных частиц Эпштейна-Барра
- Через 5 дней в инкубаторе центрифугируют содержимое пластины на 120 х г в течение 8 мин, чтобы гранулировать клетки. Соберите бесклеточный, вирусосодержащий супернатант и выбросьте клеточную гранулу.
- Центрифугируйте супернатант при 16 000 х г в течение 90 мин при 4 °C, чтобы гранулировать вирусные частицы. Выбросьте супернатант и повторно суспендируйте гранулу вируса в 5 мл питательной среды.
ПРИМЕЧАНИЕ: Фосфатно-буферный физиологический раствор (PBS) может быть использован для повторного суспендирования гранул вируса вместо питательной среды. - Aliquot вирусную суспензию получают в 20 пробирках, каждая из которых содержит 250 мкл вирусной суспензии. Хранить суспензию при -80 °C.
4. Извлечение ДНК из вирусных частиц
ВНИМАНИЕ: При обращении с фенолом следует проявлять крайнюю осторожность, так как он токсичен и коррозионен и способен вызывать сильные ожоги. Фенол светочувствительн и окисляется при контакте со светом или воздухом. Храните его в светостойком контейнере или в качестве альтернативы накройте фенольную трубку непрозрачным материалом, таким как алюминиевая фольга.
- Отделение белков от ДНК
- Добавьте 500 мкл насыщенного триsCl фенола в одну из пробирок объемом 250 мкл. Добавьте 100 мкл воды (для увеличения объема водной фазы) и хорошо вихревое отверстие для получения розовой эмульсии. Центрифуга в течение 15 мин при 9650 х г.
- Осаждение ДНК
- Соберите супернатант (прозрачная, водная фаза) и переложите его в новую микроцентрифужную трубку объемом 1,5 мл.
- Добавьте эквивалент 1/10 объема супернатанта холодного ацетата натрия (3 М, рН 5,2) и перемешайте путем пипетки вверх и вниз. Добавьте 1 мкл 20 мг/мл гликогена и перемешайте путем пипетирования.
ПРИМЕЧАНИЕ: Этот шаг является необязательным, но добавление гликогена усиливает осаждение ДНК, а также облегчает визуализацию гранул ДНК. - Добавьте в три раза больше объема супернатанта холодного 100% этанола. Хранить при температуре -80 °C в течение ночи.
ПРИМЕЧАНИЕ: Процедура может быть остановлена здесь, чтобы быть возобновленной в более позднее время. Образец может храниться при -80 °C в течение 1 ч или альтернативно в течение ночи. Ночное хранение усиливает осаждение ДНК и поэтому рекомендуется.
- Выделение вирусной ДНК
- На следующий день центрифугируют при 9650 х г в течение 15 мин при 4 °C и выбрасывают супернатант для получения гранулы ДНК.
- Вымойте гранулу три раза 1 мл холодного 70% этанола, центрифугируйте при 9650 х г в течение 15 мин и выбросьте супернатант.
- Высушите гранулы на воздухе около 10 мин. Повторно суспендировать гранулу в 10-50 мкл дистиллированной воды без нуклеазы (в зависимости от размера гранулы ДНК).
- Храните образцы при -20 °C для последующей обработки или при 4 °C в течение ночи, чтобы обеспечить максимальное растворение ДНК с последующим хранением при -20 °C. Кроме того, можно непосредственно перейти к шагу 5.
5. Проверка концентрации и чистоты ДНК
- После очистки постамента микроспектрофотометра с деликатной задачей стеклоочистителя загрузите 1 мкл препарата ДНК.
- Обратите внимание на концентрацию ДНК в образце. Проверьте коэффициенты поглощения как на , так
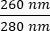 и
и 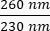 на . ДНК будет поглощать при 260 нм, белки при 280 нм, а органические вещества, такие как фенол, будут поглощать при 230 нм. Соотношение 1,8-2 считается достаточным для ПЦР в режиме реального времени.
на . ДНК будет поглощать при 260 нм, белки при 280 нм, а органические вещества, такие как фенол, будут поглощать при 230 нм. Соотношение 1,8-2 считается достаточным для ПЦР в режиме реального времени.
6. Количественная оценка с помощью полимеразной цепной реакции в режиме реального времени
- Приготовление реакционных смесей ПЦР
- Поместите 5 мкл зеленой ПЦР-смеси SYBR в режиме реального времени в пробирки ПЦР 0,2 мл. Добавьте к каждой пробирке 1 мкл прямой грунтовки 7,5 пмоль/мкл и 1 мкл обратной грунтовки 7,5 пмоль/мкл. Прямая последовательность грунтовки: 5'-CCCTAGTGGTTTCGGACACA-3'; обратная последовательность праймера: 5'-ACTTGCAAATGCTCTAGGCG-3'. Ген, амплифицируемый для определения числа копий генома EBV, является геном малой РНК 2 вируса Эпштейна-Барра (EBER-2 ).
- В одну из пробирок добавьте 2 мкл воды без нуклеазы и 1 мкл вирусной ДНК со стадии 4. Общий объем реакционной смеси составляет 10 мкл.
ПРИМЕЧАНИЕ: В зависимости от концентрации ДНК в образце может потребоваться этап разбавления. Следует отметить коэффициент разрежения F, который будет включен в формулу на этапе 6.3. - Подготовьте другие трубки, которые будут использоваться в качестве стандартов с известными номерами копий генома ВЭБ (1000, 2000, 5000, 10 000 и 54 000 копий).
- Запускайте ПЦР-смеси, начиная с начальной стадии активации при 95 °C в течение 5 мин, затем 40 циклов при 95 °C и 58 °C (отжиг) в течение 15 с и 30 с соответственно.
- Генерация стандартной кривой qPCR путем построения значений Ct стандартов по журналу количества копий генома EBV на стандартную трубку. Используя стандартное уравнение кривой, выведите количество копий генома ВЭБ в трубке ПЦР, содержащей индуцированную вирусную ДНК. Затем используйте следующую формулу для расчета концентрации индуцированного вирусного препарата:

Где X — количество копий генома ВЭБ, полученных из стандартной кривой, а F — коэффициент разбавления, используемый для настройки ДНК, используемой в реакции ПЦР.
7. Проверка биологической активности/инфекционности вирусных частиц
- Перенесите клетки BC-3 с 100 мм культуральной пластины при 80% слиянии в коническую трубку объемом 15 мл. Плотность посева клеток P3HR-1 составляет 1 х 106 клеток/мл. Поддерживать в полной культуральной среде RPMI (79% питательной среды RPMI, 20% фетальной бычьей сыворотки, 1% пен-стрептококкового антибиотика) при 37 °C и 5% CO2 и проходить каждые 3-4 дня.
- Подсчитайте ячейки BC-3 так же, как были подсчитаны клетки P3HR-1, выполнив следующий шаг 1. К плите из 96 лунок добавьте в каждую лунку по 105 клеток BC-3. Используйте три, шесть, девять или 12 скважин, чтобы обеспечить значимость результатов и минимизировать ошибки.
- Добавляют объем вирусного запаса в каждую лунку в зависимости от концентрации вирусного препарата, определенной на этапе 6.3. MOI может варьироваться, и оптимизация этого протокола выявит лучший MOI для инфекции (рекомендуется диапазон MOI 2-50). Убедитесь, что общий объем смеси, присутствующей в каждой скважине, составляет 250 мкл.
- Для определения необходимого объема следует знать концентрацию вирусного запаса и подбирать МВД. Например, если MOI равен 2, то количество добавленных вирусных частиц должно быть в два раза больше количества клеток. Рассчитайте требуемый объем V вирусного запаса, используя формулу:
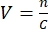 , где n — количество необходимых вирусных частиц, а C — известная концентрация вирусного запаса.
, где n — количество необходимых вирусных частиц, а C — известная концентрация вирусного запаса.
- Для определения необходимого объема следует знать концентрацию вирусного запаса и подбирать МВД. Например, если MOI равен 2, то количество добавленных вирусных частиц должно быть в два раза больше количества клеток. Рассчитайте требуемый объем V вирусного запаса, используя формулу:
- Инкубировать содержимое 96-луночной плиты в течение 5 дней. Через 5 дней перенесите содержимое каждой лунки в пробирку объемом 1,5 мл.
- Центрифугируйте пробирки по 120 х г в течение 8 мин, чтобы отделить клетки от вирусосодержащей питательной среды. Подвергайте клеточные гранулы, а также супернатанты экстракции ДНК с последующей количественной оценкой ПЦР в режиме реального времени, чтобы проверить наличие вирусных геномов в каждой фракции, тем самым оценивая инфекционность вирусных частиц.
Результаты
Целью этой процедуры является выделение частиц ВЭБ в суспензии с известным вирусным титром, который впоследствии может быть использован для моделирования ВЭБ-инфекции. Таким образом, крайне важно использовать оптимальные концентрации различных реагентов для получения наибольшего в?...
Обсуждение
Производство частиц ВЭБ необходимо для понимания биологии этого вируса, а также связанных с ним заболеваний. Здесь мы описали производство этих частиц из клеточной линии P3HR-1. Эта клеточная линия не является единственной линией EBV-производителя; фактически, частицы ВЭБ также были выдел?...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Финансирование этой работы было поддержано грантами ER от Исследовательского фонда Асмара, Ливанского национального совета по научным исследованиям (L-CNRS) и Плана медицинской практики (MPP) в Американском университете Бейрута.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.2 mL thin-walled PCR tubes | Thermo Scientific | AB0620 | Should be autoclaved before use |
| 0.2-10 µL Microvolume Filter Tips | Corning | 4807 | Should be autoclaved before use |
| 0.5-10 µL Pipette | BrandTech | 704770 | |
| 10 mL Disposable Serological Pipette | Corning | 4488 | |
| 1000 µL Filtered Pipette Tips | QSP | TF-112-1000-Q | |
| 100-1000 µL Pipette | Eppendorf | 3123000063 | |
| 100x20 mm Cuture Plates | Sarstedt | 83.1802 | |
| 10-100 µL Pipette | BrandTech | 704774 | |
| 15 mL Conical Tubes | Corning | 430791 | |
| 200 µL Filtered Pipette Tips | QSP | TF-108-200-Q | |
| 20-200 µL Pipette | Eppendorf | 3123000055 | |
| 50 mL Conical Tubes | Corning | 430828 | |
| CFX96 Real-Time C-1000 Thermal Cycler | Bio-Rad | 184-1000 | |
| DMSO | Amresco | 0231 | |
| DNase/RNase Free Water | Zymo Research | W1001-1 | |
| EBER Primers | Macrogen | N/A | Custom Made Primers |
| EBV DNA Control (Standards) | Vircell | MBC065 | |
| Ethanol (Laboratory Reagent Grade) | Fischer Chemical | E/0600DF/17 | |
| Fetal Bovine Serum | Sigma | F9665 | |
| Fresco 21 MicroCentrifuge | Thermo Scientific | 10651805 | |
| Glycogen Solution | Qiagen | 158930 | |
| Hemocytometer | BOECO | BOE 01 | |
| Inverted Light Microscope | Zeiss | Axiovert 25 | |
| iTaq Universal SYBR Green Supermix | Bio-Rad | 172-5121 | |
| Microcentrifuge Tube | Costar (Corning) | 3621 | Should be autoclaved before use |
| P3HR-1 Cell Line | ATCC | HTB-62 | |
| Penicillin-Streptomycin Solution | Biowest | L0022 | |
| Phenol | VWR | 20599.297 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma-Aldrich | P8139 | |
| Pipette Filler | Thermo Scientific | 9501 | |
| Precision Wipes | Kimtech | 7552 | |
| RPMI-1640 Culture Medium | Sigma | R7388 | |
| SL 16R Centrifuge | Thermo Scientific | 75004030 | |
| Sodium Acetate | Riedel-de Haën (Honeywell) | 25022 | |
| Spectrophotomer | DeNovix | DS-11 | |
| Tris-HCl | Sigma | T-3253 | |
| Trypan Blue Solution | Sigma | T8154 | |
| Water Jacketed CO2 Incubator | Thermo Scientific | 4121 |
Ссылки
- Epstein, M. A., Achong, B. G., Barr, Y. M. Virus particles in cultured lymphoblasts from Burkitt's lymphoma. Lancet. 1 (7335), 702-703 (1964).
- Sample, J., et al. Epstein-Barr virus types 1 and 2 differ in their EBNA-3A, EBNA-3B, and EBNA-3C genes. Journal of Virology. 64 (9), 4084-4092 (1990).
- Chang, M. S., Kim, W. H. Epstein-Barr virus in human malignancy: a special reference to Epstein-Barr virus associated gastric carcinoma. Cancer Research and Treatment. 37 (5), 257-267 (2005).
- Manet, E., Schwab, M. . Encyclopedia of Cancer. , 1602-1607 (2017).
- Babcock, G. J., Decker, L. L., Volk, M., Thorley-Lawson, D. A. EBV persistence in memory B cells in vivo. Immunity. 9 (3), 395-404 (1998).
- Khan, G., Miyashita, E. M., Yang, B., Babcock, G. J., Thorley-Lawson, D. A. Is EBV persistence in vivo a model for B cell homeostasis. Immunity. 5 (2), 173-179 (1996).
- Jha, H. C., Banerjee, S., Robertson, E. S. The role of gammaherpesviruses in cancer pathogenesis. Pathogens. 5 (1), 18 (2016).
- El-Sharkawy, A., Al Zaidan, L., Malki, A. Epstein-Barr virus-associated malignancies: roles of viral oncoproteins in carcinogenesis. Frontiers in Oncology. 8, 265 (2018).
- Vereide, D., Sugden, B. Insights into the evolution of lymphomas induced by Epstein-Barr virus. Advances in Cancer Research. 108, 1-19 (2010).
- Vereide, D. T., Sugden, B. Lymphomas differ in their dependence on Epstein-Barr virus. Blood. 117 (6), 1977-1985 (2011).
- Houen, G., Trier, N. H. Epstein-Barr virus and systemic autoimmune diseases. Frontiers in Immunology. 11, 587380 (2020).
- Ortiz, A. N., et al. Impact of Epstein-Barr virus infection on inflammatory bowel disease (IBD) clinical outcomes. Revista Espanola de Enfermedades Digestivas. 114 (5), 259-265 (2021).
- Caplazi, P., et al. Mouse models of rheumatoid arthritis. Veterinary Pathology. 52 (5), 819-826 (2015).
- Kiesler, P., Fuss, I. J., Strober, W. Experimental models of inflammatory bowel diseases. Cellular and Molecular Gastroenterology and Hepatology. 1 (2), 154-170 (2015).
- Warde, N. Experimental arthritis: EBV induces arthritis in mice. Nature Reviews Rheumatology. 7 (12), 683 (2011).
- Jog, N. R., James, J. A. Epstein Barr virus and autoimmune responses in systemic lupus erythematosus. Frontiers in Immunology. 11, 623944 (2020).
- Shimizu, N., Yoshiyama, H., Takada, K. Clonal propagation of Epstein-Barr virus (EBV) recombinants in EBV-negative Akata cells. Journal of Virology. 70 (10), 7260-7263 (1996).
- Hsu, C. H., et al. Induction of Epstein-Barr virus (EBV) reactivation in Raji cells by doxorubicin and cisplatin. Anticancer Research. 22, 4065-4071 (2002).
- Nutter, L. M., Grill, S. P., Li, J. S., Tan, R. S., Cheng, Y. C. Induction of virus enzymes by phorbol esters and n-butyrate in Epstein-Barr virus genome-carrying Raji cells. Cancer Research. 47 (16), 4407-4412 (1987).
- Fresen, K. O., Cho, M. S., zur Hausen, H. Recovery of transforming EBV from non-producer cells after superinfection with non-transforming P3HR-1 EBV. International Journal of Cancer. 22 (4), 378-383 (1978).
- Glaser, R., Tarr, K. L., Dangel, A. W. The transforming prototype of Epstein-Barr virus (B95-8) is also a lytic virus. International Journal of Cancer. 44 (1), 95-100 (1989).
- Sairenji, T., et al. Inhibition of Epstein-Barr virus (EBV) release from P3HR-1 and B95-8 cell lines by monoclonal antibodies to EBV membrane antigen gp350/220. Journal of Virology. 62 (8), 2614-2621 (1988).
- Savage, A., et al. An assessment of the population of cotton-top tamarins (Saguinus oedipus) and their habitat in Colombia. PLoS one. 11 (12), 0168324 (2016).
- Kallin, B., Klein, G. Epstein-Barr virus carried by raji cells: a mutant in early functions. Intervirology. 19 (1), 47-51 (1983).
- Fresen, K. O., Cho, M. S., Hausen, H. Z. Recovery of transforming EBV from non-producer cells after superinfection with non-transforming P3HR-1 EBV. International Journal of Cancer. 22 (4), 378-383 (1978).
- Bounaadja, L., Piret, J., Goyette, N., Boivin, G. Evaluation of Epstein-Barr virus, human herpesvirus 6 (HHV-6), and HHV-8 antiviral drug susceptibilities by use of real-time-PCR-based assays. Journal of Clinical Microbiology. 51 (4), 1244-1246 (2013).
- Buelow, D., et al. Comparative evaluation of four real-time PCR methods for the quantitative detection of Epstein-Barr virus from whole blood specimens. Journal of Molecular Diagnostics. 18 (4), 527-534 (2016).
- Wu, D. Y., Kalpana, G. V., Goff, S. P., Schubach, W. H. Epstein-Barr virus nuclear protein 2 (EBNA2) binds to a component of the human SNF-SWI complex, hSNF5/Ini1. Journal of Virology. 70 (9), 6020-6028 (1996).
- Li, C., et al. EBNA2-deleted Epstein-Barr virus (EBV) isolate, P3HR1, causes Hodgkin-like lymphomas and diffuse large B cell lymphomas with type II and Wp-restricted latency types in humanized mice. PLoS Pathogens. 16 (6), 1008590 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены