Method Article
Мышиная модель неоваскуляризации роговицы с помощью щелочного ожога
В этой статье
Резюме
Этот протокол фокусируется на неоваскуляризации роговицы, вызванной ожогом щелочи у мышей. Метод создает воспроизводимую и контролируемую модель заболевания роговицы для изучения патологического ангиогенеза и связанных с ним молекулярных механизмов, а также для тестирования новых фармакологических агентов для предотвращения неоваскуляризации роговицы.
Аннотация
Неоваскуляризация роговицы (CoNV), патологическая форма ангиогенеза, включает в себя прорастание кровеносных и лимфатических сосудов в аваскулярную роговицу из лимба и отрицательно влияет на прозрачность и зрение. Ожог щелочью является одной из наиболее распространенных форм травмы глаза, которая приводит к CoNV. В этом протоколе CoNV экспериментально индуцируется с помощью раствора гидроксида натрия контролируемым образом для обеспечения воспроизводимости. Модель ожога щелочью полезна для понимания патологии CoNV и может быть расширена для изучения ангиогенеза в целом из-за аваскулярности, прозрачности и доступности роговицы. В данной работе CoNV анализировали путем прямого исследования под препарирующим микроскопом и иммуноокрашивания плоских роговиц с использованием анти-CD31 мАТ. Лимфангиогенез выявляли на плоских роговицах методом иммуноокрашивания с использованием анти-LYVE-1 мАТ. Отек роговицы визуализировали и количественно оценивали с помощью оптической когерентной томографии (ОКТ). Таким образом, эта модель поможет усовершенствовать существующие методы неоваскуляризации и открыть новые стратегии лечения патологического глазного и экстраокулярного ангиогенеза.
Введение
Роговица представляет собой аваскулярную ткань, которая сохраняет свою прозрачность, устанавливая ангиогенную привилегию 1,2. Повреждение роговицы может привести к воспалению и развитию кровеносных и лимфатических сосудов, а также к фиброзу3. Неоваскуляризация роговицы (CoNV) приводит к ухудшению зрения и является второй по значимости причиной слепоты во всем мире4. CoNV поражает около 1,4 миллиона человек в Соединенных Штатах вгод5. CoNV может быть индуцирован различными факторами, включая химические ожоги, инфекции, воспаление и гипоксию 3,6. Химические ожоги являются одной из наиболее распространенных неотложных офтальмологических состояний, на их долю приходится около 13,2% глазных травм, и они требуют немедленной оценки и лечения7. Химические ожоги могут быть ожогами щелочью или кислотой, но ожоги щелочью вызывают более серьезные повреждения, поскольку щелочь проникает глубже в ткани8.
Мышиные модели ожога щелочью широко используются для изучения CoNV и заживления ран. По сравнению с моделью ангиогенеза роговичного кармана 9,10, модели ожога щелочью относительно просты в создании и также могут быть использованы для изучения воспаления роговицы, фиброза и пролиферации эпителия. Эти модели также более тесно связаны с клиническими химическими ожогами, чем модели ангиогенеза по шву роговицы11. При ожоге щелочью в аваскулярной роговице развиваются кровеносные сосуды из-за воспаления и дисбаланса антиангиогенных и проангиогенных факторов 1,2. Недостатками моделей ожога роговицы щелочью являются трудности в контроле площади и тяжести ожога щелочью, вариативность неоваскуляризации роговицы и непреднамеренное ожог прилегающих тканей из-за избытка раствора щелочи. Целью данного исследования является описание модели контролируемого ожога роговицы щелочью у мышей с использованием фильтровальной бумаги, предварительно замоченной в растворе гидроксида натрия. Эта модель может быть использована для изучения ангиогенных факторов, антиангиогенных терапевтических реагентов и других факторов и реагентов, которые могут модулировать воспаление и фиброз.
протокол
Все работы с животными, включая экспериментальные процедуры и эвтаназию, были одобрены Комитетом по уходу и использованию животных (IACUC) в Медицинском колледже Бэйлора под номером протокола AN-8790.
1. Приготовление 1 Н NaOH
- Добавьте 4 мл стерильной деионизированной воды в центрифужную пробирку объемом 15 мл. Взвесьте 400 мг гидроксида натрия (NaOH) и осторожно добавьте в пробирку.
- Растворите NaOH, медленно перемешивая раствор с помощью стеклянной палочки. Доведите объем до 10 мл, добавив в пробирку стерильную деионизированную воду, и снова перемешайте, осторожно переворачивая пробирку вверх и вниз. Плотно закройте крышку, и храните раствор при комнатной температуре.
- Готовьте свежий раствор каждый месяц, потому что концентрация раствора NaOH может быть снижена за счет поглощения раствором углекислого газа из воздуха.
- Всегда аккуратно перемешивайте раствор NaOH перед использованием.
ВНИМАНИЕ: Приготовьте раствор внутри химического колпака и наденьте соответствующие средства индивидуальной защиты (СИЗ).
2. Приготовление 4% раствора параформальдегида (PFA)
- Добавьте 30 мл 1x фосфатно-солевого буфера (PBS) в стеклянный стакан. Отвесьте 4 г параформальдегида (PFA) и добавьте его в стакан.
- Держите стакан на горячей плите при температуре 60 °C, помешивая. Добавьте по каплям раствор NaOH 1 N, чтобы повысить pH до тех пор, пока раствор не станет прозрачным.
- Проверьте и отрегулируйте рН до 7,4 с помощью 1 Н соляной кислоты (HCl). Отрегулируйте окончательный объем до 50 мл с помощью 1x PBS.
- Остудить и процедить раствор. Хранить раствор при температуре 4 °C.
ВНИМАНИЕ: Приготовьте раствор в вытяжном шкафу, надев соответствующие СИЗ.
3. Приготовление коктейля кетамин/ксилазин
- Приготовьте коктейль кетамин/ксилазин, добавив 0,8 мл кетамина (концентрация бульона: 100 мг/мл) и 0,16 мл ксилазина (концентрация бульона: 100 мг/мл) к 9,4 мл физиологического раствора.
- Храните коктейль в стерильных флаконах для инъекций при комнатной температуре (RT).
4. Ожог щелочью роговицы мыши
- Ввести мелоксикам (4-6 мг/кг массы тела) подкожно за 30 мин до процедуры для облегчения боли. Обезболивайте мышей (C57BL/6J, 6-8-недельный возраст, самец) с помощью внутривенной инъекции коктейля кетамин/ксилазин (кетамин 80 мг/кг и ксилазин 16 мг/кг массы тела).
- Проверьте рефлекторную реакцию (отвод педали), зажав пальцы мыши, и подтвердите отсутствие рефлекса. Нанесите одну каплю местного анестетика, 0,5% пропаракаина, на поверхность роговицы одного глаза и каплю искусственной слезы на другой глаз.
- С помощью биопсийного пуансона диаметром 2 мм выбейте диски из ватмана из фильтровальной бумаги.
- Добавьте 2 мкл 1N NaOH в чистую чашку Петри. Поместите диск из фильтровальной бумаги диаметром 2 мм на каплю NaOH 1 N и дайте ему впитаться в течение 15 секунд.
- Возьмите фильтровальную бумагу щипцами и приложите фильтровальную бумагу к обработанному пропаракаином глазу в центре роговицы на 30 с.
ПРИМЕЧАНИЕ: Фильтровальная бумага должна касаться только центра роговицы, и необходимо соблюдать осторожность, чтобы избежать смещения фильтровальной бумаги после размещения, так как перемещение фильтровальной бумаги может вызвать ожоги прилегающих тканей. - Промыть глаз путем промывания 20 мл стерильного физиологического раствора в стерильном шприце.
ПРИМЕЧАНИЕ: Необходимо следить за тем, чтобы роговица вместе с конъюнктивальным мешком была тщательно промыта, чтобы предотвратить дальнейшее повреждение роговицы или окружающих тканей. Промывание конъюнктивального мешка еще больше предотвратит симблефарон. - Аккуратно сотрите излишки физраствора с глаз и прилегающей области одноразовыми мягкими салфетками. После этого держите мышей в клетке для восстановления на теплой грелке до тех пор, пока они не станут амбулаторными.
ПРИМЕЧАНИЕ: Мыши наблюдаются ежедневно после ожога щелочью в течение 3 дней. Если наблюдаются симптомы боли или стресса, мелоксикам (4-6 мг/кг массы тела) вводят подкожно.
5. Обследование и оценка неоваскуляризации и помутнения
- У мышей, находящихся под наркозом, осмотрите глаза под диссекционным микроскопом на 10-й день после ожога и получите изображения с помощью камеры, прикрепленной к эндоскопу, чтобы оценить помутнение и неоваскуляризацию.
ПРИМЕЧАНИЕ: Достаточно обычного эндоскопа для вскрытия с прикрепленной камерой. - Наблюдая за роговицей через диссекционный микроскоп, оценивайте помутнение после ожога по следующей шкале12:
0 = непрозрачность отсутствует; прозрачная роговица
1 = умеренная непрозрачность; незначительная мутность в области радужки и зрачка; радужная оболочка и зрачок хорошо видны
2 = умеренная непрозрачность; радужная оболочка и зрачок едва видны
3 = сильная непрозрачность; радужная оболочка или зрачок не видны
4 = Непрозрачная роговица; радужная оболочка и зрачок не видны - Наблюдая за роговицей через диссекционный микроскоп, оценивайте CoNV по следующей шкале12:
0 = неоваскуляризация отсутствует; Никаких новых сосудов из лимба
1 = легкая неоваскуляризация; Новые сосуды, происходящие из лимба
2 = умеренная неоваскуляризация; Кровеносные сосуды берут начало от лимба и растут к центру роговицы
3 = тяжелая неоваскуляризация; кровеносные сосуды, берущие начало из лимба и достигающие и/или пересекающие центр роговицы - Используйте t-критерий Стьюдента для статистического сравнения показателей непрозрачности и неоваскуляризации между группами со щелочным ожогом и здоровыми глазами.
- Усыпляют мышей на 10-й день путем воздействия изофлурана в дозе 5% до 1 мин после остановки дыхания с последующим вывихом шейки матки и собирают роговицы для плоской визуализации.
6. Оптическая когерентная томография (ОКТ)
- Сделайте ОКТ-снимки переднего отрезка глаза у мышей, находящихся под наркозом, на 10-е сутки после ожога. Получение ОКТ-изображений в виде объемного сканирования в режиме ИК-+ ОКТ с углом обзора 30° и интенсивностью ИК-излучения 100%.
- Количественная оценка толщины роговицы с помощью программного обеспечения ImageJ.
- Чтобы измерить толщину, используйте инструмент «Выделение линии » в программном обеспечении ImageJ, чтобы создать прямую линию между передней и задней поверхностями в центральной части роговицы.
- Нажмите « Анализ > измерение » в программных инструментах, чтобы перенести значения в окно данных.
- Скопируйте значения в файл электронной таблицы и статистически сравните толщину роговицы между группами со щелочным ожогом и здоровыми глазами с помощью t-критерия Стьюдента.
ПРИМЕЧАНИЕ: Толщина роговицы - это расстояние от точки на передней поверхности роговицы до ближайшей точки на задней поверхности роговицы в центре роговицы.
7. Иммуноокрашивание на CoNV на плоской роговице
- Усыпляйте мышей на 10-й день после ожога щелочью и проклейте глаза тупым вскрытием.
- Раздвиньте веки большим и указательным пальцами и поместите щипцы под глазное яблоко. Закройте щипцы и осторожно оттяните глазное яблоко от орбиты.
- Поместите глазные яблоки в 1x PBS. Для каждого глазного яблока удалите роговицу из глазного яблока, предварительно сделав надрез иглой 30 G ниже области лимба.
- Разрежьте область лимба с помощью роговичных микроножниц, сделав разрез в качестве отправной точки, и медленно отделите роговицу и лимб от глобуса.
- Аккуратно очистите роговицу тонкой кистью, чтобы удалить радужную оболочку. Зафиксируйте роговицу в 4% параформальдегиде на 1 ч.
- Промойте роговицу три раза по 20 минут каждый в 1x PBS при комнатной температуре (RT).
- Инкубируют в блокирующем буфере (1x PBS с добавлением 0,1% Triton-X 100 и 5% бычьего сывороточного альбумина [BSA]) в течение 1 ч при RT.
- Перенесите роговицу в раствор антител, содержащий первичные антитела. Приготовьте раствор антител в 1x PBS с добавлением 1% BSA, 0,1% Triton-X 100, Dylight550-конъюгированного анти-CD31 mAb (1:100) и Alexa Fluor488-конъюгированного анти-LYVE-1 mAb (1:100).
- Выдерживают 3 дня при температуре 4 °C. Промыть роговицу в 1x PBS три раза по 20 мин каждый.
- Окрасьте ядра раствором красителя Хёхста (1:1,000) в течение 5 минут в темноте.
- Расплющите роговицы радиальными надрезами и установите их на предварительно очищенное предметное стекло с помощью монтажной среды и покровных стекол. Запечатайте покровные стекла прозрачным лаком для ногтей и высушите предметные стекла в течение ночи в темноте перед анализом с помощью конфокальной микроскопии.
- Визуализация плоских роговиц с помощью конфокальной микроскопии путем сшивания отдельных изображений Z-стека; Используйте 10-кратный объектив, лазеры с длиной волны 488 нм и 561 нм и разрешением 512 x 512 пикселей на срез на нерезонансных сканерах Galvano.
- Количественная оценка плотности CD31+ кровеносных и лимфатических сосудов LYVE-1+ с помощью программного обеспечения ImageJ.
- Чтобы определить сосудистую плотность, преобразуйте конфокальные изображения в 8-битное изображение.
- Выберите Vascular Density (Плотность сосудов) из списка плагинов.
- Выберите интересующую область на изображении и нажмите кнопку ОК. Измерения откроются в новом окне данных.
- Скопируйте значения в файл электронной таблицы и статистически сравните плотность сосудов между группами со щелочным ожогом и здоровыми глазами с помощью t-критерия Стьюдента.
ПРИМЕЧАНИЕ: CD31, также называемый молекулой адгезии эндотелиальных клеток тромбоцитов-1 (PECAM-1), представляет собой молекулу клеточной адгезии, участвующую в ангиогенезе и высоко экспрессируемую в эндотелиальных клетках ранних и зрелых кровеносных сосудов13. LYVE-1 (эндотелиальный гиалуроновый рецептор-1 лимфатических сосудов) является маркером клеточной поверхности лимфатических эндотелиальных клеток и может использоваться в качестве маркера лимфангиогенеза14.
Результаты
В этом исследовании описывается метод индуцирования ангиогенеза роговицы в глазу мыши путем ожога щелочью. Изображения, полученные с помощью диссекционного микроскопа (рис. 1A, B), продемонстрировали значительно более высокие показатели неоваскуляризации и помутнения роговицы в группе ожогов щелочью (P < 0,05; Рисунок 1C,D). Роговица, собранная на 10-й день, была дополнительно окрашена анти-CD31 мАТ для кровеносных сосудов и анти-LYVE-1 мАТ для лимфатических сосудов соответственно (рис. 2A-I). Группа ожогов щелочью показала значительно более высокую плотность кровеносных и лимфатических сосудов через 10 дней (P < 0,001 и P < 0,05 соответственно; Рисунок 2J,K). Толщина роговицы, визуализированная и количественно определенная с помощью ОКТ (рис. 3A, B), была значительно выше в группе с ожогом щелочью (P < 0,01; Рисунок 3В).
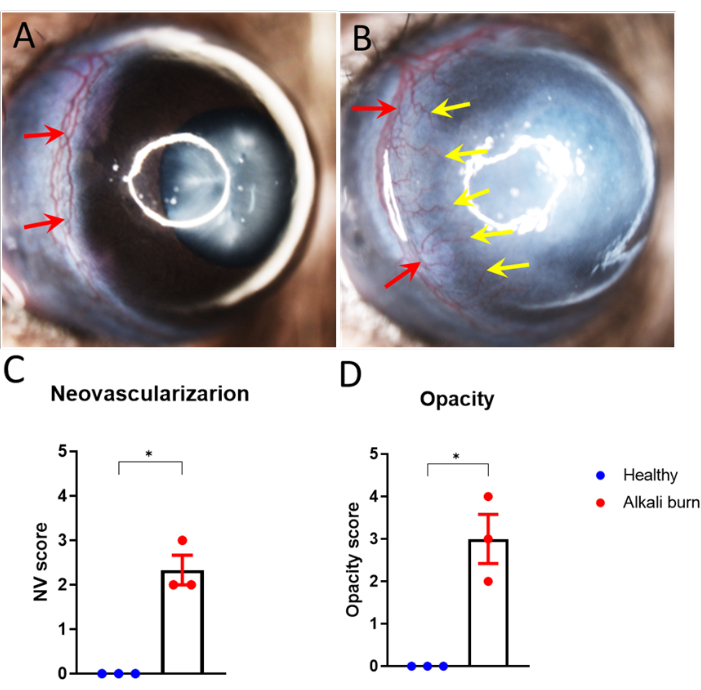
Рисунок 1: Неоваскуляризация роговицы и помутнение, вызванное щелочным ожогом. (А,Б) Неоваскуляризация роговицы проросла из сосудов лимба к центру роговицы в (В) обожженном щелочью глазу мыши (А), но не здоровом глазу через 10 дней после травмы. (С,Д) Количественная оценка (C) неоваскуляризации роговицы и (D) помутнения в панелях A и B (± SEM; t-критерий; *P < 0,05; n = 3 глаза, 1 глаз/мышь). Красные стрелки обозначают лимб, а желтая стрелка указывает на прорастающие новые сосуды. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
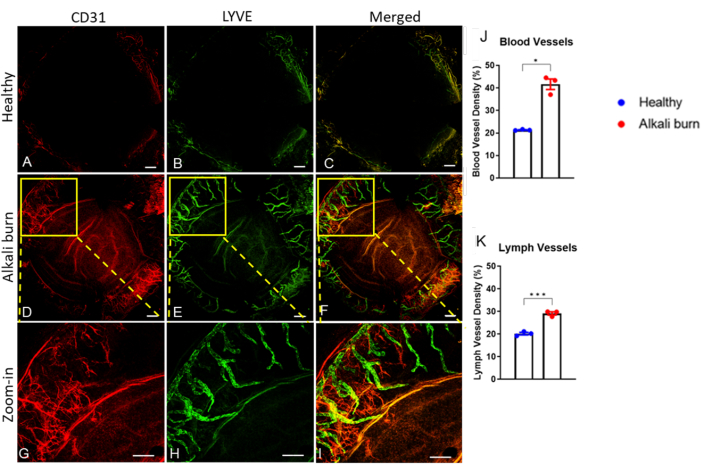
Рисунок 2: Неоваскуляризация роговицы и лимфангиогенез, вызванные ожогом щелочью. Иммуногистохимический анализ выявил (A,D,G) кровеносные и (B,E,H) лимфатические сосуды с использованием анти-CD31 и анти-LYVE-1 мАТ соответственно. (А-С) Здоровая роговица мыши. (Д-И) Обожженная щелочью роговица через 10 дней после травмы. (С,Ф,И) Наложенные изображения сигналов CD31 и LYVE-1. (Г-И) Увеличенные изображения для панелей D-F. Масштабные линейки = (A-F) 200 мкм и (G-I) 500 мкм. (J,K) Количественная оценка плотности кровеносных и лимфатических сосудов в панелях A-F, как указано (± SEM; t-критерий; *P < 0,05; ***P < 0,001; n = 3 глаза, 1 глаз/мышь). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
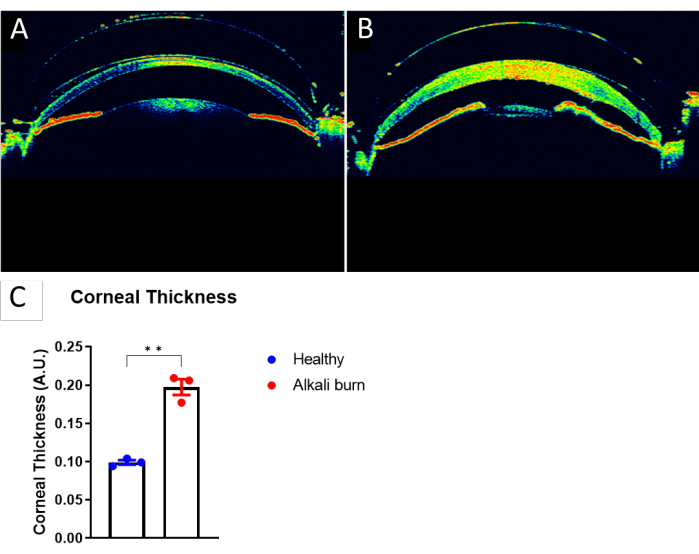
Рисунок 3: Увеличение толщины роговицы, вызванное ожогом щелочью . (A) ОКТ-изображение здорового глаза мыши. (B) ОКТ-изображение роговицы мыши через 10 дней после ожога щелочью. (C) Количественная оценка толщины роговицы в панелях А и В, измеренная в центре роговицы (± SEM; t-критерий; **P < 0,01; n = 3 глаза, 1 глаз/мышь). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Обсуждение
Роговица является отличной тканью для изучения ангиогенеза и воспаления, потому что она доступна и аваскулярна, а это означает, что неоваскуляризация может быть легко обнаружена и задокументирована. Ожог роговицы у кроликов, крыс и мышей был использован для изучения ангиогенеза роговицы, воспаления и помутнения, изъязвления, перфорации роговицы и фиброза15,16,17. Кроме того, мышиная модель ожога роговицы ценна для тестирования различных терапевтических стратегий ангиогенеза и воспаления, потому что иммунная система мышей тесно связанас иммунной системой человека. Доступность методов генетического манипулирования геномом мыши также делает этот вид отличным выбором для такогорода исследований. Задача в этом исследовании состояла в том, чтобы разработать метод ожога роговицы, который обеспечивал бы последовательную, воспроизводимую патофизиологию.
Модель ожога щелочью особенно полезна для фармакологического скрининга препаратов, которые модулируют ангиогенез, воспаление и фиброз. Минимальные требования к реагентам и ресурсам, простота выполнения щелочного ожога, а также преимущества короткой продолжительности протокола и непосредственного наблюдения за результатами делают ожог щелочью на роговице мыши основным выбором для фармакологического скрининга лекарственных средств. Тем не менее, при выполнении этой процедуры следует учитывать некоторые меры предосторожности, чтобы обеспечить согласованность и воспроизводимость. Во-первых, фильтровальная бумага должна быть помещена в центр роговицы, чтобы избежать ожога других областей глаза, особенно лимба, век и конъюнктивы; во-вторых, объем и концентрация NaOH должны быть подходящими для получения стабильных результатов от щелочного ожога роговицы. Фильтр не должен быть мокрым, но должен быть замочен в растворе NaOH. Размер и тип фильтра, а также нормаль и объем раствора, используемые в этом методе, оптимизированы таким образом, чтобы избежать переполнения NaOH. Использование фильтровальной бумаги другого размера или большего или меньшего объема NaOH может привести к несоответствиям в неоваскуляризации. В-третьих, важно предотвратить поглощение раствором NaOHСО2 из воздуха в помещении, немедленно затянув крышку пробирки раствора после использования и уменьшив соотношение воздух/раствор. Необходимо соблюдать осторожность при использовании свежих растворов щелочи, чтобы предотвратить несоответствия в неоваскуляризации и избежать изъязвления роговицы. Наконец, необходимо обширное промывание всего раствора NaOH из глаза и конъюнктивы физиологическим раствором, чтобы предотвратить дальнейшее повреждение роговицы и окружающих тканей глаза. Тщательное промывание роговицы и прилегающих тканей также предотвратит симблефарон.
Описанный здесь протокол является эффективным и надежным методом изучения патофизиологии ангиогенеза роговицы. Этот протокол может быть в дальнейшем использован для изучения воспаления роговицы, фиброза и заживления ран.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Эта работа была поддержана Благотворительной корпорацией SRB, Национальными институтами здравоохранения (NIH) P30EY002520 и неограниченным институциональным грантом от Исследовательской организации по предотвращению слепоты (RPB) для отделения офтальмологии Медицинского колледжа Бэйлора. W.L. поддерживается Фондом глаз рыцарей-тамплиеров в области офтальмологии.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride Injection | Hospira | KL-7302 | |
| 30 G Needle | McKesson | 16-N3005 | |
| A1R Confocal | Nikon Instruments | ||
| Anti-CD31 | Novus Biologicals | NB100-1642R | |
| Anti-LYVE-1 | Life technologies | 53-0443-82 | |
| ASM Module | Heidelberg Engineering | Anterior segment objective | |
| Biopsy Punch | McKesson | 16-1309 | |
| BSA | Thermoscientific | 9048-46-8 | |
| Coverslip | VWR International | 22X22-1-601640G | |
| Dissection Microscope | AmScope | SM-4TZ-30WY-10M3 | |
| Fluoromount-G | Electron Microscopy Sciences | 17984-25 | |
| Forceps | Fine Science Tools | 15000-02 | |
| Forceps | Fine Science Tools | 11049-10 | |
| Forceps | Fisherbrand | 12-000-157 | |
| Forceps | Roboz | RS-4905 | |
| Gonak Hypromellose | Akorn | 17478006412 | |
| GraphPad Prism 9 | GraphPad Sotware, Inc | ||
| Heating pad | K&H Pet Products | 100213018 | |
| Hoescht | Life Technologies | 62249 | |
| HRA + OCT Spectralis | Heidelberg Engineering | ||
| Insulin Syringe | Mckesson | 102-SN310C31516P | |
| Kimwipe | Kimberly Clark Professional | 34155 | |
| Micro Cover Glass | VWR | 48366-067 | |
| Microscissors | Roboz | RS-5110 | |
| Microscopic Slide | Fisherbrand | 12-550-15 | |
| NaOH | Sigma Aldrich | 55881-500G | |
| Neomycin and Polymyxin B Sulfates and Dexamethasone | Bausch & Lomb | 24208-0795-35 | |
| Normal Serum | Jackson Immuno | 008-000-121 | |
| Paraformaldehyde | Sigma Aldrich | 158127-500G | |
| PBS | Gibco | 20012-027 | |
| Proparacaine HCl | Bausch & Lomb | 24208073006 | |
| Saline | Henry Schein | 1531042 | |
| SMZ125 | Nikon Instruments | ||
| Syringe 10 mL | McKesson | 16-S10C | |
| Triton X-100 | Sigma Aldrich | TX1568-1 | |
| Whatmann Filter Paper | Cytiva | WHA1003323 |
Ссылки
- Ellenberg, D., et al. Novel aspects of corneal angiogenic and lymphangiogenic privilege. Progress in Retinal and Eye Research. 29 (3), 208-248 (2010).
- Azar, D. T. Corneal angiogenic privilege: Angiogenic and antiangiogenic factors in corneal avascularity, vasculogenesis, and wound healing (an American Ophthalmological Society thesis). Transactions of the American Ophthalmological Society. 104, 264-302 (2006).
- Rolfsen, M. L., et al. Corneal neovascularization: A review of the molecular biology and current therapies. Expert Review of Ophthalmology. 8 (2), 167-189 (2013).
- Skobe, M., Dana, R. Blocking the path of lymphatic vessels. Nature Medicine. 15 (9), 993-994 (2009).
- Lee, P., Wang, C. C., Adamis, A. P. Ocular neovascularization: An epidemiologic review. Survey of Ophthalmology. 43 (3), 245-269 (1998).
- Su, W., et al. Efficacious, safe, and stable inhibition of corneal neovascularization by AAV-vectored anti-VEGF therapeutics. Molecular Therapy - Methods & Clinical Development. 22, 107-121 (2021).
- Lasagni Vitar, R. M., et al. Epidemiology of corneal neovascularization and its impact on visual acuity and sensitivity: A 14-year retrospective study. Frontiers in Medicine. 8, 733538 (2021).
- Said, D. G., Dua, H. S. Chemical burns acid or alkali, what's the difference. Eye. 34, 1299-1300 (2020).
- Muthukkaruppan, V. R., Auerbach, R. Angiogenesis in the mouse cornea. Science. 2 (4413), 1416-1418 (1979).
- Kenyon, B. M., et al. A model of angiogenesis in the mouse cornea. Investigative Ophthalmology & Visual Science. 37 (8), 1625-1632 (1996).
- Cursiefen, C., Maruyama, K., Jackson, D. G., Streilein, J. W., Kruse, F. E. Time course of angiogenesis and lymphangiogenesis after brief corneal inflammation. Cornea. 25 (4), 443-447 (2006).
- Yoeruek, E., et al. penetration and efficacy of topically applied bevacizumab: Evaluation of eyedrops in corneal neovascularization after chemical burn. Acta Ophthalmologica. 86 (3), 322-328 (2008).
- DeLisser, H. M., et al. Involvement of endothelial PECAM-1/CD31 in angiogenesis. The American Journal of Pathology. 151 (3), 671-677 (1997).
- Johnson, L. A., Prevo, R., Clasper, S., Jackson, D. G. Inflammation-induced uptake and degradation of the lymphatic endothelial hyaluronan receptor LYVE-1. The Journal of Biological Chemistry. 282 (46), 33671-33680 (2007).
- Choi, H., et al. Comprehensive modeling of corneal alkali injury in the rat eye. Current Eye Research. 42 (10), 1348-1357 (2017).
- Chung, J. H., Fagerholm, P., Lindström, B. The behaviour of corneal epithelium following a standardized alkali wound. Acta Ophthalmologica. 65 (5), 529-537 (1987).
- Chang, J. H., Gabison, E. E., Kato, T., Azar, D. T. Corneal neovascularization. Current Opinion in Ophthalmology. 12 (4), 242-249 (2001).
- Alves da Costa, T., Lang, J., Torres, R. M., Pelanda, R. The development of human immune system mice and their use to study tolerance and autoimmunity. Journal of Translational Autoimmunity. 2, 100021 (2019).
- vander Weyden, L., White, J. K., Adams, D. J., Logan, D. W. The mouse genetics toolkit: Revealing function and mechanism. Genome Biology. 12 (6), 224 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены