Бактерии 3D-печати для изучения подвижности и роста в сложных пористых 3D-средах
В этой статье
Резюме
Данный протокол описывает процедуру трехмерной (3D) печати колоний бактерий для изучения их подвижности и роста в сложных 3D-пористых гидрогелевых матрицах, которые больше похожи на их естественную среду обитания, чем обычные жидкие культуры или чашки Петри.
Аннотация
Бактерии повсеместно распространены в сложных трехмерных (3D) пористых средах, таких как биологические ткани и гели, а также подповерхностные почвы и отложения. Тем не менее, большая часть предыдущих работ была сосредоточена на исследованиях клеток в объемных жидкостях или на плоских поверхностях, которые не полностью отражают сложность многих естественных мест обитания бактерий. В данной работе этот пробел в знаниях восполняется описанием разработки метода 3D-печати плотных колоний бактерий в застрявших гранулированных гидрогелевых матрицах. Эти матрицы имеют настраиваемые размеры пор и механические свойства; они физически ограничивают клетки, тем самым поддерживая их в 3D. Они оптически прозрачны, что позволяет напрямую визуализировать распространение бактерий в окружающей среде с помощью визуализации. В качестве доказательства этого принципа возможности этого протокола продемонстрированы с помощью 3D-печати и визуализации неподвижных и подвижных виброхолер, а также неподвижной кишечной палочки в застрявших гранулированных гидрогелевых матрицах с различными размерами межтканевых пор.
Введение
Бактерии часто населяют различные, сложные 3D-пористые среды, начиная от гелей слизистой оболочки в кишечнике и легких и заканчивая почвой в земле 1,2,3,4,5,6,7,8,9,10,11,12,13,14,15, 16,17,18,19,20,21,
22,23,24,25. В этих условиях движению бактерий за счет подвижности или роста могут препятствовать окружающие препятствия, такие как полимерные сетки или упаковки твердых минеральных зерен, влияющие на способность клеток распространяться в окружающей среде26, получать доступ к источникам питательных веществ, колонизировать новую территорию и формировать защитные сообщества биопленок27. Тем не менее, в традиционных лабораторных исследованиях обычно используется сильно упрощенная геометрия, фокусируясь на клетках в жидких культурах или на плоских поверхностях. Несмотря на то, что эти подходы дают ключевое представление о микробиологии, они не дают полного представления о сложности естественной среды обитания, что приводит к резким различиям в темпах роста и подвижности по сравнению с измерениями, выполненными в реальных условиях. Поэтому критически необходим метод определения колоний бактерий и изучения их подвижности и роста в пористых 3D-средах, более близких ко многим из их естественных сред обитания.
Посев клеток в агаровый гель с последующей визуализацией их макроскопического распространения на глаз или с помощью камеры представляет собой один простой способ достижения этой цели, впервые предложенный Титтслером и Сандхольцером в 1936году. Однако этот подход сопряжен с рядом ключевых технических проблем: (1) хотя размеры пор в принципе можно варьировать, изменяя концентрацию агарозы, пористая структура таких гелей плохо определена; (2) Рассеяние света приводит к помутнению этих гелей, что затрудняет визуализацию клеток в индивидуальном масштабе с высоким разрешением и точностью, особенно в больших образцах; (3) Когда концентрация агара слишком велика, миграция клеток ограничивается верхней плоской поверхностью геля; (4) Сложная реология таких гелей затрудняет введение инокуляции с четко определенной геометрией.
Чтобы устранить эти ограничения, в предыдущей работе лаборатория Датты разработала альтернативный подход, используя гранулированные гидрогелевые матрицы, состоящие из застрявших биосовместимых частиц гидрогеля, набухающих в жидкой бактериальной культуре, в качестве «пористых чашек Петри» для удержания клеток в 3D. Эти матрицы представляют собой мягкие, самовосстанавливающиеся твердые тела с пределом текучести; таким образом, в отличие от сшитых гелей, используемых в других процессах биопечати, инъекционное микросопло может свободно перемещаться внутри матрицы по любой предписанной 3D-траектории путем локального перегруппировки частиц гидрогеля29. Затем эти частицы быстро уплотняются и самовосстанавливаются вокруг введенных бактерий, поддерживая клетки на месте без какой-либо дополнительной вредной обработки. Таким образом, этот процесс представляет собой разновидность 3D-печати, которая позволяет расположить бактериальные клетки в желаемой 3D-структуре с определенным составом сообщества в пористой матрице, обладающей настраиваемыми физико-химическими свойствами. Кроме того, гидрогелевые матрицы полностью прозрачны, что позволяет напрямую визуализировать клетки с помощью визуализации.
Полезность этого подхода была продемонстрирована ранее двумя способами. В одной серии исследований разбавленные клетки были диспергированы по всему гидрогелевому матриксу, что позволило изучить подвижность отдельных бактерий30,31. В другой серии исследований многоклеточные сообщества были напечатаны на 3D-принтере в гелях сантиметрового масштаба с использованием инъекционной насадки, установленной на программируемом столике микроскопа, что позволило изучить распространение бактериальных коллективов в окружающей среде32,33. В обоих случаях эти исследования выявили ранее неизвестные различия в характеристиках распространения бактерий, обитающих в пористых средах, по сравнению с таковыми в жидкой культуре/на плоских поверхностях. Однако, учитывая, что они были установлены на столике микроскопа, эти предыдущие исследования были ограничены небольшими объемами образцов (~1 мл) и, следовательно, короткими экспериментальными временными рамками. Они также были ограничены в своих способностях определять геометрию посевов с высоким пространственным разрешением.
В этой статье описывается следующее поколение этой экспериментальной платформы, которая устраняет оба ограничения. В частности, предусмотрены протоколы, с помощью которых можно использовать модифицированный 3D-принтер с прикрепленным шприцевым экструдером для 3D-печати и изображения бактериальных колоний в больших масштабах. Более того, репрезентативные данные показывают, как этот подход может быть полезен для изучения подвижности и роста бактерий на примере биопленкообразователя холерного вибриона и планктонной кишечной палочки . Такой подход позволяет поддерживать колонии бактерий в течение длительного времени и визуализировать их с помощью различных методов визуализации. Следовательно, способность этого подхода изучать бактериальные сообщества в пористых средах обитания 3D имеет огромный исследовательский и прикладной потенциал, влияя на лечение и изучение микробов в кишечнике, коже, легких и почве. Более того, этот подход может быть использован в будущем для 3D-печати инженерных живых материалов на основе бактерий в более сложные отдельно стоящие формы.
протокол
Этот подход заключается в преобразовании коммерческого 3D-принтера для моделирования методом наплавления в 3D-биопринтер с использованием ранее разработанного протокола Tashman et al.34. Вкратце, Ташман и др. заменили коммерческую головку экструдера на изготовленный по индивидуальному заказу экструдер со шприцевым насосом. Этот экструдер позволяет печатать высококонцентрированные жидкие суспензии бактериальных клеток в 3D, при этом его экструдированный объем и 3D-положение контролируются языком программирования G-кода. Экструдированный объем задается в программном обеспечении шагом экструдера (E-step) и дополнительно калибруется, как описано ниже. Таким образом, эти бактериальные суспензии печатаются непосредственно в гранулированной гидрогелевой матрице, которая действует как 3D-опора для клеток. Ниже в протоколе также описывается, как получить матрицы с различными концентрациями полимеров, охарактеризовать результирующие изменения размера пор и реологических свойств, а также охарактеризовать последующую подвижность и рост бактерий с помощью прямой визуализации.
1. Переоборудование коммерческого 3D-принтера в 3D-биопринтер
- Извлеките экструдер и нагреватель из коммерческого 3D-принтера (см. Таблицу материалов).
- Следуйте предыдущим протоколам для изготовления экструдера34 шприцевого насоса с дополнительной модификацией для размещения одноразового шприца с замком Люэра. Установите экструдер шприцевого насоса на принтер.
ПРИМЕЧАНИЕ: Файлы CAD, необходимые для модификации экструдера шприцевого насоса для пластиковых шприцев, приведены в дополнительных файлах 1-3. - Установите и откройте программное обеспечение 3D-принтера (см. Таблицу материалов) на компьютере. Подключите 3D-принтер к компьютеру.
- Загрузите одноразовый шприц объемом 1 мл иглой соответствующего размера в зажимы, напечатанные на 3D-принтере, совместив верхнюю и нижнюю половины механизма (рис. 1). Закрепите зажимы вокруг шприца с помощью трех торцевых болтов M8 и тонких стальных шестигранных гаек (см. Таблицу материалов). Поршень шприца соединяется с ходовым винтом в экструдере шприцевого насоса. Вручную поднимите поршень, вращая ходовой винт, чтобы создать в шприце воздушный зазор объемом 0,5 мл.
- Если загрязнение является проблемой для эксперимента, транспортируйте комплекс шприц-зажим в биокапот и стерилизуйте 70% этаноловым спреем при входе, прежде чем выполнять следующие шаги.
2. Приготовление бактериальной суспензии
- Для V. cholerae и E. coli выращивают в течение ночи на 2%-ной агаровой пластине Lennox LB (бульон Лурии, см. таблицу материалов) при температуре 37 °C.
- Для V. cholerae инокулируют клетки в 3 мл жидкого LB с десятью стерильными стеклянными шариками. Выращивают клетки во встряхивающем инкубаторе при 37 °C в течение 5-6 ч до середины экспоненциальной фазы до оптической плотности (OD) 600 ~0,9.
- При обнаружении кишечной палочки инокуляцию клеток в 3 мл жидкого LB. Выращивайте клетки во встряхивающем инкубаторе при температуре 37 °C в течение ночи. Иннокуляцию 200 мкл ночной культуры в свежий LB в течение 3 ч до тех пор, пока наружный диаметр не достигнет 0,6.
- Переложите культуру в центрифужную пробирку объемом 10 мл. Центрифугируйте культуру в течение 5 мин при 5 000 x g при комнатной температуре до образования гранулы. Удалите надосадочную жидкость. Ресуспендируйте с ~10 мкл жидкого LB для достижения плотности клеток ~9 x 1010 клеток на мл.
3. Загрузка бактериальной суспензии в шприц
ПРИМЕЧАНИЕ: Для загрузки бактерий в шприц предусмотрены два метода (шаг 3.1 и шаг 3.2). Этап 3.1 предназначен для загрузки небольших объемов бактериальных суспензий, <200 мкл, а этап 3.2 предназначен для загрузки больших объемов бактериальных суспензий, >200 мкл. Шаг 3.1 был использован для получения репрезентативных результатов, показанных здесь.
- Загрузите пустой пластиковый шприц с замком Луэра объемом 1 мл в 3D-биопринтер. Соедините поршень шприца с ходовым винтом. Вручную втяните шприц, чтобы добавить 0,2 мл воздушного зазора, чтобы обеспечить место для движения поршня в шприце, так как для каждой партии экспериментов используется небольшой объем клеток ~20-50 мкл.
- Прикрепите тупую иглу к наконечнику шприца с размером иглы, необходимым для требуемого размера печатных элементов. Здесь используется 2-дюймовая игла 20 G.
- Загрузите бактериальную суспензию в шприц, поместив центрифужную пробирку объемом 10 мл с бактериальным посевным материалом под иглу. Вручную поверните винт, чтобы втянуть поршень шприца и загрузить ячейки в шприц. Объемы бактериальных клеток настолько малы, что часто клетки загружаются только в иглу.
- Снимите поршень с комплекса шприц-зажим и с помощью другого шприца и иглы осторожно загрузите комплекс шприц-зажим желаемыми бактериальными суспензиями, стараясь не задерживать пузырьки воздуха. Комплекс шприц-зажим следует слегка наполнить до краев нужной бактериальной суспензией, а затем перенести в биопринтер.
- Аккуратно вставьте комплекс шприц-зажим без поршня в соответствующее гнездо на основном сердечнике экструдера биопринтера.
- Убедитесь, что каретка принтера находится примерно на полпути к ходовому винту, а под загруженным шприцем находится чашка для сбора. Затем осторожно введите поршень как через каретку, так и через комплекс шприц-хомут до тех пор, пока он не зацепится за каретку. Медленно вдавите поршень в бактериальную суспензию, чтобы избежать попадания пузырьков воздуха в шприц.
- Наденьте зажим адаптера на каретку через заднюю часть поршня, чтобы закрепить его на месте как для выдавливания, так и для втягивания.
4. Калибровка шага экструдера по объему осаждения
- Чтобы откалибровать шаг экструдера (E-step) в соответствии с осажденным объемом, сначала настройте биопринтер с точным шприцем, иглой шприца и отсадочной бактериальной суспензией, которая будет использоваться в эксперименте. Здесь используется шприц с замком Люэра объемом 1 мл.
- Определите предполагаемый диапазон шагов E для калибровки, выдавливая произвольное число шагов E (~200), и запишите изменение объема плунжера с помощью маркеров объема шприца.
- Используйте это грубое отношение E-шага к объему, чтобы определить настройки E-step для выполнения калибровки. Например, если E-шаг 200 при визуальном осмотре выдавливает примерно 20 мкл, а кто-то хочет нанести 10-200 мкл, протестируйте E-шаги в диапазоне от 100 до 2000.
- Чтобы выполнить линейную калибровку, сначала разметьте и измерьте сухую массу двадцати пробирок для отбора проб объемом 1,5 мл на аналитических весах с чувствительностью 0,1 мг.
- Выдавить бактериальную суспензию в предварительно отмеренные пробирки объемом 1,5 мл. Для каждого E-шага выполните не менее 2 репликаций. Повторите эти действия для всех шагов E в линейном диапазоне, при необходимости заменяя бактериальную суспензию. Если для эксперимента существует проблема загрязнения, протирайте внешнюю поверхность иглы шприца безворсовой салфеткой, пропитанной 70% этанолом, после каждого образца.
- Измерьте массу всех пробирок объемом 1,5 мл с помощью одинаковых аналитических весов. Вычтите первое значение массы из второго, чтобы получить чистую массу отложенной бактериальной суспензии.
- Переведите массу бактериальной суспензии в объем с плотностью материала. Для многих бактериальных суспензий, состоящих в основном из воды, 1 г/мл является подходящим приближением плотности.
- Выполните линейную подгонку между шагом E и экструдированным объемом, чтобы завершить процесс калибровки.
5. Приготовление гранулированной гидрогелевой матрицы
- В шкафу биобезопасности добавьте сухие гранулы сшитых сополимеров акриловой кислоты/алкилакрилата (см. таблицу материалов) в 400 мл 2% Леннокса Лурия-Бертани (LB), чтобы матрица оставалась стерильной; Однако для набухания гидрогелевой матрицы можно использовать и другие жидкие питательные среды для клеток.
ПРИМЕЧАНИЕ: Весовой процент гранул, добавляемых в LB, зависит от размера пор, к которому вы стремитесь. В настоящем исследовании для 0,9% гранулированной гидрогелевой матрицы добавляют 3,6 г сухих гранул в LB, а для гранулированной гидрогелевой матрицы 1,2% добавляют 4,8 г сухих гранул в LB. Гранулы гидрогеля однородно диспергируют, перемешивая их в миксере в течение 2 мин. - После смешивания отрегулируйте pH до 7,4, добавив от 20 до 500 мкл с шагом 10 М гидроксида натрия (NaOH), чтобы обеспечить жизнеспособность клеток. После каждого добавления NaOH измеряйте pH, погружая наконечник пипетки в смесь, а затем протирая гидрогелевую матрицу о бумагу для определения pH.
ПРИМЕЧАНИЕ: По мере добавления NaOH вязкость смеси будет увеличиваться, поскольку гранулы гидрогеля начинают набухать. Набухшие гранулы гидрогеля имеют диаметр от ~5 мкм до 10 мкм и склеены вместе в гидрогелевую матрицу. Внутренний размер ячеек гранул составляет от ~40 нм до 100 нм, как установлено ранее32. Размер ячейки достаточно велик для того, чтобы небольшие молекулы (например, кислород и питательные вещества) могли свободно диффундировать, но достаточно мал для того, чтобы бактерии могли находиться между межклеточными порами. - Далее переносят гранулированную гидрогелевую матрицу в центрифужную пробирку объемом 50 мл с помощью стерильного пластикового шприца объемом 50 мл. Центрифугируйте гидрогелевую матрицу при концентрации 161 x g в течение 1 мин при комнатной температуре, чтобы удалить пузырьки, образующиеся в процессе смешивания.
- Дайте гидрогелевой матрице постоять не менее 2 дней при комнатной температуре, чтобы убедиться в отсутствии загрязнения. Загрязнение проявляется в виде микроколоний, взвешенных в гидрогелевой матрице. Через два дня центрифугируйте гидрогелевую матрицу при концентрации 161 x g в течение 1 мин, чтобы удалить образовавшиеся дополнительные пузырьки.
ПРИМЕЧАНИЕ: Протокол можно приостановить, храня гидрогелевую матрицу при комнатной температуре до недели. - В шкафу биобезопасности с помощью стерильного пластикового шприца объемом 30 мл переносят нужное количество гидрогелевой матрицы в контейнер, где будет происходить печать (здесь использовали ~20 мл для 20 мл колбы для тканевой культуры или 1 мл для 1 мл пластиковых микрокювет).
6. Характеристика реологических свойств гранулированной гидрогелевой матрицы
- Загрузите ~3 мл гидрогелевой матрицы в сдвиговой реометр (см. таблицу материалов) с зазором 1 мм между шероховатыми параллельными пластинами диаметром 50 мм для измерения реологических свойств.
- Количественно оцените текучесть с помощью однонаправленных измерений сдвига на реометре сдвига, измерив напряжение сдвига в зависимости от логарифмической развертки скорости сдвига от 10-4 с-1 до 102 с-1 (например, рисунок 2A).
ПРИМЕЧАНИЕ: При низких скоростях сдвига гидрогелевая матрица будет иметь постоянное напряжение сдвига (предел текучести), которое не зависит от скорости сдвига. При высоких скоростях сдвига напряжение сдвига будет увеличиваться со степенной зависимостью от скорости сдвига, что указывает на псевдоожижение матрицы гидрогеля. Такое поведение предела текучести позволяет печатать бактерии на 3D-принтере в гранулированной гидрогелевой матрице29. - Измерьте модули накопления и потерь, G' и G'' соответственно, в зависимости от частоты, используя осцилляторные реологические свойства малой амплитуды с амплитудой деформации 1% и частотами от 0,1 до 1 Гц (например, рисунок 2B).
ПРИМЕЧАНИЕ: Идеальная гранулированная гидрогелевая матрица для 3D-печати должна иметь модуль хранения, превышающий модуль потерь, что указывает на то, что среда действует как застрявшее упругое твердое вещество29.
7. Характеристика размера интерстициальных пор гранулированной гидрогелевой матрицы
- Наносите ультразвуком 100 нм карбоксилированные флуоресцентные наночастицы полистирола (~3,6 x 1013 частиц/мл, см. таблицу материалов) в упаковке в течение 15 мин для ресуспендирования для разрушения любых агрегаций/кластеров частиц. Перенесите 50 мкл наночастиц в микроцентрифужную пробирку объемом 1,5 мл.
- Центрифуга в течение 10 мин при 9 500 x g при комнатной температуре до образования гранул и прозрачности надосадочной жидкости. Удалите надосадочную жидкость и повторно суспендируйте гранулу в 1 мл жидкой питательной среды (в данном случае LB), используемой для приготовления гранулированной гидрогелевой матрицы.
ПРИМЕЧАНИЕ: Здесь протокол можно приостановить, храня ресуспендированные наночастицы при 4 °C до 3 месяцев.
- Центрифуга в течение 10 мин при 9 500 x g при комнатной температуре до образования гранул и прозрачности надосадочной жидкости. Удалите надосадочную жидкость и повторно суспендируйте гранулу в 1 мл жидкой питательной среды (в данном случае LB), используемой для приготовления гранулированной гидрогелевой матрицы.
- Подвергайте ресуспендированные наночастицы ультразвуковой обработке в течение 30 минут. Перелейте 1 мл гранулированной гидрогелевой матрицы в микроцентрифужную пробирку объемом 1,5 мл. Добавьте 1 мкл ресуспендированных наночастиц в гранулированную гидрогелевую матрицу и перемешайте их наконечником пипетки. После смешивания центрифугу в течение 30 с при 161 х г при комнатной температуре.
- Перенесите гидрогелевую матрицу и смесь наночастиц в чашку Петри диаметром 35 мм со стеклянным дном толщиной 0,1 мм. Скважина имеет диаметр 20 мм и глубину 1 мм. Положите сверху стеклянную защитную пленку и надавите, чтобы отключить поток и испарение во время визуализации. Альтернативой стеклянному покровному покрытию является добавление сверху 1 мл парафинового масла.
- Визуализируйте наночастицы с помощью конфокального микроскопа с 40-кратным масляным объективом и 8-кратным дополнительным увеличением в программном обеспечении для визуализации (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Вместо использования дополнительного цифрового зума в программном обеспечении можно использовать объектив с более высоким увеличением.- Визуализируйте временную петлю без задержки (в идеале ~19 кадров/с) в одной z-плоскости в течение 2 минут с не менее чем четырьмя наночастицами в поле зрения. Повторите 15-20 раз в разных местах, чтобы собрать достаточно данных для статистики (от 100 до 200 наночастиц).
- Используйте программное обеспечение для отслеживания частиц для анализа смещения частиц. Здесь используется специально написанный сценарий, основанный на классическом алгоритме Крокера-Гриера, для отслеживания центра масс наночастицы35 (см. Дополнительный файл 7).
- На основе отслеживания частиц вычислите среднеквадратичное смещение (MSD). MSD будет демонстрировать свободную диффузию в поровом пространстве на коротких длинах и временных масштабах и перейдет к субдиффузионному масштабированию на больших длинах и временных масштабах из-за конфайнмента35.
- Определите шкалу длины, на которой происходит переход к субдиффузионному масштабированию, чтобы оценить локальный размер пор. Рассчитайте размер пор, добавив эту шкалу длины к диаметру наночастицы. Повторите анализ размера пор для каждой измеряемой наночастицы. Это даст распределение пор по размерам, на основе которого можно рассчитать средний размер пор (например, рисунок 3).
8. 3D процесс печати
- Изготовленные на 3D-принтере держатели для контейнеров с образцами (см. Дополнительные файлы 4-6 для файлов CAD). Здесь используются держатели для колб для тканевых культур и микрокюветы. Держатели позволяют запрограммировать принтер на печать нескольких образцов за один сеанс печати. Поместите контейнеры с образцами с гидрогелевой средой в держатели на рабочей платформе.
- Откройте программу для 3D-печати. Загрузите предварительно запрограммированный g-код в программное обеспечение. Для получения репрезентативных результатов используется шаг 3.1 для загрузки бактериальной суспензии в 3D-принтер.
ПРИМЕЧАНИЕ: Пример g-кода для печати линейной вертикальной геометрии приведен в таблице 1. - С помощью программного обеспечения для 3D-печати переместите плоскости x-y-z, чтобы отцентрировать печатающую головку в плоскости x-y, чтобы она стала первым контейнером, а затем переместить ось z. Ось Z самонаведения поднимет печатающую головку. Медленно вращайте винт, чтобы нажать на поршень шприца, пока на кончике иглы не появится небольшое количество бактериальной суспензии.
- Слегка сотрите излишки бактериальной суспензии стерильной одноразовой салфеткой. В зависимости от высоты держателя образца, иглы и шприца, используя программное обеспечение для 3D-печати, опустите печатающую головку на фиксированное расстояние в гидрогелевую среду в выбранном контейнере для образцов. Запустите процесс печати, нажав на кнопку «Печать».
- После завершения печати закройте контейнеры для образцов. Протрите принтер 70% этанолом. Правильно утилизируйте шприц и иглу.
9. Выращивание и визуализация V. cholerae
- Для получения изображений с большим полем зрения используйте камеру с зум-объективом, чтобы запечатлеть рост клеток с помощью лайтбокса. Отобразите образцы сразу после печати при комнатной температуре, а затем перенесите их в инкубатор. Поддерживайте образцы при температуре 37 °C в стационарном инкубаторе между сеансами визуализации во время эксперимента.
- Делайте снимки в течение желаемого периода времени, чтобы наблюдать за поведением роста в течение длительных периодов времени в гранулированной гидрогелевой матрице.
Результаты
Использование 3D-биопринтера с гранулированной гидрогелевой матрицей расширяет возможности биопринтеров по печати колоний бактерий в формы, которые при печати на плоской подложке опустились бы из-за низкой вязкости бактериальной суспензии. Разрешение представленного здесь подхода зависит от скорости экструзии, размера иглы, скорости печатающей головки, воздуха в игле и вязкости бактериальной суспензии. Из-за малого объема бактериальной суспензии во время загрузки бактериальной суспензии в шприц и иглу могут случайно попасть пузырьки воздуха. Это может привести к тому, что в готовой печатной структуре оседают пузырьки воздуха (рис. 4). Еще один способ введения пузырьков воздуха в печать - это если не нажимать на поршень, чтобы образовалась небольшая капля бактериальной суспензии на кончике иглы перед печатью, а на кончике иглы существует воздушный зазор. Если не нажимать на поршень шприца перед печатью, это также может привести к тому, что в одной и той же партии будут напечатаны разные объемы клеток. Однако с течением времени пузырь воздуха растворяется в окружающей среде, как показано на рисунке 4.
Для калибровки шага экструзии наплавленный объем зависит от того, как линейный привод печатающей головки перемещает поршень шприца, внутренний диаметр шприца будет напрямую влиять на объем. Кроме того, реологические свойства бактериальной суспензии влияют на то, насколько легко они проходят через сжатие иглы для плавной печати. Таким образом, эта процедура калибровки должна быть повторена для каждой настройки шприца/иглы/бактериальной суспензии. В принципе, калибровка шприца может быть автоматизирована. Однако на практике написание такого кода, который широко применим ко многим случаям использования, было бы сложной задачей. Например, пользователю, стремящемуся откалибровать экструзию примерно 300 мкл из шприца объемом 1 мл, потребуется перезагружать шприц гораздо чаще, чем пользователю, калибрующему около целевого объема в 30 мкл. Поскольку константа калибровки от шага E до объема неизвестна на момент начала процесса калибровки, пользователь может быть не в состоянии точно предсказать, как часто на самом деле потребуется повторная загрузка. Кроме того, для автоматизации процесса калибровки необходимо указать точное положение каждой предварительно взвешенной пробирки объемом 1,5 мл. Чтобы убедиться, что все биочернила осаждаются из иглы в пробирку для точной калибровки, между иглой и дном/стенкой трубки должен быть установлен точный контакт. Без хорошего контакта мелкие капли могут остаться смоченными и прилипнуть к игле. Таким образом, любое изменение положения труб может в значительной степени способствовать ошибкам в процессе калибровки. По этим причинам авторы рекомендуют каждому пользователю создать программу калибровки, соответствующую его уникальным потребностям.
Ключевой особенностью представленного здесь подхода является возможность визуализировать распространение бактерий в окружающей среде непосредственно через подвижность и рост с помощью визуализации. В более ранней версии протокола визуализации 6-луночные планшеты заполняли 19 мл гранулированной гидрогелевой матрицы. Тем не менее, даже при успешной 3D-печати горизонтальной линии клеток, которую можно было бы наблюдать на инвертированном микроскопе, плотная колония также будет расти на верхней поверхности среды, ограничивая визуализацию с помощью светлопольной микроскопии (рис. 5). Колония на верхней поверхности, вероятно, образовалась в результате загрязнения, когда игла шприца была помещена в носитель или удалена из него во время печати. Чтобы обойти эту проблему, вертикальные линии клеток печатаются в сцинтилляционных флаконах (рис. 6А). Однако кривизна цилиндрических флаконов вызвала деформацию во время визуализации. Это привело к выбору плоскостенных кювет и колб для тканевых культур в качестве контейнеров для образцов для печати, что позволило получить неискаженное изображение (рис. 6B-D). Одним из ограничений колб для тканевых культур является небольшое наклонное горлышко, которое ограничивает геометрию, которую можно напечатать.
В совокупности этот протокол позволяет наблюдать за подвижностью и ростом бактерий в сложных пористых средах в течение длительного времени. На рисунке 6B-G показаны примеры формирования биопленки V. cholerae с помощью светлопольной микроскопии, а также планктонных клеток E. coli с помощью лазерно-сканирующей флуоресцентной конфокальной микроскопии, демонстрирующие универсальность этого подхода. Действительно, потенциальной проблемой гидрогелевых матриц является их возможная автофлуоресценция при визуализации с помощью флуоресцентной микроскопии; однако изображения, показанные на рисунке 6F,G, показывают, что такая автофлуоресценция минимальна на представленной здесь экспериментальной платформе. Еще одним ограничением таких подходов оптической микроскопии является их пространственное разрешение, которое задается дифракционным пределом в ~100 нм; однако эта шкала длины намного меньше, чем размер отдельной бактериальной клетки, и поэтому оптические методы дают возможность визуализировать бактериальные клетки от масштаба отдельных клеток (рис. 6G) до масштаба более крупных многоклеточных колоний 30,31,32,33. Дополнительные примеры описаны ниже.
Как отмечалось выше, представленный здесь подход может быть использован для 3D-печати и изображения бактериальных колоний в малых (1 мл) и больших (20 мл) матричных объемах. Таким образом, различия в результатах, полученных с использованием разных объемов, описаны ниже, на примере репрезентативных колоний подвижных и неподвижных V. cholerae , напечатанных на 3D-принтере. Пространственное разрешение (ширина линии) отпечатка задается внутренним диаметром сопла. В примерах, описанных ниже, игла с внутренним диаметром 0,6 мм дает начальную цилиндрическую колонию 0,6 мм. Предыдущая работа показала, что разрешение печати может быть снижено еще больше, если использовать вытянутый стеклянный капилляр с внутренним диаметром ~100-200 мкм33.
Для небольших объемов используются две различные гранулированные гидрогелевые матрицы с двумя различными распределениями пор по размерам: одна со средним размером пор больше, чем средний диаметр клетки V. cholerae , 0,2-0,4 мкм36, а другая со средним размером пор меньше этого диаметра. Образцы в течение двенадцати дней получают изображения и измеряют с помощью анализа изображений расширения колоний с течением времени (рис. 7 и рис. 8). Для неподвижных клеток, которые могут распространяться в окружающей среде только за счет клеточного роста, скорость расширения площади была одинаковой между различными исследованными матрицами (рис. 7), что указывает на то, что различия в размере пор матрикса не влияют на распространение клеток в процессе роста, как и ожидалось. Напротив, для подвижных клеток, которые распространяются в окружающей среде посредством активной подвижности, скорость площадного расширения V. cholerae была выше для гидрогелевого матрикса с более крупными порами, для которых удержание зернами гидрогеля меньше затрудняет клеточную подвижность. Эти различия в распространении бактерий также были очевидны в морфологии колоний (рис. 8). Колония V. cholerae в гидрогелевых матрицах с более крупными порами распространяется через гладкие, диффузные шлейфы (рис. 8А), что отражает распространение за счет активной подвижности, как это наблюдалось ранее32. Действительно, в соответствии с этой интерпретацией, эти диффузные шлейфы не наблюдаются в случае неподвижных клеток (рис. 8C). Кроме того, поры достаточно большие, чтобы клетки не выталкивали шарики, когда они плавают через поры. Кроме того, вязкое напряжение, создаваемое плаванием, составляет менее 1 Па, что недостаточно для заметной деформации окружающей гидрогелевой матрицы. Напротив, колония в гидрогелевых матрицах с меньшими порами распространяется только через шероховатые, фрактальноподобные шлейфы как для подвижных, так и для неподвижных клеток (рис. 8B, D), отражая распространение исключительно за счет клеточного роста, в то время как клетки растут, они временно деформируются и уступают окружающий матрикс. На самом деле, учитывая, что предел текучести гидрогелевых матриц намного меньше, чем тургорное давление ячеек, в этом пределе малого размера пор матрица обеспечивает только слабое сопротивление росту клеток и, по-видимому, не оказывает сильного влияния на структуру, напечатанную на 3D-принтере, что также было подтверждено в нашей предыдущей работе37.
Аналогичные результаты наблюдаются и для экспериментов, выполненных на образцах большого объема; Однако, учитывая большее обилие питательных веществ в этих образцах, эксперименты могут поддерживать клеточный рост в течение более длительных временных масштабов. В качестве примера показаны результаты с использованием гранулированных гидрогелевых матриц, где средний размер пор был меньше размера клетки, и, таким образом, распространение клеток происходило в первую очередь за счет роста. Образцы визуализируются в течение ~30 дней в гранулированных гидрогелевых матрицах и наблюдаются одинаковое расширение площади как для неподвижных, так и для подвижных клеток в течение первых 150 ч; однако в течение еще более длительных периодов времени наблюдается сильная изменчивость между образцами, при этом некоторые образцы демонстрируют более высокие темпы распространения (Рисунок 9 и Рисунок 10). Интересно, что при повторной выборке гидрогелевой матрицы после эксперимента - преимущество большого объема гидрогелевой матрицы - измеряется снижение предела текучести, модулей накопления и модулей потерь (рис. 11), что указывает на то, что матрицы стали мягче. Это изменение может быть связано с тем, что V. cholerae продуцирует молекулу, которая изменяет свойства гидрогелевого матрикса и способствует распространению клеток в течение длительного времени, что будет интересно проверить в будущих исследованиях. Примеры грубых, фрактальноподобных морфологий колоний, которые получаются в результате этих экспериментов, показаны на рисунке 10.

Рисунок 1: Изображения 3D-биопринтера, изготовленного по индивидуальному заказу. (A) Биопринтер с модифицированной головкой экструдера шприцевого насоса с одноразовым шприцем и иглой с замком Люэра. Ширина биопринтера ~46 см. (Б) Изображение 3D-печати клеток в колбах, заполненных застрявшей гидрогелевой матрицей. Ширина изображения 87 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
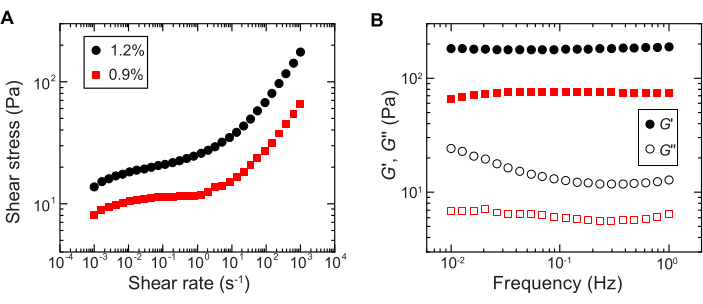
Рисунок 2: Характеристика реологических свойств гранулированных гидрогелевых матриц. (A) Напряжение сдвига в зависимости от приложенной скорости сдвига. (B) Модули накопления и потерь, G' и G'' соответственно, в зависимости от частоты колебаний. В условных обозначениях указывается массовая доля гидрогеля, используемая для приготовления каждой гидрогелевой матрицы. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
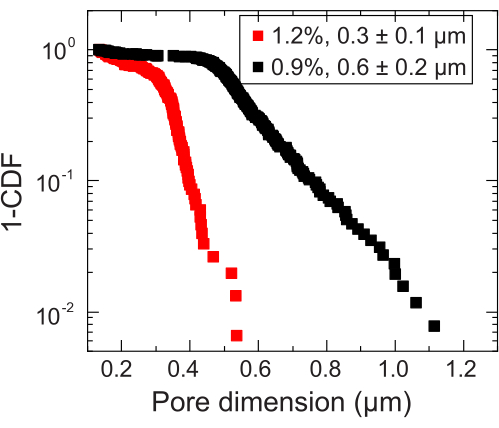
Рисунок 3: Измерение размера пор двух репрезентативных гранулированных гидрогелевых матриц. С помощью отслеживающих индикаторов определяется распределение характерных размеров пор для каждой гидрогелевой матрицы. Данные представлены 1-CDF, где CDF — кумулятивная функция распределения. В условных обозначениях указана массовая доля гидрогеля, используемая для приготовления каждой матрицы. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
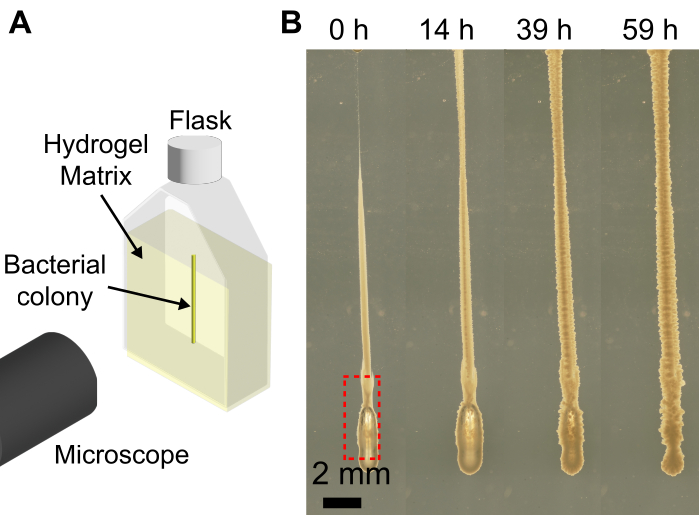
Рисунок 4: Примеры пузырьков, образующихся при 3D-печати бактерий. (A) Схема установки визуализации. (B) Снимки роста V. cholerae с пузырем в нижней части отпечатка (красная рамка) в 1,2% гидрогелевой матрице, набухшей в LB. Через 59 ч выращивания при 37 °C пузырь воздуха полностью растворяется, и колония схлопывается обратно за счет эластичности гидрогелевой матрицы. Масштабная линейка = 2 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Изображения горизонтальной линии подвижных V. cholerae, напечатанных в шестилуночном планшете, заполненном 1,2% гидрогелевой матрицей, набухшей в LB и биопленке, образовавшейся на верхней поверхности после 48 ч инкубации при 37 °C. (A) Схема установки визуализации. (B) Образование биопленки на верхней поверхности из-за загрязнения во время 3D-печати снижает непрозрачность и не позволяет получить четкое изображение горизонтальной линии. На верхней поверхности образуются морщины, предположительно из-за дифференциального роста. Масштабная линейка = 5 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
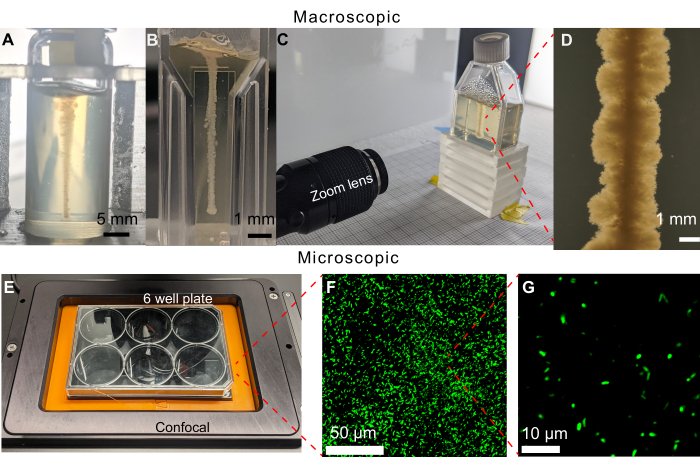
Рисунок 6: Примеры различных контейнеров для образцов, которые можно использовать в этом методе. (А) V. cholerae, напечатанный в стеклянном флаконе, заполненном 1,2% гранулированной гидрогелевой матрицей, через 470 ч. Кривизна флакона затрудняет визуализацию роста. Масштабные линейки = 5 мм. (B) V. cholerae , напечатанные в микрокювете, заполненной 1,2% гранулированной гидрогелевой матрицей. Плоские стороны позволяют получать четкие изображения, однако небольшие объемы ограничивают продолжительность экспериментов до того, как в клетках закончатся субстраты для роста. (C) Установка визуализации с зум-объективом для получения изображения V. cholerae , напечатанного в колбе для культуры тканей, заполненной 1,2% гранулированной гидрогелевой матрицей. Как и в случае с футляром для микрокюветы, плоские стороны обеспечивают четкое изображение. Колбы для тканевых культур могут быть заполнены большими объемами гранулированной гидрогелевой матрицы, что удлиняет время эксперимента. (D) Изображение V. cholerae , напечатанное с помощью зум-объектива внутри 1,2%-ной гранулированной гидрогелевой матрицы после 100 ч инкубации при 37 °C. Масштабная линейка = 1 мм. (E) Установка визуализации с помощью конфокального микроскопа для получения изображений флуоресцентных клеток. (F) 3D-проекция конфокальных микрофотографий флуоресцентной кишечной палочки внутри 1,2% гранулированной гидрогелевой матрицы после 10 дней инкубации при 37 °C. Масштабная линейка = 50 мкм. (G) Конфокальная микрофотография флуоресцентной кишечной палочки внутри гидрогелевой матрицы с разрешением одной ячейки. Масштабная линейка = 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
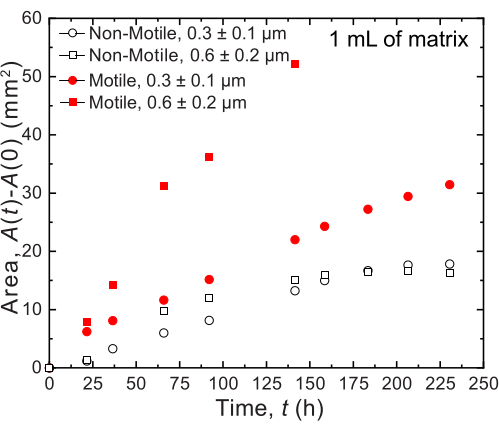
Рисунок 7: Расширение площади в зависимости от времени колоний V. cholerae , напечатанных в 1 мл гранулированных гидрогелевых матриц. Данные на графике взяты из анализа изображений на рисунке 8. Было замечено, что подвижные клетки (замкнутые красный круг и квадрат) распространяются с большей скоростью, чем неподвижные клетки, отражая распространение как по росту, так и по подвижности. Кроме того, подвижные клетки в гидрогелевой матрице с большим размером пор (красные квадраты) распространяются быстрее, чем клетки в гидрогелевом матриксе с порами 0,3 мкм (красные круги). Неподвижные клетки не показывают разницы в скорости расширения площади между двумя размерами пор, так как они только растут. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 8: Колонии V. cholerae , напечатанные в 1 мл гранулированных гидрогелевых матриц. (A) Снимки роста и подвижности подвижных V. cholerae в 0,9% гранулированной гидрогелевой матрице, где размер пор больше, чем средний диаметр клеток. Стрелками обозначен диффузный шлейф, который образуется из-за движения клеток через гидрогелевый матрикс. (B) Моментальные снимки роста и подвижности подвижных V. cholerae в 1,2% гранулированной гидрогелевой матрице, где размер пор меньше, чем средний диаметр клетки. Стрелки указывают на шероховатый, фрактально-подобный шлейф, который образуется из-за роста клеток. (C) Моментальные снимки временной эволюции неподвижных V. cholerae в 0,9% гранулированном гидрогелевом матриксе, где размер пор больше, чем средний диаметр клеток. При этом диффузные шлейфы, отражающие подвижность, не наблюдаются. (D) Моментальные снимки роста неподвижных V. cholerae в 1,2% гранулированной гидрогелевой матрице, где размер пор меньше среднего диаметра клетки. В этом случае снова наблюдаются шероховатые, фрактальные шлейфы, отражающие рост. Масштабные линейки = 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
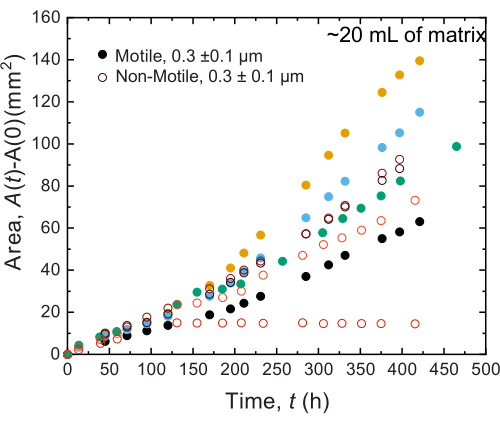
Рисунок 9: Расширение площади в зависимости от времени колоний V. cholerae , напечатанных в 20 мл 1,2% гранулированных гидрогелевых матриц. Наблюдается, что неподвижные (разомкнутые круги) и подвижные клетки (замкнутые круги) распространяются с одинаковой скоростью в течение первых 100 часов. Через 100 ч наблюдаются различия в скоростях расширения площади, возможно, из-за эволюции изменчивости в течение длительного времени. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 10: Колонии V. cholerae , напечатанные в 22 мл 1,2% гранулированных гидрогелевых матриц, выращенных при 37 °C. (Вверху) Снимки роста подвижных V. cholerae. (Внизу) Моментальные снимки роста неподвижных V. cholerae. В обоих случаях наблюдаются шероховатые, фрактальноподобные шлейфы, отражающие рост. Масштабные линейки = 2 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
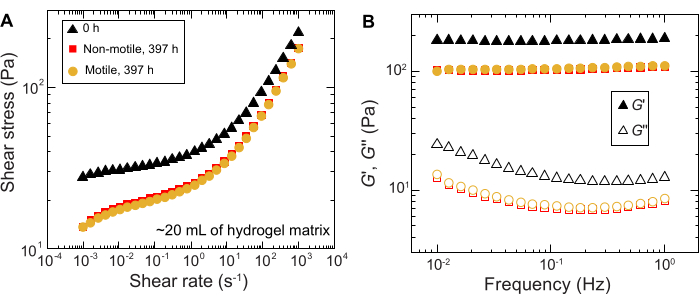
Рисунок 11: Характеристика реологических свойств 1,2%-ной гранулированной гидрогелевой матрицы до (0 ч) и после эксперимента (397 ч). (A) Напряжение сдвига в зависимости от приложенной скорости сдвига. (B) Модули накопления и потерь, G' и G'' соответственно, в зависимости от приложенной частоты колебаний. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
| Команды Gcode | Задачи | |||
| М82 | Режим абсолютной экструзии | |||
| М302 С0 | Включить холодную экструзию | |||
| М92 Э14575 | Установка шагов экструзии на мм | |||
| Г92 С35,61 И81 З0 Э0,0 | Установите ось Z и положение экструзии на ноль, а положение x-, y- на 35,71 мм и y 88 мм, где находится печатающая головка, когда запускается g-код | |||
| М221 С100 Т0 | Устанавливает скорость потока на 100% | |||
| М107 | Выключите вентилятор | |||
| Г1 Ф1 С35.61 И81 Э0.1 | Выдавить 20 мкл биочернил в матрицу со скоростью подачи 50 мкл/мин в том месте, где было установлено текущее положение | |||
| Г0 Ф200 З60 | Вытащить иглу из матрицы и отобрать образец со скоростью 200 мм/мин | |||
| Г0 Ф500 С65.81 Г81.0 | Переместите иглу к следующему контейнеру образцов со скоростью 500 мм/мин | |||
| Г0 Ф100 З0 | Опустите иглу в следующий контифайнер образца в то же z-положение, где началась печать со скоростью 100 мм/мин | |||
| G1 F1 X65.81 Y81.0 E0.2 | Выдавить 20 мкл биочернил в матрицу со скоростью подачи 50 мкл/мин в том месте, где было установлено текущее положение | |||
| Г0 Ф200 З60 | Вытащить иглу из матрицы и отобрать образец со скоростью 200 мм/мин | |||
| Г0 Ф500 С96.01 Г81.0 | Переместите иглу к следующему контейнеру образцов со скоростью 500 мм/мин | |||
| Г0 Ф100 З0 | Опустите иглу в контианер образцов в то же z-положение, с которого началась печать со скоростью 100 мм/мин | |||
| Г1 Ф1 С96.01 Г81.0 Э0.3 | Выдавить 20 мкл биочернил в матрицу со скоростью подачи 50 мкл/мин в том месте, где было установлено текущее положение | |||
| Г0 Ф200 З60 | Вытащить иглу из матрицы и отобрать образец со скоростью 200 мм/мин | |||
| Г0 Ф500 С126.21 Г81.0 | Переместите иглу к следующему контейнеру образцов со скоростью 500 мм/мин | |||
| Г0 Ф100 З0 | Опустите иглу в следующий контифайнер образца в то же z-положение, где началась печать со скоростью 100 мм/мин | |||
| Г1 Ф1 С126.21 И81.0 Э0.4 | Выдавить 20 мкл биочернил в матрицу со скоростью подачи 50 мкл/мин в том месте, где было установлено текущее положение | |||
| Г0 Ф200 З80 | Вытащить иглу из матрицы и отобрать образец со скоростью 200 мм/мин | |||
Таблица 1: Программирование G-кода для печати вертикальных линий бактериальной суспензии.
Дополнительный файл 1: STL-файл для нижнего зажима 1 мл одноразовых шприцев с замком Люэра для экструдера шприцев. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 2: STL-файл для верхнего зажима для одноразовых шприцев с замком Люэра объемом 1 мл для экструдера шприцев. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 3: STL-файл для адаптера шприца для одноразовых шприцев с замком Люэра объемом 1 мл для экструдера шприцев. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 4: Файл STL для держателя образца кюветы. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 5: STL-файл для держателя образца тканевой колбы. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 6: STL-файл для 6-луночного планшета и 35-миллиметровой чашки Петри. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 7: Пользовательский скрипт для отслеживания частиц. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
Критические шаги в протоколе
Важно следить за тем, чтобы при приготовлении каждой гидрогелевой матрицы матрица изготавливалась в стерильной среде. В противном случае может произойти контаминация, которая проявляется, например, в виде микроколоний (небольших сфероидов) в матрице через несколько дней. В процессе смешивания важно, чтобы все сухие гранулированные частицы гидрогеля растворились. Кроме того, при регулировке pH каждой гидрогелевой матрицы с помощью NaOH гранулы начинают набухать, что увеличивает вязкость гидрогелевой матрицы, что затрудняет смешивание. Использование стационарного миксера поможет обеспечить хорошее смешивание NaOH с гидрогелевой матрицей. Во время загрузки каждой бактериальной суспензии в игле могут образовываться воздушные карманы. Чтобы избежать этой проблемы, убедитесь, что кончик иглы всегда находится в бактериальной суспензии в центрифужной пробирке, а не на дне пробирки или рядом с верхней поверхностью. Другим способом решения этой проблемы является выращивание больших объемов клеток и, таким образом, получение больших объемов бактериальной суспензии для печати.
Ограничения
В настоящее время во время печати низкая вязкость бактериальной суспензии ограничивает геометрию, которая может быть напечатана, и часто приводит к образованию биопленки и росту на поверхности гидрогелевой матрицы из-за следовых клеток. Существует несколько потенциальных методов преодоления этого ограничения, включая увеличение вязкости бактериальной суспензии или дальнейшую оптимизацию настроек 3D-принтера. Для повышения вязкости бактериальной суспензии можно смешивать бактериальную суспензию с другим полимером, например, с альгинатом, который ранее использовался для 3D-печати бактерий на плоских поверхностях38. Настройки принтера могут быть дополнительно оптимизированы, чтобы обеспечить втягивание поршня шприца во время извлечения иглы из гранулированной гидрогелевой матрицы, что потенциально может предотвратить осаждение клеток во время извлечения иглы из гидрогелевой матрицы.
Значимость метода по отношению к существующим/альтернативным методам
Описанный здесь метод позволяет печатать колонии бактерий в гранулированные гидрогелевые матрицы. Гранулированные гидрогелевые матрицы позволяют изучать влияние факторов внешней среды (например, размера пор, деформируемости матрицы) на подвижность и рост бактерий. Кроме того, в то время как в этой работе LB используется в качестве жидкой питательной среды для набухания гидрогелевого матрикса, гидрогелевый матрикс может быть набухан другими жидкими питательными средами, включая среды с антибиотиками. Предыдущие методы изучения бактерий в замкнутых средах были ограничены продолжительностью экспериментального времени, размером полимерной сетки и жесткостью окружающей гидрогелевой матрицы37,38. Уже существуют протоколы для изготовления гранулированных гидрогелевых матриц из различных полимеров, поэтому потенциал для изучения влияния различных условий окружающей среды на подвижность и рост бактерий огромен. Этот метод позволяет изучать бактерии в контрольных средах, которые легче повторяют среду, в которой бактерии обитают в реальном мире, такие как слизь хозяина или почва. Еще одним ограничением многих других методов является непрозрачность окружающей матрицы; Однако такой подход с использованием оптически прозрачных материалов дает возможность исследовать, например, оптогенетический контроль и паттернирование бактерий в 3D.
Помимо изучения подвижности и роста, описанный здесь метод 3D-печати преодолевает ограничения многих других методов биопечати, которые требуют нанесения биочернил на подложку и, следовательно, ограничены в высоте инженерного живого материала, который они могут производить. В будущем этот протокол биопечати может быть расширен для изготовления биогибридных материалов путем смешивания полимеров с биопленкообразующими клетками. Гранулированные гидрогелевые матрицы обеспечивают поддержку 3D-печати более толстых, крупномасштабных инженерных живых материалов и более сложной геометрии, чем многие другие современные методы биопечати бактерий. В то время как в этой работе использовались только V. cholerae и E. coli, другие виды, такие как Pseudomonas aeruginosa, также были успешно напечатаны на3D-принтере. Помимо печати, принтер может быть адаптирован для проведения контролируемого отбора проб бактерий после роста, чтобы, например, увидеть, произошли ли какие-либо генетические изменения.
Раскрытие информации
Экспериментальная платформа, используемая для 3D-печати и визуализации бактериальных сообществ в данной публикации, является предметом патентной заявки, поданной Принстонским университетом от имени Тапомой Бхаттачарджи и S.S.D. (номер заявки PCT/US/2020/030213).
Благодарности
R.K.B. выражает признательность за поддержку со стороны Президентской программы стипендиатов для постдокторантов. Этот материал также основан на работе, поддержанной грантом NSF Graduate Research Fellowship Program Grant DGE-2039656 (to A.M.H.). А.С.Д.-М. и H.N.L. выражают признательность за поддержку со стороны Фонда независимой работы и диссертаций Принстонского университета. Мы также благодарим лабораторию Бонни Басслер за предоставление штаммов V. cholerae. S.S.D. выражает признательность за поддержку со стороны грантов NSF CBET-1941716, DMR-2011750 и EF-2124863, а также Фонда трансформационных технологий Эрика и Венди Шмидт, Фонда здравоохранения Нью-Джерси, Программы Pew Biomedical Scholars Program и Программы преподавателей-ученых Камиля Дрейфуса.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL cuvettes | VWR | 97000-586 | |
| 1 mL Luer lock syringe | BH Supplies | BH1LL | |
| 10 M NaOH | Sigma-Aldrich | 72068 | |
| 100 nm carboxylated fluorescent polystyrene nanoparticles (FluoSpheres) | Invitrogen, (ThermoFischer Scientific) | F8803 | |
| 15 mL centrifuge tubes | ThermoFischer Scientific | 14-955-237 | |
| 20 G blunt needle | McMaster Carr | 75165A252 | |
| 25 mL tissue culture flasks | VWR | 10861-566 | |
| 3D printer | Lulzbot | LulzBot Mini 2 | |
| 3D printing software | Cura | Cura-Lulzbot | |
| 50 mL centrifuge tubes | ThermoFischer Scientific | 14-955-239 | |
| Agar | Sigma-Aldrich | A1296 | |
| Carbomer Granular Hydrogel Particles | Lubrizol | Carbopol 980NF | dry granules of crosslinked acrylic acid/alkyl acrylate copolymers |
| Centrifuge (2 mL tube capacity) | VWR | 2405-37 | |
| Centrifuge (50 mL tube capacity) | ThermoFischer Scientific | 75007200 | Sorvall (brand) ST 8 (model) |
| Confocal Microscope | Nikon | A1R+ inverted laserscanning confocal microscope | |
| Glass bottom petri dish | Cellvis | D35-10-1-N | |
| Lennox LB (Lubria Broth) | Sigma-Aldrich | L3022 | |
| M8 × 1.25 mm, 150 mm long, Fully Threaded Socket Cap | McMaster Carr | 91290A478 | |
| M8 × 1.25 mm, Brass Thin Hex Nut | McMaster Carr | 93187A300 | |
| Open-source syringe pump | Custom-made | Replistruder 4 | https://www.sciencedirect.com/science/article/pii/S2468067220300791 |
| Petri dish (60 mm round) | ThermoFischer Scientific | FB0875713A | |
| Shear Rheometer | Anton Paar | MCR 501 | |
| Ultrasonic cleaner | VWR | 97043-992 |
Ссылки
- Persat, A., et al. The mechanical world of bacteria. Cell. 161 (5), 988-997 (2015).
- Stoodley, P., Dodds, I., Beer, D. D., Scott, H. L., Boyle, J. D. Flowing biofilms as a transport mechanism for biomass through porous media under laminar and turbulent conditions in a laboratory reactor system. Biofouling. 21 (3-4), 161-168 (2005).
- Ludemann, H., Arth, I., Liesack, W. Spatial changes in the bacterial community structure along a vertical oxygen gradient in flooded paddy soil cores. Applied and Environmental Microbiology. 66 (2), 754-762 (2000).
- Sicard, J. F., Bihan, G. L., Vogeleer, P., Jacques, M., Harel, J. Interactions of intestinal bacteria with components of the intestinal mucus. Frontiers in Cellular and Infection Microbiology. 7, 387 (2017).
- Grice, E. A., Segre, J. A. The skin microbiome. Nature Reviews Microbiology. 9 (4), 244-253 (2011).
- Balzan, S., Quadros, C. D. A., Cleva, R. D., Zilberstein, B., Cecconello, I. Bacterial translocation: Overview of mechanisms and clinical impact. Journal of Gastroenterology and Hepatology. 22 (4), 464-471 (2007).
- Chaban, B., Hughes, H. V., Beeby, M. The flagellum in bacterial pathogens: For motility and a whole lot more. Seminars in Cell & Developmental Biology. 46, 91-103 (2015).
- Datta, S. S., Steinberg, A. P., Ismagilov, R. F. Polymers in the gut compress the colonic mucus hydrogel. Proceedings of the National Academy of Sciences. 113 (26), 7041-7046 (2016).
- Harman, M. W., et al. The heterogeneous motility of the Lyme disease spirochete in gelatin mimics dissemination through tissue. Proceedings of the National Academy of Sciences. 109 (8), 3059-3064 (2012).
- Ribet, D., Cossart, P. How bacterial pathogens colonize their hosts and invade deeper tissues. Microbes and Infection. 17 (3), 173-183 (2015).
- Siitonen, A., Nurminen, M. Bacterial motility is a colonization factor in experimental urinary tract infection. Infection and Immunity. 60 (9), 3918-3920 (1992).
- Lux, R., Miller, J. N., Park, N. H., Shi, W. Motility and chemotaxis in tissue penetration of oral epithelial cell layers by Treponema denticola. Infection and Immunity. 69 (10), 6276-6283 (2001).
- O’Neil, H. S., Marquis, H. Listeria monocytogenes flagella are used for motility, not as adhesins, to increase host cell invasion. Infection and Immunity. 74 (12), 6675-6681 (2006).
- Gill, C. O., Penney, N. Penetration of bacteria into meat. Applied and Environmental Microbiology. 33 (6), 1284-1286 (1977).
- Shirai, H., Datta, A. K., Oshita, S. Penetration of aerobic bacteria into meat: A mechanistic understanding. Journal of Food Engineering. 196, 193-207 (2017).
- Thornlow, D. N., Brackett, E. L., Gigas, J. M., Dessel, N. V., Forbes, N. S. Persistent enhancement of bacterial motility increases tumor penetration: Motility enhances bacterial tumor penetration. Biotechnology and Bioengineering. 112 (11), 2397-2405 (2015).
- Toley, B. J., Forbes, N. S. Motility is critical for effective distribution and accumulation of bacteria in tumor tissue. Integrative Biology. 4 (2), 165-176 (2011).
- Dechesne, A., Wang, G., Gülez, G., Or, D., Smets, B. F. Hydration-controlled bacterial motility and dispersal on surfaces. Proceedings of the National Academy of Sciences. 107 (32), 14369-14372 (2010).
- de Souza, R., Ambrosini, A., Passaglia, L. M. P. Plant growth-promoting bacteria as inoculants in agricultural soils. Genetics and Molecular Biology. 38 (4), 401-419 (2015).
- Turnbull, G. A., Morgan, J. A. W., Whipps, J. M., Saunders, J. R. The role of bacterial motility in the survival and spread of Pseudomonas fluorescens in soil and in the attachment and colonisation of wheat roots. FEMS Microbiology Ecology. 36 (1), 21-31 (2001).
- Watt, M., Kirkegaard, J. A., Passioura, J. B. Rhizosphere biology and crop productivity—a review. Soil Research. 44 (4), 299-317 (2006).
- Adadevoh, J. S. T., Ramsburg, C. A., Ford, R. M. Chemotaxis Increases the Retention of Bacteria in Porous Media with Residual NAPL Entrapment. Environmental Science & Technology. 52 (13), 7289-7295 (2018).
- Adadevoh, J. S. T., Triolo, S., Ramsburg, C. A., Ford, R. M. Chemotaxis Increases the Residence Time of Bacteria in Granular Media Containing Distributed Contaminant Sources. Environmental Science & Technology. 50 (1), 181-187 (2016).
- Ford, R. M., Harvey, R. W. Role of chemotaxis in the transport of bacteria through saturated porous media. Advances in Water Resources. 30 (6-7), 1608-1617 (2007).
- Wang, M., Ford, R. M., Harvey, R. W. Coupled effect of chemotaxis and growth on microbial distributions in organic-amended aquifer sediments: Observations from laboratory and field studies. Environmental Science & Technology. 42 (10), 3556-3562 (2008).
- Amchin, D. B., Ott, J. A., Bhattacharjee, T., Datta, S. S. Influence of confinement on the spreading of bacterial populations. PLoS Computational Biology. 18 (5), e1010063 (2022).
- Moore-Ott, J. A., Chiu, S., Amchin, D. B., Bhattacharjee, T., Datta, S. S. A biophysical threshold for biofilm formation. eLife. 11, e76380 (2022).
- Tittsler, R. P., Sandholzer, L. A. The use of semi-solid agar for the detection of bacterial motility. Journal of Bacteriology. 31 (6), 575-580 (1936).
- Bhattacharjee, T., et al. Polyelectrolyte scaling laws for microgel yielding near jamming. Soft Matter. 14 (9), 1559-1570 (2018).
- Bhattacharjee, T., Datta, S. S. Confinement and activity regulate bacterial motion in porous media. Soft Matter. 15 (48), 9920-9930 (2019).
- Bhattacharjee, T., Datta, S. S. Bacterial hopping and trapping in porous media. Nature Communications. 10 (1), 2075 (2019).
- Bhattacharjee, T., Amchin, D. B., Ott, J. A., Kratz, F., Datta, S. S. Chemotactic migration of bacteria in porous media. Biophysical Journal. 120 (16), 3483-3497 (2021).
- Bhattacharjee, T., Amchin, D. B., Alert, R., Ott, J. A., Datta, S. S. Chemotactic smoothing of collective migration. eLife. 11, e71226 (2022).
- Tashman, J. W., Shiwarski, D. J., Feinberg, A. W. A high performance open-source syringe extruder optimized for extrusion and retraction during FRESH 3D bioprinting. HardwareX. 9, e00170 (2021).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. Journal of Colloid and Interface Science. 179 (1), 298-310 (1996).
- Chatterjee, T., Chatterjee, B. K., Chakrabarti, P. Modelling of growth kinetics of Vibrio cholerae in presence of gold nanoparticles: Effect of size and morphology. Scientific Reports. 7 (1), 9671 (2017).
- Martínez-Calvo, A., et al. Morphological instability and roughening of growing 3D bacterial colonies. Proceedings of the National Academy of Sciences. 119 (43), e2208019119 (2022).
- Lehner, B. A. E., Schmieden, D. T., Meyer, A. S. A Straightforward approach for 3D bacterial printing. ACS Synthetic Biology. 6 (7), 1124-1130 (2017).
- Zhang, Q., et al. Morphogenesis and cell ordering in confined bacterial biofilms. Proceedings of the National Academy of Sciences. 118 (31), e2107107118 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены