Werner Heisenberg considerò i limiti di quanto accuratamente si possano misurare le proprietà di un elettrone o di altre particelle microscopiche. Ha determinato che c'è un limite fondamentale a quanto accuratamente si può misurare sia la posizione di una particella che il suo momento contemporaneamente. Più accurata è la misurazione del momento di una particella, meno accurata è la posizione in quel momento e viceversa. Questo è ciò che ora viene chiamato principio di indeterminazione di Heisenberg. Egli ha matematicamente collegato l'incertezza nella posizione e l'incertezza nello slancio alla quantità che coinvolge la costante di Planck.
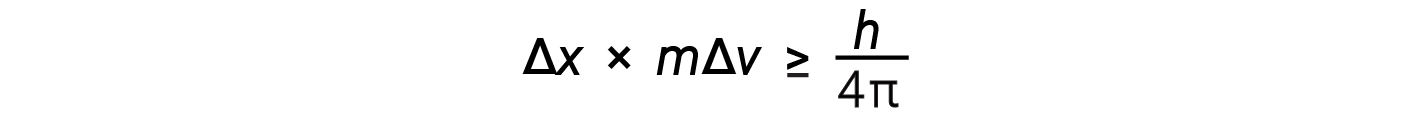
Questa equazione calcola il limite a quanto precisamente si può conoscere sia la posizione simultanea di un oggetto che il suo momento.
Quindi, più accurata è la posizione dell'elettrone, meno accurata è la sua velocità e viceversa. Ad esempio, si può prevedere dove una palla da baseball atterrerebbe nel campo esterno notando la sua posizione e velocità iniziali e considerando l'effetto della gravità e del vento, ecc. La traiettoria del baseball può essere stimata.
Per un elettrone, tuttavia, la posizione e la velocità non possono essere determinate simultaneamente. Pertanto, una traiettoria per l'elettrone di un atomo non può essere determinata. Questo comportamento è indeterminato. Invece della posizione precisa di un elettrone, si può parlare in termini di probabilità di trovare un elettrone in una certa regione dell'atomo, che è una densità di probabilità. Può essere indicato come quadrato psi(ψ2). Maggiore è la probabilità di trovare un elettrone in una particolare regione, maggiore è il valore del quadrato psi. Sulla base di questo, gli atomi sono descritti come costituiti da un nucleo circondato da una nube di elettroni.
Il principio di Heisenberg impone limiti finali a ciò che è conoscibile nella scienza. Il principio di incertezza può essere dimostrato come una conseguenza della dualità onda-particella, che è al centro di ciò che distingue la moderna teoria quantistica dalla meccanica classica.
Questo testo è adattato da Openstax, Chemistry 2e, Section 6.3: Development of Quantum Theory.
Dal capitolo 7:

Now Playing
7.8 : Il principio dell'incertezza
Struttura elettronica degli atomi
22.7K Visualizzazioni

7.1 : La natura ondulatoria della luce
Struttura elettronica degli atomi
47.9K Visualizzazioni

7.2 : Lo spettro elettromagnetico
Struttura elettronica degli atomi
52.2K Visualizzazioni

7.3 : Interferenza e diffrazione
Struttura elettronica degli atomi
29.8K Visualizzazioni

7.4 : Effetto fotoelettrico
Struttura elettronica degli atomi
29.0K Visualizzazioni

7.5 : Il modello di Bohr
Struttura elettronica degli atomi
49.1K Visualizzazioni

7.6 : Spettri di emissione
Struttura elettronica degli atomi
48.7K Visualizzazioni

7.7 : La lunghezza d'onda di de Broglie
Struttura elettronica degli atomi
25.1K Visualizzazioni

7.9 : Il modello quantistico-meccanico di un atomo
Struttura elettronica degli atomi
41.5K Visualizzazioni

7.10 : Numeri quantistici
Struttura elettronica degli atomi
34.0K Visualizzazioni

7.11 : Orbitali atomici
Struttura elettronica degli atomi
32.7K Visualizzazioni

7.12 : Il principio di esclusione di Pauli
Struttura elettronica degli atomi
33.0K Visualizzazioni

7.13 : Le energie degli orbitali atomici
Struttura elettronica degli atomi
23.5K Visualizzazioni

7.14 : Il principio di Aufbau e la regola di Hund
Struttura elettronica degli atomi
42.1K Visualizzazioni

7.15 : Configurazione elettronica di atomi multielettronici
Struttura elettronica degli atomi
37.0K Visualizzazioni