I solidi in cui gli atomi, gli ioni o le molecole sono disposti in uno schema ripetuto definito sono noti come solidi cristallini. Metalli e composti ionici in genere formano solidi cristallini ordinati. Un solido cristallino ha una temperatura di fusione precisa perché ogni atomo o molecola dello stesso tipo è tenuto in posizione con le stesse forze o energia. Solidi amorfo o solidi non cristallini (o, a volte, occhiali) che mancano di una struttura interna ordinata e sono disposti casualmente. Le sostanze che consistono di grandi molecole, o una miscela di molecole i cui movimenti sono più limitati, spesso formano solidi amorfo. Il materiale amorfo subisce un graduale ammorbidimento, su una gamma di temperature, a causa della non equivalenza strutturale delle molecole. Quando un materiale amorfo viene riscaldato, le attrazioni intermolecolari più deboli si rompono per prime. Man mano che la temperatura aumenta ulteriormente, le attrazioni più forti sono rotte.
Cella unitaria
La struttura di un solido cristallino è meglio descritta dalla sua unità ripetuta più semplice, indicata come la sua cella unitaria. La cella unitaria è costituita da punti del reticolo che rappresentano le posizioni di atomi o ioni. L'intera struttura è quindi costituita da questa cella unitaria che si ripete in tre dimensioni, come illustrato nella figura 1.
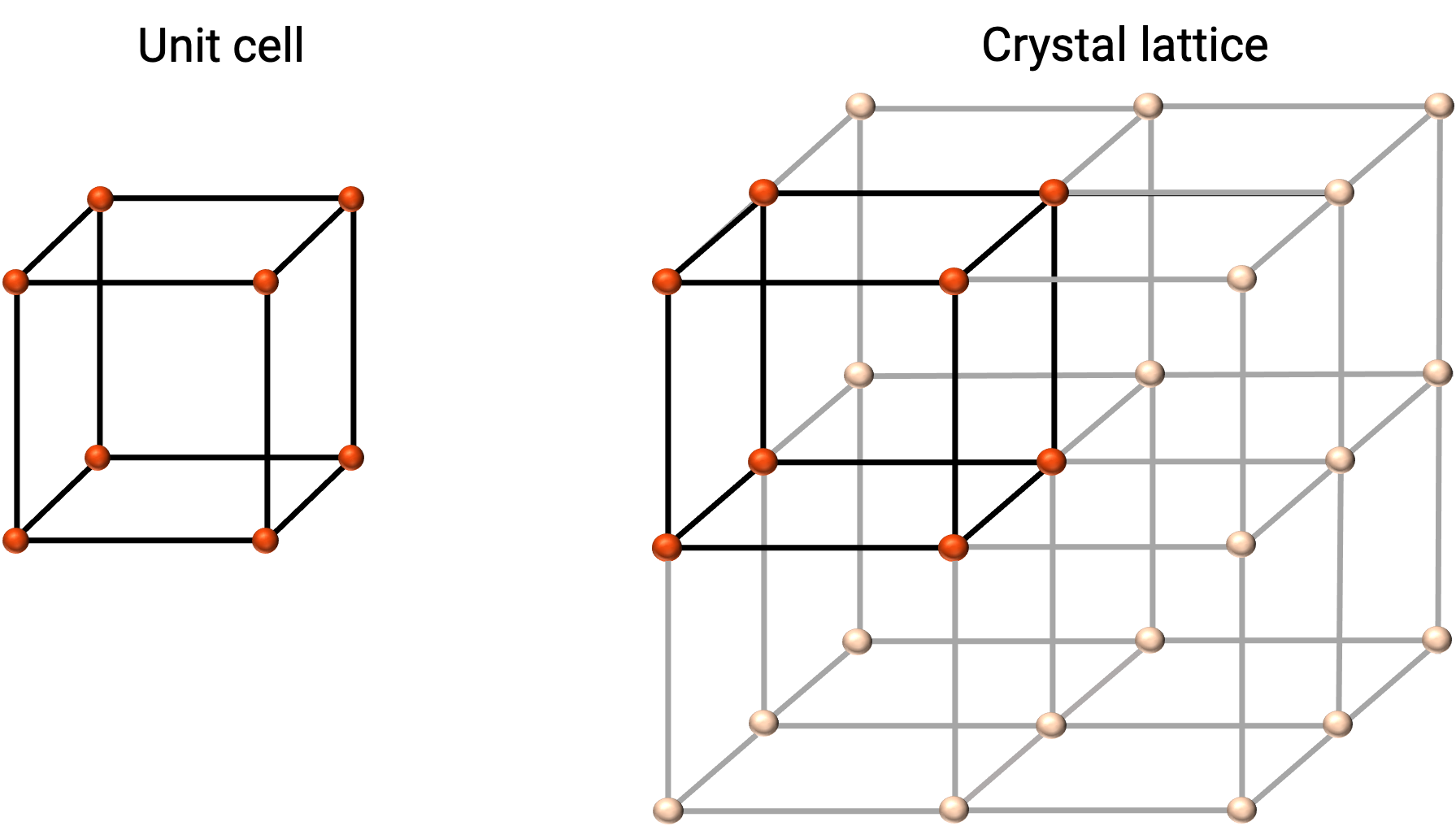
Figura 1. Cella unitaria e reticolo cristallino con punti reticolari indicati in rosso.
In generale, una cella unitaria è definita dalle lunghezze di tre assi (a, be c) e dagli angoli (α, βe γ) tra di essi, come illustrato nella figura 2. Gli assi sono definiti come le lunghezze tra i punti nel reticolo spaziale.
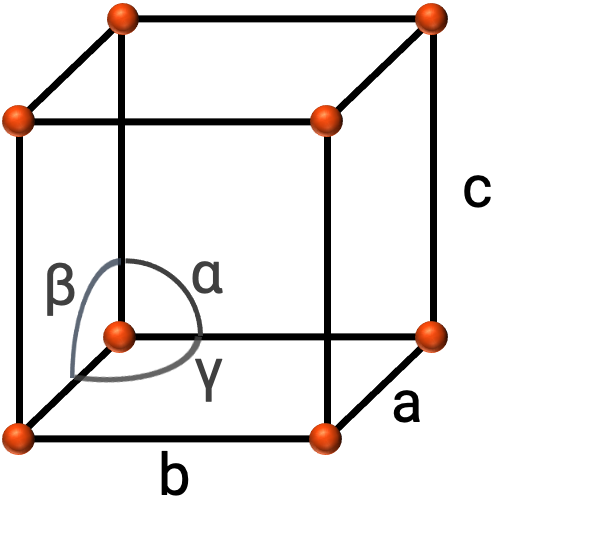
Figura 2. La cella unitaria è definita dai relativi assi (a, be c) e dagli angoli (α, βe γ)
Ci sono sette diversi sistemi reticolari, alcuni dei quali hanno più di un tipo di reticolo, per un totale di quattordici diverse celle unitarie.
| Sistemi | Angoli | Assi |
| Cubi | α = β = γ = 90° | a = b = c |
| Tetragonale | α = β = γ = 90° | a = b ≠ c |
| Ortorombica | α= β = γ = 90° | a ≠ b ≠ c |
| Monoclinico | α = γ = 90°; β ≠ 90° | a ≠ b ≠ c |
| Trilinico | α ≠ β ≠ γ ≠ 90° | a ≠ b ≠ c |
Questo testo è adattato da Openstax, Chemistry 2e, Section 10.6: Lattice Structures in Crystalline Solids.
Dal capitolo 11:

Now Playing
11.14 : Strutture dei solidi
Liquidi, solidi e forze intermolecolari
13.3K Visualizzazioni

11.1 : Confronto molecolare di gas, liquidi e solidi
Liquidi, solidi e forze intermolecolari
39.7K Visualizzazioni

11.2 : Forze intermolecolari vs intramolecolari
Liquidi, solidi e forze intermolecolari
83.5K Visualizzazioni

11.3 : Forze intermolecolari
Liquidi, solidi e forze intermolecolari
54.9K Visualizzazioni

11.4 : Confronto delle forze intermolecolari: punto di fusione, punto di ebollizione e miscibilità
Liquidi, solidi e forze intermolecolari
43.3K Visualizzazioni

11.5 : Tensione superficiale, azione capillare e viscosità
Liquidi, solidi e forze intermolecolari
27.1K Visualizzazioni

11.6 : Transizioni di fase
Liquidi, solidi e forze intermolecolari
18.4K Visualizzazioni

11.7 : Transizioni di fase: vaporizzazione e condensazione
Liquidi, solidi e forze intermolecolari
16.8K Visualizzazioni

11.8 : Pressione del vapore
Liquidi, solidi e forze intermolecolari
33.7K Visualizzazioni

11.9 : Equazione di Clausius-Clapeyron
Liquidi, solidi e forze intermolecolari
54.6K Visualizzazioni

11.10 : Transizioni di fase: fusione e congelamento
Liquidi, solidi e forze intermolecolari
12.1K Visualizzazioni

11.11 : Transizioni di fase: sublimazione e deposizione
Liquidi, solidi e forze intermolecolari
16.4K Visualizzazioni

11.12 : Curve di riscaldamento e raffreddamento
Liquidi, solidi e forze intermolecolari
21.8K Visualizzazioni

11.13 : Diagrammi di fase
Liquidi, solidi e forze intermolecolari
38.1K Visualizzazioni

11.15 : Solidi molecolari e ionici
Liquidi, solidi e forze intermolecolari
16.3K Visualizzazioni
See More