La loi d'action de masse stipule que le rapport entre la concentration des produits et la concentration des réactifs à l'équilibre, élevées à leurs coefficients stœchiométriques respectifs, est égal à une constante, appelée la constante d'équilibre, K ou Kc.
Ainsi, l'expression de la constante d'équilibre pour la réaction ci-dessus est écrite comme suit :
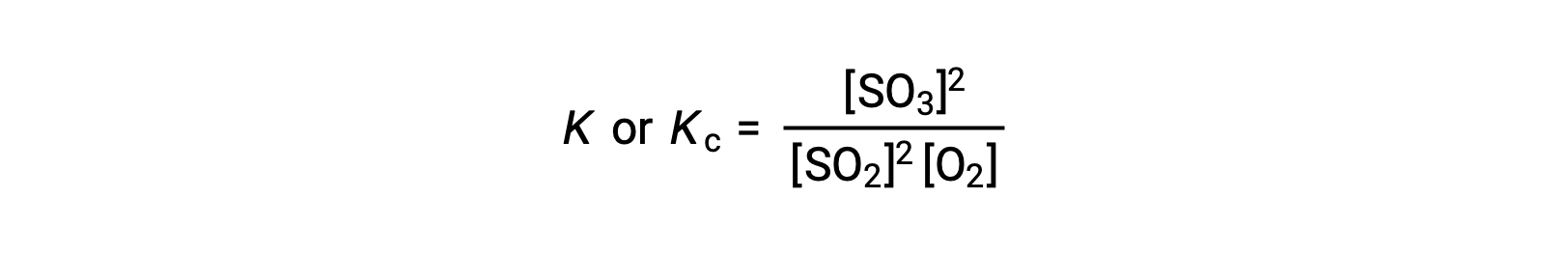
où, l'indice ‘ c ’ indique que la constante d'équilibre tient compte de la concentration molaire des réactifs et des produits.
La taille de la constante d'équilibre reflète explicitement la composition d'un mélange réactionnel à l'équilibre. Une réaction présentant un K élevé atteint l'équilibre lorsque la majeure partie du réactif a été convertie en produit, alors qu'un petit K indique que la réaction atteint l'équilibre après la conversion de très peu de réactif. Il est important de garder à l’esprit que la taille de K n'indique pas à quel point l’équilibre sera atteint rapidement ou lentement. Certains équilibres sont établis si rapidement qu'ils sont presque instantanés, et d'autres si lentement qu'aucun changement perceptible n'est observé pendant des jours, des années, voire plus. La constante d'équilibre d'une réaction peut être utilisée pour prédire le comportement de mélanges contenant ses réactifs et/ou ses produits. Comme l'a démontré le processus d'oxydation du dioxyde de soufre décrit ci-dessus, une réaction chimique se fera dans la direction nécessaire pour atteindre l'équilibre.
Équilibres couplés
De nombreux systèmes d'équilibre impliquent deux ou plusieurs réactions d'équilibrecouplées, celles qui ont en commun une ou plusieurs espèces de réactifs ou de produits. La valeur deKd'un système impliquant des équilibres couplés peut être liée aux valeurs deKdes réactions individuelles. Trois manipulations de base sont impliquées dans cette approche, comme décrites ci-dessous :
Changer le sens d’une équation chimique permute essentiellement les identités des “ réactifs ” et des “ produits ”, de sorte que la constante d’équilibre de l’équation inverse est simplement l'inverse de celle de l’équation directe ;
La modification des coefficients stœchiométriques dans une équation par un facteur xentraîne une variation exponentielle de la constante d'équilibre par ce même facteur ;
Additioner ensemble deux équations d’équilibre ou plus donne une équation globale dont la constante d’équilibre est le produit mathématique des valeurs deKdes réactions individuelles.
Expression de la constante d'équilibre pour les équilibres hétérogènes
Pour les équilibres hétérogènes impliquant des réactifs et des produits dans deux ou plusieurs phases différentes, les concentrations de solides purs ou de liquides purs ne sont pas incluses dans l'expression de la constante d'équilibre, comme illustré dans l'exemple suivant :

En effet, les concentrations relatives des liquides purs et des solides purs restent constantes pendant la réaction.
Ce texte a été adapté de Openstax, Chimie 2e, Section 13.2 Constantes d'équilibre.
Du chapitre 14:

Now Playing
14.2 : La constante d'équilibre
Équilibre chimique
45.2K Vues

14.1 : Équilibre dynamique
Équilibre chimique
48.7K Vues

14.3 : Équilibre homogène pour les réactions gazeuses
Équilibre chimique
23.4K Vues

14.4 : Calcul de la constante d'équilibre
Équilibre chimique
29.9K Vues

14.5 : Quotient de réaction
Équilibre chimique
47.2K Vues

14.6 : Calcul des concentrations d'équilibre
Équilibre chimique
46.2K Vues

14.7 : Principe de Le Châtelier : modification de la concentration
Équilibre chimique
56.5K Vues

14.8 : Principe de Le Châtelier : modification du volume (pression)
Équilibre chimique
33.3K Vues

14.9 : Principe de le Châtelier : modification de la température
Équilibre chimique
28.3K Vues

14.10 : Négliger le changement de concentration initiale
Équilibre chimique
45.4K Vues