Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Bloque de agar-microcosmos de descomposición controlada de Tejidos Vegetales de hongos aerobios
* Estos autores han contribuido por igual
En este artículo
Resumen
Este vídeo demuestra un enfoque ambiente controlado para estudiar la degradación de los tejidos vegetales lignocelulósicos por hongos aerobios. La capacidad de controlar las fuentes de nutrientes y la humedad es una ventaja clave de microcosmos bloque de agar-, pero el enfoque a menudo produce resultados desiguales. Nos dirigimos a peligros críticos para el rendimiento reproducible, de baja variabilidad de resultados.
Resumen
Los dos métodos principales para el estudio de biodegradación de hongos de tejidos de las plantas lignocelulósicas se han desarrollado para las pruebas de conservación de la madera (suelo-bloque; agar-bloque). Es bien aceptado que bloque de suelo-microcosmos de rendimiento mayores tasas de descomposición, menos problemas de humedad, una menor variabilidad entre los estudios, y aumento de los umbrales de toxicidad conservante. Suelo-bloque de pruebas es, pues, la técnica más utilizada y ha sido estandarizado por la Sociedad Americana para Pruebas y Materiales (ASTM) (método D 1413-1407). El diseño del suelo-bloque tiene sus inconvenientes, sin embargo, utilizando fuentes de suelo a nivel local-variable y en la limitación del control de nutrientes externos (exógenos) en los tejidos en descomposición. Estos inconvenientes se han convertido en un problema en la aplicación de este método a otros objetivos, la investigación cada vez más popular. Estos objetivos incluyen la lignocelulosa moderna degradantes para la investigación de bioenergía, biorremediación de pruebas de co-metabolizada tóxicos, la evaluación de los mecanismos oxidativos, y el seguimiento de los elementos trasladaron a lo largo de las redes de hifas. Los bloques de tierra no prestan suficiente control en estas aplicaciones. Un refinado agar-bloque enfoque es necesario.
Aquí, nosotros usamos la podredumbre parda de la madera degradantes hongo lacrymans Serpula para degradar la madera en el microcosmos de bloques de agar, con profunda platos de Petri con agar bajo contenido de calcio. Ponemos a prueba el papel de la exógena de yeso en descomposición en una serie de tiempo, para demostrar la utilidad y la variabilidad esperada. Bloques de una sola placa RIP (corte longitudinal) están condicionadas, se pesa, autoclave, e introdujo asépticamente sobre una malla de plástico. Inoculaciones de hongos se encuentran en cada cara del bloque, con exógenos yeso añadido en las interfaces. Las cosechas son asépticas hasta la cosecha destructiva final. Estos microcosmos están diseñados para evitar el contacto con el bloque de agar o en las paredes placa de Petri. La condensación se reduce al mínimo durante el plato y se derrama durante la incubación. Por último, el inóculo / yeso / madera distancia se reduce al mínimo, pero sin permitir el contacto. Estos aspectos menos técnicos del diseño del agar-bloque también son las causas más comunes de fracaso y la principal fuente de variabilidad entre los estudios. Publicación de vídeo tanto, es útil en este caso, y lo demostramos de baja variabilidad, resultados de alta calidad.
Protocolo
Este protocolo se aplica a los sustratos leñosos y no leñosos, como se indica, así como a los materiales al horno o secado al aire. Lea el primer protocolo, sin embargo, antes de set-up. Hay varios puntos planteados que pueden aplicarse a su estudio, y estos puntos (subrayado) requieren de una planificación. Además, tenga en cuenta que hay dos publicados bloque de agar-métodos que se utilizan en ocasiones, uno de los británicos 838 estándar y otro después de un Grupo Internacional de Investigación sobre la protección de la madera (IRG-WP) documento presentado por Bravery (1978). Nuestro método se asemeja a 838, con las modificaciones principalmente en el diseño microcosmos y el control del medio de agar, pero una vez más, los dos enfoques se evita a menudo debido a los problemas históricos de control de humedad en bloques de madera, causando anoxia y la variabilidad. Una buena revisión de estos métodos de prueba que incluye la discusión de los diseños de bloques de agar, incluida la norma 838, se puede encontrar en Nicolás (1973).
1) Preparación de Microcosmos
Microcosmos de estos ensayos son 1 cm más alto (más profundo) que las típicas placas de Petri, el aumento de espacio libre encima de los bloques de madera. Están llenos de una cantidad modesta y exacta de agar con el fin de un control absoluto cantidades de nutrientes, además de su concentración, y para mantener los bloques de madera bien lejos (> 3 mm) de la tapa. El agar utilizado en este caso de las pruebas de yeso es un tipo de calcio-A agar, sin embargo, se muestran resultados representativos utilizando un medio de Blakeslee, el medio ATCC recomendadas para el mantenimiento de la prueba de aislamiento del lacrymans Serpula (Wulfen: Fries) Schroeter cepa APEM 65 ( ATCC 32750).
Este diseño mantiene los tejidos de plantas fuera de contacto con agar y lejos de la tapa del plato y las paredes. Mojar variable de sustratos lignocelulósicos es la principal fuente de variabilidad en las pruebas de bloque de agar. Humectantes para aumentar el contenido de humedad crea y suprime la anoxia o incluso detiene la biodegradación aeróbica. También crea un problema para cualquiera que estudie los mecanismos oxidativos de los hongos de pudrición marrón y blanco responsables de la descomposición de la madera. La condensación en las tapas de la placa es un problema si el agua sin formar gotas y la humedad del sustrato. Del mismo modo, la madera y otros tejidos "mecha" del agua rápidamente de agar al entrar en contacto, dando lugar a contenidos de humedad superior al 80% (en peso seco. Base) y detener la degradación aeróbica. Los tejidos deben ser distanciado de estas fuentes de agua, permitiendo que los hongos filamentosos para encontrar, conectar y controlar la humedad en el sustrato.
- Hacer lo suficiente los medios de agar para llenar el número deseado de las placas de Petri con agar de 20 ml, cada uno. Utilizamos cinco repeticiones (n = 5) por tratamiento, determinado por análisis de poder utilizar los resultados anteriores.
- De calcio y el hierro libre Tipo A agar, se añade 15 g de agar a un matraz aforado de 500 ml contiene aproximadamente 400 ml de agua desionizada modificado con 1,0 g de NH 4 NO 3, 1,0 g monobásico KH 2 PO 4, 0,25 g de MgSO 4 x 7H 2 O y 1,0 g de glucosa. A la mezcla, que utilizan las soluciones de archivo para añadir micronutrientes. Sumamos 50 l cada uno de H 3 BO 4 (0,057 g / 100 ml) y ZnSO4 (0,031 g / 100 ml). Sumamos 50 l cada uno de MnCl2 (0,036 g / 100 ml), CuSO 4 (0,039 g / 100 ml), y (NH 4) 6 Mo 7 O 24 (0,018 g / 100 ml). Una vez que se añaden nutrientes, llenar el matraz aforado a la línea de 500 ml.
- Una adición de calcio típicas en este caso sería 0,05 g de CaCl 2 x 2H 2 O / 500 ml. En nuestro caso, el uso de calcio agar como un tratamiento, con una concentración de 5 mM final. Estamos contra el aumento de la fuerza iónica y la adición de cloruro mediante la adición de 5 mM NaCl al microcosmos otras. Del mismo modo, el uso libre de hierro los medios de comunicación para esta demostración, pero en los casos en que el hierro se incluye, que mezcla 0,112 g de FeSO 4 con 2 ml de agua desionizada y se añaden 50 l de esta solución fresca (no acciones) inmediatamente después de la agitación. En cualquier medio de comunicación donde el control de la adición de nutrientes, es conveniente poner a prueba el pH antes de esterilizar. Adiciones ácidos o básicos (por ejemplo, FeCl 3) afectará a la solidificación.
- La transferencia de los medios de comunicación a un matraz y autoclave el medio a 121 º C y 16 psi durante 20 minutos. No exceder los 500 ml de volumen (por frasco de 1000 ml), para evitar que el agar se solidifique antes de que podamos administrar todo ello a las placas de prueba.
(Nota:.. Es aconsejable cuando se utilizan medios de comunicación alternativos, agar nutritivo, especialmente con un mínimo de sales añadido basal, para verificar que su primera prueba de hongo crece en ella de alta fuerza iónica puede inhibir el crecimiento o incluso matar a su prueba de aislamiento) - Utilice una pipeta portátil de ayuda y 10 pipetas ml de poliestireno estériles para transferir asépticamente agar en un gabinete de bioseguridad, una vez frascos fresco. Dejar que los medios de comunicación fría al tacto es importante en este caso para minimizar la condensación. Además, la pila de platos de alta, ya que se vierten, para minimizar el agua libre sobre los párpados. Mientras que la condensación es una molestia en el cultivo normal, aquí representa un problema importante si droplets forma y se orinan en la madera. Contenido de humedad (MC) más del 80% (peso seco) creará anoxia en los tejidos, la decadencia límite por hongos aeróbicos, y aumentar la variabilidad. MC calcular de la siguiente manera:
MC * = [(peso fresco x peso seco) / peso seco] x 100
* (MC puede superar el 100% - esto puede parecer una extraña manera de calcular el MC, pero es el estándar)- Microcosmos Alternativa: Si se prueban los tejidos vegetales que deben ser pre-molido y tamizado (por ejemplo, tallos de maíz y hojas de rastrojo, en conjunto), hay dos opciones de plato que utilizamos. Dividido placas de Petri están disponibles con 2 o 4 secciones, y el agar se puede excluir de los compartimientos con el polvo. Agar solidificado se puede cortar y quitar una parte para dejar espacio para el polvo, pero se debe tener cuidado para mantener volúmenes iguales agar restantes si la disponibilidad de nutrientes debe ser controlado.
- Añadir generosamente cortar las redes de malla de plástico a la superficie de la placa, utilizando bien lavadas y las redes de autoclave agregó asépticamente. Nosotros usamos un producto, la Guardia Gutter (35 x 50 mm, 2 mm de espesor), de nuestra malla, y han utilizado microscopía electrónica de barrido para mostrar una superficie limpia y después de lavar jabón y agua y para demostrar la falta de penetración de hongos. Hemos tenido un éxito relativo con filtros de fibra de vidrio y con los bloques por la que se directamente sobre el micelio desarrollado, tanto debido a problemas de absorción. Usted recibirá la decadencia, pero su coeficiente de variabilidad (CV) será alta, por lo que las comparaciones de tratamiento estadísticamente débiles. Se utilizó varillas de vidrio previamente, pero los bloques son susceptibles de deslizamiento de las barras cuando se empujaban, dejando los bloques en contacto con el agar. Una buena alternativa es cortar círculos completos para adaptarse a las placas, corte de un borde de dar cabida a inóculo. En general, cortar las redes para adaptarse a su propia configuración, pero asegúrese de que estaba totalmente plano en las placas de Petri.
2) Preparación de Sustratos 'Bloque'
Estos protocolos han sido desarrollados para la madera sólida, pero se pueden adaptar para los tejidos de la planta. Pérdida de masa es la medida estándar para el progreso descomposición de la madera degradada por hongos filamentosos. Por lo tanto, nuestro enfoque utiliza el horno de secado pesos antes y después de la desintegración de determinar la pérdida de masa. Sin embargo, para cualquier investigación en bioenergía, donde la atención se centra en la química de los tejidos vegetales, muchos descubren que los tejidos de secado al aire es preferible. Mostramos aquí los protocolos para la preparación de su bloque de agar-culturas para el uso del horno-seca el material de partida, pero dar a la información alternativa se seque al aire y también para procesar en polvo en lugar de sustratos sólidos.
- Para esta demostración, se utiliza pino amarillo del sur (SYP). SYP es una madera disponible en el mercado que representan a la inmensa mayoría de la madera utilizada en las viviendas residenciales en los EE.UU. puede ser cualquiera de las cuatro especies del género Pinus. No se utiliza madera tratada y sin nudo, de los bloques se cortan de una sola RIP (corte longitudinal) a lo largo del grano (19 x 19 mm). Esto reduce al mínimo la variabilidad química de la madera. Esta longitud se corta en 19 mm a 3 cuadras. Nosotros utilizamos este tamaño de bloque de ensayos de suelos, y cortar muchos bloques en una sola sesión en la sierra de mesa.
- Los 19 mm a 3 cuadras de utilizar en el microcosmos de bloques de agar se dividen además en dos a lo largo del grano, utilizando un cincel y un martillo, no una sierra. Esto hace que un borde del bloque en bruto a boca abajo en la malla de plástico, y un borde liso de arriba a la etiqueta. Bloques de etiqueta con un lápiz. Si no se puede etiquetar sus sustratos, asegúrese de crear un sistema para mantenerse al día con las muestras. Cortar los bloques suficientes para satisfacer sus tratamientos (de nuevo, se utiliza n = 5 por tratamiento), así como no inoculadas controles que servirán como monitores de contaminación y como datos de referencia las muestras, condicionado en paralelo.
- De secado en horno de material, las muestras de lugar en un horno de convección a 100 ° C durante 48 horas. Si secado al aire de material es necesario, el estado de las muestras en una cámara o habitación con humedad y temperatura constantes. Nosotros usamos el 65% de humedad relativa y 20 ° C, y por lo general cuentan con aire 10-14 días, dependiendo del material.
- Pre-analizar sus muestras para determinar el peso inicial de secado en horno o fresca. Con las muestras del horno, simplemente transferir las muestras a un desecador para enfriar y pesar.
- Alternativas de secado al aire: con secado al aire material, tomar cinco muestras (n = 5; estos sacrificios no serán utilizados en el microcosmos), pesarlos fresco, secado al horno a que el anterior, y re-peso después de secado. Calcular un factor de corrección de humedad para cada uno de los dos bloques de la siguiente manera:
Factor de corrección MC = peso seco / peso fresco
Ejemplo: 2,46 g (en seco) / 2,68 g (dulce) = 0,918, así, un bloque de 3,0 g de dulce es de 2.75 g secado al horno
Promedio de las cinco muestras para obtener el factor de corrección promedio. Entonces, pese a todos sus bloques de secado al aire. Multiplicar cada peso por el factor de corrección promedio de MC para determinar inicial de secado en horno pesos.
- Alternativas de secado al aire: con secado al aire material, tomar cinco muestras (n = 5; estos sacrificios no serán utilizados en el microcosmos), pesarlos fresco, secado al horno a que el anterior, y re-peso después de secado. Calcular un factor de corrección de humedad para cada uno de los dos bloques de la siguiente manera:
- Autoclave etiquetados muestras a 121 ° C y 16 psi durante 1 hora, o más, con muestras más grandes. Bien de aluminio para reducir al mínimo mojado.
- Alternatiesterilización ve: La radiación gamma se puede utilizar para esterilizar, si está disponible. Hemos probado la picea y madera de haya con anterioridad para efectos de la temperatura sobre la pérdida de hemicelulosa, y no lo encontró, junto con la pérdida de fuerza o no cambio de color. Sin embargo, esto puede variar entre los sustratos y sus preferencias / necesidades, y la radiación gamma es una alternativa probada.
- Para esta demostración, que están poniendo a prueba el papel de los sólidos de yeso (puro versus 1% FeSO 4) sobre la degradación de los pinos (SYP) muestras. Estos están hechos los discos con las superficies y los volúmenes exactos, una vez más para controlar su disponibilidad, además de su concentración. Estos se esterilizan en autoclave separado y se añadirán durante el paso de la inoculación. Necesitamos un disco por cada bloque, y estamos agregando dos bloques por placa de Petri para permitir dos cosechas.
3) Inoculación y etiquetado
Inoculación de bloque de agar-microcosmos es más tiempo que la inoculación de bloque de suelo-jarras. Para nosotros, contamos con la inoculación de tomar cada 3 min. A cajas de Petri con agar, este es el punto de adición de las mallas, la madera, de fuentes de nutrientes exógenos (en este caso, los pellets de yeso), y el hongo. Hay una mayor posibilidad de contaminación debido a la cantidad de tiempo que la tapa está abierta y el número de visitas en el interior. También hay varios errores fundamentales que se hacen comúnmente en esta etapa, y estos son los mejores cubiertos por el acoplamiento de vídeo con el texto. Vea el video.
- En un recipiente estéril de cabinas de seguridad, montar sus placas de agar vacía, un plato de origen para su inóculo fúngico (usamos dos culturas semana), de malla, el sustrato vegetal (madera), materiales exógenos, un rotulador, tiras de parafina, y herramientas de transferencia. Nos llama esterilización con etanol al 70%, y se utiliza una herramienta de transferencia de inóculo y pinzas para bloques y malla. Parafilm se deben cortar con una navaja de afeitar para evitar muescas en los bordes. Nicks en parafina llevar a rompe cuando el sellado, y esto se disputan las muestras y requerir una nueva inscripción.
- Herramientas de transferencia de la llama o fórceps antes de añadir el siguiente (en este orden):
- Malla de plástico.
- Madera de soporte. Para nuestra demostración, vamos a añadir dos bloques de madera a lo largo de la longitud de la malla, tanto del mismo bloque inicial que se dividió para que podamos par de datos de las cosechas tempranas y tardías. Estos bloques se añaden al lado del otro, con el fin de grano (de madera de sección transversal) hacia el punto de la fuente de inóculo fúngico.
- Materiales exógenos. Aquí, estamos probando el papel de yeso en descomposición por hongos filamentosos. Por lo tanto, queremos que el hongo se encuentra con estos discos de yeso antes de llegar a la madera, y así añadir un disco de yeso entre cada punto de inóculo y el bloque en la parte superior de la malla. Esto significa que la adición de 2 discos por microcosmos. No permita el contacto entre los discos y la madera, pero de manera estrecha.
- Inóculo fúngico. Utilizamos un taladro # 4 de corcho con 7 mm de diámetro para hacer tapones de 2 semanas de cultivos crecidos en agar de 20 ml. Esto ayuda a controlar el volumen del inóculo. Para los controles no inoculados, lo mejor es agregar un complemento de una placa estéril. Por lo general estos tapones para añadir el agar, y no en la malla. No permita el contacto entre el inóculo y, o bien los sustratos exógenos o la madera, pero una vez más, colocarlos juntos. Hay un tapón de inóculo por bloque.
Nota: Es recomendable el montaje de estos contenidos en un plato de agar antes de comenzar a garantizar que habrá al menos 3 mm de espacio para la cabeza, que habrá al menos 3 mm de distancia entre los bloques de madera y las paredes de la tapa, y que su malla de plástico dimensiones fácilmente se adaptará a sus sustratos.
- Platos Parafilm para sellarlos, manteniendo una llama ardiente del alcohol y con unas pinzas listo. Mantenga las placas horizontales y parafina envuelven en un movimiento continuo suave. Si se rompe o parafina si el contenido se empujan, parafina quitar, volver a entrar y montar los contenidos, y vuelva a intentarlo.
- La etiqueta de la tapas de los recipientes con un marcador resistente al alcohol, el etiquetado números de bloque directamente sobre la parte superior de los sustratos respectivos. También dibujar círculos en los discos de yeso. Como se descompone la madera, es probable que pierda la capacidad de leer el etiquetado de los sustratos. Es importante mantenerse al día con la posición del plato. Además, no hay que subestimar la capacidad de un hongo para degradar o colonizar gran variedad de otros tipos de materiales, incluyendo metales.
- Si usted tiene encaje delicado en su malla, la transferencia de las placas cuidadosamente a la incubadora. Que tenemos, sólo una vez, encontré la caja de placas en contra de un atasco de la puerta y tuvo que volver a montar las placas. Tómese su tiempo, y trazar su ruta. Se trata de una preocupación por una sola vez, así que tenga cuidado esta vez.
4) La incubación y cosecha
Las placas pueden ser incubados para adaptarse a su hongo, pero se deben mantener en una incubadora biológica, si es posible, para evitar la condensación debido a las fluctuaciones de temperatura. Las cosechas de series de tiempo se realizan asépticamente, a excepción de la última cosecha. Si estas cosechas intermedias se realizan después de un crecimiento enlos sustratos es significativo, la manipulación de las placas es más fácil porque las hifas sustratos enlace cruzado.
- Para nuestra demostración, incubar las placas a 20 ° C y en la oscuridad. En un momento de la cosecha semanas 5, retirar el lote completo de tratamiento, rociar cada parte inferior y superior con el 70% de etanol y el uso de fórceps flameado para retirar el material dentro de la cabina de bioseguridad.
- Tome fotos antes de destruir las placas de agar, centrándose en cualquier morfología o melanización.
- Retire los bloques a ser tratados como sus necesidades requieren. Use su dedo para rodar fuera el exceso de hifas (con guantes de nitrilo), pero tenga cuidado de no perder ningún material deteriorado. Por lo general, secado al horno bloques de aluminio pesan los recipientes para determinar la pérdida de masa, utilizando el peso fresco y seco de los controles para vigilar la absorción excesiva. También la etiqueta y seguir todos los bloques de color marrón oscuro que son claramente anegadas, aunque esto debe ser un mínimo de seguir este enfoque. Los datos de pérdida de masa ayuda a medir el progreso decadencia, y es un dato importante si las concentraciones elementales se calculan sobre una base gramos de peso, más adelante. También recuerde que los datos porcentuales se deben normalizar las estadísticas. Se calcula de la siguiente manera:
% De pérdida de masa = [(peso inicial peso final) / peso inicial] x 100- Alternativas de secado al aire: Si usted requiere de secado al aire, con el objetivo de tratar biológicamente el material adicional, debe utilizar el régimen de acondicionamiento de la sección 2.3 para reacondicionar. Si usted tiene que determinar la pérdida de masa, se requiere una medida del contenido de humedad, una solución es dividir los bloques (o en polvo) en una parte de grandes y pequeños. Pesan tanto, pero sólo horno de secado de la pequeña porción. Calcular el contenido de humedad el factor de conversión, como el anterior, y luego aplicarlo al peso total fresco de pequeñas porciones grandes + (peso fresco total de bloques). Especialmente si el pretratamiento de materiales con un hongo antes de la sacarificación u otros procesos, pérdida de masa le ayudará con la determinación del balance de masa más tarde y es responsable de los carbohidratos consumidos por el hongo.
- Destruir las culturas en las bolsas de autoclave, sino para salvar la malla de soporte de plástico y otros componentes que pueden ser reciclados para su uso en futuros experimentos.
5) Interpretación de los resultados
Tejidos lignocelulósicos por lo general la descomposición más lenta en los diseños de bloque de agar-, pero en este momento usted debe tener la variabilidad relativamente baja incluso a niveles de deterioro moderado. Usted también debe tener moderada (20-50%), la humedad no es alta en los tejidos control.
- Contenido de humedad (en base al peso seco) en la madera no expuestos a los hongos suelen ser moderadas, alrededor del 40% en esta demostración. Esto está por encima del punto de saturación de la fibra (FSP) de pino (normalmente alrededor del 24%), lo que significa que hay un poco de agua libre en exceso del agua consolidado en la pared celular secundaria lignocelulósica. Esto también significa que algunas mechas probable que ocurra. Una humedad relativa del 100% no se debe permitir que la madera sigue siendo MC exceda el FSP. Su diseño puede lograr resultados diferentes dependiendo del sustrato y la selección de la malla. La clave es mantener el contenido de humedad inferior al 85% o menos, sobre la base del peso seco.
- La pérdida de masa% de la madera degradada en estos microcosmos bloque de agar-es típicamente alrededor de un 30% después de 16 semanas para la mayoría de los hongos. Para seleccionar los hongos, en este caso lacrymans Serpula, hongos alcanzará la degradación completa en este tiempo, la pérdida de> 60% de la masa. S. lacrymans es un hongo podredumbre parda, la eliminación de la lignina poco, así que la pérdida de 62% en masa en este juicio significa la decadencia es casi terminado o en el pasado. Hongos blancos se pudrirá remover la lignina, y la pérdida de masa depende de la especie, así como sustrato.
- Tenga cuidado de registrar la morfología de las hifas. En esta demostración, la morfología de las hifas no inherentemente mostrar el éxito o el fracaso de cualquier tratamiento, pero los colores eran importantes melanización. Esto nos permitió relacionar el papel del hierro como impureza en el yeso de los estudios más antiguos, como al bajo et al. (2000), donde los materiales nativos fueron probados y que esta "óxido" coloración observada fue. El papel del calcio y el hierro se debatieron en Low et al. (2000), y aquí vemos la decadencia reforzada con hierro, ni calcio, y estos mismos hifas de color rojizo.
- Si desea medir las concentraciones de cualquier cosa en este bosque degradado, lo mejor es la normalización de la pérdida de masa. Si, por ejemplo, el calcio no es importado o exportado de madera podrida del 50%, su concentración en la base del peso aparecerá el doble de tiempo cero hasta la cosecha final. Esto se debe a 1 g de polvo ahora representa el doble del volumen de madera que lo hizo en el momento cero. El hongo se consume el 50% de la matriz, la disminución de la densidad. Normalizar cualquier concentración dada (por ejemplo mmol / g) para compensar la pérdida de masa de la siguiente manera:
Concentración normalizada = mmol / gx [1 - (% de pérdida de masa / 100)]
Por ejemplo: 10 mmol / g de Ca en madera degradada del 20%, frente a 7 mmol / g en el momento cero.
Pregunta: ¿aumentar el contenido de Ca durante la desintegración?
10 mmol / g es un claro 3 mmol / g aumento, un aumento del 43%, pero one gramo de polvo de madera degradados con menor densidad de hoy representa un volumen mayor. La normalización es necesaria para comparar el contenido de Ca inicial y final de los volúmenes de madera iguales.
10 x [1 x (20% / 100)] = 8 mmol / g normalizado
Respuesta: Si, Ca aumentó, pero en un 14% no, 43%.
(Los datos también puede ser expresada por el volumen de madera, mmol / cm 3, multiplicando por la densidad.

Figura 1. Agar-bloque microcosmos, según lo establecido en esta demostración, antes de la incubación.

Figura 2. Lacrymans Serpula colonizando los bloques de madera de pino que descansa sobre una malla de plástico para elevar por encima de los bloques de agar de contacto. Este micelio representa una importante conexión entre la madera y fuentes de nutrientes exógenos / elemento, y el control de estas fuentes de material exógeno en el agar o como materiales sólidos es una ventaja clave del diseño de agar-bloque, en comparación con el suelo diseño de bloques.
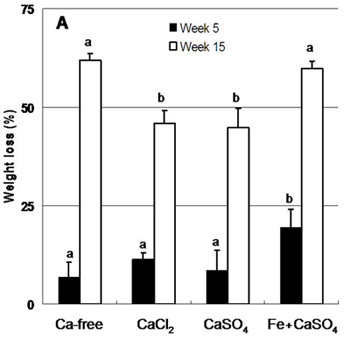
Figura 3. La pérdida media de peso%, como una medida del grado de descomposición de la madera por lacrymans Serpula después de 5 y 15 semanas de incubación con el pino en el microcosmos bloque de agar. El tratamiento había ninguno (Ca-libre), 5 mM CaCl 2 que se añade al agar (CaCl 2),> 99% de yeso (CaSO 4), o el 1% de hierro, yeso modificado. Protegidos mediante ANOVA se compararon mediante pruebas de Tukey, con α = 0,05. Respecto de cada cosecha, bares en la misma letra no son significativamente diferentes. Las barras de error = desviación estándar. Publicado en Schilling (2010).
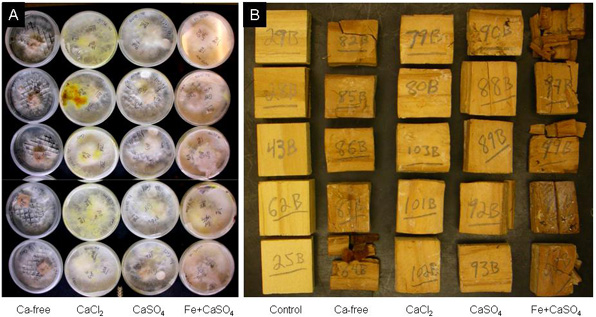
Figura 4. Imagen de arriba (A) de todos los cinco repeticiones en la semana 15 de la decadencia por el mismo hongo marrón prueba de la putrefacción, lacrymans Serpula, así como los bloques (B) retirados y secado al horno. Tenga en cuenta la falta de melanización en Ca sin tratamiento, el color amarillento en los tratamientos de calcio puro, y la aparición de óxido de hierro-modificado el tratamiento. Los tratamientos son etiquetados como en la figura 3, con el control de los bloques (B) que no inoculados para la comparación.

Figura 5. Imagen de arriba de un ensayo de diferentes utilizando un medio de mayor concentración de hierro, agar de malta Blakeslee. Tenga en cuenta la pérdida de melanización observada, en comparación con la Figura 4. Bloques retiró y se pesó el tratamiento no mostró ningún efecto sobre la pérdida de peso. Esto se presenta como una demostración de la influencia de los componentes exógenos de estos ensayos bloque. Estos efectos no ser comprobable en el diseño de frasco bloque de suelo-, donde estos insumos exógenos son muy difíciles de controlar.
Discusión
Usando nuestro bloque de agar-set-up (Figura 1) lacrymans Serpula creció en contacto directo con las superficies de yeso y en bloques de madera (Figura 2), lo que lleva a más del 60% de pérdida de peso en el control de color marrón-podrido bloques de pino (Figura 3 ). Esto satisface fácilmente la meta estándar ASTM de descomposición> 50%, y el coeficiente promedio de variación (C V) en decadencia en 0.055 fue en la semana 16. Estos datos se publican en Schilling 7. Una vez más,...
Divulgaciones
Materiales
| Name | Company | Catalog Number | Comments |
| Petri dishes | Nalge Nunc international | 4014 | 25 x 150 mm |
| Agar, Type A | Sigma-Aldrich | A4550 | |
| Ammonium nitrate, NH4NO3 | Millinckrodt | 3436-12 | |
| Potassium phosphate, KH2PO4 | JT Baker | 3246-01 | |
| Magnesium sulfate 7-hydrate, MgSO4•7H2O | Sigma-Aldrich | 230391 | |
| D-(+)-Glucose | Sigma-Aldrich | G8270 | Dextrose |
| Boric acid, H3BO4 | Mallinckrodt Baker Inc. | 2549-04 | |
| Zinc sulfate 7-hydrate, ZnSO4•7H2O | Mallinckrodt Baker Inc. | 8880-12 | |
| Manganous chloride 4-hydrate, MnCl2•4H2O | JT Baker | 2540-04 | |
| Copper(II) sulfate 5-hydrate, CuSO4•5H2O | Sigma-Aldrich | 209198 | |
| Ammonium heptamolybdate 4-hydrate, (NH4)6Mo7O24•4H2O | Sigma-Aldrich | 431346 | |
| Calcium chloride dihydrate, CaCl2•2H2O | Mallinckrodt Baker Inc. | 4160-12 | |
| Sodium chloride, NaCl | Mallinckrodt Baker Inc. | 7581-12 | |
| Ferrous sulfate 7-hydrate, FeSO4•7H2O | Mallinckrodt Baker Inc. | 5056-12 | |
| Pipet-aid | Drummond Scientific | 4-000-110 | Cordless EtOH the surface |
| 10 ml sterile polystyrene pipette | BD Biosciences | 357551 | |
| Gutter Guard | Thermwell Products Co. | VX620 | Pre-scrubbed with soap Hardware store |
| Calcium sulfate hemihydrate, CaSO4•0.5H2O | Acros Organics | 385355000 | |
| #4 cork borer | Boekel Scientific | 1601 | |
| Parafilm "M" | Pechiney Plastic Packaging | PM-996 |
Referencias
- ASTM D1413-07. Standard test method for testing wood preservatives by laboratory soil-block cultures. . Annual Book of ASTM Standards. , 185-192 (2007).
- Bravery, A. F. . A miniaturized wood block for the rapid evaluation of wood preservative fungicides. , (1978).
- Low, G. A., Young, M. E., Martin, P., Palfreyman, J. W. Assessing the relationship between the dry rot fungus Serpula lacrymans and selected forms of masonry. Int. Biodeterior. Biodegrad. 46, 141-150 (2000).
- Nicolas, D. Volume I (One/1) - Degradation and Protection of Wood (Syracuse Wood Science Series #5). Wood Deterioration and Its Prevention by Preservative Treatments. , (1973).
- Schilling, J. S. Effects of calcium-based materials and iron impurities on wood degradation by the brown rot fungus Serpula lacrymans. Holzforschung. 64, 93-99 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados