Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Isolation of Human Lymphatic Endothelzellen durch Multiparameter-Fluoreszenz-aktivierten Zellsortierung
In diesem Artikel
Zusammenfassung
Das Ziel des Protokolls ist es, lymphatische Endothelzellen menschlicher Lymphmissbildung zystenartige Gefäße und Vorhaut mittels Fluoreszenz-aktivierter Zellsortierung (FACS) isoliert werden. Anschließende Zellkultur und Expansion dieser Zellen ermöglicht eine neue Stufe der experimentellen Raffinesse für genetische, Proteomik, funktionale und Zelldifferenzierung Studien.
Zusammenfassung
Lymphsystems, wie primäre Lymphödem, lymphatischen Missbildungen und lymphatischen Tumoren sind seltene Erkrankungen, die einer erheblichen Morbidität verursachen, aber wenig über ihre Biologie bekannt. Isolierung hochreiner menschlichen lymphatischen Endothelzellen (LECs) von kranken und gesunden Gewebe wäre Studien des lymphatischen Endothels bei genetischen, molekularen und zellulären Ebene zu erleichtern. Es wird erwartet, dass diese Untersuchungen können Ziele für neue Therapien, die die klinische Behandlung von diesen Bedingungen ändern können offenbaren. Ein Protokoll, die Isolierung von humanen Vorhaut LECs und Lymphmissbildung lymphatischen Endothelzellen (LM LECs) beschreibt, wird vorgestellt. Zu erhalten, eine Einzelzellsuspension Gewebe wurde zerkleinert und mit Dispase II und Collagenase II enzymatisch behandelt. Die resultierenden Einzelzellsuspension wurde dann mit Antikörpern gegen Cluster of Differentiation (CD) Marker CD34, CD31, Vascular Endothelial Growth Factor-3 (VEGFR-3) und podoplanin markiert. StaiNed lebensfähige Zellen wurden auf einem Fluoreszenz-aktivierten Zellsortierer (FACS) sortiert werden, um das CD34-CD31 Low Pos VEGFR-3 Pos podoplanin Pos LM LEC Population aus anderen endothelialen und nicht-endothelialen Zellen abzutrennen. Die sortierten LM LECs wurden kultiviert und auf Fibronektin-beschichteten Kolben für weitere experimentelle Nutzung erweitert.
Einleitung
Eine Hauptfunktion des lymphatischen Gefäßsystems ist es, Lymphe, einen Überschuß der interstitiellen Flüssigkeit enthaltenden Lipide, Proteine und Zellbestandteile aufnehmen und führen es in die Blutvenensystem. Ein Netzwerk von lymphatischen Kapillaren lenkt Lymphe zu den Lymphknoten, wo sie auf das Vorhandensein von fremden Antigenen, ein wichtiger Prozess bei der Immunüberwachung und Bereitstellung von weißen Blutkörperchen auf fremde Antigene zu neutralisieren gescreent.
Die unidirektionale Lymphsystem beginnt in Geweben mit dem anfänglichen lymphatischen Kapillaren, eine einzigartige Struktur mit einer diskontinuierlichen Einzelschicht von dünnwandigen flachen Endothelzellen mit spezialisierten Zellverbindungen, die Lymphe Eintrag 1,2 ermöglichen. Diese Kapillaren sind an das Nachbar Bindegewebsmatrix via Verankerung Filamente Gefäß Zusammenbruch in Gegenwart von erhöhten interstitiellen Druck 3 zu verhindern, angebracht. Die anfänglichen Lymphkapillaren münden in Sammel Lymphkapillarendie in größeren Lymphgefäße oder Venen zusammenwachsen. Im Vergleich zu lymphatischen Kapillaren anfänglichen Sammel Lymphgefäße dickere Gefäßwände gepaart lymphatischen Ventile und werden von einem diskontinuierlichen Basalmembran in der wenige glatte Muskelzellen eingebettet 4 umhüllt. Koordiniertes Öffnen und Schließen der Ventile und lymphatischen Kontraktion der glatten Muskelzellen erleichtert Lymphfluß 3. Bei Menschen, die lymphatischen Adern aus verschiedenen Regionen des Körpers verbinden, um Lymphstämme die an zwei Lymphbahnen bilden verschmelzen zu bilden: das Brustgang und das Recht lymphatischen Kanal. Der Ductus Lymphe von der linken Seite des Körpers und von der rechten Seite unterhalb der Brust, während die rechte lymphatischen Kanal Lymphe vom rechten Arm und rechten Seite des Kopfes, des Halses und Thorax. Beide Kanäle leiten Lymphe in die subclavia in den Hals 5.
Erkrankungen des lymphatischen Systems erworben werden grob in einen gruppiertennd angeboren (Tabelle 1). Beispiele für erworbene Bedingungen Lymphangitis und sekundären Lymphödem. Lymphangitis ist eine Entzündung ein Lymphgefäß aufgrund bakterieller Infektionen. Die betroffenen Lymphgefäße erweitern und füllen mit Exsudat enthält polymorphkernigen Zellen. In der Haut sind diese Lymphgefäße als rote, schmerzhafte subkutane Streifen oft durch Erweiterung der zugehörigen Lymphknoten (Lymphadenitis) 6 begleitet sichtbar. Sekundären Lymphödemen entsteht als Folge einer Beschädigung oder Behinderung der Lymphgefäß oder Lymphknoten Obstruktion. Dies führt zu chronischer progressiver Schwellung aufgrund einer Ansammlung von Lymphe distal zur Beschädigung oder Verstopfung. In den entwickelten Ländern wird sekundäre Lymphödem am häufigsten mit malignen Erkrankungen, wo metastasierenden Tumoren behindern Lymphgefäße oder regionalen Lymphknoten oder als Folge der Anti-Krebs-Therapie nach der chirurgischen Entfernung der Lymphknoten, nach der Bestrahlung Fibrose und post-entzündlichen Throm zugeordnetBosis und Narbenbildung 7. In anderen Teilen der Welt, kann sekundäre Lymphödem sekundär lymphatischen Obstruktion von parasitischen Würmern verursacht werden, wie Wuchereria bancrofti 6.
| Erkrankungen des Lymphgefäßsystems | |||
| Erworben | Angeboren | ||
| Lymphadenitis Sekundäre Lymphödeme | Primary Lymphödem 10 | Sporadische Lymphatische Fehlbildungen 13 | Lymphatische Fehlbildungen mit Syndromes 13 |
| zB Milroy-Syndrom Meige Syndrom | Ganz einfach: Lymphatische Fehlbildungen | zB Klippel-Tranaunay Syndrom Parks Weber-Syndrom Sturge-Weber-Syndrom | |
| Kombiniert: Kapillar-lymphatischen Missbildungen Kapillar-lymphatischen-venöse Malformation Kapillar-lymphatischen-arteriovenöse Missbildung Kapillar-lymphatischen venösen-arteriovenöse Missbildung | |||
Tabelle 1 Übersicht über die Erkrankungen des lymphatischen Kreislauf-System.
Angeborenen Erkrankungen des lymphatischen Systems umfassen primäre (idiopathische) Lymphödem gedacht, durch genetische Mutationen, Lymphangiektasie und Anomalien des Lymphsystems 8,9 verursacht werden. Primary Lymphödem kann sporadisch vermutlich durch Neumutationen verursacht, oder geerbt. Lymphsystems kann auch isoliert werden oder einen Teil eines allgemeineren Syndrom 10. In der pädiatrischen Population, 97% der LympheÖdem ist sporadisch mit Anomalien in lymphatischen Gefäßstruktur, die regionalen Lymphdrainage 11 beeinträchtigen. Milroy Krankheit ist ein Beispiel für primäre Lymphödem durch Mutation in der VEGFR-3-Gen offensichtlich bei der Geburt oder kurz nach 12 verursacht. Obwohl meist familiäre Zustand der Milroy Krankheit kann auch bei Säuglingen ohne Familiengeschichte von Milroy Krankheit 32 identifiziert werden. Die Schwere einer Lymphödem ist abhängig von der Menge der Lymphe Produktion und die Fähigkeit, Lymphtransport zurück zur venösen Kreislauf 6.
Basierend auf der klinischen Präsentation und In-situ Endothelzellproliferation sind Anomalien des Lymphsystems lymphatischen Tumoren oder lymphatischen Mißbildungen 13 klassifiziert. Kaposiform Lymphangiomatose ist ein Beispiel einer LEC Tumor 14. Lymphatische Fehlbildungen gedacht werden, um während der Embryonalentwicklung entstehen und wachsen im Verhältnis zum Kind 15,16. Sie Regress selten, kann aber Leistungsbezogenen asymptomatisch bis zum Trauma oder Infektion fällt schnelles Wachstum, was zu klinischen Komplikationen. Die geordnete Struktur des lymphatischen Netzwerks und Durchführung von Lymphe aus dem Gewebe, um oben beschrieben venösen Blutkreislauf wird in lymphatischen Missbildungen, die von lokalen Sammlungen von abnormalen zystische Strukturen mit Lymphflüssigkeit gefüllt bestehen gestört. Zwar gibt es keine klinischen oder experimentellen Beweis, dass diese zystische Schiffe werden an die Lymphzirkulation verbunden oder dass sie funktions lymphatischen Ventile enthält, wird ihre lymphatischen Identität durch Expression Reihe von lymphatischen Zellmarker wie Podoplanin, CD31, Lymphgefäß Endothelial Receptor 1 bestätigt (LYVE-1), Prospero homeobox protein 1 (PROX-1) und VEGFR-3 15,17,18. Diese zystische Strukturen kann entweder klein (mikrozystischen) oder groß (macrocystic), aber die meisten lymphatischen Bildungen enthalten sowohl mikrozystischen und macrocystic Komponenten (1) 16. Nach der Operation injection Sklerotherapie und / oder Radiofrequenz-Ablation des lymphatischen Missbildungen häufig wieder auftreten.
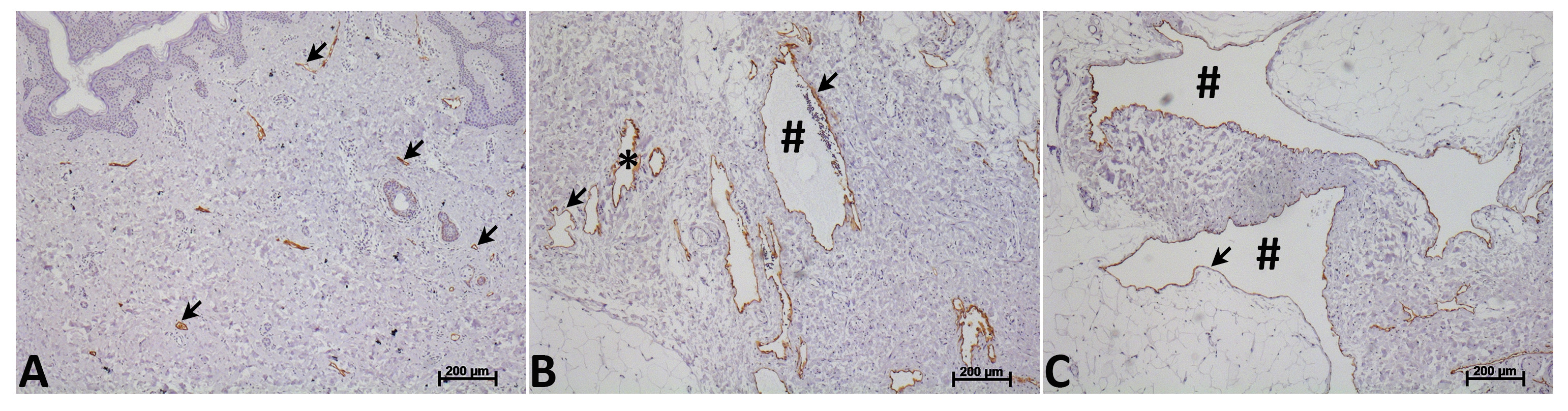
Abbildung 1. Morphologie der menschlichen Lymphgefäße und lymphatischen Missbildungen. Normale menschliche Lymphsystem (A) und Lymphmissbildung Gefäße (B und C) mit einem Antikörper gegen Podoplanin beschriftet (braun-Label, Pfeil). Menschen Lymphmissbildung Gefäße werden durch deutliche Dilatation und erhebliche Unterschiede in der Lumengröße gekennzeichnet. Diese lokalisierten abnormalen zystischen Strukturen können sowohl kleine (mikrozystischen, *) (B) oder groß (macrocystic, #) (C) sein. Die meisten lymphatischen Missbildungen enthalten sowohl mikrozystischen und macrocystic Komponenten. Bitte klicken Sie hier, um eine größere Version der Abbildung zu sehen.
Einige Forscher haben vorgeschlagen, dass lymphatische Fehlbildungen sind eine Entwicklungsstörung des lymphatischen Gefäßsystems, in dem die LECs keinen abnormalen Wachstumspotential, sondern es nicht gelungen, in den normalen Kreislauf 19 angeschlossen werden. Jedoch haben wir gefunden, dass die LM LECs proliferieren schneller und sind widerstandsfähiger gegen Apoptose als Vorhaut LECs 15 darauf hindeutet, dass es eine primäre Defekt im LM LECs. Wenn LM LECs sind in einem Maus-Xenograft-Modell implantiert, bilden sie Strukturen erinnern an lymphatischen Missbildungen 15. Dies unterstützt die Hypothese, dass lymphatischen Bildungen können durch eine oder mehrere somatische Mutationen entstehenden LM LECs während der fetalen Entwicklung verursacht werden. In der Tat haben die jüngsten Berichte eine solche Mutation im p110α katalytische Untereinheit der Phosphoinositid-3-Kinase (PIK3CA) Gen 20 identifiziert.
Angesichts der Fortschritte in der DNA-Sequenzierung Technologie, relevante Mutationen cOuld leichter in isolierten LM LECs identifiziert werden, Führungs zukünftige Studien dieser Bedingungen. Die Isolierung von lebensfähigen LECs würde Vergleiche zwischen abnormalen und normalen LECs in Assays wie Migration, Proliferation, Rohrbildungsfähigkeit und das Überleben in Antwort auf eine reduzierte Nährstoffverfügbarkeit oder proapoptotischen Mittel 15 zu erleichtern. Isolated LECs würde weiter ermöglichen es uns, zellspezifische Genexpression und Proteomik-Studien durchzuführen, um neue LEC-Subpopulationen abzugrenzen und entdecken Sie neue pharmakologische Wirkstoffe für klinische Behandlung von lymphatischen Missbildungen.
Wir haben bereits eine LEC Isolierung in Anlehnung an magnetische Kügelchen Trennung von LECs von neonatalen Vorhaut und lymphatischen Missbildungen 15 veröffentlicht. Berichteten wir eine Strategie der Trennung normaler und erkrankter LECs von vaskulären endothelialen Zellen auf der Basis der Abwesenheit von CD34-Expression, gefolgt von Unterwerfen CD34 Neg Zellfraktion einer positiven Selektion für CD31.Jedoch wurde dieses Verfahren durch die Anwesenheit von restlichem nicht-endothelialen Zellen behindert. Dies war unabhängig von der Entfernung von Epidermis vor den nachfolgenden Bindegewebe Verdauung. Diese Verunreinigungen in der Regel vermehrt sich schneller und damit schließlich die Endothelzellkulturen trotz nachfolgenden Versuche, LEC Isolierung wiederholen überwuchsen. Tatsächlich wird eine anfängliche Kontamination der Nicht Endothelzellen so niedrig wie 2% bis 5% war ausreichend, um den LEC Bevölkerung 15 überwältigen. Dies veranlasste uns, fluoreszenzaktivierte Zellsortierung Verfahren als Option zu LEC Zelle Ausbeute und Reinheit zu verbessern erkunden. Zusätzlich verwendeten wir Multiparameter Sortierung die Spezifität der LEC Populationen erweitern, Zugabe VEGFR-3 und podoplanin den Selektionsmarker CD34 CD31 Low Pos VEGFR-3 Pos podoplanin Pos LECs identifizieren.
Die Gründe für die Auswahl dieser Marker wurde auf die Berichte auf der Grundlage, dass, während LECs und Blut vaskulären endothelialen cells haben viele Zelloberflächenmarker gemeinsam, wie CD31, LECs zeigen phänotypische Veränderung ihrer Expression von CD34, Podoplanin und VEGFR-3 Zelloberflächenmarker im Vergleich zu Blutgefäßendothelzellen 21-23. CD31 ist ein 130 kDa Transmembranglycoprotein auch als Thrombozyten endothelial cell adhesion molecule 1 (PECAM-1) bekannt. Es wird betrachtet, eine pan-endotheliale Zellmarker, da es auf allen Arten von Blut- und Lymphgefäße 21,24,25 zum Ausdruck kommt. CD34 ist auf den meisten hämatopoetischen Vorläufer vorliegende 110-kDa Transmembran-Glykoprotein und Stammzellen, vaskuläre Endothelzellen und einige Lymphgefäße 26.
VEGFR-3, der Rezeptor für den vaskulären endothelialen Wachstumsfaktoren C und D, ist anfänglich vorhanden auf die Entwicklungs Venen im Maus-Embryo, aber nach lymphatischen Spezifikation durch den Transkriptionsfaktoren reguliert SRY bezogenen HMG-Box (SOX) -18, c hicken o valbumin u pstream p romoter t ranscription f Schauspieler 2 (COUPTF-II) und PROX-1, VEGFR-3 ist venösen Ausdruck verloren, und es wird zu embryonalen LECs 25,27 beschränkt. Podoplanin, ein 38 kDa Membran Mucoprotein, wird zuerst auf Lymphgefäße bei etwa embryonaler Tag 11 (~ E11.0) von Maus-Embryonalentwicklung 28 festgestellt und während es ist stark von mikrovaskulären Lymphgefäße, Podoplanin Expression durch macrocystic Lymphendothel in lymphatischen Missbildungen zum Ausdruck ist variabler 15. Durchflusszytometrie Experimente legen nahe, dass zumindest einige CD34 CD31 hoch Pos Endothelzellen exprimieren das lymphatische Marker podoplanin 29. Obwohl systematische Bewertung LYVE-1 und Podoplanin Färbung in menschlichen lymphatischen Malformationen zeigten, dass beide sind effektiv bei der Färbung Lymphmissbildung Endothel 30, in normalen Geweben, LYVE-1 wurde berichtet, dass stark in der Anfangs lymphatischen vorhandenKapillarendothel aber reduziert und in der Sammel Lymphendothel 31 gar nicht vorhanden. Da unser Ziel ist es, zu isolieren, sowohl die Anfangs- und Sammeln lymphatischen Endothelzellen wir entschieden haben, nicht zu LYVE-1 als Teil unserer Zellenauswahl-Strategie zu verwenden. Schließlich wurde die Entscheidung, diese Marker setzen auch von der Verfügbarkeit von Antikörpern, die diagnostisch für die Markierung von Lymphgefäßen für mikroskopische Bildgebung verwendet werden, eine Funktion, die Korrelation zwischen der Durchflusszytometrie und Immunfluoreszenz-Studien erlauben würde basiert.
Dieser Artikel wird die Gewebeaufschlussverfahren, Zellfärbung und FACS-Einstellungen für eine erfolgreiche Isolierung von CD34 Low CD31 Pos VEGFR-3 Pos Podoplanin Pos LECs als auch CD34 Hohe CD31 Pos VEGFR-3 Pos Podoplanin Pos Endothelzellen aus Vorhaut und Lymphmissbildung erforderlich beschreiben Gewebe.
Protokoll
Ethics Statement: Ethische Genehmigung für die Sammlung von Lymphmissbildung und Vorhaut Geweben wurde von den Human Research Ethik-Kommissionen in der Royal-Kinderklinik, Melbourne, Australien erhalten. Unterzeichnet Zustimmung wurde von Patienten Eltern erhielten vor der Operation. Gewebeproben wurden von Patienten mit LMs zogen chirurgischen Verfahren als Teil ihrer klinischen Management und elektiven Beschneidung diagnostiziert gesammelt. Alle Experimente wurden in Übereinstimmung mit den Richtlinien des National Health und Medical Research Council, Australien durchgeführt.
1. Herstellung der Zellsuspension aus Vorhaut und Lymphmissbildung Tissues
- Puffer und Medienvorbereitung.
- Bereiten komplette Endothelzellen-Medien mit handelsüblichen EGM-2 MV Kugel Kit durch Erwärmen EGM-2-Medien und schonend Auftauen der Kit-Komponenten in 37 ° C warmes Wasserbad. In der Klasse II Biosicherheitswerkbank, aseptischfügen Sie jede Komponente auf die Medien EGM-2. Nachdem alle Komponenten zu den Medien, auf diese Medien als "komplette Endothelzellen Medien" beziehen. Verwenden Sie sterile 50 ml-Pipette, um den Inhalt vor der Verwendung zu mischen.
HINWEIS: Alle Schritte in Bezug auf Zellkultur in einer Klasse II Biohazard Schrank durchgeführt. Alle Lösungen sind bei 4 ° C gemäß den Anweisungen des Herstellers gespeichert und auf Raumtemperatur vor der Verwendung erwärmt. Die kompletten endothelialen Zellmedien, Zellkultur-Puffer und Enzymlösungen werden bei 37 ° C für 20 min vor der Verwendung erwärmt. - Ergänzen vollständige endotheliale Zellmedium mit 50 ng / ml VEGF-C. Aliquot der ergänzt Endothelzellen Medien in 50 ml sterilen Röhrchen und lagern bei 4 ° C bis zur Verwendung. Das Medium ist für mindestens 4 Wochen stabil, wenn sie bei 4 ° C gelagert.
- Vorbereitung Calcium und Magnesium freie Phosphat-gepufferter Salzlösung (PBS) durch Auflösen von 8,752 g NaCl, 1,416 g Na 2 HPO 4 · 2H 2 O und0,395 g KH 2 PO 4 in 1000 ml Wasser. PH-Wert auf 7,4. Filter sterilisieren PBS mit 0,22 um Filter und bei 4 ° C. Vor der Verwendung hinzufügen Antibiotikum / Antimykotikum-Lösung (bei 1: 100).
- Um Humanfibronectin vorzubereiten, aufzulösen 1 mg von Fibronektin in 10 ml sterilem Wasser. Shop fertige Lösung in 100 ul Aliquots bei -20 ° C. Am Tag der Anwendung 10 ml sterilem PBS auf 100 ul von Fibronektin Aliquot (um eine endgültige Arbeitskonzentration von 10 ug / ml zu ergeben).
- Für die Enzym Medien, bereiten eine Lösung, die 0,04% Dispase II, 0,25% Collagenase II und 0,01% DNase I in sterilem PBS. Erstens wiegen Dispase und Collagenase, in eine sterile 50-ml-Röhrchen, fügen Sie das erforderliche Volumen an PBS und Inkubation für 30 min unter Schütteln bei 37 ° C zu lösen. Einmal gelöst, Filter zu sterilisieren (0,22 um Filter) Dispase / Collagenase-Lösung in die biologische Sicherheit Kapuze. Die enzymatische Lösung aseptisch DNase I. Shop bei 37 ° C bisverwenden.
HINWEIS: DNase I ist eine kommerzielle Zellkultur grade Reagenz als sterile gefriergetrocknetes Pulver zur Verfügung.
- Bereiten komplette Endothelzellen-Medien mit handelsüblichen EGM-2 MV Kugel Kit durch Erwärmen EGM-2-Medien und schonend Auftauen der Kit-Komponenten in 37 ° C warmes Wasserbad. In der Klasse II Biosicherheitswerkbank, aseptischfügen Sie jede Komponente auf die Medien EGM-2. Nachdem alle Komponenten zu den Medien, auf diese Medien als "komplette Endothelzellen Medien" beziehen. Verwenden Sie sterile 50 ml-Pipette, um den Inhalt vor der Verwendung zu mischen.
2. Herstellung der Zellsuspension aus Vorhaut und des lymphatischen Missbildungen
- Wiege eine 50-ml-Röhrchen mit 10 ml DMEM / 2% Antibiotikum Antimykotika-Lösung. Dieses Rohr wird für die Gewebesammlung verwendet werden.
- Nach der chirurgischen Entfernung der Vorhaut Lymphmissbildung und Gewebe aseptisch Gewebeprobe in den das Rohr und den Transfer auf Eis zum Zellkulturlabor.
- Wiegen Sie das Rohr in das Gewebe enthält, und berechne Gewebegewicht. Verwenden dieses Gewicht, das Volumen der benötigt wird, um das Gewebe zu verdauen Enzymlösung zu berechnen.
- In der Klasse II Biosicherheitswerkbank, sterilen Pinzette verwenden, um das Gewebe und Medien in einen 100 mm-Gewebekulturschale zu übertragen. Verwenden einer sterilen Schere fein zerkleinern das Gewebe in ~ 1 mm 3 Stück.
- Transfer zerkleinerte Gewebe mit Medien i gemischtnin ein 50 ml Röhrchen, enthaltend zusätzlich 10 ml steriles DMEM / 2% Antibiotikum Antimykotika-Lösung. Mischen durch Inversion zu resuspendieren das Gewebe. Zentrifugieren Sie die Probe bei 300 xg für 5 min.
- Entfernen Sie den Überstand. Basierend auf Gewebegewicht, 1 ml der vorgewärmten (37 ° C) Collagenase II / DNase I / Dispase II Aufschlusslösung pro 100 mg zerkleinerte Gewebe. Im Allgemeinen benutzen 10 ml Enzymlösung für etwa 1 g des zerkleinerten Gewebes.
- Inkubieren des Gewebes in einem Inkubator bei 37ºC für 20-90 min unter konstantem Schütteln bei 200 Upm. Am Ende dieses Zeitraums sicherzustellen, dass nahezu der gesamte Gewebe wird in feine Fragmente verdaut.
HINWEIS: Exposition der Zellen gegenüber Collagenase und Dispase bei der Isolation von der primären Geweben beeinflusst das Überleben der Zelle. Wir haben empirisch festgestellt, dass die meisten neonatalen Vorhaut Proben optimal benötigen 20-30 Minuten der Verdauung, während fibrotische Lymphmissbildung Proben 60-90 min der Verdauung benötigen. LM LEC Ausbeuteweiter Bindegewebe s werden durch die Menge an vorhandenem Fibrose beeinflusst wodurch weniger Zellen, möglicherweise aufgrund der schädlichen Wirkungen von längerer Einwirkung von Collagenase II und Dispase II. - Nach der Verdauung, übertragen Sie die Röhre auf die Biosicherheitswerkbank und übergeben die verdaute Gewebe Lösung durch ein 70 um Sieb in ein steriles 50 ml-Röhrchen gegeben. Verwendung von 3 ml Spritzenkolben mit Gummistopfen, schleifen Sie die verbleibende Gewebe, bis nur noch geringe Spuren von extrazellulärer Matrix eingehalten werden.
- Mit einem Volumen von Endothelzellmedium entspricht dem Volumen des Mediums dissoziierenden Enzyms an Zellen klebte Sieb gegeben und zur Inaktivierung der Enzyme zu erholen wäscht den Zellsieb. Beispielsweise wird für 2 ml dissoziierenden Enzyms Medium, um das zerkleinerte Gewebe zu verdauen, 2 ml endothelialer Zellmedium, um die Enzyme zu inaktivieren.
- Zentrifugieren Sie die Zell-Lösung bei 300 xg für 5 Minuten und saugen Sie den Überstand. R> E-die Zellen in 10 ml PBS. Centrifuge Zellen bei 300 gfür 5 Minuten, entfernen Sie den Überstand dann zweimal wiederholen Zelle waschen. > Zellpellet in 20 ml Endothelzellmedium. Zählen von Zellen unter Verwendung von Trypanblau dann seed 2 x 10> 6 Zellen in 150 cm> 2 -Kolben mit Fibronectin vorbeschichtet wurde in einem Endvolumen von 20 ml Endothelzellmedium. Bei 37 ° C in einem 5% CO> 2 in angefeuchteter Luft Inkubator.>
HINWEIS: Es wird erwartet, dass 75% -90% der kernhaltigen Zellen überleben Gewebe Verdauung durch Trypanblau-Ausschluß bestimmt. Die anfängliche Zellzahl spiegelt alle kernhaltigen Zellen in der Zellsuspension (dh Keratinozyten, Leukozyten, Makrophagen, Bindegewebszellen und Zellen von Blutgefäßen). Die Zellzahl auf 5-7 Tage spiegelt Zellen, die angebracht wurden, überlebte und während der Zellkultur vermehrt. Beschichtung von Gewebekulturflaschen mit Fibronektin verbessert auch die nachfolgenden LEC und LM LEC Überleben. - Nach Inkubation über Nacht abzuwaschen ungebundenen Zellen in drei Waschungen mit PBS / 1% Antibiotikum-Antimykotikum-Lösung und fügen Sie frische Endothelzellmedium. Führen Sie drei Wäschen, um ungebundene Zellen und roten Blutkörperchen im Kolben vorhanden effektiv zu entfernen. Ändern Sie jeden zweiten Tag Medien. Die Zellen werden nach 5-7 Tagen sein ~ 80% konfluent.
3. Antikörper-Färbung von Zellen für lymphatische endotheliale Zelloberflächenmarker für die Durchflusszytometrie
- Nachdem die Zellen 80% Konfluenz Aspirat Mediums und Spülen Zellen mit PBS erreicht.
- Lösen adhärenten Zellen durch Inkubieren der Zellen mit 7 ml Zellablösung Lösung wie Accutase pro 150 cm 2 -Kolben für 5-7 Minuten bei 37 ° C.
- Ernte abgelösten Zellen inaktivieren, die Zellablösung Lösung durch Zugabe von 3 Volumina Endothelzellmedium und übertragen die Zellsuspension in ein neues steriles Röhrchen.
- Zentrifugieren der Zellen bei 300 g für 5 min.
- Überstand wird abgesaugt und wieder die Zellen in 5 ml PBS. Centrifuge Zellen bei 300 xg für 5 Minuten, entfernen Sie die supernatant wiederholen Sie dann Zelle waschen. Resuspendieren der Zellen in 5 ml PBS.
- Zählen die Anzahl von lebensfähigen Zellen. Mischen Sie 10 ul der Zellsuspension mit 90 & mgr; l von 0,4% Trypanblau. Transfer 10 ul dieser Suspension bis zum Zählen Zählkammer.
BEACHTEN SIE: Der endgültige Zellausbeute auf der Stichprobengröße verarbeitet abhängen. Die übliche Zellausbeute pro 150 cm 2-Kolben reicht von 7 x 10 5 bis 1,2 x 10 6 lebensfähigen Zellen. - Bereiten Sie die Antikörperlösungen für Zellfärbung.
HINWEIS: Die folgenden Verdünnungen wurden zum Anfärben 1 x 10 6 in einer Färbung von 100 ul titriert.- Verdünnter PE konjugierten Maus-anti-Mensch-VEGFR-3 (1:50); PE-Cy7 konjugierten Maus-anti-Mensch-konjugierten CD34 (1: 200); APC-konjugiertem Maus-anti-Mensch-CD31 (1: 100) und Alexa 488-konjugiertes Ratte-anti-Mensch podoplanin (1: 200) in einem Gesamtvolumen von 100 ul steriler 5% FBS / PBS-Lösung pro Gewebeprobe. Nach der HerstellungAntikörperlösung, halten auf Eis bis zum Gebrauch. Ebenso bereiten verdünnter Isotypkontrollantikörper Mischung, um die Einstellung der Durchflusszytometrie Tore zu erleichtern.
- Um nicht-spezifische Bindung der Antikörper zu reduzieren, Zentrifuge Zellen bei 300 × g für 2 min, zu entfernen Überstand dann die Zellen zu suspendieren in 100 ul sterile 5% FBS / PBS-Lösung pro Probe zu gefärbt werden. Inkubieren Zellen auf Eis für 20 min bei 4 ° C.
- Zentrifuge Zellen bei 300 g für 5 min, Überstand abnehmen, dann resuspendieren Zellen in der konjugierten Antikörper-Cocktail. Auch einen kleineren Fleck Aliquot von Zellen (1 x 10 & sup5;) in 100 ul Isotypkontrollantikörper Gemisches. Inkubieren Zellen auf Eis für 20 min.
- Um die ungebundenen Antikörper zu entfernen, fügen Sie 2 ml 2% FBS / PBS-Lösung und Zentrifuge die Zellen bei 300 xg für 5 min. Den Überstand aspirieren und wiederholen Sie die Wäsche.
- Zellpellet zur Isotypenkontrolle und dem Antikörper gefärbten Probe in 300 ul 0,5 mg / ml Propidiumiodid io sortiertdide / 2% FBS / PBS-Lösung. Zeigen Röhrchen auf Eis, bis die Sortierung.
4. Zellsortierung
- Verwenden Sie die folgenden Materialien, um das Gerät einzurichten; Ausrichtungsperlen wie im Handel erhältlichen fluoreszierenden Teilchen, phosphatgepufferter Kochsalzlösung auf der Basis Hüllflüssigkeit und Tröpfchenverzögerungs Perlen, wie Accudrop fluoreszierenden Kügelchen.
- Isolieren der gereinigten menschlichen LECs auf einer Multi-Parameter-Fluoreszenz-aktivierten Zellsortierung Instruments. Stellen Sie das Gerät und richten Sie nach den Empfehlungen des Herstellers. Darüber hinaus laufen einzigen Fleck Entschädigung Kontrollen bei jeder Art, um die Kompensationsmatrix zu erzeugen und damit zu beseitigen erhebliche Blutung durch die Emission von Fluoreszenzfarbstoffen wie PE in die PE-Cy-Kanal.
HINWEIS: Ein höherer Anteil der FACS sortierten Zellen überleben die Isolation, wenn ein 100 & mgr; m Düse verwendet, und die Zellen werden in Endothelzellmedium sortiert.
5. Cell Culture Beitrag FACS Sortierening
- Folgende Sortier zentrifugieren Zellen bei 300 g für 5 min. Aspiration des Überstands und Resuspendieren der Zellen in 5-10 ml Medium (je nach dem zur Herstellung der Zell Impfkolben). Wenn weniger als 50.000 Zellen sortiert, sind die Zellen in Fibronectin-beschichteten 25 cm 2 -Kolben kultiviert.
- Ob die Kultur werden die Zellen in 75 cm 2 fibronektinbeschichtete Kolben bei 37 ° C in einem 5% CO 2, Luft befeuchteten Inkubator. Ändern Sie Medien nach 2 Tagen.
HINWEIS: Cell-Medium wird jeden zweiten Tag gewechselt, weil die Verlängerung der Zeit zwischen den Medienwechsel scheint das Überleben der nicht-endothelialen Zellen begünstigen. Wir überprüfen das lymphatische Endothelzellen Phänotyp mit immunhistochemischen Nachweis von Markern: PROX-1, VEGFR-3, Podoplanin, CD34 und CD31, wenn die Zellen zunächst Split für die weitere Expansion 15.
Ergebnisse
Nach der anfänglichen Gewebe Verdauung, nach 24 Stunden in Kultur von unfraktionierten Proben deutliche endothelialen Zellkolonien zusammen mit Fibroblasten-ähnliche Zellen und glatten Muskelzellen beobachtet werden (Abbildung 2A). Im Anschluss an das Sortieren und nach 24 Stunden in der Zellkultur, die CD34 Low CD31 Pos VEGFR-3 Pos Podoplanin Pos Zellen befestigen und zeigen typische Kopfsteinpflastermorphologie (2B und C)....
Diskussion
LECs spielen eine wichtige Rolle bei der Aufrechterhaltung der Homöostase Fluid, Immunantwort auf fremde Antigene, und die Absorption und den Transport von bestimmten Nährstoffen. LEC-Homöostase durch Krankheitsprozesse wie bakterielle Infektionen und Tumormetastasen betroffen sein, aber LECs können somatische Mutationen, die in der Bildung von dysfunktionalen Lymphgefäße und signifikante Morbidität für die betroffenen Patienten führen zu entwickeln. Um mehr Verständnis Lymphmissbildung Ätiologie durch Implan...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Die Autoren möchten die Baker-Stiftung und dem Königskinder "Women in Science Fellowship 'Foundation Unterstützung Zerina Lokmić anzuerkennen. Andrew G. Elefanty und Edouard G. Stanley sind NHMRC Senior Research Fellows. Arbeit in ihren Labors wurde von NHMRC und Stammzellen Australien unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| DMEM | Life Technologies (Gibco) | 11965-092 | Used to collect tissue samples from the operating theatre. |
| EGM-2 MV Bullet Kit | Lonza | CC-3202 | EGM-2 MV Bullet Kit contains 500 ml of EBM-2 media and human EGF, hydrocortisone, gentamycin (GA-1000), fetal bovine serum (FBS), VEGF, human FGF-b, R3-IGF-1 and ascorbic acid. |
| VEGF-C | R&D Systems | 2179-VC-025 | Complete endothelial cell media is supplemented with 50 ng/ml VEGF-C |
| Antibiotic-antimycotic solution (100x) | Life Technologies (Gibco) | 15240-062 | This solution contains 10,000 U/ml of penicillin, 10,000 mg/ml of streptomycin and 25 mg/ml of Fungizone antimycotic. Use at 1:100 dilution. |
| Fibronectin from human plasma | Sigma-Aldrich | F2006 | Used at 10 mg/ml concentrations. It can be re-used for up to 1 month if kept at 4 °C and maintained sterile. Use 7 ml to coat 150 cm2 flask. |
| StemPro Accutase Cell dissociation reagent | Life Technologies (Gibco) | A11105-01 | StemPro®Accutase® is used at 0.05 ml per cm2 to cover the entire surface area of the flask. Using lesser volumes may result in incomplete cell detachment. |
| 0.4% Trypan Blue dye | Life Technologies (Gibco) | 15250-061 | Used as a viability stain. |
| Dispase II | Roche Applied Biosciences | 4942078001 | Used at 0.04% |
| Collagenase II | Worthington Lab | 4176 | Used at 0.25% |
| DNase I | Roche Applied Biosciences | 11284932001 | Used at 0.01% |
| 70 mm nylon cell strainers | BD Falcon | 352350 | |
| [header] | |||
| PE-conjugated VEGFR-3 clone 9D9F9, clone WM59 | BioLegend | 356204 | Used at 1:50 dilution |
| PE-Cy7-conjugated CD34, clone 581 | BioLegend | 343516 | Used at 1:200 dilution |
| APC-conjugated mouse anti human CD31, clone WM59 | BioLegend | 303116, | Used at 1:100 dilution |
| Alexa 488-conjugated rat anti human Podoplanin, clone NC-80. | BioLegend | 337006 | Used at 1:200 dilution |
| PE-conjugated mouse IgG1, k isotype, clone MOPC-21 | BioLegend | 400112 | Used at 1:50 dilution |
| PE-Cy7-conjugated mouse IgG1, k isotype, clone MOPC-21 | BioLegend | 400126 | Used at 1:200 dilution |
| APC-conjugated mouse IgG1, k isotype, clone MOPC-21 | BioLegend | 400120 | Used at 1:100 dilution |
| Alexa 488-conjugated mouse IgG2a, k isotype, clone RATK2758 | BioLegend | 400525 | Used at 1:200 dilution |
Referenzen
- Baluk, P., et al. Functionally specialized junctions between endothelial cells of lymphatic vessels. J Exp Med. 204 (10), 2349-2362 (2007).
- Yao, L. C., Baluk, P., Srinivasan, R. S., Oliver, G., McDonald, D. M. Plasticity of button-like junctions in the endothelium of airway lymphatics in development and inflammation. Am J Pathol. 180 (6), 2561-2575 (2012).
- Zawieja, D. C. Contractile physiology of lymphatics. Lymphat Res Biol. 7 (2), 87-96 (2009).
- Witte, M. H., et al. Structure function relationships in the lymphatic system and implications for cancer biology. Cancer Metastasis Rev. 25 (2), 159-184 (2006).
- Andrade, M., Jacomo, A. Anatomy of the human lymphatic system. Cancer Treat Res. 135, 55-77 (2007).
- Kumar, V., Abbas, A. K., Aster, J. C., Ch Fausto, N. . Cotran Pathologic Basis of Disease. 43-78. 2, (2009).
- Shayan, R., Achen, M. G., Stacker, S. A. Lymphatic vessels in cancer metastasis: bridging the gaps. Carcinogenesis. 27 (9), 1729-1738 (2006).
- . . Mulliken & Young's Vascular Anomalies Hemangiomas and. , 1059-1076 (2013).
- . . Mulliken & Young's Vascular Anomalies Hemangiomas. 14, 562-594 (2013).
- Bellini, C., Hennekam, R. C. Clinical disorders of primary malfunctioning of the lymphatic system. Adv Anat Embryol Cell Biol. 214, 187-204 (2014).
- Schook, C. C., et al. Primary lymphedema: clinical features and management in 138 pediatric patients. Plast Reconstr Surg. 127 (6), 2419-2431 (2011).
- Brouillard, P., Boon, L., Vikkula, M. Genetics of lymphatic anomalies. J Clin Invest. 124 (3), 898-904 (2014).
- . for the Study of Vascular Anomalies (ISSVA) classification. Available from: http://www.issva.org/classification.com. , (2014).
- Croteau, S. E., et al. Kaposiform lymphangiomatosis: a distinct aggressive lymphatic anomaly. J Pediatr. 164 (2), 383-388 (2014).
- Lokmic, Z., et al. Isolation of human lymphatic malformation endothelial cells, their in vitro characterization and in vivo survival in a mouse xenograft model. Angiogenesis. 17 (1), 1-15 (2014).
- Smith, R. J. Lymphatic malformations. Lymphat Res Biol. 2 (1), 25-31 (2004).
- Chen, E. Y., et al. Similar histologic features and immunohistochemical staining in microcystic and macrocystic lymphatic malformations. Lymphat Res Biol. 7 (2), 75-80 (2009).
- Norgall, S., et al. Elevated expression of VEGFR-3 in lymphatic endothelial cells from lymphangiomas. BMC cancer. 7 (2), 75-80 (2007).
- Garzon, M. C., Huang, J. T., Enjolras, O., Frieden, I. J. Vascular malformations. Part I. J Am Acad Dermatol. 56 (3), 353-370 (2007).
- Osborn, A., Dickie, P., Adams, D., Dickie, B. . 20th International workshop on Vascular Anomalies. ISSVA. , (2014).
- Baluk, P., McDonald, D. M. Markers for microscopic imaging of lymphangiogenesis and angiogenesis. Ann N Y Acad Sci. 1131, 1-12 (2008).
- Lokmic, Z., Mitchell, G. M. Engineering the microcirculation. Tissue engineering. Part B, Reviews. 14 (1), 87-103 (2008).
- Lokmic, Z., Mitchell, G. M. Visualisation and stereological assessment of blood and lymphatic vessels. Histol Histopathol. 26 (6), 781-796 (2011).
- Hagerling, R., et al. A novel multistep mechanism for initial lymphangiogenesis in mouse embryos based on ultramicroscopy. EMBO J. 32 (5), 629-644 (2013).
- Pollmann, C., Hagerling, R., Kiefer, F. Visualization of lymphatic vessel development, growth, and function. Adv Anat Embryol Cell Biol. 214, 167-186 (2014).
- Breiteneder-Geleff, S., et al. Angiosarcomas express mixed endothelial phenotypes of blood and lymphatic capillaries: podoplanin as a specific marker for lymphatic endothelium. Am J Pathol. 154 (2), 385-394 (1999).
- Kaipainen, A., et al. Expression of the fms-like tyrosine kinase 4 gene becomes restricted to lymphatic endothelium during development. Proc Natl Acad Sci U S A. 92 (8), 3566-3570 (1995).
- Schacht, V., et al. T1alpha/podoplanin deficiency disrupts normal lymphatic vasculature formation and causes lymphedema. EMBO J. 22 (14), 3546-3556 (2003).
- Kriehuber, E., et al. Isolation and characterization of dermal lymphatic and blood endothelial cells reveal stable and functionally specialized cell lineages. J Exp Med. 194 (6), 797-808 (2001).
- Florez-Vargas, A., et al. Comparative analysis of D2-40 and LYVE-1 immunostaiing in lymphatic malformations. Lymphology. 41 (3), 103-110 (2008).
- Makinen, T., et al. PDZ interaction site in ephrinB2 is required for the remodeling of lymphatic vasculature. Genes Dev. 19 (3), 397-410 (2005).
- Connell, F. C., et al. Analysis of coding regions of VEGFR3 and VEGFRC in Milroy disese and other primary lymphoedemas. Hum Genet. 124 (6), 625-631 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten