Method Article
Haute fréquence imagerie par ultrasons de souris cervicales ganglions lymphatiques
Dans cet article
Résumé
Ce protocole décrit l'application des ultrasons à haute fréquence (HFU) pour l'imagerie souris ganglions lymphatiques du col utérin. Cette technique permet d'optimiser la visualisation et la quantification de la morphologie du col de ganglion lymphatique, le volume et le débit sanguin. Guidée par l'image de biopsie des ganglions lymphatiques cervicaux et de traitement de tissu lymphatique pour l'évaluation histologique est également démontrée.
Résumé
L'échographie à haute fréquence (HFU) est largement utilisé en tant que méthode non invasive pour l'imagerie de structures anatomiques internes dans les petits systèmes animaux expérimentaux. HFU a la capacité de détecter des structures aussi petites que 30 um, une propriété qui a été utilisée pour la visualisation de ganglions lymphatiques superficiels chez les rongeurs de luminosité (B) -mode. La combinaison de puissance Doppler avec l'imagerie en mode B permet de mesurer le débit sanguin circulatoire à l'intérieur des ganglions lymphatiques et d'autres organes. Bien que HFU a été utilisée pour l'imagerie des ganglions lymphatiques dans un certain nombre de systèmes de modèles de souris, un protocole détaillé décrivant HFU imagerie et la caractérisation des ganglions lymphatiques cervicaux chez la souris n'a pas été signalée. Ici, nous montrons que HFU peut être adapté pour détecter et caractériser des ganglions lymphatiques cervicaux chez la souris. Combiné en mode B et l'imagerie Doppler puissance peuvent être utilisés pour détecter une augmentation du flux sanguin dans les ganglions cervicaux immunologiquement élargie. Nous décrivons également l'utilisation de l'imagerie en mode B pour effectuer des biopsies à l'aiguille fine de lymphatique cervical paspour récupérer des tissus lymphatiques pour l'analyse histologique. Enfin, des mesures de logiciels assistée sont décrits pour calculer les variations de volume des ganglions lymphatiques et de visualiser des changements dans la morphologie des ganglions lymphatiques suivants reconstruction de l'image. La capacité de surveiller visuellement les changements dans la biologie du col de ganglion lymphatique au cours du temps fournit une technique simple et puissant pour le contrôle non invasif du col de modifications des ganglions lymphatiques chez les souris modèles précliniques de maladies de la cavité buccale.
Introduction
le drainage lymphatique du fluide de tissu interstitiel est la principale méthode de diffusion pour les microorganismes infectieuses et des cancers qui se posent dans la région buccale et maxillo-faciale 1,2. L'évaluation clinique des ganglions cervicaux est une pratique de diagnostic couramment utilisé pour déterminer la présence ou la progression de maladies qui sont originaires de la cavité buccale. Cela souligne l'importance de la collecte des ganglions cervicaux que les sites anatomiques précieux pour le diagnostic de la maladie par voie orale 3. Plusieurs méthodologies d'imagerie spécialisés sont cliniquement utilisés pour identifier des ganglions lymphatiques cervicaux malades. Ceux-ci comprennent la tomographie par émission de positons (TEP), la tomodensitométrie (TDM) et l'imagerie par résonance magnétique (MR). Bien que très précieux, ces méthodes nécessitent tous une vaste préparation du patient, un équipement hautement spécialisé et / ou perfusion chimique dans la circulation pour permettre ou améliorer le processus d'imagerie.
Imagerie échographique (ultrasons; Etats-Unis) est une technique couramment utilisée pour appliquer imganglions cervicaux âge lymphatiques présentant une adénopathie due à une infection ou une atteinte métastatique 4-6. US est souvent combiné avec la TEP-TDM et l'IRM pour fournir une représentation complète de l'état du patient ganglionnaire, pour aider à déterminer la mise en scène de la tumeur et de la nécessité pour l'excision chirurgicale 7. La nature non-invasive des États-Unis a aussi des avantages inhérents sur d'autres modalités d'imagerie, y compris la facilité d'utilisation, faible coût, l'inconfort du patient et la préparation minimale. La localisation sous-cutanée superficielle de la plupart des ganglions cervicaux permet de nous pour nous guider fines biopsies aiguille d'aspiration minimalement invasives avec une précision accrue, l'amélioration de la précision du diagnostic 8.
Haute fréquence commerciale (HF) des États-Unis offre une résolution détaillée des structures anatomiques internes à 30 um 9. Utilisation de transducteurs allant de 22 à 70 MHz, HFU a été facilement appliquée à une variété de systèmes expérimentaux de rongeurs pour permettre une imagerie en temps réel des organes internes in vivo.; HFU a été adapté pour la visualisation de la formation de tumeurs de la luminosité (B) -mode classique, ainsi qu'avec un certain nombre de rehaussement du contraste général et spécialisé agents9. Utilisation de l'énergie Doppler avec HFU offre la possibilité de surveiller le flux sanguin dans les tumeurs de souris, ce qui permet une évaluation complète de la perfusion angiogénique chez la souris en direct 10,11. HFU a été utilisée pour visualiser les ganglions lymphatiques de la souris malades à l'intérieur de la cavité du corps principal, ce qui démontre l'utilité de cette technologie parallèle à la pratique clinique. En particulier, inflammatoires et métastatiques lymphatiques viscérale altérations de noeuds ont été observés dans des modèles murins de cancer hébergeant sein 12,13, pancréatiques 14, colorectal 15 et les poumons 16 des tumeurs, ainsi que histocytomas fibreux 17, et un modèle de souris âgées de hydronéphrose acquis 18 . Ces exemples se solidifient la valeur de HFU comme un puissant outil d'enquête pour lymphadénopathie induite par la tumeur dans une grande variété de rosystèmes de dent.
Plusieurs modèles d'infection bactérienne 19,20 et de la tête et du cou carcinome spinocellulaire (CETC) 21,22 ont été développées pour étudier ces maladies dans le cadre préclinique. En revanche pour les humains, les souris contiennent trois ganglions lymphatiques cervicaux de cet inventaire lymphe à partir de tissus de la cavité orale (mandibulaire, sous-maxillaire et mandibulaire parotide superficiel 23). Récemment, nous avons signalé l'utilisation de HFU à cartographier l'emplacement et de la morphologie de ces ganglions lymphatiques, le suivi des changements de volume des ganglions lymphatiques et la circulation sanguine dans un modèle de souris induite par carcinogène de HNSCC 24. Ici, nous fournissons un protocole détaillé pour l'utilisation de HFU pour l'identification, l'analyse et l'imagerie des ganglions lymphatiques cervicaux chez des souris vivantes. Ce protocole démontre également la possibilité d'utiliser HFU de mener image- biopsie à l'aiguille fine guidée des ganglions cervicaux de souris élargie, permettant un suivi histologique des changements dans lymphatique cervical contenu du nœud et des pathologies plus tEMI à la même animal. Ce protocole est facilement adaptable pour permettre l'étude détaillée des pathologies du col de ganglions lymphatiques obtenus à partir de toutes les maladies de la cavité buccale invasive chez la souris.
Protocole
Toutes les procédures animales démontré dans ce protocole ont été examinés et approuvés par le Comité de protection des animaux et l'utilisation de l'Université West Virginia en vertu des protocoles 11-0412 et 14-0514 et menées en conformité avec les principes et les procédures décrites dans le Guide du NIH pour le soin et l'utilisation des animaux.
1. Préparation d'un animal
- Anesthésier une seule souris dans une chambre d'induction en utilisant 3% isofluorane mélangé avec 1,5 L / min 100% d'oxygène. Retirer l'animal de la chambre de l'induction et la place dans une position couchée sur la plate-forme d'imagerie préchauffé à 40 ° C et maintenue entre 37-42 ° C (figure 2A). Confirmez l'anesthésie par l'absence de réponse à un pincement de l'orteil.
- Positionner le museau de la souris dans la coiffe reliée au système d'anesthésie. Appliquer l'anesthésie pour maintenir la sédation de l'état d'équilibre (1,5% de isofluorane mélangé avec 1,5 L / min 100% d'oxygène).
- Appliquer du lubrifiant de l'œil chaque œil pour empêcher Drying. Appliquer le gel de l'électrode pour les électrodes et utilisez du ruban pour fixer chacune des quatre pattes à l'électrode correspondante. Les plots d'électrodes ECG se transmettre de l'animal dans le système de formation d'image pour permettre la surveillance de la fréquence cardiaque et la fréquence respiratoire. Graisser et insérer la sonde de température rectale pour la surveillance continue de la température corporelle. La température normale du corps de la souris est de 36,9 ° C. 1-2 ° C variation est normale, tandis que sous anesthésie.
- Utiliser une crème dépilatoire pour enlever la fourrure du col de la souris. Rincer la région du cou avec de la gaze imbibée d'eau pour enlever les poils et l'excès de crème dépilatoire. Eventuellement, utiliser l'application supplémentaire de crème dépilatoire pour enlever tous les poils du corps restant (figure 2B).
2. Identification et Image Acquisition du col de l'utérus de souris ganglions lymphatiques Utilisation HFU
- Pour commencer, appliquer une couche de gel d'ultrasons réchauffé à la région du cou dépourvu de fourrure. Utilisez application libérale de gel pour une image optimalequalité (figure 2C). Éviter d'introduire des bulles d'air dans le gel lors de l'application, ce qui peut interférer avec l'imagerie par ultrasons.
- Ajustez la plate-forme d'imagerie 20-30 ° de sorte que la souris est positionné avec la tête légèrement surélevée. Cette position permet de garantir le taux de respiration optimale pour la souris. Placez le transducteur de 40 MHz transversalement dans le système de montage avec soin et l'abaisser jusqu'à ce que l'avant de la tête de balayage de transducteur est immergé dans le gel à ultrasons (Figure 2C).
NOTE: Assurez-vous de ne pas mettre une pression excessive sur le col de la souris, car cela pourrait entraîner une détresse respiratoire excessive. En outre, il est utile pour l'imagerie d'avoir un tampon de gel entre le transducteur et la souris.
Imagerie en mode B et de détection des ganglions lymphatiques:
- Utilisation de l'ordinateur qui commande le logiciel d'acquisition HFU, régler la luminosité (B-) Les réglages du mode des paramètres suivants: Gain de 22 dB, la profondeur 10.00mm, largeur 14,08 mm.
NOTE: Ces paramètres sont un point de départ suggéré, et peuvent exiger un léger ajustement pour l'acquisition d'image optimale entre les différentes applications. Respecter les ganglions cervicaux normaux que les structures hypoéchogènes ovales près de la surface de la peau dans un champ hyperéchogène environnante. L'apparition de ganglions lymphatiques malades peuvent varier selon les modèles. Pour l'image systématiquement tous les ganglions lymphatiques dans la région du cou utiliser les étapes suivantes:- Utilisez l'axe Y pour balayer le cou dans un crâne de manière caudale vers la région thoracique. Utilisez X-axe pour centrer l'image.
- Identifier les principaux points de repère: cavité buccale, de la langue et de la glande thyroïde (figures 3A, B et C; respectivement); incliner la plate-forme de formation d'image à régler horizontalement la surface ventrale du cou de la souris, ce qui rend les deux côtés du cou apparaissent même dans l'image B-mode. La quantité de basculement dépend de la physiologie de chaque souris individuelle.
- Effectuer un balayage 3D de la région du cou ensemble de la région de la cavité / langue buccale à la glande thyroïde, afin de cartographier les ganglions lymphatiques et des monuments associés tout au long du cou.
- Localisez le / région de la cavité buccale de la langue (figure 3A) et notez l'emplacement numérique sur l'échelle Y.
- Localiser glande thyroïde (Figure 3C) et notez l'emplacement numérique sur l'échelle Y.
- Calculer la différence entre les valeurs obtenues en (2.4.1) et (2.4.2) à déterminer la longueur totale en mm de la zone de cou portant une image.
- Utilisez le bouton Y pour centrer le transducteur sur le point médian de la longueur totale déterminée.
- Appuyez sur "3D". Entrez la longueur totale. Pour la taille de l'étape 3D, utiliser 0,076 mm d'acquérir la pile de la série d'image pour la région du cou entier.
- Une fois la numérisation terminée, sélectionnez le côté droit ou gauche du cou et de centrer le transducteur sur un ganglion personne d'intérêt, puis relevez le 40 MHz transducteur de la souris. Retirez le transducteur de 40 MHz et le remplacer par un transducteur microscan 50 MHz (également dans une position transversale) pour obtenir des images haute résolution. Reconstituer le gel à ultrasons sur le goulot de la souris et abaisser le transducteur de 50 MHz dans le gel à ultrasons.
3D Alimentation imagerie Doppler
- Conduite 3D numérise avec une puissance Doppler pour ânes volume et la vascularisation des individuels ganglions cervicaux comme suit:
- Appuyez sur le bouton d'alimentation sur le clavier du système pour acquérir le pouvoir Dopper et ajuster les réglages de puissance en mode suivantes: PRF 4 KHz, Doppler gain de 34 dB, un gain de 30 dB 2D, profondeur 5,00 mm, largeur de 4,73 mm. NOTE: Comme précédemment, ces paramètres sont un point de départ suggéré et peut être modifié au besoin pour l'acquisition d'image optimale dans divers modèles.
- Localisez le plus crânienne-point de ganglion lymphatique d'intérêt et notez l'emplacement sur l'échelle Y.
- Localisez le point le plus caudale du même noeud et la notel'emplacement sur l'échelle Y.
- Calculez la différence de distance pour déterminer la longueur totale du ganglion lymphatique (voir l'étape 2.4.3).
- Centrer le transducteur sur le point médian de la longueur totale déterminée, en utilisant l'emplacement Y-échelle.
- Appuyez sur "3D" et entrez la longueur totale des ganglions lymphatiques. Utiliser 0,051 mm pour la taille de pas.
Remarque: En raison de la proximité du transducteur à la région de la poitrine, le transducteur de 50 MHz peut donner lieu à une image Doppler instable en raison de la détection de mouvement respiratoire normal. Cela peut être éliminé en utilisant l'option "Respiration Gating" disponible sous l'onglet "physiologique". - Entourez le ganglion lymphatique sélectionné avec la boîte jaune qui désigne la région à être analysés par Doppler puissance et sélectionnez "scan 3D" pour acquérir des images. Soulever le transducteur hors de la souris et le déplacer vers le côté opposé du goulot. Abaisser le transducteur sur la souris et répétez les étapes décrites ci-dessus pour image ganglions lymphatiques de ce côté du cou.
- Enregistrer ensembles d'image pour une analyse ultérieure.
3. biopsie du ganglion cervical
- Sélectionner le ganglion lymphatique souhaitée pour la biopsie et maintenir l'imagerie par HFU avec le transducteur de 50 MHz. Chose la plus importante ganglion lymphatique cervical visible de chaque côté du col de la souris. Hypertrophie des ganglions lymphatiques indique généralement une réponse inflammatoire, et donc ces nœuds sont des candidats idéaux pour une biopsie.
NOTE: Nous avons trouvé qu'il est très difficile de procéder à des biopsies sur ganglions cervicaux inférieure à 10 mm 3. - Préparer l'aiguille et la seringue pour biopsie en plaçant une seringue de 1 ml avec une aiguille de 0,5 pouces 27 G ci-joint dans le porte-seringue. Ajuster le porte-aiguille pour orienter l'aiguille 90 ° par rapport au col de la souris (figure 4A).
- Préparer par élévation de la plate-forme entière de la souris au niveau de l'aiguille. Atteindre cet objectif en retirant le moteur 3D et le passage à un plus grand PlatORM, ou en plaçant un objet solide de hauteur convenable sous la plate-forme courte fourni. Utiliser un portoir de tubes de microcentrifugeuse en plastique à cet effet. Si nécessaire, faire tourner la plate-forme de 180 ° afin de biopsie noeuds situés sur le côté opposé du col de l'appareil d'aiguille.
- Réglez les paramètres d'acquisition en sélectionnant «Préférences», puis en choisissant "Max & tampon élargie". Agrandir le champ de vision jusqu'à une profondeur de 8,00 mm et une largeur de 9,73 mm. Tournez sur le guide de l'aiguille en utilisant l'écran touches d'appel. Le guide d'aiguille prédire la trajectoire de l'aiguille sur l'écran et permet à l'utilisateur d'aligner le ganglion lymphatique d'intérêt dans l'emplacement correct pour une biopsie.
- Assurez-vous que le ganglion lymphatique reste constamment en vue, en centrant le ganglion lymphatique au milieu ou légèrement à gauche du centre de l'écran (figure 4B). Pour obtenir la boucle ciné ensemble de la procédure, appuyez sur pré-déclenchement sur le clavier du système avant de commencer la biopsie.
- Régler le support de l'aiguille jusqu'à ce que la pointe de l'aiguille est en vue et les contacts de la peau (figure 4B). Avancer l'aiguille avec une entreprise, pousser vite pour perforer la peau. Continuer à avancer l'aiguille jusqu'à la pointe perfore également la capsule (figure 4C) et est visible dans la moelle (figure 4D).
- Une fois que l'aiguille est correctement situé dans le noeud, tirez doucement sur le piston de la seringue dos entre les démarcations 200-300 pi de procéder à la biopsie (Figure 4D et 4E). Notez que matériau de biopsie est typiquement pas visible à l'intérieur de la seringue.
- Retirez délicatement l'aiguille du cou de la souris. Expulser le contenu de la seringue dans un tube à microcentrifugation de 1,5 ml. Retirez l'aiguille de la seringue, laissant l'aiguille dans le tube. Prélever 1 ml de milieu de biopsie (à partir d'une aliquote, séparés de la source du stock) avec la même seringue, puis remettre en place l'aiguille à la seringue tout en gardant l'aiguille dans etube e.
- Rincer la seringue et l'aiguille avec les médias biopsie en expulsant les médias biopsie dans le tube.
NOTE: Ne tirez pas sur le piston alors que l'aiguille est fixée à tout moment après la biopsie. Cela réduit le risque de perdre le matériau de biopsie raison de la petite taille de l'échantillon.
- Rincer la seringue et l'aiguille avec les médias biopsie en expulsant les médias biopsie dans le tube.
- Confirmez lymphatique contenu du nœud par des moyens histologiques (Figure 4F) et d'analyser par des méthodes supplémentaires (histochimie, la cytométrie en flux, etc.), le cas échéant.
- Une fois que la biopsie est terminée, éteignez l'anesthésie et retirer la sonde de température rectale. Retirer le gel échographique excès de la souris avec de la gaze et retirez le ruban adhésif de chaque patte.
- Retirer la souris à partir de la plate-forme de formation d'image et revenir à une cage. Saignement minime de site de biopsie peut se produire, mais cela arrête sans intervention. Surveiller la souris lors de la récupération jusqu'à ce que la pleine activité reprend.
4. Analyse d'image des ganglions lymphatiques cervicaux
- Dans le logiciel de l'échographie, sélectionnez l'image pour l'analyse et accédez à l'onglet "Image Processing". Choisissez "Charger dans 3D".
- Sélectionnez "3D reconstruite Image" dans le coin supérieur gauche, en cliquant sur le bouton "Afficher Volet unique". Utilisez la fonction de zoom pour agrandir l'image, si désiré. Basculer "Disposition de l'affichage" pour afficher l'image que dans les modes B, qui élimine la superposition puissance Doppler de la vue. Il est ainsi plus facile de voir les bords du ganglion lymphatique au cours de l'analyse ultérieure en 3-D. Faire défiler la série d'images pour localiser le début du ganglion lymphatique.
- Pour circonscrire le ganglion lymphatique, accédez à l'onglet "Paramètres 3D". Sélectionnez "volume", puis sur le bouton "Démarrer" à côté de "parallèle".
- Dessiner les contours autour de la zone d'intérêt dans les images individuelles par défilement. Continuez jusqu'à ce que les images qui englobent l'ensemble des ganglions lymphatiques sont marqués. Choisissez "Terminer" pourcompléter l'analyse.
- Au bas de l'image, 3D% volume et la vascularisation est automatiquement affichée.
REMARQUE: 3D volume correspond au volume des ganglions lymphatiques, et la vascularisation pour cent représente le pourcentage du ganglion lymphatique positif pour le flux sanguin par effet Doppler puissance. - Basculer "Disposition de l'affichage" pour afficher l'imagerie Doppler puissance en surimpression sur l'image en mode B-. Sur le point de vue de surface observer une vue nette de la zone de volume d'intérêt. Exporter les images dans le fichier d'image (TIF) ou le format 3D scans marquées que les films (.avi) pour une utilisation ultérieure.
Résultats
Le schéma global des procédures d'imagerie et la biopsie est montré à la figure 1. Les principales étapes de la procédure comprennent une bonne préparation de la souris pour l'imagerie, l'identification des ganglions cervicaux, une bonne préparation et la réalisation de la biopsie à l'aiguille, et l'analyse de B -MODE et Doppler images pour mesurer le volume et la quantité de la vascularisation au sein de chaque noeud sélectionné en utilisant un logiciel informatique.
HFU imagerie des ganglions lymphatiques cervicaux de souris nécessite l'application et le maintien de l'anesthésie appropriés tout au long de la période de formation d'image (figure 2A), ainsi que l'élimination complète de la chevelure couvrant toute la zone de col (Figure 2B). L'application libérale de gel d'ultrasons à la région épilée assure un signal de HFU clair lors de la procédure (figure 2C).
HFU imagerie de la région du cou est facilitée par la visualisation des repères anatomiques du col utérin qui produisent des images échographiques caractéristiques. FigureLa figure 3 montre des exemples des principaux organes (Figure 3A-C), les ganglions cervicaux en mode B (Figure 3D) et en mode Doppler puissance (figure 3E).
En temps réel HFU imagerie chez la souris anesthésiés permet de biopsie guidée à l'aiguille fine des ganglions cervicaux similaires à ce qui est réalisé dans la pratique clinique. Mise en place de l'aiguille de biopsie et la seringue de prélèvement fixée à l'équipement de commande de micro-injecteur est représenté sur la figure 4A. B-mode Après images échographiques montrent un positionnement idéal de l'aiguille avant une biopsie (figure 4B), l'aiguille entrée dans un ganglion lymphatique cervical (Figure 4C) de pointe, et la position de l'aiguille lors de la biopsie (figure 4D). Close-up image montre la pointe de l'aiguille dans le bulbe du noeud lymphatique (figure 4E). Traitement des composants biopsie par cytospin révèle amas de cellules lymphoïdes abondantes et du tissu conjonctif associé, la vérification des ganglions lymphatiques succèsbiopsie (Figure 4F).
Analyse des images HFU base-informatique permet pour des informations détaillées au sujet d'obtenir l'architecture ganglionnaire, le volume et le flux vasculaire. Utilisation du mode Doppler puissance et les mesures de volume 3D, pour cent vascularisation (PV) peut être calculé à partir de la série d'image englobant nœuds entières (figure 5A). En outre, l'imagerie 3D permet une reconstruction de ganglion lymphatique virtuel, indiquant la topographie globale des ganglions lymphatiques (figure 5B).
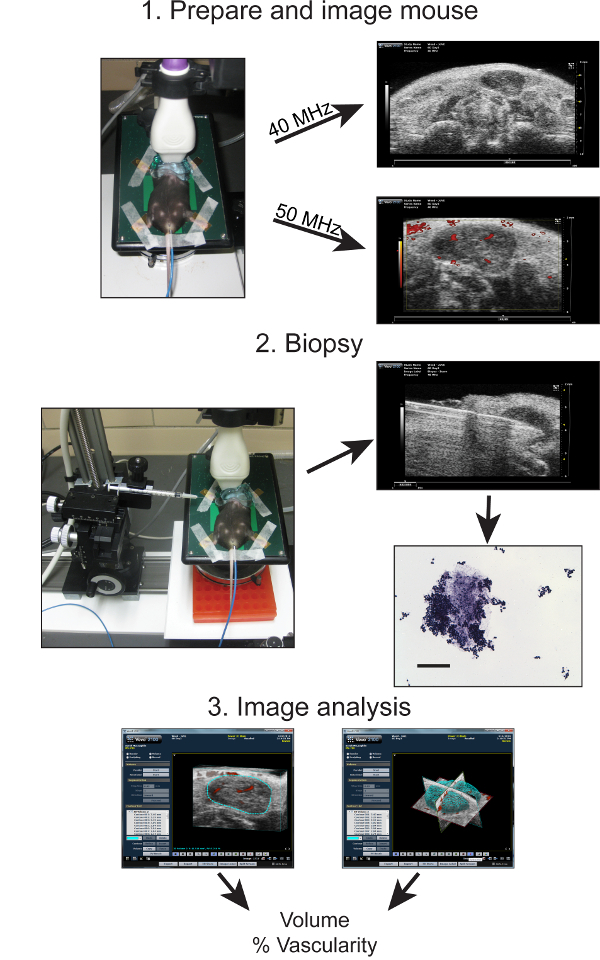
Figure 1:. Aperçu schématique des étapes impliquées dans HFU diagnostic ganglionnaire cervicale imagerie chez la souris Les étapes clés comprennent 1: Préparation de la souris pour l'imagerie de HFU et l'obtention de 40 et 50 images d'une résolution de MHz de la région du cou contenant les ganglions cervicaux trois souris . 2: aiguille fine guidée par l'image biopsie de ganglions cervicaux et analyse histologique ultérieure matériau de biopsie. 3: analyse d'image assistée par ordinateur et de la reconstruction d'images 3D de ganglions lymphatiques obtenus en mode B et Doppler pour déterminer le volume des ganglions lymphatiques et respective pour cent (%) de l'écoulement vasculaire.

Figure 2:. Aperçu de la haute résolution dans le système de micro-imagerie in vivo pour l'évaluation du col du ganglion lymphatique et la biopsie (A) Le système de HFU est représenté avec une souris anesthésiée préparé pour l'imagerie cervicale ganglionnaire. Il indique également le microinjecteur (MI) et le stade 3D-moteur (3D MS) équipement accessoire. (B) Gros plan sur une souris anesthésiée préparé pour l'imagerie HFU avec des cheveux enlevés dans la région du cou. (C) Le même souris avec le transducteur de 50 MHz en place sur le cou. Notez le gel de l'échographie supplémentaire utilisé pour faciliter le cou région imagerie.
718fig3.jpg "/>
Figure 3: HFU Représentant images de l'anatomie du col utérin en mode B et Doppler puissance. (A, B) images en mode B de la cavité buccale, montrant la cavité buccale (BC) et la langue (T) visualisée par imagerie plus proche de la cavité nasale. Les trois ganglions cervicaux trouvés sur chaque côté du cou (étiquetés M, mandibulaire; SM, sous-maxillaire; SP, parotide superficiel), apparaissent comme un groupe de structures hypoéchogènes dans un plan d'imagerie unique, comme illustré (B). (C) la glande thyroïde (Th) comme visualisé dans la région thoracique supérieure, apparaissant comme une structure solide en forme de papillon, échogène. (AC) ont été visualisés avec un transducteur de 40 MHz; barre d'échelle = 1 mm. (D, E) Des images représentatives de la normale (D) et dilatées (E) cervicales ganglions lymphatiques avec mode B et Doppler puissance (rouge). Pointillés décrivent ganglions lymphatiques individuels. Barre d'échelle = 0,5 mm.

Figure 4: col de l'utérus biopsie ganglionnaire set-up, l'imagerie et l'analyse cytospin du matériel de biopsie (A) La plate-forme d'imagerie montrant le micro-injecteur et placement de l'aiguille près du col de la souris.. Un porte-microtube large (bloc orange) est utilisé afin de soulever légèrement la plate-forme, permettant un placement à aiguille appropriée tout en laissant de l'espace pour la scène 3D-moteur. Cette disposition minimise le temps passé supprimant l'étape du moteur pour chaque souris. (B - D) Le total des images de HFU du cou prises à partir d'une vidéo d'une biopsie du ganglion lymphatique cervical en utilisant le transducteur de 50 MHz. (B) HFU image en mode B montre l'aiguille positionnée sur le côté de l'encolure avant biopsie. La pointe de l'aiguille est la structure hyperéchogène juste en dessous de la position du guide d'aiguille (ligne pointillée verte) superposée lors de l'imagerie pour désigner la trajectoire de l'aiguille. Le ganglion lymphatique est dans le centre del'image. Barre d'échelle = 1 mm. (C) l'entrée dans le ganglion lymphatique de l'aiguille. (D) La biopsie du ganglion lymphatique cervical. (E) de biopsie agrandie de ganglion lymphatique cervical. Barre d'échelle = 0,5 mm. Analyse (F) Cytospin de matière représentative biopsie ganglionnaire confirmant succès de la biopsie. Barre d'échelle = 100 um.

Figure 5:. L'analyse par ordinateur des images 3D ganglionnaires cervicales (A) capture d'écran représentant d'un ganglion lymphatique analysé à l'aide de logiciels informatiques. Le noeud est circonscrit en bleu; résultats de l'analyse montrent volume 3D et la vascularisation pour cent (PV) comme indiqué. (B) Une image de vue de face du même noeud après analyse 3D. Renders volume entier des ganglions lymphatiques à partir de mesures prises dans A.
Discussion
Le protocole décrit permet la visualisation et l'évaluation in situ des ganglions lymphatiques cervicaux murins à l'aide de l'imagerie non-invasive HFU dans. L'utilisation de mode B et Doppler puissance imagerie pour visualiser cervical morphologie des ganglions lymphatiques, du volume et du ganglion lymphatique flux sanguin prévoit une analyse expérimentale des systèmes précliniques de modèle de souris similaires à ceux utilisés pour la caractérisation des ganglions cervicaux de patients dans la pratique clinique. La capacité de surveiller les ganglions lymphatiques via cervial amende biopsie à l'aiguille fournit également une technique utile pour détecter des altérations des cellules immunitaires et de la présence de types de cellules étrangères ou des bactéries au cours de lymphadénopathies induite par des maladies de la cavité buccale chez les souris. La facilité d'utilisation et son faible coût associé à HFU permet la sélection rapide de col de l'utérus statut des ganglions lymphatiques dans une large variété de modèles animaux.
Une étape cruciale dans ce protocole est l'identification initiale réussie des ganglions cervicaux en images HFU. Notre établissement dispose d'un assortiment de HFU transducers que décrits, de sorte que nous les avons utilisés pour obtenir les images de haute qualité. Cependant, si les transducteurs ne sont pas disponibles, nous décrivons, il est possible d'adapter l'image à l'aide d'autres capteurs. A cet effet, le réglage de la profondeur et de la largeur de l'image pour obtenir une image adéquate est tout ce qui est nécessaire. Résolution de ces images peut varier, mais il devrait encore être possible d'obtenir des images de haute qualité en utilisant HFU. des sites d'intérêt pour l'image de la cavité buccale et de la glande thyroïde grandement contribuer à orienter l'utilisateur de la région appropriée où les ganglions lymphatiques sont localisés. La forme ovale, la nature et l'emplacement hypoéchogène caractéristique superficielle près de la surface de la peau permet de confirmation pour l'identification rapide des ganglions lymphatiques cervicaux approprié à l'intérieur de la région du cou. Bien que tous les trois noeuds peuvent être visibles dans un plan de formation d'image unique (figure 3B), typiquement une ou deux noeuds sont capturées au cours de l'imagerie. Des ajustements mineurs de la position du transducteur peuvent être menées à déchirerer imagerie différents plans visibles, permettant la visualisation de tous les noeuds sur un seul côté du cou.
Bien que nous ayons trouvé la technique décrite pour l'identification fiable des ganglions lymphatiques cervicaux, il existe des limitations spécifiques à la technique d'imagerie et la biopsie. Le caractère superficiel de souris ganglions lymphatiques du col confère une mobilité excessive quand même une légère pression est appliquée sur la peau par la tête de transducteur. On peut y remédier en appliquant lentement la tête de transducteur dans le gel à ultrasons sur le goulot de la souris jusqu'à ce que les images de repère sont identifiés. la mobilité des ganglions lymphatiques peut aussi compliquer la biopsie à l'aiguille fine, en particulier lors de l'utilisation des transducteurs dans la résolution plus élevée (50 MHz) de la plage. Centré images de ganglions lymphatiques pour biopsie sont généralement poussés hors du champ de vision due à la force de l'aiguille de biopsie nécessaire pour percer la peau sus-jacente et de la capsule. Cela peut être résolu par la position excentrée du ganglion lymphatique dans la direction de pénétration de l'aiguille,fournissant l'espace pour le ganglion lymphatique d'être poussé à travers mais toujours rester dans le champ de vision lors de la biopsie. Dans notre expérience, les ganglions lymphatiques> 10 mm 3 sont très difficiles à biopsie, et sont souvent poussés par l'aiguille plutôt que de pénétrer pendant aiguille avancement. Ainsi, une biopsie est préférable de réserver pour des ganglions lymphatiques où la taille est> 10 mm 3 pour assurer suffisamment de taille et la stabilité de la cible de noeud dans la région cervicale. En outre, le matériel de biopsie peut ne pas contenir le nombre de cellules suffisant pour les procédures où le nombre de cellules plus grandes sont nécessaires (par exemple, la cytométrie de flux).
HFU a été utilisé avec succès pour visualiser les tumeurs HNSCC orthotopique 25, et a le potentiel pour contrôler les métastases des ganglions col de l'utérus chez la souris avec des tumeurs 24 orales. En plus de l'échographie, l'imagerie par bioluminescence a également été utilisé pour visualiser la formation de tumeur orthotopique orale et cervical métastase des ganglions lymphatiques chez les souris vivantes 26,27. Comme une alternapproche ative, l'imagerie par bioluminescence a un net avantage sur HFU à être en mesure de quantifier directement la progression tumorale et la charge métastatique au fil du temps chez le même animal. Bien indéniablement utile, l'imagerie par bioluminescence est incapable de mesurer de nombreux paramètres visualisés par HFU, y compris les ganglions lymphatiques morphologie, volumes nodaux ou le débit sanguin. imagerie par bioluminescence nécessite également des boîtes noires spécialisées pour maintenir souris lors de l'imagerie, rendant cette technique impropre à l'adaptation pour bien biopsie à l'aiguille.
En outre, l'imagerie par bioluminescence nécessite la production de cellules tumorales qui expriment de façon stable l'enzyme luciférase, ce qui permet cette technique doit être utilisé que dans des cas de xénogreffes orthotopique avec des cellules tumorales luciférase transfecté chez des souris immunodéprimées, ou avec des systèmes inductibles spécifiques d'un tissu transgéniques qui limitent l'expression de la luciférase d'une manière spatio-temporelle spécifique au tissu d'origine de la tumeur. En revanche, HFU peut être used en conjonction avec des images de bioluminescence dans ces modèles, ainsi que d'être capable de l'imagerie des ganglions cervicaux dans des modèles de tumeurs buccales induite carcinogène chez la souris dont le système immunitaire complets 28,29. Alors que HFU peut être plus adaptable aux modèles plupart des murins de cancer de la bouche, les informations combinées qui peut être obtenu à partir de la bioluminescence et l'imagerie HFU dans les systèmes où les cellules tumorales expriment la luciférase peut fournir une image plus complète de l'implication des ganglions lymphatiques du col utérin que soit la modalité d'imagerie seul.
La capacité d'identifier et de détecter les ganglions lymphatiques cervicaux de souris en temps réel permet de cette technique pour être utilisé dans la plupart des modèles de la maladie bucco-dentaire qui se traduisent par une lymphadénopathie inflammatoire dans laquelle l'animal peut être maintenu dans une position inversée sous anesthésie à court terme. La détection des métastases des ganglions lymphatiques ou d'une infection bactérienne et l'impact concomitant sur la morphologie des ganglions lymphatiques chez les animaux vivants présente un avantage important par rapport aux méthodes traditionnellesqui exigent des ganglions lymphatiques à être enlevés d'animaux morts pour le traitement histologique. La combinaison HFU avec amende biopsie à l'aiguille permet à un moyen pour effectuer une analyse pathologique de routine des ganglions lymphatiques cervicaux, similaire à ce qui est réalisé dans la clinique, en fournissant un procédé amélioré pour la surveillance de la progression de la maladie dans la plupart des modèles de souris courantes de maladies de la cavité buccale.
Déclarations de divulgation
Les frais de publication de cet article sont parrainés par Visual Sonics.
Remerciements
Ce travail a été soutenu par le fonds de dotation Dorothy D. Radford de la West Virginia University Mary Babb Randolph Cancer Center. L'utilisation de la West Virginia University modèles animaux et Imaging Facility (AMIF) et des installations Microscopy Imaging (MIF) (soutenu par le P20 subventions RR16440 Mary Babb Randolph Cancer Center et le NIH, P30 RR032138 / GM103488 et S10 RR026378) est grandement apprécié.
matériels
| Name | Company | Catalog Number | Comments |
| Vevo2100 High Resolution Micro-ultrasound Imaging System, with integrated software Version 1.6.0 | VisualSonics, Toronto, Ontario, Canada | VS-11945 | |
| Power Dopper Mode and 3D Mode | VisualSonics, Toronto, Ontario, Canada | VS-11952; VS-11484 | |
| Vevo compact anesthesia system | VisualSonics, Toronto, Ontario, Canada | ||
| Vevo integrated rail system including 3D motor and micromanipulator for injections | VisualSonics, Toronto, Ontario, Canada | SA-11983 | |
| Thermasonic Gel Warmer | VisualSonics, Toronto, Ontario, Canada | Optional | |
| Transducers – MS-550D (Broadband frequency: 22 MHz - 55 MHz) | VisualSonics, Toronto, Ontario, Canada | VS-11960 | Referred to as 40 MHz Transducer |
| Transducers – MS-700 (Broadband frequency: 30 MHz - 70 MHz) | VisualSonics, Toronto, Ontario, Canada | VS-12026 | Referred to as 50 MHz Transducer |
| Ophthalmic Ointment | Patterson Veterinary | 07-888-1663 | |
| Electrode gel | Parker Laboratories | 174-1525 | |
| Tape | Medical Arts Press | 174-153000 | |
| Depilatory Cream | Carter Products | ||
| Cotton swabs | General Supply | ||
| Gauze | Fisher Scientific | 22-037-907 | |
| Water | General Supply | ||
| Lubricating gel | Parker Laboratories | 57-05 | |
| Ultrasound gel | Parker Laboratories | 01-50 | |
| Microcentrifuge tube rack | General Supply | Used to raise mouse platform for optimal biopsy position | |
| 27 G ½ inch needle with 1 ml syringe | Fisher Scientific | 14-826-87 | |
| ThinPrep PreservCyt Solution | Hologic | 70097-002 | Refered to as biopsy media |
| Microcentrifuge tubes | General Supply | ||
| Thinprep 2000 processor | Cytyc, Marlborough, MA | Blue Filter | |
| Olympus AX70 Provis Microscope | Olympus, Center Valley, PA |
Références
- Montone, K. T. Infectious diseases of the head and neck: a review. Am J Clin Pathol. 128 (1), 35-67 (2007).
- Bryson, T. C., Shah, G. V., Srinivasan, A., Mukherji, S. K. Cervical lymph node evaluation and diagnosis. Otolaryngol Clin North Am. 45 (6), 1363-1383 (2012).
- Joshi, P. S., Pol, J., Sudesh, A. S. Ultrasonography - A diagnostic modality for oral and maxillofacial diseases. Contemp Clin Dent. 5 (3), 345-351 (2014).
- Oz, F., et al. Evaluation of clinical and sonographic features in 55 children with tularemia. Vector Borne Zoonotic Dis. 14 (8), 571-575 (2014).
- Niedzielska, G., Kotowski, M., Niedzielski, A., Dybiec, E., Wieczorek, P. Cervical lymphadenopathy in children--incidence and diagnostic management. Int J Pediatr Otorhinolaryngol. 71 (1), 51-56 (2007).
- Ying, M., Bhatia, K. S., Lee, Y. P., Yuen, H. Y., Ahuja, A. T. Review of ultrasonography of malignant neck nodes: greyscale, Doppler, contrast enhancement and elastography. Cancer Imaging. 13 (4), 658-669 (2013).
- Stoeckli, S. J., et al. Initial staging of the neck in head and neck squamous cell carcinoma: a comparison of CT, PET/CT, and ultrasound-guided fine-needle aspiration cytology. Head Neck. 34 (4), 469-476 (2012).
- Rottey, S., et al. Evaluation of metastatic lymph nodes in head and neck cancer: a comparative study between palpation, ultrasonography, ultrasound-guided fine needle aspiration cytology and computed tomography. Acta Clin Belg. 61 (5), 236-241 (2006).
- Greco, A., et al. Ultrasound biomicroscopy in small animal research: applications in molecular and preclinical imaging. J Biomed Biotechnol. 2012, (2012).
- Chen, J. J., Fu, S. Y., Chiang, C. S., Hong, J. H., Yeh, C. K. Characterization of tumor vasculature distributions in central and peripheral regions based on Doppler ultrasound. Med Phys. 39 (12), 7490-7498 (2012).
- El Kaffas, A., Giles, A., Czarnota, G. J. Dose-dependent response of tumor vasculature to radiation therapy in combination with Sunitinib depicted by three- dimensional high-frequency power Doppler ultrasound. Angiogenesis. 16 (2), 443-454 (2013).
- Bachawal, V. S. Earlier detection of breast cancer with ultrasound molecular imaging in a transgenic mouse model. Cancer Res. 73 (6), 1689-1698 (2013).
- Loveless, M. E., et al. A method for assessing the microvasculature in a murine tumor model using contrast-enhanced ultrasonography. J Ultrasound Med. 27, 12-1699 (2008).
- Snyder, C. S., et al. Complementarity of ultrasound and fluorescence imaging in an orthotopic mouse model of pancreatic cancer. BMC Cancer. 9, 106 (2009).
- Kodama, T., et al. Volumetric and angiogenic evaluation of antitumor effects with acoustic liposome and high-frequency ultrasound. Cancer Res. 71 (22), 6957-6964 (2011).
- Hwang, M., Hariri, G., Lyshchik, A., Hallahan, D. E., Fleischer, A. C. Correlation of quantified contrast-enhanced sonography with in vivo tumor response. J Ultrasound Med. 29 (4), 597-607 (2010).
- Li, L., Mori, S., Sakamoto, M., Takahashi, S., Kodama, T. Mouse model of lymph node metastasis via afferent lymphatic vessels for development of imaging modalities. PLoS One. 8 (2), e55797 (2013).
- Springer, D. A., et al. Investigation and identification of etiologies involved in the development of acquired hydronephrosis in aged laboratory mice with the use of high-frequency ultrasound imaging. Pathobiol Aging Age Relat Dis. 4, (2014).
- Papadopoulos, G., et al. A Mouse Model for Pathogen-induced Chronic Inflammation at Local and Systemic Sites. J Vis Exp. (90), (2014).
- Vulcano, A. B., et al. Oral infection with enteropathogenic Escherichia coli triggers immune response and intestinal histological alterations in mice selected for their minimal acute inflammatory responses. Microbiol Immunol. 58 (6), 352-359 (2014).
- Myers, J. N., Holsinger, F. C., Jasser, S. A., Bekele, B. N., Fidler, I. J. An orthotopic nude mouse model of oral tongue squamous cell carcinoma. Clin Cancer Res. 8 (1), 293-298 (2002).
- Kanojia, D., Vaidya, M. M. 4-nitroquinoline-1-oxide induced experimental oral carcinogenesis. Oral Oncol. 42 (7), 655-667 (2006).
- Van den Broeck, W., Derore, A., Simoens, P. Anatomy and nomenclature of murine lymph nodes: Descriptive study and nomenclatory standardization in BALB/cAnNCrl mice. J Immunol Methods. 312 (1-2), 12-29 (2006).
- Walk, E. L., McLaughlin, S., Coad, J., Weed, S. A. Use of high frequency ultrasound to monitor cervical lymph node alterations in mice. PLoS One. 9 (6), e100185 (2014).
- Pezold, J. C., Zinn, K., Talbert, M. A., Desmond, R., Rosenthal, E. L. Validation of ultrasonography to evaluate murine orthotopic oral cavity tumors. ORL J Otorhinolaryngol Relat Spec. 68 (3), 159-163 (2006).
- Sano, D., Myers, J. N. Metastasis of squamous cell carcinoma of the oral tongue. Cancer Metastasis Rev. 26 (3-4), 645-662 (2007).
- Sano, D., et al. The effect of combination anti-endothelial growth factor receptor and anti-vascular endothelial growth factor receptor 2 targeted therapy on lymph node metastasis: a study in an orthotopic nude mouse model of squamous cell carcinoma of the oral tongue. Arch Otolaryngol Head Neck Surg. 135 (4), 411-420 (2009).
- Tang, X. H., Knudsen, B., Bemis, D., Tickoo, S., Gudas, L. J. Oral cavity and esophageal carcinogenesis modeled in carcinogen-treated mice. Clin Cancer Res. 10 (1 Pt 1), 301-313 (2004).
- Vitale-Cross, L., et al. Chemical carcinogenesis models for evaluating molecular- targeted prevention and treatment of oral cancer. Cancer Prev Res (Phila). 2, 419-422 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon