Method Article
La detección de alto rendimiento de los patógenos respiratorios de especímenes animales por PCR nanoescala
En este artículo
Resumen
pruebas de alto rendimiento de ADN y ARN patógenos basados por nanoescala PCR se describe el uso de un canino sindrómica y el panel de PCR respiratoria equina.
Resumen
En tiempo real a escala de nanolitros PCR utiliza multiplexado espacial para permitir que varios ensayos que se ejecutan en paralelo en una sola placa sin los inconvenientes típicos de la combinación de reacciones juntos. Hemos diseñado y evaluado un panel basado en este principio para identificar rápidamente la presencia de agentes patógenos comunes en perros y caballos con enfermedad respiratoria aguda. Este manuscrito describe un flujo de trabajo de PCR de diagnóstico a escala nanométrica para la preparación de muestras, amplificación y análisis de secuencias de patógenos objetivo, centrándose en los procedimientos que son diferentes de reacciones escala microlitro. En el panel respiratorio presentado, 18 ensayos se establecieron cada uno por triplicado, con capacidad para 48 muestras por placa. Una extracción y pre-amplificación de flujo de trabajo universal, se ha optimizado para la preparación de muestras de alto rendimiento para acomodar múltiples matrices y patógenos basados en ADN y ARN. Los datos representativos se presentan para una diana de ARN (influenza A matriz) y una diana de ADN (virus del herpes equino1). La capacidad de probar con rapidez y precisión para un grupo amplio, basado en el síndrome de patógenos es una herramienta valiosa para mejorar la eficiencia y la ergonomía de las pruebas de diagnóstico y para el diagnóstico de la enfermedad respiratoria aguda y la gestión.
Introducción
Con la demanda para la detección rápida y completa de múltiples agentes en el diagnóstico clínico para humanos y animales, métodos de diagnóstico molecular de un solo organismo para la detección de patógenos son difíciles de cumplir si no se utiliza un gran número de muestras que se está probando para una sola enfermedad. En el contexto veterinario, metodologías de diagnóstico de alto rendimiento son particularmente importantes debido a la necesidad adicional para cubrir los patógenos de una amplia variedad de especies. OneHealth enfoques para la gestión de las enfermedades transmitidas por los alimentos y la vigilancia de los patógenos emergentes son ejemplos de necesidades de pruebas que incluyen una serie de bacterias, virus (ADN o ARN basadas), parásitos y hongos. El desafío de la combinación de ensayos para múltiples analitos juntos (multiplexación) con el fin de mejorar la eficiencia de la prueba es una posible pérdida de sensibilidad y una gran carga para la optimización y validación de ensayos.
reacción en cadena de la polimerasa en tiempo real a escala de nanolitros (PCR) es un alternativo a la práctica de multiplexación que permite que muchas reacciones separadas puedan funcionar simultáneamente en la misma muestra 1. La plataforma OpenArray es una aplicación de este principio 2; que combina la tecnología de microarrays con PCR en tiempo real. Basado en el concepto de multiplexación espacial, cada muestra se analiza para un gran número de objetivos en separada agujeros pasantes. Esta plataforma se utilizó inicialmente con la unión de ADN de doble cadena a base de cianina química 2 y ahora está disponible para la química basada en sondas utilizando sondas de enfriamiento 3 oscuras. Esta plataforma ha sido utilizada principalmente para la caracterización genética en los seres humanos y los animales 4 5. Recientemente se ha adaptado para detectar ADN y ARN patógenos de la sangre por Grigorenko et al. 6 mediante un procedimiento de dos etapas de transcripción inversa / pre-amplificación (preamplificador).
Se describe aquí un procedimiento basado en preamplificador de un solo paso para la detección de ambos tipos de agentes patógenos en sec respiratoriaretions y una variedad de otros tipos de muestras que se pueden realizar en su totalidad en un día de trabajo normal. Al finalizar el preamplificador de una sola etapa, las muestras se transfirieron a una placa de 384 pocillos, que es el formato aceptado por el sistema de manejo de líquidos automatizado que viene con este nanoescala plataforma PCR. El sistema señala a la mezcla maestra y de la muestra a través de la superficie de hasta 4 placas (192 muestras y controles) a la vez. Después de este proceso de carga, se describe cómo se amplifican muestras y se analizaron usando una hoja de cálculo macro que resume el promedio de 3 repeticiones técnica para cada combinación de muestra / diana en una tabla que quepa en una página impresa.
Se estableció un método uniforme para el análisis de ADN y / o ARN extraído de muestras usando esta plataforma. Se extrajeron Una amplia variedad de muestras, transcribe inversa, y pre-amplificado en un formato de 96 pocillos, lo que minimiza la posibilidad de errores. muestras respiratorias analizadas incluyeron muestras nasales, faríngeas profundas hisopos,lavados trans-traqueales, lavado broncoalveolar, y el tejido pulmonar. Dado que algunos de los agentes probados también pueden estar presentes en la sangre periférica o las heces, incorporamos estos tipos de muestras en el procedimiento. Este flujo de trabajo optimizado ayuda a ahorrar tiempo y recursos en comparación con llevar a cabo experimentos en múltiples placas, permitiendo la prueba eficiente a través de patógenos y toxinas detección de genes basados en panel en su lugar de pruebas individuales. El panel respiratoria ha demostrado aquí tenía 18 ensayos cada impresos por triplicado orificios pasantes, con capacidad para 48 muestras por placa. Los patógenos equinos detectados incluyen adenovirus equino 1 y 2, virus de la arteritis equina, virus de la rinitis equina A y B, virus del herpes equino (EHV) tipos 1 y 4, y Streptococcus equi. Los patógenos caninos incluyen coronavirus canino respiratoria (betacoronavirus), el virus del moquillo canino, adenovirus canino, virus de la parainfluenza canina, pneumovirus canino, Bordetella bronchiseptica y Mycoplasma Cynos. UNla gripe universal, también se incluyó un ensayo y un control interno (MS2 ARN del fago).
Protocolo
Ninguno de los sujetos humanos o animales experimentales se utilizaron para el desarrollo de este protocolo. Los controles fueron generados por la purificación de los amplicones confirmó la secuencia y la transcripción in vitro de dianas de ARN. Las muestras clínicas que se sometieron a pruebas de diagnóstico de rutina para el Centro de Diagnóstico en Salud Animal de Cornell.
1. Diseño de la placa
- Utilice el software de diseño de cebadores para verificar que cada ensayo se ajusta al tiempo real las condiciones del ciclo de PCR basados en sondas estándar con 60 ° C recocido utilizando el instrumento de medida de la sonda de imprimación (seleccionar la sonda de cuantificación de ajuste con los parámetros por defecto).
NOTA: El objetivo de ARN representativo utilizado fue adaptado de la gripe universal de un ensayo de matriz dirigida publicada por Shu et al 7.. Los cebadores y la sonda son los siguientes: Cebador directo: GACCRATCCTGTCACCTCTGAC, cebador inverso: AGGGCATTYTGGACAAAKCGTCTA, Sonda: FAM-TGCAGTCCTCGCTCACTGGGCACG-QSY. El ensayo de ADN representativo utilizado aquí fue adaptada lado a otrom el método de detección de virus del herpes equino de tipo 1 (EHV-1) publicado por Elia et al. 8. Los cebadores y la sonda son los siguientes: Cebador directo: GCTCTCAGGTTTTACGACATC, cebador inverso: CTTTACCCAGGCCCTTGAAA, Sonda: FAM-TCAACGTGGACAATACCGCAGTGATTAT-QSY. - Pide placas a nanoescala de amplificación de PCR en la configuración deseada.
NOTA: Para este estudio, se utiliza el formato de la expresión de genes 18x3 (Tabla 1). Proporcionar secuencias para todos los cebadores y sondas (o ID de ensayo inventariados) para cada objetivo para el fabricante.
2. Extracción de ácido nucleico
- Extracto de ácido nucleico total (ADN y ARN) por cualquier método deseado.
NOTA: Un kit de extracción basado en perlas magnéticas automatizado se utiliza aquí de acuerdo con las instrucciones del fabricante (ver la tabla de materiales para más detalles). - Preparar muestras como sigue:
- Limpiar el exterior de cada envase de la muestra con un 10% de lejía y seque completamente. F limpie con guantesconsejos Inger con 10% de lejía entre muestras para evitar la contaminación cruzada.
- Lugar nasal o hisopos faríngeos profundos en cualquier vial estéril sellado (como un tubo de recogida de sangre tapa roja) con varias gotas de solución salina añaden a prevenir la desecación antes de su elaboración.
NOTA: algodón, plástico, con empuñadura de madera, y Dacron y otros hisopos sintéticos son aceptables, pero evitan hisopos de alginato de calcio. - Para hisopos y lavados traqueales, añadir medio Eagle modificado de Dulbecco (DMEM), de modo que hay al menos 1 a 2 ml de líquido. Agite la torunda y DMEM con fuerza en el tubo. A continuación, utilizar una pipeta para transferir aproximadamente 1 ml de medio a un nuevo tubo.
- tejidos mecánicamente lisan (100-200 mg en 1 ml de DMEM) utilizando un disruptor de tejido de acuerdo con las instrucciones del fabricante, seguido por centrifugación durante 3 min a 825 x g. Transferir 500 l del sobrenadante a un nuevo tubo.
- Para las heces, se combinan 400 mg de heces con 800 l de 1x sa tamponada con fosfatolínea de pH 7,4 (PBS). Vórtex con la suspensión durante 1 min o más hasta que la muestra se homogeneiza o completamente suspendida. Una vez homogeneizada, centrifugar la suspensión durante 10 min a 18.000 xg, a continuación, transferir 400 l a un tubo nuevo.
- Para la sangre sin coagular todo, vórtice de la muestra y tomar una alícuota de 250 microlitros. Agregue seis gotas de reactivo lítico y agitar para mezclar. Incubar 15 minutos a 37 ° C.
- Preparar de lisis y de lavado tampones de acuerdo con las instrucciones del fabricante. Añadir fago MS2 o un control interno de elección para el tampón de lisis como control positivo interno de extracción 9.
- Añadir 235 l de tampón de lisis y 175 l de muestra (o PBS para el control negativo) a cada tubo de talón. Proceder con el protocolo del fabricante.
NOTA: Se purificó el ácido nucleico total se eluyó aquí en 90 l.
3.-transcripción inversa / Pre-amplificación (preamplificador)
NOTA: Mantenga todos los reactivos y muestras utilizadas enla reacción de preamplificación en hielo en todo momento. Después de preamplificador, mantenga todos los reactivos a temperatura ambiente.
- Montar ADN eluido y / o ARN, mezcla de reacción de PCR, agua libre de nucleasa como un control negativo, y las normas agrupados para control de amplificación positivo.
NOTA: Hasta 48 muestras se puede ejecutar en una placa de amplificación incluidos los controles (incluya al menos un control negativo para la extracción de cada placa de extracción de muestras, que han de ser tirado). - Imprimir un mapa de la muestra. Tener una segunda comprobación persona que el mapa y la muestra coincida con el diseño.
- En un tubo de 1,5 ml, añadir lo siguiente al preparar la mezcla maestra preamplificador.
NOTA: Se utilizó un volumen final de 14 l aquí.- Añadir un grupo de cebadores premezclados de cada diana de modo que la concentración final de cada cebador es 900 nM.
NOTA: La piscina se utiliza aquí se preparó a una concentración 10 veces, y 1,4 l añadió por reacción. - Añadir cebadores aleatorios a una concentración final de 600 nM o 0,1x.
- Añadir 2x mezcla RT-qPCR a la mitad del volumen final (7 l aquí).
- Mezclar los componentes de la mezcla maestra en conjunto por agitación y girando suavemente hacia abajo.
- Añadir un grupo de cebadores premezclados de cada diana de modo que la concentración final de cada cebador es 900 nM.
- Realizar el preamplificador en una placa de 96 pocillos estándar utilizando el lado izquierdo de la placa sólo (columnas 1-6).
- Añadir 8,5 l de preamplificador mezcla maestra y 5,5 l de muestra de ADN / ARN a cada pocillo.
- Después de combinar todos los reactivos (muestras, controles positivos y controles negativos con la mezcla de preamplificador), sellar completamente la placa de 96 pocillos estándar con un sello adhesivo transparente. Eliminar cualquier exceso de sello usando una hoja de afeitar para prevenir la formación de ranuras de obturación durante el ciclismo. Se centrifuga la placa de sellado durante 20 segundos utilizando una placa de PCR spinner. Compruebe que todos los reactivos se combinan en la parte inferior de los pocillos de la placa.
- Ejecutar el ensayo de preamplificador en un termociclador convencional bajo las condiciones siguientes: 15 min a 50 ° C; 1 min a 95 ° C; 20 ciclos de 15 segundos a 95 ° C, a continuación, 2 min a 60 ° C; 99.9 & #176; C durante 10 min; mantener a 4 ° C. Programa de estas condiciones antes de comenzar.
- Encender el termociclador convencional, seleccione el programa de ciclismo preamplificador e iniciar el programa. Coloque la placa de 96 pocillos en el termociclador sólo cuando la parte inferior de la termociclador (no cubierta) alcanza la temperatura requerida para la producción de cDNA (50 ° C) mediante el control de la lectura de temperatura en la pantalla. Antes de esto, mantener el frío placa para reducir al mínimo el riesgo de producir falsos resultados positivos.
- Una vez que el plazo preamplificador es completa, verificar que la placa ha permanecido sellado.
- Proceder de inmediato al paso 4.1. Para almacenar esta placa durante la noche, realizar la dilución, según se describe en los pasos 4.2 a 4.5, excepto que en lugar de cubrir holgadamente la placa, sellar la placa con un sello adhesivo transparente y colocar en una bolsa con cierre de cremallera de bloqueo, se almacena a 4 ° C.
4. La dilución del preamplificador Plate
- Retire el número apropiado de placas de amplificación de aquí para allám el congelador (hasta 4 pueden funcionar a la vez). No abra el envase. Dejar que la placa se caliente durante al menos 15 minutos a temperatura ambiente. Registrar el número y el lote número de serie de la placa.
NOTA: placas sin abrir puede permanecer a temperatura ambiente durante un máximo de 24 horas, pero para mejores prácticas, eliminar estos del congelador no más de 30 minutos antes de que sea necesario. - Se centrifuga la placa preamplificador completado durante 20 segundos utilizando la placa de ruleta PCR. Encienda la máquina de amplificación y el ordenador e iniciar el programa asociado.
- Eliminar todos los elementos innecesarios de un área de configuración de PCR. Póngase los guantes dobles y las cubiertas de la manga.
- Retire el sello de la placa de preamplificador y cuidadosamente retirar y desechar los guantes exteriores. Diluir los productos de preamplificación en 1: 5 mediante la adición de 56 l de tampón TE a cada pocillo de las columnas 1-6 de la placa de preamplificador 96 pocillos y se mezcla pipeteando arriba y abajo. Ir sólo a la primera parada de la pipeta, la aspiración de la parte inferior y la dispensación de más arriba, pero no la creaciónburbujas. Añadir tampón TE a los 6 columnas independientemente de los pocillos no utilizados.
- Volver a sellar la placa, ya sea con un adhesivo transparente o sello de aluminio, y se centrifuga durante 20 segundos utilizando la placa de ruleta PCR. Ajuste este plato a un lado (forrados) hasta el paso 6.1 se ha completado. Desechar restantes guantes y protectores de la manga.
5. Preparación para la transferencia de 384 pocillos en la placa de amplificación
- Configurar los materiales necesarios para cubrir y sellar la placa de amplificación: tapa, enchufe, jeringas de líquido de inmersión, placa de prensa, una botella de etanol chorro, y toallitas de laboratorio sin pelusa. Retire la tapa de la jeringa y bloquear una punta de plástico pequeño en la jeringa (requiere la fuerza). Expulsar una pequeña cantidad de fluido de inmersión sobre una toalla de papel para eliminar la acumulación de aire (es aceptable si algunas pequeñas burbujas de aire en la punta). Utilizar el líquido de inmersión de 60 minutos de retirar la jeringa de la bolsa de aluminio sellada al vacío. Una vez que se abre una jeringa, no vuelva a colocar la tapa para su uso posterior.
- Comprobarque el cubo de la basura del controlador de carga de líquido plato está vacío y abrir el cuadro de consejos. Escribe la fecha de caducidad de las extremidades en la tapa de la caja de punta cuando se abre una nueva caja, y asegurar que las puntas no se cumplan. Encienda el manipulador de líquidos y el ordenador y abrir el software manejador de líquidos, que llevará a cabo una autocomprobación.
- Haga clic en "Configuración y carga". Haga clic en "Examinar" para seleccionar el archivo csv creado desde el software del perseguidor de la muestra. Si no se muestra el archivo, vaya a "Instrumento / Editar Preferencias" y luego haga clic en "Cambiar" por "la carpeta de archivos placa de muestras". Seleccione la carpeta donde se guarda el archivo csv. A continuación, haga clic en "Configuración y carga", luego en "Examinar" y seleccione el archivo.
- A continuación, haga clic en "Examinar" junto a la "placa de soporte Posición 1" y seleccione el archivo TPF (proporcionado por el fabricante) que tiene el mismo número de la placa.
6. Transferencia Liquid Handler
Nota: No inicie fillenando la placa de 384 pocillos hasta que todos los pasos anteriores se han completado. La evaporación es una preocupación con pequeños volúmenes - no deje que la placa de 384 pocillos sentarse al descubierto con líquido en su interior.
- Una vez que todos los pasos anteriores se han completado poner en nuevos, guantes dobles queden bien, y el manguito cubre. A continuación, añadir 2,5 l de mezcla maestra de amplificación a una placa de 384 pocillos.
- Transferir 2,5 l de producto preamplificador diluido a la placa de 384 pocillos de acuerdo con el mapa en la Tabla 2 y cubrir inmediatamente la placa firmemente con un sello de aluminio. Deseche los guantes exteriores y cubiertas de la manga.
- Se centrifuga la placa de 384 pocillos durante 20 s en el plato giratorio PCR.
- No retire el sello de aluminio, pero se coloca la placa de 384 pocillos en el manipulador de líquidos.
- Abrir el paquete que contiene una placa de amplificación encajonado y colocarlo cuidadosamente en el manipulador de líquidos en la primera ranura con el número de serie de la derecha - mantenga el caso por los bordes sin tocar la superficie of la placa. Utilice placas tiene una hora después de la apertura.
Nota: El propósito del caso es proteger la placa de ser tocado, ya que esto podría molestar a las pequeñas cantidades de cebadores y sondas en el interior de los agujeros pasantes. - Retire el sello de aluminio de la placa de 384 pocillos dentro del manejador de líquidos una vez que todo está en su lugar. Haga clic en Siguiente y luego se les presentarán todas las cajas que se completa cada paso. Haga clic en OK para iniciar la carrera.
- Cierre la puerta del manipulador de líquidos e iniciar inmediatamente el proceso de llenado. Manténgase al lado del manipulador de líquidos e inmediatamente proceder al siguiente paso una vez que se llena el plato.
- Mientras que el manipulador de líquidos está en funcionamiento, retire la película protectora de la parte inferior de la tapa de la caja.
NOTA: El adhesivo en la parte inferior de la tapa de la caja está cubierta por una cinta de color rojo y una película protectora. La película debe ser eliminado primero en acceder a la cinta roja.- Deja la película superior en su lugar hasta el paso 6.15. Primer de la cinta de color rojo tirando ligeramente hacia release desde el adhesivo.
- Retire la placa de amplificación cargado (lleno) del manipulador de líquidos y suavemente colocarlo en la prensa placa con el número de serie de la derecha.
- Coloque la tapa en la parte superior de la placa con el extremo con muescas a la derecha y el adhesivo en la parte inferior (que señala hacia la placa).
- Tire hacia abajo la palanca de prensa placa de cierre con cuidado; la luz parpadea durante 20 segundos. No toque la placa de prensa durante este tiempo. Una vez que la luz cambie a verde sólido, levante la palanca con cuidado y retirar con cuidado la placa de sellado sujetándola por los bordes.
- Mientras sostiene la placa de amplificación sellado verticalmente por los bordes de la caja, insertar inmediatamente la punta de la jeringa en el puerto de carga en el extremo de la caja, a continuación dispensar el fluido de inmersión lentamente en un movimiento continuo suave para llenar el espacio entre la placa y la tapa. Dejar una pequeña burbuja de aire en la esquina una vez que se sumerge la placa.
- Mientras continúa hvieja la placa verticalmente por los bordes, sellar la abertura de carga mediante la inserción de la clavija en el puerto y girando el tapón en sentido horario, la aplicación de una presión suficiente hasta que el mango se interrumpe. Agarre los bordes de la caja firmemente para que la fuerza de rotura del mango no causa el caso de la gota. Si se deja caer un plato, desprenderse de ella.
- Limpiar la caja con un paño que no suelte pelusa se ha pulverizado a fondo con etanol. Para secar el caso, limpie la caja hacia abajo con un trapo limpio. manejar con cuidado el caso; asegúrese de no aplicar presión sobre el vidrio por encima de los pozos.
- Llevar la placa de sellado a la máquina de amplificación. En la pestaña "Instrumento", seleccione "consola de instrumentos." Seleccione la máquina de amplificación a continuación, haga clic en el botón de "puertas abiertas".
- Coloque la placa de amplificación en la primera ranura del adaptador de la placa, la comprobación de que el adaptador está correctamente alineada con la A1 en la esquina superior izquierda. Orientar la placa con el código de barras hacia arriba y haciala parte frontal del instrumento. Haga clic en el botón "Cerrar la puerta". Observe el uso de la bandeja de adaptador - hay un límite de 10 usos.
- En la pestaña Inicio en la parte inferior de la pantalla, en el menú Ejecutar, seleccione OpenArray. Haga clic en "Obtener ID de la placa." Las cajas vacías se rellenan automáticamente con la información sobre la placa. Para comenzar la carrera, haga clic en "Inicio Ejecutar".
- Cierre el software manejador de líquidos y apagar el manipulador de líquidos. Coloque la cubierta de punta sobre el estante de punta. Desechar la punta del cubo de la basura y limpiarlo. Limpiar y descontaminar todos los artículos, incluyendo la superficie de trabajo, pipetas, cubo de residuos, y las cajas de puntas.
- Volver a sellar la placa de preamplificador con un sello adhesivo transparente y se almacena a -20 ° C.
Análisis 7. Resultado
- Una vez que la carrera ha terminado, guarde el archivo y haga clic en la "X" en la pestaña con el nombre de ejecución en la parte inferior de la pantalla para cerrar el archivo.
- Haga clic en "Open Door"En la parte superior de la pantalla para abrir la puerta. Retire la placa de amplificación, comprobando que ningún fluido de inmersión se ha filtrado. Haga clic en" Cerrar la puerta "en la parte superior de la pantalla para cerrar la puerta.
- Haga clic en "Open" y selecciona el archivo de ejecución para abrirla. Pulse el botón verde Analizar en la parte superior derecha de la pantalla. Haga clic en "Exportar" en el lado izquierdo de la pantalla y luego "Inicio Exportar" para exportar los resultados (como un archivo .txt). Minimizar el archivo después de que se abre. A continuación, haga clic en "Exportar imágenes de control de calidad."
- Revisar las imágenes de control de calidad en el programa de análisis de imagen de acuerdo con los siguientes criterios:
- Evaluar la calidad de la carga con PRE-READ_CHANNEL_4.tiff y POST-READ_CHANNEL_4.tiff, comprobando que no hay manchas oscuras o manchas.
NOTA: Un colorante detectado por este canal se añade por el fabricante a los cebadores y sondas, que se libera en la solución cuando se carga la reacción. La lectura en este canal indica que las reacciones eran correctamentecargan y que los cebadores y la sonda se mezclaron con colorante estaban presentes. - Compruebe si hay fugas o agitación a la placa después de la carga utilizando S02_C001_t03_p001_m1_x2_e1_cp # _spotfind.tiff. Si la imagen se ve oscura, aumentar el brillo (pulse Ctrl + Shift + C para abrir los controles) hasta que la placa entera es visible. Compruebe que la imagen se ve uniforme sin sombras, burbujas, o muestras desplazadas.
- Evaluar la colocación de la tapa y residuos debajo de la tapa (puntos brillantes) usando STAGE2_CYCLE1_CHANNEL_1.tiff y STAGE2_CYCLE40_CHANNEL_1.tiff.
- Evaluar la calidad de la carga con PRE-READ_CHANNEL_4.tiff y POST-READ_CHANNEL_4.tiff, comprobando que no hay manchas oscuras o manchas.
- Opcional: Abra una hoja de cálculo que contiene los resultados Macro (archivo de código suplementario). En el archivo de datos exportado, haga clic en la pestaña en la parte inferior de la pantalla y seleccionar "Mover o copiar". En el campo "de reserva", seleccione "Resultados Macro.xlsm". Haga clic en "Ir al final" y marca la casilla "Crear copia". A continuación, pulse Aceptar.
- Si la opción Resultados de macro no aparece en el campo "de reserva", simcapa de copiar el contenido de la hoja de archivo de datos exportados (haga clic en la celda superior izquierda para resaltar todas las células y Ctrl-C) y pegarlo en una nueva pestaña.
- Eliminar la pestaña de edad "Exportar" y luego cambiar el nombre de la pestaña recién agregado como "Exportar".
- Haga clic en "Alt-F8" (o haga clic en Ver y luego macros) a continuación, seleccione "Macro" y haga clic en "Ejecutar". A continuación, repetir esta operación para Macro2 haciendo clic en "Alt-F8" y luego seleccionar "Macro2" y haciendo clic en "Ejecutar".
- Cambie el nombre del archivo de resultados macro utilizando la información relevante (fecha y número de serie), poner esta información por encima de la mesa, y guardar como el mismo nombre de archivo en la carpeta Resultados exportado. Por último, imprima la tabla de resultados generados macro.
- En el software de la máquina de amplificación, comprobar las curvas para cada muestra y control contra la mesa macro seleccionando Análisis / Amplificación Parcela en el lado izquierdo de la pantalla. A continuación, seleccione la pestaña de la muestra, y haga clic en cada muestra paraconfirman que hay 2 o 3 curvas de amplificación positivas para cada uno de los resultados positivos en la tabla.
- Apagar la máquina de amplificación.
Resultados
Los resultados se muestran en las figuras 1 y 2 para un ensayo representativo de ARN (matriz de influenza) y ensayo de ADN (EHV-1) con una combinación de controles positivos y muestras clínicas presentadas para las pruebas de diagnóstico de rutina. Las señales de fluorescencia emitida a lo largo de esta reacción típicas se muestran en la Figura 1, que representa gráficamente los valores de fluorescencia primas por ciclo. Todos los valores de ciclo umbral (Ct) relativa fueron generados automáticamente por el software de la máquina de amplificación. La fluorescencia de fondo se utiliza como un indicador separado para la evaluación de la calidad de carga en lugar de incorporarlo en las lecturas de fluorescencia antes de calcular los valores de Ct.
El límite analítico de detección (LOD) para cada objetivo se calcula en base a la media general de los valores de Ct en el nivel de detección del 95%, más 2 desviaciones estándar en una piscina de controles paratodos los objetivos. La dilución más alta que al menos 95% de las réplicas fueron positivos para los ensayos representativos fue de 50 copias; detección de 5 copias fue exitosa en 50% de repeticiones. Ni ensayo se detectó a continuación una copia. Los límites de detección para el ensayo de ARN y ADN se calcularon en los valores de Ct de 21.92 y 20.05. Estos valores se consideraron los puntos de corte para los valores de informes positivos vs. sospechoso (potencialmente no repetible).
Otros aspectos del rendimiento analítico de los objetivos se evaluó utilizando diluciones seriadas de controles positivos agrupados ejecutan en tres días diferentes (Figura 2). Las eficiencias promedio de los ensayos de ARN y ADN representativas fueron 101,1% y 106,6%; la eficiencia media global para todos los objetivos fue 101,3%. Los ensayos también tuvieron una buena linealidad (R 2> 0,98). La variación dentro de la replicación a través de los orificios pasantes normalmente estaba dentro de desviaciones estándar de 0,2 para ambas muestras clínicas unacontroles d. No se observó reactividad cruzada entre cualquiera de los objetivos.
Los resultados finales de hoja de cálculo en el archivo suplementario muestra resultados cuantitativos representativos de 10 muestras de diagnóstico clínico y 4 controles. Las muestras clínicas son un subconjunto de los tipos de muestras de exámenes de rutina incluyendo hisopos nasales / orofaríngeos, tejido pulmonar, y las muestras fecales. Un (equino) muestra fecal en este conjunto muestra un control interno MS2 fallido, lo que indica la presencia de inhibidores en la muestra. Normalmente, esto se consiguió por dilución de la muestra eluida y / o re-extracción. Como es el caso aquí, el control de amplificación negativo debe ser negativo para todos los destinos, y el control negativo de extracción debe contener solamente el control interno. En el conjunto clínico, las muestras producidas valores de Ct para betacoronavirus, Bordetella bronchiseptica, virus del moquillo canino A, virus de la parainfluenza canina, pneumovirus canina, y la influenzaA.
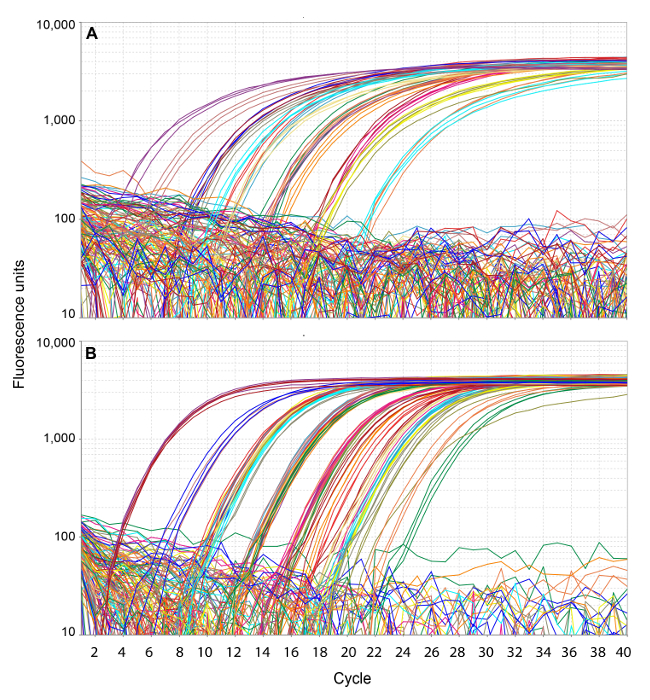
Figura 1. gráficas de amplificación. Las lecturas de fluorescencia se representan frente a ciclos de amplificación para el ensayo de ARN (A) y ensayo de ADN (B). Los triángulos se muestran denotando valores de Ct. Por favor, haga clic aquí para ver una versión más grande de esta figura.
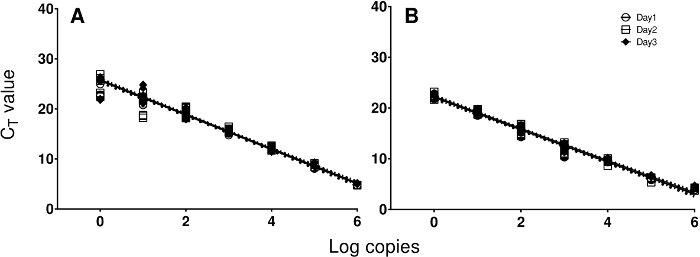
Figura 2. Las curvas de calibración. Las curvas de calibración del ensayo de ARN y ADN probado en tres días diferentes se representan con el fin de demostrar la linealidad y rango de amplificación usando los controles positivos. Ciclo umbral valores (Ct) se representan frente a log (10) del número de copias de ARN (A) o ADN ( B) estándar. Haga clic aquí para ver una versión más grande de esta figura.

Tabla 1. esquemática de los lugares de la placa y de destino de amplificación. Las placas utilizadas para las pruebas de PCR en tiempo real a escala nanométrica en esta plataforma son microscopio de diapositivas de tamaño y están dispuestos en 48 submatrices de 64 a través de agujeros pasantes, con un total de 3.072 orificios pasantes para las reacciones individuales. Un subconjunto se muestra aquí, con 18 metas, por triplicado. Cada muestra se añade a una submatriz por el manipulador de líquidos. Las placas se recubren con compuestos hidrófilos e hidrófobos para retener reactivos a través de los agujeros a través de la tensión superficial. El chip de acero inoxidable está "fotolitográfica modelado y grabado en húmedo para formar una matriz rectilínea de 3.072 micro-mecanizados, 320 micras diamete. r agujeros de 33 nl de cada "2 Las abreviaturas para los objetivos son los siguientes: BCOR, coronavirus respiratorio canino (betacoronavirus); BORD, Bordetella CAV bronchiseptica, adenovirus canino; CPIV, virus de la parainfluenza canina; CPNV, pneumovirus canino; DISTA / B, canino virus del moquillo A y B; EADV1 / 2, adenovirus equino medio; EAV, el virus de la arteritis equina; EHV1 / 4, herpesvirus equino tipo 1/4; ERVA / B, equino virus rinitis A / B; IVM, influenza A matriz; MCYNOS, Mycoplasma cynos; MS2, el control interno (MS2 ARN del fago); SEQU, Streptococcus equi.
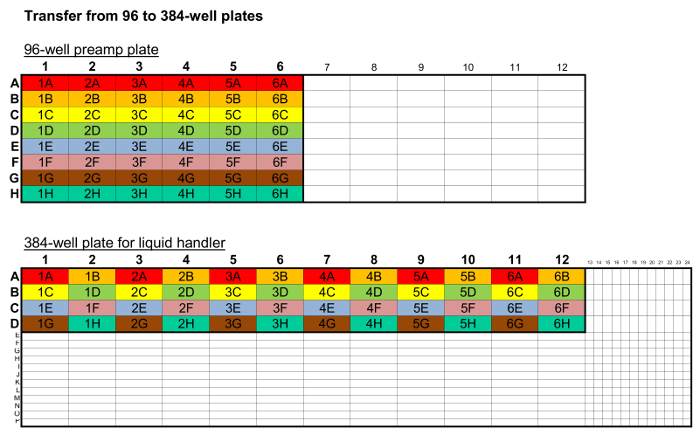
Se muestra la Tabla 2. Mapa de la transferencia de la Plata. Un mapa de transferencia de placa de un código de colores para el uso de una pipeta de 8 canales para transferir fijo de la placa de preamplificador de 96 pocillos a la placa de 384 pocillos. Alternativamente, una pipeta ajustable puede ser utilizada. El mismo procedimiento se realiza cada vez independientemente de h ow muchas muestras están en la placa.
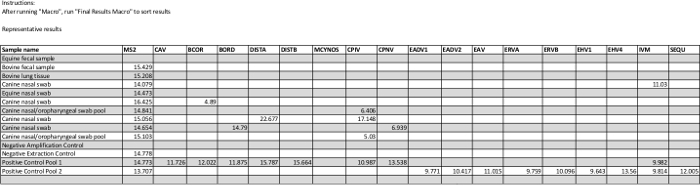
Archivo suplementario. Un archivo de hoja de cálculo habilitado para macros que contiene dos macros de resultados de formato en una tabla resumen (como se describe en el protocolo) se proporciona. Una tabla de resultados típicos generados por las macros se incluye en el archivo (en Resultados Finales). Las dos macros llenarán los nombres de las muestras en la primera columna (hasta 48 muestras) y el promedio de los tres valores de Ct para cada objetivo para las personas con resultados positivos; tenga en cuenta que los objetivos que no se amplifican aparecen en blanco en esta tabla. Esto se puede imprimir fácilmente en una hoja de papel y se utiliza como una referencia para la comprobación de los datos en bruto de manera eficiente. En la pestaña de resultados finales, se muestran resultados representativos para 10 muestras clínicas y 4 controles. Las abreviaturas de los nombres de ensayo se indican en la leyenda de la Tabla 1.www.jove.com/files/ftp_upload/54781/supplemental_code_file_R1.xlsm "target =" _ blank "> Haga clic aquí para descargar este archivo.
Discusión
Este procedimiento se ha utilizado para las pruebas de rutina de patógenos respiratorios en nuestro laboratorio en el transcurso de seis meses (2-3 veces a la semana). También hemos tenido éxito utilizando el mismo procedimiento para el perfilado de patógenos entéricos en muestras fecales y bacterias aisladas en una placa personalizada por separado. Una vez que se producen las placas, el personal experimentado puede completar los pasos 2-7 el plazo de un día de trabajo normal. Los pasos más críticos son el sellado adecuado de la placa de preamplificador, la transferencia de muestras preamplificada entre las placas (que se debe hacer rápidamente para evitar la evaporación), y el recubrimiento final de la placa de amplificación. El uso de la hoja de cálculo macro como una guía para el análisis de resultado (comprobación de curvas para muestras y controles) también fue crítica, ya que reduce en gran medida la cantidad de tiempo y trámites necesarios para este proceso. La hoja de cálculo macro proporcionada es un ejemplo; tendría que ser modificado o re-creado para placas con diferentes configuraciones. Esto puede ser fácilmente performed por alguien con conocimientos básicos de hoja de cálculo.
Debido a la muy pequeña cantidad de muestra se carga en la placa de amplificación (33 nl), se requiere pre-amplificación. En la optimización de este protocolo (no mostrado), se comparó un número de parámetros de preamplificación incluyendo la mezcla maestra, la adición de cebadores aleatorios, número de ciclos, el tiempo de recocido, y la dilución antes de la amplificación. Cada destino tiene sus propias condiciones óptimas, y los descritos aquí representan aquellos que rindió el mejor límite de detección global de nuestro panel. Este panel cubre una amplia gama de patógenos objetivos y tipos de muestras que se encuentran en las pruebas de diagnóstico veterinario de rutina, pero las modificaciones a los procedimientos de preamplificación puede ser necesario para los diferentes paneles. Las condiciones de amplificación fabricante optimizado se basan en un protocolo estándar basado en sonda de PCR en tiempo real con un 10 min a la activación de la enzima 95 ° C seguido de desnaturalización a 95 ° C y AnnEaling / extensión a 60 ° C. Los cebadores y sondas son pre-impreso en las placas también usando condiciones fabricante optimizados y por lo tanto no requieren de titulación. La combinación de los pasos de transcripción inversa y pre-amplificación para todas las muestras (independientemente del tipo de blanco) era necesario con el fin de mantener la eficacia del flujo de trabajo. Tener todas las muestras a transcripción inversa también es beneficioso para maximizar la sensibilidad. Por otra parte, el uso de una mezcla maestra para el preamplificador que está optimizado para minimizar los inhibidores permite versatilidad en la combinación de diferentes tipos de muestras en la misma placa.
El Centro para el Control de Enfermedades (CDC) de ensayo de la matriz de influenza descrito por Shu et al. 7 y adaptado aquí para reacciones a escala de nanolitros es una gripe universal de un ensayo que sea apropiado para el análisis de muestras de humanos y animales de compañía. Fue diseñado para la detección universal de la matriz de genes de todos los virus de la influenza A utilizando rea escala microlitrocciones. Se ha utilizado en todo el mundo como parte de un panel de los CDC sobre Virus de la Influenza Humana y un panel de gripe porcina CDC. El ensayo 8 EHV-1 adaptada aquí detecta un importante patógeno respiratorio de los caballos que pueden causar abortos y las enfermedades neurológicas (revisado por Pusterla y Hussey 10). El significado de la adaptación de estas pruebas a una plataforma de alto rendimiento con un control interno especies independientes es que pueden ser incorporados en un enfoque de vigilancia OneHealth. Habiendo tanto de estos ensayos en una plataforma de pruebas de alto rendimiento facilitará la preparación de emergencia para las instalaciones clínicas, refugios y eventos de rendimiento.
Los resultados descritos anteriormente eran representativos de todos los objetivos en la placa con la excepción de Mycoplasma cynos, que mostró considerablemente más variación en el rendimiento analítico. Esto era probablemente debido a la temperatura subóptima de fusión (Tm) de los cebadores, lo que debería ser, idealmente, desde 58 hasta 60 y# 176; C (la sonda ideales Tm es 68-70 ° C). Una limitación de esta plataforma es que se necesita más tiempo para diseñar y fabricar las placas que para ordenar sondas individuales, lo que limita la capacidad de modificar rápidamente secuencias. Otra limitación de PCR en tiempo real en general es la incapacidad para detectar novela o patógenos inesperados. Esto se puede superar, hasta cierto punto mediante el diseño de ensayos que responden a secuencias en múltiples especies, pero metodologías basadas imparciales secuenciación de todo el genoma son más adecuadas para el descubrimiento de nuevos agentes. 11,12
Nanoescala-PCR en tiempo real permite a un nuevo paradigma para el lugar de las pruebas basadas en especie, que es útil para reducir los costes de reactivos y laborales en el diagnóstico molecular de alto rendimiento basado en el síndrome. Las pruebas de panel de gran escala por este enfoque puede facilitar los esfuerzos de vigilancia OneHealth tales como los descritos por Dunne y Gurfield 13 y Moutailler et al. 14. Recolección de muestras de frotis temprano,generalmente dentro de 3 días de la aparición clínica, proporciona la mejor oportunidad para identificar la presencia de patógenos respiratorios. la aparición de enfermedades infecciosas es a menudo impredecible, y las pruebas que se pueden realizar en diferentes especies, sin necesidad de modificación de los reactivos son ideales para la preparación. Las futuras aplicaciones de esta tecnología son propensos a estar en patotipificación, perfiles de resistencia a los antibióticos, y otros paneles de diagnóstico clínico basados en síndromes. Nanoescala-PCR en tiempo real es más útil para la detección rápida y de alto rendimiento de múltiples tipos de muestras y de patógenos, y se complementaría con enfoques imparciales o parcialmente sesgados a base de secuenciación para la identificación de nuevas y emergentes patógenos.
Divulgaciones
Marcia Slater y Elen Ortenberg son empleados de Thermo Fisher Scientific Inc., que produce reactivos e instrumentos utilizados en este artículo.
Agradecimientos
El trabajo sobre los ensayos de patógenos respiratorios descritos aquí fue apoyada por los fondos de desarrollo interno de Cornell Centro de Diagnóstico de Salud Animal. Desarrollo de la nanoescala flujo de trabajo PCR y sistemas de aseguramiento de la calidad fue financiado parcialmente (FOA PA-13-244) y realizado en colaboración con el Laboratorio de Investigación Veterinaria de la Administración de Drogas y Alimentos y la Red de Respuesta (FDA Vet-LIRN) con la subvención No. 1U18FD005144- 01. Los gastos de publicación fueron patrocinados por VWR y Quanta Biosciences. Agradecemos a Gabrielle Nickerson, Roopa Venugopalan, Veldina Camo, Xiulin Zhang, Jinzhi Yu, Wang Weihua, y Katrina Walker por su ayuda con la escritura y la revisión del protocolo. Agradecemos a Mike Carroll para filmar las entrevistas del autor. Finalmente Agradecemos al editor y tres revisores anónimos por sus útiles comentarios.
Materiales
| Name | Company | Catalog Number | Comments |
| Zap-OGlobin II lytic reagent | Beckman Coulter | 7546138 | Optional reagent for preparing blood samples. |
| Extraction kit (MagMAX Total Nucleic Acid Isolation Kit) | Thermo-Fisher/Applied Biosystems | AM1840 | Other extraction kits appropriate for the desired sample types may be substituted. This kit comes with PBS, lysis buffer, and wash buffer. |
| 2x One-Step RT-qPCR mix (qScript XLT One-Step RT-qPCR ToughMix) | Quanta Biosciences | 95134-500 | |
| Gene-specific primer pool | IDT | custom order | Can be generated by the user or purchased with the amplification plates. |
| Random primer mix | New England Biolabs | S1330S | |
| Standard 96-well plate | Thermo-Fisher/Applied Biosystems | N8010560 | This can be any plate that fits into the conventional PCR machine used. |
| Amplification master mix (OpenArray master mix) | Thermo-Fisher/Applied Biosystems | 4462164 | |
| Clear adhesive seal | Thermo-Fisher | 430611 | |
| Foil seal | Excel Scientific | AF-100 | |
| 384-well plate | Thermo-Fisher/Applied Biosystems | 4482221 | |
| Amplification plate (QuantStudio 12K Flex OpenArray plate) | Thermo-Fisher/Applied Biosystems | 4470813 | Can be customized with any assays conforming to standard TaqMan conditions. |
| Accessories kit | Thermo-Fisher/Applied Biosystems | 4469576 | Contains the case lids, plugs, and immersion fluid. |
| AccuFill tips | Thermo-Fisher/Applied Biosystems | 4457246 | |
| Amplification machine (QuantStudio 12K Flex Real-Time PCR System) | Thermo-Fisher/Applied Biosystems | 4471090 | |
| Liquid handler (OpenArray AccuFill System) | Thermo-Fisher/Applied Biosystems | 4457243 | This is purchased with the amplification machine. |
| Primer design software (Primer Express) | Thermo-Fisher/Applied Biosystems | 4363991 | See manufacturer's instructions for detailed primer and probe specifications. |
| Image analysis program (ImageJ) | NIH | Available at http://imagej.nih.gov/ij/ | |
| Spreadsheet program (Excel) | Microsoft | Available at https://products.office.com/en-us/excel | |
| DMEM | Thermo-Fisher/Gibco | 11965-092 | |
| Tissue disruptor (TissueLyser II) | Qiagen | 85300 | |
| Conventional thermal cycler (Veriti) | Thermo-Fisher/Applied Biosystems | 4375786 | Any conventional thermal cycler with a heated lid can be used. |
| PCR plate spinner | VWR | 89184-608 | This device has only one speed (2,500 rpm); the rotor starts when the lid is closed and stops when the button is pushed. |
| TE buffer | Millipore | 8890-100ML | 10 mM Tris(hydroxymethyl)aminomethane hydrochloride, 1 mM Ethylenediaminetetraacetic acid, pH 8.0 |
Referencias
- Kalinina, O., Lebedeva, I., Brown, J., Silver, J. Nanoliter scale PCR with TaqMan detection. Nucleic Acids Res. 25 (10), 1999-2004 (1997).
- Morrison, T., et al. Nanoliter high throughput quantitative PCR. Nucleic Acids Res. 34 (18), e123 (2006).
- Bustin, S. A. Quantification of mRNA using real-time reverse transcription PCR (RT-PCR): trends and problems. J Mol Endocrinol. 29 (1), 23-39 (2002).
- McCall, M. N., et al. A benchmark for microRNA quantification algorithms using the OpenArray platform. BMC bioinformatics. 17 (1), 138 (2016).
- Pozzi, A., Previtali, C., Cenadelli, S., Gandini, L., Galli, A., Bongioni, G. Genetic traceability of cattle using an OpenArray genotyping platform. Anim Genet. 47 (1), 133-134 (2016).
- Grigorenko, E., et al. Multiplex screening for blood-borne viral, bacterial, and protozoan parasites using an OpenArray platform. J Mol Diagn. 16 (1), 136-144 (2014).
- Shu, B., et al. Design and performance of the CDC real-time reverse transcriptase PCR swine flu panel for detection of 2009 A (H1N1) pandemic influenza virus. J Clin Microbiol. 49 (7), 2614-2619 (2011).
- Elia, G., et al. Detection of equine herpesvirus type 1 by real time PCR. J Virol Methods. 133 (1), 70-75 (2006).
- Dreier, J., Störmer, M., Kleesiek, K. Use of Bacteriophage MS2 as an Internal Control in Viral Reverse Transcription-PCR Assays. J Clin Microbiol. 43 (9), 4551-4557 (2005).
- Pusterla, N., Hussey, G. S. Equine Herpesvirus 1 Myeloencephalopathy. Vet Clin North Am Equine Pract. 30 (3), 489-506 (2014).
- Firth, C., Lipkin, W. I. The genomics of emerging pathogens. Annu Rev Genomics Hum Genet. 14, 281-300 (2013).
- Lecuit, M., Eloit, M. The potential of whole genome NGS for infectious disease diagnosis. Expert Rev Mol Diagn. 15 (12), 1517-1519 (2015).
- Dunne, G., Gurfield, N. Local Veterinary Diagnostic Laboratory, a Model for the One Health Initiative. Vet Clin North Am Small Anim Pract. 39 (2), 373-384 (2009).
- Moutailler, S., et al. Co-infection of Ticks: The Rule Rather Than the Exception. PLOS Negl Trop Dis. 10 (3), e0004539 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados