Method Article
Nested pcr 法を使用してのタイマー刻みでライム病ライム病スピロヘータを検出
要約
Nested pcr 法は、ライム病ライム病の病原のプローブ DNA を抽出し目盛りに適用できる敏感な具体的で、わかりやすい手法です。最初の PCR 実験は遺伝子特定のプライマーを使用し、内部のプライマーを使用して後続の反応のためのテンプレートとなる長い amplicons を生成します。
要約
ライム病は、スピロヘータの感染しているマダニマダニ咬傷を通して人間に感染しているのボレリアブルグドルフェリsensu lato 家族によって引き起こされる深刻な媒介性感染症です。北アメリカの主な病因は、狭義のボレリアブルグドルフェリです。地理的なリスク領域を拡大、堅牢な監視プログラム ダニ感染率を測定でき、臨床医、獣医師、および一般に調査結果を通信をサポートすることをお勧めします。ネストされたポリメラーゼの連鎖反応 (nPCR) の分子技術は長いこの目的のために使用されており、ダニや野生動物のボレリアの検出に中央・安価・堅牢なアプローチ。
この資料では、感染した標本を識別するために DNA 抽出液をチェックする nPCR のアプリケーションを示します。2 つの独立ボレリア目標は、遺伝子のこの手法でエンコードのフラジェリン B (ぜい肉) と外表面蛋白質 A , (OspA) が広く使用されています。プロトコルは、ティック コレクション、DNA 抽出、および 2 つのボレリアのそれぞれを検出する PCR の最初のラウンド-特定の軌跡。後続のポリメラーゼの連鎖反応 (PCR) はより小さく、内部増幅断片を生成するのに新しいテンプレートとして最初の反作用の製品を使用します。ネストされたアプローチは、従来の PCR の感度と特異性に向上します。ダニは両方ボレリア遺伝子から内側 amplicons は agarose のゲルの電気泳動によって検出できるとき病原体陽性と見なされます。
概要
ライム病 (LD) は、北半球で最も普及している媒介性の感染症とその発生率が1を増加し続けています。この衰弱させる病気が、ライム病の (LB) 複雑な (通称ボレリアブルグドルフェリsensu の lato、または s. l.)、歴史的に支配的な北アメリカの病原体、 B. で構成され spirocheteal の病原体によって引き起こされるライム B. afzeliiとB. garinii は、ヨーロッパとアジア、普及と新たな臨床的意義2,3種に加えて狭義 (® と名づける)。これらの細菌が感染しているマダニマダニ2.の咬傷を通して人間に送信されます。主な北アメリカのベクトルがI. いるとI. スルメ港し、菌4を送信するこの属内の複数の種が見つかっています。人間、ボレリアが原因で皮膚、関節、心臓、神経系、内分泌腺、消化管、内臓5,6,7、影響を及ぼす多臓器の症状 8,9,10。疾病管理予防センターは、現在アメリカ合衆国11,12で年間 300,000 以上新しい症例を見積もっています。病気の診断し、初期の段階で治療、予後は良好なしばしば、研究が治療後症状を続けている推奨される抗生物質療法を受けた患者の 60% と 10% 間のどこかを示唆しています。停止現象記事治療ライム病症候群 (PTLDS)13,14,15と呼ばれます。さらに、臨床的介入の遅れがカチカチのかみ傷の意識、初期の病気の非固有のプレゼンテーション、伝統的な血清による診断に基づいて感染症の発症で使用する場合の低感度の不足の結果として発生します。迅速かつ的確に治療するために失敗がますます衰弱させる合併症16,17にマニフェストすることができます症状進行できます。ライム病予防したがってリスク管理の基礎です。この成長の脅威に対抗するための戦略でダニ、病原体の有病率を示すための堅牢な監視措置を含むし、懸念の地理的な地域を特定します。
この記事では、感染しているマダニを識別する分子スクリーニング ツールとして入れ子になったポリメラーゼの連鎖反応 (nPCR) の有用性を示します。、特異性を向上させるため 2 つのボレリア遺伝子は並列増幅に使用されます。フラジェリン B (ぜい肉) 18鞭毛の主要な繊維タンパク質をエンコードし、外表面蛋白質 A (OspA) のリポ蛋白製品媒介マダニの中腸間単一の線形染色体上遺伝子にあります。植民地化はプラスミド エンコード19,20。ワークフローは、ティック コレクション、DNA 抽出しボレリアを検出する PCR の最初のラウンドで構成されています-特定の軌跡。その後 PCR は小さく、内部増幅断片を生成するのに新しいテンプレートとして最初の反作用の製品を使用します。ダニと見なされる正ボレリアブルグドルフェリの両方のボレリアの遺伝子から内側 amplicons は agarose のゲルの電気泳動によって検出できます。
NPCR 技術とぜい肉とOspA遺伝子ターゲットの両方を広く生態学的監視とライム スピロヘータの初期 90 年代21,22,23 以来の検出臨床使用されています。、24,25。分子のプロトコルの開発の前にダニを26抗ボレリア蛍光抗体法 (IF) の染色、微生物文化、またはそれらの組み合わせを消化管内容物をかけることによって評価しました。これらのアプローチは成長が遅く、ボレリア27、抗体パフォーマンスの問題、および IF 処理21ライブ タイマー刻みの要件の気難しい性質を含む固有の制限に苦しみます。PCR 後、感染したベクトルの高速、高感度、および特定の識別を提供するために採用されました。カルチャに依存しないそれ以外の場合にテスト21,22 不向き死者とアーカイブのダニなどの多様な試料の種類に直接アプリケーションを含む、伝統的な方法論でマーク付きの改善を提供.入れ子になった実験的デザインをさらに増幅25,28の 2 連続ラウンドで遺伝子特定のプライマーの 2 つの異なるセットを用いた古典的な PCR の感度と特異性を改良します。
実験成功は戦略的な遺伝子の選択と増幅設計に大きく依存します。ボレリアブルグドルフェリの存在を正確に推定するには、プライマーがボレリア属にも回帰熱スピロヘータと中居に関連する病原体を検出します。ぜい肉の場合この特異性は、多様な細菌 (図 1)24,29によって共有される比較的保存の並ぶシーケンスではなく、遺伝子の可変内部領域をターゲットによって達成されます。,30。
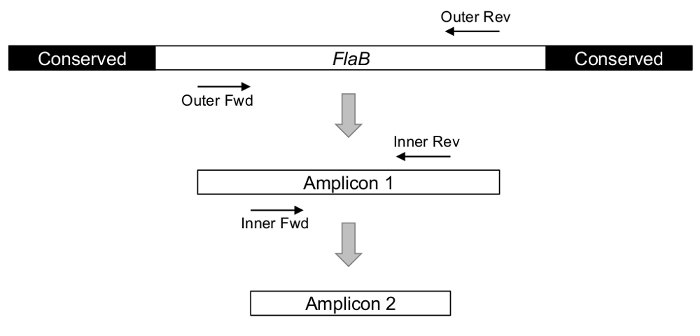
図 1: nPCR、下図を使用しての概念ボレリアぜい肉ターゲットとして遺伝子。遺伝子の 5' と 3' のテルミニはボレリアブルグドルフェリsl のこれらの地域のライムの原因となる病原体の特定の評価には適さないレンダリングを超えて生物に共通です。プライマー ターゲットとして少ない節約インテリア シーケンスを使用して、PCR の 2 ラウンドは最終的に内部の増幅を検出する実行されます。この図の拡大版を表示するのにはここをクリックしてください。
差別的な能力のテストでインテリアのぜい肉プライマーが80 以上の異なるボレリア評価、ライム病24に関連付けられているものだけを識別するために発見しました。624と純粋培養から 1031細菌間で nPCR の検出下限がされて感度は南私アンプリコン、しみが付くことおよび交配、放射性でさらに改善できますが、化学発光プローブ。単一スピロヘータ31検出しきい値を低減技術を結合します。直接の比較によって 104スピロヘータ31の最低の存在を報告するため、従来の unprobed の単一ラウンド PCR が見つかりました。しかし、無関係な DNA および潜在的な阻害物質の圧倒的な存在感のため、複雑な環境および臨床サンプルを操作するとき、アッセイの感度が低くなります、注意すべきであります。これらの課題は、主として nPCR の使用によって回避できます。
過去数十年で分子技術の進歩にもかかわらず、nPCR モダンな監視活動の定番手法のまま。デザインでこのプロトコルの実行注意は、ティック ベクトルにおける病原体の存在をキャプチャするための強力な適応性、および比較的簡単なアプローチです。
プロトコル
1 タイマー刻みから DNA の隔離
- フィールド コレクション、または獣医師および公衆のメンバーからの受動的な監視を介してダニを取得します。ダニは凍結によって殺された、密閉袋に入れ、室温で郵送する必要があります。
- 提出フォームを使用して、日付と出会い、目盛りの添付の状態、ホスト種、およびホストの最近の旅行の歴史の地理的な位置に関する情報を収集します。
- Nested pcr 法は本質的に汚染されやすいため、サンプルの間露出を最小限にする研究所のワークスペースが設定されているを確認します。これは徹底的に洗浄、滅菌、よく互いから分離独立した専用スペースでのプロトコルのさまざまな要素の実行を含む、すべての楽器を確保する汚染物質の無料です。
- 試料を受け取ったら、目盛りを写真し、識別キー32種、発達段階、セックス、および充血状態を比較することにより決定します。
- 無菌条件下で剃刀やメスを使用して目盛りを二等分する、独立したマイクロ遠心チューブ用に 2 つの目盛りの断片。
- 全 DNA を抽出するには、PCR と互換性のあるテンプレートを生成する任意の隔離プロシージャを使用します。このプロトコルは、キレート ベースの単純なアプローチを示しています。
- ティック フラグメントに溶解キレート試薬 (50-200 μ L) の間にしばしば適切な量を追加することによって開始します。具体的な金額は標本のサイズと充血の状態によって異なりますガイドラインは、製造元によって提供される必要があります。マイクロ チューブ乳棒を用いてホモジナイズしてください。
- 簡単に 45 分と渦の 60 ° c の水浴中サンプルをインキュベートします。
- デスクトップ遠心機で遠心分離機の 16,276 x g (13,300 rpm) で 4 分のサンプル。
- 反転して (1.2.3) のように遠心分離機の再ミックス、50 μ L のイソプロパノールを含む新鮮なラベル付きマイクロ チューブに上清を転送します。
- 、上清をデカントし、70% のエタノールの 50 μ L の DNA の餌をすすいでください。
- ピペット、余分なエタノールを削除し、室温で 15 分間空気乾燥ペレット。
- DNA を再懸濁します 1 mM Tris pH 7.0 の 50 μ L を追加し、60 ° C で 1 時間湯せんでサンプルをインキュベート今後の分子分析のための-20 ° C で、DNA を格納できるように。
2. ボレリア OspAとぜい肉の nested pcr 法の検出。
注: 一般的な PCR の原理と実践の概要は、ローレンツ、2012年33によって提供されます。
- 合成またはボレリアの遺伝子特定の外側と内側のオリゴヌクレオチドのプライマーを取得します。プライマー セット、それぞれ増幅サイズおよび溶融温度の表 1を参照してください。
| プライマー名 | 遺伝子ターゲット | シーケンス (5' 3') | 増幅サイズ | アニーリング温度 | |
| Fw をぜい肉 | ぜい肉 | gcatcactttcagggtctca | 503 bp | 55 ° C | |
| Rv をぜい肉 | ぜい肉 | tggggaacttgattagcctg | |||
| Fw のぜい肉 | ぜい肉 | ctttaagagttcatgttggag | 447 bp | 58 ° C | |
| Rv のぜい肉 | ぜい肉 | tcattgccattgcagattgt | |||
| OspA アウト Fw | OspA | cttgaagttttcaaagaagat | 487 bp | 55 ° C | |
| OspA アウト Rv | OspA | caactgctgacccctctaat | |||
| Fw OspA | OspA | acaagagcagacggaaccag | 350 bp | 58 ° C | |
| Rv OspA | OspA | ttggtgccatttgagtcgta | |||
表 1: ボレリア burgdorferiFlaB ・ OspA nPCR の内側と外側のプライマー。
実習では、ぜい肉のプライマー検出OspAプライマー キャプチャのみボレリア汽船、ボレリアgenospecies が密接に関連B. ボレリアブルグドルフェリss と他両方の軌跡から増幅を示すb.ボレリアブルグドルフェリ。s. s.
- 事前殺菌 UV 光と 70% エタノールを用いた PCR キャビネット。
注: 潜在的なサンプルの汚染を最小限に抑えるこのワークスペース ティック解剖、DNA の抽出の場所とは異なる、ゲルの電気泳動。- 最初の PCR 実行 DNA、上記ステップ 1.0 でリカバリし、表 2で説明したように反応混合物を設定テンプレートと組み合わせて外側のプライマーを使用します。並行して、実行制御検証ボレリアの DNA から成る、ネガティブ コントロール実行されますいいえテンプレート反応試薬とエアロゾル汚染を検出するを含む肯定的です。試薬が汚染される可能性を最小限に抑えるために端に DNA を追加します。確実にすべての回と試薬が追加されていないと、DNA 添加直後後の管を閉じて他のチューブを開く前に各管を閉じる。
- サーマルサイクラーを次のようにプログラム: 95 ° C、5 分。40 サイクル 95 ° C の 15 s、アニール温度 30 s、45 のための 72 ° C s;72 ° C、5 分。4 ° C でを押し
- 内側のプライマーを使用し 2 μ L (2.2.2 で生産) 最初の PCR の製品の最初の反応に似ています PCR の 2 番目のラウンドを実行します。
注: 反応ボリュームは表 2に再度提供されます。テンプレート DNA が最後に追加されると同時に 1 つのサンプルに対応するだけの管が開いているを確保することによって amplicons のクロス汚染を避けるために注意する必要があります。
表 2: PCR 反応混合物最初と 2 番目の拡大。コンポーネント PCR # 1 ボリューム PCR # 2 ボリューム Taq ポリメラーゼのマスター ミックス 2 X 12.5 Μ L 12.5 Μ L ヌクレアーゼ フリー水 8.5 Μ L 8.5 Μ L 10 μ M 順方向と逆プライマー 1.0 μ L 外側プライマー 1.0 μ L インナー プライマー DNA のテンプレート 2.0 μ L、サンプル抽出 (1.2.7) から PCR (2.2.2) のラウンド 1 から、2.0 μ L
- 熱 cycler を前に、プログラムが、内部のプライマー (表 1 を参照) に対応するためのアニーリングの温度を調整します。
3. Agarose のゲルの電気泳動およびイメージング
注: 電気泳動による DNA の分離の基本的な手順は、李らを参照してください。 2012 年34。
- 20 X SB バッファー (0.2 M NaOH、0.8 M ホウ酸 pH 8)、1 X に希釈を使用して 1.2% の agarose のゲルの準備し、事前のゲルの染色が必要な場合、注ぐ前に約 5 μ L の DNA 染色を追加します。
- 10 の各実験から 2 番目 (内部) PCR の反作用からの製品の μ L と 100 bp ラダー (5 μ L) と一緒にコントロールのサンプルをロードします。
- 107 で 1 時間の electrophorese V (5 v/cm)。
- 表示および transilluminator と関連付けられているカメラとソフトウェアを使用してゲルを文書化します。
結果
nPCR は、複雑な環境試料調査中である場合は特に、特異性と病原体検出の感度を高めるためのエレガントなアプローチです。PCRボレリアぜい肉軌跡 (とOspA、描かれていない) の戦略的な地域の 2 つのラウンドが短いインナーの世代を通じてボレリアブルグドルフェリ細菌の存在を報告できる図 1に示されている、amplicons。ゲルの電気泳動によって解決されると、刻みからぜい肉とOspA反応生成物が視覚的に得点し、コントロールと比較します。図 2に各ゲルの上部にあるユニークな標本の識別子が提供されます、いいえテンプレートおよびエアロゾルのコントロール表されます左端と右、それぞれ、はしごに隣接します。
堅牢な増幅バンドは選択の実験サンプルにはっきりと見える、余剰のプライマーと残留 DNA (図 2) から簡単に区別。定める実験設計の原則に基づき、ダニをボレリアネガティブ コントロールを示す増幅、および内部 amplicons、ぜい肉、 OspAプライマーから生成される並列時の肯定的な考えは。この場合、標本 T907、T604、T606 ライム病原体 (図 2) の監視条件に会った。By contrast、T923 が陽性だけOspA、結果複数の可能な説明がある: A) 起源の目盛りはボレリア、陰性ですが外側または内側OspA PCR 準備もに汚染されていたテンプレート DNA (マイナス コントロールを介して試薬の全身汚染が排除されていることに注意)、B) ダニはライム病ボレリア、低テンプレート量や実験的なエラー防止ぜい肉、または C の増幅) 有機体が存在保存されたOspAシーケンスに含まれているが、フラジェリンに欠けていたまたはプライマーをアニールぜい肉の対象地域の不十分なアイデンティティを持っていた。確かに、さまざまな植物や動物の28を含む生物にOspA配列類似性を指摘されています。コンバースの状況より多くの増幅はフラジェリン遺伝子がないOspA遺伝子を保存、可能性があります関連ボレリア種。実際には、このプロトコル シナリオ 'A' が最も可能性の高い説明であることを示唆、ぜい肉プライマーを行う以上のOspA単一肯定的な結果が得られます。好戦的な標本のさらなる実験的解析、せずただし、じゃない単一肯定的な結果の原因を特定することが可能。あいまいなサンプルに対して技術的な複製数の増加は、以前の反応にも導入された汚染物質はアーカイブされた DNA に存在ないので彼らの真の状態の調整を助けるかもしれない。ただし、これらのプライマーとそれに続く反作用は決定的な結果を提供するために失敗した場合、他のボレリアの軌跡は PCR によって調査できます。これらの反応から生成される Amplicons のシーケンシャルな id の割り当てや緊張発散の程度を推定するための隔離集団間で比較もできます。Sapi および同僚は、ひと臨床サンプル35を使用して、このワークフローの例を提供します。
すべての要因は、輪郭を描かれたプロトコルと解釈の基準はそれぞれ 0.17%、0.0063% の偽陽性と偽負のレートを生成すると推定されていると見なされます。
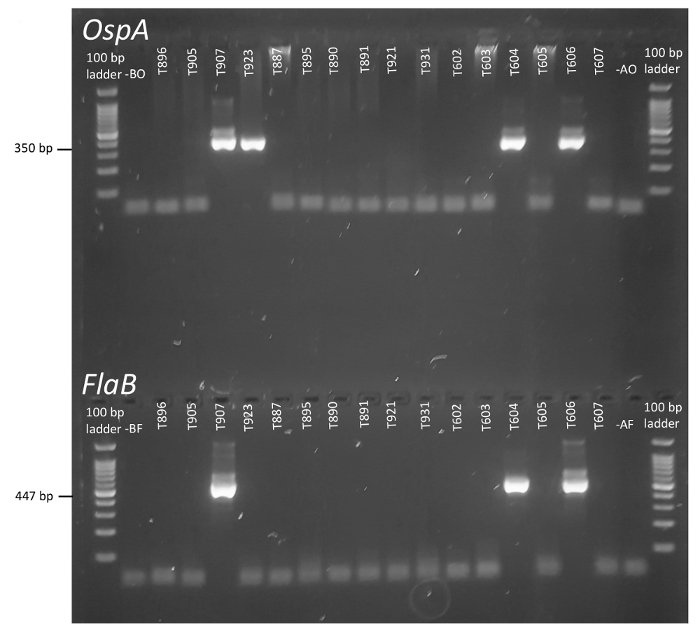
図 2: の検出ボレリアブルグドルフェリnPCR による個々 のタイマー刻みでぜい肉とOspA 。各目盛りに割り当てられたコードは、ゲルの上部に表され、アイデンティティに各試験片におけるOspAとぜい肉の検出を報告する縦に揃えます。レーン権利イメージのないテンプレート コントロールを表すの左にある B (右車線) がエアロゾル試験所環境の汚染をキャプチャするコントロールがあります。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
使用の十年間、PCR ベースの手法が一貫してその価値を証明ボレリアの検出における節足動物と哺乳類の標本からボレリアが環境または臨床的起源から来るかどうか。PCR では、監視する既存の方法より多くの改善を提供しています。特に、それは開発と抗体試薬の性能依存ではなく、代わりにすることができます簡単に適応するプライマー シーケンスを変更することによって単に興味の新しいターゲットを検出します。PCR は、単独または多重反応による並列、複数の遺伝子座の評価も可能です。それは、新鮮でアーカイブされたダニ22、動物または人間の体液と切除25を含む多様な試料の入力に適用できます。PCR はまた amplicons 例については制限の酵素の消化力、プローブの交配、または微生物のアイデンティティ21に増加し洞察力を提供するために、シーケンス処理によって、さらに加工することができますを生成できます。
臨床ツールとして感染症の二次的な対策として宿主の免疫応答に依存するのではなく、細菌の存在の直接徴候を提供するので、PCR は概念的には標準的な血清学的診断することが望ましい。ただし、ライム病は比較的控えめな微生物の負担に関連付けられて (< 50 生物/mL 尿またはプラズマ) と偽陰性に上昇を与えることができる非定常 spirochetemia 結果25。クリニックでこの技術の感度は、組織型、感染、およびサンプル条件のステージ 12.5% と血液、脳脊髄液、生検組織36の既存研究では 62% の落下によってかなり異なります。分子感度限界支障がない場合は細菌培養後 PCR を実施しかし実行可能なスピロヘータの臨床検体からの回復は、同様に挑戦的な証明されています。最近プロトコル高い収量35のために最適化されています。一方、感染成人たにの腸抱くことができます平均どこ 2,000 から以上 50,000ボレリア37,38,39、しっかり nPCR の検出範囲内にあります。したがって、プロトコルは、ティック監視活動に適しています。
NPCR は特定の課題、つまり遺伝子と amplicons 品質 DNA を回復細心の実験的ワークフローの戦略的な選択に依存するダニ感染症を正確に報告するこの技術の容量を提起しているにもかかわらず、その多くの利点サンプルのクロス露出および試薬、実験室の環境の汚染を報告する適切なコントロールの使用を最小限に抑えながら標本から実験を前にスコープおよび調査の意図、明確な適切な遺伝子座と地域、そこに選択できます。目的は、ライムを引き起こすボレリアブルグドルフェリsl の複雑なため公平な画面を提供するためには場合と同様の親和性を持つ関連株のすべてを検出するプライマーを作成して無関係なキャプチャすることがなく増幅効率生物25。新しいプライマーを設計することができ、評価インシリコプライマー ブラスト40などのソフトウェア ツールを使用して標準の参照に対して実験的に検証することもかが未同定のサンプルに適用される前に分離します。DNA 抽出手順の目標は、混在環境試料 (ティック ホモジネート) からそのまま微生物テンプレートを回復するためです。PCR に進む前にオプションのステップは、抽出した DNA の完全性を評価するためです。また、並列の反応は目盛りでハウスキーピング遺伝子を対象とする設定でした。後者の方法は、反応混合物は、ボレリアの否定的な反応は、生物のしていない阻害物質の存在がないのために、増加自信を提供する阻害剤の存在も指定できます。
入れ子になった PCR 方法の感度の向上は、偽陽性の結果を生成する潜在的な汚染を犠牲にして来る。ティック郭清および DNA の回復時や外側と内側の増幅反応を設定する過程で、外因性テンプレートをサンプルに導入できます。テンプレートまたは私アンプリコンを避けるために PCR のための最高の練習プロトコルに従うことが特に重要ですので交差汚染。必要に応じて、PCR の生物学的安全キャビネット独立した気流、封じ込めと別の作業ステーションの使用を含むこれら徹底した化学物理的洗浄、表面や試薬等の滅菌と DNAの慎重な取り扱い41. いいえテンプレート コントロールは、ストックの試薬の汚染を識別するに不可欠な。NPCR の特定の脆弱性は処理私アンプリコン第 2 PCR 容器に最初の反作用の製品を転送するときに発生します。ターゲット DNA は既に肯定的なサンプルの指数強化を受けている、ので交差汚染に特に傾向がある、この手順は、この制限を回避するために開発した単管 nPCR プロトコル。このアプローチである特定の遺伝子のためのプライマーの両方のセットは、PCR31の両方のラウンドの密封されたままで反応管に一緒に追加されます。外側と内側のプライマーのペアは、外側のカップルで内側のプライマーのため禁止はアニール温度が高いテンプレートを増幅するよう熱力学的明瞭ななりません。第 2 ラウンドでは、内部のペアに対応するアニーリングの温度が低下します。これは潜在的交絡ステップをバイパスは、それはまた追加の使用を許可だけでなく抗汚染対策31,42。ただし、この変更は、いくつかのアッセイの感度を犠牲があります。方法、サンプルに独立して実行される技術的複製数の増加にスプリアス汚染を識別するために役立ちます。
分子生物学手法も nPCR の導入以来進化を続けて、これらの新しいアプローチ オリジナル デザイン上の選択の利点を提供は、金融費用の増加であります。その名の通り、量的な PCR (qPCR または実質の時間 (RT)-PCR) 従来技術が自然43で質的なサンプルについては、病原体の列挙が可能になります。QPCR の感度は、プライマー特性28に応じて変動することができますそれが伝え nPCR38に似ています。代わりに従来の TaqMan プローブ分子ビーコン (MB) を使用して、qPCR のバリエーションは臨床検体44,45,46のボレリアの検出にも約束を示しています。彼らのユニークな二次構造による分子ビーコン伝え低バック グラウンド蛍光と通じ、優れた感度47高の正当な信号を生成します。前臨床評価では、1 から 10 のスピロヘータ44,45間の潜在的な検出しきい値をお勧めします。さらに、技術は同時に検出哺乳類宿主遺伝子44と他のダニ媒介性病原体45nPCR を容易に達成可能である多重反応で正常に適用されています。その他のデザイン変更は、標準曲線39,48を使用せず DNA を定量化することができます液滴デジタル PCR (ddPCR) 技術を含みます。ボレリアのこの技術の低い検出限界は同様におよそ 10 のスピロヘータ/サンプル39です。これらのアプローチ nPCR と比較して、彼らはシングル増幅プロトコルを必要と、汚染の減少の可能性の利点もあるされます。
監視の目的は、様々 な細菌、ダニ目次をプロファイルする代わりには、16 s rRNA メタゲノム スクリーニングは魅力的なオプション49です。正確により微生物の広いスペクトルを取り込むことができますが、この方法は高価、すべて分子生物学研究所で見つからない特殊な DNA シーケンサーを必要としより高度なバイオインフォマティクスを用いた解釈が必要になります、ベクトルの病原体の負荷を表します。
対象となる監視活動がバイナリの有無の報告にかかわっているしばしば qPCR とその誘導体、定量用選択の方法とメタゲノム画面提供ティック マイクロバイの広範な在庫、1 つまたは少数の病原体ベクトルで。このような状況下で、これらの新しいより複雑なアプローチはプロセスに不必要な複雑さと財政負担を導入可能性があります。これらの理由から、nPCR テスト目盛りで極めて重要な技術として時の試練に耐えています。
開示事項
著者が明らかに何もありません。
謝辞
プライマー デザインのため神ハリス、アシュリー McKibbon と撮影、ジェシカ トーマス エベットとジョン ・ ブレイクリー、アレクサンドラ ・ フォーリー イービ、クリス ・ ラングレー、ジュリー ・ ルイス、ケルシー ・ マッキンタイア、アシュリー McKibbon、クリス ヴォージュ山脈とロージーへの出演犬を感謝致します、ビデオ。A. M. K. は、カナダのライム病研究財団によって支えられた、自然科学工学研究会議のカナダ (レベル) によって提供されたプロジェクトの資金調達。M. k. b. W. 給与ニューブランズウィック イノベーション財団 (NBIF) からの資金を受け取った。
資料
| Name | Company | Catalog Number | Comments |
| LabGard Class II, Type A2 biological safety cabinet | Nuaire | ES AIR NU-543 | |
| Razor blades | VWR | 55411-050 | 0.22 mm thickness |
| Microfuge Tubes (Microtubes 1.5 mL) | Axygen | 311-08-051 | |
| AquaGenomic | MultiTarget Pharmaceuticals | 2030 | DNA extraction reagent |
| Microtube Pestle | Diamed | DIATEC610-1551 | Designed for 1.5 ml tubes |
| Water bath - Isotemp 202 | Fishse Scientific | 15-462-2 | |
| Vortex | Labnet | S0100 CAN | |
| Spectrafuge 24D Digital Microcentrifuge | Labnet | C2400 | |
| Isopropanol | Sigma-Aldrich | 190764 | |
| BIS-TRIS | Sigma-Aldrich | B9754 | |
| Primer Synthesis | Sigma-Aldrich | OLIGO | |
| PCR Cabinet | Misonix | PCR6-482 | |
| PCR tube with attached flat caps 0.2mL | VWR | 20170-012 | |
| GoTaq Green Master Mix 2x | Promega | M7123 | |
| Nuclease-free water | Promega | M7123 | The water comes with the GTG |
| Spectrafuge Mini | Labnet | C1301 | |
| SYBR Safe DNA Stain 10,000X Concentration | EDVOTEK | 608 | |
| Froggarose LE (Molecular Biology Grade Agarose) | FroggaBio | A87-500G | |
| GD 100 bp DNA Ladder | FroggaBio | DM001-R500 | |
| Electrophoresis power pack | VWR | VWR 105 | EC Apparatus Corporation |
| Fluor-S MultiImager | BioRad | 170-7700 (Serial number 433B0154) | |
| Quantity One 1-D Analysis Software (V. 4.5.2) | BioRad | 1709600 |
参考文献
- Schotthoefer, A. M., Frost, H. M. Ecology and epidemiology of Lyme borreliosis. Clin. Lab. Med. 35 (4), 723-743 (2015).
- Franke, J., Hildebrandt, A., Dorn, W. Exploring gaps in our knowledge on Lyme borreliosis spirochaetes - Updates on complex heterogeneity, ecology, and pathogenicity. Ticks Tick Borne Dis. 4 (1-2), 11-25 (2013).
- Rudenko, N., Golovchenko, M., Vancova, M., Clark, K., Grubhoffer, L., Oliver, J. H. Isolation of live Borrelia burgdorferi sensu lato spirochaetes from patients with undefined disorders and symptoms not typical for Lyme borreliosis. Clin. Microbiol. Infect. 22 (3), 267.e9-267.e15 (2016).
- Scott, J. D., Clark, K. L., Anderson, J. F., Foley, J. E., Young, M. R., Durden, L. A. Lyme Disease Bacterium, Borrelia burgdorferi Sensu Lato, Detected in Multiple Tick Species at Species at Kenora, Ontario, Canada. J Bacteriol Parasitol. 08 (01), 1-10 (2017).
- Sperling, J., Middelveen, M., Klein, D., Sperling, F. Evolving perspectives on lyme borreliosis in Canada. Open Neurol J. 6, 94-103 (2012).
- Pachner, A. R. Early disseminated Lyme disease: Lyme meningitis. Am. J. Med. 98 (Supplement 1), 30S-43S (1995).
- Mikkilä, H. O., Seppälä, I. J., Viljanen, M. K., Peltomaa, M. P., Karma, A. The expanding clinical spectrum of ocular lyme borreliosis. Ophthalmology. 107 (3), 581-587 (2000).
- Mc Causland, F. R., Niedermaier, S., Bijol, V., Rennke, H. G., Choi, M. E., Forman, J. P. Lyme disease-associated glomerulonephritis. Nephrol. Dial. Transplant. 26 (9), 3054-3056 (2011).
- Tunev, S. S., Hastey, C. J., Hodzic, E., Feng, S., Barthold, S. W., Baumgarth, N. Lymphoadenopathy during Lyme Borreliosis Is Caused by Spirochete Migration-Induced Specific B Cell Activation. PLoS Pathog. 7 (5), e1002066-e1002014 (2011).
- Kostić, T., et al. Manifestations of Lyme carditis. Int. J. Cardiol. 232, 24-32 (2017).
- Hinckley, A. F., et al. Lyme Disease Testing by Large Commercial Laboratories in the United States. Clin. Infect. Dis. 59 (5), 676-681 (2014).
- Nelson, C. A., et al. Incidence of Clinician-Diagnosed Lyme Disease, United States 2005-2010. Emerg. Infect. Dis. 21 (9), 1625-1631 (2015).
- Aucott, J. N., Rebman, A. W., Crowder, L. A., Kortte, K. B. Post-treatment Lyme disease syndrome symptomatology and the impact on life functioning: is there something here?. Qual Life Res. 22 (1), 75-84 (2012).
- Aucott, J. N., Crowder, L. A., Kortte, K. B. Development of a foundation for a case definition of post-treatment Lyme disease syndrome. Int. J. Infect. Dis. 17 (6), e443-e449 (2013).
- Adrion, E. R., Aucott, J., Lemke, K. W., Weiner, J. P. Health care costs, utilization and patterns of care following Lyme disease. PLoS ONE. , (2015).
- Cameron, D. J. Consequences of treatment delay in Lyme disease. Journal of Evaluation in Clinical Practice. 13 (3), 470-472 (2007).
- Johnson, L., Aylward, A., Stricker, R. B. Healthcare access and burden of care for patients with Lyme disease: a large United States survey. Health policy. 102 (1), 64-71 (2011).
- Motaleb, M. A., et al. Borrelia burgdorferi periplasmic flagella have both skeletal and motility functions. Proc. Natl. Acad. Sci. U.S.A. 97 (20), 10899-10904 (2000).
- Rosa, P. A., Tilly, K., Stewart, P. E. The burgeoning molecular genetics of the Lyme disease spirochaete. Nat. Rev. Microbiol. 3 (2), 129-143 (2005).
- Kenedy, M. R., Lenhart, T. R., Akins, D. R. The role of Borrelia burgdorferi outer surface proteins. FEMS Immunol. Med. Microbiol. 66 (1), 1-19 (2012).
- Persing, D. H., Telford, S. R., Spielman, A., Barthold, S. W. Detection of Borrelia burgdorferi infection in Ixodes dammini ticks with the polymerase chain reaction. J. Clin. Microbiol. 28 (3), 566-572 (1990).
- Persing, D. H., et al. Detection of Borrelia burgdorferi DNA in museum specimens of Ixodes dammini ticks. Science. 249 (4975), 1420-1423 (1990).
- Wise, D. J., Weaver, T. L. Detection of the Lyme disease bacterium, Borrelia burgdorferi, by using the polymerase chain reaction and a nonradioisotopic gene probe. J. Clin. Microbiol. 29 (7), 1523-1526 (1991).
- Johnson, B. J., Happ, C. M., Mayer, L. W., Piesman, J. Detection of Borrelia burgdorferi in ticks by species-specific amplification of the flagellin gene. Am. J. Trop. Med. Hyg. 47 (6), 730-741 (1992).
- Schmidt, B. L. PCR in laboratory diagnosis of human Borrelia burgdorferi infections. Clin. Microbiol. Rev. 10 (1), 185-201 (1997).
- Ogden, N. H., et al. Ixodes scapularis ticks collected by passive surveillance in Canada: analysis of geographic distribution and infection with Lyme borreliosis agent Borrelia burgdorferi. J. Med. Entomol. 43 (3), 600-609 (2006).
- Doern, G. V. Detection of selected fastidious bacteria. Clin. Infect. Dis. 30 (1), 166-173 (2000).
- Nolte, O. Nucleic Acid Amplification Based Diagnostic of Lyme (Neuro-)borreliosis - Lost in the Jungle of Methods, Targets, and Assays?. Open Neurol J. 6 (1), 129-139 (2012).
- Wallich, R., Moter, S. E., Simon, M. M., Ebnet, K., Heiberger, A., Kramer, M. D. The Borrelia burgdorferi flagellum-associated 41-kilodalton antigen (flagellin): molecular cloning, expression, and amplification of the gene. Infect. Immun. 58 (6), 1711-1719 (1990).
- Picken, R. N. Polymerase chain reaction primers and probes derived from flagellin gene sequences for specific detection of the agents of Lyme disease and North American relapsing fever. J. Clin. Microbiol. 30 (1), 99-114 (1992).
- Picken, M. M., Picken, R. N., Han, D., Cheng, Y., Strle, F. Single-tube nested polymerase chain reaction assay based on flagellin gene sequences for detection ofBorrelia burgdorferi sensu lato. Eur. J. Clin. Microbiol. Infect. Dis. 15 (6), 489-498 (1996).
- Keirans, J. E., Litwak, T. R. Pictorial key to the adults of hard ticks, family Ixodidae (Ixodida: Ixodoidea), east of the Mississippi River. J. Med. Entomol. 26 (5), 435-448 (1989).
- Lorenz, T. C. Polymerase Chain Reaction: Basic Protocol Plus Troubleshooting and Optimization Strategies. J Vis Exp. (63), e3998 (2012).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose Gel Electrophoresis for the Separation of DNA Fragments. J Vis Exp. (62), e3923 (2012).
- Sapi, E., Pabbati, N., Datar, A., Davies, E. M., Rattelle, A., Kuo, B. A. Improved culture conditions for the growth and detection of Borrelia from human serum. Int J Med Sci. 10 (4), 362-376 (2013).
- Waddell, L. A., Greig, J., Mascarenhas, M., Harding, S., Lindsay, R., Ogden, N. The Accuracy of Diagnostic Tests for Lyme Disease in Humans, A Systematic Review and Meta-Analysis of North American Research. PLoS ONE. 11 (12), e0168613-e0168623 (2016).
- Brunet, L. R., Spielman, A., Telford, S. R. Density of Lyme disease spirochetes within deer ticks collected from zoonotic sites. Am. J. Trop. Med. Hyg. 53 (3), 300-302 (1995).
- Wang, G., et al. Real-time PCR for simultaneous detection and quantification of Borrelia burgdorferi in field-collected Ixodes scapularis ticks from the Northeastern United States. Appl. Environ. Microbiol. 69 (8), 4561-4565 (2003).
- King, J. L., Smith, A. D., Mitchell, E. A., Allen, M. S. Validation of droplet digital PCR for the detection and absolute quantification of Borrelia DNA in Ixodes scapularis ticks. Parasitology. 144 (4), 359-367 (2017).
- Ye, J., Coulouris, G., Zaretskaya, I., Cutcutache, I., Rozen, S., Madden, T. L. Primer-BLAST: a tool to design target-specific primers for polymerase chain reaction. BMC Bioinformatics. 13 (1), 134 (2012).
- Kwok, S., Higuchi, R. Avoiding false positives with PCR. Nature. 339 (6221), 237-238 (1989).
- Rys, P. N., Persing, D. H. Preventing false positives: quantitative evaluation of three protocols for inactivation of polymerase chain reaction amplification products. J. Clin. Microbiol. 31 (9), 2356-2360 (1993).
- Pahl, A., Kühlbrandt, U., Brune, K., Röllinghoff, M., Gessner, A. Quantitative detection of Borrelia burgdorferi by real-time PCR. J. Clin. Microbiol. 37 (6), 1958-1963 (1999).
- Saidac, D. S., Marras, S. A. E., Parveen, N. Detection and quantification of Lyme spirochetes using sensitive and specific molecular beacon probes. BMC Microbiol. 9 (1), 43 (2009).
- Chan, K., Marras, S. A. E., Parveen, N. Sensitive multiplex PCR assay to differentiate Lyme spirochetes and emerging pathogens Anaplasma phagocytophilum and Babesia microti. BMC Microbiol. 13 (1), 295 (2013).
- Schlachter, S., Chan, K., Marras, S. A. E., Parveen, N. Detection and Differentiation of Lyme Spirochetes and Other Tick-Borne Pathogens from Blood Using Real-Time PCR with Molecular Beacons. Methods Mol. Biol. 1616, 155-170 (2017).
- Wang, L., Blasic, J. R., Holden, M. J., Pires, R. Sensitivity comparison of real-time PCR probe designs on a model DNA plasmid. Anal. Biochem. 344 (2), 257-265 (2005).
- Sze, M. A., Abbasi, M., Hogg, J. C., Sin, D. D. A Comparison between Droplet Digital and Quantitative PCR in the Analysis of Bacterial 16S Load in Lung Tissue Samples from Control and COPD GOLD 2. PLos ONE. 9 (10), e110351-e110356 (2014).
- Sperling, J. L., et al. Comparison of bacterial 16S rRNA variable regions for microbiome surveys of ticks. Ticks Tick Borne Dis. , 1-9 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved