Method Article
중첩된 한 PCR를 사용 하 여 틱에서 라임 질병 스피로, 보렐 리아 Burgdorferi, 감지
요약
중첩 된 PCR 틱 보렐 리아 burgdorferi, Lyme 질병의 원인이 되는 에이전트에 대 한 조사를 DNA 추출에 적용 될 수 있는 민감한, 특정, 그리고 간단한 기술입니다. 초기 PCR 실험 유전자 특정 뇌관을 사용 하 여 내부 뇌관을 사용 하 여 후속 반응에 대 한 템플릿 되 긴 amplicons 생성.
초록
Lyme 질병 나 선상 세균 감염된 Ixodes 의 진드기에 물린 상처를 통해 인 간에 게 전송의 보렐 리아 burgdorferi sensu lato 가족에 의해 발생 한 심각한 벡터 품 어진 감염 이다. 북미 지역에서 1 차 etiological 대리인 보렐 리아 burgdorferi sensu stricto 이다. 지리적 위험 지역 확장, 그것은 진드기 감염 속도 측정 임상, 수 의사, 그리고 일반 대 중에 결과 전달할 수 있는 강력한 감시 프로그램을 지 원하는 것이 좋습니다. 중첩 된 중 합 효소 연쇄 반응 (nPCR)의 분자 기술을 오래이 목적을 위해 사용 되었습니다 그리고 그것 진드기와 야생 동물에 보렐 리아 의 검출에 중앙, 저렴 한, 그리고 강력한 접근 남아 있다.
이 문서에서는 감염된 표본 식별을 DNA 추출 틱 nPCR의 응용 프로그램을 보여 줍니다. 두 개의 독립적인 B. burgdorferi 대상, 유전자 인코딩 Flagellin B (군살) 및 외부 표면 단백질 A (OspA), 이 기법으로 광범위 하 게 사용 되어 왔습니다. 프로토콜 관련 틱 컬렉션, DNA 추출, 그리고 두 Borrelia의 각을 검출 하는 PCR의 초기 라운드-특정 loci. 이후 연쇄 반응 (PCR) 작고, 내부 증폭 조각을 생성 하 새 템플릿으로 첫 번째 반응의 제품을 사용 합니다. 중첩 된 접근 특이성 및 기존의 PCR의 민감도 향상 시킵니다. 틱 때 두 보렐 리아 유전자에서 내부 amplicons agarose 젤 전기 이동 법에 의해 검출 될 수 있다 병원 체에 대 한 긍정적으로 간주 됩니다.
서문
Lyme 질병 (LD), 북반구에서 가장 널리 퍼진 벡터 품 어진 감염 이며 그 발생률1증가 하 고. 이 쇠 약 질병은 라임 borreliosis (파운드) 복잡 한 (흔히 보렐 리아 burgdorferi sensu lato, 또는 s.l.), 역사적으로 지배적인 북미 병원 체, B. 구성의 spirocheteal 병원 균에 의해 발생 burgdorferi sensu stricto (s.s), B. afzelii 및 B. garinii, 유럽 및 아시아에 걸쳐 널리 고 신흥 임상 관련성2,3종의. 이 박테리아는 감염된 Ixodes 틱2. 의 바이트를 통해 인 간에 게 전달 주요 북미 벡터는 I. scapularis 그리고 I. pacificus, 항구 박테리아4전송 하이 속 내의 여러 종 발견 되었습니다. 인간에서는, B. burgdorferi 피부, 관절, 심장, 신 경계, 내 분 비 땀 샘, 위장, 그리고 내부 장기5,6,7에 영향을 미치는 multisystem 증상을 일으킬 수 있습니다. 8,,910. 질병 통제 및 예방 센터는 현재 미국11,12에서 매년 30만 이상의 새로운 인간의 경우를 견적 한다. 연구와 치료 후 증상이 계속 권장된 항생제 처방을 받은 환자의 60% 10% 사이 아무 데도 그 때 질병 진단 및 초기 단계에서 치료 예 후를 유리한 자주 동안 제안 정지, 현상에서 게시물 치료 Lyme 질병 증후군 (PTLDS)13,,1415되 나. 또한, 임상 개입에 지연 진드기 바이트의 인식, 초기 질병의 일반적인 프레 젠 테이 션 및 감염의 발병에서 사용 될 때 전통적인 혈 청 학 기반 진단의 낮은 감도의 부족으로 인해 발생할 수 있습니다. 신속 하 고 적절 하 게 치료 하지 않으면 합병증16,17를 점점 더 쇠 약에서 증명할 수 있는 증상 진행을 수 있습니다. Lyme 질병 예방은 따라서 리스크 관리의 초석입니다. 이 성장 위협에 대처 하기 위해 전략 틱, 병원 체 보급을 나타내는 강력한 감시 조치를 포함 하 고 관심사의 지리적 영역을 식별.
이 문서에서는 감염 된 진드기를 식별 하는 분자 검사 도구로 중첩된 연쇄 반응 (nPCR)의 유틸리티를 보여줍니다. 특이성을 높이기 위해 두 보렐 리아 유전자 병렬 증폭에 사용 됩니다. Flagellin B (군살) 편18의 주요 필 라 멘 트 단백질 인코딩하고 외부 표면 단백질 A (OspA)의 단백 제품 틱 midgut 중재 동안 단일 선형 염색체에 있는 유전자 식민, 플라스 미드로 인코딩된19,20. 워크플로 구성 틱 컬렉션, DNA 추출, 그리고 보렐 리아를 검출 하는 PCR의 초기 라운드-특정 loci. 이후 PCR 작고, 내부 증폭 조각을 생성 하 새 템플릿으로 첫 번째 반응의 제품을 사용 합니다. 진드기는으로 간주 긍정적인 보렐 리아 burgdorferi 때 두 보렐 리아 유전자에서 내부 amplicons agarose 젤 전기 이동 법에 의해 검출 될 수 있다.
NPCR 기술 그리고 FlaB 및 OspA 유전자 대상, 널리 사용 된 생태 감시 및 초기 1990 년대21,,2223 이후 라임 spirochete의 임상 탐지 ,2425. 분자 프로토콜 개발, 이전 틱 subjecting 본질적인 내용을 안티-보렐 리아 면역 형광 검사 (면) 얼룩, 미생물 문화, 또는 조합을26평가 됐다. 이러한 접근 한계, 느린 성장 및 보렐 리아27, 항 체 성능 문제 및 IF 처리21라이브 틱의 요구의 까다로운 성격 등에서 고통. PCR 감염된 벡터의 빠른, 민감한, 그리고 특정 식별 제공 하기 위해 연속적으로 채택 되었다. 그것은 그렇지 않으면 될 하지 테스트21,22 적합 죽은 및 보관 된 틱 등 다양 한 견본 유형에 문화권 직접 응용 프로그램을 포함 한 전통적인 방법론 표시 된 개선 제안 . 중첩 된 실험적인 디자인 더 증폭25,28의 두 연속 라운드에서 유전자 특정 뇌관의 두 가지 세트를 채용 하 여 고전 PCR의 민감도와 특이성 향상.
실험 성공 비판적 amplicon 디자인과 전략적 유전자 선택에 따라 달라 집니다. 보렐 리아 burgdorferi의 존재를 정확 하 게 예측 하려면 뇌관 보렐 리아 속에 또한 회귀 열 나 선상 세균을 cross-reacting 없이 관련 병원 체를 탐지 해야 합니다. 군살, 경우이 특이성 유전자, 보다는 오히려 공유 하는 다양 한 박테리아 (그림 1)24,29 에 의해 상대적으로 보존된 측면에 서 시퀀스의 변수 내부 영역을 대상으로 이루어집니다. , 30.
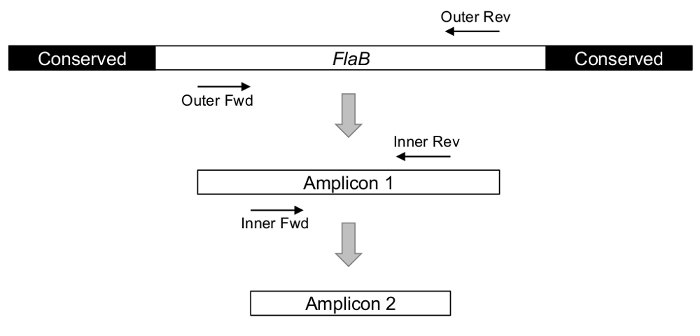
그림 1: nPCR, 같이 사용 하 여의 개념 보렐 리아 FlaB 유전자를 대상으로. 유전자의 5'과 3' 테르미니가이 지역 라임을 일으키는 병원 체의 특정 평가 대 한 부적 절 한 렌더링 보렐 리아 burgdorferi s.l. 넘어 생물에 공통 됩니다. 덜 보존 인테리어 시퀀스를 사용 하 여 뇌관 대상으로, PCR의 2 라운드 최종, 내부 amplicon 검색 실행 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
그들의 차별 능력의 시험에서 인테리어 FlaB 뇌관 80 개 이상의 다른 Borrelia 격리와 평가 되었고만 그 라임 병24와 관련 된 식별을 발견. NPCR의 낮은 검출 한계 문서화 되었습니다에서 624 사이의 순수한 문화에서 1031 박테리아 비록 감도 amplicon blotting 남쪽과 radiolabelled 교배 시키기에 의해 더욱 향상 시킬 수 있습니다 또는 chemiluminescent 프로브입니다. 커플링 기술 단일 spirochete31검출 임계값을 줄일 수 있습니다. 직접 비교 하 여 기존의 unprobed 단일 라운드 PCR 104 나 선상 세균31의 최소의 존재를 보고 발견 됐다. 그러나 그것은,, 복잡 한 환경 및 임상 샘플 없는 DNA 및 잠재적인 억제 물질의 압도적인 존재 때문에 작업할 때 분석 결과 감도 낮은 것 이다 주목 해야한다. 이러한 과제는 크게 nPCR의 사용에 의해 피할 수 있습니다.
지난 수십 년간에서 분자 기술 발전에 불구 하 고 nPCR 현대 감시 노력에 주식 기법을 남아 있습니다. 주의 디자인 및 실행이이 프로토콜의 경우 틱 벡터에 병원 체의 존재를 캡처, 적응력, 강력 하 고 비교적 간단 접근 이다.
프로토콜
1. DNA 별개로 틱
- 필드 컬렉션, 또는 수 의사와 공중의 구성원에서 수동 감시를 통해 진드기를 취득 합니다. 틱 해야 동결에 의해 살해, 봉인된 된 봉투에 배치 되며 실 온에서 발송.
- 제출 양식을 사용 하 여, 날짜와 만남, 틱 부착 상태, 호스트 종, 및 호스트의 최근 여행 역사의 지리적 위치에 대 한 정보를 수집 합니다.
- 중첩된 한 PCR 본질적으로 오염에 취약 한 이기 때문에, 실험실 작업 샘플의 크로스-노출을 최소화 하기 위해 설정 되어 확인 합니다. 이 프로토콜의 다른 요소를 철저 하 게 청소 하 고 소독, 서로 잘 분리 별도, 전용 공간에서 실행을 포함 하 고 모든 계측을 보장 하는 것은 오염 물질의 무료.
- 시료를 받으면 진드기 사진 하 고 식별 키32 종, 발달 단계, 섹스, 그리고 engorgement 상태를 비교 하 여 결정 합니다.
- 무 균 조건 하에서 무 균 면도날 또는 메스를 사용 하 여 눈금을 이등분 고 두 틱 조각 별도 microcentrifuge 관 합니다.
- 총 DNA 추출, PCR 호환 서식 파일;을 생성 하 어떤 격리 절차 사용 하 여 이 프로토콜에서는 간단한 chelation 기반 접근 방식을 보여 줍니다.
- 진드기 파편 용균성 킬레이트 시 약의 (수시로 50-200 µ L) 사이의 적절 한 볼륨을 추가 하 여 시작 합니다. 구체적인 금액 표본 크기와 engorgement 상태;에 따라 달라 집니다. 지침 서는 제조 업체에 의해 제공 되어야 한다. 균질 microtube 방 앗 공이 사용 하 여.
- 짧게 45 분, 그리고 소용돌이 60 ° C에서 물 욕조에 샘플을 품 어.
- 데스크톱 microcentrifuge에서 16,276 x g (13300 rpm)에서 4 분에 대 한 샘플을 원심.
- 50 µ L 소 프로 파 놀, 반전, 그리고 다시 (1.2.3)에서 원심에 의해 혼합을 포함 하는 신선한, 레이블이 microtube 상쾌한 전송.
- 상쾌한, 가만히 따르다와 DNA 펠 릿의 70% 에탄올 50 µ L와 린스.
- 초과 에탄올을 피 펫을 제거 하 고 실 온에서 15 분 동안 건조를 펠 릿을 허용.
- Resuspend DNA, 1 mM Tris pH 7.0의 50 µ L을 추가 하 고 60 ° c.에 1 시간을 위한 물 욕조에 샘플을 품 어 DNA는 이제 미래 분자 분석-20 ° C에 저장할 수 있습니다.
2. 중첩 된 PCR Borrelia OspA FlaB의 탐지.
참고: 일반적인 PCR 원칙 및 관행에 대 한 개요는 로렌스, 201233에 의해 제공 됩니다.
- 합성 또는 보렐 리아 유전자 특정 외부 및 내부 oligonucleotide 뇌관을 얻을. 뇌관 세트, 그들의 각각 amplicon 크기, 및 녹는 온도 대 한 표 1 을 참조 하십시오.
| 뇌관 이름 | 진 대상 | 시퀀스 (5'-3') | Amplicon 크기 | 어 닐 링 온도 | |
| Fw 아웃 flaB | 군살 | gcatcactttcagggtctca | 503 혈압 | 55 ° C | |
| Rv가 밖으로 군살 | 군살 | tggggaacttgattagcctg | |||
| Fw에 flaB | 군살 | ctttaagagttcatgttggag | 447 혈압 | 58 ° C | |
| Rv에 flaB | 군살 | tcattgccattgcagattgt | |||
| OspA 아웃 Fw | OspA | cttgaagttttcaaagaagat | 487 혈압 | 55 ° C | |
| OspA 아웃 Rv | OspA | caactgctgacccctctaat | |||
| Fw에 OspA | OspA | acaagagcagacggaaccag | 350 혈압 | 58 ° C | |
| OspA Rv | OspA | ttggtgccatttgagtcgta | |||
표 1: 내부 및 외부 뇌관 Borrelia burgdorferiFlaB 및 OspA nPCR에 대 한.
실제로, FlaB 뇌관 B. burgdorferi s.s. 등 밀접 한 보렐 리아 genospecies OspA 뇌관만 B. burgdorferi s.s. 캡처 동안 감지 두 loci에서 증폭 B. 나타냅니다 burgdorferi. s.s.
- 미리 소독 UV 빛과 70% 에탄올과 PCR 캐비닛.
참고: 잠재적인 샘플 오염을 최소화 하려면이 작업 한다 틱 해 부, DNA 추출의 위치에서 되며 젤 전기 이동 법.- 초기 PCR 실행에 대 한 외부 뇌관을 사용 하 여 DNA 1.0, 위의 단계에서 복구 하 고 반응 혼합물 표 2에 설명 된 대로 템플릿와 함께. 동시에 긍정적인 제어 실행 확인된 보렐 리아 DNA의 구성 하 고 부정적인 제어 없음 템플릿 반응 시 약 및에 어로 졸 오염 감지를 포함 하 여 실행을 수행 합니다. 시 약의 잠재적인 오염을 최소화 하기 위해 끝에 DNA를 추가 합니다. 각 튜브 시 약의 추가 되지 및 DNA 추가 후 즉시 및 다른 튜브 열 전에 튜브를 닫을 때 항상 모든 닫힌 확인 하십시오.
- 다음과 같이 열 cycler 프로그램: 95 ° C 5 분; 15 95 ° C의 40 주기 어 닐 링 온도 30 s s, 45 72 ° C s; 72 ° C 5 분; 4 ° c.에서 개최
- 2 µ L의 첫 번째 PCR 제품 (2.2.2에서 생산)와 내부 뇌관을 사용 하 여 제외 하 고 첫 번째 반응에 유사한 PCR의 두번째 라운드를 수행 합니다.
참고: 반응 볼륨 다시 표 2에 제공 됩니다. 서식 파일 DNA 마지막 추가 되 고 한 번에 하나의 샘플에 해당 하는 관은 오픈 함으로써 amplicons의 교차 오염을 방지 하려면 주의 해야 합니다.
표 2: 첫 번째 및 두 번째 확대에 대 한 PCR 반응 혼합물.구성 요소 PCR # 1 볼륨 PCR # 2 볼륨 Taq 중 합 효소 마스터 믹스 2 X 12.5 Μ L 12.5 Μ L Nuclease 무료 물 8.5 Μ L 8.5 Μ L 10 µ M 앞으로 반전 뇌관 1.0 µ L 외부 뇌관 1.0 µ L 내부 뇌관 DNA 템플렛 샘플 추출 (1.2.7)에서 2.0 µ L PCR (2.2.2)의 1 라운드에서 2.0 µ L
- 이전, 열 cycler 프로그램 하지만 내부 뇌관 (표 1 참조)에 맞게 어 닐 링 온도 조정.
3. Agarose 젤 전기 이동 법 및 이미징
참고: 기본 DNA 전기 이동 법으로 분리, 참조 리 외. 2012,34.
- 20 X SB 버퍼 (0.2 M NaOH, 0.8 M 붕 소의 산 성 pH 8), 1 X, 희석을 사용 하 여 1.2 %agarose 젤 준비 하 고 바란다면 미리 젤의 얼룩은 따르고, 전에 DNA 얼룩의 약 5 µ L를 추가 합니다.
- 10 µ L의 각 실험에서 두 번째 (내부) PCR 반응에서 제품 및 제어 샘플 100 bp 사다리 (5 µ L)와 함께 로드 합니다.
- 107에서 1 h electrophorese V (5V/cm).
- 보기 및 문서는 transilluminator와 연결 된 카메라와 소프트웨어를 사용 하 여 젤.
결과
nPCR 복잡 한 환경 샘플 조사를 받고 있을 때 특히 특이성 및 병원 체 검출의 감도 증가 하는 우아한 접근 이다. 그림 1에서 같이, 보렐 리아 FlaB 로커 스 (및 OspA, 사진 안)의 전략적 영역을 대상으로 하는 PCR의 2 라운드 짧은 내부의 세대를 통해 보렐 리아 burgdorferi 박테리아의 존재를 보고할 수 있습니다. amplicons입니다. 젤 전기 이동 법으로 해결 하는 경우 각 틱에서 FlaB 와 OspA 반응 제품 시각적으로 득점 고 컨트롤에 대 한 비교. 그림 2를 독특한 견본 식별자 각 젤 상단의 제공 되며 노 템플릿과 졸 컨트롤 표시 됩니다 맨 왼쪽 및 오른쪽, 각각, 사다리에 인접 한.
강력한 amplicon 밴드 선택 실험 샘플에서 명확 하 게 볼 수 있습니다 그리고 그들은 쉽게 과잉 뇌관 및 잔여 DNA (그림 2)에서 고유. 명시 된 실험 설계 원칙에 따라, 진드기가 여겨진다 긍정적인 보렐 리아 때 부정적인 컨트롤 설명 없음 증폭, 및 내부 amplicons FlaB 와 OspA 뇌관에서 생산 됩니다에 병렬에 대 한. 이 경우에, T907, T604, 및 T606 표본 라임 병원 체 (그림 2)에 대 한 감시 기준을 만났다. By contrast, T923 OspA, 결과는 여러 가지 이유가 있다에 대 한 긍정적인만 했다: A) 원래 틱 보렐 리아에 대 한 부정적인 했지만 외부 또는 내부 OspA PCR 준비 가짜로 오염 된 서식 파일 DNA (참고 시 약의 전신 오염 부정적인 컨트롤을 통해 밖으로 지배 되었다), B) 진드기 수행 라임 보렐 리아, 하지만 낮은 템플릿 금액 또는 실험 오류 방지 FlaB또는 C의 증폭) 유기 체는 그 보존된 OspA 시퀀스를 포함 하지만 Flagellin 부족 또는 뇌관을 anneal 하 FlaB 의 대상된 지역에서 부족 정체성을 했다. 실제로, OspA 시퀀스 유사 생물, 식물 및 동물28등의 다양 한 지적 되었습니다. 대화 상황, 더 증폭 Flagellin 유전자, 하지만 하지 OspA 유전자 보존, 관련된 보렐 리아 종족을 나타낼 수 있습니다. 실제로,이 프로토콜 FlaB 뇌관, 시나리오 'A'가 가장 가능성이 설명 제안 하는 것 보다 더 많은 OspA 단일 긍정적인 결과 생성 합니다. 그러나 논쟁 적인 견본의 추가 실험 분석, 없이, 아니다 단일 긍정적인 결과의 소스를 확인할 수 없습니다. 가짜로 이전 반응에 도입 된 어떤 오염 물질 보관 된 DNA에 존재 하지 않을 것 이다 이후 그들의 진정한 상태를 조정 하 모호 샘플에 수행 하는 기술 복제의 수를 증가 도움이 됩니다. 그러나, 이러한 뇌관으로 후속 반응 결정적인 결과 제공 하지, 다른 Borrelia loci PCR에 의해 조사 될 수 있습니다. 이 반응에서 생성 된 Amplicons 또한 시퀀싱 하 고 격리 id를 할당 하 고 스트레인 분기의 정도 추정 하 중 비교 수 있습니다. Sapi와 동료 인간의 임상 샘플35를 사용 하 여이 워크플로의 예를 제공 합니다.
모든 요인을 고려, 개요 프로토콜 및 해석 조건을 각각 0.0063%와 0.17%의 거짓 긍정과 거짓 부정적인 요금을 생성 견적 되었다.
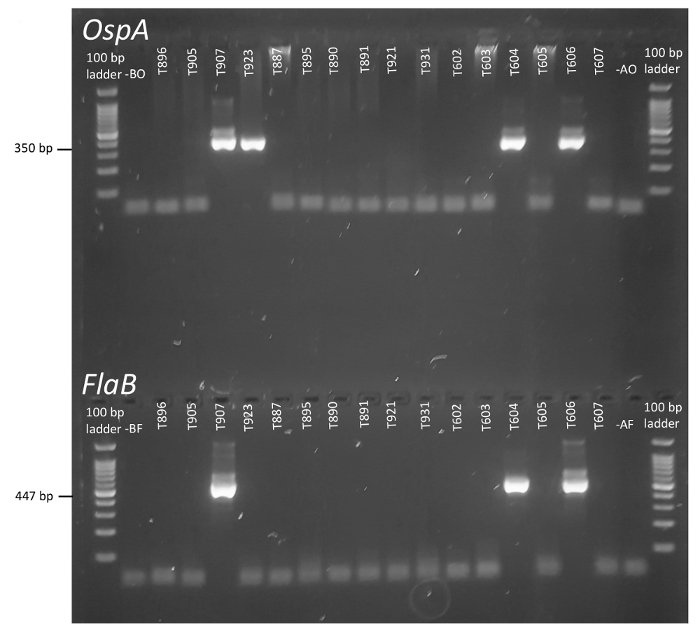
그림 2 :의 보렐 리아 burgdorferi nPCR의 의해 개별 틱 군살 그리고 OspA. 각 눈금에 할당 된 코드는 젤의 위쪽에 표시 되 고 정체성 각 표본에서 OspA FlaB 의 탐지를 보고 맞춤. 레인 (오른쪽 차선)는 실험실 환경 오염을 잡으려고 졸 컨트롤 이미지 대표 노-템플릿 컨트롤의 왼쪽에서 B를 받을 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
사용의 년간 PCR 기반 기술을 일관 되 게 입증 Borrelia 의 검출에 그들의 가치 arthropod와 포유류 표본에서 보렐 리아 환경 또는 임상에서 온 여부. PCR 감시를 기존의 방법 많은 개선을 제공합니다. 특히, 그것은 개발 및 항 체 시 약의 성능에 의존 하 고 대신 적용할 수 있습니다 쉽게 단순히 뇌관 시퀀스를 수정 하 여 관심의 새로운 목표를 검출 하기. 독립적으로 또는 다중 반응을 통해 PCR는 또한 동시에 여러 개의 loci의 평가 수용 한다. 그것은 신선 하 고 보관 된 틱22, 동물 또는 인간의 체액 및 절제 조직25를 포함 하 여 다양 한 표본 입력에 적용할 수 있습니다. PCR amplicons 처리할 수 있는 추가, 예를 들면 금지 효소 소화, 프로브 교 잡, 또는 시퀀싱, 미생물 정체성21에 증가 된 통찰력을 제공 하 여 생성 됩니다.
임상 도구로 PCR 바람직합니다 개념적으로 표준 혈 청 학적인 진단에 감염의 보조 수단으로 호스트 면역 반응에 의존 하는 것 보다는 세균 존재의 직접적인 표시를 제공 합니다. 그러나, 라임 borreliosis 상대적으로 겸손 한 미생물 부담으로 연결 됩니다 (< 소변 또는 플라즈마의 50 생물/mL) 및 false 네거티브를 야기할 수 있는 일시적인 spirochetemia 결과25. 병원에서이 기법의 감도 조직 유형, 감염, 및 샘플 상태의 단계 12.5%와 혈액, 중추 신 경계, 그리고 biopsied 조직36의 기존 연구에서 62% 사이 떨어지는 상당히 다릅니다. 그러나 분자 감도 제한 되지 않습니다 우려 PCR은 세균성 문화, 이후 착수 하는 경우 복구 가능한 나 선상 세균의 임상 표본에서 마찬가지로 어려운 입증 했다. 최근에 프로토콜 높은 수익률35에 대 한 최적화 되었습니다. 한편, 감염된 된 성인 진드기의 용기 수 항구 평균 어디 2000에서 50000 이상의 보렐 리아37,38,39, 단단하게 nPCR의 감지 범위 내에서입니다. 따라서, 프로토콜은 틱 감시 활동에 적합 합니다.
그 많은 장점에도 불구 하 고 특정 도전과 정확 하 게 보고 진드기 감염 따라서 유전자 그리고 amplicons, 품질 DNA를 복구 하는 세심 한 실험 워크플로의 전략적 선택에 따라이 기술 수 nPCR 포즈지 않습니다. 크로스-노출의 샘플, 그리고 실험실 환경 및 시 약에서 오염 물질을 보고할 수 있는 적절 한 컨트롤의 사용을 최소화 하면서의 표본에서 어떤 실험에 앞서 범위와 조사 의도 정의 되어야 한다 명확 하 게 되도록 적절 한 유전 loci과 지역, 선택할 수 있습니다. 목적은 라임을 일으키는 보렐 리아 burgdorferi s.l. 복잡 한에 대 한 편견된 화면을 제공 하는, 모두 비슷한 선호도와 관련 된 긴장을 검출 하기 위하여 뇌관을 생성 해야 하 고 증폭 효율, 캡처 없이 무관 유기 체25. 새로운 뇌관 디자인 될 수 있다 고 평가 철에 비록 그들은 또한 유효성을 검사 해야 실험적으로 표준 참조에 대 한 뇌관 폭발40, 같은 소프트웨어 도구를 사용 하 여 새롭거나 샘플에 적용 되 고 전에 격리. DNA 추출 절차의 목표 혼합된 환경 샘플 (틱 homogenate)에서 그대로 미생물 서식 파일을 복구 하는 것입니다. PCR 진행 하기 전에 단계는 선택적 추출 된 DNA의 무결성을 평가 하는 것입니다. 또한, 병렬 반응 수 설정할 수 틱에 하우스키핑 유전자를 대상으로. 두 번째 방법은 반응 혼합물, 제공 하 고 증가 자신감을 부정적인 보렐 리아 반응 유기 체, 그리고 하지 억제 오염 물질의 존재 때문에 억제제의 존재를 나타낼 수도 있습니다.
중첩 된 PCR 방법의 감도 증가 거짓 양성 결과 생성 하는 잠재적인 오염 비용으로 온다. 틱 해 부 및 DNA 복구 동안 또는 외부 및 내부 증폭 반응을 설정 하는 과정 외 인 템플릿 샘플 소개 수 있습니다. 그것은 따라서 템플릿이나 amplicon 피하기 위해 PCR 위한 최상의 연습 프로토콜에 따라 특히 중요 한 교차 오염. 이 PCR 및 생물 안전 캐비닛에 독립적인 기류, 봉쇄와 별도 워크 스테이션의 사용을 포함 적절 한, 철저 한 화학 및 물리적 청소와 표면 및 시 약, 살 균 및 DNA 의 신중한 처리 41. 아니-템플릿 컨트롤은 또한 재고 시 약의 오염 식별에 중요 한. NPCR의 특정 취약점을 처리 하는 amplicon 발생 두 번째 PCR 선박에 첫 번째 반응의 제품을 전송 하는 경우입니다. 이후 대상 DNA 이미 긍정적인 샘플 지 수 농축 겪은,이 단계는 교차 오염을, 특히 경향이 그리고 단일 튜브 nPCR 프로토콜이이 한계를 우회 하도록 개발 되었습니다. 이 방법에서는, 주어진된 유전자를 위한 뇌관의 두 세트는 PCR31의 두 라운드 봉인 남아 있는 반응 관에 함께 추가 됩니다. 외부 및 내부 뇌관 쌍 외부 몇 증폭 템플릿의 내부 프라이 머에 대 한 금지는 높은 어 닐 링 온도에서 그런 열역학으로 고유 해야 합니다. 두 번째 라운드에서 어 닐 링 온도 내부 쌍에 맞게 낮 췄 다. 뿐만 아니라이 잠재적으로 혼란 단계를 무시, 그것은 또한 추가의 사용 방지 오염 측정31,42. 그러나,이 수정 일부 시험 감도 희생 수 있습니다. 접근 방식에는 샘플에 독립적으로 수행 하는 기술 복제의 수를 증가 가짜 감염을 식별 하 데 도움이 됩니다.
분자 기술, nPCR의 도입 이후 진화를 계속 하 고 이러한 새로운 접근 선택 이점이 원래 디자인을 제공 하는 금융 비용 증가에 불구 하 고. 마찬가지로 이름이 있듯이, 정량 PCR (정량 또는 진짜 시간 (RT)-PCR) 기존의 기법 자연43질적 동안 샘플, 병원 체의 열거에 대 한 수 있습니다. 정량의 감도가 비슷합니다 보도 nPCR38의 뇌관 특성28에 따라 변동 될 수 있지만. 기존의 TaqMan 프로브 대신 분자 비콘 (MB)를 사용 하 여 정량의 변화는 또한 임상 표본44,,4546에 보렐 리아 의 검출에 약속을 보여주었다. 그들의 독특한 보조 구조 때문 분자 비콘 보도 낮은 배경 형광 및 그로 인하여 제공 탁월한 감도47높은 합법적인 신호를 생성 합니다. 전 임상 평가 제안 하나, 10 나 선상 세균44,45사이 잠재적인 검출 임계값. 또한, 기술은 멀티플렉스 반응을 동시에 포유류 호스트 유전자44 및45의 다른 tick-borne 병원 균 감지는 nPCR과 같이 쉽게 달성에서 성공적으로 적용 되었다. 다른 디자인 수정 포함 표준 곡선39,48를 사용 하지 않고 DNA를 계량 수 방울 디지털 PCR (ddPCR) 기술. 보렐 리아 에 대 한이 기술의 낮은 검출 한계는 똑같이 약 10 나 선상 세균/샘플39이다. NPCR에 비해, 이러한 접근 또한 이점을 오염, 감소 잠재력의 그들은 단일 증폭 프로토콜을 필요로.
감시의 목적은 프로 틱의 다양 한 세균성 내용 대신 경우 16S rRNA metagenomic 심사는 매력적인 옵션49이다. 그것은 정확 하 게 더 많은 미생물의 광범위 한 스펙트럼을 캡처할 수 있습니다 있지만이 이렇게 costlier, 모든 분자 생물학 실험실에서 찾을 수 없는 특수 DNA 시퀀서 필요 필요로 보다 정교한 생물 정보학 기반 해석, 벡터의 병원 체 로드를 나타냅니다.
정량 및 그 유도체는 양적 응용 프로그램에 대 한 선택의 방법 metagenomics 화면 틱 미생물의 광범위 한 재고를 제공 하는 동안 대상된 감시 노력은 종종 염려의 유무의 이진 보고 벡터에 하나 또는 소수의 병원 이러한 상황에서이 최신, 더 정교한 접근 과정에 불필요 한 복잡성과 재정 부담이 발생할 수 있습니다. 이러한 이유로, nPCR 틱 테스트에서 중추적인 기법으로 시간 시험을 성장 했다.
공개
저자는 공개 없다.
감사의 말
뇌관 디자인을 위해 카 미 해리스, 애슐리 McKibbon 촬영, 제시카 토마스 Ebbett 죤 Blakely, 알렉산드라 폴 리-Eby, 크리스 랭 글 리, 줄리 루이스, 켈 시 매 킨 타이어, 애슐리 McKibbon, 크리스 하느님, 그리고로 지에 대 한 개 감사 하고자 하는 저자는 비디오입니다. A. M. K. 캐나다 라임 질병 연구 재단에 의해 지원 되었다 그리고 프로젝트 자금 자연과학 및 캐나다 엔지니어링 연구 위원회 (NSERC)에 의해 제공 했다. M. K. B. W. 급여 자금 뉴 브 런 즈 윅 혁신 재단 (NBIF)에서 받았다.
자료
| Name | Company | Catalog Number | Comments |
| LabGard Class II, Type A2 biological safety cabinet | Nuaire | ES AIR NU-543 | |
| Razor blades | VWR | 55411-050 | 0.22 mm thickness |
| Microfuge Tubes (Microtubes 1.5 mL) | Axygen | 311-08-051 | |
| AquaGenomic | MultiTarget Pharmaceuticals | 2030 | DNA extraction reagent |
| Microtube Pestle | Diamed | DIATEC610-1551 | Designed for 1.5 ml tubes |
| Water bath - Isotemp 202 | Fishse Scientific | 15-462-2 | |
| Vortex | Labnet | S0100 CAN | |
| Spectrafuge 24D Digital Microcentrifuge | Labnet | C2400 | |
| Isopropanol | Sigma-Aldrich | 190764 | |
| BIS-TRIS | Sigma-Aldrich | B9754 | |
| Primer Synthesis | Sigma-Aldrich | OLIGO | |
| PCR Cabinet | Misonix | PCR6-482 | |
| PCR tube with attached flat caps 0.2mL | VWR | 20170-012 | |
| GoTaq Green Master Mix 2x | Promega | M7123 | |
| Nuclease-free water | Promega | M7123 | The water comes with the GTG |
| Spectrafuge Mini | Labnet | C1301 | |
| SYBR Safe DNA Stain 10,000X Concentration | EDVOTEK | 608 | |
| Froggarose LE (Molecular Biology Grade Agarose) | FroggaBio | A87-500G | |
| GD 100 bp DNA Ladder | FroggaBio | DM001-R500 | |
| Electrophoresis power pack | VWR | VWR 105 | EC Apparatus Corporation |
| Fluor-S MultiImager | BioRad | 170-7700 (Serial number 433B0154) | |
| Quantity One 1-D Analysis Software (V. 4.5.2) | BioRad | 1709600 |
참고문헌
- Schotthoefer, A. M., Frost, H. M. Ecology and epidemiology of Lyme borreliosis. Clin. Lab. Med. 35 (4), 723-743 (2015).
- Franke, J., Hildebrandt, A., Dorn, W. Exploring gaps in our knowledge on Lyme borreliosis spirochaetes - Updates on complex heterogeneity, ecology, and pathogenicity. Ticks Tick Borne Dis. 4 (1-2), 11-25 (2013).
- Rudenko, N., Golovchenko, M., Vancova, M., Clark, K., Grubhoffer, L., Oliver, J. H. Isolation of live Borrelia burgdorferi sensu lato spirochaetes from patients with undefined disorders and symptoms not typical for Lyme borreliosis. Clin. Microbiol. Infect. 22 (3), 267.e9-267.e15 (2016).
- Scott, J. D., Clark, K. L., Anderson, J. F., Foley, J. E., Young, M. R., Durden, L. A. Lyme Disease Bacterium, Borrelia burgdorferi Sensu Lato, Detected in Multiple Tick Species at Species at Kenora, Ontario, Canada. J Bacteriol Parasitol. 08 (01), 1-10 (2017).
- Sperling, J., Middelveen, M., Klein, D., Sperling, F. Evolving perspectives on lyme borreliosis in Canada. Open Neurol J. 6, 94-103 (2012).
- Pachner, A. R. Early disseminated Lyme disease: Lyme meningitis. Am. J. Med. 98 (Supplement 1), 30S-43S (1995).
- Mikkilä, H. O., Seppälä, I. J., Viljanen, M. K., Peltomaa, M. P., Karma, A. The expanding clinical spectrum of ocular lyme borreliosis. Ophthalmology. 107 (3), 581-587 (2000).
- Mc Causland, F. R., Niedermaier, S., Bijol, V., Rennke, H. G., Choi, M. E., Forman, J. P. Lyme disease-associated glomerulonephritis. Nephrol. Dial. Transplant. 26 (9), 3054-3056 (2011).
- Tunev, S. S., Hastey, C. J., Hodzic, E., Feng, S., Barthold, S. W., Baumgarth, N. Lymphoadenopathy during Lyme Borreliosis Is Caused by Spirochete Migration-Induced Specific B Cell Activation. PLoS Pathog. 7 (5), e1002066-e1002014 (2011).
- Kostić, T., et al. Manifestations of Lyme carditis. Int. J. Cardiol. 232, 24-32 (2017).
- Hinckley, A. F., et al. Lyme Disease Testing by Large Commercial Laboratories in the United States. Clin. Infect. Dis. 59 (5), 676-681 (2014).
- Nelson, C. A., et al. Incidence of Clinician-Diagnosed Lyme Disease, United States 2005-2010. Emerg. Infect. Dis. 21 (9), 1625-1631 (2015).
- Aucott, J. N., Rebman, A. W., Crowder, L. A., Kortte, K. B. Post-treatment Lyme disease syndrome symptomatology and the impact on life functioning: is there something here?. Qual Life Res. 22 (1), 75-84 (2012).
- Aucott, J. N., Crowder, L. A., Kortte, K. B. Development of a foundation for a case definition of post-treatment Lyme disease syndrome. Int. J. Infect. Dis. 17 (6), e443-e449 (2013).
- Adrion, E. R., Aucott, J., Lemke, K. W., Weiner, J. P. Health care costs, utilization and patterns of care following Lyme disease. PLoS ONE. , (2015).
- Cameron, D. J. Consequences of treatment delay in Lyme disease. Journal of Evaluation in Clinical Practice. 13 (3), 470-472 (2007).
- Johnson, L., Aylward, A., Stricker, R. B. Healthcare access and burden of care for patients with Lyme disease: a large United States survey. Health policy. 102 (1), 64-71 (2011).
- Motaleb, M. A., et al. Borrelia burgdorferi periplasmic flagella have both skeletal and motility functions. Proc. Natl. Acad. Sci. U.S.A. 97 (20), 10899-10904 (2000).
- Rosa, P. A., Tilly, K., Stewart, P. E. The burgeoning molecular genetics of the Lyme disease spirochaete. Nat. Rev. Microbiol. 3 (2), 129-143 (2005).
- Kenedy, M. R., Lenhart, T. R., Akins, D. R. The role of Borrelia burgdorferi outer surface proteins. FEMS Immunol. Med. Microbiol. 66 (1), 1-19 (2012).
- Persing, D. H., Telford, S. R., Spielman, A., Barthold, S. W. Detection of Borrelia burgdorferi infection in Ixodes dammini ticks with the polymerase chain reaction. J. Clin. Microbiol. 28 (3), 566-572 (1990).
- Persing, D. H., et al. Detection of Borrelia burgdorferi DNA in museum specimens of Ixodes dammini ticks. Science. 249 (4975), 1420-1423 (1990).
- Wise, D. J., Weaver, T. L. Detection of the Lyme disease bacterium, Borrelia burgdorferi, by using the polymerase chain reaction and a nonradioisotopic gene probe. J. Clin. Microbiol. 29 (7), 1523-1526 (1991).
- Johnson, B. J., Happ, C. M., Mayer, L. W., Piesman, J. Detection of Borrelia burgdorferi in ticks by species-specific amplification of the flagellin gene. Am. J. Trop. Med. Hyg. 47 (6), 730-741 (1992).
- Schmidt, B. L. PCR in laboratory diagnosis of human Borrelia burgdorferi infections. Clin. Microbiol. Rev. 10 (1), 185-201 (1997).
- Ogden, N. H., et al. Ixodes scapularis ticks collected by passive surveillance in Canada: analysis of geographic distribution and infection with Lyme borreliosis agent Borrelia burgdorferi. J. Med. Entomol. 43 (3), 600-609 (2006).
- Doern, G. V. Detection of selected fastidious bacteria. Clin. Infect. Dis. 30 (1), 166-173 (2000).
- Nolte, O. Nucleic Acid Amplification Based Diagnostic of Lyme (Neuro-)borreliosis - Lost in the Jungle of Methods, Targets, and Assays?. Open Neurol J. 6 (1), 129-139 (2012).
- Wallich, R., Moter, S. E., Simon, M. M., Ebnet, K., Heiberger, A., Kramer, M. D. The Borrelia burgdorferi flagellum-associated 41-kilodalton antigen (flagellin): molecular cloning, expression, and amplification of the gene. Infect. Immun. 58 (6), 1711-1719 (1990).
- Picken, R. N. Polymerase chain reaction primers and probes derived from flagellin gene sequences for specific detection of the agents of Lyme disease and North American relapsing fever. J. Clin. Microbiol. 30 (1), 99-114 (1992).
- Picken, M. M., Picken, R. N., Han, D., Cheng, Y., Strle, F. Single-tube nested polymerase chain reaction assay based on flagellin gene sequences for detection ofBorrelia burgdorferi sensu lato. Eur. J. Clin. Microbiol. Infect. Dis. 15 (6), 489-498 (1996).
- Keirans, J. E., Litwak, T. R. Pictorial key to the adults of hard ticks, family Ixodidae (Ixodida: Ixodoidea), east of the Mississippi River. J. Med. Entomol. 26 (5), 435-448 (1989).
- Lorenz, T. C. Polymerase Chain Reaction: Basic Protocol Plus Troubleshooting and Optimization Strategies. J Vis Exp. (63), e3998 (2012).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose Gel Electrophoresis for the Separation of DNA Fragments. J Vis Exp. (62), e3923 (2012).
- Sapi, E., Pabbati, N., Datar, A., Davies, E. M., Rattelle, A., Kuo, B. A. Improved culture conditions for the growth and detection of Borrelia from human serum. Int J Med Sci. 10 (4), 362-376 (2013).
- Waddell, L. A., Greig, J., Mascarenhas, M., Harding, S., Lindsay, R., Ogden, N. The Accuracy of Diagnostic Tests for Lyme Disease in Humans, A Systematic Review and Meta-Analysis of North American Research. PLoS ONE. 11 (12), e0168613-e0168623 (2016).
- Brunet, L. R., Spielman, A., Telford, S. R. Density of Lyme disease spirochetes within deer ticks collected from zoonotic sites. Am. J. Trop. Med. Hyg. 53 (3), 300-302 (1995).
- Wang, G., et al. Real-time PCR for simultaneous detection and quantification of Borrelia burgdorferi in field-collected Ixodes scapularis ticks from the Northeastern United States. Appl. Environ. Microbiol. 69 (8), 4561-4565 (2003).
- King, J. L., Smith, A. D., Mitchell, E. A., Allen, M. S. Validation of droplet digital PCR for the detection and absolute quantification of Borrelia DNA in Ixodes scapularis ticks. Parasitology. 144 (4), 359-367 (2017).
- Ye, J., Coulouris, G., Zaretskaya, I., Cutcutache, I., Rozen, S., Madden, T. L. Primer-BLAST: a tool to design target-specific primers for polymerase chain reaction. BMC Bioinformatics. 13 (1), 134 (2012).
- Kwok, S., Higuchi, R. Avoiding false positives with PCR. Nature. 339 (6221), 237-238 (1989).
- Rys, P. N., Persing, D. H. Preventing false positives: quantitative evaluation of three protocols for inactivation of polymerase chain reaction amplification products. J. Clin. Microbiol. 31 (9), 2356-2360 (1993).
- Pahl, A., Kühlbrandt, U., Brune, K., Röllinghoff, M., Gessner, A. Quantitative detection of Borrelia burgdorferi by real-time PCR. J. Clin. Microbiol. 37 (6), 1958-1963 (1999).
- Saidac, D. S., Marras, S. A. E., Parveen, N. Detection and quantification of Lyme spirochetes using sensitive and specific molecular beacon probes. BMC Microbiol. 9 (1), 43 (2009).
- Chan, K., Marras, S. A. E., Parveen, N. Sensitive multiplex PCR assay to differentiate Lyme spirochetes and emerging pathogens Anaplasma phagocytophilum and Babesia microti. BMC Microbiol. 13 (1), 295 (2013).
- Schlachter, S., Chan, K., Marras, S. A. E., Parveen, N. Detection and Differentiation of Lyme Spirochetes and Other Tick-Borne Pathogens from Blood Using Real-Time PCR with Molecular Beacons. Methods Mol. Biol. 1616, 155-170 (2017).
- Wang, L., Blasic, J. R., Holden, M. J., Pires, R. Sensitivity comparison of real-time PCR probe designs on a model DNA plasmid. Anal. Biochem. 344 (2), 257-265 (2005).
- Sze, M. A., Abbasi, M., Hogg, J. C., Sin, D. D. A Comparison between Droplet Digital and Quantitative PCR in the Analysis of Bacterial 16S Load in Lung Tissue Samples from Control and COPD GOLD 2. PLos ONE. 9 (10), e110351-e110356 (2014).
- Sperling, J. L., et al. Comparison of bacterial 16S rRNA variable regions for microbiome surveys of ticks. Ticks Tick Borne Dis. , 1-9 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유