Method Article
Das Lyme Krankheit Spirochete, Borrelia Burgdorferiin Zecken mit verschachtelten PCR zu erkennen
In diesem Artikel
Zusammenfassung
Nested PCR ist eine sensible, spezifische und einfache Technik, die Zecke kann, die DNA extrahiert angewendet werden, um Borrelia Burgdorferi, dem Erreger der Lyme-Borreliose untersuchen. Das erste PCR-Experiment verwendet gen-spezifische Primer, um lange Amplifikate zu generieren, die dann Vorlagen für eine nachfolgende Reaktion unter Verwendung der internen Zündkapseln werden.
Zusammenfassung
Lyme-Borreliose ist eine schwere Vektoren übertragene Infektion, die durch die Borrelia Burgdorferi Sensu Lato Familie der Spirochäten, verursacht wird, die durch den Biss von infizierten Ixodes Zecken auf den Menschen übertragen werden. Der primäre ätiologische Agent in Nordamerika ist Borrelia Burgdorferi Sensu Stricto. Als geografische Risikoregionen zu erweitern, ist es ratsam, robuste Überwachungsprogramme zu unterstützen, die können Tick Infektionsraten zu messen, und Ergebnisse, Ärzte, Tierärzte und der Öffentlichkeit zu kommunizieren. Die molekulare Technik der verschachtelten Polymerase-Kettenreaktion (nPCR) ist seit langem verwendet zu diesem Zweck, und es bleibt eine zentrale, billigen und robusten Ansatz in den Nachweis von Borrelien in Zecken und Wildtiere.
Dieser Artikel demonstriert die Anwendung der nPCR ankreuzen, DNA Extrakte zu infizierten Proben zu identifizieren. Zwei unabhängige B. Burgdorferi zielt, Gene codieren Flagellin B (FlaB) und Outer Surface Protein A (OspA), benutzt worden ausführlich mit dieser Technik. Das Protokoll beinhaltet Tick Sammlung, DNA-Extraktion und dann eine erste Runde der PCR, jeweils zwei Borrelienzu erkennen-spezifische Loci. Nachfolgenden Polymerase-Kettenreaktion (PCR) verwendet das Produkt der ersten Reaktion als eine neue Vorlage, um kleinere, interne Verstärkung Fragmente zu generieren. Die verschachtelte Ansatz verbessert die Spezifität und Sensitivität der konventionellen PCR. Eine Zecke gilt als positiv für den Erreger, wenn innere Amplifikate aus beiden Borrelien -Gene durch Agarose-Gelelektrophorese nachgewiesen werden können.
Einleitung
Lyme-Borreliose (LD) ist die am weitesten verbreiteten Vektoren übertragene Infektion in der nördlichen Hemisphäre, und die Inzidenz weiter um1zu erhöhen. Diese schwächende Krankheit wird verursacht durch spirocheteal Erreger der Lyme-Borreliose (LB) komplexe (gemeinhin als Borrelia Burgdorferi Sensu Lato oder s.l.), historisch die vorherrschende nordamerikanischen Erreger, B umfasst. Burgdorferi Sensu Stricto (SS), neben B. Afzelii und B. Garinii, die sind in Europa und Asien weit verbreitet, und Arten von neuen klinischen Relevanz2,3. Diese Bakterien sind für den Menschen durch den Biss von infizierten Ixodes Zecken2. übertragen. Obwohl die wichtigsten nordamerikanischen Vektoren I. Scapularis und I. Pacificussind, wurden mehrere Arten innerhalb dieser Gattung zu beherbergen und übertragen das Bakterium4gefunden. Beim Menschen verursachen B. Burgdorferi multisystemischen Symptome, die Auswirkungen auf die Haut, Gelenke, Herz, Nervensystem, endokrinen Drüsen, Magen-Darm-Trakt und inneren Organe5,6,7, 8,9,10. Das Center for Disease Control and Prevention schätzt derzeit mehr als 300.000 neue Fälle pro Jahr in den Vereinigten Staaten11,12. Während die Prognose oft günstig ist, wenn die Krankheit diagnostiziert und in den frühen Stadien behandelt, jedoch haben Studien gezeigt, dass überall zwischen 10 % und 60 % der Patienten, die die empfohlene antibiotische Therapie nach der Therapie Symptome weiterhin erhalten Einstellung, bezeichnet ein Phänomen Post Behandlung Lyme-Borreliose-Syndrom (PTLDS)13,14,15. Darüber hinaus können Verzögerungen in klinische Intervention aus Mangel an Bewusstsein für einen Zeckenstich, unspezifische Präsentation der ursprünglichen Krankheit, und die geringe Sensitivität der traditionellen Serologie-basierte Diagnostik bei Ausbruch der Infektion ergeben. Ausfall, rasch und angemessen zu behandeln kann Symptom Progression, die sich in immer mehr schwächenden Komplikationen16,17manifestieren kann. Lyme-Borreliose Prävention ist daher ein Eckpfeiler des Risiko-Managements. Strategien, um dieser wachsenden Bedrohung zu bekämpfen gehören robuste Überwachungsmaßnahmen um die Prävalenz der Erreger in Zecken anzugeben und geografische Regionen von Interesse zu identifizieren.
Dieser Artikel beschreibt das Dienstprogramm von verschachtelten Polymerase-Kettenreaktion (nPCR) als molekulare Screening-Instrument, um die infizierte Zecken zu identifizieren. Um die Spezifität zu erhöhen, sind zwei Borrelien Gene für parallele Verstärkung benutzt. Flagellin B (FlaB) kodiert ein großen Filament-Protein der Geissel18, und das Gen befindet sich auf der einzigen linearen Chromosom, während das Lipoprotein-Produkt des Outer Surface Protein A (OspA) Tick Mitteldarm vermittelt Kolonialisierung und Plasmid-kodierte19,20. Der Workflow besteht aus Tick Sammlung, DNA-Extraktion und dann eine erste Runde der PCR Borrelienerkennen-spezifische Loci. Anschließende PCR verwendet das Produkt der ersten Reaktion als eine neue Vorlage, um kleinere, interne Verstärkung Fragmente zu generieren. Eine Zecke gilt als positiv für Borrelia Burgdorferi , wenn innere Amplifikate aus beiden Borrelien -Gene durch Agarose-Gelelektrophorese nachgewiesen werden können.
Die nPCR Technik und Fettpölsterchen sowohl die OspA gen Ziele haben für ökologische Überwachung und klinischen Nachweis von Lyme Spirochäten seit den frühen 1990er Jahren21,22,23 weit verbreitet ,24,25. Vor der Entwicklung der molekularen Protokolle wurden Zecken von unterwirft Darminhalt zu beflecken Anti -Borrelia Immunfluoreszenz (IF), mikrobielle Kultur oder eine Kombination davon26bewertet. Diese Ansätze leiden inhärenten Beschränkungen, einschließlich des langsamen Wachstums und anspruchsvolle Art der Borrelien27, Antikörper-Performance-Probleme und das Erfordernis der live Zecken für IF Verarbeitung21. PCR wurde später angenommen, um schnelle, sensitive und spezifische Identifikation von infizierten Vektoren zur Verfügung zu stellen. Es bot deutliche Verbesserungen über die traditionellen Methodik, einschließlich kulturunabhängig direkte Anwendung auf verschiedenen Probenarten wie tot und archivierten Zecken, die sonst nicht geeignet zum Testen von21,22 . Verschachtelte experimentellen Designs weiter verbessert die Spezifität und Sensitivität der klassischen PCR durch den Einsatz von zwei unterschiedliche Sätze von Gen-spezifische Primer in zwei aufeinander folgenden Runden Verstärkung25,28.
Experimentelle Erfolg hängt entscheidend von strategischen gen Auswahl und Amplifikate Design. Um das Vorhandensein von Borrelia Burgdorferigenau abschätzen zu können, sollte Primer die relevanten Erreger erkennen, ohne kreuzreagierende mit Rückfallfieber Spirochäten auch in der Gattung Borrelia . Im Falle von Fettpölsterchenist diese Besonderheit erzielt durch die Ausrichtung auf eine interne Variable Region des Gens, anstatt die relativ erhaltenen flankierenden Sequenzen, die durch verschiedene Bakterien (Abbildung 1)24,29 geteilt werden , 30.
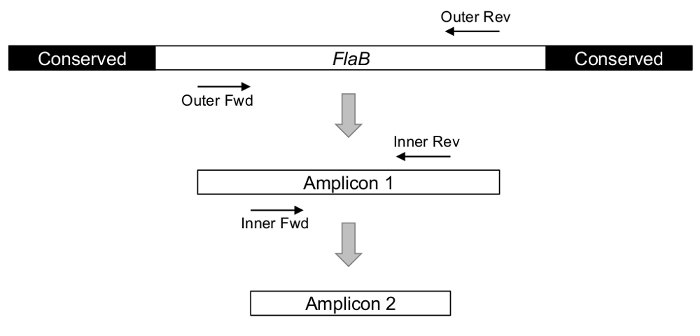
Abbildung 1: das Konzept der nPCR, wie abgebildet, mit Borrelien FlaB gen als Ziel. Der 5' und 3' Termini des Gens sind häufig auf Organismen über Borrelia Burgdorferi s.l., rendern diese Regionen ungeeignet für die spezifische Beurteilung der Lyme-verursachenden Erreger. Die weniger konserviert Innenraum Sequenzen als Grundierung Ziele verwenden, werden zwei Runden von PCR ausgeführt, um eine endgültige, interne Amplifikate zu erkennen. Bitte klicken Sie hier für eine größere Version dieser Figur.
In einem Test ihrer diskriminierenden Kapazitäten wurden innen FlaB -Primer mit über 80 verschiedenen Borrelien -Isolate ausgewertet und festgestellt, dass um nur diejenigen, die mit Lyme-Borreliose24verbunden zu ermitteln. Die untere Nachweisgrenze des nPCR wurde dokumentiert auf sechs24 bis zehn31 Bakterien aus Reinkultur, obwohl die Empfindlichkeit durch südliche Beflecken der Amplifikate und Hybridisierung ein möglicher weiter verbessert werden kann oder Chemilumineszenz-Sonde. Kupplung die Techniken reduziert die Nachweisgrenze auf einen einzigen Spirochete31. Durch direkten Vergleich ergab sich konventionelle, unprobed Einzel-Runde PCR, berichten die Präsenz von mindestens 104 Spirochäten31. Es sollte jedoch darauf hingewiesen, dass Assay Empfindlichkeit niedriger sein wird, bei der Arbeit mit komplexen Umwelt- und klinische Proben, durch die überwältigende Präsenz von unabhängigen DNA und mögliche hemmende Stoffe. Diese Herausforderungen können durch den Einsatz von nPCR weitgehend umgangen werden.
Trotz Fortschritten in der molekularen Technologien in den vergangenen Jahrzehnten bleibt nPCR eine Heftklammer Technik in modernen Überwachung Bemühungen. Wenn bei der Konzipierung und Durchführung dieses Protokolls geachtet wird, ist es leistungsfähig, anpassungsfähig und relativ unkompliziert Ansatz, das Vorhandensein von Krankheitserregern im Tick Vektoren zu erfassen.
Protokoll
1. DNA-Isolierung von Zecken
- Erwerben Sie Zecken über Feldauflistung oder passive Überwachung von Tierärzten und Mitgliedern der Öffentlichkeit. Zecken sollten getötet durch Einfrieren, platziert in einem versiegelten Beutel und verschickt bei Raumtemperatur.
- Verwenden ein Formular, informieren Sie sich auf das Datum und die geographische Lage der Begegnung, Tick Anlage Status, Wirtsarten und Zeitgeschichte reisen der Gastgeber.
- Da nested PCR von Natur aus anfällig für Verschmutzung ist, sicherzustellen Sie, dass die Labor-Arbeitsbereich eingerichtet wurde, dass Kreuz-minimieren der Proben. Dies beinhaltet Ausführung verschiedene Elemente des Protokolls in separaten, dedizierten Räumen gut voneinander isoliert, die gründlich gereinigt und sterilisiert werden, und um sicherzustellen, dass alle Instrumente sind frei von Verunreinigungen.
- Fotografieren Sie nach Erhalt der Probekörpers die Zecke zu und bestimmen Sie Arten, Entwicklungsstadium, Geschlecht und Milchstau Status im Vergleich zu einer Identifizierung wichtiger32 .
- Halbieren Sie unter aseptischen Bedingungen die Zecke mit Hilfe einer sterilen Rasierklinge oder einem Skalpell, und legen Sie die zwei Tick-Fragmente in separaten Mikrozentrifugenröhrchen.
- Um Gesamt-DNA zu extrahieren, verwenden Sie jede Isolierung-Prozedur, die PCR-kompatible Vorlage ergibt; Dieses Protokoll zeigt einen einfachen Chelat-basierten Ansatz.
- Zunächst fügen einem entsprechenden Volumen (oft zwischen 50-200 µL) eine lytische Chelat-Reagenz auf das Tick-Fragment. Die konkrete Höhe richtet sich nach der Probe Größe und Milchstau Status; Leitlinien sollten vom Hersteller bereitgestellt werden. Mit einem Reaktionscup Stößel zu homogenisieren.
- Inkubieren Sie Proben in einem Wasserbad bei 60 ° C für 45 min. und Vortex kurz.
- Zentrifugieren Sie Proben für 4 min bei 16.276 x g (13.300 u/min) in eine Desktop-Microcentrifuge.
- Übertragen Sie überstand auf eine frische, beschriftete Reaktionscup mit 50 µL Isopropanol, Mix von Inversion und Zentrifugieren Sie erneut wie in (1.2.3).
- Abgießen Sie den Überstand, und spülen Sie das DNA-Pellet mit 50 µL 70 % Ethanol.
- Entfernen Sie überschüssige Ethanol mit einer Pipette und lassen Sie das Pellet 15 min bei Raumtemperatur an der Luft trocknen.
- Aufschwemmen DNA, hinzufügen 50 µL 1 mM Tris pH 7.0 und inkubieren Sie Proben in einem Wasserbad für 1 h bei 60 ° C. Die DNA kann jetzt bei-20 ° C für künftige molekulare Analysen gespeichert werden.
2. nested PCR-Nachweis von Borrelien OspA und Fettpölsterchen.
Hinweis: Eine Übersicht über allgemeine PCR-Prinzipien und Praktiken wird von Lorenz, 201233bereitgestellt.
- Synthetisieren oder Borrelien äußeren und inneren Oligonukleotid-gen-spezifische Primer zu erhalten. Siehe Tabelle 1 für Grundierung Sets, ihre jeweiligen Amplikons Größen und Schmelztemperaturen.
| Primer-Name | Gen Ziel | Sequenz (5' - 3') | Größe der Amplifikate | Anlasstemperatur | |
| Fettpölsterchen, Fw | FlaB | gcatcactttcagggtctca | 503 bp | 55° C | |
| Fettpölsterchen, Rv | FlaB | tggggaacttgattagcctg | |||
| Fettpölsterchen In Fw | FlaB | ctttaagagttcatgttggag | 447 bp | 58° C | |
| Fettpölsterchen In Rv | FlaB | tcattgccattgcagattgt | |||
| OspA-Out Fw | OspA | cttgaagttttcaaagaagat | 487 bp | 55° C | |
| OspA-Out Rv | OspA | caactgctgacccctctaat | |||
| OspA In Fw | OspA | acaagagcagacggaaccag | 350 bp | 58° C | |
| OspA In Rv | OspA | ttggtgccatttgagtcgta | |||
Tabelle 1: Innere und äußere Primer für nPCR von Borrelia BurgdorferiFlaB und OspA.
In der Praxis die FlaB -Primer erkennen B. Burgdorferi s.s. und andere eng im Zusammenhang mit Borrelien Genospecies während OspA Primer nur B. Burgdorferi s.s. erfassen Verstärkung aus beiden Loci deutet darauf hin, B. Burgdorferi. s.s.
- Pre-sterilisieren Sie einen PCR-Schrank mit UV-Licht und 70 % Ethanol.
Hinweis: Um mögliche Kontamination der Probe zu minimieren, sollte in diesem Arbeitsbereich werden unterscheidet sich von der Lage der Zecke Dissektion, DNA-Extraktion, und gel-Elektrophorese.- Verwenden Sie für den ersten PCR-Lauf die äußere Primer in Verbindung mit der Vorlage, die DNA erholt oben in Schritt 1.0, die und richten Sie das Reaktionsgemisch wie in Tabelle 2beschrieben. Parallel führen Sie positive Control läuft bestehend aus verifizierten Borrelien DNA und Negativkontrolle läuft einschließlich keine-Vorlage Reaktionen um Reagenz und Aerosol Kontamination zu erkennen. Fügen Sie DNA am Ende um mögliche Verschmutzung von Reagenzien zu minimieren. Stellen Sie sicher, dass jedes Rohr überhaupt geschlossen ist, mal als Reagenzien werden nicht hinzugefügt und enge Röhren sofort nach Zugabe der DNA und bevor andere Röhren geöffnet werden.
- Programmieren einer Thermocycler folgendermaßen: 95 ° C für 5 min; 40 Zyklen von 95 ° C für 15 s, Ausglühen Temperatur für 30 s, 72 ° C für 45 s; 72 ° C für 5 min; und bei 4 ° c halten
- Führen Sie die zweite Runde der PCR ähnlich wie die erste Reaktion, außer inneren Primer mit 2 µL der ersten PCR-Produkt (hergestellt in 2.2.2) verwenden.
Hinweis: Reaktion Volumen sind wieder in Tabelle 2angegeben. Zur Vermeidung von Kreuzkontamination der Amplifikate indem sichergestellt wird, dass Vorlage DNA zuletzt hinzugefügt wird und dass nur Röhren entspricht einer Probe gleichzeitig geöffnet sind, muss darauf geachtet werden.
Tabelle 2: PCR Reaktionsmischungen für erste und zweite Vergrößerungen.Komponente PCR-# 1-Volumes PCR # 2 Bände Taq Polymerase Master Mix 2 X 12,5 ΜL 12,5 ΜL Nuklease-freies Wasser 8.5 ΜL 8.5 ΜL 10 µM Forward und Reverse Primer 1,0 µL äußere Primer 1,0 µL innere Primer DNA-Vorlage 2.0 µL, von der Probengewinnung (1.2.7) 2.0 µL aus Runde 1 der PCR (2.2.2)
- Programm der Thermocycler wie zuvor, aber passen Sie die Anlasstemperatur um die innere Primer zu berücksichtigen (siehe Tabelle 1).
(3) Agarose-Gelelektrophorese und Bildgebung
Hinweis: Grundlegende Anweisungen DNA durch Elektrophorese zu trennen, finden Sie unter Lee Et Al., 201234.
- Bereiten Sie eine 1,2 % Agarosegel mit 20 X SB Puffer (0,2 M NaOH, 0,8 M Borsäure pH 8), 1 X verdünnt und abschmecken Sie etwa 5 µL des Fleckes DNA vor dem Gießen, Pre-Färbung des Gels ist.
- Last 10 µL des Produkts von der zweiten (inneren) PCR-Reaktion aus jeder experimentellen und Kontrollprobe, neben einer 100 bp-Leiter (5 µL).
- Für 1 h bei 107 electrophorese V (5V/cm).
- Zeigen Sie an und dokumentieren Sie das Gel mit einem Transilluminator und zugehörigen Kamera und Software.
Ergebnisse
nPCR ist ein eleganter Ansatz zur Erhöhung der Spezifität und Sensitivität der Erregernachweis, insbesondere bei komplexen Umweltproben untersucht werden. Wie in Abbildung 1dargestellt, können zwei Runden von PCR gezielt eine strategisch wichtige Region der Borrelien FlaB Locus (und OspA, nicht im Bild) das Vorhandensein von Borrelia Burgdorferi -Bakterien durch die Generierung von kurzen inneren melden. Amplifikate. Wenn durch Gelelektrophorese gelöst, können die Fettpölsterchen und OspA Reaktionsprodukte aus jedem Tick visuell erzielte und Kontrollen verglichen. In Abbildung 2Unikat-IDs werden am oberen Rand jedes Gel zur Verfügung gestellt, und keine-Vorlage und Aerosol-Steuerelemente sind vertreten ganz links und rechts, bzw., angrenzend an den Leitern.
Robuste Amplikons Bands sind in ausgewählten experimentellen Proben deutlich sichtbar, und sie sind leicht zu unterscheiden von überschüssigen Primer und restliche DNA (Abbildung 2). Basierend auf den experimentellen Design Grundsätzen, eine Zecke positive Borrelien wenn parallel Negativkontrollen zeigen keine Verstärkung und inneren Amplifikate entstehen von Fettpölsterchen und OspA Primern gilt. In diesem Fall Kriterien Proben T907, T604 und T606 Überwachung für die Lyme-Erreger (Abbildung 2). Steckbrief, T923 war nur positiv für OspA, ein Ergebnis, dafür gibt es mehrere mögliche Erklärungen: A) die Zecke Ursprungs war negativ für Borrelien, aber die äußere oder innere OspA -PCR Zubereitung kontaminiert wurde fälschlicherweise mit Schablone DNA (Anmerkung, die systemische Kontamination von Reagenzien über Negativkontrollen ausgeschlossen wurde), B) das ticken getragene Lyme- Borrelien, aber niedrige Vorlage Beträge oder experimentellen Fehler verhindert Verstärkung der FlaB, oder C) ein Organismus anwesend war Das enthielt die konservierte OspA -Sequenz, aber fehlte Flagellin oder hatte nicht genügend Identität gezielt Fettpölsterchen , um die Zündkapseln Tempern und Umgebung. In der Tat, wurden in einer Vielzahl von Organismen, einschließlich Pflanzen und Tiere28 OspA Sequenz Ähnlichkeiten festgestellt. Die Situation umgekehrt, Verstärkung der mehr konserviert Flagellin -gen, aber nicht das OspA -gen, deutet eine Verwandten Borrelien -Arten. In der Praxis ergibt dieses Protokoll mehr OspA Single-Positive Ergebnisse als die FlaB -Primer, was darauf hindeutet, dass Szenario "A" die wenigsten wahrscheinliche Erklärung ist zu tun. Ohne weitere experimentelle Analyse der strittigen Probe ist jedoch nicht möglich, die Quelle des Single-positives Ergebnis zu bestimmen. Erhöhung der Anzahl der technischen Wiederholungen auf zweideutige Proben durchgeführt, kann helfen, um ihre wahre Stellung zu vereinbaren, da Verunreinigungen, die fälschlicherweise zu früheren Reaktionen eingeführt wurden nicht in die archivierte DNA vorhanden wäre. Wenn nachfolgende Reaktionen mit diesen Primer nicht schlüssige Ergebnisse liefern, konnten andere Borrelien -Loci mittels PCR untersucht werden. Amplifikate generiert aus diesen Reaktionen könnte auch sequenziert und unter Isolate zur Identität zuweisen, und schätzen Sie das Ausmaß der Belastung Divergenz verglichen werden. SAPI und Kollegen bieten ein Beispiel für diesen Workflow mit menschlichen klinischen Proben35.
Alle Faktoren berücksichtigt, die beschriebenen Protokoll und Interpretation Kriterien eingeschätzt wurden, bzw. falsche positive und falsche negative Zinsen von 0,17 % und 0,0063 % Ausbeute.
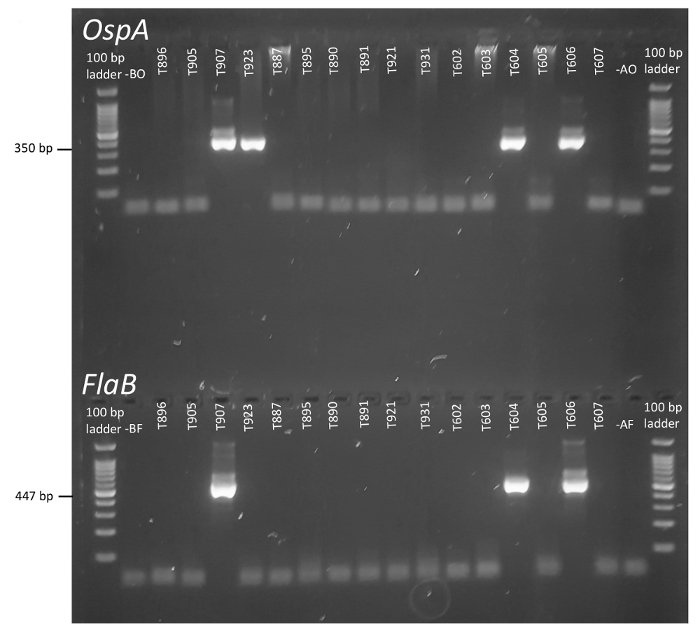
Abbildung 2 : Erkennung von Borrelia burgdorferi in einzelnen Zecken durch nPCR von FlaB und OspA. Codes zugewiesen jedem Tick sind am oberen Rand der Gele vertreten und Identitäten werden vertikal ausgerichtet, um den Nachweis von OspA und FlaB in jeder Probe zu melden. Lanes berechtigt B am linken Rand stellen keine Vorlage Bildsteuerung, während ein (rechten Fahrspuren) Aerosol Steuerelemente, Kontamination der Laborumgebung zu erfassen sind. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Über jahrzehntelange Nutzung, PCR-basierten Techniken haben immer wieder bewiesen ihren Wert in den Nachweis von Borrelien von Arthropoden und Säugetieren Proben, ob Borrelien aus ökologischen oder klinischen Herkunft kommen. PCR bietet viele Verbesserungen gegenüber bereits vorhandenen Ansätze zur Überwachung. Vor allem, es ist nicht angewiesen auf die Entwicklung und Leistung der Antikörper Reagenzien und stattdessen um neue Ziele von Interesse zu erkennen, einfach durch Ändern der Grundierung Sequenzen leicht angepasst werden. PCR beherbergt auch die Bewertung der mehrere Loci parallel, entweder eigenständig oder über eine Multiplex-Reaktion. Es kann zu vielfältigen Probe Eingänge, einschließlich frisch und archivierten Zecken22, Tier- oder menschlichen Körperflüssigkeiten und resezierten Gewebes25angewendet werden. PCR liefert auch Amplifikate, die weiter verarbeitet werden können, z. B. durch Beschränkung Enzym Verdauung, Sonde Hybridisierung oder Sequenzierung, erhöhte Einblick in mikrobiellen Identität21.
Als klinische Tool ist PCR standard serologische Diagnostik, konzeptionell vorzuziehen, da es einen direkten Hinweis auf bakterielle Präsenz, anstatt auf Host Immunantwort als sekundäre Maßnahme der Infektion bietet. Lyme-Borreliose ist aber verbunden mit einer relativ bescheidenen mikrobielle Belastung (< 50 Organismen/mL Urin oder Plasma) und vorübergehende Spirochetemia, die falsch-negativ hervorrufen kann Ergebnisse25. Die Empfindlichkeit dieser Technik in der Klinik sehr unterschiedlich je nach Gewebe, Stadium der Infektion und Probe Zustand zwischen 12,5 % und 62 % in vorhandene Untersuchungen von Blut, Liquor cerebrospinalis und biopsiert Gewebe36fallen. Molekulare Empfindlichkeit Einschränkungen sind kein Anliegen wenn PCR im Anschluss an die Bakterienkultur erfolgt, aber Erholung von lebensfähigen Spirochetes von klinischen Proben ebenso anspruchsvoll erwiesen hat. Erst kürzlich wurden Protokolle für höhere Ausbeute35optimiert. Unterdessen kann Darm von einer infizierten Zecke Erwachsene im Durchschnitt überall von 2.000 auf über 50.000 Borrelien37,38,39, Hafen fest im Erfassungsbereich des nPCR ist. Somit eignet sich das Protokoll zur Tick Überwachung Bemühungen.
Trotz vieler Vorteile stellt nPCR bestimmte Herausforderungen, und die Kapazität dieser Technik richtig angeben, dass Zecken Infektion hängt daher strategische Auswahl von Genen und Amplifikate, sorgfältige experimentelle Workflows, die Qualität DNA wiederherstellen von Proben bei gleichzeitiger Minimierung der Kreuz-Exposition von Proben und die Verwendung geeigneter Kontrollen, die Verunreinigungen in der Laborumgebung und Reagenzien melden können. Vor jedem Experiment sollte den Umfang und die Absichten der Untersuchung eindeutig festzulegen, dass darin, geeignete genetische Loci und Regionen ausgewählt werden können. Wenn das Ziel einen unvoreingenommenen Bildschirm für die Lyme-verursachenden Borrelia Burgdorferi s.l. komplexe soll, Primer geschaffen werden, um alle zugehörigen Stämme mit ähnlicher Affinität zu erkennen und Verstärkung Effizienz, ohne die Erfassung unabhängig Organismen25. Neue Primer können entworfen werden und bewertet in Silico mit Software-Tools wie Primer-BLAST40, obwohl sie gegen Standardwerk auch experimentell überprüft werden soll isoliert vor auf Fußgelenkes Proben angewendet wird. Die DNA-Extraktionsverfahren soll intakte mikrobielle Vorlage von ökologischen Mischprobe (Tick Homogenat) zu erholen. Ein optionaler Schritt, bevor Sie fortfahren mit PCR ist es, die Integrität der extrahierten DNA zu bewerten. Darüber hinaus könnten parallele Reaktionen auf ein Zimmermädchen-gen in die Zecke eingerichtet werden. Die letztere Methode kann auch angeben, dass die Anwesenheit von Inhibitoren in das Reaktionsgemisch, Bereitstellung von Selbstvertrauen, dass negative Borrelien Reaktionen aufgrund des Fehlens des Organismus und nicht auf das Vorhandensein von einem hemmenden Verunreinigung.
Die erhöhte Empfindlichkeit der verschachtelten PCR-Ansatz geht auf Kosten der möglichen Kontamination, die falsch-positiven Ergebnisse erwirtschaftet. Exogene Vorlage könnte zu einer Probe während Tick Dissektion und DNA-Recovery oder bei der Einrichtung der äußeren und inneren Amplifikationen eingeführt werden. Es ist daher besonders wichtig, beste Praxis Protokolle für PCR, Vorlage oder Amplifikate zu vermeiden folgen Cross-Kontamination. Dazu gehören die Verwendung von separaten Arbeitsstationen mit unabhängigen Luftströme, Eindämmung in PCR und biologische Sicherheitswerkbänke, gegebenenfalls gründliche chemische und physikalische Reinigung und Sterilisation von Oberflächen und Reagenzien und vorsichtigen Umgang mit DNA 41. Nr. Vorlagensteuerelemente sind auch entscheidend bei der Identifizierung von Kontamination der Lager Reagenzien. Eine besondere Gefährdung des nPCR ist der Amplifikate handling, das tritt auf, wenn die Produkte der ersten Reaktion in der zweiten PCR-Gefäß zu übertragen. Da das Ziel DNA exponentielle Anreicherung im positiven Proben bereits durchgemacht hat, dieser Schritt ist besonders anfällig für Cross-Kontamination und ein Single-Tube nPCR Protokoll wurde entwickelt, um diese Einschränkung zu umgehen. Bei diesem Ansatz werden beide Arten von Grundierungen für ein bestimmtes Gen zusammen ein Reaktionsgefäß hinzugefügt, die abgedichtet für beide Runden des PCR31bleibt. Die äußeren und inneren Grundierung Paare müssen thermodynamisch deutlich, so sein, dass das äußere paar Vorlage auf eine hohe Anlasstemperatur verstärkt, die für die innere Primer unerschwinglich ist. In der zweiten Runde wird die Anlasstemperatur abgesenkt, um das innere paar unterzubringen. Nicht nur ist dies einen potenziell verwirrende Schritt umgehen, es erlaubt auch die Verwendung von zusätzlichen Anti-Kontamination misst31,42. Diese Änderung kann jedoch einige Assay Sensibilität Opfern. Unabhängig von dem Ansatz helfen Erhöhung der Zahl der technischen Wiederholungen durchgeführt unabhängig voneinander auf einer Stichprobe, um vermeidbare Verunreinigung zu identifizieren.
Molekulare Techniken haben weiterhin seit der Einführung des nPCR zu entwickeln, und diese neueren Ansätze bieten ausgewählte Vorteile gegenüber den ursprünglichen Entwürfen, wenn auch an finanziellem Aufwand erhöht. Wie der Name schon sagt, quantitative PCR (qPCR oder Real Time (RT)-PCR) ermöglicht die Aufzählung der Erreger in einer Probe, während konventionelle Techniken qualitativer Natur43. Die Empfindlichkeit der qPCR ähnelt angeblich nPCR38, obwohl es je nach Grundierung Eigenschaften28schwanken kann. Eine Variation der qPCR, das molecular Beacons (MB) anstelle von herkömmlichen TaqMan-Sonden verwendet hat auch Versprechen in den Nachweis von Borrelien in klinischen Proben44,45,46gezeigt. Aufgrund ihrer einzigartigen Sekundärstruktur produzieren molecular Beacons angeblich geringere Hintergrundfluoreszenz und höhere legitime Signale, wodurch höhere Sensitivität47. Prä-klinischen Auswertungen vorschlagen einen möglichen Nachweisgrenze von zwischen einem und zehn Spirochäten44,45. Darüber hinaus wurde die Technik erfolgreich in Multiplex-Reaktionen gleichzeitig erkennen eine Säugetier-Wirt gen44 und andere durch Zecken übertragene Krankheitserreger45, das ist nicht so leicht erreichbar mit nPCR angewendet. Weitere Design-Modifikationen umfassen Tröpfchen digitale PCR (DdPCR)-Technologie, der ohne den Einsatz einer Standardkurve39,48DNA quantifizieren kann. Die untere Nachweisgrenze dieser Technik für Borrelien ist ebenfalls rund zehn Spirochäten/Probe39. Im Vergleich zu nPCR, haben diese Ansätze auch den Vorteil der reduzierten Potenzial für Verschmutzung, da sie nur ein einzelnes Verstärkung Protokoll erfordern.
Das Ziel der Überwachung statt ist, den abwechslungsreichen bakteriellen Inhalt einer Zecke zu profilieren, 16 s rRNA metagenomische Screening eine attraktive Option49. Obwohl dieser Ansatz teurer ist, spezielle DNA-Sequenzer nicht gefunden in allen molekularbiologischen Labors erfordert und anspruchsvollere Bioinformatik-basierte Auslegung erfordert, kann es ein breites Spektrum von Mikroben auf mehr genau erfassen. die Erreger-Last des Vektors zu vertreten.
Während qPCR und seine Derivate Methoden der Wahl für quantitative Anwendungen sind und Metagenomik Bildschirme breite Vorräte von der Zecke Mikrobiom bieten, gezielte Überwachung Bemühungen oft beschäftigen sich mit binären Berichterstattung über das Vorhandensein oder Fehlen von eine oder mehrere Erreger in einem Vektor. Unter solchen Umständen können diese neuere, aufwendigere Ansätze unnötiger Komplexität und finanzielle Belastung in den Prozess einführen. Aus diesen Gründen hat nPCR den Test der Zeit als eine zentrale Technik in Tick Prüfung standgehalten.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren möchte Kami Harris für besser gekleideteres Design, Ashley McKibbon und Jessica Thomas-Ebbett für Dreharbeiten, John Blakely, Alexandra Foley-Eby, Chris Langley, Julie Lewis, Kelsey McIntyre, Ashley McKibbon, Chris Zinck und Rosie den Hund für das erscheinen in der Video. A. M. K. wurde von der kanadischen Lyme-Borreliose-Forschungsgemeinschaft unterstützt und Projektförderung durch naturwissenschaftlich-technischen Forschung Rat von Kanada (NSERC) zur Verfügung gestellt wurde. M. K. B. W. finanziell Gehalt von New Brunswick Innovation Foundation (NBIF).
Materialien
| Name | Company | Catalog Number | Comments |
| LabGard Class II, Type A2 biological safety cabinet | Nuaire | ES AIR NU-543 | |
| Razor blades | VWR | 55411-050 | 0.22 mm thickness |
| Microfuge Tubes (Microtubes 1.5 mL) | Axygen | 311-08-051 | |
| AquaGenomic | MultiTarget Pharmaceuticals | 2030 | DNA extraction reagent |
| Microtube Pestle | Diamed | DIATEC610-1551 | Designed for 1.5 ml tubes |
| Water bath - Isotemp 202 | Fishse Scientific | 15-462-2 | |
| Vortex | Labnet | S0100 CAN | |
| Spectrafuge 24D Digital Microcentrifuge | Labnet | C2400 | |
| Isopropanol | Sigma-Aldrich | 190764 | |
| BIS-TRIS | Sigma-Aldrich | B9754 | |
| Primer Synthesis | Sigma-Aldrich | OLIGO | |
| PCR Cabinet | Misonix | PCR6-482 | |
| PCR tube with attached flat caps 0.2mL | VWR | 20170-012 | |
| GoTaq Green Master Mix 2x | Promega | M7123 | |
| Nuclease-free water | Promega | M7123 | The water comes with the GTG |
| Spectrafuge Mini | Labnet | C1301 | |
| SYBR Safe DNA Stain 10,000X Concentration | EDVOTEK | 608 | |
| Froggarose LE (Molecular Biology Grade Agarose) | FroggaBio | A87-500G | |
| GD 100 bp DNA Ladder | FroggaBio | DM001-R500 | |
| Electrophoresis power pack | VWR | VWR 105 | EC Apparatus Corporation |
| Fluor-S MultiImager | BioRad | 170-7700 (Serial number 433B0154) | |
| Quantity One 1-D Analysis Software (V. 4.5.2) | BioRad | 1709600 |
Referenzen
- Schotthoefer, A. M., Frost, H. M. Ecology and epidemiology of Lyme borreliosis. Clin. Lab. Med. 35 (4), 723-743 (2015).
- Franke, J., Hildebrandt, A., Dorn, W. Exploring gaps in our knowledge on Lyme borreliosis spirochaetes - Updates on complex heterogeneity, ecology, and pathogenicity. Ticks Tick Borne Dis. 4 (1-2), 11-25 (2013).
- Rudenko, N., Golovchenko, M., Vancova, M., Clark, K., Grubhoffer, L., Oliver, J. H. Isolation of live Borrelia burgdorferi sensu lato spirochaetes from patients with undefined disorders and symptoms not typical for Lyme borreliosis. Clin. Microbiol. Infect. 22 (3), 267.e9-267.e15 (2016).
- Scott, J. D., Clark, K. L., Anderson, J. F., Foley, J. E., Young, M. R., Durden, L. A. Lyme Disease Bacterium, Borrelia burgdorferi Sensu Lato, Detected in Multiple Tick Species at Species at Kenora, Ontario, Canada. J Bacteriol Parasitol. 08 (01), 1-10 (2017).
- Sperling, J., Middelveen, M., Klein, D., Sperling, F. Evolving perspectives on lyme borreliosis in Canada. Open Neurol J. 6, 94-103 (2012).
- Pachner, A. R. Early disseminated Lyme disease: Lyme meningitis. Am. J. Med. 98 (Supplement 1), 30S-43S (1995).
- Mikkilä, H. O., Seppälä, I. J., Viljanen, M. K., Peltomaa, M. P., Karma, A. The expanding clinical spectrum of ocular lyme borreliosis. Ophthalmology. 107 (3), 581-587 (2000).
- Mc Causland, F. R., Niedermaier, S., Bijol, V., Rennke, H. G., Choi, M. E., Forman, J. P. Lyme disease-associated glomerulonephritis. Nephrol. Dial. Transplant. 26 (9), 3054-3056 (2011).
- Tunev, S. S., Hastey, C. J., Hodzic, E., Feng, S., Barthold, S. W., Baumgarth, N. Lymphoadenopathy during Lyme Borreliosis Is Caused by Spirochete Migration-Induced Specific B Cell Activation. PLoS Pathog. 7 (5), e1002066-e1002014 (2011).
- Kostić, T., et al. Manifestations of Lyme carditis. Int. J. Cardiol. 232, 24-32 (2017).
- Hinckley, A. F., et al. Lyme Disease Testing by Large Commercial Laboratories in the United States. Clin. Infect. Dis. 59 (5), 676-681 (2014).
- Nelson, C. A., et al. Incidence of Clinician-Diagnosed Lyme Disease, United States 2005-2010. Emerg. Infect. Dis. 21 (9), 1625-1631 (2015).
- Aucott, J. N., Rebman, A. W., Crowder, L. A., Kortte, K. B. Post-treatment Lyme disease syndrome symptomatology and the impact on life functioning: is there something here?. Qual Life Res. 22 (1), 75-84 (2012).
- Aucott, J. N., Crowder, L. A., Kortte, K. B. Development of a foundation for a case definition of post-treatment Lyme disease syndrome. Int. J. Infect. Dis. 17 (6), e443-e449 (2013).
- Adrion, E. R., Aucott, J., Lemke, K. W., Weiner, J. P. Health care costs, utilization and patterns of care following Lyme disease. PLoS ONE. , (2015).
- Cameron, D. J. Consequences of treatment delay in Lyme disease. Journal of Evaluation in Clinical Practice. 13 (3), 470-472 (2007).
- Johnson, L., Aylward, A., Stricker, R. B. Healthcare access and burden of care for patients with Lyme disease: a large United States survey. Health policy. 102 (1), 64-71 (2011).
- Motaleb, M. A., et al. Borrelia burgdorferi periplasmic flagella have both skeletal and motility functions. Proc. Natl. Acad. Sci. U.S.A. 97 (20), 10899-10904 (2000).
- Rosa, P. A., Tilly, K., Stewart, P. E. The burgeoning molecular genetics of the Lyme disease spirochaete. Nat. Rev. Microbiol. 3 (2), 129-143 (2005).
- Kenedy, M. R., Lenhart, T. R., Akins, D. R. The role of Borrelia burgdorferi outer surface proteins. FEMS Immunol. Med. Microbiol. 66 (1), 1-19 (2012).
- Persing, D. H., Telford, S. R., Spielman, A., Barthold, S. W. Detection of Borrelia burgdorferi infection in Ixodes dammini ticks with the polymerase chain reaction. J. Clin. Microbiol. 28 (3), 566-572 (1990).
- Persing, D. H., et al. Detection of Borrelia burgdorferi DNA in museum specimens of Ixodes dammini ticks. Science. 249 (4975), 1420-1423 (1990).
- Wise, D. J., Weaver, T. L. Detection of the Lyme disease bacterium, Borrelia burgdorferi, by using the polymerase chain reaction and a nonradioisotopic gene probe. J. Clin. Microbiol. 29 (7), 1523-1526 (1991).
- Johnson, B. J., Happ, C. M., Mayer, L. W., Piesman, J. Detection of Borrelia burgdorferi in ticks by species-specific amplification of the flagellin gene. Am. J. Trop. Med. Hyg. 47 (6), 730-741 (1992).
- Schmidt, B. L. PCR in laboratory diagnosis of human Borrelia burgdorferi infections. Clin. Microbiol. Rev. 10 (1), 185-201 (1997).
- Ogden, N. H., et al. Ixodes scapularis ticks collected by passive surveillance in Canada: analysis of geographic distribution and infection with Lyme borreliosis agent Borrelia burgdorferi. J. Med. Entomol. 43 (3), 600-609 (2006).
- Doern, G. V. Detection of selected fastidious bacteria. Clin. Infect. Dis. 30 (1), 166-173 (2000).
- Nolte, O. Nucleic Acid Amplification Based Diagnostic of Lyme (Neuro-)borreliosis - Lost in the Jungle of Methods, Targets, and Assays?. Open Neurol J. 6 (1), 129-139 (2012).
- Wallich, R., Moter, S. E., Simon, M. M., Ebnet, K., Heiberger, A., Kramer, M. D. The Borrelia burgdorferi flagellum-associated 41-kilodalton antigen (flagellin): molecular cloning, expression, and amplification of the gene. Infect. Immun. 58 (6), 1711-1719 (1990).
- Picken, R. N. Polymerase chain reaction primers and probes derived from flagellin gene sequences for specific detection of the agents of Lyme disease and North American relapsing fever. J. Clin. Microbiol. 30 (1), 99-114 (1992).
- Picken, M. M., Picken, R. N., Han, D., Cheng, Y., Strle, F. Single-tube nested polymerase chain reaction assay based on flagellin gene sequences for detection ofBorrelia burgdorferi sensu lato. Eur. J. Clin. Microbiol. Infect. Dis. 15 (6), 489-498 (1996).
- Keirans, J. E., Litwak, T. R. Pictorial key to the adults of hard ticks, family Ixodidae (Ixodida: Ixodoidea), east of the Mississippi River. J. Med. Entomol. 26 (5), 435-448 (1989).
- Lorenz, T. C. Polymerase Chain Reaction: Basic Protocol Plus Troubleshooting and Optimization Strategies. J Vis Exp. (63), e3998 (2012).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose Gel Electrophoresis for the Separation of DNA Fragments. J Vis Exp. (62), e3923 (2012).
- Sapi, E., Pabbati, N., Datar, A., Davies, E. M., Rattelle, A., Kuo, B. A. Improved culture conditions for the growth and detection of Borrelia from human serum. Int J Med Sci. 10 (4), 362-376 (2013).
- Waddell, L. A., Greig, J., Mascarenhas, M., Harding, S., Lindsay, R., Ogden, N. The Accuracy of Diagnostic Tests for Lyme Disease in Humans, A Systematic Review and Meta-Analysis of North American Research. PLoS ONE. 11 (12), e0168613-e0168623 (2016).
- Brunet, L. R., Spielman, A., Telford, S. R. Density of Lyme disease spirochetes within deer ticks collected from zoonotic sites. Am. J. Trop. Med. Hyg. 53 (3), 300-302 (1995).
- Wang, G., et al. Real-time PCR for simultaneous detection and quantification of Borrelia burgdorferi in field-collected Ixodes scapularis ticks from the Northeastern United States. Appl. Environ. Microbiol. 69 (8), 4561-4565 (2003).
- King, J. L., Smith, A. D., Mitchell, E. A., Allen, M. S. Validation of droplet digital PCR for the detection and absolute quantification of Borrelia DNA in Ixodes scapularis ticks. Parasitology. 144 (4), 359-367 (2017).
- Ye, J., Coulouris, G., Zaretskaya, I., Cutcutache, I., Rozen, S., Madden, T. L. Primer-BLAST: a tool to design target-specific primers for polymerase chain reaction. BMC Bioinformatics. 13 (1), 134 (2012).
- Kwok, S., Higuchi, R. Avoiding false positives with PCR. Nature. 339 (6221), 237-238 (1989).
- Rys, P. N., Persing, D. H. Preventing false positives: quantitative evaluation of three protocols for inactivation of polymerase chain reaction amplification products. J. Clin. Microbiol. 31 (9), 2356-2360 (1993).
- Pahl, A., Kühlbrandt, U., Brune, K., Röllinghoff, M., Gessner, A. Quantitative detection of Borrelia burgdorferi by real-time PCR. J. Clin. Microbiol. 37 (6), 1958-1963 (1999).
- Saidac, D. S., Marras, S. A. E., Parveen, N. Detection and quantification of Lyme spirochetes using sensitive and specific molecular beacon probes. BMC Microbiol. 9 (1), 43 (2009).
- Chan, K., Marras, S. A. E., Parveen, N. Sensitive multiplex PCR assay to differentiate Lyme spirochetes and emerging pathogens Anaplasma phagocytophilum and Babesia microti. BMC Microbiol. 13 (1), 295 (2013).
- Schlachter, S., Chan, K., Marras, S. A. E., Parveen, N. Detection and Differentiation of Lyme Spirochetes and Other Tick-Borne Pathogens from Blood Using Real-Time PCR with Molecular Beacons. Methods Mol. Biol. 1616, 155-170 (2017).
- Wang, L., Blasic, J. R., Holden, M. J., Pires, R. Sensitivity comparison of real-time PCR probe designs on a model DNA plasmid. Anal. Biochem. 344 (2), 257-265 (2005).
- Sze, M. A., Abbasi, M., Hogg, J. C., Sin, D. D. A Comparison between Droplet Digital and Quantitative PCR in the Analysis of Bacterial 16S Load in Lung Tissue Samples from Control and COPD GOLD 2. PLos ONE. 9 (10), e110351-e110356 (2014).
- Sperling, J. L., et al. Comparison of bacterial 16S rRNA variable regions for microbiome surveys of ticks. Ticks Tick Borne Dis. , 1-9 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten