Method Article
Evaluación de la función respiratoria en ratones conscientes por Pletismografía de doble cámara
En este artículo
Resumen
El objetivo del presente artículo es proporcionar una descripción detallada de los procedimientos recomendados para evaluar la función respiratoria en ratones conscientes por Pletismografía de doble cámara.
Resumen
Cambios de volumen de aire creadas por un sujeto consciente respiración espontáneamente dentro de una caja de cuerpo están en la base de la pletismografía es una técnica no invasiva evaluar algunas características de la función respiratoria en los seres humanos, así como en animales de laboratorio. El presente artículo se centra en la aplicación de la pletismografía de doble cámara (DCP) en pequeños animales. Proporciona información sobre la metodología, así como un procedimiento paso a paso detallado para evaluar con éxito la función respiratoria en consciente, respiración espontánea animales de una manera no invasiva. El DCP puede utilizarse para monitorear la función respiratoria de animales múltiples en paralelo, así como identificar los cambios inducidos por sustancias aerosolizadas durante un período de tiempo escogido y de manera repetida. Experimentos en ratones alérgicos y control se utilizan aquí para demostrar la utilidad de la técnica, explicar los parámetros de resultado asociado, así como para discutir los relacionados con ventajas y deficiencias. En general, el DCP proporciona lecturas válidas y teóricamente sano que se pueden confiables para evaluar la función respiratoria de animales pequeños conscientes al inicio y después de problemas con sustancias aerosolized.
Introducción
El uso cada vez mayor de pequeños animales a enfermedades respiratorio humano modelo ha impulsado el desarrollo de técnicas para evaluar cuantitativamente las funciones del sistema respiratorio en los animales. Actualmente, la técnica de oscilación forzada (FOT) es reconocida como el método más preciso para evaluar la mecánica respiratoria en pequeños animales1,2. Sin embargo, como afirma el principio de incertidumbre de phenotyping, lo que se gana en precisión de la medida con el FOT cotiza apagado contra una pérdida de noninvasiveness3. De hecho, las mediciones de la FOT se adquieren bajo condiciones experimentales altamente controladas que requieren anestesia, traqueotomía o intubación por vía oral, así como ventilación mecánica; un escenario muy lejos de la vida real.
En situaciones donde los requerimientos experimentales proscriben el uso de agentes anestésicos o convocatoria de poca o ninguna desviación del estado fisiológico natural del animal, puede considerarse doble cámara Pletismografía (DCP). Como su nombre indica, una configuración DCP consiste en dos compartimientos rígidos conectados construidos para aislar herméticamente como sea posible la cabeza del animal (o nariz), en la cámara frontal, su tórax, en la cámara posterior. Dentro de la configuración, el animal está consciente y respira espontáneamente mientras que siendo refrenado. Porque las paredes de las cámaras no se pueden expandir o retraer, el movimiento del aire de entrada y salida del animal genera una correspondiente pero opuesto forma de onda dentro de la cámara posterior, como resultado de la compresión/descompresión de aire circundante. La forma de onda debido al flujo nasal en la cámara frontal y se relaciona con el movimiento torácico en la cámara posterior puede así separado y capturado al mismo tiempo. Dependiendo del diseño de la instalación DCP, estas formas de onda pueden ser adquiridas mediante un conjunto de transductores de presión o pneumotachographs respectivamente, grabar los cambios en presión o flujo de entrada y salida de las cámaras de aire en función del tiempo. Este último enfoque es más común hoy en día.
Mientras que la frecuencia de respiración del animal puede determinarse con precisión cualquier tipo de técnicas de la pletismografía, la situación no es la misma para la determinación del volumen de marea y sus parámetros de ventilación relacionados (p. ej., ventilación minuto, volumen espiratorio, etc.). A diferencia de la técnica de pletismógrafo de cuerpo entero (WBP), donde se estima el volumen tidal del animal desde la caja de4,señal5, la técnica DCP proporciona evaluaciones precisas del volumen tidal. Esto está relacionado con la adquisición directa del movimiento torácica del animal en la cámara posterior, que son proporcionales a los cambios en el volumen pulmonar durante la respiración.
Además de estos parámetros ventilatorios precisos (por ejemplo, el volumen tidal, frecuencia respiratoria y ventilación minuto), algunos disturbios en la forma del ciclo respiratorio también pueden utilizarse para investigar aspectos neuronales que gobiernan el respiratoria o reflejos respiratorios. Un ejemplo concreto de que la aplicación sería la evaluación del potencial de irritación de sustancias inhaladas en las neuronas sensoriales de vía aérea superior6. Aquí, la duración de una pausa en el inicio de la caducidad se determina mediante un parámetro llamado pausa inspiratoria final (EIP), también conocida como duración del frenado6. La prolongación de esta pausa por una sustancia irritante es asociada con el cierre de la glotis del animal, provocando un período mensurable de frenada en la primera parte de la caducidad6,7.
Otra ventaja importante de la DCP es que proporciona dos parámetros validados e indiscutibles que son sensibles a la obstrucción del flujo de aire. Uno se llama el flujo en volumen espiratorio mediados-de marea y es abreviado EF508,9,10. Es el flujo de aire en el volumen medio de cada respiración de marea durante la expiración. EF50 se extrae del rastro de flujo torácica y por lo tanto puede ser medido sin la cámara frontal (es decir, en una configuración de salida de la cabeza). El otro se llama resistencia de vía aérea específica y abreviada sRaw11,12,13. La determinación de sRaw requiere la grabación simultánea del flujo nasal y torácica del animal como se computa desde el tiempo de retardo entre estos rastros respiratorios separados en el punto de flujo cero en el final de la inspiración. La razón que describe la base por la que este retraso se refiere a sRaw se expatiated previamente11. En pocas palabras, los cambios en el volumen pulmonar preceden el movimiento del aire desde un gradiente de presión tiene que desarrollar en orden al flujo de aire de impulsión. En un animal sano respirar tranquilamente, este retraso es típicamente muy pequeña. Sin embargo, el gradiente de presión que se requiere para acomodar un flujo determinado (por ejemplo, un flujo suficiente para proporcionar una ventilación adecuada) está influenciado por el grado de resistencia de vía aérea. Durante la broncoconstricción, por ejemplo, el gradiente de presión necesario para un flujo dado es mayor, lo que implica que el animal tiene que trabajar más duro para respirar. Un mayor gradiente de presión en el tórax del animal también implica que una mayor parte del flujo de entrada y salida de la cámara posterior es debido a la descompresión y compresión de aire dentro del tórax, que es la parte de la total expansión/retracción torácica que es fuera de fase con el flujo nasal. El aumento de la resistencia debido a la broncoconstricción así aumentará el retraso entre la parte trasera y las cámaras frontales y aumenta de tal modo sRaw. El gradiente de presión que impulsa la circulación de aire entrada y salida del pulmón también se ve influido por el volumen inicial de gas torácico (TGV). En un TGV mayor por ejemplo, la expansión/contracción del tórax es necesario generar un determinado gradiente de presión es mayor (simplemente porque el desplazamiento de volumen que se requiere para generar un determinado gradiente de presión es mayor), que también implica que el animal tiene que trabajar más duro para respirar. Una vez más, estos desplazamientos extra torácicas son las requeridas para descomprimir/comprimir aire en el tórax y son así fuera de fase con el flujo nasal. Por lo tanto, una mayor TGV también aumentará el retraso entre las cámaras y aumenta de tal modo sRaw. Como puede verse, broncoconstricción y aumento de TGV como resultado de un esfuerzo más importante de entrada y salida del pulmón el aire. Esto es, en esencia, el significado fisiológico de funcionamiento a pajar. Representa el trabajo necesario para respirar5,14.
Por lo tanto es importante entender que dos distintos factores influyen en la sRaw: resistencia de vía aérea y TGV. De hecho, sRaw puede expresarse como el producto de la resistencia de las vías respiratorias y TGV11. Animales conscientes pueden modificar su TGV en la voluntad, en cuanto a adaptar su ventilación a un entorno determinado. En estas condiciones, donde el estado fisiológico natural del animal es inalterado, así es imposible discernir si un cambio en sRaw surge de una alteración en la resistencia de vía aérea, de un cambio en el TGV o de una mezcla de los dos. Por lo tanto, se recomienda complementar la evaluación DCP con más mediciones invasivas de la mecánica respiratoria o volúmenes pulmonares, tales como los proporcionados por el FOT1,15.
Hasta la fecha, el DCP se ha utilizado en diversas aplicaciones de la investigación. La técnica puede utilizarse con o sin la cámara cabeza cuantitativamente y evaluar con precisión el efecto de diversas sustancias, tales como agentes farmacéuticos, alergenos, irritantes u otros mediadores, en la función respiratoria en los animales pequeños conscientes 1617,de,18. La cámara frontal también puede utilizarse como una cámara de exposición a sustancias aerosolized o diferentes gases concentraciones (hipoxia, hipercapnia, etc.)19. Convenientemente, permite medir concomitante los efectos agudos de estas exposiciones. De hecho, uno de los usos comunes del DCP es evaluar el grado de sensibilidad a la metacolina aerosolizada en diferentes modelos de enfermedades respiratorias20,21,22,23, 24 , 25.
Aunque la técnica DCP es aparentemente sencilla, algunos desafíos prácticos pueden disuadir a los usuarios inexpertos o afectar a la exactitud y reproducibilidad de los resultados. El presente trabajo proporciona una descripción detallada de los procedimientos recomendados para grabar con éxito de la función respiratoria por DCP en ratones conscientes, sobrio y respirando espontáneamente. La descripción es específica para el equipo indicado (consulte la Tabla de materiales). La utilidad y el valor del DCP también se demuestra en un modelo común de la inflamación alérgica en dos cepas de ratones probados en condiciones basales y en respuesta a la metacolina aerosolized.
Protocolo
Los procedimientos fueron aprobados por el corazón de Quebec y el Comité de cuidado del Animal Instituto de pulmón según las directrices del Consejo Canadiense sobre el cuidado Animal (CCAC).
1. preparación
- Estudio
- (Crítica) Antes de realizar cualquier experimento, obtener las aprobaciones apropiadas (por ejemplo, IACUC) y entrenamientos (p. ej., manejo de animales).
- Familiarizarse con el equipo y el software operativo. Manuales de instrucciones del usuario y, si es necesario, crear un archivo de configuración para definir el número de sitios, señales, analizadores y los parámetros de entrada.
Nota: Asegúrese de seleccionar una frecuencia de muestreo alta (2 KHz). - Configurar las opciones de analizadores para los parámetros de interés.
- Seleccione ajuste de la barra de herramientas y luego analizadores.
- Ajustar el umbral de flujo a un valor que separa correctamente las respiraciones (ratón: 0,5 mL/s) y optar por Ti + Te calcular la tasa de respiración.
- Defina un valor para la presión barométrica (760 mm Hg) y especifique la desviación máxima del volumen inspiratorio/espiratorio de un aliento para ser considerado válido (ratón: 20%).
- Haga clic en configuración en el campo de los parámetros calculados para ajustar los límites de aceptación.
Nota: Los siguientes parámetros se utilizaron para los experimentos de ratón descrito: tiempo de inspiración, ms de 50 a 170; tiempo de expiración, ms de 40 a 180; frecuencia de la respiración, bpm de 30 a 450; resistencia de vía aérea específica, 0 a 15 cmH2O·s; flujo midexpiratory con una precisión de al menos 3 decimales. - Una vez completado, seleccione aplicar y cerrar para salir de la ventana de diálogo.
- Desde el menú de barra de herramientas, ir a Tuning otra vez y luego almacenamiento de información para establecer una tasa de almacenamiento de datos deseados. Haga clic en aplicar y cerrar para salir de la ventana.
Nota: Un promedio en cada 10 s se utiliza normalmente. - Crear un protocolo en el software operativo para definir una secuencia de comandos y el momento deseado para cada uno. Un ejemplo se muestra en la figura 1.
- Si el experimento consiste en la administración de una sustancia por aerosol, preparar diluciones según las concentraciones a ensayar las soluciones adecuadas.
- Animal
- Trabajo en una zona tranquila alejada de la habitación de la vivienda. Permitir a los animales ajustar al cambio del medio ambiente.
- Pesan los animales y seleccionar el tamaño del alojamiento apropiado.
- (Crítica) Aclimatar a los animales para el limitador y procedimientos antes del inicio del experimento. Dependiendo del diseño experimental, varias sesiones de aclimatación de aumento de la duración (por ejemplo, 5-30 min) puede ser necesaria.
Nota: Animales que no adapte deben retirarse del estudio.- En cada sesión de aclimatación, introducir el animal en el limitador, procede la abertura hacia atrás; sostener verticalmente el dispositivo puede ser útil.
- Una vez que el animal está en posición, inserte el émbolo posterior y suavemente bloquearlo sin aplicar una fuerza excesiva.
- (Crítica) Verifique visualmente que el animal respira normalmente. Si es necesario, ajustar su posición al mover el mecanismo de bloqueo. Asegúrese de que nares del animal son que sobresalen fuera del cono de nariz con su hocico apoyado contra las paredes internas del limitador.
- Separar la parte trasera de la cámara torácica, inserte el limitador que contiene el animal a través de la goma en la cámara torácica y cerrar la cámara.
- Conecte la cámara principal y proporcionan un flujo diagonal. Utilizar un flujo de 0.5 L/min para un ratón.
- Permite al animal descansar por 5 minutos.
- Una vez que el animal está tranquilo, iniciar la grabación de las señales de flujo nasal y torácica. Verificar en la pantalla del ordenador que los rastros son lisos y que muestran un patrón de respiración regular; ver ejemplo en figura 2.
Nota: Si el protocolo consiste en la administración de aerosoles de una sustancia, un desafío solución salino puede incluirse en el procedimiento de aclimatación. - Al final de cada sesión, sacar el animal de la cámara torácica y el limitador y devolverlo a su jaula de alojamiento y habitación.
- Equipo
- En el día del experimento, iniciar una sesión experimental y cargar el archivo de configuración apropiada.
Nota: Verificar que contenga el protocolo deseado para el experimento. - Vaya a Ejecutar en el menú de la barra de herramientas. Entrar en el experimento y la información del animal. Una vez hecho esto, haga clic en el botón Ejecutar en la parte inferior de la ventana.
- Proceder con la calibración del sistema. Calibrar cada sitio y entrada de señal por separado.
- Encienda el generador de flujo diagonal, conectarlo a la cámara principal a través de un pedazo de tubo y ajustar el flujo.
- Cerrar la abertura superior de la cámara de cabeza con un gorro.
- Quitar la parte trasera de la cámara torácica, Inserte firmemente la herramienta de calibración dentro del caucho entre la cabeza y la cámara de cuerpo para crear un sello hermético. Luego cierre y vuelva a colocar el panel posterior de la cámara torácica.
- Verificar que el puerto lateral de la cámara torácica es un tope.
- Desde el menú de barra de herramientas de software, ir a Tuning y luego calibrar.
- Ir a la entrada 1 (torácica) y seleccione calibrar para lanzar el cuadro de diálogo de calibración para la señal de flujo torácica.
- (Crítica) Verificar que los parámetros listados en la ventana de diálogo de calibración muestran los ajustes correspondientes, es decir, estrés físico aplicado bajo valor: 0; Estrés físico aplicado alto valor:-20 mL/s; Muestras: integrar. Una vez hecho esto, haga clic en baja en la ventana de muestras .
- Verificar que la señal generada es constante a través de la ventana de visualización y haga clic en cerrar.
- Conecte una jeringa de 20 mL a través del puerto lateral de la cámara torácica usando un conector de plástico y un trozo de tubería.
- (Crítica) Seleccione el alta en la ventana de muestras e inmediatamente inyectar 20 mL de aire en la cámara durante 2 s con un caudal lo más constante posible.
- Compruebe que la señal generada aparece completamente dentro de la ventana de visualización. Utilice el icono de flecha para comprobar si la señal es centrada y simétrica alrededor de la línea de cero. Luego, haga clic en cerrar. Retire cualquier desplazamiento de cero haciendo clic en eliminar AC offset en la ventana de muestras
Nota: La calibración de alto valor se puede rehacer, si es necesario. - Verificar que la resultante Gama de escalado de entrada esté dentro del intervalo recomendado (ratón: ±280 a ±420 mL/s). (Crítica) Repita los pasos de calibración si los valores están fuera del rango aceptable.
- Calibrar la cámara principal de una manera similar como la cámara torácica (paso 1.3.3.6). Esta vez, seleccione la entrada 2 (nasal).
Nota: (Importante) El valor de estrés físico aplicado alto valor debe establecerse en + 20 mL/seg. Esto va a cambiar la polaridad de la corriente en la cámara frontal en relación con la cámara posterior. Por lo tanto, cuando el animal respira, las señales de dos flujo casi estén en fase, aparte de la demora para calcular sRaw.
- En el día del experimento, iniciar una sesión experimental y cargar el archivo de configuración apropiada.
2. mediciones de función pulmonar
- Pesan los animales y tenga en cuenta su peso corporal.
- Inserte el animal en el limitador y coloque dentro de la cámara de pletismografía torácica (pasos 1.2.3.1 a 1.2.3.5).
- Permite al animal descansar por al menos 5 minutos.
- Para empezar el protocolo de comandos, seleccione el primer paso y a continuación, haga clic en Ejecutar.
- Compruebe en la pantalla del ordenador que la respiración del animal señales son regular y liso (figura 2). El software automáticamente muestra los parámetros calculados sobre una base de respiración por respiración. Verificar que los parámetros del animal son estables.
- Grabar el patrón de respiración bajo las condiciones iniciales hasta 10 minutos.
- Para los protocolos que implican la administración de una sustancia por aerosol, haga lo siguiente:
- Ajusta el ciclo de tiempo y obligación de nebulizador, como sea necesario.
Nota: En los ejemplos en este artículo, el nebulizador fue funcionado en un ciclo de trabajo de 5% durante 10 s. - Realizar un reto de vehículo (por ejemplo, solución salina) y registrar la respuesta.
- Si es necesario, exponer el animal al aumento de las concentraciones de la sustancia al cambiar la concentración en el nebulizador en escalada de pasos (por ejemplo, duplicar las concentraciones). Registro de la respuesta después de cada administración.
- Al final de la sesión experimental, si no se hace automáticamente, detener la grabación y devolver el animal a su jaula de alojamiento y habitación.
- Ajusta el ciclo de tiempo y obligación de nebulizador, como sea necesario.
- Si es necesario, seleccione Ejecutar desde el menú de la barra de herramientas para ejecutar otra sesión experimental.
- Entre sesiones, limpiar las cámaras de pletismógrafo y enjuague el nebulizador con agua.
Nota: El consumo de alcohol puede causar daños irreversibles en el pletismógrafo.
- Entre sesiones, limpiar las cámaras de pletismógrafo y enjuague el nebulizador con agua.
- Si el estudio implica evaluaciones repetidas en el tiempo, repetir la secuencia de medición entero en cada punto elegido.
Nota: Sabiamente se recomienda complementar el estudio con algunas mediciones precisas de la mecánica respiratoria o pulmonar volúmenes1,15.
3. Análisis de los datos
Nota: El software automáticamente guarda el archivo experimental y exporta los parámetros registrados cuando la sesión experimental.
- Calcular un promedio de referencia para los parámetros de interés para cada grupo animal y experimental.
Nota: la tabla 1 enumera una serie de parámetros típicos, categorizados según el tipo de información que proporcionan. - Cuando proceda, evaluar el efecto de la sustancia aerosolizada estudiada sobre los parámetros de interés en cada concentración con un punto específico (por ejemplo, valor máximo o mínimo), un promedio o el curso de tiempo completo; también se puede considerar una normalización a línea de fondo.
- Informar de los resultados con el grupo medios y errores en una tabla o formato gráfico. Analizar estadísticamente los resultados.
Nota: En el presente estudio, ANOVAs de dos vías con repitieron medidas se utilizaron para evaluar el efecto de metacolina, alérgenos, ácaros de polvo de la casa (HDM) – y su interacción en diferentes lecturas de la DCP (sRaw y EF50), así como en diferentes lecturas FOT (RN, G y H), en ambas cepas de ratones. Pruebas de comparación múltiples de Sidak entonces fueron utilizadas para determinar las concentraciones de metacolina en el cual los ratones alérgicos difieren de los ratones de control. Se utilizaron las mismas pruebas para evaluar el efecto de días, HDM y su interacción en línea de base (es decir, antes del methacholine) en lecturas de obstrucción de vía aérea (sRaw y EF50) y del patrón de ventilación (BF, TV, MV y EIP). Correlaciones de Pearson se utilizaron para evaluar las correlaciones entre sRaw obtenidos con la DCP y RN obtenidas con el FOT. Todos los análisis estadísticos y gráficos se realizaron con estándar estadístico software alternativo (p. ej., GraphPad Prism). p ≤ 0.05 se consideró suficiente para rechazar la hipótesis nula.
Resultados
Los resultados de evaluaciones repetidas de la función respiratoria por DCP, realizada bajo las condiciones iniciales en tres días consecutivos (días 12, 13 y 14 del protocolo ilustrado en la figura 1) en el control y alérgicas ratones BALB/c, se muestran en figura 3 . Los parámetros seleccionados para evaluar el patrón de respiración incluyen respiración frecuencia (Figura 3A), volumen de marea (figura 3B), ventilación minuto (figura 3) y pausa inspiratoria final (figura 3D). Los parámetros utilizados para evaluar la obstrucción de vía aérea fueron EF50 (figura 3E) y sRaw (figura 3F). Los resultados de cada parámetro seleccionado fueron estables durante estos tres días consecutivos en ambos grupos, sin efecto aparente causada por la inflamación alérgica.
El grado de sensibilidad a la metacolina se evaluó por DCP en días sucesivos (días 12, 13 y 14 del protocolo ilustrado en la figura 1) en el control y ratones BALB/c alérgicas. Los resultados, se muestra en la figura 4, muestran los cambios en los dos parámetros que son sensibles a la obstrucción de vía aérea, es decir, sRaw (Figura 4A, B y C) y EF50 (figura 4, E y F). Como era de esperar, concentraciones incrementales de methacholine aumentaron progresivamente sRaw y disminuyeron progresivamente EF50. Estas respuestas fueron potenciadas por la inflamación alérgica, especialmente en la concentración final probada, que la presencia de hipersensibilidad. Los resultados también demuestran que el grado exagerado de la sensibilidad se limitó al primer día (día 12), como no se observó durante las dos evaluaciones posteriores (es decir, a los días 13 y 14).
Los resultados de la evaluación de la mecánica respiratoria por el FOT, realizada en el último día del protocolo experimental (día 15; Figura 1) tanto en control como alérgicas ratones BALB/c, se muestran en la figura 5. Estos experimentos se incluyeron en el estudio para complementar las evaluaciones de la DCP. El FOT es reconocido como un enfoque más preciso para evaluar la función respiratoria2. Uno de sus puntos fuertes es que proporciona conocimientos topográficos en cuanto a que sitios del pulmón (realización de las vías aéreas frente a las vías aéreas periféricas y tejido pulmonar) se ven afectados por las intervenciones probadas (por ejemplo, alérgenos y metacolina). La metodología recomendada para evaluar la mecánica respiratoria con la FOT fue descrito previamente1. Aquí, tres parámetros FOT fueron utilizados para describir los cambios en la mecánica respiratoria inducida por metacolina y la inflamación alérgica. Estos parámetros incluyen: resistencia 1 newtonianos (RN; Figura 5A), un parámetro para que los cambios en valoran principalmente reflejan variaciones en la resistencia de las vías aéreas conductoras grandes; 2-tejido amortiguación (G; Figura 5B), un parámetro para que los cambios en valoran principalmente reflejan variaciones en la resistencia de los tejidos; y 3-tejido elastancia (H; Figura 5), un parámetro para que los cambios en valoran principalmente reflejan variaciones en la rigidez de tejidos2. Como era de esperar, hubo un aumento en cada uno de estos parámetros en respuesta a concentraciones incrementales de metacolina. Compatible con sRaw y EF50 resultados obtenidos con el DCP del día anterior (día 14; Figura 1), los cambios en RN inducida por metacolina (figura 5A) fueron comparables entre el control y los ratones alérgicos. De hecho, los valores de funcionamiento a pajar en día 14 correlacionaron con los valores de RN en día 15 (figura 5). El aumento de H inducida por metacolina fue también similar entre el control y los ratones alérgicos (figura 5B). Sin embargo, el aumento de G inducida por metacolina fue significativamente mayor en los ratones alérgicos (figura 5). Este resultado demuestra la presencia de un fenotipo hyperresponsive que persiste en los ratones alérgicos en el día 15, que no fue detectado por las evaluaciones de DCP en los dos días anteriores.
Todo el estudio fue repetido con los ratones C57BL/6. Los resultados de las evaluaciones sucesivas de DCP de sRaw, a los días 12, 13 y 14 del Protocolo (figura 1) y de la evaluación de la FOT de RN, en el día 15, se muestran en la figura 6. En esa cepa de ratón específicos, la respuesta exagerada del methacholine observada en los ratones alérgicos se mantuvo durante los tres días consecutivos (figura 6A, By C). Este fenotipo hyperresponsive también fue representado con el FOT en el día 15 por un aumento en RN inducida por metacolina que fue más pronunciado en los ratones alérgicos (figura 6E). Éstos estaban en marcado contraste con los resultados obtenidos con los ratones BALB/c, donde una progresiva disminución de la hipersensibilidad ocurrió entre los días 12 y 14 (figura 4) y se observó la falta de diferencia en la subida inducida por metacolina en RN en el día 15 (figura 5A). Juntos, estos resultados indicaron un efecto tiempo-que varía del alergeno en la respuesta inducida por metacolina entre las dos cepas de ratones. Lo importante, esta diferencia de tensión fue representada por el DCP y el FOT. Unanimidad, los valores de sRaw medido por el DCP en el día 14 se correlacionaron con los valores de RN medida por FOT en el día 15 (figura 6F), como se observó con los ratones BALB/c (figura 5).

Figura 1 . Protocolos utilizados para inducir inflamación alérgica pulmonar y para evaluar el grado de sensibilidad a la metacolina. Este estudio se llevó a cabo en hembras de ratones BALB/c y C57BL/6 ratones de 7 a 9 semanas de edad. La secuencia de las intervenciones llevadas a cabo durante todo el estudio se muestra en el panel (A). La mitad de los ratones fue expuesto a 50 μg de extracto de ácaros del polvo de la casa (HDM) intranasal en 14 días consecutivos para inducir inflamación alérgica pulmonar. La otra mitad fue expuesta con solución salina y utilizada como control. Se evaluó la función respiratoria por Pletismografía de doble cámara (DCP) en tres ocasiones separadas (días 12, 13 y 14; los círculos negros) después de una sesión de aclimatación (día 11, círculo gris) que incluye un desafío con aerosol salino. Durante cada sesión, función respiratoria basal y la respuesta a la metacolina se evaluaron usando el protocolo automatizado que se muestra en el panel (B). En el día 15, una evaluación invasiva de mecánica respiratoria con la técnica de oscilación forzada (FOT) se realizó como se describió anteriormente1. Haga clic aquí para ver una versión más grande de esta figura.
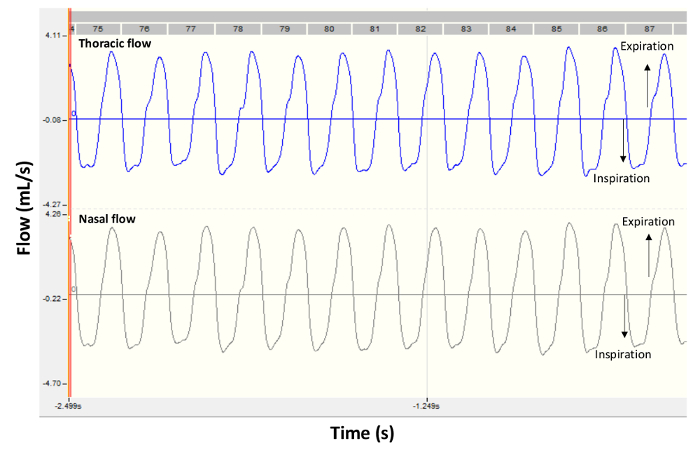
Figura 2 . Señales de flujo representativo de un saludable ratón BALB/c. Los paneles muestran rastros de grabación típico obtenidos por Pletismografía de doble cámara en un ratón de control bajo las condiciones iniciales. Torácica de flujo se muestra en el panel superior y flujo nasal se muestra en la parte inferior. Los valores negativos son durante la inspiración y los valores positivos son durante la expiración. Haga clic aquí para ver una versión más grande de esta figura.
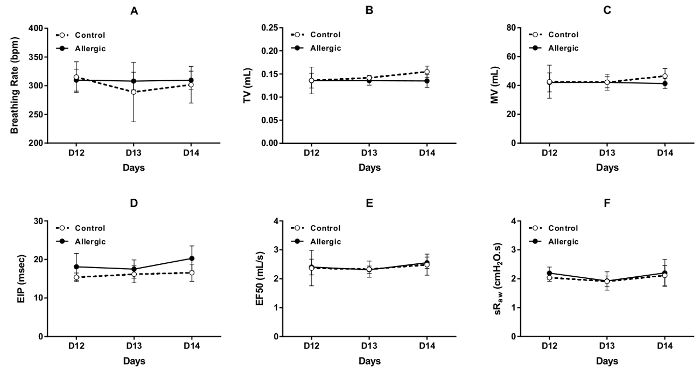
Figura 3 . Repetir las evaluaciones de la función respiratoria en ratones BALB/c conscientes. Función respiratoria basal fue evaluada mediante Pletismografía de doble cámara (DCP) en el control (símbolos abiertos) y ratones alérgicos (símbolos sólidos) en los días 12, 13 y 14 del protocolo ilustrado en la figura 1. Los parámetros DCP utilizados para evaluar la función respiratoria incluida respiración frecuencia en (A), ventilación minuto (VM) en (C), el volumen tidal (TV) en (B), final inspiratorio pausa (EIP) en (D), flujo en el mediados de-mareas volumen espiratorio ( EF50) en (E) y resistencia de vía aérea específica (sRaw) en (F). Los valores de respiración frecuencia, TV, MV, sRaw y EIP para cada ratón fueron que los valores medios registran sobre 1,5 minutos. El valor de EF50 era el valor mínimo obtenido durante este período de grabación. Los resultados se presentan como grupo medio ± desviación estándar (n = 5/Grupo). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4 . Prueba de bronchoprovocation Methacholine en ratones BALB/c conscientes. Respuesta metacolina fue evaluado mediante Pletismografía de doble cámara (DCP) en ratones alérgicos (símbolos sólidos) y control (símbolos abiertos) los días 12, 13 y 14 del protocolo ilustrado en la figura 1. Los parámetros de la DCP para evaluar la respuesta incluyen resistencia vía aérea específica (sRaw) en (A) (C) y el flujo en volumen espiratorio medio marea (EF50) en (D) a (F). El bronchoprovocation fue realizada por aerosolizing del methacholine en la cámara principal de DCP 10 s a concentraciones incrementales. La respuesta fue monitoreada durante 1,5 min. después de cada concentración. El valor de funcionamiento a pajar para cada ratón a cada concentración fue que el valor promedio registrado durante 1,5 minutos. El valor de EF50 era el valor mínimo obtenido durante este período de grabación. Los resultados se presentan como grupo medio ± desviación estándar (n = 5/Grupo). El símbolo de asterisco * señala una diferencia estadísticamente significativa (p 

Figura 5 . Evaluación invasiva de mecánica respiratoria en ratones BALB/c. Mecánica respiratoria en condiciones basales y en respuesta a la metacolina se evaluó por la técnica de oscilación forzada (FOT) el día 15 del protocolo ilustrado en la figura 1. El control (símbolos abiertos) y los ratones alérgicos (símbolos sólidos) eran iguales a los probados por Pletismografía de doble cámara (DCP) en los días 12, 13 y 14. Los parámetros utilizados para evaluar la mecánica respiratoria fueron resistencia newtoniana (RN) (A), tejido elastancia (H) (B) y amortiguación (G) en (C) del tejido. Se realizó la bronchoprovocation nebulizando concentraciones incrementales de methacholine directamente en el tubo endotraqueal de ratones anestesiados, crujías, paralizados y ventilación mecánica en posición supina. La respuesta fue monitoreada durante 5 min después de cada concentración. El valor de cada parámetro para cada ratón a cada concentración fue el valor más alto obtenido durante este período de grabación. Los resultados se presentan como grupo medio ± desviación estándar (n = 5/Grupo). Panel (D) muestra la correlación entre la resistencia de vía aérea específica (sRaw) medido por DCP en el día 14 y RN medida por FOT el día 15. Los símbolos abiertos representan los valores basales y los símbolos sólidos representan los valores máximos en la mayor concentración de metacolina para el control (círculos) o los ratones alérgicos (cuadrados). El recuadro muestra el coeficiente de determinación (r2). El símbolo de asterisco * señala una diferencia estadísticamente significativa (p ≤ 0.05). Haga clic aquí para ver una versión más grande de esta figura.
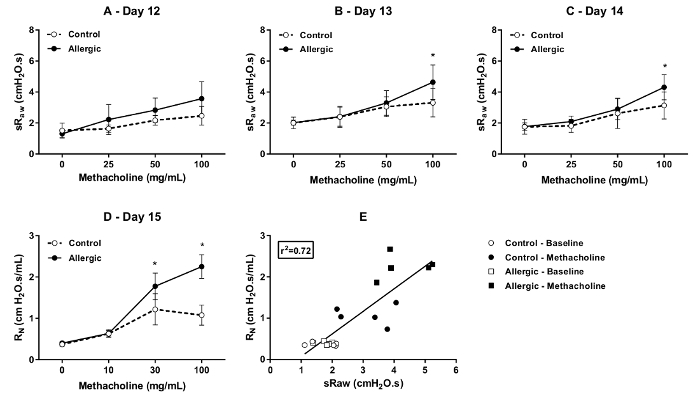
Figura 6 . La función respiratoria y mecánica respiratoria invasiva en ratones C57BL/6. Resistencia de vía aérea específica (sRaw) fue evaluada mediante Pletismografía de doble cámara (DCP) en condiciones basales y en respuesta a la metacolina en ratones alérgicos (símbolos sólidos) y control (símbolos abiertos) los días 12 (A), 13 (B) y 14 (C) de la Protocolo ilustrado en la figura 1. Resistencia newtoniana (RN) en condiciones basales y en respuesta a la metacolina se evaluaron por la técnica de oscilación forzada (FOT) el día 15 (D). El bronchoprovocations se realizaron como se describe en la figura 4 y figura 5 para el DCP y el FOT, respectivamente. Los resultados se presentan como grupo medio ± desviación estándar (n = 5/Grupo). Panel (E) muestra la correlación entre sRaw medido por DCP en el día 14 y RN medido por FOT el día 15. Los símbolos abiertos representan los valores basales y los símbolos sólidos representan los valores máximos en la mayor concentración de metacolina para el control (círculos) o los ratones alérgicos (cuadrados). El recuadro muestra el coeficiente de determinación (r2). El símbolo de asterisco * señala una diferencia estadísticamente significativa (p ≤ 0.05). Haga clic aquí para ver una versión más grande de esta figura.
| Parámetro | Unidad | Descripción | Información |
| F | BPM | Frecuencia de la respiración | Patrón de ventilación |
| TV | mL | Volumen de marea | |
| MV | mL | Ventilación minuto | |
| Ti | MS | Tiempo inspiratorio | |
| Te | MS | Tiempo expiratorio | |
| PIF | mL/s | Flujo inspiratorio Peak | |
| PEF | mL/s | Flujo espiratorio máximo | |
| EV | mL | Volumen espiratorio | |
| NTV | mL | Volumen nasal | |
| NEV | mL | Volumen espiratorio nasal | |
| EIP | MS | Pausa inspiratoria final | |
| EEP | MS | Pausa espiratoria final | |
| dT | MS | Tiempo de retardo | Obstrucción del flujo de aire |
| sRaw | cmH2O·s | Resistencia de vía aérea específica | |
| Organiza | 1/cmH2O·s | Conductancia específica de la vía aérea | |
| EF50 | mL/s | Flujo en el mediados de-mareas volumen espiratorio | |
| Sr | % | Tasa de éxito | Control de calidad |
| N | Número de respiraciones válidas |
Tabla 1. Lista de parámetros típicos obtenidos de doble cámara pletismografía. Los parámetros fueron agrupados según la naturaleza de la información que proporcionan durante una evaluación de la función respiratoria.
| Ventajas | Limitaciones |
| · Animales conscientes | · Necesidad de controlar el entorno |
| · Parámetros de ventilación preciso | · Previa aclimatación de los animales |
| · Índices de indiscutibles de la obstrucción del flujo de aire (sRaw, EF50) | · Requisito para separar herméticamente el flujo nasal y torácica |
| · Adaptable a varios tamaños de animales y especies | · Variabilidad de valor absoluto para algunos parámetros de resultado |
| · Utilizado en muchas aplicaciones de investigación | · sRaw no una verdadera medida de la resistencia |
| · Técnica sencilla | · Presencia de las vías aéreas superiores |
| · Sensible al cambio | · Como complemento de las mediciones con una evaluación invasiva |
Tabla 2. Lista de ventajas y limitaciones asociadas con Pletismografía de doble cámara.
| Pletismografía de doble cámara | Técnica de oscilación forzada | |
| Estado animal de conciencia | Sin alteraciones | Anestesiados (y generalmente paralizado) |
| Posición del animal | En posición vertical | Decúbito supino |
| Accesibilidad del animal | Confinado dentro de cámara | Accesible |
| Integración animal en el dispositivo de medición | Sello de la nariz o el cuello | Intubación oral o traqueotomía |
| Árbol de las vías respiratorias de los animales | Intacta | Parcial: segmento de la vía aérea superior excluida (conductas es decir, nasales, faringe y laringe) |
| Volumen pulmonar en el cual se obtienen los parámetros de resultado | Variable - volumen espontánea adoptada por el animal | Estandarizado - mediante maniobras de reclutamiento controlado y presión extremo-expiratoria positiva. |
| Frecuencia en la cual se evalúan los parámetros de resultado | Variable - frecuencia de la respiración espontánea adoptada por el animal | Controlar - con formas de onda predefinidas en frecuencias especificadas |
| Contribución del segmento de la vía aérea superior a los parámetros de resultado | De esperar | Eludidas |
| Sitio de entrega de aerosol | Dentro de la cámara principal | Directamente en la tráquea |
| Efecto de segmento de vía aérea superior en la dosis inhalada / patrón de deposición de aerosoles | De esperar | Prevenido |
| Capacidad de detectar cambio - basado en los resultados del presente estudio | Observado | Observado |
| Variabilidad inherente de la técnica - basada en los resultados del presente estudio | Fluctuación del coeficiente de variación para sRaw basales: 7.5-20,6% | Fluctuación del coeficiente de variación de RN en la línea de base: 3.6-13.4% |
Tabla 3. Comparación entre las técnicas de la oscilación forzada y pletismografía de doble cámara.
Discusión
Investigación respiratoria claramente está garantizada la capacidad para medir la función pulmonar en animales conscientes. En general, el DCP es un enfoque interesante para evaluar la función de ventilación del sistema respiratorio en consciente y en respiración espontánea animales26. Más específicamente, el DCP, o su variante de cabeza-hacia fuera, a menudo golpea un equilibrio correcto entre la calidad de la información suministrada y el nivel deseado de invasividad3 (tabla 2). La técnica puede adaptarse a diferentes especies (e.g., ratón, rata, conejillo de Indias) o animales tamaños y puede ser utilizada en muchas aplicaciones de investigación. Es particularmente útil evaluar numerosos animales a la vez en un diseño de estudio paralelo, para controlar la función respiratoria de manera repetida y capturar la cinética de la respuesta en el tiempo. Además, la técnica es sencilla y puede ser aprendida en forma relativamente oportuna. En el documento, un protocolo que emplea medidas de DCP en ratones fue utilizado como un ejemplo para describir los aspectos prácticos de esta restringida técnica de pletismografía, así como para discutir los pasos críticos y relacionados con los resultados.
Cuando se trabaja con animales conscientes, es esencial para el control de las condiciones del entorno (por ejemplo, habitación tranquila con un número limitado de personas o actividad) con el fin de generar resultados reproducibles. Puesto que el restrainers vienen en varias dimensiones, es importante empezar con el tamaño adecuado para que los movimientos de respiración son imperturbable. También es útil y a menudo necesario para aclimatar a los animales para el montaje experimental y los procedimientos, como está bien establecido en ratones que la restricción afecta a la respiración frecuencia12. Dependiendo del diseño experimental o las condiciones, pueden necesitarse varias sesiones de duraciones incrementales. Por último, dejando tiempo al comienzo de un experimento para que ajustar al cambio de habitación y manejo necesario de los animales es una consideración simple que resultó eficaz para asegurarse de que el patrón de respiración es siempre regular y relajado al inicio del estudio. Trabajar en condiciones donde los animales son confortables, bien adaptado y tranquilo también será beneficioso en términos de calidad y variabilidad del resultado. También limita cualquier liberación inducida por el estrés de las catecolaminas, que pueden aumentar el calibre de las vías respiratorias y atenuar una broncoconstricción inducida.
Es importante entender que hay una necesidad de separar tan herméticamente como sea posible el flujo nasal y torácica. Dependiendo del sistema o especies estudiadas, el mecanismo de cierre puede variar en forma, así como en eficacia. En el DCP que describimos en este documento, se crea el sello entre el hocico del animal y el dispositivo de restricción. Al evaluar la función respiratoria por DCP, también es esencial para proporcionar un flujo de polarización suficiente y continuado, como una disminución en el nivel de oxígeno disponible para el animal producirá efectos significativos. Teniendo en cuenta el bienestar del animal en el limitador limita la propensión para fugas de aire por agitación y así maximiza la calidad de los datos. En contraste, una ruptura en el sello resultará en conjuntos de datos rechazados o una subestimación de algunos parámetros.
Además para permitir la grabación separada de la señal de flujo nasal, la cámara principal se utiliza normalmente para exponer al animal a sustancias aerosolized. Como se ilustra en este artículo, esto puede ser utilizado para realizar una prueba de bronchoprovocation para demostrar diferentes grados de capacidad de respuesta. En dichos experimentos, ajustar el rango de concentraciones probadas puede ser necesaria dependiendo de la especie, cepa o sexo de los animales estudiados. Como demostrado anteriormente8,9,10,27, los resultados muestran que los cambios inducidos por la metacolina en sRaw correlacionaron bien con medidas invasivas de FOT de resistencia de vía aérea. Los resultados también demuestran que la técnica DCP no es tan sensible como el FOT para que su capacidad para detectar disfunción respiratoria y para identificar una respuesta alterada dentro de los compartimientos más bajos del pulmón (tejido del pulmón o las vías aéreas periféricas pequeñas) . Puesto que las vías respiratorias del animal intactas, la presencia de las vías aéreas superiores, que representa la mayor parte de la resistencia respiratoria total al flujo de aire28, puede afectar la distribución del aerosol y deposición además de humedecer la contribución de las vías aéreas más bajas para una medición. La tabla 3 resume otras diferencias entre la técnica DCP y el FOT. Por último, si bien sería teóricamente posible estimar la resistencia de vía aérea total del animal (incluyendo las vías respiratorias superiores) de una medida de funcionamiento a pajar, se recomienda generalmente para complementar la evaluación DCP con una técnica de medición invasiva tales como el FOT29 para obtener mediciones directas de la detallada mecánica respiratoria. Dependiendo de los objetivos del estudio, las mediciones de resistencia de vía aérea superior también se pueden considerar30,31,32.
Conclusión
Debido a su limitado grado de invasividad, el DCP es una técnica que puede satisfacer una necesidad importante en la investigación respiratoria. Es capaz de proporcionar lecturas exactas del modelo ventilación en animales conscientes simultáneamente con algunos índices indiscutibles de la obstrucción del flujo de aire. La información obtenida complementa también verdaderamente de más invasivos.
Divulgaciones
DB y AR son empleados por SCIREQ científica respiratorio equipo Inc, una entidad comercial en temas relacionados con el contenido de este artículo. DB también es propietaria de acciones. SCIREQ Inc. es una empresa de tecnologías de emka.
Agradecimientos
SML es apoyado por una beca de los institutos canadienses de investigación en salud, MG es apoyado por una beca de la red de salud respiratoria de la FRQS (Fonds de recherche du Québec – Santé) y YB es becario de investigación del FRQS.
CONTRIBUCIÓN DE LOS AUTORES
Todos los autores contribuyeron a la concepción del manuscrito o el video. SML y LD recopilaron los datos. SML, LD, YB, DM, DB y AR contribuyen al análisis de datos, la generación de figuras y escritura de manuscrito. YB, AR, KL y MG estuvieron implicados en la preparación de la escritura de la video. La obra fue realizada por YB, KL y MG.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetyl-β-methylcholine chloride | Sigma-Aldrich | A-2251 | Methacholine |
| Phosphate buffered saline | Multicell | 311-506-CL | PBS 10X |
| House dust mite extract | GREER | 290902 | HDM |
| DCP complete system | SCIREQ Inc. /emka TECHNOLOGIES | ||
| iox software | SCIREQ Inc. /emka TECHNOLOGIES | ||
| Aerogen Aeroneb nebulizer | SCIREQ Inc. /emka TECHNOLOGIES | ||
| flexiVent FX complete system | SCIREQ Inc. /emka TECHNOLOGIES |
Referencias
- McGovern, T. K., Robichaud, A., Fereydoonzad, L., Schuessler, T. F., Martin, J. G. Evaluation of respiratory system mechanics in mice using the forced oscillation technique. J Vis Exp. (75), e50172 (2013).
- Bates, J. H. T. CORP: Measurement of lung function in small animals. J Appl Physiol (1985). 123 (5), 1039-1046 (2017).
- Bates, J. H., Irvin, C. G. Measuring lung function in mice: the phenotyping uncertainty principle. J Appl Physiol. 94 (4), 1297-1306 (2003).
- Lim, R., et al. Measuring respiratory function in mice using unrestrained whole-body plethysmography. J Vis Exp. (90), e51755 (2014).
- Enhorning, G., van Schaik, S., Lundgren, C., Vargas, I. Whole-body plethysmography, does it measure tidal volume of small animals?. Can J Physiol Pharmacol. 76 (10-11), 945-951 (1998).
- Vijayaraghavan, R., Schaper, M., Thompson, R., Stock, M. F., Alarie, Y. Characteristic modifications of the breathing pattern of mice to evaluate the effects of airborne chemicals on the respiratory tract. Arch Toxicol. 67 (7), 478-490 (1993).
- Willis, D. N., Liu, B., Ha, M. A., Jordt, S. E., Morris, J. B. Menthol attenuates respiratory irritation responses to multiple cigarette smoke irritants. FASEB J. 25 (12), 4434-4444 (2011).
- Neuhaus-Steinmetz, U., et al. Sequential development of airway hyperresponsiveness and acute airway obstruction in a mouse model of allergic inflammation. Int Arch Allergy Immunol. 121 (1), 57-67 (2000).
- Glaab, T., et al. Tidal midexpiratory flow as a measure of airway hyperresponsiveness in allergic mice. Am J Physiol Lung Cell Mol Physiol. 280 (3), L565-L573 (2001).
- Glaab, T., et al. Noninvasive measurement of midexpiratory flow indicates bronchoconstriction in allergic rats. J Appl Physiol (1985). 93 (4), 1208-1214 (2002).
- Pennock, B. E., Cox, C. P., Rogers, R. M., Cain, W. A., Wells, J. H. A noninvasive technique for measurement of changes in specific airway resistance. J Appl Physiol Respir Environ Exerc Physiol. 46 (2), 399-406 (1979).
- DeLorme, M. P., Moss, O. R. Pulmonary function assessment by whole-body plethysmography in restrained versus unrestrained mice. J Pharmacol Toxicol Methods. 47 (1), 1-10 (2002).
- Flandre, T. D., Leroy, P. L., Desmecht, D. J. Effect of somatic growth, strain, and sex on double-chamber plethysmographic respiratory function values in healthy mice. J Appl Physiol (1985). 94 (3), 1129-1136 (2003).
- Criee, C. P., et al. Body plethysmography--its principles and clinical use. Respir Med. 105 (7), 959-971 (2011).
- Robichaud, A., et al. Automated full-range pressure-volume curves in mice and rats. J Appl Physiol (1985). 123 (4), 746-756 (2017).
- Mizutani, N., Goshima, H., Nabe, T., Yoshino, S. Complement C3a-induced IL-17 plays a critical role in an IgE-mediated late-phase asthmatic response and airway hyperresponsiveness via neutrophilic inflammation in mice. J Immunol. 188 (11), 5694-5705 (2012).
- Nabe, T., et al. Roles of basophils and mast cells infiltrating the lung by multiple antigen challenges in asthmatic responses of mice. Br J Pharmacol. 169 (2), 462-476 (2013).
- Morris, J. B., et al. Immediate sensory nerve-mediated respiratory responses to irritants in healthy and allergic airway-diseased mice. J Appl Physiol (1985). 94 (4), 1563-1571 (2003).
- Merazzi, D., Mortola, J. P. Effects of changes in ambient temperature on the Hering-Breuer reflex of the conscious newborn rat. Pediatr Res. 45 (3), 370-376 (1999).
- Rao, R., Nagarkatti, P. S., Nagarkatti, M. Delta(9) Tetrahydrocannabinol attenuates Staphylococcal enterotoxin B-induced inflammatory lung injury and prevents mortality in mice by modulation of miR-17-92 cluster and induction of T-regulatory cells. Br J Pharmacol. 172 (7), 1792-1806 (2015).
- Agrawal, A., et al. Inhibition of mucin secretion with MARCKS-related peptide improves airway obstruction in a mouse model of asthma. J Appl Physiol (1985). 102 (1), 399-405 (2007).
- Mabalirajan, U., Aich, J., Agrawal, A., Ghosh, B. Mepacrine inhibits subepithelial fibrosis by reducing the expression of arginase and TGF-beta1 in an extended subacute mouse model of allergic asthma. Am J Physiol Lung Cell Mol Physiol. 297 (3), L411-L419 (2009).
- Desmet, C., et al. Treatment of experimental asthma by decoy-mediated local inhibition of activator protein-1. Am J Respir Crit Care Med. 172 (6), 671-678 (2005).
- Zang, N., et al. Pulmonary C Fibers Modulate MMP-12 Production via PAR2 and Are Involved in the Long-Term Airway Inflammation and Airway Hyperresponsiveness Induced by Respiratory Syncytial Virus Infection. J Virol. 90 (5), 2536-2543 (2015).
- Shukla, M., et al. Carryover of cigarette smoke effects on hematopoietic cytokines to F1 mouse litters. Mol Immunol. 48 (15-16), 1809-1817 (2011).
- Murphy, D. J. Respiratory function assessment in safety pharmacology. Curr Protoc Pharmacol. , (2003).
- Lofgren, J. L., et al. Restrained whole body plethysmography for measure of strain-specific and allergen-induced airway responsiveness in conscious mice. J Appl Physiol (1985). 101 (5), 1495-1505 (2006).
- DiMaria, G. U., Wang, C. G., Bates, J. H., Guttmann, R., Martin, J. G. Partitioning of airway responses to inhaled methacholine in the rat. J Appl Physiol (1985). 62 (3), 1317-1323 (1987).
- Hoymann, H. G. Lung function measurements in rodents in safety pharmacology studies. Front Pharmacol. 3, 156 (2012).
- Agrawal, A., Singh, S. K., Singh, V. P., Murphy, E., Parikh, I. Partitioning of nasal and pulmonary resistance changes during noninvasive plethysmography in mice. J Appl Physiol (1985). 105 (6), 1975-1979 (2008).
- McLeod, R. L., Young, S. S., Erickson, C. H., Parra, L. E., Hey, J. A. Characterization of nasal obstruction in the allergic guinea pig using the forced oscillation method. J Pharmacol Toxicol Methods. 48 (3), 153-159 (2002).
- Miyahara, S., Miyahara, N., Takeda, K., Joetham, A., Gelfand, E. W. Physiologic assessment of allergic rhinitis in mice: role of the high-affinity IgE receptor (FcepsilonRI). J Allergy Clin Immunol. 116 (5), 1020-1027 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados