Method Article
Avaliação da função respiratória em ratos conscientes por pletismografia dobro-câmara
Neste Artigo
Resumo
O objetivo do presente artigo é fornecer uma descrição detalhada dos procedimentos recomendados para avaliar a função respiratória em ratos conscientes por pletismografia dobro-câmara.
Resumo
Variações de volume de ar criadas por um sujeito consciente, respirando espontaneamente dentro de uma caixa de corpo são a base da pletismografia, uma técnica utilizada de forma não-invasiva de avaliar algumas características da função respiratória em humanos como em animais de laboratório. O presente artigo centra-se sobre a aplicação da pletismografia da dobro-câmara (DCP) em pequenos animais. Fornece informações básicas sobre a metodologia, bem como um procedimento passo a passo detalhado para avaliar a função respiratória em consciente, respirando espontaneamente os animais de uma forma não-invasiva com êxito. O DCP pode ser usado para monitorar a função respiratória de vários animais, em paralelo, bem como identificar alterações induzidas por substâncias aerossol durante um período de tempo escolhido e de forma repetida. Experiências em controle e ratos alérgicos são usadas neste documento para demonstrar a utilidade da técnica, explicar os parâmetros de resultado associado, bem como a discutir as vantagens relacionadas e deficiências. No geral, o DCP fornece leituras válidas e teoricamente som que podem ser confiáveis para avaliar a função respiratória dos animais pequenos conscientes na linha de base e depois desafios com substâncias aerossol.
Introdução
A crescente utilização de pequenos animais para doenças respiratórias humanas modelo instou o desenvolvimento de técnicas para avaliar quantitativamente as funções do sistema respiratório em animais. Atualmente, a técnica de oscilações forçadas (FOT) é reconhecida como a abordagem mais precisa para avaliar a mecânica respiratória em animais de pequeno porte1,2. No entanto, como afirma o princípio de incerteza de fenotipagem, o que se ganha em precisão de medição com o FOT é negociada fora contra uma perda em noninvasiveness3. Com efeito, as medições FOT são adquiridas nas condições experimentais altamente controladas que exigem anestesia, traqueostomia ou intubação oral, bem como a ventilação mecânica; um cenário muito longe da vida real.
Em situações onde as exigências experimentais proscrever o uso de agentes anestésicos ou ligue para pouco ou nenhum desvio do estado fisiológico natural do animal, pode considerar-se dobro-câmara pletismografia (DCP). Como seu nome indica, uma instalação DCP consiste de duas câmaras rígidas conectadas, construídas para isolar tão hermeticamente quanto possível, a cabeça do animal (ou nariz), na câmara da frente, do seu tórax, na câmara traseira. Dentro da instalação, o animal está consciente e respira espontaneamente enquanto sendo contido. Porque as paredes das câmaras não podem expandir ou retrair, o movimento do ar entrar e sair do animal gera um correspondente mas oposta da forma de onda no interior da câmara traseira, como resultado da compressão/descompressão do ar ao seu redor. A forma de onda devido ao fluxo nasal na câmara frontal e aquela relacionada com o movimento torácico na câmara posterior, portanto, pode ser separada e capturada simultaneamente. Dependendo do projeto da instalação do DCP, estas formas de onda podem ser adquiridas usando um conjunto de transdutores de pressão ou pneumotachographs respectivamente, gravar as alterações na pressão da câmara ou do fluxo de ar entrar e sair das câmaras em função do tempo. A última abordagem é mais comum nos dias de hoje.
Enquanto a frequência de respiração do animal pode ser determinada com precisão por qualquer tipo de técnicas Pletismográfica, a situação não é a mesma para a determinação do volume corrente e seus parâmetros de ventilação relacionados (por exemplo, ventilação por minuto, volume expiratório, etc.). Ao contrário da técnica de pletismografia de corpo inteiro (WBP), onde o volume corrente do animal é estimado a partir do sinal de caixa4,5, a técnica DCP fornece avaliações precisas do volume corrente. Isto está relacionado com a aquisição direta de movimento de torácica do animal na câmara traseira, que são proporcionais às mudanças no volume pulmonar durante a respiração.
Além desses parâmetros precisos ventilatórios (por exemplo, volume corrente, frequência de respiração e ventilação por minuto), alguns distúrbios na forma do ciclo respiratório também podem ser usados para investigar aspectos neuronais que governam o unidade respiratória ou reflexos respiratórios. Um exemplo específico de tal pedido seria a avaliação do potencial de irritação de substâncias inaladas nos neurônios sensoriais das vias aéreas superiores6. Aqui, a duração de uma pausa no início da expiração é determinada usando um parâmetro chamado pausa inspiratória-final (EIP), também conhecida como duração de travagem6. O prolongamento dessa pausa por uma substância irritante é associado com o fechamento da glote do animal, causando um período mensurável de travagem na primeira parte da expiração6,7.
Outra vantagem importante do DCP é que fornece dois parâmetros validados e indiscutível que são sensíveis à obstrução do fluxo de ar. Um é chamado o fluxo em meados-tidal volume expiratório e é abreviado EF508,9,10. É o fluxo de ar no volume na metade de cada respiração tidal durante a expiração. EF50 é extraído o rastreamento de fluxo torácica e pode assim ser medido sem a câmara frontal (ou seja, em uma configuração de cabeça-para fora). O outro chama-se resistência específica das vias aéreas e é abreviado sRaw11,12,13. A determinação da sRaw requer a gravação simultânea dos fluxos de nasal e torácica do animal, como ele é calculado a partir do atraso de tempo entre estes traços respiratórios separados no ponto zero fluxo no final da inspiração. A lógica que descreve a base pela qual este atraso refere-se ao sRaw foi expatiated anteriormente11. Simplificando, as mudanças no volume pulmonar precedem a circulação de ar, desde que um gradiente de pressão precisa de desenvolver-se em ordem de fluxo de ar de carro. Em um animal saudável respirar calmamente, esse atraso é normalmente muito pequeno. No entanto, o gradiente de pressão que é necessário para acomodar um determinado fluxo (por exemplo, um fluxo suficiente para fornecer a ventilação adequada) é influenciado pelo grau de resistência das vias aéreas. Durante a broncoconstrição, por exemplo, o gradiente de pressão necessária para acomodar um determinado fluxo é maior, o que implica que o animal tem que trabalhar mais para respirar. Um maior gradiente de pressão no tórax do animal também implica que uma parcela maior do fluxo de entrar e sair da câmara traseira é devido à descompressão/compressão de ar dentro do tórax, que é a parte da expansão/retração torácica total que é fora de fase com o fluxo nasal. O aumento da resistência devido a broncoconstrição assim aumentará o atraso entre a traseira e a câmara frontal e aumenta desse modo sRaw. O gradiente de pressão que impulsiona o fluxo de ar entrar e sair do pulmão também é influenciado pelo volume inicial gás torácica (TGV). A um TGV maior por exemplo, a expansão/retração do tórax necessário para gerar um determinado gradiente de pressão é maior (simplesmente porque o deslocamento do volume que é necessário para gerar um determinado gradiente de pressão é maior), o que também implica que o animal tem que trabalhar mais para respirar. Novamente, estes deslocamentos extra torácicos são aqueles necessários para descompactar/comprimir ar no tórax e são, portanto, fora de fase com o fluxo nasal. Então, um aumento de TGV também aumentará o atraso entre as câmaras e aumenta desse modo sRaw. Como pode ser visto, tanto a broncoconstrição e aumento TGV resultam em um esforço mais importante para extrair o ar entrar e sair do pulmão. Isto é, em essência, o significado fisiológico da sRaw. Ele representa o trabalho necessário para5,14de respiração.
Assim, é importante compreender que a influência de dois fatores distintos sRaw: TGV e resistência das vias aéreas. Na verdade, o sRaw pode ser expressa como o produto da resistência das vias aéreas e TGV11. Animais conscientes podem modificar seu TGV à vontade, como para se adaptar a sua ventilação para um determinado ambiente. Sob tais condições, onde o estado fisiológico natural do animal é inalterado, assim é impossível discernir se uma mudança na sRaw decorre de uma alteração na resistência das vias aéreas, de uma mudança no TGV ou de uma mistura dos dois. Portanto, é recomendável para complementar a avaliação de DCP com mais medições invasivas da mecânica respiratória e/ou volumes de pulmão, como os fornecidos pelo FOT1,15.
Até à data, o DCP tem sido usado em várias aplicações de pesquisa. A técnica pode ser usada com ou sem câmara de cabeça para quantitativamente e avaliar com precisão o efeito de várias substâncias, tais como farmacêuticos, alérgenos, irritantes ou outros mediadores, na função respiratória em animais de pequenos porte conscientes 16,17,18. A câmara frontal também pode ser usada como uma câmara expondo a substâncias aerossol ou variados gás concentrações (hipóxia, hipercapnia, etc)19. Convenientemente, permite medir concomitantemente dos efeitos agudos dessas exposições. Na verdade, um dos usos comuns do DCP é avaliar o grau de capacidade de resposta à Metacolina aerossol em diferentes modelos de doenças respiratórias20,21,22,23, 24 , 25.
Embora a técnica DCP é aparentemente simples, alguns desafios práticos potencialmente poderiam desencorajar os usuários inexperientes ou prejudicar a precisão e a reprodutibilidade dos resultados. O presente trabalho fornece uma descrição detalhada dos procedimentos recomendados para a função respiratória com sucesso recorde pelo DCP em camundongos conscientes, comedidos, respirando espontaneamente. A descrição é específica para o equipamento indicado (consulte a Tabela de materiais). O utilitário e o valor do DCP também é demonstrada em um modelo comum de inflamação alérgica pulmonar em duas linhagens de camundongos testados na linha de base e em resposta à Metacolina aerossol.
Protocolo
Os procedimentos a seguir foram aprovados pelo Quebec coração e pulmão Instituto Animal conta Comité em conformidade com as diretrizes do Conselho canadense no cuidado Animal (CCAC).
1. preparação
- Estudo
- (Crítica) Antes de realizar qualquer experimento, obter as aprovações apropriadas (por exemplo, IACUC) e treinamentos (por exemplo, manipulação de animais).
- Familiarize-se com o equipamento e o software operacional. O manual do usuário e, se necessário, crie um arquivo de configuração para definir o número de sites, sinais, analisadores e parâmetros de entrada.
Nota: Certifique-se de selecionar uma alta taxa de amostragem (2 KHz). - Configure as definições de analisadores para os parâmetros de interesse.
- Selecione Tuning na barra de ferramentas e em seguida analisadores.
- Ajustar o limite de fluxo para um valor que separa corretamente as respirações (rato: 0,5 mL/s) e optar por Ti + Te calcular a taxa de respiração.
- Defina um valor para a pressão atmosférica (760 mm Hg) e especificar o desvio máximo de volume inspiratório/expiratório para respirar para serem considerados válidos (rato: 20%).
- Clique em configuração no campo calculado parâmetros para ajustar os limites de aceitação.
Nota: As configurações a seguir foram utilizadas para os experimentos descritos rato: tempo de inspiração, 50 a 170 ms; tempo de expiração, 40 a 180 ms; frequência da respiração, 30 a 450 bpm; Resistência específica das vias aéreas, de 0 a 15 cmH2O·s; fluxo de midexpiratory com uma precisão de pelo menos 3 casas decimais. - Uma vez concluída, selecione aplicar e fechar para sair da janela de diálogo.
- No menu de barra de ferramenta, ir para Tuning novamente e, depois, armazenamento para definir uma taxa de armazenamento de dados desejado. Clique em aplicar e fechar para sair da janela.
Nota: Em média a cada 10 s é normalmente usado. - Crie um protocolo dentro do software operacional para definir uma sequência de comandos e o tempo desejado para cada um. Um exemplo é exibido na Figura 1.
- Se o experimento envolve a administração de uma substância por aerossol, prepare as soluções adequadas e diluições de acordo com as concentrações a ser testado.
- Animal
- Trabalhe em uma área tranquila remota da sala de habitação. Permitir que os animais se ajustar à mudança do ambiente.
- Pesar os animais e selecione o tamanho adequado de contenção.
- (Crítica) Adapte os animais para a retenção e procedimentos antes do início do experimento. Dependendo do design experimental, várias sessões de aclimatação de aumentar a duração (por exemplo, 5-30 min) podem ser necessários.
Nota: Animais que não se aclimatar devem ser retirados do estudo.- Em cada sessão de aclimatação, inserir o animal dentro da retenção, procedentes de volta à abertura; segurar o dispositivo na vertical pode ser útil.
- Uma vez que o animal está em posição, insira o êmbolo volta e suavemente trancá-lo sem aplicar força excessiva.
- (Crítica) Verifique visualmente que o animal respira normalmente. Se necessário, ajuste sua posição movendo o mecanismo de travamento. Certifique-se que narinas do animal estão projetando-se fora do cone de nariz com seu focinho encostadas às paredes interiores da retenção.
- Retire o painel traseiro da câmara torácica, inserir a retenção contendo o animal através da borracha abertura na câmara torácica e fechar a câmara.
- Anexar a câmara principal e fornecer um fluxo de viés. Use um fluxo de 0,5 L/min para um rato.
- Permitir que o animal relaxar por 5 min.
- Uma vez que o animal está calmo, inicie a gravação dos sinais de fluxo nasal e torácica. Verifique se na tela do computador que os traços são suaves e que eles exibem um padrão de respiração regular; consulte o exemplo na Figura 2.
Nota: Se o protocolo envolve a administração de aerossóis de uma substância, um desafio salino pode ser incluído no processo de aclimatação. - No final de cada sessão, retire o animal da câmara torácica e a retenção e devolvê-lo à sua habitação gaiola e quarto.
- Equipamentos
- No dia do experimento, iniciar uma sessão experimental e carregar o arquivo de configuração apropriado.
Nota: Verifique se que ele contém o protocolo desejado para o experimento. - Vá para executar no menu da barra de ferramenta. Insira a experiência e a do animal. Uma vez feito, clique no botão executar na parte inferior da janela.
- Prosseguir com a calibração do sistema. Calibrar a cada site e sinal de entrada separado.
- Ligue o gerador de fluxo diagonal, conectá-lo à câmara de cabeça através de um pedaço de tubo e ajustar a taxa de fluxo.
- Feche a abertura superior da câmara de cabeça com um boné.
- Retirar o painel traseiro da câmara torácica, firmemente, insira a ferramenta de calibração dentro da borracha abertura entre a cabeça e a câmara de corpo para criar um selo hermético. Feche e volte a colocar o painel traseiro da câmara torácica.
- Verifique se que o orifício lateral da câmara torácica é limitado.
- O menu de barra de ferramenta de software, acesse Tuning e, em seguida, calibrar.
- Vá para a entrada 1 (torácica) e selecione calibrar para iniciar a caixa de diálogo de calibração para o sinal de fluxo torácica.
- (Crítica) Verifique se que os parâmetros listados na janela de diálogo de calibragem exibem as configurações apropriadas, ou seja, estresse físico aplicado valor baixo: 0; Estresse físico aplicado elevado valor:-20 mL/s; Amostras: integrar. Uma vez feito, clique em baixo na janela de amostras .
- Verifique se o sinal gerado é constante através da janela de exibição e, em seguida, clique em fechar.
- Conecte uma seringa 20 mL através da porta lateral da câmara torácica usando um conector de plástico e um pedaço de tubo.
- (Crítica) Selecionar alta na janela amostras e imediatamente injetar 20ml de ar na câmara durante um período de s 2 em uma taxa de fluxo tão constante quanto possível.
- Verifique se o sinal gerado aparece completamente dentro da janela de exibição. Use o ícone de seta para verificar se o sinal é centrado e simétrica em torno da linha zero. Em seguida, clique em fechar. Remover qualquer deslocamento de zero clicando em remover AC deslocamento na janela amostras
Nota: A calibração de alto valor pode ser refeita, se necessário. - Verifique se o resultante Scaled escala de entrada está dentro da faixa recomendada (rato: ±280 para ±420 mL/s). (Crítica) Repita as etapas de calibração, se os valores estiverem fora do intervalo aceitável.
- Calibre a câmara de cabeça em uma maneira similar como a câmara torácica (etapa 1.3.3.6). Desta vez, selecione a entrada 2 (nasal).
Nota: (Importante) O valor para o estresse físico aplicado de alto valor deve ser definido como + 20 mL/s. Isso vai mudar a polaridade do fluxo na câmara frontal em relação a câmara traseira. Assim, quando o animal está a respirar, os fluxo de dois sinais quase será em fase, além do atraso usado para calcular sRaw.
- No dia do experimento, iniciar uma sessão experimental e carregar o arquivo de configuração apropriado.
2. as medidas de função pulmonar
- Pesar os animais e Observe seus pesos de corpo.
- Inserir o animal dentro da retenção e coloque-o dentro da câmara de pletismografia torácica (etapas 1.2.3.1 para 1.2.3.5).
- Permitir que o animal relaxar pelo menos 5 min.
- Iniciar o protocolo de comandos selecionando o primeiro passo e, em seguida, clique em executar.
- Verifique na tela do computador que a respiração do animal os sinais são regular e liso (Figura 2). O software exibe automaticamente os parâmetros calculados numa base de respiração-por-respiração. Verifique se que os parâmetros do animal são estáveis.
- Grave o padrão de respiração em condições de linha de base para até 10 minutos.
- Para protocolos que envolvem a administração de uma substância por aerossol, faça o seguinte:
- Ajuste o nebulizador do tempo e dever ciclo, conforme necessário.
Nota: Nos exemplos demonstrados neste artigo, o nebulizador foi operado em um ciclo de serviço de 5% para 10 s. - Realizar um desafio do veículo (por exemplo, solução salina) e gravar a resposta.
- Se necessário, expor o animal a aumentar as concentrações da substância, alterando a concentração no nebulizador em escalada etapas (por exemplo, dobrando as concentrações). Grave a resposta depois de cada administração.
- No final da sessão experimental, se não for feito automaticamente, parar a gravação e devolver o animal para sua gaiola de habitação e o quarto.
- Ajuste o nebulizador do tempo e dever ciclo, conforme necessário.
- Se necessário, selecione executar no menu de barra de ferramenta para executar outra sessão experimental.
- Entre as sessões, limpe as câmaras pletismografia e passe o nebulizador com água.
Nota: O uso de álcool pode causar danos irreversíveis a pletismografia.
- Entre as sessões, limpe as câmaras pletismografia e passe o nebulizador com água.
- Se o estudo envolve avaliações repetidas ao longo do tempo, repita a sequência inteira de medição em cada commit escolhido.
Nota: Recomenda-se sabiamente para complementar o estudo com algumas medidas precisas de mecânica respiratória e/ou volumes de pulmão1,15.
3. análise de dados
Nota: O software automaticamente salva o arquivo experimental e exporta os parâmetros gravados quando a sessão experimental é fechada.
- Calcule uma média de linha de base para os parâmetros de interesse para cada grupo de animal e experimental.
Nota: tabela 1 enumera uma série de parâmetros típicos, categorizados com base no tipo de informação que eles fornecem. - Quando relevante, avaliar o efeito da substância aerossol estudada sobre os parâmetros de interesse a cada concentração usando um ponto específico (por exemplo, valor máximo ou mínimo), uma média ou o curso a tempo inteiro; também pode ser considerada uma normalização para linha de fundo.
- Relate os resultados usando os meios de grupo e erros em uma tabela ou um formato gráfico. Analise os resultados estatisticamente.
Nota: No presente estudo, ANOVA de duas vias com repetidas medidas foram utilizadas para avaliar o efeito de metacolina, o alérgeno – casa-ácaro (HDM) – e sua interação em diferentes leituras do DCP (sRaw e EF50), bem como em diferentes leituras FOT (R,N, G e H), em ambas as cepas de ratos. Testes de comparação múltipla do Sidak foram então usados para determinar as concentrações de metacolina na qual os ratos alérgicos diferem os ratos controle. Os mesmos testes foram utilizados para avaliar o efeito de dias, HDM e sua interação na linha de base (ou seja, antes de metacolina) em leituras de obstrução das vias aéreas (sRaw e EF50) e do padrão de ventilação (BF, TV, MV e EIP). Correlações de Pearson foram usadas para avaliar as correlações entre sRaw obtidos com o DCP e RN obtidos com o FOT. Todas as análises estatísticas e gráficos foram realizados usando o software estatístico padrão alternativo (por exemplo, GraphPad Prism). p ≤ 0,05 foram considerado suficiente para rejeitar a hipótese nula.
Resultados
Os resultados das avaliações repetidas da função respiratória por DCP, realizadas sob condições de linha de base em três dias consecutivos (dias 12, 13 e 14 do protocolo ilustrado na Figura 1) no controle e alérgicos camundongos BALB/c, são mostrados em Figura 3 . Os parâmetros que foram selecionados para avaliar o padrão de respiração incluídos respirando frequência (Figura 3A), volume corrente (Figura 3B), ventilação por minuto (Figura 3) e pausa inspiratória-final (Figura 3D). Os parâmetros utilizados para avaliar a obstrução das vias aéreas foram EF50 (Figura 3E) e sRaw (Figura 3F). Os resultados de cada parâmetro seleccionado foram estáveis ao longo destes três dias consecutivos em ambos os grupos, com nenhum efeito aparente, causada pela inflamação alérgica.
O grau de capacidade de resposta à Metacolina foi avaliado pelo DCP em dias sucessivos (dias 12, 13 e 14 do protocolo ilustrado na Figura 1) no controle e alérgicos camundongos BALB/c. Os resultados, mostrados na Figura 4, exibem as alterações nos dois parâmetros que são sensíveis a obstrução das vias aéreas, nomeadamente sRaw (Figura 4A, B e C) e EF50 (Figura 4, E e F). Como esperado, concentrações incrementais de metacolina aumentaram progressivamente sRaw e diminuíram progressivamente EF50. Estas respostas foram potencializadas pela inflamação alérgica, especialmente na concentração final testada, que atestou a presença de hyperresponsiveness. Os resultados também demonstram que o exagerado grau de responsividade limitou-se o primeiro dia (dia 12), como não foi observado durante as duas avaliações subsequentes (isto é, nos dias 13 e 14).
Os resultados da avaliação da mecânica respiratória pelo FOT, realizada no último dia do protocolo experimental (dia 15; A Figura 1) tanto no controle como alérgicos camundongos BALB/c, são mostrados na Figura 5. Estas experiências foram incluídas no estudo para complementar as avaliações do DCP. O FOT é reconhecido como uma abordagem mais precisa para avaliar a função respiratória2. Um dos seus pontos fortes é que ele fornece introspecções topográficas sobre quais sites do pulmão (realização de vias aéreas versus vias aéreas periféricas e tecido pulmonar) são afetados por intervenções testadas (por exemplo, alérgeno e metacolina). A metodologia recomendada para avaliar a mecânica respiratória com o FOT foi descrito anteriormente1. Neste documento, três parâmetros FOT foram usados para descrever as alterações na mecânica respiratória induzida pela metacolina e inflamação alérgica. Estes parâmetros incluídos: 1-Newtoniano resistência (RN; Figura 5A), um parâmetro para que as alterações no valor principalmente refletir variações na resistência das vias aéreas realizando grandes; 2-tecido amortecimento (G; Figura 5B), um parâmetro para que as alterações no valor principalmente refletir variações na resistência do tecido; e 3-tecido elastância (H; A Figura 5), um parâmetro para que as alterações no valor principalmente refletir variações em tecido rigidez2. Como esperado, houve um aumento em cada um desses parâmetros em resposta a concentrações incrementais de metacolina. Consistente com o sRaw e EF50 resultados obtidos com o DCP do dia anterior (dia 14; A Figura 1), as mudanças em RN induzida pela metacolina (Figura 5A) eram comparáveis entre o controle e os ratos alérgicos. Na verdade, os valores de sRaw no dia 14 correlacionaram com os valores de RN no dia 15 (Figura 5). O aumento em H induzida pela metacolina também foi semelhante entre o controle e os ratos alérgicos (Figura 5B). No entanto, o aumento induzido por metacolina G foi significativamente maior nos ratos alérgicos (Figura 5). Este resultado demonstra a presença de um fenótipo hyperresponsive persistentes nos ratos alérgicos no dia 15, que não foi detectado pelas DCP avaliações realizadas nos dois dias anteriores.
O estudo inteiro foi repetido com camundongos C57BL/6. Os resultados das avaliações sucessivas DCP do sRaw, no dias 12, 13 e 14 do protocolo (Figura 1) e da avaliação FOT do RN, no dia 15, são mostrados na Figura 6. Em tensão que rato específico, a resposta exagerada metacolina observada nos ratos alérgicos foi mantida ao longo dos três dias consecutivos (figura 6A, Be C). Este fenótipo hyperresponsive também foi retratado com o FOT no dia 15, por um aumento de RN induzido pela metacolina que foi mais pronunciada nos ratos alérgicos (Figura 6E). Estes eram, em contraste com os resultados obtidos com os camundongos BALB/c, onde um declínio progressivo do hyperresponsiveness ocorreu dos dias 12 a 14 (Figura 4) e observou-se uma falta de diferença na ascensão induzida pela metacolina em RN no dia 15 (Figura 5A). Juntos, esses resultados indicaram um efeito tempo-variando de alérgeno na resposta entre as duas cepas de ratos induzida pela metacolina. Importante, esta diferença de tensão foi descrita por ambos o DCP e o FOT. Respondendo, os valores de sRaw medido pelo DCP no dia 14 correlacionaram com os valores de RN medido pelo FOT no dia 15 (Figura 6F), como foi observado com os camundongos BALB/c (Figura 5).

Figura 1 . Protocolos utilizados para induzir a inflamação alérgica pulmonar e para avaliar o grau de capacidade de resposta à Metacolina. Este estudo foi conduzido em feminino BALB/c e camundongos C57BL/6, de 7 a 9 semanas de idade. A sequência das intervenções realizadas sobre o estudo inteiro é mostrada no painel (A). Metade dos ratos foi exposto a 50 µ g de extrato de casa-ácaro (HDM) practicar em 14 dias consecutivos de induzir inflamação pulmonar alérgica. A outra metade foi exposta ao soro fisiológico e usada como controle. Função respiratória foi avaliada pelo dobro-câmara pletismografia (DCP) em três ocasiões distintas (dias 12, 13 e 14; círculos pretos) após uma sessão de aclimatação (dia 11; círculo cinzento) que incluiu um desafio com solução salina de aerossol. Durante cada sessão, a função respiratória de base e a resposta à Metacolina foram avaliados usando o protocolo automatizado mostrado no painel (B). No dia 15, realizou-se uma avaliação invasiva da mecânica respiratória com a técnica de oscilações forçadas (FOT) como descrito anteriormente,1. Clique aqui para ver uma versão maior desta figura.
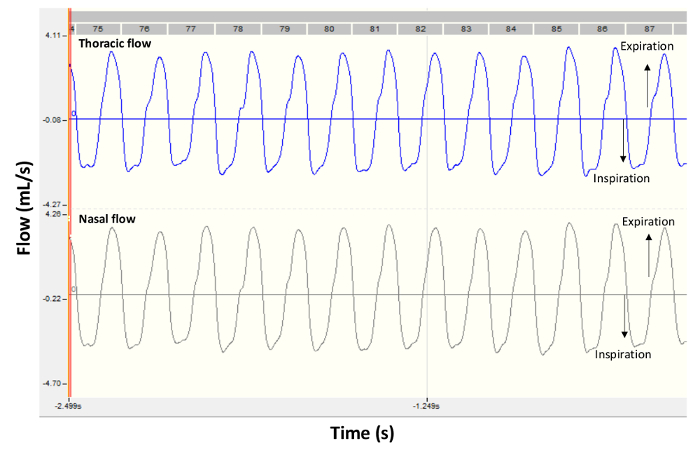
Figura 2 . Sinais de fluxo representativo de um rato saudável de BALB/c. Os painéis mostram traços de gravação típico obtidos por pletismografia dobro-câmara em um rato de controle sob condições de linha de base. Fluxo torácico é mostrado no painel superior e fluxo nasal é exibido no painel inferior. Valores negativos são durante a inspiração e valores positivos durante a expiração. Clique aqui para ver uma versão maior desta figura.
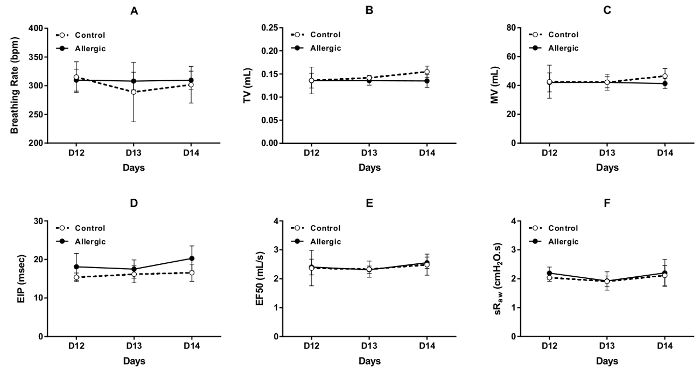
Figura 3 . Repetidas avaliações de função respiratória em conscientes camundongos BALB/c. A função respiratória de base foi avaliada por pletismografia dobro-câmara (DCP) no controle (símbolos abertos) e ratos alérgica (símbolos sólidos) nos dias 12, 13 e 14 do protocolo ilustrado na Figura 1. Os parâmetros DCP utilizados para avaliar a função respiratória incluída respirando frequência no (A), volume corrente (TV) em (B), ventilação por minuto (MV) em (C) final inspiratória pausar (EIP) em (D), o fluxo em meados-tidal volume expiratório ( EF50) em (E) e a resistência das vias aéreas específicas (sRaw) (F). Os valores de frequência, TV, MV, sRaw e EIP de respiração para cada mouse foram que os valores médios registados mais de 1,5 min. O valor de EF50 era o valor mínimo obtido durante este período de gravação. Os resultados são apresentados como grupo média ± desvio padrão (n = 5/grupo). Clique aqui para ver uma versão maior desta figura.

Figura 4 . Teste de Broncoprovocação com bronchoprovocation em conscientes camundongos BALB/c. Broncoprovocação com capacidade de resposta foi avaliada por pletismografia dobro-câmara (DCP) no controle (símbolos abertos) e ratos alérgica (símbolos sólidos) nos dias 12, 13 e 14 do protocolo ilustrado na Figura 1. Os parâmetros DCP utilizados para avaliar a resposta incluídos resistência de vias aéreas específicas (sRaw) no (A) através de (C) e fluxo em meados-tidal volume expiratório (EF50) em (D) a (F). O bronchoprovocation foi realizada por aerosolizing metacolina na câmara principal do DCP para 10 s em concentrações incrementais. A resposta foi monitorada durante 1,5 min após cada concentração. O valor de sRaw para cada mouse para cada concentração foi que o valor médio registado mais de 1,5 min. O valor de EF50 era o valor mínimo obtido durante este período de gravação. Os resultados são apresentados como grupo média ± desvio padrão (n = 5/grupo). O símbolo de asterisco * designa uma diferença estatisticamente significativa (p 

Figura 5 . Avaliação invasiva da mecânica respiratória em camundongos BALB/c. Mecânica respiratória na linha de base e em resposta à Metacolina foi avaliada pela técnica de oscilações forçadas (FOT) no dia 15 do protocolo ilustrado na Figura 1. O controle (símbolos abertos) e os ratos alérgica (símbolos sólido) foram os mesmos que os testados por pletismografia dobro-câmara (DCP) nos dias 12, 13 e 14. Os parâmetros utilizados para avaliar a mecânica respiratória foram resistência newtoniana (RN) em (A), tecido elastância (H) em (B) e tecido de amortecimento (G) em (C). O bronchoprovocation foi realizada por nebulização concentrações incrementais de metacolina diretamente no tubo endotraqueal de ratos anestesiados, tracheotomized, paralisados e ventilação mecânica em posição supina. A resposta foi monitorada durante 5 min após cada concentração. O valor para cada parâmetro para cada mouse para cada concentração era o valor do pico obtido durante este período de gravação. Os resultados são apresentados como grupo média ± desvio padrão (n = 5/grupo). Painel (D) mostra a correlação entre a resistência das vias aéreas específicas (sRaw) medido pelo DCP no dia 14 e RN medido pelo FOT no dia 15. Os símbolos abertos representam os valores na linha de base e os símbolos sólidos representam os valores de máximas com a maior concentração de metacolina testada para o controle (círculos) ou os ratos alérgica (praças). A inserção mostra o coeficiente de determinação (r2). O símbolo de asterisco * designa uma diferença estatisticamente significativa (p ≤ 0,05). Clique aqui para ver uma versão maior desta figura.
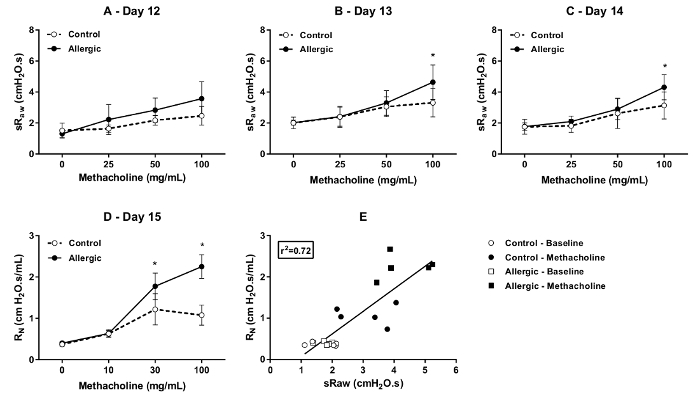
Figura 6 . Função respiratória e mecânica respiratória invasiva em camundongos C57BL/6. Resistência específica das vias aéreas (sRaw) foi avaliada pelo dobro-câmara pletismografia (DCP) na linha de base e em resposta à Metacolina em controle (símbolos abertos) e ratos alérgica (símbolos sólidos) nos dias 12 (A), 13 (B) e 14 (C) do protocolo, ilustrado na Figura 1. Resistência newtoniana (RN) na linha de base e em resposta à Metacolina foram avaliados pela técnica de oscilações forçadas (FOT) no dia 15 (D). Os bronchoprovocations foram realizados conforme descrito na Figura 4 e Figura 5 para o DCP e o FOT, respectivamente. Os resultados são apresentados como grupo média ± desvio padrão (n = 5/grupo). Painel (E) mostra a correlação entre sRaw medido pelo DCP no dia 14 e RN medido pelo FOT no dia 15. Os símbolos abertos representam os valores na linha de base e os símbolos sólidos representam os valores de máximas com a maior concentração de metacolina testada para o controle (círculos) ou os ratos alérgica (praças). A inserção mostra o coeficiente de determinação (r2). O símbolo de asterisco * designa uma diferença estatisticamente significativa (p ≤ 0,05). Clique aqui para ver uma versão maior desta figura.
| Parâmetro | Unidade | Descrição | Informações |
| F | BPM | Frequência de respiração | Padrão de ventilação |
| TV | mL | Volume corrente | |
| MV | mL | Ventilação por minuto | |
| Ti | MS | Tempo inspiratório | |
| Te | MS | Tempo expiratório | |
| PIF | mL/s | Pico de fluxo inspiratório | |
| PEF | mL/s | Pico de fluxo expiratório | |
| EV | mL | Volume expiratório | |
| NTV | mL | Volume corrente nasal | |
| NEV | mL | Volume expiratório nasal | |
| EIP | MS | Pausa inspiratória final | |
| EEP | MS | Pausa expiratória final | |
| dT | MS | Tempo de atraso | Obstrução do fluxo de ar |
| sRaw | cmH2O·s | Resistência específica das vias aéreas | |
| sGaw | 1/cmH2O·s | Condutância específica das vias aéreas | |
| EF50 | mL/s | Fluxo em meados-tidal volume expiratório | |
| Sr | % | Taxa de sucesso | Controle de qualidade |
| N | Número de respirações válidos |
Tabela 1. Lista de parâmetros típicos obtidos da dobro-câmara pletismografia. Os parâmetros foram agrupados de acordo com a natureza da informação fornecem durante uma avaliação da função respiratória.
| Vantagens | Limitações |
| · Animais conscientes | · Necessidade de controlar o meio ambiente |
| · Parâmetros de ventilação exatos | · Aclimatação prévia dos animais |
| · Índices indiscutível de obstrução do fluxo de ar (sRaw, EF50) | · Requisito para separar hermeticamente os fluxos nasais e torácicos |
| · Adaptável a vários tamanhos de espécies e animal | · Variabilidade do valor absoluto para alguns parâmetros de resultado |
| · Usados em muitas aplicações de pesquisa | · sRaw não uma verdadeira medida da resistência |
| · Técnica simples | · Presença de vias aéreas superiores |
| · Sensível a mudar | · Complementando as medições com uma avaliação invasiva |
Tabela 2. Lista de vantagens e limitações associadas a pletismografia dobro-câmara.
| Dobro-câmara pletismografia | Técnica de oscilação forçada | |
| Estado do animal de consciência | Inalterado | Anestesiado (e geralmente paralisado) |
| Posição do animal | Posição vertical | Supina |
| Acessibilidade do animal | Confinado dentro da câmara | Acessível |
| Integração de animais para o dispositivo de medição | Selo de nariz ou pescoço | Intubação traqueostomia ou oral |
| Árvore de vias aéreas do animal | Intacta | Parcial – segmento da via aérea superior excluído (condutas ou seja, nasais, faringe e laringe) |
| Volume pulmonar no qual são obtidos os parâmetros de resultado | Variável - volume espontânea adotado pelo animal | Padronizado - usando manobras de recrutamento controlado e pressão expiratória final positiva. |
| Frequência na qual são avaliados os parâmetros de resultado | Variável - frequência de respiração espontânea, adotado pelo animal | Controlados - usando formas de onda predefinidas em frequências especificadas |
| Participação do segmento das vias aéreas superiores para os parâmetros de resultado | De esperar | Contornado |
| Local de entrega do aerossol | Dentro da câmara de cabeça | Diretamente na traqueia |
| Efeito do segmento das vias aéreas superiores na dose inalada / padrão de deposição de aerossol | De esperar | Impedido |
| Capacidade de detectar alteração - baseada nos resultados do presente estudo | Observada | Observada |
| Variabilidade inerente da técnica - baseada nos resultados do presente estudo | Variação do coeficiente de variação para sRaw na linha de base: 7,5-20,6% | Variação do coeficiente de variação para RN na linha de base: 3.6-13,4% |
Tabela 3. Comparação entre as técnicas de oscilação forçada e dobro-câmara pletismografia.
Discussão
A capacidade de medir a função pulmonar em animais conscientes é claramente justificada na investigação respiratória. Em geral, o DCP é uma abordagem interessante para avaliar a função de ventilação do aparelho respiratório no consciente e respirando espontaneamente animais26. Mais especificamente, o DCP, ou sua variante de cabeça-para fora, muitas vezes atinge um certo equilíbrio entre a qualidade das informações prestadas e o nível desejado de invasividade3 (tabela 2). A técnica pode ser adaptada para várias espécies (por exemplo, rato, rato, cobaia) ou animais de tamanhos e pode ser usada em muitas aplicações de pesquisa. É particularmente útil para avaliar a numerosos animais ao mesmo tempo em um projeto de estudo paralelo, para monitorar a função respiratória de forma repetida e capturar a cinética da resposta ao longo do tempo. Além disso, a técnica é simples e pode ser aprendida de forma relativamente oportuna. No presente trabalho, um protocolo empregando medidas do DCP em ratos foi usado como um exemplo para descrever os aspectos práticos do presente contido técnica pletismografia, bem como para discutir os passos críticos e relacionadas com os resultados.
Quando se trabalha com animais conscientes, é essencial para controlar as condições do ambiente circundante (por exemplo, quarto silencioso com um número limitado de pessoas ou atividade) a fim de gerar resultados reprodutíveis. Desde que os aparelhos vêm em várias dimensões, é importante começar com o tamanho adequado para que os movimentos de respiração são imperturbável. Também é útil e muitas vezes necessário para se aclimatar os animais para a montagem experimental e procedimentos, como é bem conhecido em camundongos que restrição afeta a frequência de respiração12. Dependendo do delineamento experimental ou condições, podem ser necessárias várias sessões de durações incrementais. Finalmente, permitindo tempo no início de uma experiência para os animais ajustar para a mudança de sala e manipulação necessária é uma consideração simples que se mostrou eficaz para garantir que o padrão de respiração é consistentemente regular e descontraída na linha de base. Trabalhando sob condições onde os animais são confortáveis, bem adaptados e calmo também será benéfico em termos de qualidade e variabilidade do resultado. Ela também limita qualquer liberação induzida por estresse de catecolamina, que pode aumentar o calibre das vias aéreas e atenuar uma broncoconstrição induzida.
É importante compreender que há uma necessidade de separar tão hermeticamente quanto possível os fluxos nasais e torácicos. Dependendo do sistema ou espécies estudadas, o mecanismo de vedação pode variar em forma, bem como em eficácia. O DCP nós aqui descritos, o selo é criado entre o focinho do animal e o dispositivo de restrição. Ao avaliar a função respiratória por DCP, também é essencial para fornecer um fluxo contínuo e suficiente de viés, como uma diminuição do nível de oxigênio disponível para o animal irá resultar em efeitos significativos. Tendo em conta o bem-estar do animal a retenção limita a propensão para vazamentos de ar criado por agitação e assim maximiza a qualidade dos dados. Por outro lado, estima, uma quebra no selo da resultará em conjuntos de dados rejeitados ou subestimação de alguns parâmetros.
Além para habilitar a gravação separada do sinal do fluxo nasal, câmara de cabeça normalmente é usada para expor o animal a substâncias aerossol. Conforme ilustrado neste artigo, este pode ser utilizado para executar um teste de bronchoprovocation para demonstrar diferentes graus de capacidade de resposta. Em tais experiências, ajustar o intervalo de concentrações testadas pode ser necessários dependendo da espécie, estirpe ou sexo dos animais estudados. Como demonstrado anteriormente8,9,10,27, os presentes resultados mostram que as alterações induzidas pelo metacolina na sRaw correlacionaram com medições de FOT invasivas da resistência das vias aéreas. Os resultados também demonstram que a técnica DCP não é tão sensível como o FOT por sua capacidade para detectar disfunção respiratória e identificar uma resposta alterada, localizada dentro dos compartimentos inferiores do pulmão (tecido pulmonar e/ou pequenas vias aéreas periféricas) . Desde que vias aéreas do animal estão intactas, a presença de vias aéreas superiores, que esclarece a maior parte da resistência ao fluxo de ar28respiratória total, pode afetar a distribuição de aerossóis e deposição em adição para amortecer a contribuição do as vias respiratórias inferiores para uma medição. Tabela 3 resume outras diferenças entre a técnica DCP e o FOT. Finalmente, embora seja teoricamente possível estimar a resistência de vias aéreas total do animal (incluindo vias aéreas superiores) de uma medida de sRaw, geralmente é recomendado para complementar a avaliação de DCP com uma técnica de medição invasiva, tais como o FOT29 para obter medições directas da mecânica respiratória detalhadas. Dependendo dos objectivos do estudo, as medições da resistência das vias aéreas superiores também podem ser consideradas30,31,32.
Conclusão
Devido ao seu limitado grau de invasividade, o DCP é uma técnica que pode satisfazer uma necessidade importante na investigação respiratória. É capaz de fornecer leituras precisas de padrão de ventilação em animais conscientes simultaneamente com alguns índices indiscutível de obstrução do fluxo de ar. As informações obtidas também verdadeiramente que complementa de abordagens mais invasivas.
Divulgações
DB e AR são empregados por SCIREQ científica respiratória equipamento Inc, uma entidade comercial envolvidos em temas relacionados com o conteúdo deste artigo. DB também possui ações. SCIREQ Inc. é uma empresa de tecnologias de emka.
Agradecimentos
SML é suportado por uma bolsa de estudo dos institutos canadenses de pesquisa em saúde, MG é apoiado por uma bolsa da rede saúde respiratória da FRQS (de Fonds recherche du Québec – Santé) e YB é um estudioso de pesquisa de FRQS.
CONTRIBUIÇÃO DOS AUTORES
Todos os autores contribuíram para a concepção do manuscrito e/ou o vídeo. SML e LD coletaram os dados. SML, LD, YB, DM, DB e AR contribuiram para a análise dos dados, a geração de figuras e a escrita do manuscrito. YB, AR, KL e MG foram envolvidos na elaboração do roteiro de vídeo. A obra foi realizada por YB, KL e MG.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetyl-β-methylcholine chloride | Sigma-Aldrich | A-2251 | Methacholine |
| Phosphate buffered saline | Multicell | 311-506-CL | PBS 10X |
| House dust mite extract | GREER | 290902 | HDM |
| DCP complete system | SCIREQ Inc. /emka TECHNOLOGIES | ||
| iox software | SCIREQ Inc. /emka TECHNOLOGIES | ||
| Aerogen Aeroneb nebulizer | SCIREQ Inc. /emka TECHNOLOGIES | ||
| flexiVent FX complete system | SCIREQ Inc. /emka TECHNOLOGIES |
Referências
- McGovern, T. K., Robichaud, A., Fereydoonzad, L., Schuessler, T. F., Martin, J. G. Evaluation of respiratory system mechanics in mice using the forced oscillation technique. J Vis Exp. (75), e50172 (2013).
- Bates, J. H. T. CORP: Measurement of lung function in small animals. J Appl Physiol (1985). 123 (5), 1039-1046 (2017).
- Bates, J. H., Irvin, C. G. Measuring lung function in mice: the phenotyping uncertainty principle. J Appl Physiol. 94 (4), 1297-1306 (2003).
- Lim, R., et al. Measuring respiratory function in mice using unrestrained whole-body plethysmography. J Vis Exp. (90), e51755 (2014).
- Enhorning, G., van Schaik, S., Lundgren, C., Vargas, I. Whole-body plethysmography, does it measure tidal volume of small animals?. Can J Physiol Pharmacol. 76 (10-11), 945-951 (1998).
- Vijayaraghavan, R., Schaper, M., Thompson, R., Stock, M. F., Alarie, Y. Characteristic modifications of the breathing pattern of mice to evaluate the effects of airborne chemicals on the respiratory tract. Arch Toxicol. 67 (7), 478-490 (1993).
- Willis, D. N., Liu, B., Ha, M. A., Jordt, S. E., Morris, J. B. Menthol attenuates respiratory irritation responses to multiple cigarette smoke irritants. FASEB J. 25 (12), 4434-4444 (2011).
- Neuhaus-Steinmetz, U., et al. Sequential development of airway hyperresponsiveness and acute airway obstruction in a mouse model of allergic inflammation. Int Arch Allergy Immunol. 121 (1), 57-67 (2000).
- Glaab, T., et al. Tidal midexpiratory flow as a measure of airway hyperresponsiveness in allergic mice. Am J Physiol Lung Cell Mol Physiol. 280 (3), L565-L573 (2001).
- Glaab, T., et al. Noninvasive measurement of midexpiratory flow indicates bronchoconstriction in allergic rats. J Appl Physiol (1985). 93 (4), 1208-1214 (2002).
- Pennock, B. E., Cox, C. P., Rogers, R. M., Cain, W. A., Wells, J. H. A noninvasive technique for measurement of changes in specific airway resistance. J Appl Physiol Respir Environ Exerc Physiol. 46 (2), 399-406 (1979).
- DeLorme, M. P., Moss, O. R. Pulmonary function assessment by whole-body plethysmography in restrained versus unrestrained mice. J Pharmacol Toxicol Methods. 47 (1), 1-10 (2002).
- Flandre, T. D., Leroy, P. L., Desmecht, D. J. Effect of somatic growth, strain, and sex on double-chamber plethysmographic respiratory function values in healthy mice. J Appl Physiol (1985). 94 (3), 1129-1136 (2003).
- Criee, C. P., et al. Body plethysmography--its principles and clinical use. Respir Med. 105 (7), 959-971 (2011).
- Robichaud, A., et al. Automated full-range pressure-volume curves in mice and rats. J Appl Physiol (1985). 123 (4), 746-756 (2017).
- Mizutani, N., Goshima, H., Nabe, T., Yoshino, S. Complement C3a-induced IL-17 plays a critical role in an IgE-mediated late-phase asthmatic response and airway hyperresponsiveness via neutrophilic inflammation in mice. J Immunol. 188 (11), 5694-5705 (2012).
- Nabe, T., et al. Roles of basophils and mast cells infiltrating the lung by multiple antigen challenges in asthmatic responses of mice. Br J Pharmacol. 169 (2), 462-476 (2013).
- Morris, J. B., et al. Immediate sensory nerve-mediated respiratory responses to irritants in healthy and allergic airway-diseased mice. J Appl Physiol (1985). 94 (4), 1563-1571 (2003).
- Merazzi, D., Mortola, J. P. Effects of changes in ambient temperature on the Hering-Breuer reflex of the conscious newborn rat. Pediatr Res. 45 (3), 370-376 (1999).
- Rao, R., Nagarkatti, P. S., Nagarkatti, M. Delta(9) Tetrahydrocannabinol attenuates Staphylococcal enterotoxin B-induced inflammatory lung injury and prevents mortality in mice by modulation of miR-17-92 cluster and induction of T-regulatory cells. Br J Pharmacol. 172 (7), 1792-1806 (2015).
- Agrawal, A., et al. Inhibition of mucin secretion with MARCKS-related peptide improves airway obstruction in a mouse model of asthma. J Appl Physiol (1985). 102 (1), 399-405 (2007).
- Mabalirajan, U., Aich, J., Agrawal, A., Ghosh, B. Mepacrine inhibits subepithelial fibrosis by reducing the expression of arginase and TGF-beta1 in an extended subacute mouse model of allergic asthma. Am J Physiol Lung Cell Mol Physiol. 297 (3), L411-L419 (2009).
- Desmet, C., et al. Treatment of experimental asthma by decoy-mediated local inhibition of activator protein-1. Am J Respir Crit Care Med. 172 (6), 671-678 (2005).
- Zang, N., et al. Pulmonary C Fibers Modulate MMP-12 Production via PAR2 and Are Involved in the Long-Term Airway Inflammation and Airway Hyperresponsiveness Induced by Respiratory Syncytial Virus Infection. J Virol. 90 (5), 2536-2543 (2015).
- Shukla, M., et al. Carryover of cigarette smoke effects on hematopoietic cytokines to F1 mouse litters. Mol Immunol. 48 (15-16), 1809-1817 (2011).
- Murphy, D. J. Respiratory function assessment in safety pharmacology. Curr Protoc Pharmacol. , (2003).
- Lofgren, J. L., et al. Restrained whole body plethysmography for measure of strain-specific and allergen-induced airway responsiveness in conscious mice. J Appl Physiol (1985). 101 (5), 1495-1505 (2006).
- DiMaria, G. U., Wang, C. G., Bates, J. H., Guttmann, R., Martin, J. G. Partitioning of airway responses to inhaled methacholine in the rat. J Appl Physiol (1985). 62 (3), 1317-1323 (1987).
- Hoymann, H. G. Lung function measurements in rodents in safety pharmacology studies. Front Pharmacol. 3, 156 (2012).
- Agrawal, A., Singh, S. K., Singh, V. P., Murphy, E., Parikh, I. Partitioning of nasal and pulmonary resistance changes during noninvasive plethysmography in mice. J Appl Physiol (1985). 105 (6), 1975-1979 (2008).
- McLeod, R. L., Young, S. S., Erickson, C. H., Parra, L. E., Hey, J. A. Characterization of nasal obstruction in the allergic guinea pig using the forced oscillation method. J Pharmacol Toxicol Methods. 48 (3), 153-159 (2002).
- Miyahara, S., Miyahara, N., Takeda, K., Joetham, A., Gelfand, E. W. Physiologic assessment of allergic rhinitis in mice: role of the high-affinity IgE receptor (FcepsilonRI). J Allergy Clin Immunol. 116 (5), 1020-1027 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados