Method Article
Évaluation de la fonction respiratoire chez des souris conscientes par pléthysmographie Double-chambre
Dans cet article
Résumé
L’objectif du présent article est de fournir une description détaillée des procédures recommandées pour évaluer la fonction respiratoire chez des souris conscientes par pléthysmographie double-chambre.
Résumé
Changements de volume d’air créés par un sujet conscient respirer spontanément dans une zone du corps sont à la base de pléthysmographie, une technique utilisée de façon non invasive évaluer certaines caractéristiques de la fonction respiratoire chez l’humain ainsi que dans des animaux de laboratoire. Le présent article se concentre sur l’application de la pléthysmographie de double-chambre (DCP) chez de petits animaux. Il fournit des renseignements généraux sur la méthodologie, mais aussi une procédure détaillée étape par étape pour évaluer correctement la fonction respiratoire, conscients, respirant spontanément des animaux d’une manière non invasive. Le DCP peut être utilisé pour surveiller la fonction respiratoire des animaux multiples en parallèle, ainsi que pour identifier des changements induits par des substances en aérosol sur une période de temps choisie et de façon répétée. Expériences sur le contrôle et la souris allergiques sont utilisés dans les présentes à démontrer l’utilité de la technique, d’expliquer les paramètres de résultats associées, ainsi quant à discuter les avantages connexes et les lacunes. Globalement, le DCP fournit lectures valides et théoriquement solide qui ne peuvent faire confiance pour évaluer la fonction respiratoire des animaux petits conscients aussi bien au départ et après les difficultés avec les substances en aérosol.
Introduction
L’utilisation croissante des petits animaux aux maladies respiratoires humaines modèle a encouragé le développement de techniques pour évaluer quantitativement les fonctions de l’appareil respiratoire chez les animaux. Actuellement, la technique d’oscillation forcée (FOT) est reconnue comme l’approche plus précis pour évaluer la mécanique respiratoire en petits animaux1,2. Toutefois, comme l’a affirmé le principe d’incertitude de phénotypage, ce qui est gagné en précision de la mesure avec l’OFT est échangé contre une perte en invasif3. En effet, les mesures de FOT sont acquis dans des conditions expérimentales très contrôlées qui rendent nécessaire l’anesthésie, la trachéotomie ou intubation orale, ainsi que la ventilation mécanique ; un scénario loin de la vie réelle.
Dans les cas où les conditions expérimentales proscrivent l’utilisation d’agents anesthésiques ou appellent pour peu ou pas de déviation d’état physiologique naturel de l’animal, on peut considérer les double-chambre pléthysmographie (DCP). Comme son nom l’indique, une configuration DCP comprend deux chambres rigides connectés construits pour isoler aussi hermétiquement que possible la tête de l’animal (ou le nez), dans la chambre avant, de son thorax, dans la chambre arrière. Dans la configuration, l’animal est conscient et respire spontanément tout en étant sobre. Dans la mesure où les murs des chambres ne peut pas développer ou se rétracter, le mouvement de l’air-and-out de l’animal génère un correspondant mais une forme d’onde opposée à l’intérieur de la chambre arrière, à la suite de la compression/décompression de l’air ambiant. La forme d’onde en raison de l’écoulement nasale dans la chambre avant et celle liée à la motion thoracique dans la chambre arrière peut ainsi être séparé et capturé en même temps. Selon la conception de l’installation DCP, ces signaux peut être acquises à l’aide d’un ensemble de capteurs de pression ou pneumotachographs respectivement enregistrer les changements dans la pression dans la chambre ou le débit d’air-and-out des chambres en fonction du temps. Cette dernière approche est plus fréquente de nos jours.
Alors que la fréquence respiratoire de l’animal peut être déterminée avec précision par n’importe quel genre de techniques de pléthysmographie, la situation n’est pas la même chose pour la détermination du volume de marée et ses paramètres de ventilation connexes (p. ex., ventilation minute, volume expiratoire maximal, etc.). Par opposition à la technique de la pléthysmographie corporelle (WBP), où volume respiratoire de l’animal est estimé de la boîte de4,signal5, la technique DCP fournit une évaluation précise du volume de marée. Cela est lié à l’acquisition directe du mouvement thoracique de l’animal dans la chambre arrière, qui sont proportionnels aux changements du volume pulmonaire au cours de la respiration.
Outre ces paramètres ventilatoires précis (p. ex., volume courant, fréquence respiratoire et ventilation minute), quelques perturbations dans la forme du cycle respiratoire peuvent également servir à étudier les aspects neuronales qui régissent la entraînement respiratoire ou des réflexes respiratoires. Un exemple précis de cette demande serait l’évaluation le potentiel d’irritation des substances inhalées sur les voies aériennes supérieures neurones sensoriels6. Ici, la durée d’une pause au début de l’expiration est déterminée à l’aide d’un paramètre appelé pause inspiratoire-fin (EIP), aussi appelée durée de freinage6. Le prolongement de cette pause par une substance irritante est associé à la fermeture de la glotte de l’animal, provoquant une période mesurable de freinage dans la première partie de la péremption6,7.
Un autre avantage important de la DCP, c’est qu’il fournit deux paramètres validés et incontestés qui sont sensibles à l’obstruction du flux d’air. Un s’appelle le flux à mi marée volume expiratoire maximal et est abrégée EF508,9,10. C’est le débit d’air à mi-chemin volume de chaque marée souffle durant l’expiration. EF50 est extraite de la trace de flux thoracique et peut donc être mesurée sans la chambre avant (c'est-à-dire, dans une configuration de tête-out). L’autre est appelée résistance des voies aériennes spécifiques et est abrégée sRaw11,12,13. La fixation de sRaw nécessite l’enregistrement simultané des flux nasal et thoracique de l’animal, il est calculé à partir du délai entre ces traces respiratoires distincts au point zéro débit à la fin de l’inspiration. La logique qui décrit la base par lequel ce délai concerne sRaw a été expatiated déjà11. Autrement dit, les modifications du volume pulmonaire précédant le mouvement de l’air depuis un gradient de pression doit mettre en place dans l’ordre de débit d’air de voiture. Chez un animal sain, respirer tranquillement, ce retard est généralement très faible. Toutefois, le gradient de pression qui est requis pour recevoir un flux donné (par exemple, d’un débit suffisant pour assurer une ventilation suffisante) est influencé par le degré de résistance des voies aériennes. Au cours de la bronchoconstriction, par exemple, le gradient de pression nécessaire pour loger un flux donné est supérieur, ce qui implique que l’animal doit redoubler d’efforts pour respirer. Un dégradé plu de pression dans le thorax de l’animal implique également qu’une plus grande partie de l’écoulement-and-out de la chambre arrière est due à la décompression/compression d’air dans le thorax, qui est la partie de l’expansion/rétraction thoracique totale qui est déphasée avec l’écoulement nasal. La résistance accrue en raison de la bronchoconstriction augmentera ainsi le délai entre l’arrière et les chambres avant et augmente ainsi le sRaw. Le gradient de pression qui entraîne la circulation d’air-and-out du poumon est également influencé par le volume de gaz thoracique initiale (TGV). À un plus grande TGV par exemple, l’expansion/rétraction du thorax nécessaire pour générer un gradient donné de la pression est supérieure (tout simplement parce que le déplacement de volume qui sert à générer un gradient donné de la pression est supérieur), qui implique également que les animal doit redoubler d’efforts pour respirer. Encore une fois, ces déplacements extra thoraciques sont ceux nécessaires pour décompresser/compresse l’air dans le thorax et sont donc hors de phase avec l’écoulement nasal. Ainsi, un TGV accrue permettra également d’augmenter le délai entre les chambres et augmente ainsi le sRaw. Comme peut être vu, tant bronchoconstriction et TGV accrue entraînent un effort plus important pour aspirer l’air-and-out du poumon. C’est, en substance, le sens physiologique de sRaw. Il représente le travail nécessaire pour respirer5,14.
Il est donc important de comprendre que les deux facteurs distincts influencent sRaw : résistance des voies aériennes et TGV. En fait, sRaw peut être exprimée comme le produit de la résistance des voies aériennes et TGV11. Animaux conscients peuvent modifier leur TGV à volonté, à adapter leur ventilation à un environnement donné. Dans ces conditions, où l’état physiologique naturel de l’animal est inchangé, il est donc impossible de discerner si un changement dans le sRaw provient d’une altération dans la résistance des voies aériennes, d’un changement de TGV ou d’un mélange des deux. Par conséquent, il est recommandé de compléter l’évaluation de DCP avec plusieurs mesures invasives de la mécanique respiratoire et/ou des volumes pulmonaires, tels que ceux fournis par l’OFT1,15.
A ce jour, le DCP a été utilisé dans diverses applications de la recherche. La technique peut être utilisé avec ou sans chambre à tête quantitativement et évaluer avec précision l’effet de diverses substances, telles que les agents pharmaceutiques, allergènes, irritants ou autres médiateurs, sur la fonction respiratoire chez des animaux conscients de petites 16,17,18. La chambre avant peut également servir comme une chambre exposante aux substances en aérosol ou gaz différentes concentrations (hypoxie, hypercapnie, etc.)19. Idéalement, il permet de mesurer simultanément les effets aigus de l’exposition à ces substances. En fait, l’une des utilisations courantes de la DCP est d’évaluer le degré de réceptivité à la méthacholine en aérosol dans différents modèles de maladies respiratoires20,21,22,23, 24 , 25.
Bien que la technique DCP est apparemment simple, certains défis pratiques pourraient potentiellement décourager les utilisateurs inexpérimentés ou nuire à la précision et la reproductibilité des résultats. Le présent document fournit une description détaillée des procédures recommandées pour la fonction respiratoire avec succès record de DCP chez les souris conscientes, la retenue, la respiration spontanément. La description est spécifique à l’équipement indiqué (veuillez vous référer à la Table des matières). L’utilité et la valeur de la DCP est également démontré dans un modèle commun de l’inflammation allergique pulmonaire chez deux lignées de souris testées au départ et en réponse à la méthacholine en aérosol.
Protocole
Les procédures suivantes ont été approuvées par la Québec cœur poumon Institut Comité de protection des animaux conformément aux directives du Conseil canadien de protection des animaux (CCPA).
1. préparation
- Étude
- (Critique) Avant d’effectuer toute expérience, obtenir les approbations appropriées (p. ex., IACUC) et les formations (p. ex., traitement d’animaux).
- Vous familiariser avec le matériel et le logiciel d’exploitation. Lire les manuels d’utilisation et, si nécessaire, créez un fichier de configuration pour définir le nombre de sites, de signaux, les analyseurs et les paramètres d’entrée.
Remarque : Veillez à sélectionner une fréquence d’échantillonnage élevée (2 KHz). - Configurer les paramètres d’analyseurs pour les paramètres d’intérêt.
- Sélectionnez Tuning dans la barre d’outils, puis sur analyseurs.
- Régler le seuil de flux à une valeur qui sépare correctement les respirations (souris : 0,5 mL/s) et opter pour Ti + Te calculer le rythme de la respiration.
- Définir une valeur pour la pression barométrique (760 mm Hg) et spécifiez la déviation maximale du volume inspiratoire/expiratoire pour une respiration soient considérées comme valides (souris : 20 %).
- Cliquez sur le paramètre dans le champ paramètres calculés pour ajuster les limites d’acceptation.
Remarque : Les paramètres suivants ont été utilisés pour les expériences décrites souris : temps d’Inspiration, de 50 à 170 ms ; délai d’expiration, 40 à 180 ms ; fréquence de la respiration, de 30 à 450 puls/min ; résistance des voies aériennes spécifiques, 0 à 15 cmH2O·s ; ainsi les flux avec une précision d’au moins 3 décimales. - Une fois terminé, sélectionnez Appliquer puis sur Fermer pour fermer la fenêtre de dialogue.
- Dans le menu de barre d’outil, allez à Tuning à nouveau, puis sur stockage de fixer un taux de stockage de données souhaitées. Cliquez sur Appliquer puis sur Fermer pour fermer la fenêtre.
Remarque : Une moyenne à toutes les 10 s est généralement utilisée. - Créer un protocole dans le logiciel d’exploitation de définir une séquence de commandes et la date désirée pour chacun d’eux. Un exemple est illustré à la Figure 1.
- Si l’expérience consiste en l’administration d’une substance par aérosol, préparer les dilutions selon les concentrations à tester et les solutions appropriées.
- Animal
- Travailler dans une zone calme éloignée de la chambre de logement. Que les animaux puissent s’adapter à la modification de l’environnement.
- Peser les animaux et sélectionnez la taille de retenue approprié.
- (Critique) Acclimater les animaux à la drisse et procédures avant le début de l’expérience. Selon le protocole expérimental, plusieurs séances d’acclimatation de l’augmentation de la durée (p. ex., 5-30 min) peuvent être nécessaires.
Remarque : Animaux qui ne pas acclimater devraient être retirés de l’étude.- À chaque session d’acclimatation, insérer l’animal au sein de la drisse, partant de l’orifice arrière ; en tenant l’appareil verticalement peut être utile.
- Une fois que l’animal est en position, le piston arrière et insérer délicatement en place sans appliquer une force excessive.
- (Critique) Vérifier visuellement que l’animal respire normalement. Si nécessaire, ajuster sa position en déplaçant le mécanisme de verrouillage. Assurez-vous que les narines de l’animal sont en saillie à l’extérieur du cône de nez avec son museau contre les parois internes de la drisse.
- Retirez le panneau arrière de la chambre thoracique, insérer la drisse contenant l’animal à travers le caoutchouc d’ouverture dans la chambre thoracique et fermer la chambre.
- Fixez la Chambre siège et fournir un courant de polarisation. Utiliser un débit de 0,5 L/min pour une souris.
- Permettre à l’animal pour se détendre pendant 5 min.
- Une fois que l’animal est calme, commence l’enregistrement des signaux écoulement nasal et thoraciques. Vérifier sur l’écran d’ordinateur que les traces sont lisses et qu’ils affichent une respiration régulière ; Voir exemple à la Figure 2.
Remarque : Si le protocole consiste en l’administration d’aérosols d’une substance, un défi salin peut être inclus dans la procédure d’acclimatation. - À la fin de chaque session, enlevez l’animal de la chambre thoracique et la drisse et retourner à sa cage de logement et de la salle.
- Matériel
- Le jour de l’expérience, démarrer une session expérimentale et charger le fichier de configuration approprié.
Remarque : Vérifiez qu’il contient le protocole souhaité pour l’expérience. - Aller à exécuter dans le menu de barre d’outil. Entrer dans l’expérience et les informations de l’animal. Une fois cela fait, cliquez sur le bouton au bas de la fenêtre exécuter .
- Procéder à l’étalonnage du système. Calibrer chaque site et séparément le signal d’entrée.
- Allumez l’appareil biais, connectez-le à la Chambre siège par un bout de tube et régler le débit.
- Fermer l’ouverture supérieure de la chambre de tête avec une casquette.
- Retirez le panneau arrière de chambre thoracique, insérez fermement le calibreur à l’intérieur du caoutchouc d’ouverture entre la tête et la chambre de corps pour créer un joint hermétique. Puis fermez et ré-attacher le panneau arrière de la chambre thoracique.
- Vérifiez que le port du côté de la chambre thoracique est plafonné.
- Dans le menu de barre outil logiciel, allez dans Tuning puis calibrer.
- Allez à l’entrée 1 (thoracique) et sélectionnez calibrer pour lancer la boîte de dialogue de calibration pour le signal de débit thoracique.
- (Critique) Vérifiez que les paramètres répertoriés dans la fenêtre de dialogue calibration affichent les paramètres appropriés, c'est-à-dire, des contraintes physiques appliquent de faible valeur: 0 ; Stress physique appliquée de grande valeur:-20 mL/s ; Échantillons: intégrer. Une fois cela fait, cliquez sur bas dans la fenêtre d’échantillons .
- Vérifier que le signal est constant à travers la fenêtre d’affichage, puis sur Fermer.
- Connecter une seringue 20 mL-à travers l’orifice de la chambre thoracique à l’aide d’un connecteur en plastique et un bout de tube.
- (Critique) Sélectionnez haut dans la fenêtre d’échantillons et injecter immédiatement 20 mL d’air dans la chambre sur une période de 2 s à un débit aussi constante que possible.
- Vérifiez que le signal généré apparaît complètement à l’intérieur de la fenêtre d’affichage. Utilisez l’icône de flèche pour vérifier si le signal est centrée et symétrique autour de la ligne du zéro. Ensuite, cliquer sur Fermer. Retirer tout décalage du zéro en cliquant sur supprimer AC décalage dans la fenêtre d’échantillons
Remarque : L’étalonnage de valeur élevée peut être rétablie, si nécessaire. - Vérifiez que les Scaled entrée de gamme est dans l’intervalle recommandé (souris : ±280 ±420 mL/s). (Critique) Répétez les étapes d’étalonnage si les valeurs sont en dehors de la plage acceptable.
- Calibrer la chambre de la tête d’une façon semblable comme la chambre thoracique (étape 1.3.3.6). Cette fois, sélectionnez entrée 2 (nasale).
Remarque : (Important) La valeur de stress physique appliquée à haute valeur doit être définie + 20 mL/s. Cela va changer la polarité de l’écoulement dans la chambre avant en ce qui concerne la chambre arrière. Par conséquent, lorsque l’animal respire, les deux flux de signaux sera presque en phase, mis à part le délai permettant de calculer le sRaw.
- Le jour de l’expérience, démarrer une session expérimentale et charger le fichier de configuration approprié.
2. mesures de fonction de poumon
- Peser les animaux et noter leurs poids corporel.
- Insérer l’animal au sein de la drisse et placez-la à l’intérieur de la chambre de pléthysmographie thoracique (étapes 1.2.3.1 à 1.2.3.5).
- Permettre à l’animal pour se détendre pendant au moins 5 min.
- Commencer le protocole de commandes en sélectionnant la première étape et puis cliquez sur Execute.
- Sur l’écran de l’ordinateur, vérifiez que la respiration de l’animal des signaux sont régulières et lisses (Figure 2). Le logiciel affiche automatiquement les paramètres calculés sur une base de souffle-de-souffle. Vérifiez que les paramètres de l’animal sont stables.
- Enregistrement de la respiration en conditions basales jusqu'à 10 minutes.
- Pour les protocoles impliquant l’administration d’une substance d’essai par aérosol, procédez comme suit :
- Régler le cycle nébuliseur à temps et devoir, comme l’exige.
Remarque : Dans les exemples dans cet article, le nébuliseur a été opéré à un cycle de 5 % pendant 10 s. - Effectuer un défi de véhicule (par exemple, une solution saline) et d’enregistrer la réponse.
- Le cas échéant, exposer l’animal à l’augmentation des concentrations de la substance d’essai en changeant la concentration dans le nébuliseur dans l’escalade des mesures (p. ex., doublement des concentrations). Enregistrer la réponse après chaque administration.
- À la fin de la session expérimentale, si ne pas fait automatiquement, arrêter l’enregistrement et retourner l’animal de sa cage de logement et de la salle.
- Régler le cycle nébuliseur à temps et devoir, comme l’exige.
- Si nécessaire, sélectionnez exécuter dans le menu de barre d’outil pour exécuter une autre session expérimentale.
- Entre les sessions, les chambres de la pléthysmographie et rincer le nébuliseur avec de l’eau.
Remarque : La consommation d’alcool peut causer des dommages irréversibles à la pléthysmographie.
- Entre les sessions, les chambres de la pléthysmographie et rincer le nébuliseur avec de l’eau.
- Si l’étude comprend des évaluations répétées au fil du temps, répéter la séquence entière mesure à chaque validant choisie.
Remarque : Sagement, il est recommandé de compléter l’étude avec des mesures précises de la mécanique respiratoire et/ou pulmonaires volumes1,15.
3. analyse des données
Remarque : Le logiciel enregistre le fichier expérimental et exporte les paramètres enregistrés lors de la session expérimentale est fermée automatiquement.
- Calcul d’une moyenne de référence pour les paramètres d’intérêt pour chaque groupe d’animaux et expérimentale.
Remarque : tableau 1 énumère un certain nombre de paramètres typiques, classés selon le type de renseignements qu’ils fournissent. - Le cas échéant, évaluer l’effet de la substance en aérosol a étudié sur les paramètres d’intérêt à chaque concentration à l’aide d’un point spécifique (par exemple, valeur maximale ou minimale), une moyenne ou le cours à temps plein ; une normalisation au niveau de référence peut également être considérée.
- Communiquer les résultats en utilisant les moyens de groupe et les erreurs dans une table ou un format graphique. Analyser statistiquement les résultats.
Remarque : Dans la présente étude, ANOVA bidirectionnelle avec répétée des mesures ont été utilisées pour évaluer l’effet de la méthacholine, l’allergène – maison-acariens (HDM) – et leur interaction sur les différents affichages DCP (sRaw et EF50), ainsi que sur les différents affichages FOT (R,N, G et H), dans les deux souches de souris. Plusieurs tests de comparaison de Sidak servent ensuite à déterminer les concentrations de méthacholine au cours de laquelle les souris allergiques se distinguent les souris témoins. Les mêmes tests ont été utilisés pour évaluer l’effet des jours, HDM et leur interaction au départ (c'est-à-direavant la méthacholine) sur lectures d’obstruction des voies respiratoires (sRaw et EF50) et d’une ventilation (BF, TV, MV et le PPC). Corrélations de Pearson ont été utilisées pour évaluer les corrélations entre sRaw obtenus avec la DCP et RN obtenus avec l’OFT. Toutes les analyses statistiques et graphiques ont été réalisés à l’aide de logiciels statistiques standard alternatifs (p. ex., GraphPad Prism). p ≤ 0,05 a été jugée suffisante pour rejeter l’hypothèse nulle.
Résultats
Les résultats des évaluations répétées de la fonction respiratoire par DCP, effectué en conditions basales sur trois jours consécutifs (les jours 12, 13 et 14 du protocole illustré à la Figure 1) dans le contrôle et les souris BALB/c allergiques, sont présentées dans Figure 3 . Les paramètres qui ont été choisis pour évaluer le modèle de respiration inclus respiration fréquence (Figure 3 a), le volume de marée (Figure 3 b), la ventilation minute (Figure 3) et pause inspiratoire-fin (Figure 3D). Les paramètres utilisés pour évaluer l’obstruction des voies respiratoires étaient EF50 (Figure 3E) et sRaw (Figure 3F). Les résultats de chaque paramètre sélectionné ont été stables au cours de ces trois jours consécutifs dans les deux groupes, sans effet apparent causée par l’inflammation allergique.
Le degré de réceptivité à la méthacholine a été évalué par DCP jours successifs (les jours 12, 13 et 14 du protocole illustré à la Figure 1) en contrôle et allergiques souris BALB/c. Les résultats, illustrés à la Figure 4, affichent les modifications dans les deux paramètres qui sont sensibles à l’obstruction des voies respiratoires, nommément sRaw (Figure 4 a, B et C) et EF50 (Figure 4, E et F). Comme prévu, concentrations incrémentielles de méthacholine une augmentation progressive du sRaw et diminué progressivement EF50. Ces réponses sont potentialisées par l’inflammation allergique, surtout à la concentration finale, qui atteste la présence de l’hyperréactivité. Les résultats démontrent également que le degré exagéré de réactivité se limitait au premier jour (jour 12), car il n’était pas observé lors des deux évaluations ultérieures (c.-à-d., 13 et 14 jours).
Les résultats de l’évaluation de la mécanique respiratoire par l’OFT, effectué le dernier jour du protocole expérimental (jour 15 ; La figure 1) en contrôle et souris BALB/c allergiques, sont indiquées à la Figure 5. Ces expériences ont été inclus dans l’étude pour compléter les évaluations de la DCP. L’OFT est reconnu comme une approche plus précise pour évaluer la fonction respiratoire2. Un de ses points forts est qu’il donne un aperçu topographique quant aux sites du poumon (direction d’orchestre airways versus peripheral airways et du tissu pulmonaire) sont affectés par les interventions éprouvées (p. ex., allergène et la méthacholine). La méthode recommandée pour évaluer la mécanique respiratoire avec l’OFT a été précédemment décrit1. Ici, trois paramètres FOT ont été utilisées pour décrire les changements dans la mécanique respiratoire induite par la méthacholine et l’inflammation allergique. Ces paramètres compris : la résistance 1-Newton (RN; Figure 5 a), un paramètre pour lequel les changements de valeur principalement tenir compte des variations de la résistance des des grandes voies ; 2-tissu amortissement (G ; Figure 5 b), un paramètre pour lequel les changements de valeur surtout refléter les variations de résistance tissulaire ; et 3-tissu élastance (H ; ( Figure 5), un paramètre pour lequel les changements de valeur principalement reflètent les variations de raideur des tissus2. Comme prévu, il y avait une augmentation de chacun de ces paramètres en réponse à des concentrations incrémentielles de la méthacholine. Compatible avec le sRaw et EF50 résultats obtenus avec la DCP depuis la veille (jour 14 ; Figure 1), les changements dans RN induite par la méthacholine (Figure 5 a) étaient comparables entre le contrôle et les souris allergiques. En effet, les valeurs de sRaw au jour 14 corrélées avec les valeurs de RN au jour 15 (Figure 5). La montée en H induite par la méthacholine est également similaire entre le contrôle et les souris allergiques (Figure 5 b). Toutefois, l’augmentation induite par la méthacholine G était significativement plus élevée chez les souris allergiques (Figure 5). Ce résultat démontre la présence d’un phénotype hyperréactive persistant chez les souris allergiques au jour 15, qui n’a pas décelé des DCP évaluations effectuées sur les deux jours précédents.
L’ensemble de l’étude a été répétée avec des souris C57BL/6. Les résultats des évaluations successives DCP de sRaw, à jours 12, 13 et 14 du protocole (Figure 1) et de l’évaluation de la FOT de RN, au jour 15, sont indiquées à la Figure 6. Cette souche de souris spécifiques, la réponse exagérée de la métacholine observée chez les souris allergiques a été maintenue pendant trois jours consécutifs (Figure 6 a, Bet C). Ce phénotype hyperréactive était également représenté avec l’OFT à 15 jours par une augmentation de RN induite par la méthacholine qui était plus prononcée chez les souris allergiques (Figure 6E). Ceux-ci étaient en contraste avec les résultats obtenus avec les souris BALB/c, où un déclin progressif de l’hyperréactivité a eu lieu de jours 12 à 14 (Figure 4) et une absence de différence dans l’augmentation induite par la méthacholine RN a été observée au jour 15 (Figure 5 a). Ensemble, ces résultats montrent un effet instationnaire de l’allergène sur la réponse induite par la méthacholine entre les deux souches de souris. Ce qui est important, cette différence de souche a été dépeinte par le RSD tant l’OFT. Aujourd'hui, les valeurs de sRaw mesurée par le RSD au jour 14 corrélées avec les valeurs de RN mesurée par FOT au jour 15 (Figure 6F), a été observée avec les souris BALB/c (Figure 5).

Figure 1 . Protocoles utilisés pour induire une inflammation pulmonaire allergique et d’évaluer le degré de réceptivité à la méthacholine. Cette étude a été menée sur les femelle BALB/c et souris C57BL/6 de 7 à 9 semaines d’âge. L’enchaînement des interventions effectuées sur l’ensemble de l’étude est indiqué sur le panneau (A). La moitié des souris a été exposé à 50 µg de maison-acariens (HDM) extrait par voie intranasale sur 14 jours consécutifs pour induire une inflammation pulmonaire allergique. L’autre moitié a été exposée à une solution saline et utilisé comme témoin. La fonction respiratoire a été évaluée par pléthysmographie double-chambre (DCP) à trois reprises (jours 12, 13 et 14 ; cercles noirs) après une session d’acclimatation (jour 11 ; cercle gris) qui comprenait un défi avec une solution saline en aérosol. Au cours de chaque session, la fonction respiratoire de base ainsi que la réponse à la méthacholine ont été évalués en utilisant le protocole automatisé montré dans le graphique (B). Au jour 15, une envahissante de la mécanique respiratoire avec la technique d’oscillation forcée (OFT) a été effectuée comme précédemment décrit1. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
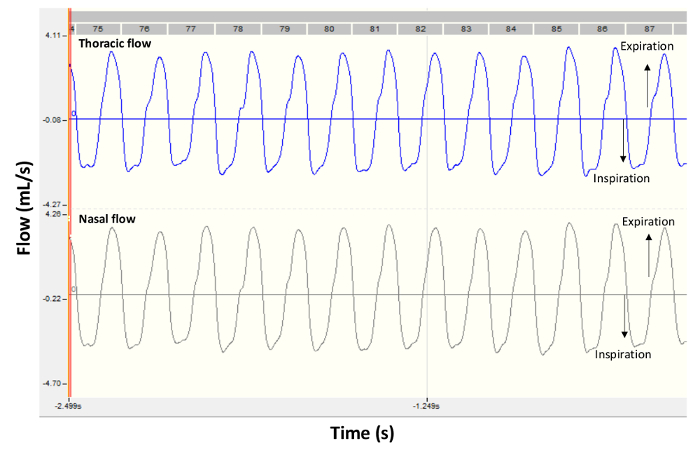
Figure 2 . Signaux de flux représentant par un sain de souris BALB/c. Les panneaux présentent des traces d’enregistrement typique obtenus par pléthysmographie double-chambre chez une souris de contrôle en conditions basales. Thoracique flux s’affiche dans le panneau supérieur et l’écoulement nasal est affiché dans le panneau inférieur. Les valeurs négatives sont pendant l’inspiration et des valeurs positives pendant l’expiration. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
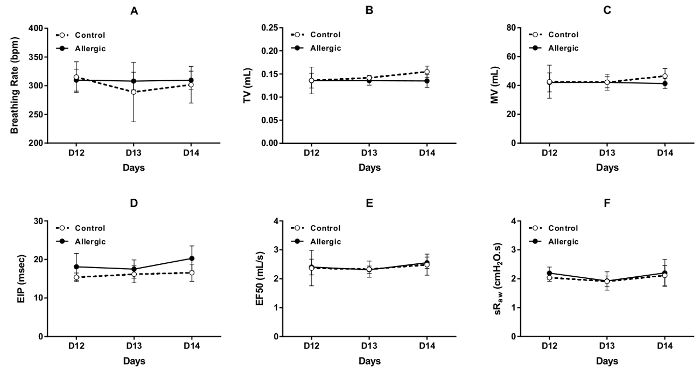
Figure 3 . Répété des évaluations de la fonction respiratoire chez des souris BALB/c conscientes. Fonction respiratoire de base a été évaluée par pléthysmographie double-chambre (DCP) contrôle (symboles ouverts) et des souris allergiques (symboles solide) jours 12, 13 et 14 du protocole illustré à la Figure 1. Les paramètres DCP utilisés pour évaluer la fonction respiratoire incluse respiratoires fréquence dans (A), volume de marée (TV) (B), ventilation minute (VM) en (C), fin inspiratoire pause (EIP) (D), débit à mi marée volume expiratoire maximal ( EF50) in (E) et la résistance des voies aériennes spécifiques (sRaw) dans (F). Les valeurs de fréquence, TV, MV, sRaw et EIP de respiration pour chaque souris étaient que les valeurs moyennes enregistrement pendant 1,5 min. La valeur de EF50 était la valeur minimale obtenue au cours de cette période d’enregistrement. Les résultats sont présentés comme le groupe moyen ± écart-type (n = 5/groupe). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 . Test ergospirométrie méthacholine consciente souris BALB/c. Méthacholine réactivité a été évaluée par pléthysmographie double-chambre (DCP) contrôle (symboles ouverts) et des souris allergiques (symboles solide) jours 12, 13 et 14 du protocole illustré à la Figure 1. Les paramètres DCP utilisés pour évaluer la réponse inclus la résistance des voies spécifiques (sRaw) en (A) à (C) et le débit à mi marée volume expiratoire maximal (EF50) en (D) à (F). La bronchoprovocation a été réalisée par capilaires méthacholine dans la Chambre siège de DCP pour 10 s à des concentrations incrémentielles. La réponse a été suivie pendant 1,5 min après chaque concentration. La valeur de sRaw pour chaque souris à chaque concentration était que la valeur moyenne enregistrée pendant 1,5 min. La valeur de EF50 était la valeur minimale obtenue au cours de cette période d’enregistrement. Les résultats sont présentés comme le groupe moyen ± écart-type (n = 5/groupe). Le symbole astérisque * désigne une différence statistiquement significative (p 

Figure 5 . Évaluation envahissante de la mécanique respiratoire chez la souris BALB/c. Mécanique respiratoire au départ et en réponse à la méthacholine a été évaluée par la technique d’oscillation forcée (OFT) sur 15 jour du protocole illustré à la Figure 1. Le contrôle (symboles ouverts) et les souris allergiques (symboles solide) étaient les mêmes que celles testées par pléthysmographie double-chambre (DCP) 12, 13 et 14 jours. Les paramètres utilisés pour évaluer la mécanique respiratoire ont été résistance newtonienne (RN) (A), tissu élastance (H) (B) et tissus d’amortissement (G) en (C). La bronchoprovocation a été réalisée par nébulisation concentrations incrémentielles de méthacholine directement dans la sonde endotrachéale de souris anesthésiés, trachéotomisés, paralysés et sous ventilation mécanique en position couchée. La réponse a été suivie pendant 5 min après chaque concentration. La valeur de chaque paramètre pour chaque souris à chaque concentration est la valeur maximale obtenue au cours de cette période d’enregistrement. Les résultats sont présentés comme le groupe moyen ± écart-type (n = 5/groupe). Panneau (D) montre la corrélation entre la résistance des voies aériennes spécifiques (sRaw) mesurée par DCP le 14e jour et RN mesurée par FOT le 15e jour. Les symboles ouverts représentent les valeurs de base et les solides symboles représentent les valeurs maximales à la concentration maximale de la méthacholine testée pour le contrôle (cercles) ou les souris allergiques (carrés). L’encart montre le coefficient de détermination (r2). Le symbole astérisque * désigne une différence statistiquement significative (p ≤ 0,05). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
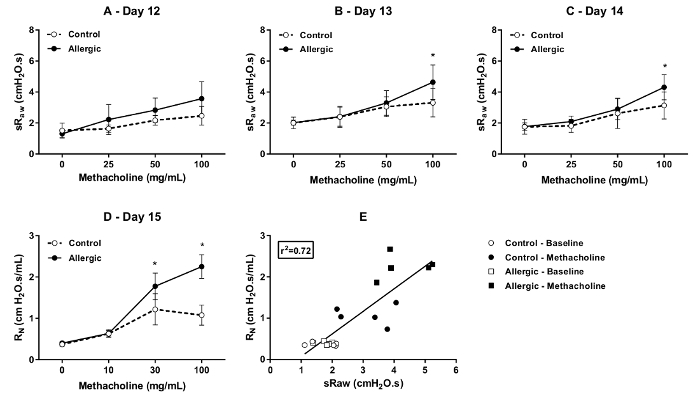
Figure 6 . Fonction respiratoire et la mécanique respiratoire invasive chez les souris C57BL/6. La résistance des voies aériennes spécifiques (sRaw) a été évaluée par double-chambre pléthysmographie (DCP) au départ et en réponse à la méthacholine contrôle (symboles ouverts) et des souris allergiques (symboles solide) 12 (A), 13 (B) et 14 (C) jours de la Protocole, illustré à la Figure 1. Newtonienne résistance (RN) au départ et en réponse à la méthacholine ont été évaluées par la technique d’oscillation forcée (FOT) au jour 15 (D). Les bronchoprovocations ont été effectuées comme indiqué dans la Figure 4 et Figure 5 pour le DCP et l’OFT, respectivement. Les résultats sont présentés comme le groupe moyen ± écart-type (n = 5/groupe). Panneau (E) montre la corrélation entre sRaw mesurée par DCP le jour 14 et RN mesurée par FOT le 15e jour. Les symboles ouverts représentent les valeurs de base et les solides symboles représentent les valeurs maximales à la concentration maximale de la méthacholine testée pour le contrôle (cercles) ou les souris allergiques (carrés). L’encart montre le coefficient de détermination (r2). Le symbole astérisque * désigne une différence statistiquement significative (p ≤ 0,05). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Paramètre | Unité | Description | Informations |
| F | BPM | Fréquence respiratoire | Modèle de ventilation |
| TV | mL | Volume de marée | |
| MV | mL | Ventilation minute | |
| TI | MS | Temps inspiratoire | |
| Te | MS | Temps expiratoire | |
| PARTENAIRES D’ENVOL | mL/s | Débit inspiratoire de pointe | |
| PEF | mL/s | Débit expiratoire de pointe | |
| EV | mL | Volume expiratoire maximal | |
| NTV | mL | Volume de marée nasale | |
| NEV | mL | Volume expiratoire nasal | |
| EIP | MS | Pause inspiratoire fin | |
| EEP | MS | Pause expiratoire de fin | |
| dT | MS | Temps de retard | Obstruction de la circulation de l’air |
| sRaw | cmH2O·s | Résistance des voies aériennes spécifiques | |
| sGaw | 1/cmH2O·s | Conductance des voies spécifiques | |
| EF50 | mL/s | Flow au milieu-tidal volume expiratoire maximal | |
| SR | % | Taux de réussite | Contrôle de la qualité |
| N | Nombre de respirations valides |
Tableau 1. Liste des paramètres typiques provenant de double-chambre pléthysmographie. Les paramètres ont été regroupés selon la nature des informations qu’ils fournissent au cours d’une évaluation de la fonction respiratoire.
| Avantages | Limites |
| · Animaux conscients | · Nécessité de contrôler le milieu environnant |
| · Paramètres de ventilation exacte | · Acclimatation préalable des animaux |
| · Index incontestés de l’obstruction de l’écoulement d’air (sRaw, EF50) | · Obligation de séparer hermétiquement les flux nasales et thoraciques |
| · Adaptable à différentes tailles d’espèces et animal | · Variabilité de la valeur absolue de certains paramètres de résultat |
| · Utilisé dans de nombreuses applications de la recherche | · sRaw pas une vraie mesure de la résistance |
| · Technique simple | · Présence des voies respiratoires supérieures |
| · Sensibles au changement | · Complétant les mesures avec une évaluation invasive |
Le tableau 2. Liste des avantages et des limites associées à double-chambre pléthysmographie.
| Double-chambre pléthysmographie | Technique d’Oscillation forcée | |
| État de l’animal de la conscience | Inchangée | Anesthésiés (et généralement paralysé) |
| Position de l’animal | Position verticale | En position couchée |
| Accessibilité de l’animal | Enfermé dans la chambre | Accessible |
| Animale intégration à l’appareil de mesure | Joint de nez ou du cou | Trachéotomie ou oral intubation |
| Arbre bronchique de l’animal | Intact | Partielle-segment des voies aériennes supérieures exclus (c'est-à-dire nasale effectue, du pharynx et du larynx) |
| Au cours de laquelle les paramètres de résultats sont obtenus du volume pulmonaire | Variable - volume spontanée par l’animal adopté | Standard - à l’aide de manoeuvres de recrutement contrôlé et une pression positive résiduelle expiratoire. |
| Fréquence à laquelle les paramètres de résultats sont évalués | Variable - fréquence de respiration spontanée par l’animal adopté | Contrôlé - en utilisant des formes d’onde prédéfinies à fréquences spécifiées |
| Contribution du segment des voies aériennes supérieures aux paramètres de résultat | S’attendre à ce | Contourné |
| Site de livraison de l’aérosol | À l’intérieur de la chambre de la tête | Directement dans la trachée |
| Effet du segment des voies aériennes supérieures sur la dose inhalée / profil de dépôt aérosol | S’attendre à ce | A empêché |
| Capacité à détecter les changements - basé sur les résultats de cette étude | Observé | Observé |
| Variabilité inhérente de la technique - basée sur les résultats de cette étude | Variation du coefficient de variation pour sRaw au départ : 7,5-20,6 % | Variation du coefficient de variation pour RN au départ : 3,6-13,4 % |
Tableau 3. Comparaison entre le double-chambre pléthysmographie et techniques de l’oscillation forcée.
Discussion
La capacité de mesurer la fonction pulmonaire chez les animaux conscients est nettement justifiée dans la recherche en pneumologie. En général, le DCP est une approche intéressante pour évaluer la fonction de ventilation de l’appareil respiratoire en conscient et respirant spontanément des animaux26. Plus précisément, le DCP, ou sa variante tête barrée, frappe souvent un juste équilibre entre la qualité des informations fournies et le niveau souhaité de pouvoir envahissant3 (tableau 2). La technique peut être adaptée à différentes espèces (p. ex., souris, rat, cochon d’Inde) ou animaux de tailles et peut être utilisée dans de nombreuses applications de recherches. Il est particulièrement utile évaluer les nombreux animaux à la fois dans une étude parallèle, pour surveiller la fonction respiratoire de manière répétée et de capturer la cinétique d’une réaction au fil du temps. En outre, la technique est simple et peut être apprise de façon relativement rapide. Dans le présent document, un protocole utilisant des mesures de DCP chez la souris a été utilisé comme un exemple pour décrire les aspects pratiques de cette sobre technique pléthysmographie ainsi quant à discuter des étapes critiques et associés résultats.
Lorsque vous travaillez avec des animaux conscients, il est essentiel de contrôler les conditions de l’environnement (p. ex., salle de détente avec un nombre limité de personnes ou d’activité) afin de générer des résultats reproductibles. Puisque les dynamiques viennent dans différentes dimensions, il est important de commencer avec la taille appropriée de sorte que les mouvements respiratoires sont non perturbés. Il est également utile et souvent nécessaire d’acclimater les animaux pour le montage de l’expérience et les procédures, car il est bien établi chez la souris que contention influe sur la fréquence de respiration12. Selon le protocole expérimental ou conditions, plusieurs sessions de durées supplémentaires peuvent être nécessaires. Enfin, laissant le temps au début d’une expérience pour les animaux à s’adapter à la changement de chambre et de la manutention nécessaire sont un examen simple qui s’est avérée efficace pour s’assurer que la respiration est toujours régulier et détendu au départ. Travail dans des conditions où les animaux sont confortables, bien adapté et calme sera également bénéfique en termes de qualité et de la variabilité du résultat. Elle limite également tout rejet provoqués par le stress des catécholamines, ce qui peut augmenter le calibre des voies aériennes et atténuer une bronchoconstriction induite.
Il est important de comprendre qu’il est nécessaire de séparer aussi hermétiquement que possible les flux nasales et thoraciques. Selon le système ou les espèces étudiées, le mécanisme de fermeture peut varier dans la forme aussi bien que dans l’efficacité. Dans le RSD nous décrit ci-après, le joint est créé entre le museau de l’animal et le dispositif de retenue. Lors de l’évaluation de la fonction respiratoire par DCP, il est également essentiel de fournir un flux biais suffisant et continu, comme une diminution du niveau d’oxygène disponible pour l’animal entraînera des effets importants. En tenant compte du bien-être de l’animal dans la drisse limite la propension des fuites d’air créé par agitation et optimise ainsi la qualité des données. Par contraste, une rupture du joint se traduira par des ensembles de données rejetées ou une sous-estimation de certains paramètres.
En outre pour activer l’enregistrement distinct du signal de débit nasal, la chambre de la tête est généralement utilisée pour exposer l’animal aux substances en aérosol. Comme illustré dans cet article, il peut être utilisé pour effectuer un essai ergospirométrie pour illustrer les différents degrés de réactivité. Dans de telles expériences, réglage de la portée des concentrations testées peut-être être nécessaires selon l’espèce, souche ou le sexe des animaux étudiés. Comme démontré précédemment8,9,10,27, les présents résultats montrent que les variations induites par la méthacholine sRaw corrélées bien avec les mesures invasives de FOT de résistance des voies aériennes. Les résultats démontrent également que la technique DCP n’est pas aussi sensible que l’OFT pour sa capacité à détecter des troubles respiratoires et d’identifier une réponse altérée localisée dans les compartiments inférieurs du poumon (tissu pulmonaire et/ou petites voies aériennes périphériques) . Étant donné que les voies respiratoires de l’animal sont intacts, la présence des voies respiratoires supérieures, qui représente la plus grande partie de la résistance respiratoire totale à débit d’air28, peut affecter la distribution d’aérosol et le dépôt en outre pour amortir la contribution de les voies respiratoires inférieures à une mesure. Le tableau 3 résume les autres différences entre la technique DCP et l’OFT. Enfin, il serait théoriquement possible d’estimer la résistance des voies aériennes totale de l’animal (y compris les voies aériennes supérieures) d’une mesure de sRaw, il est généralement recommandé de compléter l’évaluation de DCP avec une technique de mesure invasive comme le FOT29 pour obtenir des mesures directes de la mécanique respiratoire détaillée. Selon les objectifs de l’étude, mesures de la résistance des voies aériennes supérieures peuvent aussi être considéré comme30,31,32.
Conclusion
En raison de son degré limité de techniques invasives, le DCP est une technique qui peut répondre à un besoin important en recherche en pneumologie. Il est en mesure de fournir des lectures précises du modèle de ventilation chez des animaux conscients en même temps que certains indices incontestés d’obstruction de la circulation de l’air. L’information obtenue également vraiment complémentaire de celui de plusieurs approches envahissantes.
Déclarations de divulgation
DB et AR sont employés par SCIREQ Scientific Inc. équipement respiratoire, une entité commerciale impliqués dans les sujets liés au contenu de cet article. DB est également propriétaire de stock. SCIREQ Inc. est une société de TECHNOLOGIES emka.
Remerciements
SML est soutenue par une bourse d’étude de l’instituts de recherche en santé du Canada, MG est soutenu par une bourse du réseau en santé respiratoire de la FRQS (Fonds de recherche du Québec – Santé) et YB est un érudit recherche FRQS.
CONTRIBUTION DES AUTEURS
Tous les auteurs ont contribué à la conception du manuscrit et/ou la vidéo. SML et LD collecté les données. SML, LD, YB, DM, DB et AR a contribué à l’analyse des données, la génération de chiffres et de l’écriture du manuscrit. YB, AR, KL et MG ont participé à la préparation du script vidéo. La pièce a été jouée par YB, KL et MG.
matériels
| Name | Company | Catalog Number | Comments |
| Acetyl-β-methylcholine chloride | Sigma-Aldrich | A-2251 | Methacholine |
| Phosphate buffered saline | Multicell | 311-506-CL | PBS 10X |
| House dust mite extract | GREER | 290902 | HDM |
| DCP complete system | SCIREQ Inc. /emka TECHNOLOGIES | ||
| iox software | SCIREQ Inc. /emka TECHNOLOGIES | ||
| Aerogen Aeroneb nebulizer | SCIREQ Inc. /emka TECHNOLOGIES | ||
| flexiVent FX complete system | SCIREQ Inc. /emka TECHNOLOGIES |
Références
- McGovern, T. K., Robichaud, A., Fereydoonzad, L., Schuessler, T. F., Martin, J. G. Evaluation of respiratory system mechanics in mice using the forced oscillation technique. J Vis Exp. (75), e50172(2013).
- Bates, J. H. T. CORP: Measurement of lung function in small animals. J Appl Physiol (1985). 123 (5), 1039-1046 (2017).
- Bates, J. H., Irvin, C. G. Measuring lung function in mice: the phenotyping uncertainty principle. J Appl Physiol. 94 (4), 1297-1306 (2003).
- Lim, R., et al. Measuring respiratory function in mice using unrestrained whole-body plethysmography. J Vis Exp. (90), e51755(2014).
- Enhorning, G., van Schaik, S., Lundgren, C., Vargas, I. Whole-body plethysmography, does it measure tidal volume of small animals? Can J Physiol Pharmacol. 76 (10-11), 945-951 (1998).
- Vijayaraghavan, R., Schaper, M., Thompson, R., Stock, M. F., Alarie, Y. Characteristic modifications of the breathing pattern of mice to evaluate the effects of airborne chemicals on the respiratory tract. Arch Toxicol. 67 (7), 478-490 (1993).
- Willis, D. N., Liu, B., Ha, M. A., Jordt, S. E., Morris, J. B. Menthol attenuates respiratory irritation responses to multiple cigarette smoke irritants. FASEB J. 25 (12), 4434-4444 (2011).
- Neuhaus-Steinmetz, U., et al. Sequential development of airway hyperresponsiveness and acute airway obstruction in a mouse model of allergic inflammation. Int Arch Allergy Immunol. 121 (1), 57-67 (2000).
- Glaab, T., et al. Tidal midexpiratory flow as a measure of airway hyperresponsiveness in allergic mice. Am J Physiol Lung Cell Mol Physiol. 280 (3), L565-L573 (2001).
- Glaab, T., et al. Noninvasive measurement of midexpiratory flow indicates bronchoconstriction in allergic rats. J Appl Physiol (1985). 93 (4), 1208-1214 (2002).
- Pennock, B. E., Cox, C. P., Rogers, R. M., Cain, W. A., Wells, J. H. A noninvasive technique for measurement of changes in specific airway resistance. J Appl Physiol Respir Environ Exerc Physiol. 46 (2), 399-406 (1979).
- DeLorme, M. P., Moss, O. R. Pulmonary function assessment by whole-body plethysmography in restrained versus unrestrained mice. J Pharmacol Toxicol Methods. 47 (1), 1-10 (2002).
- Flandre, T. D., Leroy, P. L., Desmecht, D. J. Effect of somatic growth, strain, and sex on double-chamber plethysmographic respiratory function values in healthy mice. J Appl Physiol (1985). 94 (3), 1129-1136 (2003).
- Criee, C. P., et al. Body plethysmography--its principles and clinical use. Respir Med. 105 (7), 959-971 (2011).
- Robichaud, A., et al. Automated full-range pressure-volume curves in mice and rats. J Appl Physiol (1985). 123 (4), 746-756 (2017).
- Mizutani, N., Goshima, H., Nabe, T., Yoshino, S. Complement C3a-induced IL-17 plays a critical role in an IgE-mediated late-phase asthmatic response and airway hyperresponsiveness via neutrophilic inflammation in mice. J Immunol. 188 (11), 5694-5705 (2012).
- Nabe, T., et al. Roles of basophils and mast cells infiltrating the lung by multiple antigen challenges in asthmatic responses of mice. Br J Pharmacol. 169 (2), 462-476 (2013).
- Morris, J. B., et al. Immediate sensory nerve-mediated respiratory responses to irritants in healthy and allergic airway-diseased mice. J Appl Physiol (1985). 94 (4), 1563-1571 (2003).
- Merazzi, D., Mortola, J. P. Effects of changes in ambient temperature on the Hering-Breuer reflex of the conscious newborn rat. Pediatr Res. 45 (3), 370-376 (1999).
- Rao, R., Nagarkatti, P. S., Nagarkatti, M. Delta(9) Tetrahydrocannabinol attenuates Staphylococcal enterotoxin B-induced inflammatory lung injury and prevents mortality in mice by modulation of miR-17-92 cluster and induction of T-regulatory cells. Br J Pharmacol. 172 (7), 1792-1806 (2015).
- Agrawal, A., et al. Inhibition of mucin secretion with MARCKS-related peptide improves airway obstruction in a mouse model of asthma. J Appl Physiol (1985). 102 (1), 399-405 (2007).
- Mabalirajan, U., Aich, J., Agrawal, A., Ghosh, B. Mepacrine inhibits subepithelial fibrosis by reducing the expression of arginase and TGF-beta1 in an extended subacute mouse model of allergic asthma. Am J Physiol Lung Cell Mol Physiol. 297 (3), L411-L419 (2009).
- Desmet, C., et al. Treatment of experimental asthma by decoy-mediated local inhibition of activator protein-1. Am J Respir Crit Care Med. 172 (6), 671-678 (2005).
- Zang, N., et al. Pulmonary C Fibers Modulate MMP-12 Production via PAR2 and Are Involved in the Long-Term Airway Inflammation and Airway Hyperresponsiveness Induced by Respiratory Syncytial Virus Infection. J Virol. 90 (5), 2536-2543 (2015).
- Shukla, M., et al. Carryover of cigarette smoke effects on hematopoietic cytokines to F1 mouse litters. Mol Immunol. 48 (15-16), 1809-1817 (2011).
- Murphy, D. J. Respiratory function assessment in safety pharmacology. Curr Protoc Pharmacol. , Chapter 10 Unit10 19 (2003).
- Lofgren, J. L., et al. Restrained whole body plethysmography for measure of strain-specific and allergen-induced airway responsiveness in conscious mice. J Appl Physiol (1985). 101 (5), 1495-1505 (2006).
- DiMaria, G. U., Wang, C. G., Bates, J. H., Guttmann, R., Martin, J. G. Partitioning of airway responses to inhaled methacholine in the rat. J Appl Physiol (1985). 62 (3), 1317-1323 (1987).
- Hoymann, H. G. Lung function measurements in rodents in safety pharmacology studies. Front Pharmacol. 3, 156(2012).
- Agrawal, A., Singh, S. K., Singh, V. P., Murphy, E., Parikh, I. Partitioning of nasal and pulmonary resistance changes during noninvasive plethysmography in mice. J Appl Physiol (1985). 105 (6), 1975-1979 (2008).
- McLeod, R. L., Young, S. S., Erickson, C. H., Parra, L. E., Hey, J. A. Characterization of nasal obstruction in the allergic guinea pig using the forced oscillation method. J Pharmacol Toxicol Methods. 48 (3), 153-159 (2002).
- Miyahara, S., Miyahara, N., Takeda, K., Joetham, A., Gelfand, E. W. Physiologic assessment of allergic rhinitis in mice: role of the high-affinity IgE receptor (FcepsilonRI). J Allergy Clin Immunol. 116 (5), 1020-1027 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon