Method Article
На месте Измерение и корреляции плотность клеток и светового излучения биолюминесцентных бактерий
В этой статье
Резюме
Биолюминесцентных бактерий регулируют света производства через различные механизмы, например кворума. Этот новый метод позволяет на месте расследования биолюминесценции и корреляции светового излучения в плотность клеток. Искусственные биолюминесцентных Escherichia coli система позволяет характеристика опероны люкс , Люкс белков и их взаимодействие.
Аннотация
Существует значительное количество бактериальных видов способен излучает свет. Все из них доля того же кластера гена, а именно Оперон люкс . Несмотря на это сходство эти бактерии показывает экстремальные различия в характеристики как рост поведение, интенсивность светового излучения или регулирование биолюминесценции. Метод, представленный здесь является недавно разработанный assay, который сочетает в себе запись роста клеток и интенсивности биолюминесцентных светового излучения со временем, используя читателя пластины. Результате роста и характеристики светового излучения может быть связаны с важных особенностей соответствующих бактериальный штамм, например кворума зондирования регулирования. Выращивание ряда биолюминесцентных бактерий требует конкретных среднего (например, средний искусственный морской воды) и определенных температур. Прост в обращении, не биолюминесцентных стандарт исследовательский бактерии Escherichia coli (E. coli), с другой стороны, можно выращивать недорого в больших количествах в лабораторном масштабе. Использование E. coli путем введения плазмида, содержащий весь люкс Оперон может упростить экспериментальных условий и дополнительно открывает много возможностей для будущих приложений. Выражение генов люкс , используя штамм E. coli выражение было достигнуто за счет строительства плазмида выражение через Гибсон клонирования и вставки четырех фрагментов, содержащий семь люкс генов и три ребра генов Оперон люкс ребра в pET28a вектор. E. coli на основе люкс экспрессии генов может быть индуцированных и контролируется через изопропил β-D-thiogalactopyranosid (IPTG) сложения, что приводит к биолюминесцентных E. coli клетки. Преимущества этой системы определяются во избежание кворума зондирования регулирование ограничения и сложные средние композиции вместе с нестандартными роста условий, таких как температуры. Эта система позволяет проводить анализ люкс генов и их взаимосвязь, исключение соответствующих генов от Оперон люкс , или даже добавление новых генов, обмена luxAB генов из одной бактериальный штамм другим, или Анализ комплексов протеина, например luxCDE.
Введение
Излучение света, живыми организмами (биолюминесценции) это увлекательный процесс в бактерий, грибков, насекомых, нематоды, рыба и кальмары1. Биолюминесцентных светового излучения возникает от хемилюминесцентный реакции, в которых химической энергии (частично) преобразуется в энергию света («холодного света»). В биолюминесцентных бактерий гетеродимерная Люцифераза Фермент катализирует monooxygenation длинноцепочечных алифатических альдегидов, например tetradecanal, для соответствующей кислоты, в сопровождении светового излучения с максимальной в 490 Нм2, 3.
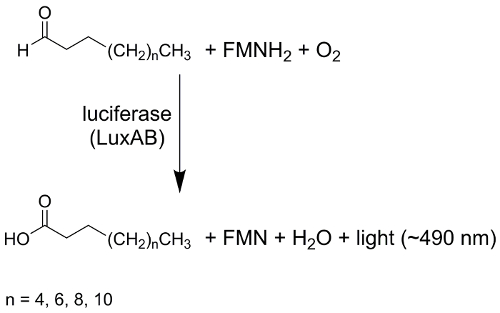
Рисунок 1 : Общие реакции схема бактериальных Люцифераза. Бактериальные Люцифераза (LuxAB) катализирует monooxygenation длинной цепи альдегиды (CH3(2CH)nЧо), используя сокращены Флавинмононуклеотид (FMNH2) и молекулярного кислорода (2O), приносит продукты длинные цепи кислоты (CH3(2CH)nCOOH), флавин мононуклеотид (FMN), воды (H2O) и излучение света по центру в 490 Нм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Энергия, выделяющаяся при этом окисления вызывает возбужденного состояния ФМн 4a-гидроксид, который служит светоизлучающих люциферин4. Белков, участвующих в бактериальных биолюминесценции, а именно LuxCDABEG, кодируются Оперон люкс и сохраняются высоко над различных штаммов бактерий2,5. Гены luxA и luxB кодирования для гетеродимерная Люцифераза; в luxC, luxDи люкс в продукты гена являются компонентами жирных кислот-редуктазы комплекса; и luxG кодирует для Флавин редуктазы6. Количество биолюминесцентных Photobacteria (e.g.,Photobacterium mandapamensis 27561) нести дополнительные luxF ген. Было сообщено, что LuxF это м.в белок, который связывается необычные Флавин производная 6-(3'-(R)-myristyl)-ФМн (myrFMN)7,8,9,10,11 ,12. Определены дополнительные гены, которые отвечают за синтез рибофлавин (например, ribEBH) и Кроме того были зарегистрированы регуляторных генов, которые играют роль в кворума зондирования регулирование биолюминесценции, особенно для холерный фишери и Vibrio harveyi6,13. Несмотря на приказ высоко сохранены гена биолюминесцентных бактерий показать высокие колебания в характеристики как рост поведение, интенсивность светового излучения, или регулирование биолюминесценции2,5,14 .
Несколько измененных штаммов или плазмиды, содержащие части или весь люкс опероны известны, используют биолюминесценцию как репортер систем. Различные приложения, например определение промоутер деятельность, мониторинг бактериальных загрязнений в окружающей среде или образцах пищевых продуктов, биолюминесценцию резонанс энергии передачи (BRET), в естественных условиях изображений инфекций в эукариотических организмов, Пиросеквенирование и так далее были установленным15,16,17. Интересно, что три наиболее часто используемые биолюминесцентных репортер систем являются производными от Северной Америки Светлячок (откладываемых pyralis), кишечных патогенов нематод (Photorhabdus luminescens) и море анютины глазки (Renilla reniformis). Ни одна из этих систем имеет бактериального происхождения, но использование люкс генов и опероны от бактериального происхождения приобретает все больший интерес для прикладных исследований16. Менее обильные применение биолюминесценции белков от бактериальных источников объясняется главным образом ниже стабильность и долговечность бактерий производных светящиеся белков, которые могут быть связаны с их морской среды обитания. Биолюминесцентных бактерии морских ареалов обитания, не обрабатываемых в стандартных лабораторных условиях. Эти бактерии требуют конкретных питательных сред и условий, таких как температура среднего и нижнего роста/инкубации искусственный морской воды (например, 28 ° C).
Чтобы упростить сравнение характеристик Оперон люкс или двухместный люкс гены целого ряда различных биолюминесцентных бактериальных штаммов, метод для стандартизации люкс Оперон выражение и анализ является предварительным условием. Таким образом возникла идея интеграции Оперон весь люкс ребра в стандарт исследовательский бактерии Escherichia coli (E. coli). Для этой цели Гибсон Ассамблея оказалась полезным инструментом для интеграции нескольких линейного, перекрытие фрагментов в одно выражение вектор без необходимости для конкретного ограничения сайтов. Этот метод также подходит, когда ДНК вставки слишком велики (27561e.g.,P. mandapamensis luxCDABFEG-ribEBH; 9 КБ ~ Оперон размер), быть усилена через PCR. Оперон люкс могут быть разделены на несколько перекрывающихся фрагментов, а затем собрал в одно выражение плазмиду и наконец последовательность проверки сборки продукта могут быть непосредственно преобразованы в соответствующие E. coli системы для получения высококачественного урожая белка выражение18,19,20. В дополнение к легко обрабатывать E. coli на основе люкс экспрессии генов простой метод, объединяющий записи роста клеток и биолюминесцентных светового излучения по-прежнему создаваться. Метод, описанный здесь позволяет в situ измерения и корреляции плотность клеток и светового излучения биолюминесцентных бактерий.
Анализ генов люкс и люкс Оперон порядка и регулирования различных биолюминесцентных бактерий, с одной стороны, искусственные биолюминесцентных E. coli системы, содержащие весь люкс ребра Оперон P. mandapamensis 27561 и, с другой стороны, пробирного читатель недавно разработанных пластины, сочетая в situ записи плотность клеток и светового излучения, помогает получить более подробную информацию о различных системах бактериальных люкс . Это основные характеристики и сравнение luciferases и связанных с ними ферментов может привести к альтернатив уже созданной репортер систем с укрепления стабильности и деятельности.
протокол
1. Проектирование, подготовка и выражение люкс Оперон в Escherichia coli
Примечание: Смотрите Таблицу материалов для получения информации о коммерческих наборы, используемые в этом разделе.
- Для передачи Оперон люкс в E. coli выберите Стандартный ПЭТ вектор с места соответствующие ограничения и антибиотикам ген интереса (например, pET28a; NcoI, XhoI, канамицин).
- Дизайн фрагменты и перекрывающихся Праймеры для Ассамблеи Гибсон, основанный на последовательности ДНК Photobacterium mandapamensis 27561 (GenBank: DQ988878.2).
- Настройка стандартной реакции PCR с дизайном грунты и изолированные геномной ДНК Photobacterium mandapamensis 27561 как шаблон (см. Дополнительные материалы для грунтовки и условий).
Примечание: Изоляции геномной ДНК бактериального штамма соответствующих повышает эффективность ПЦР. - Очищайте продукт PCR через очищение спин колонки.
- Выполните пищеварение ограничения изолированной pET28a вектора с NcoI и XhoI при 37 ° C на 45 мин.
- Очистить линеаризованного вектора и ПЦР фрагментов через агарозы гель электрофореза и последующих спин колонки очистки.
- Определение концентрации ДНК каждого фрагмента и линеаризованного вектора и рассчитать оптимальное количество для Ассамблеи согласно протокола20,21.
Примечание: Эффективность Ассамблеи зависит размер фрагментов и номер и корректироваться согласно производителя протокол20,21. - После объединения всех фрагментов и буфера в ПЦР-пробирку, Инкубируйте Ассамблея смесь в машину ПЦР при 50 ° C за 1 час.
- Трансформировать собранный продукт вектор согласно протоколы стандартные преобразования для преобразования бактериальных плазмид E. coli в соответствующей E. coli система для высокодоходных плазмида репликации (например, кишечной палочки TOP10 или XL-1).
- Выберите колоний от преобразования пластины и полоска на новые пластины для изоляции ДНК.
- Изолируйте плазмида ДНК по стандартным протоколам.
- Чтобы проверить правильную сборку плазмида, включая все фрагменты, сначала выполните колонии PCR согласно стандартных протоколов с помощью грунтовки, специфичных для каждый собранный фрагмент.
- Дополнительно к колонии PCR и последующих геля агарозы, подготовьте все изолированные Ассамблеи векторов для секвенирования ДНК для проверки правильной сборки и правильной последовательности ДНК.
- Трансформировать проверенных плазмида согласно протоколы стандартные преобразования для преобразования бактериальных плазмид E. coli в соответствующей E. coli система для производства белка высокодоходных (e.g.,E. coli BL21).
Примечание: Продолжите непосредственно с протоколом выражение ниже. Для более длительного хранения рекомендуется подготовке биржевых глицерин.
2. выражение штаммов модифицированных E. coli
- Подготовьте ночь культуры (ONC) для выражения, прививка соответствующего объема LB среды (например, 100 мл) с ранее подготовленными глицерина запас E. coli BL21 клеток превращается с собрал плазмида или непосредственно из преобразования пластины. 100 мкл канамицин (50 мг/мл; антибиотикам ген pET28a) и инкубировать ONC при 37 ° C и 120 об/мин в шейкер инкубатор на ночь.
- Прививать культуру основные выражения (например, 800 мл среды LB) с 8 мл ONC и 800 мкл канамицин (50 мг/мл).
- Инкубировать основной культуры при 37 ° C и 120 об/мин в шейкер инкубатор, до тех пор, пока плотность клеток достигает ОД600 0,6 - 0,8 (примерно 2,5 часа).
- Снижение температуры инкубации до 28 ° C.
- Побудить выражение протеина, добавив IPTG до конечной концентрации 0,1 мм.
Примечание: Эмпирические тесты показали, что снижение температуры до 28 ° C дал высокие интенсивности света. - Соблюдайте клетки, пока они не начинают блестящие (примерно 1 час).
Примечание: В зависимости от цели выражения, клетки растут пока на следующий день и затем собирают, или клетки может быть постоянно тряски до тех пор, как они сияют (максимум 48 часов). Заготовка клетки и очистки любой белков может быть сделано в соответствии со стандартными процедурами.
3. выражение биолюминесцентных штаммов бактерий
Примечание: Штаммы бактерий биолюминесцентных требуют определенного роста среднего/искусственный морской воды среднего для легких производства и роста.
- Подготовка среднего искусственное море воды, состоит из двух отдельно подготовленных компонентов среды.
Примечание: Подготовка среднего искусственный морской воды был адаптирован от оригинального протокола22. Следующие суммы являются для жидкой среды 1 Л или 1 L агар среднего.- Для средних искусственный морской воды, весят в следующих солей: 28.13 г NaCl, 0,77 г KCl, 1,60 g CaCl2 · 2H2O, 4.80 g MgCl2 · 6H2O, 0,11 g NaHCO3и 3,50 г MgSO4 · 7H2O.
- Добавить 1 Л дистиллированной воды и растворяет все компоненты.
- Для средних LB, весят в следующие ингредиенты: экстракт дрожжей 10 g, 10 g Пептон и за дополнительные 20 g агар агар пластины.
- Добавьте 250 мл водопроводной воды и распустить компонентов.
- Автоклав обеих подготовлен СМИ отдельно при температуре 121 ° C для 20 мин.
- Для плиты агара сочетать 250 мл среды фунтов с 750 мл искусственное море водной среды непосредственно после автоклавирования и готовить тарелки.
- Для жидкой среды сочетают 250 мл среды фунтов с 750 мл искусственное море водной среды непосредственно после автоклавирования или когда остынет.
Примечание: Средство искусственный морской воды может получить мутная через соль осадков.
- Полоска биолюминесцентных штаммов бактерий на искусственный морской воды средних агар пластины и Инкубируйте на ночь на 24-30 ° C.
Примечание: Длительное время хранения штаммов бактерий обычно достигается за счет замораживания глицерин запасы бактериальной культуры. Штаммы всегда должен быть прожилками на плитах агара сначала обеспечить равномерное стартовые условия для всех штаммов, до использования жидкого культур, из-за запаздывания фазы роста после оттаивания. - Подготовьте ONC прививки 100 мл искусственное море водной среды с единой колонии от пластины. Инкубируйте ONC на 24-30 ° C и 120 об/мин в шейкер инкубатор на ночь.
- Прививать 800 мл с 8 мл ONC искусственное море водной среды.
- Инкубируйте бактериальные клетки в 24-30 ° C и 120 об/мин в шейкер инкубатор.
Примечание: Профиль интенсивности света биолюминесцентных бактерий сильно зависит от температуры. В зависимости от механизмы регулирования света производства соответствующих бактериальный штамм светового излучения может начаться после примерно 1-6 ч. - Соблюдайте культуру бактериальных клеток, до тех пор, пока они начинают блестящие (около 1-6 h).
Примечание: В зависимости от цели выражения, клетки растут пока на следующий день и затем собирают, или клетки может быть постоянно тряски до тех пор, как они сияют. Заготовка клетки и очистки любой белков может быть сделано в соответствии со стандартными процедурами.
4. в естественных условиях деятельности пробирного биолюминесцентных штаммов бактерий и штаммов модифицированных E. coli
Примечание: Длительное время хранения штаммов является обычно acieved через замораживания глицерин запасы бактериальной культуры. Штаммы всегда должен быть прожилками на плитах агара сначала обеспечить равномерное стартовые условия для всех штаммов, до использования жидкого культур, из-за запаздывания фазы роста после оттаивания.
- Полоска желаемого биолюминесцентных бактериальный штамм или модифицированных E. coli деформации на плите агар и Инкубируйте на 28 ° C на ночь.
Примечание: Температуры инкубации может варьироваться от штамма к деформации и оценивать эмпирически. Чтобы иметь возможность сравнить биолюминесцентных бактериальных штаммов и модифицированных штаммов E. coli , условий роста должны быть идентичны. - Прививок 3 мл среды с соответствующей деформации с единой колонии от плиты агара и инкубировать клетки на 28 ° C и 180 об/мин в шейкер инкубатор для примерно 1-2 ч.
- Измерить плотность клеток в 1:10 разбавления жидкости культуры на 650 Нм. Вычислить коэффициент и объемом 1 мл культуры с ОД650 0,05.
Примечание: Assay читателя последующих плита будет определять плотность ячеек на 650 нм, чтобы избежать помех от светового излучения штаммов. - Пипетка вычислительного объема культуры и среднего в 24-ну со стенами черный плиту с стекла дном. Для модифицированных E. coli процедить, добавить 1 мкл канамицин (антибиотикорезистентности pET28a вектора) и 1 мкл IPTG (индукция экспрессии генов) образцов. Поместите крышку на пластину во избежание испарения во время измерения.
Примечание: Чтобы заверить, что вектор pET28a, содержащий весь люкс Оперон не теряйтесь культуры е. coli , канамицин должен добавляться для каждого образца E. coli в лунках и заверить что света производства E. coli клетки могут быть измерены, экспрессии генов должны быть индуцированных IPTG. Чтобы избежать перекрестных помех и измерения вмешательства, черный стеной хорошо пластины с стекла дно и прозрачной крышкой показали лучшие результаты. Тем не менее уровень помех может наблюдаться и хорошо позиции должны быть выбраны тщательно. - Начало измерения на тарелку читателя.
Примечание: Плита читателя протокол основан на специально разработан сценарий для этого анализа (см. Дополнительные материалы), сочетает в себе два измерения, поглощения и биолюминесценции. Точки данных собираются каждые 10 мин с постоянной тряски между измерениями и постоянной температурой 28 ° C.
Результаты
Ген порядок Оперон люкс - luxCDABFEG - сохраняется высоко над различных штаммов2,5,14. Для дизайна плазмида последовательности информация была взята из биолюминесцентных бактериальный штамм Photobacterium mandapamensis 27561 и порядка его ген держали то же самое, и, Кроме того, были рассмотрены некодирующих последовательностей между единичных генов. Схематический обзор применяемых Гибсон клонирования стратегии изображен на рисунке 2. Были созданы четыре фрагментов в общей сложности, luxCDAB, luxF, luxEG и ribEBH, с 20-40 пар перекрывающимися последовательностями. После всех шагов Гибсон Ассамблеи20, секвенирование ДНК подтвердили правильную сборку плазмида, включая все фрагменты. Векторная карта окончательную сборку продукта pET28a содержащий люкс ребра Оперон изображена на рисунке 3. Значительное преимущество этого вектора модифицированных pET28a является использование стандартизированных условий роста кишечной палочки и контролируемых индукции с IPTG.
Для измерения излучения света биолюминесцентных бактерий и плотность соответствующих клеток, был разработан метод чтения на основе плиты. Метод для чтения пластины было создано объединение одного измерения сценариев для легких плотности интенсивности и клеток. Этот роман сценарий включены измерения ОД650 и интенсивности света каждые 10 мин для пользователя определены сроки, который должен корректироваться время генерации бактерий, для соответствующего анализа (например, 10 h). Измерение оптической плотности была исполнена на 650 нм, чтобы избежать вмешательства с светового излучения. Как доказательство концепции и обеспечить здоровье и поведение правильный рост клеток кишечной палочки ссылка измерения были выполнены. Рисунок 4 сравнение E. coli BL21 клеток, E. coli BL21 клетки, содержащие пустую pET28a вектор и E. coli BL21 клетки, содержащие pET28a вектор с люкс ребра Оперон представлены вставки. Для последнего штамма не IPTG был добавлен для анализа излучения света из-за негерметичности промотора T7. Все три ссылки измерения показывают сигмоид роста кривой с три фазы роста (ЛАГ, экспоненциальное и стационарные фаза). Только E. coli BL21 ячейки, содержащие pET28a вектор с люкс ребра Оперон Вставка начинают излучать свет, но в отличие от измерения где выражение индуцируется IPTG и свет излучается через 30 мин,-индуцированной клетки только начинают светить после примерно 5 h и показать гораздо ниже светового излучения (ОК. 4 раза) по сравнению с индуцированных системы.
Рисунок 5 дает сравнение кривых роста и света Оперон люкс , выраженная в E. coli и биолюминесцентных бактериальный штамм P. mandapamensis 27561, LB среднего или в среде искусственный морской воды, с помощью Роман создан метод в situ . Чтобы сравнить эти бактерии, измерения проводились при температуре инкубации 28 ° c. Эта температура снижается, темп роста модифицированных E. coli деформации в среде фунтов, а также искусственное море водной среды, но для более низких температур биолюминесцентных бактериальных штаммов имеют решающее значение. Эта зависимость температуры виден на рис. 5A, как P. mandapamensis 27561 показывает намного выше, плотность клеток, чем E. coli. Кроме того, в то время как для штаммов E. coli , LB среднего позволяет поколение более высокой плотности клеток, естественных биолюминесцентных бактериальных штаммов, искусственный морской воды среднего является предпочтительным и необходимыми для биолюминесценции. Плотности записи ячейки коррелируют с соответствующей интенсивности света, как показано на рис. 5B. Примечательно, биолюминесцентных E. coli клеток достичь аналогичных света выбросов Максима в обоих LB как среднего, так и искусственный морской воды среде, хотя высокие интенсивности были записаны в разное время точках. В отличие от этого наблюдения, P. mandapamensis 27561 жизнеспособным с высоко снижение темпов в среде фунтов, но бактериальные клетки не излучают свет на всех (рис. 5B). В среде искусственный морской воды, P. mandapamensis 27561 показывает максимум излучения света на около 1 х 104 пунктам в секунду, что фактор почти 200 меньше, чем E. coli. Рисунок 5 C представляет относительный легких единиц, где биолюминесценции нормируется ОД. Эти результаты подтверждают, что не только был вставки плазмида содержащие Оперон люкс в E. coli успешных и функциональный, но также, что это изменение E. coli штамм является действительный альтернатива с даже больше светового излучения урожайность и без ограничения бактериальной биолюминесценции Марина бактерий, таких как комплекс морской средних и более низких температурах.
Кроме того долгосрочное измерение экспрессии генов люкс ребра E. coli на основе более 24 h была выполнена для анализа долговечности излучения света (рис. 6). Излучения света длился 19,5 ч, гораздо дольше, чем бактериальных штаммов (например, P. mandapamensis 27561), где постепенное снижение было отмечено, что приводит к очень низкой светового излучения после 10 h.
Чтобы проиллюстрировать ограничения развитых assay, Рисунок 7 показывает результаты измерений трех биолюминесцентных штаммов бактерий, а именно S1 Photobacterium mandapamensis , Photobacterium mandapamensis TH1 и холерный harveyi 14126. Первый сорт (S1) метод работает очень хорошо и показывает максимальное биолюминесценции интенсивности почти 2 x 10-6. Для других двух штаммов (TH1 и 14126), максимальная сила света не может быть определено, потому что интенсивности света, порожденных оба превышен предел обнаружения, используемый инструмент настройки. Получить значение, определенное для разработанного метода (сценарий) для этих двух штаммов был установлен слишком высокий. Тем не менее начала биолюминесценции активности можно сравнить друг с другом. P. mandapamensis TH1 и P. mandapamensis S1 начать блестящие после примерно 1 h и ОД650 значение 0.1 - 0.2, соответственно. В отличие от V. harveyi 14126 начинает излучать свет после примерно 5,5 ч в ОД650 значение 1.0. Наблюдаемые начала светового излучения сопровождается экспоненциальным ростом в ОД, а также биолюминесценции. Известно, что биолюминесценция V. harveyi 14126 лежит в основе кворума зондирования регулирования и поэтому определенной ячейки плотности, позволяя активации Оперон люкс , который четко прослеживается в рисунке 713. Этот результат демонстрирует, что этот роман в situ пробирного читатель пластины можно легко сравнить биолюминесцентных бактерий и также примерно определить механизм регулирования этих штаммов путем определения кворума зондирования регулирования может быть наблюдается или нет.
На рисунке 8 показан пример выражения культуры е. coli BL21 клетки укрывательство собрал pET28a плазмиды, содержащий люкс Оперон после индукции с IPTG. После примерно один час после индукции E. coli клетки начать блестящие сине зеленым цветом. Рисунок 8 A показывает E. coli выражение культуры сфотографировали в свете и Рисунок 8B дает ту же культуру в темноте. Рисунок 8 C изображает агар пластины искусственных море водной среды с P. mandapamensis S1 светящийся в темноте в характеристике же сине зеленый цвет для бактериальных биолюминесценции.
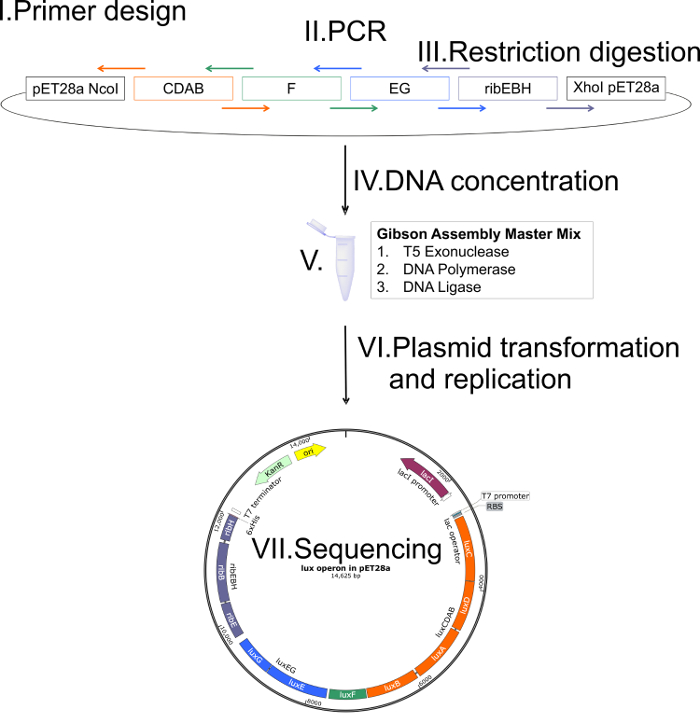
Рисунок 2 : Схематическое представление прикладной Гибсон, клонирование стратегии. Шаг (I): предназначены перекрывающиеся грунтовки (цветные стрелки; ОК. 20-40 пар перекрываются). Перекрывающиеся грунтовки содержат отжига последовательности, состоящие из соответствующего региона 5' и 3' одного фрагмента и региона соответствующих 3' и 5' прилегающих сегмента. Этап (II): Разработанные фрагменты для сборки создаются с помощью стандартных реакций PCR. Этап (III): Вектор целевой линеаризации, пищеварение ограничения (например, NcoI, XhoI). Шаг (IV): Концентрации ДНК всех фрагментов и линеаризованного вектора должны определяться для регулировки концентрации для Ассамблеи Гибсон (по данным производителя протокол). Шаг (V): Все фрагменты и линеаризованного вектора с оптимизированной концентрации ДНК в сочетании с Гибсон Ассамблеи мастер смеси (при exonuclease T5, ДНК-полимеразы и ДНК лигаза) и инкубируют при 50 ° C за 1 ч. Шаг (VI): Ассамблея продукт трансформируется по данным стандартных протоколов в соответствующей E. coli деформации для высокодоходных плазмида репликации (например, кишечной палочки TOP10 или XL-1). Шаг (VII): Чтобы проверить правильную сборку плазмида, секвенирование ДНК собрал плазмидной должна выполняться. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
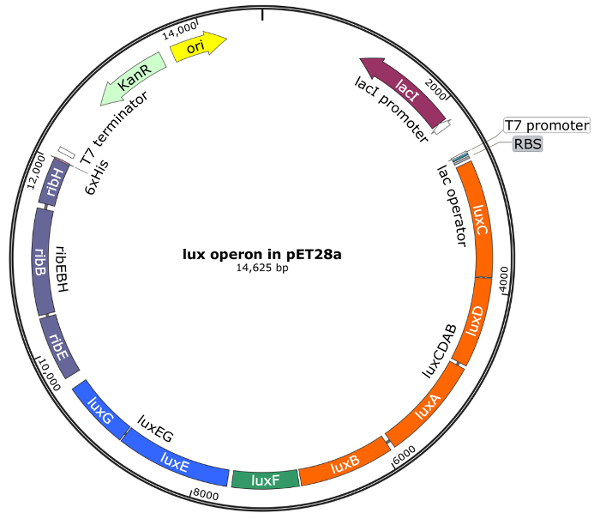
Рисунок 3 : Векторная карта pET28a содержащие люкс ребра оперона. Люкс ребра Оперон P. mandapamensis 27561 вставляется в несколько клонирования сайта pET28a в оригинальной последовательности гена (luxCDABFEG-ribEBH). NcoI и XhoI места ограничения, используемые для клонирования. Фрагменты, используемые для сборки Гибсон оперона являются luxCDAB в оранжевый, luxF в зеленый, luxEG синим и ribEBH в лаванды; гены внутри фрагмента показываются в отдельной коробке. В прикладной клонирования стратегии включены некодирующих последовательностей между каждого гена оперона. Размер окончательный плазмида pET28a содержащий Оперон весь люкс ребра — 14625 пар оснований. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4 : Сравнение кривых роста и света эталонных штаммов. ОД 650 нм и интенсивности биолюминесценции в подсчитывает в секунду были измерены каждые 10 мин свыше 10 h 28 ° c. Все измерения являются средними значениями три биологических реплицирует с четырех технических реплицирует. Планки погрешностей представляют стандартных отклонений. E. coli BL21 клетки (серый квадрат), E. coli BL21 клетки, содержащие пустую pET28a вектор (серые круги), и E. coli BL21 клетки, содержащие pET28a вектор с люкс ребра Оперон вставки (черный алмаз) были проанализированы с обеспечить правильное роста поведение наших клеток кишечной палочки . Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
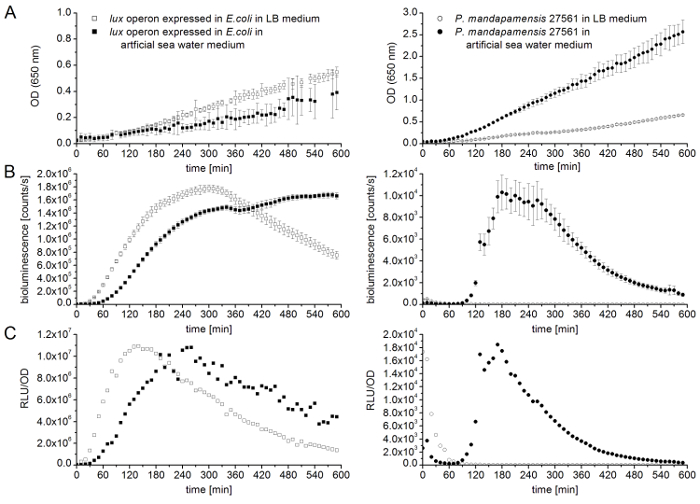
Рисунок 5 : Сравнение кривых роста и света люкс -оперона выраженной в E. coli (квадраты) и P. mandapamensis 27561 (круги) в средних фунтов (открытые символы) или искусственное море водной среды (заполненные символы). Все измерения являются средними значениями три биологических реплицирует с четырех технических реплицирует. Планки погрешностей представляют стандартных отклонений. Все эксперименты проводились при температуре инкубации 28 ° c. (A) оптические измерения плотности (OD) 650 Нм выполнялись каждые 10 мин для 10 h. E. coli люкс Оперон выражение (левая панель) по сравнению с P. mandapamensis 27561 (правая панель) в LB средних и искусственное море водной среды. Плотность ячеек определяются на 650 нм, чтобы избежать вмешательства биолюминесценции. (B) измерение интенсивности света (биолюминесценции [пунктам/s]) выполнялась каждые 10 минут за 10 h. E. coli люкс Оперон выражение (левая панель) по сравнению с P. mandapamensis 27561 (правая панель) в LB средних и искусственное море водной среды. Относительный света (C) света (RLU/OD) Оперон люкс , выраженная в E. coli (левая панель) и P. mandapamensis 27561 (правая панель) определяются путем нормализации биолюминесценции для плотность клеток. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
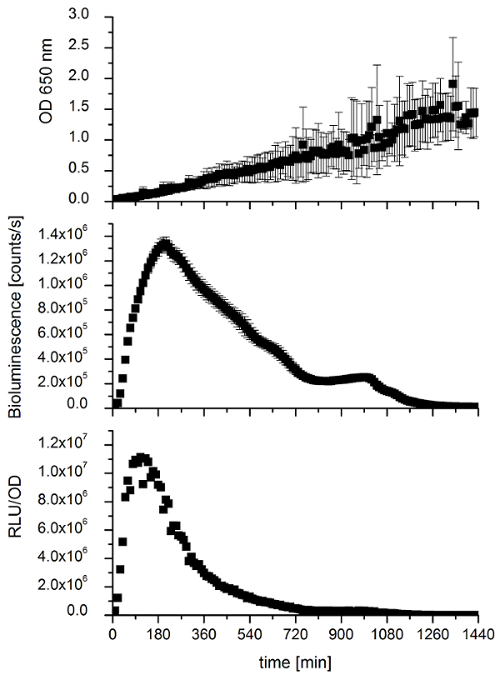
Рисунок 6 : На основе сравнения кривых роста и света E. coli экспрессии генов люкс за 24 ч. ОД 650 нм и интенсивности биолюминесценции в подсчитывает в секунду были измерены каждые 10 мин более 24 ч составляет 28 ° C. Все измерения являются средними значениями три биологических реплицирует с четырех технических реплицирует. Планки погрешностей представляют стандартных отклонений. Кроме того представлены относительной интенсивности света (RLU/OD), где биолюминесценции нормируется плотность клеток. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
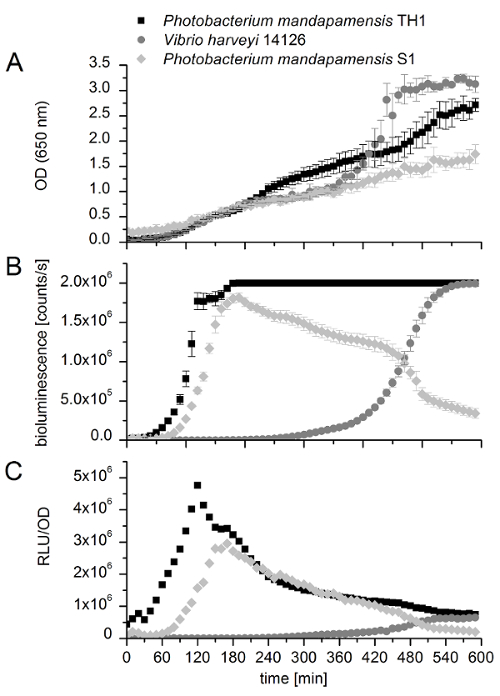
Рисунок 7 : Сравнение биолюминесцентных бактерий для оценки потенциальных кворума зондирования регулирования. Излучения света и плотность ячеек измеряются каждые 10 мин для 10 h и представляют собой средние значения трех биологических реплицирует с четырех технических реплицирует. Планки погрешностей представляют стандартных отклонений. Измерения Photobacterium mandapamensis TH1 (черные квадраты), harveyi холерный 14126 (серые круги) и Photobacterium mandapamensis S1 (серые алмазы) были сопоставлены друг с другом; (A) изображает оптической плотности (OD) 650 нм, (B) света интенсивность (биолюминесценции [пунктам/s]) и (C) относительной интенсивности света (RLU/OD). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
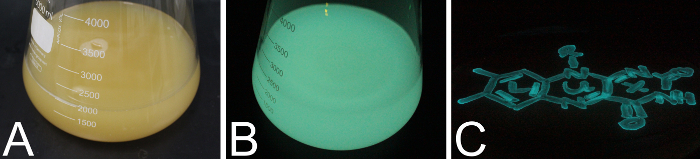
Рисунок 8 : Биолюминесценции в жидких средах и на плитах агара. (A) 5 L колбу с 2 Л LB среднего привиты с E. coli BL21 клетки, выражая Оперон плазмида pET28a люкс , сфотографировали в свете. (B) же культура, как (A) сфотографировали в темноте. A и B были снимки приблизительно 2 ч после индукции выражения. (C) искусственный морской воды средних агар плита с прожилками культуры P. mandapamensis S1, сфотографировали в темноте. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Строительство плазмида выражения, содержащие четыре фрагментов, составляющих весь люкс ребра Оперон P. mandapamensis 27561 была достигнута через Гибсон клонирования. Это выражение гена люкс E. coli на основе позволяет E. coli клетки, чтобы излучать свет. Избегая кворума зондирования правил и условий нестандартного роста являются существенные преимущества этой системы.
Преимущества использования Гибсон клонирования стратегии являются легко Ассамблея нескольких линейных фрагментов ДНК, высокая гибкость и нет необходимости для конкретного ограничения сайтов18,19,20. Этот метод позволяет легко менять Оперон люкс , за исключением единичных генов или гена кластеров или введения новых генов или обмена гены от одного штамма с другой. Предварительным условием для применения этого метода является наличие соответствующих люкс Оперон генная последовательность. Только для небольшого числа биолюминесцентных бактерий полной последовательности ДНК соответствующих люкс -оперона известных и/или доступны. Многие из этих последовательностей являются разрозненными, потому что они были созданы с помощью дробовика последовательности. В случае исследуемых P. mandapamensis 27561 полной последовательности ДНК люкс -оперона известны и доступны из базы данных NCBI гена (GenBank: DQ988878.2).
Один важный шаг в протоколе собрания Гибсон является расчет концентрации ДНК одной фрагментов. В протоколе Ассамблея производителя, было рекомендовано использовать 0,2 - 0,5 pmols и суммарный объем 20 мкл для 4-6 фрагменты20,21. В нашем случае, где luxCDABFEG-ribEBH состоит из 4 фрагментов, концентрации и общие объемы были 0.1 пмоль и 45 мкл, соответственно, в зависимости от доходности продуктов PCR. С одной стороны концентрация пришлось сократить, а с другой стороны, объем пришлось увеличить. Тем не менее Ассамблея работал очень хорошо и секвенирования ДНК подтвердили правильность подсоединения с первой попытки. Этот вывод подтвержден Гибсон Ассамблеи как надежные и соответствующий метод для нашего исследования, которые могут быть легко изменение18,19,20.
Assay читатель недавно созданной пластина легко обрабатывать метод. Это позволяет простой первичный анализ новых или (ООН-) известный биолюминесцентных бактериальных штаммов и дает уже первый намек на механизм регулирования света производства (например, отставание в люминесценции при плотностях низкой клеток). Кроме того условия для роста в сочетании с легкими производства легко могут оцениваться путем простого изменения, рост средний или температуры.
Измерения с читателем пластины были исполнены на 28 ° C. Для этого необычного параметра причина чувствительность температуры биолюминесцентных бактериальных штаммов, где температура выше 30 ° C ведут к меньше или даже нет роста и/или излучение света. Обратите внимание, что плита читатель способен поддержания определенной температуры со временем с ограничением отсутствуют активные системы охлаждения. Таким образом температура должна быть ниже температуры измерений.
Как доказательство концепции сравнение E. coli конструкции с биолюминесцентных штамм P. mandapamensis (рис. 5) с одной стороны и ведения измерений (рис. 4) с другой стороны были исполнены и подтвердите надежность этой недавно созданной системы. Кроме того долгосрочное измерение заверил долголетия излучения света (рис. 6). Но надо учитывать, что ОД значения не являются надежными, выше определенной оптической плотности, в зависимости от характеристик устройства используемые измерения (примерно 15 h в данном случае), где потребуются соответствующие разрежения для измерения в линейный Диапазон детектора. Эти высокие разницы в ОД значения делают эти измерения долгое время не надежны. Таким образом короче измерения например 10 h рекомендуется использование экспериментальной установки сообщили здесь.
Ограничения пробирного читателя установленные плиты можно увидеть на рисунке 7. Сложность заключается в том, чтобы найти соответствующий параметр измерения. Получить значение регулирует чувствительность фото множитель трубки (ПЛТ). Прибыль является усиление сигнала в ПЛТ, означает, что высокий коэффициент повышения будет увеличить сигнал. Если прибыль установлено слишком низкое, отношение сигнал-шум становится больше и света «низкий» блестящие биолюминесцентных бактерий может быть измерена любой больше (сигналы близка к нулю, данные не показаны). В биолюминесцентных assay задача установить коэффициент усиления таким образом результаты измерений для всех бактериальных штаммов оставаться в пределах документа. Кроме того, диапазон измерения для свечения зависит от интервала времени измерения (например, максимум 2.000.000 для 1 s).
Прирост был установлен до 2800, который был эмпирически протестированы и выбрали для читателя конкретных пластины, используется для создания данного метода. Параметр использовать выгоды позволяет записывать максимальная испускаемого света, биолюминесцентных кишечной системы, P. mandapamensis 27561 и P. mandapamensis S1 без переполнения, но штаммов P. mandapamensis TH1 и V. harveyi 14126 прибыль была слишком высока. Таким образом эти последние штаммов превышает предел обнаружения и реальная максимальная сила света не может быть измерена. Это техническое ограничение могло бы предотвратить сравнение биолюминесцентных бактерий, которые показывают высокие изменения максимального светового излучения, хотя условия роста и плотности клеток могут быть сопоставимыми.
Позиционирование проанализированных штаммов бактерий внутри используется хорошо пластины должен оцениваться эмпирически. Хотя были использованы черный также пластины с стеклянный днищами, наблюдалось перекрестных помех между выборками. Интенсивность света конкретных штаммов настолько высока, что все соседние скважины будут показывать ложные положительные света выбросов (например, пустой). Таким образом важно для оценки двух различных штаммов, либо отдельно, либо с определенного пространственного разделения друг к другу.
Уже есть многие изменены штаммов E. coli , известно, что содержат части Оперон люкс и главным образом ориентированные на приложения15,16,17. Методы, описанные здесь, направлены на фундаментальных исследований, например возможность анализа каждого гена люкс отдельно. Хотя исследования биолюминесценции имеет долгую историю, есть еще много открытых вопросов. Исключая или введение генов от Оперон люкс , обмена luxAB генов с генами от другого напряжения или анализа белка комплексов, встроенный в легко обрабатывать E. coli и дальнейшее применение пластины пробирного читателя, может быть возможность получить больше информации о регуляторных процессов и функций генов люкс .
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы хотим поблагодарить Владислав Майер (BMG Labtech GmbH) за его поддержку в создании самостоятельной письменность для читателя пластины. Эта работа была поддержана австрийского «Fonds zur Förderung der wissenschaftlichen Тюрингия» (FWF) до вечера (P24189) и программы PhD «ДК молекулярной энзимологии» (W901) до вечера.
Материалы
| Name | Company | Catalog Number | Comments |
| NEBuilder High-Fidelity DNA Assembly Cloning Kit | New England Biolabs Inc. | E2621S | for 10 rxn dx.doi.org/10.17504/protocols.io.cwaxad |
| Phusion Polymerase | Thermo Scientific | F530S | |
| Q5 High Fidelity DNA Polymerase | New England Biolabs Inc. | M0491S | |
| GeneJet Genomic DNA Purififcation Kit | Thermo Scientific | K0721 | for 50 rxn |
| Restriction enzymes and buffer (NcoI, XhoI) | New England Biolabs Inc. | R3193S/R0146S | |
| Wizard SV Gel and PCR Clean-Up kit | Promega | A9282 | for 250 rxn |
| Monarch DNA Gel Extraction Kit | New England Biolabs Inc. | #T1020S | for 50 rxn |
| GeneJet Plasmid Miniprep Kit | Thermo Scientific | K0503 | for 250 rxn |
| GoTaq G2 DNA Polymerase | Promega | M7841 | |
| 24-well black sensoplate with glass bottom | Greiner Bio One | 662892 | |
| FLUOStar Omega plate reader | BMG Labtech | ||
| OPTIMA/Mars Analysis Software | BMG Labtech | Version 2.20 | |
| Microsoft Excel 2010 | Microsoft | ||
| Multitron Standard Incubator Shaker | Infors AG |
Ссылки
- Widder, E. A. Bioluminescence in the Ocean: Origins of Biological Chemical, and Ecological Diversity. Science. 328 (5979), 704-708 (2010).
- Dunlap, P. Bioluminescence, Microbial. Encycl Microbiol. , 45-61 (2009).
- Ulitzur, S., Hastings, J. W. Evidence for tetradecanal as the natural aldehyde in bacterial bioluminescence. Proc Natl Acad Sci USA. 76 (1), 265-267 (1979).
- Kurfürst, M., Ghisla, S., Hastings, J. W. Characterization and postulated structure of the primary emitter in the bacterial luciferase reaction. Proc Natl Acad Sci USA. 81, 2990-2994 (1984).
- Dunlap, P. Biochemistry and genetics of bacterial bioluminescence. Biolumin Fundam Appl Biotechnol. 1, 37-64 (2014).
- Meighen, E. A. Bacterial Bioluminescence: Organization, regulation, and application of the lux genes. FASEB J. 7, 1016-1022 (1993).
- Moore, S. A., James, M. N. G., O'Kane, D. J., Lee, J. Crystallization of Photobacterium leiognathi non-fluorescent flavoprotein with limited sequence identity to bacterial luciferase. J Mol Biol. 224, 523-526 (1992).
- Moore, S. A., James, M. N. G., O'Kane, D. J., Lee, J. Crystal structure of a flavoprotein related to the subunits of bacterial luciferase. EMBO J. 12 (5), 1767-1774 (1993).
- Moore, S. A., James, M. N. G. Common structural features of the luxF protein and the subunits of bacterial luciferase: Evidence for a (βα)8 fold in luciferase. Protein Sci. 3, 1914-1926 (1994).
- Moore, S. A., James, M. N. G. Structural refinement of the non-fluorescent flavoprotein from Photobacterium leiognathi at 1.60 Å resolution. J Mol Biol. 249, 195-214 (1995).
- Kita, A., Kasai, S., Miyata, M., Miki, K. Structure of flavoprotein FP390 from a luminescent bacterium Photobacterium phosphoreum refined at 2.7 Å resolution. Acta Crystallogr Sect D Biol Crystallogr. 52 (1), 77-86 (1996).
- Bergner, T., et al. Structural and biochemical properties of LuxF from Photobacterium leiognathi. Biochim Biophys Acta - Proteins Proteomics. 1854 (10), 1466-1475 (2015).
- Defoirdt, T., Boon, N., Sorgeloos, P., Verstraete, W., Bossier, P. Quorum sensing and quorum quenching in Vibrio harveyi: Lessons learned from in vivo work. ISME J. 2 (1), 19-26 (2008).
- Meighen, E. Genetics of bacterial bioluminescence. Annu Rev Genet. 28, 117-139 (1994).
- Kelkar, M., De, A. Bioluminescence based in vivo screening technologies. Curr Opin Pharmacol. 12 (5), 592-600 (2012).
- Waidmann, M. S., Bleichrodt, F. S., Laslo, T., Riedel, C. U. Bacterial luciferase reporters: The Swiss army knife of molecular biology. Bioeng Bugs. 2 (1), 8-16 (2011).
- Wilson, T., Hastings, J. W. . Bioluminescence living lights, lights for living. , (2013).
- Gibson, D. G., Young, L., Chuang, R. Y., Venter, J. C., Hutchison, C. A., Smith, H. O. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nat Methods. 6 (5), 343-345 (2009).
- Gibson, D. G., Smith, H. O., Hutchison, C. A., Venter, J. C., Merryman, C. Chemical synthesis of the mouse mitochondrial genome. Nat Methods. 7 (11), 901-903 (2010).
- Gibson, D. G. Enzymatic assembly of overlapping DNA fragments. Methods Enzymol. 498, 349-361 (2011).
- . . NEB NEBuilder HiFi DNA Assembly Reaction. , (2015).
- Atlas, R. M. . Handbook of Microbiological Media, Third Edition. , (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены