Method Article
Микро агар соль Мост электрод для анализа текучести Протон рекомбинантных мембранных белков
В этой статье
Резюме
В электрофизиологические измерения наличие потенциальных диффузии мешает точное измерение обратной потенциал, изменяя электродный потенциал. С помощью микро агар соль мост, влияние диффузии потенциальных сводится к минимуму, что позволяет более точное измерение субстрата оборот чисел восстановленный рекомбинантных мембранных белков.
Аннотация
На сегодняшний день, более 50% всех фармакологических препаратов целевой транспорта кинетика мембранных белков. Электрофизиологические характеристики мембранных белков перевозчик воссоздана в липидного бислоя мембраны это мощный, но тонкий метод для оценки их физико-химических и фармакологических свойств. Номер оборота субстрата является уникальный параметр, который позволяет сравнения деятельности различных мембранных белков. В electrogenic транспорта градиент translocated субстрата создает потенциал мембраны, которая напрямую коррелирует субстрата текучесть белка. С помощью электродов хлорид серебра, диффузии потенциал, также называется жидкий Джанкшен потенциал, наведено, который изменяет электродный потенциал и существенно мешает потенциальным измерения точные мембраны. Диффузия потенциальных могут быть уменьшиты соль мост, который уравновешивает электродный потенциал. В этой статье микро агар соль мост предназначен для улучшения электрофизиологических настройки, который использует micropipettes для формирования мембраны. Раствор соли заполняется в кончик микрокапиллярной пипетку, стабилизированная добавлением агарозы и может быть легко установлен Стандартный электрод. Электродный потенциал электрода микро солевой мост является более стабильным по сравнению с Стандартный электрод. Внедрение этой системы стабилизирует электродный потенциал и позволяет более точные измерения мембранного потенциала порожденных градиента рН. С помощью этой системы, Протон текучести митохондриальной перевозчиков, UCP1 и UCP3 связи и по сравнению с ранее измерений.
Введение
Мембранные белки являются мишенью до 60% от всех известных фармацевтических препаратов1. Электрофизиологические измерения мембранных белков являются мощный, но тонкий инструмент для анализа electrogenic перевозки субстратов, посредничестве мембраны несущей белков. Модуляция трансмембранный ток приложением напряжения постоянного тока или напряжения рампы позволяет оценить фармакологических и физические свойства перевозчиков, например, активации и торможения субстратов или транспортом Кинетика. Особый интерес представляет номер оборота субстрат, который отображает количество субстрата, перемещен, мембранные белки в единицу времени. Это основной параметр, при сравнении кинетика различных мембранных белков. Создание градиента концентрации субстрата взимается через мембрану генерирует ЭДС, из которого выводится оборот количество субстрата.
С помощью AgCl электродов, наличие хлоридно свободный буфера создает потенциал диффузии, который изменяет электродный потенциал и приводит к смещению в измерения напряжения тока2. Хотя всегда присутствует, это незначительно для стандартных проводимости и измерения емкости, так как эти параметры являются либо зависимых на склоне вольт амперных запись (проводимость) или являются разница одной записи (мощности), который отменяет потенциал. Однако запись обратного потенциал, который создается на транспорте субстрата, может значительно встревожена диффузии потенциал. Таким образом для точного измерения обратного потенциал, электродных потенциалов должны быть неизменным.
Потенциального распространения могут быть уменьшиты двумя методами: (i) в присутствии из бислоя мембраны, концентрации субстрата должно быть увеличено на одной стороне мембраны3,4, или (ii) соль Мост остатки электродный потенциал 5. Первый способ заключается в значительной степени зависит от стабильности измерений. Мембрана имеет выжить в течение нескольких минут, от добавления субстрата при перемешивании до тех пор, пока субстрат почти равномерно распределены в решении. Если мембрана разрывов между ними, субстрат градиента изменяется путем свободного обмена заряженные молекулы, и измерения включите неточными. Последний метод остатки диффузии потенциальных, но ограничен размер структуры. Осуществление небольшой, но функционирования соль мост в микро диапазоне электрофизиологических настройки является сложным6. Для последнего метода раствор соли заполняется в кончик микрокапиллярной и стабилизированная добавлением агарозы для предотвращения диффузии соли раствора для буферного раствора.
В этом протоколе описан простой производства микро агар соль мост и внедрение в электрофизиологических настройки, основанные на пипетку set-up7 . Микрокапиллярной наконечник корректируется для содержать раствором KCl 3 M с 1 моль % (w/v) агарозы и преодоления AgCl электродов и буферной решение. Преимущество микро солевой мост отображается время записи электродный потенциал сдвига и более точные измерения мембранного потенциала в различных рН градиентов. В системе модель рекомбинантных белков в липосомах текучесть митохондриальной перевозчиков, UCP1 и UCP3, производится в аналогичных условиях связи и по сравнению с предыдущим результаты3,8.
протокол
1. производство рекомбинантных расцеплять белков (UCPs) и формирование Вселенский бислоя мембран
- Производить рекомбинантные UCP1 и UCP3, как описано Rupprecht et al. 9 и Hilse и др. 10
- Формируют Вселенский бислоя мембраны на советы обычных расходные Пластиковые пипетки как описано Бек и др. 7
2. Подготовка микро агар соль Мост электрода
- Отрегулируйте пипетки микрокапиллярной Совет (см. Таблицу материалы) для соответствующей длины.
- Отметьте положение на пустой оконечности на котором буфера содержащих подсказка будет прикреплен к и использовать раздвижные суппорта для измерения длины электрода микро агар соль мост.
Предупреждение: Микрокапиллярной наконечник должен быть достаточно долго ввести буферный раствор для измерений. - Отрежьте кончик микрокапиллярной с острым ножом или лезвием и чистота поверхности среза с этанол и вода.
- Отметьте положение на пустой оконечности на котором буфера содержащих подсказка будет прикреплен к и использовать раздвижные суппорта для измерения длины электрода микро агар соль мост.
- Подготовьте покрытием AgCl электродов.
- Cut off Ag проволока около 8 см в длину и очистить его с этанол и вода.
- Возьмите кусок наждачной бумаги и заглаживают поверхности длиной 1 см на конце провода, который должен быть в контакте с солевым раствором.
- DIP сглаженного конца в раствор хлористого калия 3 M и пальто электрохимически с хлоридом с помощью тока 1,5 V 10 s.
- Очистить электрод с водой, высушить его и отрегулировать длину AgCl электродов со стороны немелованной, таким образом, чтобы он проникает кончик микрокапиллярной так же глубоко, как это возможно.
Примечание: Протокол может быть приостановлена здесь.
- Приготовляют раствор соли KCl 3 М с агарозы 1% (v/v).
- Весят, 4.47 г KCl и растворяют в 20 мл воды, помешивая его в колбу.
- Снимите мешалку, весят, 0,2 г агарозы и добавить его в колбу.
- Нагревают раствор до 100 ° C до расплава агарозы и предотвратить его от свертывания.
Предостережение: Фляга будет очень жарко. Не прикасайтесь к ней с голыми руками. Рекомендуется используйте перчатки для обработки.
- Заполните кончик микрокапиллярной раствором соли агарозы.
Предупреждение: Решение жарко. Защита рук и работу тщательно, чтобы избежать брызг.- Если агарозы начинает свертывания, нагревают раствор соли снова таять полностью агарозы.
- Замочите 10 мкл раствора соли агар в кончик микрокапиллярной. Окуните его медленно и тщательно чтобы избежать воздушных пузырей в кончик.
- Удаление кончик из пипетки и нажать в AgCl электродов с широкой стороны наконечника. Убедитесь, что электрод проникает раствор соли.
- Охладить электрода до комнатной температуры и подключите его к усилителю.
- Подготовьте буфер для измерений.
- Весят в 0.710 g Na2т4, 0,195 г МЧС, 0,121 g трис и 0,023 g EGTA, затем добавить 100 мл дистиллированной воды в стакан и перемешать раствор.
- Проверьте значение пэ-аша буфера с помощью рН электрода и отрегулируйте значение рН 7,32.
- Проверьте, что электрод сравнения и агар соль Мост электрода электрического контакта.
- Добавьте 1 мл буфера в пластиковый контейнер.
- DIP в электрод сравнения и агар соль Мост электрода и проверить сигнал ответа. Если сигнал ответ правильно, переходите к шагу 2.7.
- Если есть ложный сигнал ответа или без электрического контакта на всех, устранения следующих неполадок.
- Проверьте, если электрод находится в контакте с раствор соли и нажмите электрода в раствор.
Примечание: Если решение уже слишком липкое, удалите микро агар соль мост и подготовить новый наконечник микрокапиллярной. - Проверьте, если есть пузырьков воздуха в раствор соли. Если да, подготовьте новый наконечник микрокапиллярной.
- Проверьте, если раствор соли находится в контакте с буферным раствором. Если нет, то отрезали еще 1 мм конца трубки наконечника.
Предупреждение: Убедитесь в том, что Совет все еще достаточно долго, чтобы проникнуть буфера содержащих кончик. Если еще нет контактов, подготовьте новый наконечник микрокапиллярной. - Если ни один из этих шагов поможет, подготовьте новый наконечник микрокапиллярной.
- Проверьте, если электрод находится в контакте с раствор соли и нажмите электрода в раствор.
- Для хранения окуните агар соль Мост электрода в раствор хлористого калия 3 M.
Примечание: Протокол может быть остановлено здесь. Для паузы в одночасье, храните электрода в солевом растворе KCl 3 М при 4 ° C. - Подготовьте буфера содержащих пластикового наконечника.
Примечание: Если электрод хранилась на ночь, принять его и пусть он тепла до комнатной температуре в течение 30 мин.- Возьмите микрокапиллярной наконечник и согнуть трубу, 2 см от края узкая часть, примерно 90 градусов с помощью Отопление проволоки.
- Используйте очень острым ножом или лезвием и отрезали трубку около 5 мм от сгиба.
- Очистить поверхность в конце с этанол и вода и измерить диаметр отверстия наконечник. Исходя из этого Вычислите площадь поверхности.
- Покройте поверхность наконечника с 85:15 (v: v) гексана: гексадекан.
- Пипетка 3 мкл растворителя и удалить его из наконечника.
- Подождите 1 мин, таким образом, чтобы все остаточного растворителя в кончик испарилась.
- Заполните измерительный наконечник с 3 мкл буфера и подключите его на соль Мост электрода.
Примечание: Проверьте снова если соль Мост электрода и электрод сравнения электрического контакта, выполнив шаг 2.5.3. - Если нет электрического контакта, проверьте следующее:
- Проверьте, является ли соль Мост электрода при контакте с буферным раствором. Если нет, то увеличить объем буфера в кончик или подготовить больше кончик микрокапиллярной.
- Если пузырек воздуха, удалите наконечник из микро солевой мост электрода, заполнения буфера в кончик и снова подключите его электрода.
3. измерения электрических параметров мембраны с рекомбинантных белков
- Применить треугольной переменного напряжения сигнала с максимальное напряжение UМакс = 50 МВ и ΔTрамп = 50 мс, которые создает прямоугольный переменного тока ответ. Средние значения токов положительной и отрицательной (я+ и–) Вычислите потенциал мембраны по следующей формуле:
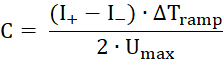
- Применить напряжения рамп, начиная от -50 мВ до 50 МВ и запись текущей. Соответствовать линейной функции для данных - наклон проводимости - и вычислить точку пересечения оси x fit.
- Выполнять решения в пластиковый наконечник и заполнить новую с буфер, содержащий расширение субстрата концентрации.
- Если не мембраны формируется в течение первых 20-30 s, выполнять объем и пополнить его. Это гарантирует, что градиент концентрации через мембрану существенно не изменяется во время формирования мембраны.
- После формирования мембраны выполните 3.1 и 3.2 снова для проверки правильного формирования мембраны и получить точку пересечения оси x.
4. Расчет оборачиваемости субстрата
Примечание: Смотрите предыдущие работы детали3,7.
- Приблизительное количество белка в мембране от молекулярной массы липидов и белков (Mлипидов и Mбелок), площадь мембраны и начальник группы одной липидов (мембраны илипидов) и массе белка на липидов (r).
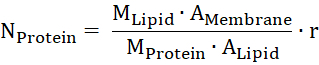
- Вычислите потенциал для перевозимых субстрата Нернста. R-это константа газа, T-температура, z бесплатно перевозимого субстрата, F Фарадея постоянной и c1 и c2 концентрации субстрата обе стороны мембраны.
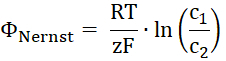
- С вольт амперных записей принимают обратное потенциальных рассчитывается с разницей точки пересечения оси от линейной вписывается в наличие и отсутствие градиента субстрата.
- Рассчитайте долю субстрата проводимости, Gсубстрат, чтобы общая мембраны проводимости, Gвсего, соотношение обратного потенциал Нернста потенциальных11.
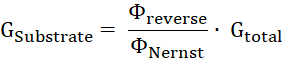
- Рассчитать число ΔN субстрат оборотсубстрата в время блока ΔT от субстрата проводимости (Gсубстрата), приложенного напряжения U и заряд субстрат z:
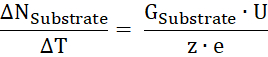
- От соотношения перевозимых субстрата за время количество белков Вычислите κ скорость оборота.
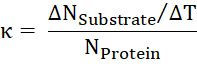
Результаты
Чтобы проверить минимизации потенциальных диффузии, была измерена стабильность измерений-амперных нетронутыми мембраны. Рисунок 2Aпредставитель-амперных записи изображены в присутствии (белые точки) и отсутствие (черных точек) градиента рН. Согласно уравнению Нернста градиента рН вызывает сдвиг в напряжения. От точки пересечения оси линейного подходят к данным рассчитывается потенциального сдвига. Чтобы протестировать оба электродов, сдвиг в точке пересечения оси были проанализированы для стандартного AgCl электродов (рис. 2B; белые точки) и микро агар соль мост (рис. 2B; черные точки). Рампа напряжения был записан в десять раз подряд и означает сдвиг по оси x изображен против времени. В то время как электрод агар соль Мост был максимальный сдвиг менее 5 МВ даже после 300 секунд измерения, Стандартный электродный варьируется до 30 МВ в непредсказуемой, случайные, поведение.
Далее оба электроды были протестированы в различных рН градиентов (рисA). Для стандартных электродных был создан градиента рН 0,35 и 1.0 (белые точки); для агар соль Мост электрода, рН градиенты 0,35, 0,7 и 1.0 (черные точки). Сдвиг в потенциал был проанализирован в трех независимых измерений. В отличие от градиент 0.35, где измеренное сдвиг только слегка меняется, напряжения сдвига значительно изменяет в градиента рН 1,0 в отсутствие микро агар соли моста. С линейной подходят к данным наклон функция является 26,4 ± 2.3 МВ/ΔpH для стандартных электродных и 50,1 ± 4,6 МВ/ΔpH для микро агар соль Мост электрода. Согласно уравнению Нернста, рассчитанные потенциальных сдвиг является 60.7 МВ/ΔpH при T = 32 ° C.
С помощью микро агар соль мост, оборот число протонов, κ митохондриального UCP1 и UCP3 был измеряется и сравнивается с предыдущих измерений (рис. 3B). Похож на Рисунок 3A, ΔpH = 1.0 была создана и была измерена обратный потенциал. Количество белка в мембране оценивалась по формуле, содержащейся в статье 4 протокола, с белками соотношение липидов 4 мкг / (мг липидов), молекулярной массой 33000 и 750 Да для белков и липидов, площадь поверхности мембраны 3,53 x 10 -4 см2и область за липидов 7.8 x 10-15 см2. Полученные κwas 5,56 ± 0,38 s-1 и 4.10 ± 0,71 s-1 для UCP1 и UCP3, соответственно (рис. 3B).
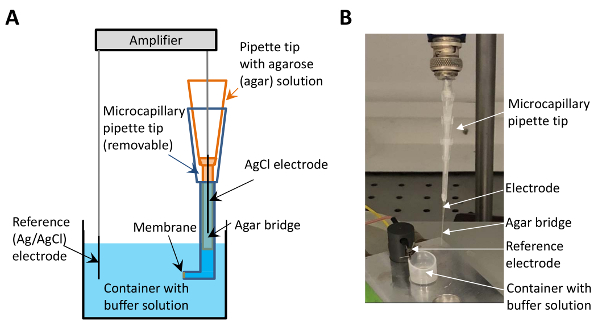
Рисунок 1 : Электрофизиологических set-up с микро агар соль мост. (A) Эта панель показывает эскиз set-up. Кончик микрокапиллярной, содержащих агар солевого раствора (изображены в оранжевый) помещается между электродом (черный) и кончик буфера содержащих (синий). Мембрана образуется на поверхности в конце буфера содержащих кончика (указано стрелкой). (B) Эта группа показывает изображение электрофизиологических set-up с осуществлением микро агар соли моста. Стрелки указывают на электроде, микро агар соль мост, электрод сравнения и контейнер с буферным раствором. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
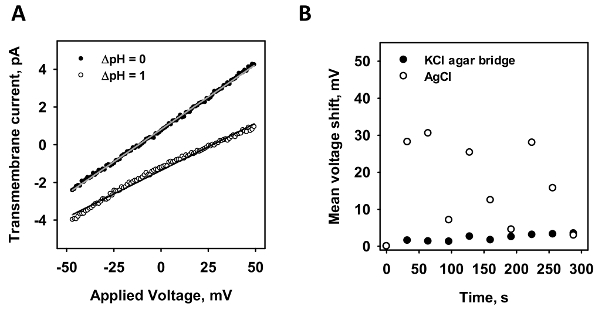
Рисунок 2 : Сравнение микро агар соль мост и стандартный электродный AgCl. (A) Эта группа показывает представитель-амперных измерение в присутствии (серые точки) и отсутствие (белые точки) градиента рН 1. Линии представляют линейной подходят для данных, от которого проводимости и оси пересечения значения получаются. Напряжение сдвига оценивается по разности значения пересечения обеих записей. (B) Эта группа показывает смещение мембраны потенциал стандартного AgCl электрода (белые точки) для микро агар соль Мост электрода (черных точек) в времени. Десять-амперных измерения были записаны в ряд и среднее напряжение сдвига путем диффузии потенциальных заговор против времени. В всех экспериментов мембрана была сделана из 45:45:10 моль % с 15% мол арахидоновой кислоты в концентрации 1,5 мг/мл DOPC:DOPE:CL. Буфер содержит 50 мм Na2т4, 10 мм MES, 10 мм трис и 0,6 мм EGTA при pH = 7.34 и T = 32 ° C. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
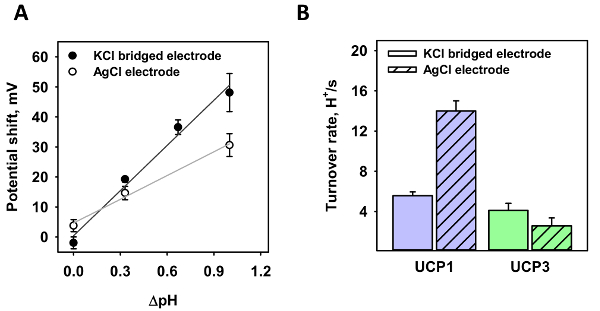
Рисунок 3 : Протон оборот количество UCP1 и UCP3 рассчитывается от обратного потенциал при наличии градиента рН. (A) Эта группа показывает сдвиг в потенциал мембраны UCP1-содержащих различных градиентов рН Стандартный AgCl электродов (белые точки) и микро агар соль Мост электрода (черные точки). Линии представляют линейной подходят к данным. (B) Эта группа показывает количество UCP1 Протон оборот (первый набор данных) и UCP3 (второй набор данных) как вычисляемые от соотношение напряжения сдвига, Нернста потенциал по формулам в разделе 4 протокола. Первый бар каждого набора представляет текучесть, измеренная с микро агар соль мост. Второй бар каждого набора данных представляет предыдущих измерений с использованием стандартных AgCl электродов. Значения для UCP1 и UCP3 были взяты из Urbankovaи др. 3 и Мачер и др. 8. при всех измерениях, мембрана была сделана из 45:45:10 моль % DOPC:DOPE:CL с 15 моль % AA и UCP1/UCP3. Концентрацию липидов и белков был 1,5 мг/мл и 4 мкг/мг липидов, соответственно. Буфер содержит 50 мм Na2т4, 10 мм MES, 10 мм трис и 0,6 мм EGTA при pH = 7.34 и T = 32 ° C. PH буфера для градиентные измерения было увеличено до 7,66, 8.00 или 8.33, добавляя трис и было изменено в раствор, содержащий пипеткой. Значения являются среднее ± стандартное отклонение трех независимых измерений. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Осуществление микро агар соль мост с электродом минимизирует его потенциал распространения и позволяет более точные измерения мембранного потенциала порожденных градиента рН. При наличии различных трансмембранного рН градиенты, потенциального сдвига обоих электродов является приемлемым на ΔpH = 0,35 при сравнении к значению теоретический потенциал уравновешения Нернста (ΦНернста = 23,8 mV для ΔpH = 0,4). Однако в более физиологических рН градиенты, как экземпляр в митохондриях между матрицей и межмембранное пространства, Стандартный AgCl электродов не позволяет точно измерить потенциал сдвига на ΔpH = 1 (рис. 3А). Электрод, мостовой с микро агар соли доставлены ценности, которые были гораздо более сопоставимы с теории.
Диффузия потенциал может возникнуть на электрод сравнения AgCl если буферный раствор изменяется во время эксперимента. Хлоридно свободный буферный раствор был использован в экспериментах с расцеплять белки были предложены для транспортировки хлорид-ионов, и pH была скорректирована с помощью трис или МЧС. Электродный потенциал, в отсутствие существенной концентрации хлорида, в первую очередь зависит от примесей хлорида в буферном растворе. Как его состав изменяется в ходе экспериментов, это просто приведет к постоянной смещения потенциал. Однако для измерения абсолютной разности потенциалов между двумя электродами, систему соли мост простой агар (Ag/AgCl 3 M KCl) может также использоваться для электрод сравнения.
Микро агар соль Мост остатки диффузии потенциал путем уравновешивания электродный потенциал. Для того чтобы стабилизировать раствор соли, агарозы 1% (w/v) был добавлен для предотвращения смешивания солевого раствора с буферным раствором. Соли ионов K+ и Cl– имеют аналогичные подвижности в жидкости и сбалансировать электродный потенциал. Чтобы правильно установить соль мост, солевой раствор Агар имеет достаточно нагревается заполнения кончик микрокапиллярной без каких-либо воздушных пузырьков и покрыть AgCl электродов. Перед дальнейшим использованием электрического контакта между электродом соль мост и электрод сравнения должна быть проверена. В зависимости от времени, которое используется соль Мост раствор соли должно быть достаточно загущенное для предотвращения любого смешивания солевого раствора с буфером. Это особенно важно, если расследование K+ или Cl– транспортеры. Соль мост был использован для очень короткое время и элюции агарозы незначительна в этот промежуток времени. Более высокую концентрацию агарозы до 5%, или агар (3% - 5%), позволяет использовать соль мост для более длительного периода времени6,12.
Этот метод позволяет определить транспорта кинетики мембраны транспортера (i) с низкой текучести и (ii) митохондриальных протеинов внутренней мембраны, которые вряд ли могут быть исследованы в структурах зажим Стандартный патч13. Его точность зависит главным образом от обратного измерение потенциала, точность которых уменьшается в проводимости низкой общей мембраны и небольших градиенты концентрации, которые вызывают мембранного потенциала ниже шум записи.
С помощью этой настройки, были измерены текучести UCP1 и UCP3, как производится на тех же условиях. Из-за более высоких рН градиента полученные показатели, как представляется, быть более точным и невозмущенной, артефакты, результате потенциального сдвига небольшие электродный. Он может использоваться для дальнейшего анализа и сравнения митохондриальной мембраны перевозчиков производится в аналогичных условиях.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана австрийский научный фонд (P31559-B20 в E.E.P.). Авторы благодарят Сара Bardakji за отличную техническую помощь в производстве и воссоздание мышь UCP1 и UCP3 в proteoliposomes.
Материалы
| Name | Company | Catalog Number | Comments |
| Microloader tips | Eppendorf | 5242956.003 | Microcapillary pipette tip |
| Ethanol 99% | AustrAlco Österr. Agrar-Alkohol Handelsges.m.b.H | AAAH-5020-07025-230317 | |
| Kaliumchlorid | Carl Roth GmbH + Co. Kg | 6781.3 | |
| DC supply | Voltcraft | V10/CPG 1940 -01 | |
| Agarose Standard | Carl Roth GmbH + Co. Kg | 3810.2 | |
| Patch Clamp Amplifier | Heka | ||
| Sample tube | Carl Roth GmbH + Co. Kg | 5863.1 | |
| Na2SO4 | Carl Roth GmbH + Co. Kg | 8560.3 | |
| MES | Carl Roth GmbH + Co. Kg | 4256.2 | |
| TRIS | Carl Roth GmbH + Co. Kg | AE15.2 | |
| EGTA | Carl Roth GmbH + Co. Kg | 3054.1 | |
| Hexane | Sigma-Aldrich | 296090-100ML | |
| Hexadecane | Sigma-Aldrich | 296317-100ML | |
| Heating wire | Voltcraft | USPS-2250 |
Ссылки
- Terstappen, G. C., Reggiani, A. In silico research in drug discovery. Trends in Pharmacological Sciences. 22 (1), 23-26 (2001).
- Raynauld, J. P., Laviolette, J. R. The silver-silver chloride electrode: A possible generator of offset voltages and currents. Journal of Neuroscience Methods. 19 (3), 249-255 (1987).
- Urbankova, E., Voltchenko, A., Pohl, P., Jezek, P., Pohl, E. E. Transport kinetics of uncoupling proteins. Analysis of UCP1 reconstituted in planar lipid bilayers. Journal of Biological Chemistry. 278 (35), 32497-32500 (2003).
- Beck, V., et al. Polyunsaturated fatty acids activate human uncoupling proteins 1 and 2 in planar lipid bilayers. The FASEB Journal. 21 (4), 1137-1144 (2007).
- Shao, X. M., Feldman, J. L. Micro-agar salt bridge in patch-clamp electrode holder stabilizes electrode potentials. Journal of Neuroscience Methods. 159 (1), 108-115 (2007).
- Kleene, S. J. A simple intrapipette salt bridge. Journal of Neuroscience Methods. 46 (1), 11-16 (1993).
- Beck, V., et al. A new automated technique for the reconstitution of hydrophobic proteins into planar bilayer membranes. Studies of human recombinant uncoupling protein 1. Biochimica et Biophysica Acta-Bioenergetics. 1757 (5-6), 474-479 (2006).
- Macher, G., et al. Inhibition of mitochondrial UCP1 and UCP3 by purine nucleotides and phosphate. Biochimica et Biophysica Acta. 1860 (3), 664-672 (2018).
- Rupprecht, A., et al. Role of the transmembrane potential in the membrane proton leak. Biophysical Journal. 98 (8), 1503-1511 (2010).
- Hilse, K. E., et al. The expression of UCP3 directly correlates to UCP1 abundance in brown adipose tissue. Biochimica et Biophysica Acta. 1857 (1), 72-78 (2016).
- Fuks, B., Homble, F. Permeability and electrical properties of planar lipid membranes from thylakoid lipids. Biophysical Journal. 66 (5), 1404-1414 (1994).
- Barry, P. H., Lewis, T. M., Moorhouse, A. J. An optimised 3 M KCl salt-bridge technique used to measure and validate theoretical liquid junction potential values in patch-clamping and electrophysiology. European Biophysics Journal. 42 (8), 631-646 (2013).
- Huang, D., Li, J. The feasibility and limitation of patch-clamp recordings from neonatal rat cardiac ventricular slices. In Vitro Cellular & Developmental Biology. 47 (4), 269-272 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены