Method Article
איתור של Extravascular טריאנוסומה טפילים על ידי שאיפה מחט פיין
In This Article
Summary
שאיפה מחט פיין היא טכניקה, לפיו התאים מתקבלים מפצע או איבר באמצעות מחט דקה. חומר מנושפי מרוח, מוכתם ונבדק תחת מיקרוסקופ לאבחון או משמש לביולוגיה מולקולרית, לצילנסה או לניתוח מבחנה. הוא זול, פשוט, מהיר וגורם לטראומה מינימלית.
Abstract
פיין מחט שאיפה (FNA) הוא הליך אבחון שגרתי חיוני הן מנהגים רפואיים וטרינריים. זה מורכב השאיפה הפרעורית של תאים ו/או מיקרואורגניזמים מגושים מוחשי, איברים או פליטות (הצטברות נוזלים בחלל הגוף) באמצעות מחט דקה דומה מחט רגילה המשמש לנקב הורידים. החומר שנאסף על ידי FNA הוא באופן כללי סלולרי מאוד, ואת האספירין מאוחזרים מרוח אז, האוויר מיובש, רטוב קבוע, ויטראז ונצפתה תחת מיקרוסקופ. בהקשר הקליני, FNA הוא כלי אבחון חשוב המשמש כמדריך לניהול הטיפולית המתאימה. מכיוון שהוא פשוט, מהיר, פולשני מינימלית ודורש השקעה מוגבלת במעבדה ובמשאבי אנוש, הוא משמש באופן נרחב על ידי מתרגלים וטרינרי, בעיקר בבית, אבל גם בבעלי חיים חקלאיים. במחקרים באמצעות דגמי בעלי חיים, FNA יש את היתרון כי ניתן לבצע שוב ושוב באותו בעלי חיים, המאפשר מחקרים האורך דרך אוסף של תאים מגידולים ואיברים/רקמות במהלך המחלה. בנוסף למיקרוסקופיה השוטפת, ניתן להשתמש בחומר מאוחזר גם לאימונוציטוכימיה, מיקרוסקופ אלקטרונים, אנליזה ביוכימית, הזרמת הcy, ביולוגיה מולקולרית או מבחנה. FNA נעשה שימוש כדי לזהות את פרוטוזוזה טפיל טריאנוסומה בלוטות בגונדות של עכברים נגועים, פתיחת האפשרות לאבחנה עתידית בבקר.
Introduction
פיין מחט שאיפה (FNA) משמש רבות באבחון של סרטן ומחלות שאינן נאופלסטית, הן בבעלי חיים אנושיים וביתיים. הטכניקה הייתה סטנדרטית במשך השנים והיא מתוארת בספרי לימוד רבים1,2.
זה מורכב בעיקר השאיפה הפרעורית של גושים מוחשי, איברים או פליטות עם מחט דקה מצויד מזרק ריק, באמצעות הלחץ השלילי למשוך תאים או נוזל מן המסה1,3. מחטים הם בדרך כלל 22 כדי 25 G (מד המתאים לקוטר הפנימי של המחט), והשימוש במחט גדולה יותר (קוטר גדול, למשל, 21 G) מועיל כדי להגדיל את cellularity, למרות שזה יכול לייצר זיהום דם מוגזם. אורך המחט יהיה תלוי בעומק המסה אבל 1 או 11/2 אינטש משמש בדרך כלל להמונים שטחיים. מזרקים הם בדרך כלל 5 כדי 10 מ ל, עם מזרקים גדולים יותר השגת ואקום גבוה יותר, אשר בתורו מגביר את התשואה לשאוב. מיסות עמוקות שאינן מוחשי יכולות להיות גם משועבות, עם מחטים ארוכות ותחת הדרכה לתמונה (ultrasonography). לאחר מכן יכול להיות מרוח, מיובשים, רטוב קבוע, מוכתם ונצפה תחת מיקרוסקופ כדי להשיג אבחנה3 (איור 1).
זוהי טכניקה פשוטה, זולה, ללא כאבים ופולשנית בעיקר בשימוש בהגדרה preאופרטיבית כדי להשיג אבחנה על מיסות מוחשי וגם עבור איברים, כמו בלוטות הלימפה, בלוטת התריס, ערמונית או אפילו מבנים חיצוניים הרבייה גברים 1. בנוסף להיותו כלי אבחון, ניתן להשתמש בטכניקה זו לצורך איסוף תאים למטרות אחרות, כלומר ציטוגנטיקה, מיקרוסקופ אלקטרוני (איור 1d), אפיון של מעבד ציטומטק4,5 ,6,7, הקמת תרביות תאים8. דוגמה נפוצה בתחום הקליני היא אחזור זרע עבור הפריה חוץ גופית9.
השאיפה יכולה לחזור על עצמה מספר פעמים באותה מסה כדי לקבל מספר מסמירים. במקרה של נגע הטרוגנית, למשל, אזור מוצק ומרחב סיסטיק, חשוב שתאים משוטחים מכל אזור. החומר שנאסף על ידי FNA הוא באופן כללי סלולרי מאוד, אשר ברוב המקרים מאפשר אבחון של מחלות ללא צורך ביופסיה של רקמות. , כתמים מיוחדים. מאימונולובורנציה אימונוציטוכימיה (איור 1D), וטכניקות מולקולריות ניתן לבצע גם בסמארים שהתקבלו באמצעות FNA, למשל, לזיהוי של סוכנים זיהומיות כאשר לא ניתן לזהותם על ידי מורפולוגיה לבד10. סקירה קצרה של היישומים הכלליים ושל הציוד והאספקה הדרושים עבור FNA מסוכמים בטבלאות 1 ו- 2, בהתאמה.
הדו ח הראשון על השימוש בניקוב המחט למטרות אבחון מתואר בכתבי מוקדם של הרפואה הערבית, אבל זה בתחילת המאה ה -20 כי המחט המודרנית טכניקות השאיפה יושמו11. בעיקר, אולי הדו ח הראשון שמרמז על השימוש FNA לאבחון של מחלות זיהומיות היה מחקר ב 1904, שם גריג ו גריי דיווחו על שאיפות המחט של בלוטות הלימפה מפני חולים עם מחלת שינה חשף מורצפת טריאנוזומים12 . המחברים דיווחו על נוכחות של טריאנוזומים במקרים מוקדמים ומתקדמים, ובצפיפות גבוהה יותר מזו שנראתה בסמירים בדם, בהם אירועים נדירים בדרך כלל12.
האבחנה הנוכחית של טרינוסומהרציה בבקר מסתמכת על התבוננות ישירה של טפילים בדם, הלימפה או בטכניקות אבחון חיסוני13,14,15. בעבר הצגנו כי בזיהומים הניסיוניים טריאנוסומה בעכבר, טריאנוסומה ברוסייבי (T. brucei) יש הטרוריזם מדהים כדי לעשות שומן ברקמה16 וגם חלק ממבני הרבייה של גברים חיצוניים, כלומר האפידיזה17. טפילים להצטבר משתית של רקמות אלה במספרים גדולים16.
הפרוטוקול המתואר להלן מתאר הליך טכני מפורט צעד אחר צעד עבור FNA בעכברים חיים, שמטרתו השאיפה של טריאנוזומים הנמצאים במבני הרבייה החיצוניים של הזכרים (בעיות, אפידיסטיות ואפידימל שומן), ולאחריה ציטולוגיה וכתמים קונבנציונליים עבור חלבונים טפיל ספציפיים (vsg)16,17. השאיפה בוצעה 6 ימים לאחר שהליכי ההדבקה והבטיחות החלים הם אלה שהוקמו בדרך כלל לטיפול שגרתי בבעלי חיים ניסיוניים. אמצעים נוספים נדרשים עבור בעלי חיים שיש להם ליקויים חיסוניים (לבישת שמלת קיטור מעוקר, מסכה, שיער כובע, כפפות סטרילי, ולהבטיח טכניקה אספטי בכל עת) כדי להמתיק חשיפה מקרית לפתוגנים אופורטוניסטים.
Protocol
כל ניסויי החיות בפרוטוקול זה בוצעו על פי תקנות האיחוד האירופי ואושרו על-ידי ועדת האתיקה של בעלי החיים במכון מולקולרי (iMM) (AEC_2011_006_LF_TBrucei_IMM). המתקן החי של iMM תואם את החוק הפורטוגלי לשימוש בעלי חיים מעבדה (צו-חוק 113/2013) ובעקבות הדירקטיבה האירופית 2010/63/האיחוד האירופי felasa (הפדרציה של האיחוד האירופי אגודות מחקר בעלי חיים) הנחיות ו המלצות בנוגע לרווחת בעלי חיים מעבדתיים.
1. השאיפה של טפילים מן המין החיצוני איברי הרבייה של העכבר
הערה: שאיפה מחט פיין (FNA) בוצע פראי זכר C57BL/6J עכברים, 6 עד 10 שבועות, נגוע T. brucei דרך הזרקת הצפק של 200 μl של מלוחים עם 2,000 טפילים כמתואר בעבר16.
-
עבור FNA של איברי הרבייה הגברי החיצוני, מניחים את העכבר במכסה זרם למינארי, מורדם בעלי החיים עם הזרקה התוך הצפק של 200 μL של תערובת של 75 mg/ק"ג הקטמין + 1 מ"ג/ק"ג מדטומדין בתמיסת מלח.
- אשר את ההרדמה. בשיטת הצביטה בבוהן כאשר הרפלקס של הנסיגה של הרגל נעדר, מיקום העכבר בתוך שכיבה מראש (איור 2A).
- מפנים בזהירות את המכסים, הערכת גודל ומרחק מהעור. רסן את האיבר בין המפתח לאצבע האמצעית או בין האצבע המורה לאגודל. מתחו את העור הצמוד בחוזקה על פני המסה כדי לשתק את המטרה. נקו את המשטח עם מגבונים (איור 2A).
- להחזיק את המחט התאספו 22 גרם ו 5 מזרק mL ולהכניס את העצה מחט לתוך היעד, תמיד עם הבוכנה במצב השאר (איור 2B-C).
- החלת יניקה על ידי באמצעות מעבר המזרק על 4 מ"ל כדי 5 מ"ל סימן 2-3 פעמים. נתב מחדש את המחט בתוך האיבר בקו ישר או לאורך מספר משיקים שונים כדי להגדיל את ההסתברות של מדגם מייצג ולכוון מבנים קטנים כמו האפידיאמיס. ודא כי הליך זה עדין, כדי למזער את הנזק לרקמות (איור 2C-D).
- שחררו את היניקה ולאחר מכן משיכת המחט. אין לצייר משוב את המחט עם הבוכנה והוא מוביל לשאיבה של המזרק לתוך החבית של מזרק ולעכב את ההתאוששות שלו (איור 2E). לאחר הנסיגה של המחט, לשלוט על כל דימום על ידי הפעלת לחץ עם ספוג גזה מעוקר באתר הניקוב.
- לנתק את המזרק מן המחט, למלא אותו באוויר, לחבר מחדש את המחט ולהוציא בעדינות את התוכן של המחט על שקופית. מניחים את קצה המחט קרוב מאוד או אפילו על השקופית כדי להימנע משפריץ (איור 2F-I).
- לבצע לפחות שאיפה אחת נוספת לכל איבר/בעל חיים כדי להבטיח דגימת שכפול.
- לחזור הרדמה עם הזרקה תת עורית של 200 μL של 1 מ"ג/ק"ג Atipamezole ב מלוחים ולהחזיר בעלי חיים כלוב הבית שלהם להתאוששות ולהתבונן עד התאוששות מלאה.
2. הכנת הכתם מחומר משומן
הערה: השתמש בכפפות במהלך ההליך ולהבטיח סילוק בטוח של מחטים ומזרקים.
-
שני שלבים למשוך שיטה
- הרם את השקופית הכוללת את טיפת האספירין בידי היד הלא-דומיננטית, וצבוט את הקצה הקפוא בין האגודל לאצבע המורה (איור 3 א).
- להרים שקופית נקייה שנייה, את השקופית פסק, עם היד הדומיננטית ולהביא אותו לאורך השקופית הראשונה עם טיפת האספירין. מניחים את הקצה הנקי חלקה של השקופית על שקופית דגימה רק על החלק העליון של הירידה בזווית של כ 30 ° (איור 3B).
- החליקי את השקופית קדימה באמצעות תנועה אחת קלה, רציפה ויציבה כדי לקבל סרט דק (איור 3C).
- הנח את השקופית ואפשר את ייבוש האוויר המלא והמהיר של החומר (איור 3D). . אל תתקן את החום סמן את הקצה המזוגג של השקופית באמצעות עיפרון.
הערה: ניתן להשהות את הפרוטוקול בשלב זה, והסמארים יכולים להיות מאוחסנים ללא הגבלת זמן עד שיהיו מוכנים להיות מוכתמים.
3. צביעת הסמארים
הערה: השתמש בכפפות לאורך ההליך וודא שהשלבים 3.1.4 ו 3.2.9 מתבצעים בתוך מכסה המנוע.
-
פרוטוקול צביעת באמצעות giemsa
- תקן מיובשים האוויר על ידי האישר את השקופיות לתוך צנצנת Coplin המכיל 100% מתנול עבור 5 דקות (איור 3E).
- העבר את השקופית לתוך צנצנת Coplin המכילה 20% Giemsa פתרון (מדולל כדי 1/5 במים מזוקקים) עבור 30 דקות, או 10% Giemsa עבור 10 דקות (איור 3F).
- לשטוף במים ברז ויבש ביסודיות באמצעות נייר טישו כדי לטפוח.
- החזק את השקופית אופקית והחל טיפה אחת של המדיום הגובר שאינו מימית על הכתם. הצב את קצה כיסוי הזכוכית על השקופית, הנמך אותו והקש בעדינות כדי להסיר בועות אוויר.
-
אימונוציטוכימיה בFNA סמארים
- תקן האוויר מיובש מסמירים ב 100% מתנול בטמפרטורת החדר עבור 10 דקות.
- שטוף את השקופית למשך 5 דקות בצנצנת Coplin עם מאגר פוספט של 1 x (PBS), חזרה על שלב זה 3 פעמים באמצעות חדש 1x PBS בכל פעם.
- הסר את השקופית מצנצנת של Coplin, מחק מאגר עודף מבלי לגעת בכתם ולצייר עיגול סביב הכתם עם עט דוחה מים (טבלה של חומרים).
- להחזיק את השקופית אופקית ולהחיל 150 μL של פתרון הנוגדן העיקרי מדולל על כל משטח ו דגירה עבור 1 h בטמפרטורת החדר.
הערה: נוגדן ראשוני משמש כאן הוא סרום ארנב לא מטוהרים נגדT. brucei VSG13 אנטיגן (חוצה תגובתי עם הרבה T. brucei vsgs, המיוצר ב-house), מדולל ב-1x PBS ב 1:50,000. לבצע פקדים שליליים על ידי החלפת הנוגדן העיקרי המתאים עם סרום טרום החיסונית (טבלת חומרים) כדי לאפשר הערכה של הכריכה הלא ספציפית של הנוגדן המשני. - שטוף את השקופית למשך 5 דקות בצנצנת Coplin עם 1x PBS, חוזר על שלב זה 3 פעמים באמצעות חדש 1x PBS בכל פעם.
- החזק את השקופית אופקית והחל 150 μL של מערכת הדמיית peroxidase/מסחרית הזמינה באופן מסחרי לכל מחיצה. דגירה של 30 דקות בטמפרטורת החדר (טבלת חומרים).
- כביסה עבור 3x עבור 5 דקות ב-1x PBS.
- הכתם על ידי הפיכת השקופיות לתוך צנצנת Coplin המכילה את האריס המטאוקסילין. לשטוף במים ברז ויבש ביסודיות באמצעות נייר כדי לטפוח.
- החזק את השקופית אופקית והחל טיפה אחת של המדיום הגובר שאינו מימית על הכתם. הצב את קצה כיסוי הזכוכית על השקופית, הנמך אותו והקש בעדינות כדי להסיר בועות אוויר.
תוצאות
FNA בוצעה באברי הרבייה החיצוני זכר של עכברים נגועים T. brucei באמצעות מחט 22 G מצמידים מזרק 5 מ ל, ושקופיות זכוכית עבור הכנת הכתם (איור 1a-C). השיטה היא פשוטה אך התוצאות האופטימליות מסתמכות על שלבים קריטיים: השתק מושלם של העכבר שהושג דרך הרדמה כללית וייצוב האברים במהלך כל ההליך (איור 2A-B). היניקה הוחלה 2-3 פעמים והמחט מנותבת מחדש 1-2 פעמים כדי לאפשר דגימה ייצוגית של האיברים הקטנים והרקמות: אפידיאמיס ושומן אפידידל. לחץ שלילי שוחרר לפני ההחטפת המחט. את החומר הכלול לומן הרכזת של המחט (כ 20 μL), שימש כדי לייצר 2 סמארים (איור 3A-C). במקרים בהם המחט היתה מסוגר ללא שחרורו של היניקה, החומר נשאב לתוך המזרק ולא ההשבה. התהליך חזר בהצלחה פעמיים, אחד עבור כל איבר לזווג. לאחר ייבוש, הסמירים היו רטובים קבוע ו אימונוטוקוכימיה עבור טריאנומין משטח חלבונים בוצע.
הכתם באיכות טובה (איור 4a-C) התאפיין מונאולייר של תאים עם צפיפות תאית טובה, שבה תאים מארחים להראות תכונות מורפולוגיות שנשמרו, המאפשר זיהוי של רקמת המקור שלהם ויחסי פרופורציה אחד לשני טפילים היו מוכתמים ביעילות, הניתנים לזיהוי והמנייה (איור 4B). מקרה אחד של FNA של הצפק מיזוג בתוך עכבר נגוע, מוכתם Giemsa עבור התבוננות ישירה ואבחון, מוצג גם (איור 3D-F ו- איור 4c).
תוצאת FNA נמוכה או שלילית עלולה לנבוע מסיבות שונות: (1) חומר FNA קטן מדי מתבטא על השקופית והוא תחת הנציגה של המדגם; (2) יותר מדי חומר FNA מתבטא על שקופית אחת, מה שהופך מסמירים עבים מדי והערכה ציטולוגית הפוגע; (3) יותר מדי כוח מוחל בעת ביצוע הכתם, ואת התאים משתבש, וכתוצאה מכך הרבה גרעינים ערומים ופסי DNA (לרסק החפץ); או (4) לא מספיק כוח מוחל בעת ביצוע הכתם והתאים אינם מצטברים, והתוצאה היא שכבה שכבתית הפוגעת הערכה של תכונות מורפולוגיות של התאים (איור 5).
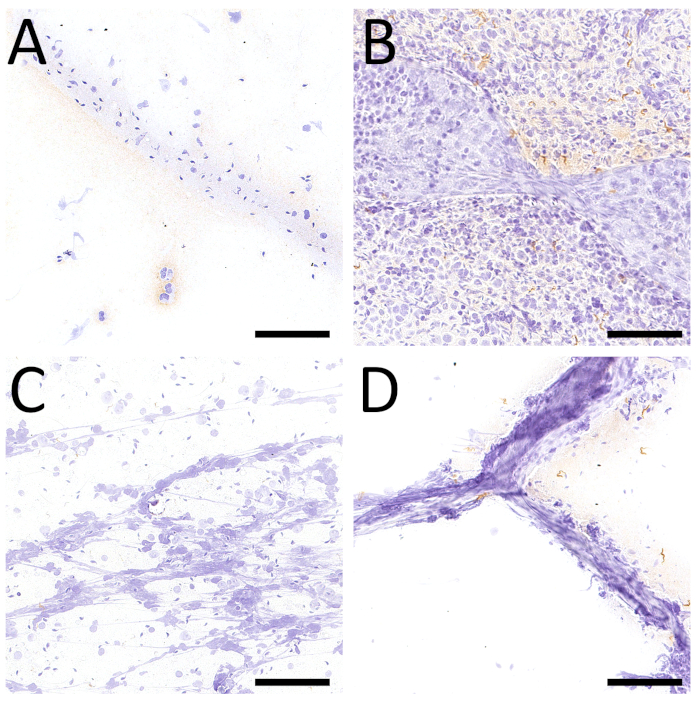
כאשר אנו משווים FNA cytopathology עם histopathology, כלומר, ניתוח של תאים לעומת רקמות, אגרוף יש את היתרון כי מורפולוגיה הסלולר הוא שמור טוב יותר פרופורציות יחסיות ספירת תאים יכול להיות מוערך טוב יותר (איור 6). יתר על כן, האימונוציטוכימיה היא פשוטה יותר, מהירה וקל יותר לייעל מאשר אימונוהיסטוכימיה, אשר מבוצעת בדרך כלל ברקמה מובנית של פורמאלין ופרפין.
| יעד | יישומים | יתרונות | גבלות |
| מסה ממשית | מיקרוסקופ שגרתי, אבחון | פשוט, מהיר | ללא ארכיטקטורת רקמות |
| איבר | אימונוהיסטוכימיה | עלות נמוכה | השאיפה העיוורת (המחט עלולה להחמיץ את היעד בכיוון ההוא; השאיפה עשויה לכוון נקרוטיק, פיברוזיס או אזורים מדמם) |
| פליטות | ציטומטלי זרימה | דגימה ממספר אתרים | |
| ציטוגנטיקה | מורפולוגיה סלולרית משומרת היטב | ||
| מיקרוסקופ אלקטרוני | חינם של סיבוכים | ||
| PCR, טכניקות מולקולריות אחרות | דיוק אבחון גבוה | ||
| אנליזה ביוכימית | הרדמה | ||
| , בתוך מבחנה, תרבית תאים | פרוצדורה שאינה מסוף |
טבלה 1: יעד, יישומים כלליים, יתרונות והגבלה של שאיפה מחט קנס.
| ערכת FNA | ארכיטיפ של מחט ומזרק של שאיפה |
| שאיפה | מחטים חלקים: |
| 1. מזרקים חד פעמיים מפלסטיק (5 או 10 מ"ל) (איור 1B) | משופע. קצה של פיר המחט משופע כדי ליצור נקודה, השיפוע להיות שיקוע. רק מחטים משופעים מתאימים שאיפות מעורית. |
| 3. מחטים של 22 כדי 25-מד (קוטר); 0.75, 1.0, 1.5 סנטימטרים, עם קצה משופע רגיל קצה המחט (איור 1A) | פיר. החלק הצינורי החלול של המחט אשר אורכו עשוי להיות מותאם בהתאם לעומק המסה. מד המחט מקביל לקוטר העמום, שהוא קוטרו של החלק הפנימי של הפיר (מחטים קטנות יותר יש מד גבוה יותר). השימוש של מחטים מנשא גדול (פחות מ -22 G) מועיל כדי להגדיל את cellularity, למרות שזה יכול לייצר זיהום דם מופרז מוגזמת. |
| 1. הרדמה (במידת הצורך). הכאב הקשור FNA הוא דומה לזה של ניקוב ורידים, עם זאת, שאיפה טובה מחייב השתק טוב של הנושא, חשוב במיוחד בבעלי חיים קטנים ו/או עבור נגעים קטנים, תנודות ואיברים. חולדות ועכברים בכפוף FNA צריך להיות מרוסן באופן פסיבי כראוי, או, בעת הצורך, הרגעה או להיות תחת הרדמה כללית קלה. | רכזת. חלק פלסטיק של המחט המצורפת המזרק; צריך להיות שקוף כדי לאפשר ויזואליזציה של חומר מנושף. את החומר מקבל אספירין במהלך FNA יש לאסוף את פיר המחט ואת השאיפה עצר כאשר החומר נראה כניסה לרכזת. |
| FNA ביצוע ופרשנות: | מזרק חלקים: |
| 1. מיקרוסקופ זכוכית קצה מזוגג (איור 1C) | חבית/גליל. . החלק החלול של המזרק אלא אם כן מתמודדים עם נגעים פיברוזיס או פליטות, חומר כי הוא מאונן לחבית בדרך כלל לא ניתן לשחזר. הנפח האידיאלי של ומנושף עבור FNA ציטולוגיה הוא כ 5 μL, המתאים לנפח הממוצע של ומנושף כי תופס את הפיר ואת הרכזת של המחט. |
| 2. מסוג רומקובסקי כתמי (למשל, Diff-Quik, Giemsa) | טיפ. סוף החבית שאליה מצורפת רכזת המחט. |
| 3. מיקרוסקופ (בהיר-שדה) | בוכנה. החלק הנייד של המזרק שיש לו דיסק שטוח או שפתיים בקצה אחד וחותם גומי בקצה השני. מתאים לתוך החבית ומספק את הלחץ כדי למשוך את התאים, נוזל לתוך המחט. הבוכנה אטומה לחלוטין שיוצרת לחץ שלילי טוב היא חובה לקבל תשואה טובה ומתן. |
טבלה 2: ציוד ואספקה הדרושים שאיפה מחט עדינה.
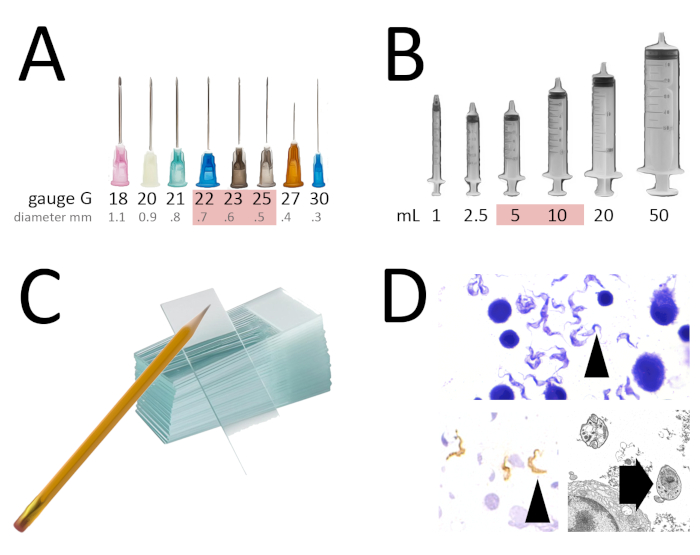
איור 1 : כלים ותוצאות עבור השאיפה מחט פיין. (A) הקוטר האידיאלי של המחט עבור FNA הוא מ 22 אל 25 G. (ב) הדיסק האידיאלי מזרק כדי לקבל תשואה טובה והוא של 5 כדי 10 mL. (ג) נקי, יבש, חופשי משומן זכוכית עם שטח סימון מזוגג לכתיבה עם עיפרון מצופה מראש (אם עבור אימונוהיסטוכימיה). (ד) דוגמה לטריאנוזומים שנצפתה עם מכתים giemsa (ראש חץ שחור), מוכתם בחלבונים של פני השטח של vsg (ראש חץ לבן) ותחת שידור אלקטרון מיקרוסקופ (לחסום את החץ). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2 : תרשימים המראים שאיפה מחט בסדר (FNA) של איברי הרבייה של גברים חיצוניים (ביקורות, אפידיסטיות, ו אפידימל שומן) בעכברים. (א) ברגע שבעל החיים מאובטח, מכשיר השאיפה שנאסף בעבר נאסף. (B-C) הכניסו את עצת המחט לאיבר היעד. (ד) להחיל את היניקה על ידי באמצעות באמצעות המזרק במזרק על 1 מ"ל עד 2 מ"ל סימן, שוב ושוב 3-4 פעמים. עצה מחט ניתן גם להעביר הלוך ושוב בתוך היעד תוך החלת יניקה, כדי לאסוף חומר מספיק. (ה) לשחרר את היניקה ורק לאחר מכן למשוך את המחט. (ו) להסיר את המחט ממזרק ו (G) למשוך את הבוכנה בחזרה. (ח) חבר מחברו את המחט. (I) לגרש את החומר על שקופית זכוכית על ידי דחיפת הבוכנה במהירות דרך המזרק. על מנת להימנע משפריץ, ודא שקצה המחט מתקרב מאוד או אפילו בשקופית. ירידה של מנושף ממוקם כ 1 ס מ מהקצה של אזור סימון מזוגג. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
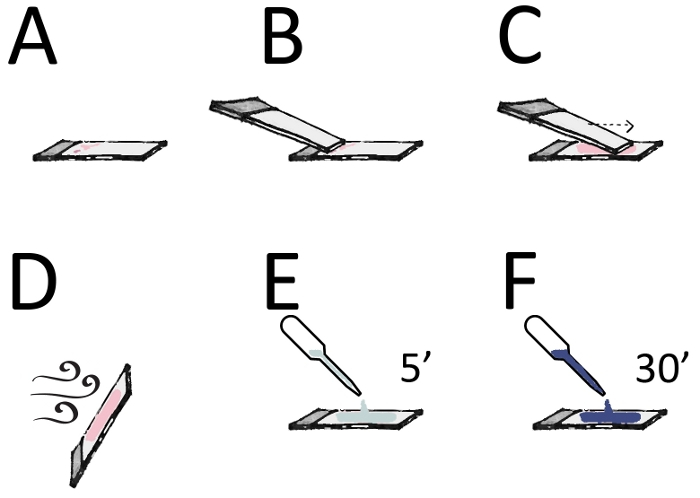
איור 3 : הכנת הכתם וכתמים. (א) החזק קצה אחד של השקופית (אזור מזוגג) בין האגודל לאצבע המורה. (ב) למקם את הקצה הנקי חלקה של שקופית שנייה (spreader) על שקופית הדגימה רק לפני טיפת החומר. (ג) החלק את הפריסה קדימה פעם אחת עם מהירות מתונה כדי לקבל סרט דק. (ד) אפשר לשקופית להתייבש באוויר ולסמן את הקצה המזוגג של השקופית בעיפרון. (ה) לאחר ייבוש להשלים לתקן עם מתנול עבור 5 דקות (F) כתם עם 20% giemsa פתרון עבור 30 דקות (או 10% giemsa עבור 10 דקות). שטפו בקלילות במים, יבשים לחלוטין, טובלים בקסילן, ומצוידים בסוכן הרכבה חסר מיים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

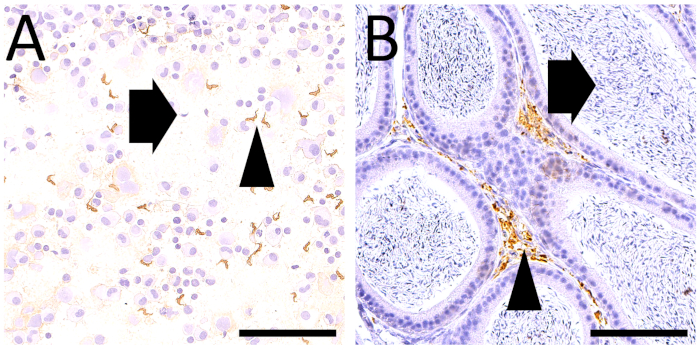
איור 4 : מיקרוצילומים של סמארים שהתקבלו מ FNA של מבנים חיצוניים הרבייה הגברי בעכברים נגועים . טי. (א) הופעה ברוטו של מכתם ישיר באיכות טובה: החומר התבטא על השקופית במרחק של כ 1 ס מ מן הקצה השחור (נקודה שחורה), מרוח ועצר 0.5 ס מ לפני קצה השקופית (קווים מקבילים). (ב) אימונוציטוכימיה עבור חלבונים מפני השטח של הטפיל (vsg) בוצע עבור הסמארים שהתקבלו מ FNA של איברי הרבייה של גברים חיצוניים ביום 6 של זיהום. טפילים רבים (ראש חץ) זוהו admixed עם תאים נבט העכבר (חץ). . מוכתם בעזרת האריס המטאוקסילין הגדלה מקורית: 40x (סרגל קנה מידה = 50 μm). (ג) giemsa-צביעת של הכתם שהושג לאחר FNA של אפוזיה הצפק ביום 21 של הזיהום, הראה טפילים רבים (ראש חץ) admixed עם מארח (עכבר) תאים, במקרה זה בתאי דלקת, מקרופאגים (חץ) ו לימפוציטים. הגדלה מקורית: 40x (סרגל קנה מידה = 50 μm). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 5 : מFNA סמיטרים באיכות ירודה. (א) מכתם סלולרי גרוע, תחת הנציגה של המסה או העוגב. (ב) כתם עבה מאוד. (ג) חפץ כתוש, עם תאים שיבשו, גרעינים ערומים ופסי דנ א. (ד) אגרגטים ושכבות של תאים שעברו בשכבות. . מוכתם בעזרת האריס המטאוקסילין הגדלה מקורית: 20x (סרגל קנה מידה = 100 μm). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 6 : השוואה בין ציטולוגיה והיסטולוגיה בעכברים נגועים ב . טי. (A) מיקרוצילומים המתאימים לכתם FNA ו (ב) 4 יקרומטר מקטע פרפין, באותה הגדלה (20x ההגדלה המקורית, סרגל קנה מידה = 100 יקרומטר), שניהם חיסוני עבור חלבונים פני השטח של הטפיל (vsg). הכתם הראה מספר רב של טפילים (ראש חץ) עם מורפולוגיה סלולרית משומרת היטב, מעורבב עם מספר בינוני של תאי הנבט ומעט הזרע (חץ). הסעיף היסטולוגית הראה בארכיטקטורת רקמה משומרת היטב, המורכבת מצינורות אפידיתים עם מנורות-על (חץ), ונוכחותם של מספר רב של טפילים המרחיבות את משתית האפידימל (ראש חץ). . מוכתם בעזרת האריס המטאוקסילין הגדלה מקורית: 20x (סרגל קנה מידה = 100 μm). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
פיין מחט שאיפה (FNA) היא שיטה נפוצה לאבחן מחלות בבעלי חיים אנושיים וביתיים. הטכניקה היתה סטנדרטית במשך שנים רבות1,2, אשר עושה שימוש מחט קטנה נשא לאספירין תאים או נוזל ממסה ממשית או איבר1,3. המנושף מרוח בדרך כלל על שקופית זכוכית ומוכתם להשגחה מיקרוסקופית כדי להשיג אבחנה, אבל הטכניקה יכולה לשמש גם לאחזור תאים למטרות אחרות4,5,6, מיכל סבן , בן שמונה , . בסדר, תשע
ההליך הוא מהיר (< 5 דקות לכל העכבר, עבור חוקר מנוסה) והסיכון של סיבוכים הוא מינימלי, בדומה לסיכון שנגרמו כאשר עובר ניקוב ורידים פשוטה. מסיבה זו, עבור FNA של ההמונים ממשית, הרדמה נדרשת רק מיקומים אנטומיים רגישים או כאשר השתק טוב של בעל החיים וייצוב של האיבר או מסה להיות מורדם הוא חיוני מאוד עבור תוצאות אופטימליות. זה תדיר עבור חיות מעבדה קטנות, כמו איפוק בטוח ואפקטיבי של מכרסם קטן עם יד אחת תוך הבטחת הגישה הטובה ביותר לאזור לשאיפה עם היד האחרת, קשה להשיג ללא הרדמה. הרדמה לטווח קצר היא ברוב המקרים מספיק, בכל זאת הכרחי, עבור FNA טוב בעכבר. השתק טוב מגדיל את הסיכוי להשיג את המאכלת, כי הוא נציג של הרכיבים הסלולריים של הנגע וגם ממזער את הסיכויים להטות את קצה המחט בעוד לחץ שלילי מוחל.
למרות ההליך עצמו הוא מאוד פשוט, יישום מתואם ושחרור של ואקום הם הצעדים הקריטיים ביותר. לאחר החדרת המחט, את הבוכנה של המזרק הוא שואב כדי להשיג ואקום מבוקרת (יניקה), ואת המחט ניתן להסיר רק מן המסה לאחר שחרור הלחץ השלילי על ידי הסרת הבוכנה (איור 2); אחרת את האספירין הוא נשאב לתוך החבית של המזרק, ולאחר מכן קשה מאוד להתאושש. צעד חשוב נוסף הוא הכנת מסמיארים איכותיים. ישנן שיטות שונות לבצע הכתם, אך ללא קשר לשיטה, יש להכין את הסמירים מיד לאחר שהחומר הוצב על הזכוכית. החומר הביולוגי צריך להתפשט בעדינות כדי למנוע חפצים מלמחוץ את התאים. שימוש coverslip כמו פסק יכול לעזור למנוע את החפצים האלה. עם זאת, היישום של כוח רב מדי תוך הפיכת הכתם ישבור את הכיסויים. הכתם באיכות טובה בדרך כלל יש את רוב אוכלוסיית התא מופץ כמונאולייר כך שהם יכולים בקלות לשדר אור. חומר סלולארי לא צריך להיות. לכוד בתוך קריש הדם
המטרה של FNA היא לאסוף תאים ממסה, רקמה או איבר. השימוש במחטים גדולות יותר הוא מועיל כדי להגדיל את cellularity, אבל יכול להיות משויך לזיהום דם מופרז, בעוד דגימה עם מחטים קטנות תשואות איכות גבוהה יותר, אם כי פחות חומר שופע. במקרה שלנו, השאיפה הפרעורית של מבנים חיצוניים הרבייה הגברי של עכברים בניסויים נגועים T. brucei, בוצע עם מחטים 22 מצמידים בתוספת 5 מ"ל מזרק. העכברים היו מורדם, הקלפים התייצבו ביד אחת, נקב והשאיפה הונחה והופיעה עם היד השנייה. החזרנו טריאנוזומים רבים בתאי הנבט, הזרע, תאים אפיתל, תאים סטרומה, אשר היו מרוח ומוכתם חיסוני של הטפילים של פני השטח (VSG) (איור 4).
יש תמיד את שגיאת הדגימה הפוטנציאלית בתוך משמת תוצאות שליליות מניב, כי למרות אזורים מרובים של נגע נתון ניתן לטעום מספר פעמים, זהו שאיפה עיוור שבו אנחנו לא לדמיין את קצה המחט ואת איבר היעד או המסה. זה רלוונטי ביותר בסביבה קלינית, שבה FNA שלילית של נגע חשוד לא ברור חקירה נוספת, אבל זה לא רלוונטי כל כך במודלים של בעלי חיים של מחלות. לפיכך, מגבלות כלליות כוללות בעיקר תוצאות שליליות כוזבות, והתוצאות החיוביות פחות שקריות (למשל, מזיהום הדם), אך המגבלה החשובה ביותר בקביעת ניסויים בבעלי חיים היא חוסר מידע על רקמות אדריכלות17, כמו שיש לנו עם histopathology, למשל דפוס הפצה של טפילים, של תאים חיסוניים, ואת האינטראקציה תא תאים תכונות. למרות זאת, היתרונות הם ש-FNA היא הליך שאינו מסוף המאפשר את הדגימה החוזרת באותה חיה באותה התקופה ומאפשרת תמיד למבנה הסלולר השמור טוב יותר (איור 5). חלופות FNA לקצירת תאים מארחים, תאים חיסוניים או מיקרואורגניזמים מעכבר תמיד להסתמך על המתת החסד של העכבר כדי לאסוף את המסה או איברים של עניין.
לידיעתך, יש רק דיווחים מעטים על השימוש FNA בחיות מעבדה קטנות, אחד מ 1949 מתאים לשאיפה של מח עצם עם המחט G 22 לימוד המטפיאה18, וכל אחרים בשילוב עם cy, לנסות ל מכמת או תאים דלקתיים הקשורים לגידול או תאים אנדותל7,19,20. העבודה שלנו מראה כי ניתן להרחיב את הטכניקה הזאת לאבחון ולמחקר של דגמי מחלות זיהומיות והוא יכול לשלב ציטולוגיה עם טכניקות כגון אימונוציטוטוכימיה או אלקטרון מיקרוסקופ. שניים מהיתרונות העיקריים של השיטה בבעלי חיים ניסיוניים הם: (1) הליך זה אינו מסוף, כלומר, ניתן לבצע בעכברים חיים; ו-(2) בשל חומרת מתון היא מאפשרת שאיפות סדרתיות באותה חיה. ולכן פחות עכברים נדרשים עבור כל מחקר, ואת הקורלציה בין התקדמות של מחלה קלינית האבולוציה של התכונות הסלולר והמולקולרי של מחלה ו/או מיקרואורגניזם ניתן לבצע בקלות, ובכך מאפשר לימודי האורך.
אולי הדו ח הראשון על השימוש FNA לאבחון מחלות זיהומיות הוא מחקר של גריג וגריי ב 1904 כי דוחות שאיפות המחט של בלוטות הלימפה מחולים עם מחלת שינה, אשר חשף טריאנוזומים מורצפת12. אם הממצאים שלנו בעכברי מעבדה למצוא תרגום בקר, כלומר, כי אם טריאנוסומה ניתן לדגום בקלות על ידי FNA מן מבנים חיצוניים הרבייה הגברי, אפשר לצפות כי טכניקה זו תהיה שימושית לוטרינרים לאבחון בעלי חיים מחלת השינה בחווה, במשק החי.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
פרויקט זה מומן על ידי הפונדחידה הסינית הסינית (FCT)/Ministério da Ciência, Tecnoלוגיה e Ensino מעולה (MCTES) דרך Fundos do Orçamento דה Estado (ref.: ID/בים/50005/2019). LMF הוא חוקר של הפונדסאו של הדיווה הטובה ביותר (IF/01050/2014) והמעבדה ממומנת על ידי ERC (FatTryp, ref. 771714). פרסום של עבודה זו ממומנת גם UID/בים בם/50005/2019 הפרויקט ממומן על ידי הדיווה העליונה Ciência e Tecnoלוגיה (FCT)/Ministério da Ciência, Tecnoוגיה e Ensino מעולה (MCTES) דרך Fundos do Orçamento דה Estado. אנו מודים Andreia פינטו מהמעבדה היסטולוגיה השוואתי פתולוגיה של iMM לסיוע מומחה מיקרוסקופ אלקטרון, וסנדרה טרידייד, Tiago המורדים הנריק מצ (iMM) עבור שיתוף רקמות מפני עכברים נגועים.
Materials
| Name | Company | Catalog Number | Comments |
| Atipamezole (ANTISEDAN 10 mL) | Bio 2 | 7418046 | Anesthesia reversal |
| Cover slips (24 x 60 No.1) | VWR | 631-0664 | Smear making |
| DAB | Dako | K3468 | Immunocytochemistry |
| Entellan (500 mL) | VWR | 1.07961.0500 | Mounting media |
| Envision Flex antibody diluent | Dako | 8006 | Immunocytochemistry |
| EnVision Flex conjugated w/ HRP (anti-rabbit) | Dako | K4010 | Immunocytochemistry |
| Envision Flex Wash Buffer | Dako | K8007 | Immunocytochemistry |
| Giemsa stain | Atom Scientific Ltd | RRSPSS-A | Smear staining |
| Glass slides (Superfrost Plus) | VWR | 631-9483 | Smear making |
| Harris Haematoxylin | Bio-optica | 05-06004E | Immunocytochemistry |
| Hydrogen Peroxidase solution | Sigma | H1009-500ML | Immunocytochemistry |
| Hypodermic needles Microlance 3 (23G) | Henry Schein | 902-8001 | Aspiration technique |
| Ketamin (IMALGENE 1000 - 10 mL) | Bio 2 | 7410928 | Anesthesia |
| Medetomidine (DOMITOR 10 mL) | Bio 2 | 7418335 | Anesthesia |
| Methanol | Merck | 1.06009.2511 | Smear fixative |
| Pap pen | Merck | Z377821-1EA | Immunocytochemistry |
| Protein Block Serum free | Dako | X0909 | Immunocytochemistry |
| Syringes (5 mL, 10 mL) | Henry Schein | 900-3311, 900-3304 | Aspiration technique |
References
- Leopold, G., Koss, M. R. M. . Koss’ Diagnostic cytology and it’s histologic bases. , (2006).
- Raskin, R. E., Meyer, D. J. . Canine and Feline Cytology: a Color Atlas and Interpretation Guide. Canine and Feline Cytology. , (2016).
- Hopper, K. D., Abendroth, C. S., Sturtz, K. W., Matthews, Y. L., Shirk, S. J. Fine-needle aspiration biopsy for cytopathologic analysis: Utility of syringe handles, automated guns, and the nonsuction method. Radiology. 185 (3), 819-824 (1992).
- Saliba, A. E., et al. Microfluidic sorting and multimodal typing of cancer cells in self-assembled magnetic arrays. Proceedings of the National Academy of Sciences, U.S.A. 107 (33), 14524-14529 (2010).
- Guzera, M., Cian, F., Leo, C., Winnicka, A., Archer, J. The use of flow cytometry for immunophenotyping lymphoproliferative disorders in cats: a retrospective study of 19 cases. Veterinary and Comparative Oncology. 14, 40-51 (2016).
- Young, N. A., Al-Saleem, T. I., Ehya, H., Smith, M. R. Utilization of fine-needle aspiration cytology and flow cytometry in the diagnosis and subclassification of primary and recurrent lymphoma. Cancer. 40 (4), 307-319 (1998).
- Carroll, C. S. E., Altin, J. G., Neeman, T., Fahrer, A. M. Repeated fine-needle aspiration of solid tumours in mice allows the identification of multiple infiltrating immune cell types. Journal of Immunological Methods. 425, 102-107 (2015).
- Araujo, R. W., Paiva, V., Gartner, F., Amendoeira, I., Martinez Oliveira, J., Schmitt, F. C. Fine needle aspiration as a tool to establish primary human breast cancer cultures in vitro. Acta Cytologica. 43 (6), 985-990 (1999).
- Craft, I., et al. Percutaneous epididymal sperm aspiration and intracytoplasmic sperm injection in the management of infertility due to obstructive azoospermia. Fertility and Sterility. 63 (5), 1038-1042 (1995).
- Powers, C. N. Diagnosis of infectious diseases: A cytopathologist’s perspective. Clinical Microbiology Reviews. 120 (3), 351-367 (1998).
- Diamantis, A., Magiorkinis, E., Koutselini, H. Fine-needle aspiration (FNA) biopsy: Historical aspects. Folia Histochemica et Cytobiologica. 47 (2), 191-197 (2009).
- Greig, E. D. W., Gray, A. C. H. Note on the lymphatic glands in sleeping sickness. British Medical Journal. 1 (2265), 1252 (1904).
- Robson, J., Ashkar, T. S. Trypanosomiasis in domestic livestock in the Lambwe Valley area and a field evaluation of various diagnostic techniques. Bulletin of the World Health Organization. 47 (6), 727-734 (1972).
- Disease, T. African Animal Trypanosomiasis. In Vitro. , 1-15 (2009).
- Kennedy, P. G. E. Clinical features, diagnosis, and treatment of human African trypanosomiasis (sleeping sickness). Lancet Neurology. 12 (2), 186-194 (2012).
- Trindade, S., et al. Trypanosoma brucei parasites occupy and functionally adapt to the adipose tissue in mice. Cell Host and Microbe. 19 (6), 837-848 (2016).
- Carvalho, T., Trindade, S., Pimenta, S., Santos, A. B., Rijo-Ferreira, F., Figueiredo, L. M. Trypanosoma bruceitriggers a marked immune response in male reproductive organs. PLoS Neglected Tropical Diseases. 12 (8), 1-15 (2018).
- Sundberg, R. D., Hodgson, R. E. Aspiration of bone marrow in laboratory animals. Blood. 4 (5), 557-561 (2013).
- Sottnik, J. L., Guth, A. M., Mitchell, L. A., Dow, S. W. Minimally invasive assessment of tumor angiogenesis by fine needle aspiration and flow cytometry. Angiogenesis. 13 (3), 251-258 (2010).
- Betka, J., Hovorka, O., Boucek, J., Ulbrich, K., Etrych, T., Rihova, B. Fine needle aspiration biopsy proves increased T-lymphocyte proliferation in tumor and decreased metastatic infiltration after treatment with doxorubicin bound to PHPMA copolymer carrier. Journal of Drug Targeting. 21 (7), 648-661 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved