Method Article
질소 고정 열대 카나바세아 나무 파라스포니아 앤더슨이 변형, 게놈 편집 및 현상형 화
요약
Parasponia andersonii는 대마초 가족 (칸 나바세아)에 속하는 빠르게 성장하는 열대 나무이며, rhizobium와 관련하여 질소 고정 뿌리 작은 혹을 형성 할 수 있습니다. 여기에서, 우리는 Agrobacterium tumefaciens-중재된 안정한 변환 및 CRISPR/Cas9 기지를 둔 게놈 편집에 근거를 둔 P. andersonii에 있는 역유전 분석을 위한 상세한 프로토콜을 기술합니다.
초록
파라스 포니아 앤더슨은 대마초 가족 (칸 나바 세아)에 속하는 빠르게 성장하는 열대 나무입니다. 4종의 추가 종과 함께, 리조비움과 질소 고정 결절 공생을 확립할 수 있는 유일한 알려진 비콩구종 혈통을 형성한다. 콩과 식물과 P. 앤더슨 ii 사이의 비교 연구는 뿌리 줄이 형성의 기본 유전 네트워크에 귀중한 통찰력을 제공 할 수 있습니다. 비교 연구를 촉진하기 위해, 우리는 최근에 P. andersonii 게놈을 시퀀싱하고 아그로박테리움 투메파시엔스-중재 된 안정적인 변환 및 CRISPR / Cas9 기반 게놈 편집을 확립했습니다. 여기에서는 P. andersonii를위해 개발된 변형 및 게놈 편집 절차에 대한 자세한 설명을 제공합니다. 또한, 우리는 종자 발아 및 공생 표현형의 특성화에 대한 절차를 설명합니다. 이 프로토콜을 사용하여, 안정적인 형질전환 돌연변이 라인은 2-3 개월의 기간에서 생성될 수 있다. T0 형질전환 선의 식물성 체외 전파는 A. tumefaciens 공동 재배 후 4 개월에 표현형 실험을 시작할 수 있습니다. 따라서, 이 프로토콜은 몇 가지 명확한 이점을 제공하지만, P. andersonii에사용할 수있는 일시적인 Agrobacterium 뿌리 형성-기반 루트 변환 방법보다 약간 더 오래 걸립니다. 함께, 여기에 설명 된 절차는 P. andersonii이 열대 나무의 생물학의 잠재적으로 다른 측면뿐만 아니라 공생 협회를 이해하는 것을 목표로 연구를위한 연구 모델로 사용할 수 있습니다.
서문
파라스포니아 앤더슨은 대마초 가족 (칸 나바세아)에 속하는 열대 나무이며 파푸아 뉴기니와여러 태평양 제도 1,2,3이원산지입니다. 4개의 추가 파라스포니아 종과 함께, 그것은 뿌리 줄기와 질소 고정 결절 공생을 확립할 수 있는 유일한 비 콩구도 혈통을 나타냅니다. 이 공생은 콩과 식물 (Fabaceae) 모델 메디카고 트렁카툴라와 로터스 japonicus에서잘 연구되어 결절 형성및 기능의 분자유전적 특성에 대한 상세한 지식을 습득한 결과 4. 또한, 콩류의 뿌리 같은혹 공생이 훨씬 더 오래되고 광범위하게 관절 성 진균 공생5에 기초한다는것이 입증되었습니다. 생리학 비교는 콩류, 파라스포니아의질소 고정 결절 공생뿐만 아니라, 디아조영양 프랭키아 박테리아를 호스트 소위 actinorhizal 식물 종, 공유 진화 기원을 가지고 있음을 시사 6,7,8. 콩과 엽 결절 형성에 관여하는 것으로 확인된 유전자가 보존된 유전적 기초의 일부인지 여부를 결정하기 위해 비콩콩종 종에 대한 연구가 필수적입니다. 이를 위해, 우리는 비교 연구 모델로 P. andersonii를 사용하는 것이 제안, 콩과 식물과 함께, 근본적인 루트 결절 형성 및 기능의 핵심 유전 네트워크를 식별하기 위해.
P. 앤더슨이 화산 언덕의 경사면에서 찾을 수있는 개척자입니다. 그것은 한 달에 45cm의 성장 속도를 충족하고 10미터 9까지의 길이에 도달 할 수 있습니다. P. 앤더슨 나무는 별도의 남성과 여성의 꽃 3,10의형성에 의해 촉진되는 바람 수분된다. 우리는 최근에 P. andersonii의디플로이드 게놈(2n= 20; 560 Mb/1C)을 시퀀싱하고, 2개의 추가파라스포니아 종의 초안 게놈 서열을 조립하였다; P. 리거다와 P. 루고사6. 이 밝혀 ~35,000 P. 앤더슨 유전자 모델 >20,000 직교 그룹에서 클러스터 될 수 있는 M. 트렁카툴라에서유전자와 함께, 콩 (글리신최대), 애기장대탈리아나, 삼림 딸기 ( 프라가리아 베스카), 트레마 오리엔탈리스, 블랙 코튼 포플러(포퓰러스트리코카르파)및 유칼립투스(유칼립투스그랜디스)6. 추가적으로, M. truncatula와 P. andersonii 사이 전사체 비교는 두 종 6에 있는 결절 강화한 표현 패턴을표시하는 290 putative orthologues의 세트를 확인했습니다. 이것은 비교 연구를위한 훌륭한 자원을 제공합니다.
P. andersonii 뿌리와 결절에서 유전자 기능을 연구하기 위해, 아그로박테리움 뿌리줄기유전자-매개 뿌리 형질전환에 대한 프로토콜이11개확립되었다. 이 프로토콜을 사용하여, 형질전환 뿌리를 방위하는 복합 식물은 비교적 짧은 시간 프레임에서 생성될 수 있다. 이 방법은, 또한, 또한, 12,13,14에널리 적용된다. 그러나 이 방법의 단점은 루트만 변환되고 각 형질전환 루트가 독립적인 변환 이벤트를 나타내므로 상당한 변동이 발생한다는 것입니다. 또한 변환은 일시적이며 형질전환 선은 유지 될 수 없습니다. 이것은 A. 뿌리 줄기-기반 루트 변환CRISPR /Cas9 매개 게놈 편집에 덜 적합합니다. 또한, A. 뿌리 줄기 유전자는 식물 게놈에 그것의 뿌리를 유도 하는 궤 적 (rol) 유전자를 전송, 한 번 호르몬 항상성을 방해 표현15. 이것은 A. 뿌리 줄기-변형 된 뿌리에서 식물 호르몬의 역할을 연구하는 것이 도전적입니다. 이러한 한계를 극복하기 위해, 우리는 최근 P. andersonii10의 아그로박테리움 투메파시엔-기반변환 및 CRISPR/Cas9 매개 돌연변이 유발에 대한 프로토콜을 개발했다.
여기에서는 P. andersonii를위해 개발된 A. tumefaciens-기반변환 절차 및 역유전학 파이프라인에 대한 자세한 설명을 제공합니다. 또한, 우리는 공생 상호 작용을 연구하기 위한 분석학을 포함하여 형질전환 식물의 하류 처리를 위한 프로토콜을 제공합니다. 여기에 설명된 프로토콜을 사용하여, 2-3개월 동안 다중 형질전환 라인을 생성할 수 있다. CRISPR/Cas9 매개 돌연변이 발생과 함께, 이것은 녹아웃 돌연변이 라인의 효율적인 생성을 가능하게 합니다. 이러한 돌연변이 선은 체외(10,16,17)에서식물적으로 전파될 수 있으며, 이는 변형 시술 후 4개월에 자형질 특성화를 시작하기에 충분한 물질을 생성할 수 있게 한다. 10. 함께, 절차의이 세트는 어떤 실험실이 열대 나무의 생물학의 잠재적으로 다른 측면뿐만 아니라, 비소 질 및 균체 연관이해겨냥 연구를위한 연구 모델로 P. andersonii을 채택 할 수 있어야합니다.
프로토콜
1. 온실에서 P. 앤더슨 나무 성장
-
게르미네이트 P. 앤더슨 II 1 씨앗18.
- 신선한 파라스포니아 베리를 사용하거나 말린 열매를 물에 담그고 2시간 동안 물에 담가 수분을 보충하십시오. 티슈 페이퍼에 열매를 스쿼시하거나 차 체 의 안쪽에 문질러 씨앗을 제거하십시오.
- 시판 표백제(~4% 하이포염소산염)를 사용하여 15-20분 동안 씨앗을 소독한 후 멸균수를 사용하여 씨앗을 6회 세척합니다.
- 씨앗을 멸균 된 200 μL PCR 튜브로 옮김. 씨앗이 완전히 잠기있도록 멸균 된 물로 튜브를 채웁니다. 다음 프로그램을 실행하는 열사이클러에서 10일 동안 튜브를 배양합니다: 30 사이클(7 °C 4 h, 4시간 동안 28°C). 씨앗을 죽일 수 있기 때문에 가열 된 뚜껑을 사용하지 마십시오.
- SH-0 플레이트를 준비합니다(표 1참조). 씨앗을 SH-0 플레이트로 옮기고 28°C, 16 h:8h-night에서 배양한다. 28 °C에서 배양 하는 동안 건조를 방지 하기 위해 탄성 밀봉 호 일의 2 층으로 접시를 닫습니다.
- 모종은 진정한 잎의 첫 번째 세트를 개발 한 후 (~ 3-4 주 28 °C에서 배양 후), 상업 화분 토양으로 채워진 냄비에 묘목을 전송하고 탈수를 방지하기 위해 반투명 플라스틱 컵으로 모종을 커버. 냄비를 28°C 기후실 또는 온실에 놓고 ~ 85% RH, 16 h:8 h:day:night 정권에 놓습니다.
- 1 주 후 반투명 플라스틱 컵을 제거하십시오. 정기적으로 냄비에 물을 주면 나무가 성장을 유지하기 위해 비료로 더 큰 보충제를 재배하십시오.
2. P. 앤더슨의 CRISPR/Cas9 매개 돌연변이 발생에 대한 구성물의 복제
참고: 표준 이진 변환 벡터는 P. andersonii의안정적인 변환에 사용할 수 있습니다. 여기서, 일례로, 모듈식 클로닝(예를 들어, 골든 게이트)을 사용하여 CRISPR/Cas9 매개 돌연변이 발생에 대한 구문을 생성하는 절차이다(예를 들어, 골든 게이트)19.
- CRISPR 설계 도구가 내장된 생물정보학 소프트웨어를 사용하여 관심 유전자에 대한 가이드 RNA 표적 서열을 식별합니다. 표적 유전자의 코딩 서열의 5'-끝에 위치한 가이드 RNA 서열을 선택하여 전체 녹아웃을 얻을 확률을 높인다. P. 앤더슨이 게놈 6에 대해 검색하여 오프타겟 효과를 확인하십시오.
참고: 표적 유전자당 2개의 sgRNAs를 사용하십시오, 바람직하게는 200-300 bp 떨어져. 이것은 PCR에 의해 그리고 그 후에 agarose 젤 전기 동에 의해 확인될 수 있는 삭제를 생성할 수 있습니다. - sgRNA 서열을 포함하는 레벨 1 골든 게이트 구문을 생성한다.
- 다음 프라이머 서열에서 N(20)의 위치에 20 bp 가이드 서열을 삽입하여 각 개별 sgRNA를 증폭시키는 프라이머를 설계합니다: 5'-TGTGGGGTCTCTCAATGN(20) GTTTTAGAGCTAGAAATAGCAAG-3'.
참고: 가이드 시퀀스가GN(19)과같으면 프라이머 시퀀스에 삽입하기 전에 가이드 시퀀스의 5' 끝에서 G를 제거합니다. - PCR은 pICH86966::AtU6p:sgRNA_PDS20 단계에서 설계된 전방 프라이머와 범용 리버스 프라이머를 사용하여 sgRNAs를 증폭시다: 5'-TGTGGTTCTCTCAGCAGCTTTTTTTTTTTTTTTTTTTTTTTTTTGTAC-3'. 고충실도 열 안정 DNA 폴리머라제 및 다음 PCR 조건을 사용하십시오: 30s에 98°C; 30 사이클 (10 s에 대 한 98 °C; 53 °C 20 s에 대 한; 72 10 s에 대 한 °C); 72°C에서 7분 동안. 성공적인 PCR 반응은 165 bp 앰플리콘을 산출한다.
- 상용 PCR 정제 키트를 사용하여 PCR 앰플리온을 컬럼 정화. 이어서, 애기장대 의 뒤에 sgRNAs를 복제하기 위하여 골든 게이트 반응을 설정[ AtU6p 작은 RNA 프로모터] sgRNA PCR 앰플리콘의 10 ng, pICSL01009의 150 ng::AtU6p20,적절한 레벨 1 수락자 벡터의 60 ng, T4의 2 μL 리가제 완충제, 소 혈청 알부민 (BSA) 2 μL 0.1 %, BsaI 0.5 μL, T4 리가제 0.5 μL, 초순수로 20 μL로 채웁니다. 모든 sgRNAs가 헤어핀 형성을 방지하기 위해 동일한 방향으로 복제되었는지 확인하십시오.
- 다음 프로그램을 실행하는 열사이클러에서 배양 반응: 20초에 대한 37°C; 26 사이클 (37 °C 3 분, 16 °C 4 분); 50 °C 5 분; 80 °C 에서 5 분. 암피실린 (50 mg / L), X-Gal (200 mg / L) 및 IPTG (1 mM)를 포함하는 LB 매체21의 대장균 및 플레이트에 골든 게이트 반응을 변환하십시오.
참고: IPTG와 X-Gal의 재고 솔루션을 초순수 및 디메틸포마미드로 준비합니다. 암피실린 및 IPTG 재고 솔루션을 살균하고 모든 주식을 -20 °C에 보관하십시오. 디메틸포름아미드를 취급할 때장갑을 착용하십시오. - 상업용 플라스미드 절연 키트를 사용하여 흰색 콜로니를 선택하고 플라스미드를 분리합니다. 시퀀스는 골든 게이트 레벨 2 어셈블리를 계속하기 전에 격리된 플라스미드를 확인합니다.
- 다음 프라이머 서열에서 N(20)의 위치에 20 bp 가이드 서열을 삽입하여 각 개별 sgRNA를 증폭시키는 프라이머를 설계합니다: 5'-TGTGGGGTCTCTCAATGN(20) GTTTTAGAGCTAGAAATAGCAAG-3'.
- 안정적인 변환을 위해 레벨 2 골든 게이트 구성을 조립합니다.
- 레벨 1 AtU6p::sgRNA 구문(섹션 2.2에서 생성)과 pICH47802::NPTII,pICH47742:35S 프로::ΩNLS-aCas9:35Ster,레벨 2 수락자 pICSL4723 및 적절한 엔드 링커 (엥글러 외22참조). 다음과 같은 반응을 수행: 각 공여자 벡터의 ~100 fmol을 사용하고 수용자 벡터의 ~ 20 fmol을 사용하고 T4 리가제 완충제의 2 μL, 0.1 % BSA의 2 μL, BpiI의 0.5 μL, 0.5 μL의 T4 리가제, 초순수로 20 μL로 채웁니다.
참고 : 레벨 1 플라스미드 pICH47802 ::NPTII,pICH47742 :35S프로::ΩNLS-aCas9:35S 테르먼저 복제 할 필요가 (보충 파일 1참조), 섹션 2.220, 22에서 sgRNAs에 대해 설명된 대로 ,23. - 2.2.4 단계 하에서 반응을 배양하고 대장균으로변환합니다. 카나마이신을 함유하는 LB 배지에 플레이트. 다음 날, 흰색 식민지를 선택하고 플라스미드를 분리합니다. 제한-소화 해석을 통해 올바른 플라스미드 어셈블리를 결정합니다.
- 레벨 1 AtU6p::sgRNA 구문(섹션 2.2에서 생성)과 pICH47802::NPTII,pICH47742:35S 프로::ΩNLS-aCas9:35Ster,레벨 2 수락자 pICSL4723 및 적절한 엔드 링커 (엥글러 외22참조). 다음과 같은 반응을 수행: 각 공여자 벡터의 ~100 fmol을 사용하고 수용자 벡터의 ~ 20 fmol을 사용하고 T4 리가제 완충제의 2 μL, 0.1 % BSA의 2 μL, BpiI의 0.5 μL, 0.5 μL의 T4 리가제, 초순수로 20 μL로 채웁니다.
- 아그로박테리움 투메파시엔스 변형 AGL124로레벨 2 구성을 변환합니다.
3. P. 앤더슨의 안정적인 변신
- A. tumefaciens 균주 AGL1로 적절한 항생제를 함유하는 2 LB 플레이트를 접종하여 관심의 구성으로 변형시켰다. 28 °C에서 2일 동안 플레이트를 배양합니다.
- 온실에서 자란 나무에서 어린 가지를 수확하십시오. 각 변환에 대해 길이 5-8cm의 약 5 가지를 사용하십시오. 감염되지 않은 건강한 분기만 사용해야 합니다. 잎을 각 잎의 끝에 남게 하여 ~1 cm2의 잎조직을 남기고 있도록 자르는 것으로 잎을 제거한다. 잎을 버리십시오.
- 폴리소르베이트 20 방울을 함유한 1:1 희석 된 상업용 표백제 (희석 후 ~ 2 % 하이포 클로르산염)를 사용하여 15 분 동안 조직을 소독하십시오. 그런 다음 조직을 오토 클레이브 물로 6 번 헹구어 보입니다.
참고:이 단계뿐만 아니라, 다음 단계는 조직 멸균을 유지하기 위해 층류 흐름 캐비닛 내부에 실시될 필요가있다. - 아세토시링곤(20 mg/L) 및 비이온계면활성제(0.001% v/v)를 함유하는 25 mL의 침윤 배지에서 1-2 플레이트에서 A. 투메파시엔세포를 재중단시켜 광학 밀도(OD600)에도달하여~5.
참고: 아세토시링원 스톡 솔루션을 70% 에탄올로 준비하고 -20°C에 보관하십시오. 비이온성 계면활성제는 침투 배지에 첨가하기 전에 필터 살균되어야 합니다. - 줄기와 잎자루 조직을 A. tumefaciens 현탁액 내부의 길이 ~1cm의 조각으로 잘라 양쪽에 신선한 상처를 만듭니다. 조직 조각을 A. 투메파시엔스 현탁액에 10-30분 동안 둡니다.
- 루팅 배지를 준비하고(표 1참조) 오토클레이브 후 아세토시링론(20 mg/L)을 첨가합니다. 멸균 된 필터 용지에 건조 조직 조각을 매체 (~ 10 이식 / 판)에 놓습니다. 2일 동안 21°C에서 어두운 플레이트를 배양한다.
참고: 아세토시링론을 추가하기 전에 배지가 ~60 °C까지 식힙니다. - 2 일 후, 곰팡이 또는 명백한 세균 오염 (A. tumefaciens이외의 박테리아)에 대한 플레이트를 검사합니다. 오염된 플레이트는 폐기해야 합니다.
- 액체 SH-10 배지를 준비합니다(표 1참조). 오토클레이브 후 폴리소르베이트 20(0.01%, v/v)을 추가합니다. 조직 조각을 폴리소르베이트 20을 함유하는 SH-10의 10 mL로 옮김. 적어도 10 분의 기간 동안, 부드럽게 조직을 씻어 모든 2-3 분 교반.
- 폴리소르베이트 20을 함유한 신선한 SH-10으로 2회 더 씻으소서. 이러한 시간, 세척 단계당 2-3 분 배양 시간은 충분하다.
- 응원 매체를 준비합니다(표 1참조). 오토클레이브 후, 세포조시메(300 mg/L)와 카나마이신(50 mg/L)을 넣고 접시를 붓습니다. 이차 변형 (형질 전환 카나마이신 내성 라인의 변형)의 경우, 히그로 마이신 (15 mg / L) 선택을 적용하십시오.
- 필터 용지의 멸균 조각에 건조 조직 조각. 그 후, 3.9단계에서 제조된 플레이트에 티슈 조각을 전사한다.
- 28°C에서 7일 동안 플레이트를 배양하고, 16 h:8 시간일:밤. 매 2 일 곰팡이 또는 세균 오염과 A. tumefaciens의과도한 성장에 대한 플레이트를 확인합니다. 오염의 경우, 감염된 되지 않은 조각을 신선한 접시로 옮김.
- 7일 후, 세포조향(300 mg/L) 및 카나마이신(50 mg/L)을 함유하는 전파 배지(표 1참조)로 조직 조각을 옮긴다. 28 °C에서 플레이트를 인큐베이션, 16 h:8 시간 낮:밤. 트랜스제닉 싹이 생길 때까지 일주일에 한 번 접시를 새로 고칩니다. 감염되지 않은 조직 조각만 신선한 접시로 옮겨야 합니다. A. tumefaciens에의해 자란 조각을 폐기하십시오.
- 일단 형질전환 싹은 길이 ≥1 cm이고, 세포조셉시메(300 mg/L) 및 카나마이신(50 mg/L)을 함유하는 전파 매체에서 독립적으로 싹을 자르고 배양한다. 촬영이 독립적인 변형자를 나타내도록 하려면 이식의 각 측면에서 단 한 번의 촬영만 수행합니다.
- 5.2단계에서 설명된 바와 같이 식물적으로 형질전환 싹을 전파합니다.
4. 적분형 형질전환 싹의 유전자변형
- sgRNA 인식 사이트에 걸친 설계 프라이머(들). PCR 앰플리온 시퀀싱을 허용하려면 sgRNA 인식 부위에서 150-250bp 떨어진 프라이머를 선택합니다.
- 각 형질전환 촬영에서 잎 끝(~5mm)을 잘라 서 유전자형으로 자른다. 또한 야생 형 제어 샘플을 수확합니다.
- 4.1단계에서 설계된 프라이머와 식물 샘플에서 DNA를 직접 증폭하는 상용 키트를 사용하여 50 μL PCR 반응을 수행합니다. 대안적으로, PCR 반응은 고충실성 폴리머라제를 사용하여 정제된 DNA상에서 수행될 수 있다.
- 1.5-2% 아가로즈 젤에 PCR 앰프를 분리.
- 겔 전기 동거의 결과를 분석합니다. 중간 크기의 인델의 존재를 나타내는 야생 유형과 다른 크기의 여러 밴드 (1 개 이상의 알레일) 및 PCR 앰플리온을 생산하는 샘플을 확인하십시오.
- 정확한 돌연변이를 확인하기 위해 PCR 앰플리온을 시퀀스. 단일 PCR 앰플리폰을 생산하는 샘플의 경우 PCR 제품을 직접 시퀀스화할 수 있습니다. 겔 전기 영동 후 1개 이상의 대역을 생성하거나 PCR 앰플리컨의 직접 시퀀싱 후 이형으로 보이는 샘플은 먼저 무딘 말단 클로닝 벡터로 복제될 필요가 있다. 이어서, 각 샘플에 대해 여러 클론을 시퀀스하여 샘플에 존재하는 모든 가능한 대두를 식별합니다.
- 관심 있는 유전자에 시퀀싱 결과를 정렬하고 정렬을 검사하여 sgRNA 표적 부위 근처의 돌연변이를 검사합니다. 그 후, 이러한 돌연변이가 프레임 시프트를 만드는지 확인하십시오. > 2 개의 대식가가 있는 선과 프레임 내 돌연변이가 포함된 선을 버립니다.
- 추가 분석을 위해 여러 줄을 선택합니다.
- 5.2단계에서 설명한 대로 선택한 선을 전파합니다.
- 라인이 몇 가지 새로운 촬영을 개발 한 경우, ≥3 잎 팁에서 새로운 샘플을 가지고 단계를 반복 4.3-4.7. 원래 PCR 샘플뿐만 아니라 동일한 라인에서 발생하는 각 샘플에 존재하는 돌연변이가 동일한지 여부를 결정합니다. 모든 샘플에서 동일한 돌연변이를 산출하는 선은 균질하게 돌연변이되며 추가 실험을 위해 사용될 수 있다. 이러한 선이 키메라와 동일한 결과를 생성하지 않는 선을 삭제합니다.
5. 실험을 위한 뿌리 깊은 P. 앤더슨이 식물의 준비
-
P. 앤더슨의새로운 조직 배양 라인을 시작합니다.
- 건강한 나무에서 자식 싹, 어린 모험 싹 또는 잎 조직을 수확하십시오. 또는 모종을 시작 재료로 사용할 수 있습니다.
- 1:1 희석된 상업용 표백제(희석 후~2% 하이포염소산염)를 사용하여 조직을 소독하고, 폴리소르베이트 20방울을 15분 동안 몇 방울 함유하고 있습니다.
참고:이 단계뿐만 아니라, 다음 단계는 조직 멸균을 유지하기 위해 층류 또는 층류 교차 흐름 캐비닛 내부에 실시될 필요가있다. - 조직을 전파 매체로 전달합니다(표 1참조). 2층의 탄성 밀봉 호일과 배양판으로 28°C, 16h:8시간 낮:밤을 닫습니다.
- 처음 2주 동안 며칠마다 플레이트를 검사하여 조직이 곰팡이 나 세균 오염이 없는지 확인하십시오.
- ~10싹을 전파매체의 신선한 접시에 올려놓음으로써 조직을 전파하고 2층의 탄성 밀봉 호일로 플레이트를 닫는다. 28 °C에서 플레이트를 인큐베이션, 16 h:8 시간 낮:밤. 이 단계를 4주마다 반복합니다.
- 촬영 길이가 >1cm인 경우, 발사를 기지에서 잘라내고 응원 매체에 놓습니다(표 1참조). 단일 응원 판에 약 10개의 사격을 배치할 수 있습니다. 촬영의 기저 팁을 매체에 삽입하여 수직으로 촬영합니다. 뿌리는 28°C에서 플레이트를 배양한 후 10-14일, 16 h:8h일(night)에 나타난다.
참고 : 모든 싹을 뿌리 뽑지 말고 조직 배양 전파를위해 부품을 보관하십시오 (5.2 단계 참조).
6. 냄비에 P. 앤더슨이 식물의 끄덕
-
rhizobium 접종을 준비합니다.
- 메소르히조비움 다각형 BOR2 6의 단일 콜로니로부터 액체 YEM 배지의 10 mL을 접종하고 2일 동안 28°C에서 배양하였다.
참고: M. plurifarium BOR2는 효율적으로 P. 앤더슨을고를 수 있기 때문에 바람직합니다. 그러나, 다른 rhizobium 균주는 P. 앤더슨의 끄덕이에도 사용할 수 있습니다 (예를 들어, 브래디리조비움 엘카니 WUR325, 리조비움 트로피치 CIAT89926,27 또는 브라디에리조비움 Sp. 켈루드2A4). - 10 mL 배양액을 사용하여 더 많은 양의 액체 YEM 배지를 접종합니다. 이 문화권의 양은 접종해야 하는 포트의 수에 따라 달라집니다.
- 액체 EKM 배지를 준비합니다(표 3, 표 4참조). 세포를 수확하기 위해 3,500 x g에서 10 분 동안 세균 배양을 원심 분리한다. 이어서, 액체 EKM에서 세균 펠렛을 재중단(원래 YEM 배양과 거의 동일한 부피를 사용)하고 광학 밀도(OD600)를결정한다.
- 메소르히조비움 다각형 BOR2 6의 단일 콜로니로부터 액체 YEM 배지의 10 mL을 접종하고 2일 동안 28°C에서 배양하였다.
- ~ 20 냄비의 경우, 액체 EKM 배지 3 L을 준비하고 단계 6.1.3에서 제조 된 rhizobial 현탁액으로 접종하십시오. 을 이은 것은 OD600 = 0.025에 도달합니다.
- 뿌리줄기를 함유한 EKM 3 L을 1,250 g의 펄라이트와 섞습니다. 그 후, 멸균 반투명 폴리 프로필렌 냄비에이 혼합물 210g을 추가합니다. 또는 펄라이트 대신, 모래를 끄덕인 암법의 기판으로 사용한다.
- 각 냄비에 식물 1-3 P. 앤더슨 이 식물. 또한, CRISPR 제어 구문으로 변형된 P. 앤더슨이 식물을 함유한 여러 냄비를 준비한다(보충표 1참조). 실험 중에 물 손실을 확인할 수 있도록 여러 냄비의 무게를 측정합니다. 각 냄비의 바닥을 덮어 뿌리를 빛노출로부터 보호합니다.
- 4-6 주 동안 climatized 성장 실 (28 °C, 16 h:8 h:8 시간 일:밤)에 냄비를 배양합니다. 일주일에 한 번, 물 손실을 결정하기 위해 여러 냄비의 무게. 물 손실이 10 mL를 초과하는 경우, 손실을 보상하기 위해 초순수로 보충하십시오.
- 4-6 주 후, 펄라이트에서 뿌리를 청소하고 결절 효율을 검사하기 위해 쌍안경을 사용하여 결절 번호를 결정합니다.
7. 판에 P. 앤더슨 이 식물의 끄덕
-
셀로판 멤브레인 준비 28.
- 셀로판 멤브레인을 12cm x 12cm 페트리 접시에 넣습니다. 멤브레인을 상단에 약간 짧게 잘라 촬영이 성장할 수 있는 공간을 확보합니다.
- 셀로판 멤브레인의 투과성을 높이려면 EDTA 용액 (1 g / L)의 멤브레인을 20 분 동안 끓여서 탈염된 물로 6 배 이상 헹구어 EDTA를 제거하십시오.
참고: 건조 막이 물과 접촉 할 때 주름이 생기는 경향이 있기 때문에 건조 막을 하나씩 용액에 담급전시킵니다. - 둥근 유리 판에 물 얇은 층에 수평으로 멤브레인을 배치합니다. 두 번 오토클레이브하여 멤브레인을 살균하십시오.
- 1개의 오토클레이브 셀로판 멤브레인을 한천 응고 된 EKM 배지를 함유하는 정사각형 12 x 12 cm 페트리 접시위에 놓습니다(표 3, 표 4참조). 3주된 뿌리 P. andersonii 식물분2개(섹션 5 참조) 또는 4주된 모종(섹션 1.1 참조)을 멤브레인 위에 놓습니다. 이러한 뿌리가 여전히 성장하고 있음을 나타내는 흰색 뿌리 끝이있는 뿌리가있는 식물또는 묘목만 선택하십시오.
- 두 번째 셀로판 멤브레인으로 뿌리를 부드럽게 덮어 샌드위치 층을 만듭니다. 탄성 밀봉 호일 의 3 층으로 접시를 밀봉. 알루미늄 호일로 플레이트의 하단 절반을 감싸고 가벼운 노출로 뿌리를 덮습니다.
- 3-4 주 동안 climatized 성장 실 (28 °C, 16 h:8 h:8 시간 일:밤)에 플레이트를 배양합니다. 루트 팁의 위치를 표시하여 시간이 지남에 따라 루트 성장을 따릅니다.
- EKM 플레이트가 장기간 배양으로 인해 건조되기 시작하면 세균 접종 며칠 전에 식물을 신선한 EKM 플레이트로 옮긴다.
- 단계 6.1에 기재된 바와 같이 세균 접종을 준비한다.
- 상부 셀로판 막을 제거하고 뿌리에 1 mL의 리조비움 배양(OD600 = 0.025)을 적용하였다. 이어서, 접종된 뿌리에 새로운 셀로판 막을 놓는다. 알루미늄 호일을 사용하여 플레이트의 외부를 감싸고 빛 노출에서 뿌리를 덮습니다.
- 4 주 후, 쌍안경을 사용하여 작은혹 번호를 검사하여 절인 효율을 확인합니다.
8. 파우치에 있는 피 앤더슨이 묘목의 끄덕이
- 제1.1절에 기재된 바와 같이 게르미네이트 P. 앤더슨이종자. 코틸레톤이 완전히 나타난 후 (28 °C에서 SH-0 플레이트에서 ~ 12 일), 모종을 파우치로 옮김을 옮니다.
- 파우치를 준비하려면 종이 심지의 접힌 부분을 찢고 수정된 EKM 배지 7mL를 추가합니다(표 3, 표 4참조).
- 종이 심지를 형성하는 용지 두 장과 파우치의 전면 플라스틱 시트 사이에 뿌리를 놓음으로써 1 개 또는 2 개의 모종을 삽입하십시오.
- 파우치 주위에 알루미늄 호일을 접어서 가벼운 노출로부터 뿌리를 보호하십시오. 높은 습도를 유지하기 위해 반투명 뚜껑으로 덮인 플라스틱 상자에 파우치를 일시 중단하십시오. 상자를 기후화된 성장실(28°C, 16 h:8 h:night)에 놓습니다.
- 종이 심지가 습기가 남아 있도록 멸균 초순수를 추가하여 물 증발을 보상하십시오 (파우치 바닥에 물이 서지 마십시오). 첫 주 후, 이것은 일반적으로 추가 해야 2-3 ml 매 4 일.
- 단계 6.1에 기재된 바와 같이 세균 접종을 준비한다.
- 파우치에서 10-12 일 동안 모종을 재배 한 후 뿌리 시스템을 500 μL의 rhizobium 배양 (OD600 = 0.025)로 접종하십시오.
- 시간을 통해 같은혹 형성을 따르십시오. 접종 후 4 주, 소두를 계산하고 수확하여 절반 효율을 결정할 수 있습니다.
9. 절절 사이토아키텍처 분석
- 고정제를 함유하는 2 mL 튜브에서 10-15 개의 결절을 수집합니다 (0.1 M 인산완충제에서 5% 글루타랄데히드, pH 7.2). 1/2-1 시간 동안 진공을 적용하고 4 °C에서 밤새 배양하십시오. 이 기간 동안 샘플은 튜브의 바닥으로 가라 앉습니다.
참고: 고정 용액은 사용 전 ~ 2-4 주 동안 4 °C에서 보관 할 수 있습니다. 티슈 고정제로 작업할 때는 장갑을 착용해야 합니다. - 0.1 M 인산 완충제, pH 7.2로 낙서 2x를 세척합니다. 각 세척 단계 사이에 10분 간격으로 발라주세요.
- 샘플을 30%, 50%, 70%, 및 100% 에탄올에서 이후에 배양하여 시료를 탈수한다. 샘플에서 모든 물이 제거되도록 하려면 100% 에탄올 스텝을 3x 반복합니다. 각 탈수 단계 사이에 10분 간격으로 바릅니다.
- 100 mL의 HEMA(2-하이드록세틸 메타크릴레이트)계 수지 용액과 혼합된 PEG400의 2.5 mL에 경화제 I 1 팩을 첨가하여 중합 혼합물 I(PM-I)을 준비한다. 용액을 ~15분 간 저어서 경화제 I를 완전히 녹입니다. 이어서 PM-I를 -20°C에 저장합니다.
- 단계 9.3에서 에탄올을 제거합니다. PM-I:100% 에탄올(1:3, v/v), PM-I:100% 에탄올(1:1, v/v), PM-I:100% 에탄올(3:1, v/v) 순으로 시료에 침투합니다. 1/2-1 시간 동안 또는 샘플이 바닥으로 가라 앉을 때까지 RT의 각 용액에서 샘플을 인큐베이션합니다.
- 100% PM-I 용액에서 4°C에서 밤새 샘플을 인큐베이트합니다.
- PM-I 및 경화제 II를 15:1(v/v) 비율로 혼합하여 중합 혼합물 II를 준비한다. 중합 용액으로 플라스틱 금형을 채우고, 금형의 바닥에서 수평으로 샘플을 방향을 지정하고, 탄성 밀봉 호일 조각으로 덮습니다. 기포의 형성을 피하십시오.
참고: 용액이 RT에 노출되면 중합되기 시작하면 플라스틱 홀더에서 가능한 한 빨리 샘플방향을 지정하십시오. 중합은 RT에서 하룻밤 배양 후 완료, 또는 37 °C에서 1 시간. - 9.7단계에서 탄성 밀봉 호일 커버를 제거하고 홀더를 중합 된 샘플에 놓습니다. 홀더를 샘플에 장착하려면 메틸 메타크릴레이트 계 수지 용액 5 mL에 메틸 메타크릴레이트 계 수지 분말 10 mL를 용해합니다. 신속하게 홀더 상단의 구멍에 솔루션을 추가합니다.
참고: 연기 후드에서 중합 단계를 수행하십시오 (RT에서 ~ 30 분). - 마이크로톤 섹션 샘플을 4-5 μm 두께로 샘플링합니다. 단면을 물 위에 놓습니다. 물이 증발하면 섹션이 슬라이드에 부착됩니다.
- 2분 동안 0.05%(v)의 토루이딘 블루에 담가 얼룩을 더합니다. 그 후, 매우 순수한 물로 3배 슬라이드를 헹구십시오. 슬라이드는 밝은 필드 현미경을 사용하여 관찰 될 수있다.
10. P. 앤더슨식물의 균질화
-
Rhizophagus 불규칙한 포자 '접종을 준비
- 210 μm, 120 μm 및 36 μm 메쉬 크기의 폴리 에스테르 직조 필터 스택을 준비합니다.
- 폴리 에스테르 필터의 스택에 상용 포자 현탁액의 필요한 양을 피펫. 100 mL의 오토클레이브 탈염수로 필터를 3배 헹구어 보시고 자라고 있습니다. 포자는 36 μm 필터의 표면에 유지됩니다.
참고: 오염을 방지하기 위해 층류 크로스 플로우 캐비닛에 포자 현탁액을 준비하십시오. - 폴리 에스테르 스택을 분해하고 36 μm 필터만 유지합니다. 오토클레이브 탈염수로 세척 단계를 6배 이상 반복합니다.
- 페트리 접시에 필터를 놓고 오토클레이브 탈염수에 포자를 다시 일시 중단합니다. 10.1.2단계에서 사용된 포자 현탁액의 부피와 동일한 양의 물을 사용한다. 포자 현탁액을 파이펫팅하여 멸균 튜브로 옮김을 전달합니다.
- 유리 슬라이드에 포자 현탁액 의 20 μL의 5 방울을 놓고 밝은 필드 현미경을 사용하여 포자의 수를 계산합니다. 포자 수를 포자/mL 비율로 변환하고 포자 현탁액이 250포자/mL에 도달할 때까지 포자 현탁액을 희석합니다. 포자 현탁액을 4°C에 보관하십시오.
- 균질 분석 을 수행합니다. 이를 위해, 1/2-Hoagland 배지 70 mL로 보충된 오토클레이브 샌드 800 g을 멸균 반투명 폴리프로필렌 냄비에 넣습니다(표 5-6참조). 모래와 중간을 냄비에 직접 섞어 힘차게 흔들어 보입니다.
- 각 냄비에 P. andersonii 식물1개를 놓고, 포자 현탁액의 피펫 1 mL을 P. andersonii 플랜렛의 뿌리에 직접 놓습니다. CRISPR 제어 구문으로 변형된 P. andersonii 식물을 포함하는 여러 냄비를 포함해야 합니다(보충 표 1참조).
- 6주 동안 기후화된 성장실(28°C, 16 h:8 h:8 일:밤)에 냄비를 인큐베이팅한다.
- 냄비에서 식물을 꺼내 가능한 한 많은 모래를 제거하기 위해 흐르는 물로 뿌리를 씻으십시오.
- 뿌리를 1cm 길이로 자르고 뿌리 조각을 90°C에서 20분 동안 10% KOH(w/v)로 끓입니다. 그 후, 100 μm 메쉬 크기로 세포 스트레이너에 삶은 뿌리를 놓고 50 mL의 물로 3 x 헹구는다.
- 0.05% (w/v) 락토글리세롤 (젖산 300 mL; 글리세롤 300 mL, 탈염수 400 mL)에서 0.05 %(w /v)의 트리판 블루로 뿌리를 수조 또는 난방 블록에서 90 °C에서 5 분 동안. 그 후, 30% 글리세롤에 뿌리를 전송. 루트 샘플은 RT에 저장할 수 있습니다.
- 단일 현미경 슬라이드에 15-25 개의 뿌리 조각을 놓습니다. 글리세롤 30%를 넣고 커버 유리로 덮고 뿌리 조각이 평평해질 때까지 누릅니다. 밝은 필드 현미경을 사용하여 루트 조각을 관찰하고 진균 식민지 를 점수.
참고: 투균을 채점하는 방법은 Trouvelot 등29에따라 설명됩니다. 이 방법은 여러 클래스 (%F, %M 및 %A)를 사용하여 각 뿌리 조각의 진균 식민지 수준과 풍부한 아부스큘러스를 신속하게 추정 할 수 있습니다.
결과
P. andersonii trees는 28°C 및 ~85% 상대 습도에서 컨디셔닝된 온실에서 재배될 수 있다(도1A). 이러한 조건하에서, 나무는 심기 후 6-9 개월에 꽃을 시작합니다. 여성 P. 앤더슨이 꽃은 각각 하나의 씨앗을 포함하는 열매를 생산하고 있습니다. 성숙하는 동안 열매는 색상을 변경합니다. 먼저 녹색에서 흰색으로, 그 후흰색에서 갈색으로 이동합니다(그림 1B). 익은 갈색 열매에서 추출 한 씨앗은 10 일 온도 주기 와 SH-0 접시에 7 일 배양 후 잘 발아합니다 (그림1C). 발아 된 씨앗은 ~ 4 주 후에 실험에 사용할 수있는 젊은묘목으로 계속 발전합니다 (그림 1D).
우리는 이전에 젊은 P. 앤더슨이 줄기의 잎이 효율적으로 A. tumefaciens 변형 AGL110을사용하여 변형 될 수 있음을 보여 주었다. 변형 절차의 시작에서, 조직 이식은 21°C에서 2일 동안 A. 투메파시엔과 함께 배양된다(도2A). 장기간 공동 재배는 A. tumefaciens에 의해 조직 이식의 과잉 식민지화를 초래하고, 따라서, 방지되어야한다 (도2B). 공동 재배 기간 이후에 조직 이식은 선택적 매체로 옮겨져 변형 된 조직의 성장을 촉진합니다. 2~3주 후, 작은 녹색 마이크로 칼리는 일반적으로 원래의상처 표면을 따라 관찰된다(도 2C). 이러한 캘리는 변형 절차가 개시된 후 6-8주 후에 1개 이상의 가설형 화살을계속 성장시키고 개발해야 한다(도 2D). 이 단계에서, 변형 효율은 전형적으로 성숙하고 부분적으로 우디 가지로부터 취한 조직 이피로 시작된 변형에 대해~10-30%의 범위입니다(표 7). 아직 꽃을 낳지 않은 가지의 젊고 빠르게 성장하는 팁에서 가져온 이식으로 변형이 시작되면 ~ 65-75 %의 변형효율을 달성 할 수 있습니다 (표 7). 때때로, 희끄무레한 칼리는 배지와 접촉하지 않는 배양의 측면에 형성되므로 카나마이신 선택을 경험하지 않습니다. 이러한 캘리는 종종 형질전환되지 않으며 이들 캘리로부터 형성된 임의의 싹은 일반적으로 카나마이신 함유배지와 직접 접촉한 후에 표백되고 죽는다(도 2E). 형질전환율이 낮거나 시동물질이 최적이 아닌 경우, 조직 조각이 갈색으로 변할 수 있으며(그림2F) A. tumefaciens에 의한 과다 증식을 겪을 수 있다(그림2G). A. tumefaciens 확산 및 근처 이식 성장에서 방지 하기 위해, 매체의 정기적인 다과 필요, 그리고 심각 하 게 감염 된 이식 제거 해야. 일단 개별형형 형질전환싹이 전파배지에 배치되면, A. 투메파시엔에 의한 과다증식은 일반적으로 더 이상 발생하지 않는다(도2H). 형질전환 촬영은 시험관 내 전파를 통해 곱할 수 있으며, 이는 한 달 동안 수십 개의 싹을 발생시킬 것이다 (그림3A-B). 이러한 싹은 ~ 2 주 후 뿌리 형성을 유도해야하는 뿌리 형성 매체에 배치 할 수 있습니다 (그림3C-D). 뿌리 식물은 이후에 실험에 사용될 수 있습니다.
녹아웃 돌연변이 선을 만들기 위해, 우리는 CRISPR /Cas9 매개 돌연변이 발생을 사용합니다. 이를 위해, 우리는 AtU6p 소형 RNA 프로모터20으로부터발현되는 표적 유전자당 CaMV35S 프로모터 및 2sgRNAs에 의해 구동되는 카나마이신 내성 유전자 NPTII,Cas9-인코딩 서열을 포함하는 이진 벡터를 이용한다. P. 앤더슨의 CRISPR/Cas9 매개 돌연변이 발생에 사용되는 구문의 그래픽 표현은 그림 4A에제공된다. 이 방법을 사용하여 게놈 편집은 10개의 형질전환 싹의 ~40%에서관찰된다. 돌연변이 선을 확인하기 위하여는, putatively 형질전환된 싹은 표적으로 한 지구를 아우르는 프라이머를 사용하여 sgRNA 표적 사이트에 돌연변이를 위한 유전형화됩니다. 예상 결과의 예는 그림 4에있습니다. 겔 전기 동동 후 찍은 사진에서 볼 수 있듯이, 여러 샘플은 야생 형과 비슷한 크기의PCR 앰플리폰을 생산합니다 (도 4B). 이 식물은 아가로즈 젤 전기 동동에 의해 가시화될 수 없거나 Cas9 효소에 의해 편집되지 않은 상태로 남아 있는 작은 인델을 포함할 수 있습니다. 추가적으로, 몇몇 샘플은 야생형(예를 들어, 도 4B에서2, 4, 7 및 8)과 크기가 다른 대역을 산출한다. 이러한 라인에서 1(줄 4, 7 및 8) 또는 둘 다(2줄) 양쪽 모두 를 쉽게 시각화할 수 있는 더 큰 인델을 포함합니다. 표적 부위에서의 돌연변이의 정확한 성질은 PCR 앰플리톤 시퀀싱 후에 밝혀진다. 도 4C에서볼 수 있듯이, 1-4 bp의 작은 인델뿐만 아니라, CRISPR/Cas9 돌연변이 발생 후에 더 큰 결실을 얻을 수 있다. 그림 4C에서줄 1의 시퀀스는 와일드 형식의 시퀀스와 동일하므로 이 줄이 편집을 이스케이프했음을 나타내므로 삭제해야 합니다. 돌연변이를 포함하는 선 들 중에서, 이종균, 동형접합체 및 이중 말기돌연변이체가 확인될 수 있다(도 4C). 그러나, 이형균 돌연변이는 일반적으로 희소한10. 동형접합체 또는 이중 말제 녹아웃 돌연변이체는 현상형 분석을 위한 충분한 물질을 얻기 위하여 식물성으로 전파될 수 있습니다. T0 세대에서 자형질 분석이 수행되기 때문에 돌연변이 선이 키메라인지 여부를 확인하는 것이 중요합니다. 이를 위해, 각 돌연변이 선에서 채취한 적어도 3개의 상이한 샘플에서, 헤노티핑은 반복될 필요가 있다. 상기 유전자형 분석 결과가 서로 동일한 경우(예: 도 4D의라인 8) 본래의 유전자형 분석 샘플이 동일하다면, 라인은 균질하게 돌연변이되고 추가 분석에 사용될 수 있다. 그러나, 지질형 검사 결과가 독립적인 샘플(예: 도 4D의라인 4)간에 다른 경우, 돌연변이 선은 키메라이며 폐기되어야 합니다.
M. 다투파륨 BOR2를 가진 P. andersonii의 접종은 뿌리 결절의 형성귀착됩니다 (그림 5). 그림 5A에서볼 수 있듯이, 이러한 작은혹은 루트 시스템을 따라 분포된다. P. andersonii의 적대는 밝은 갈색이지만 모양에 따라 뿌리 조직에서 쉽게 구별 될 수 있습니다 (그림5B). 4-6 주 동안 냄비에서 접종 실험 및 후속 성장은 전형적으로 ~ 10-30 작은혹의 형성귀착 (그림6A). 유사한 수의 작은혹은 접종 후 4 주에 EKM 판 성장 P. 앤더슨병의 접종 후 형성된다 (그림6A). 파우치에서, P. 앤더슨 모종은 일반적으로 형성 ~5-15 접종 후 5 주 에 작은 혹 (그림5C-D, 6A). 적두 세포아키텍처를 분석하기 위해, 소두는 밝은 필드 현미경 검사법을 사용하여 단면화되고 관찰될 수 있습니다. 도 6B는 P. 앤더슨이 의 작은혹의 중간을 통해 세로 단면도의 예를 나타낸다. 이 절은 감염된 세포를 포함하는 작은혹 엽에 의해 좌우되는 P. andersonii 작은혹의 중앙 혈관 번들을 보여줍니다 (그림6B).
P. 앤더슨 식물또한 균질화 될 수 있습니다. 후 6 R. 불규칙,mycorrhizal 식민지 주파수는 일반적으로 도달 > 80% (그림6C). 이 시점에서, 일반적으로 ~30%의 세포는 아부스컬을 함유한다(도6C). Arbuscles를 포함하는 P. andersonii 루트 세그먼트의 대표적인 심상은 그림 6D에도시되어 있습니다.

그림 1: P. 앤더슨 나무, 씨앗과 묘목. (A) 6개월 된 P. 앤더슨이 나무를 28°C의 온실에서 토양에서 포팅토양에서 재배하였다. (B) 성숙의 다양한 단계에서 P. 앤더슨 베리를 묘사 한 대표 이미지. 젊은 P. 앤더슨베리 열매 (익지 않은)는 녹색에서 흰색으로, 마지막으로 익으면 갈색 (익은)으로 색을 바꿉니다. (C) P. 앤더슨이 씨를 SH-0 배지에 1주일 동안 배양하였다. 검은 원은 발아 모종을 나타냅니다. (D) 4 주 된 P. 앤더슨 묘목 SH-0 배지에서 재배. 축척 막대는 25cm(A) 및 1cm(B-D)와 같습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
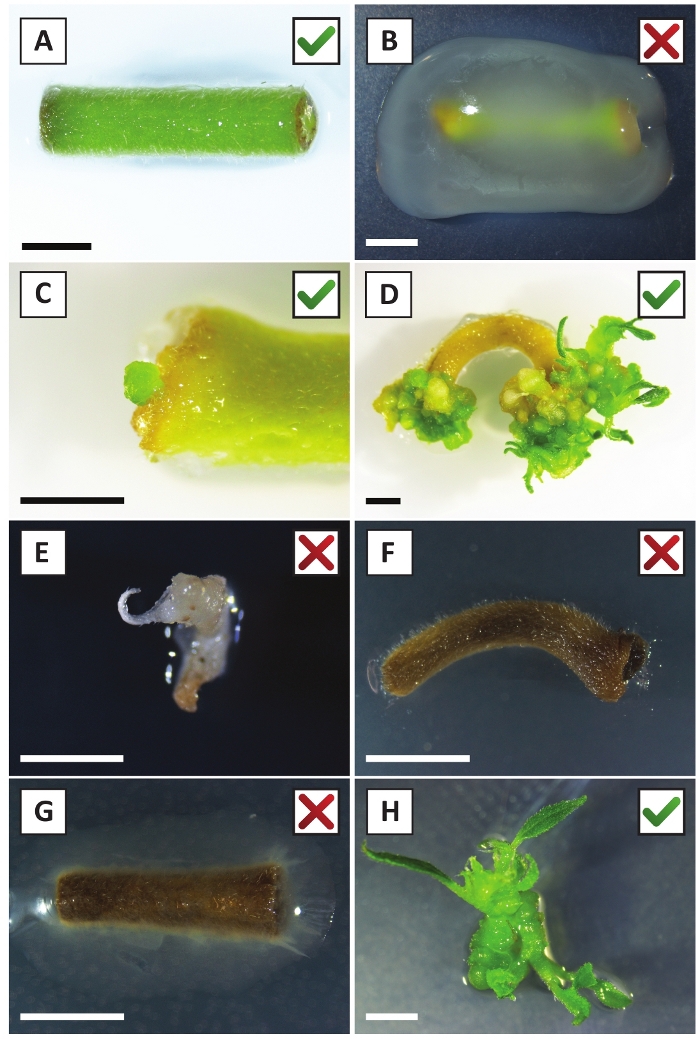
그림 2: 안정한 변환 절차의 상이한 단계에서 이식의 대표적인 이미지. (A) A. 투메파시엔스와공동 재배한 식물을 심는다. (B) 처음 2 주 동안 A. tumefaciens에 의해 자란 배화 후 변환. (C) 섭씨 미세 캘러스는 공동 재배 후 2.5주 에 배양의 상처 부위 근처에 형성되었다. (D) (트랜스제닉) 칼리에서 촬영의 출현을 보여주는 공동 재배 후 6 주에 배양의 대표적인 이미지. (E) 가나마이신 함유 매체와 직접 접촉하면 희끄무레해지고 결국 죽는 촬영의 대표적인 이미지. 이 촬영은 이식에 부착될 때 가장 가능성이 비형질전환 및 탈출 카나마이신 선택이다. (F) 변환되지 않은 이식의 대표 이미지입니다. (G) A. tumefaciens에의해 자란 성공적으로 변환 된 식물의 대표 이미지. (H) A. tumefaciens와공동 재배 후 8 주에 전파 매체에 성장 하는 단일 트랜스 제닉 촬영. 축척 막대는 2.5mm와 같습니다. 녹색 확인 표시 또는 빨간색 십자가가 포함된 상자는 각각 이식의 성공 또는 실패 변환을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 체외에서 전파할 수 있습니다. (A) 전파 매체에서 자란 싹. 플레이트를 새로 고치고 1주일 후에 이미지를 촬영했습니다. (B) 전파 매체에서 자란 싹. 플레이트를 새로 고치고 4주 후에 이미지를 촬영했습니다. (C) 응원 매체에 갓 자른 싹. (D) 2주 동안 응원 배지에 배양된 싹. 뿌리의 존재를 기록하십시오. 배율 막대는 2.5cm와 같습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
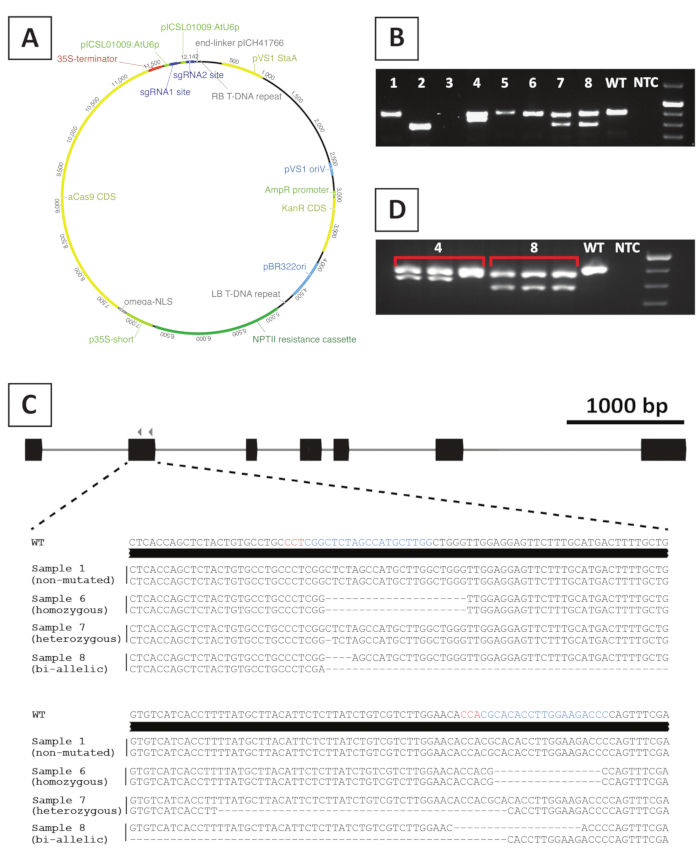
그림 4: P. 앤더슨이 T 0 형질전환 CRISPR/Cas9 돌연변이 선의 유전자 변형 후대표적인 결과. (A) CRISPR/Cas9 매개 돌연변이 발생에 사용되는 이진 벡터의 대표맵. (B) sgRNA 표적 부위에 걸쳐 프라이머를 사용하여 잠재적 CRISPR/Cas9 돌연변이 라인의 PCR 계모 지질 검사 후 대표적인 결과. 도시된 것은 앰플리온의 아가로즈 겔 전기동동후의 이미지이다. 개별 형질전환 선에서 채취한 샘플은 숫자로 표시됩니다. 와일드 타입(WT) 및 템플릿 컨트롤 없음(NTC)은 각각 양수 및 음수 컨트롤을 포함하는 차선을 나타냅니다. (C) CRISPR/Cas9 매개 유전자 편집 후 수득된 돌연변이 대문자의 개략적 표현. 청색 및 적색으로 강조 표시된 것은 각각 sgRNA 표적 사이트 및 PAM 서열이다. (D) 잠재적키메라 돌연변이 라인에 대한 PCR 기반 스크리닝 후 대표적인 결과. 도시된 것은 돌연변이선 4 및 8에서 채취한 3개의 개별 샘플의 아가로즈 겔 전기동동후의 이미지이다. 유전자 변형 돌연변이 라인 4는 키메라입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
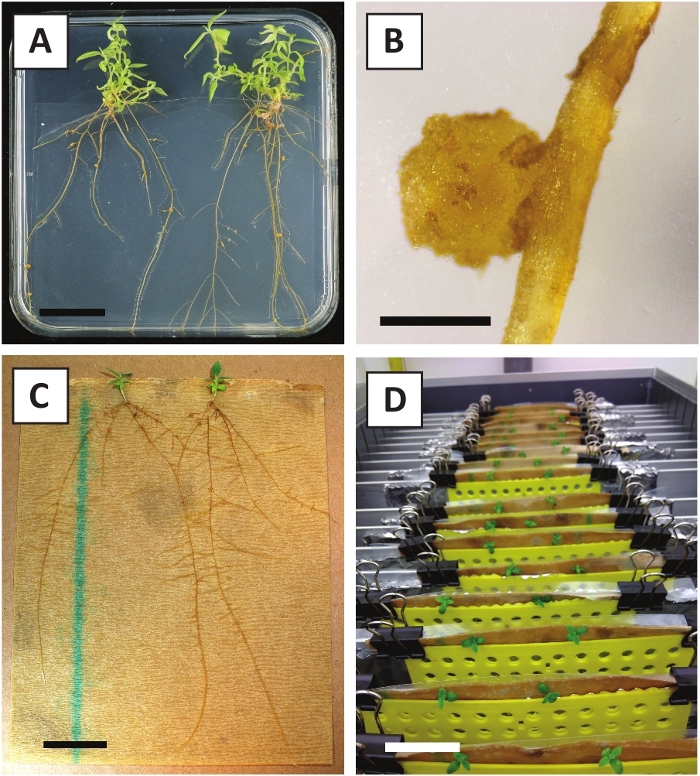
그림 5: 접시와 파우치에 있는 끄덕임 계산의 대표적인 이미지. (A) 한천 고화 EKM 배지를 함유한 플레이트에 고절을 하고 4주 동안 M. 투리파륨 BOR2로 접종하였다. (B) P. 앤더슨이 뿌리 작은 혹의 대표 이미지. 이 이미지는 M. plurifarium BOR2로 4주 후 접종후에서 촬영되었습니다. (C) 액체 EKM 배지가 함유된 파우치에 고음. 모종은 5주 동안 브라디조비움 스프. 켈루드2A4로 접종되었다. (D) 파우치의 고삐에 사용되는 전체 설정의 대표 이미지. 스케일 바는 2.5 cm(A,C),1mm(B) 및 5cm in (D)과 같습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
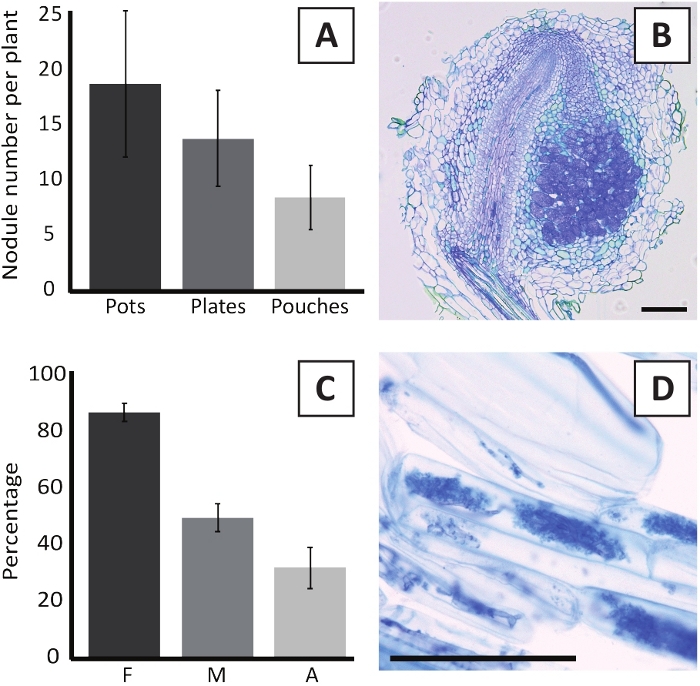
도 6: 고절 및 균질화 검사의 대표적인 결과. (A) 대표적인 바 그래프는 4주 후 식물당 형성된 작은혹의 수를 냄비 나 접시에 M. plurifarium BOR2로 접종하고 5주 후 포치에서 Bradyrhizobium sp. Kelud2A4로 접종한 후. 데이터는 평균 ± SD (n = 10)를 나타냅니다. (B) M. plurifarium BOR2를 가진 접종 후 4주에 형성된 작은혹을 통해 세로 단면도의 대표적인 이미지. 섹션은 토루이딘 블루로 얼룩져 있습니다. (C) 내균의 정량화를 나타내는 대표적인 막대 그래프. Trouvelot et al.29에 따라 정량화된 변수는 F이며, 분석된 뿌리 단편의 빈도는 균질화되는; M, 감염의 강도; A, 전체 루트 시스템에서 성숙한 아부스쿨의 풍부. 균질화는 R. 불규칙성 (변형 DAOM197198)으로 접종 후 6 주에서 정량화되었다. 데이터는 평균 ± SD (n = 10)를 나타냅니다. (D) P. 앤더슨이 뿌리 피질 세포에 존재하는 성숙한 아부큘레스의 대표적인 이미지는 R. 불규칙한접종 후 6 주. 배율 막대는 75 μm에 해당합니다.
| 화합물 | SH-0 | SH-10 | 전파 매체 | 응원 매체 | 침투 매체 |
| SH 기저 염 미수 | 3.2 g | 3.2 g | 3.2 g | 3.2 g | 3.2 g |
| SH-비타민 혼합물 | 1 g | 1 g | 1 g | 1 g | 1 g |
| 자당 | - | 10g | 20 g | 10g | 10g |
| BAP (1 mg /mL) | - | - | 1 mL(4.44 μM) | - | - |
| IBA (1 mg / mL) | - | - | 100 μL (0.49 μM) | 1 mL(4.92 μM) | - |
| NAA (1 mg /mL) | - | - | - | 100 μL (0.54 μM) | - |
| 1 M MES pH=5.8 | 3 mL | 3 mL | 3 mL | 3 mL | 3 mL |
| 1 M KOH | pH를 5.8로 조정 | pH를 5.8로 조정 | pH를 5.8로 조정 | pH를 5.8로 조정 | pH를 5.8로 조정 |
| 다이신 한천 | 8 g | - | 8 g | 8 g | - |
표 1: Schenk-Hildebrandt-기반30개의 매체의 조성은 P. andersonii 모종, 안정한 변형, 및 시험관 내 전파를 성장시키는 데 사용된다. 액체 스톡을 추가하기 전에 고체 화합물을 750 mL의 초순수로 녹입니다. 그 후, 전체 매체를 1L. 준비 BAP, IBA, NAA 주식을 0.1 M KOH로 채우고 -20 oC에 보관하십시오.
| 오토클레이브 전: | ||
| 화합물 | 리터당 양 | 최종 농도 |
| 만놀톨 | 5 g | 27.45 mM |
| 나 글루코네이트 | 5 g | 22.92 mM |
| 효모 추출물 | 0.5 g | - |
| MgSO4·7H2O | 0.2 g | 0.81 mM |
| Nacl | 0.1 g | 1.71 mM |
| K2HPO4 | 0.5 g | 2.87 mM |
| 오토클레이브 후: | ||
| 화합물 | 리터당 양 | 최종 농도 |
| 1.5 M CaCl2 | 1 mL | 1.5 mM |
표 2: 효모-만니톨(YEM) 배지의 조성은 루조비움을 성장시키는 데 사용된다. pH를 7.0으로 조정하고 초순수를 1L로 채웁니다. 한천 응고 YEM 배지를 준비하려면 오토클레이브전에 15g의 마이크로아천을 넣으세요.
| 오토클레이브 전: | |||
| 화합물 | 재고 농도 | 리터 매체당 양 | 최종 농도 |
| KH2PO4 | 0.44 M | 2mL 추가 | 0.88 mM |
| K2HPO4 | 1.03 M | 2mL 추가 | 2.07 mM |
| 500x 마이크로 요소 스톡 솔루션 | - | 2mL 추가 | - |
| MES pH=6.6 | 1 M | 3 mL 추가 | 3 mM |
| Hcl | 1 M | pH를 6.6으로 조정 | - |
| 초순수 | - | 990 mL로 채우기 | - |
| 오토클레이브 후: | |||
| 화합물 | 재고 농도 | 리터 매체당 양 | 최종 농도 |
| MgSO4·7H2O | 1.04 M | 2 mL | 2.08 mM |
| Na2SO4 | 0.35 M | 2 mL | 0.70 mM |
| NH4NO3 | 0.18 M | 2 mL | 0.36 mM |
| CaCl2·2H2O | 0.75 M | 2 mL | 1.5 mM |
| Fe(III)-구연산염 | 27 mM | 2 mL | 54 μM |
표 3: P. 앤더슨이 끄덕이 분석에 사용되는 1L 변형 EKM 배지(31)의 조성. 500x 마이크로 엘리먼트 스톡 솔루션의 조성물은 표 4에 열거되어 있다. 2% 한천 응고 EKM 매체를 준비하려면 오토클레이브 전에 다이신 한천 20g을 추가하십시오. MgSO4·7H 2O, Na2SO4,CaCl2·2H2O및 Fe(III)-구연산염 을 소독한다. 필터 는 NH4NO3 재고 용액을 살균살균합니다.
| 화합물 | 리터당 양 | 재고 농도 |
| MnSO4 | 500 mg | 3.31 mM |
| ZnSO4·7H2O | 125 mg | 0.43 mM |
| CuSO4·5H2O | 125 mg | 0.83 mM |
| H3BO3 | 125 mg | 2.02 mM |
| Na2MoO4·2H2O | 50 mg | 0.21 mM |
표 4: 변형된 EKM 배지를 준비하는 데 사용되는 500x 마이크로 소자 스톡 솔루션의 조성. 마이크로 엘리먼트 스톡 솔루션을 4°C에 보관하십시오.
| 화합물 | 재고 농도 | 리터 매체당 양 | 최종 농도 |
| K2HPO4 | 20 mM | 1 mL | 0.2 mM |
| NH4NO3 | 0.28 M | 10 mL | 2.8 mM |
| MgSO4 | 40 mM | 10 mL | 0.4 mM |
| K2SO4 | 40 mM | 10 mL | 0.4 mM |
| 페(II)-에타 | 9 mM | 10 mL | 0.9 mM |
| CaCl2 | 80 mM | 10 mL | 0.8 mM |
| 50x 마이크로 요소 스톡 솔루션 | - | 10 mL | - |
표 5: 균질화 아세에 사용되는 1/2-Hoagland32 배지의 조성. 50x 마이크로 엘리먼트 스톡 솔루션의 조성물은 표 6에 열거되어 있다. FeSO4·7H 2O(9mM)와 Na2·를 결합하여 Fe(II)-EDTA 용액을 준비한다. EDTA(9 mM)를 1개의 스톡 용액에 넣고 4°C에 보관하십시오. 1M KOH를 사용하여 배지의 pH를 6.1로 조정하고 초순수를 1L로 채웁니다.
| 화합물 | 리터당 양 | 재고 농도 |
| H3BO3 | 71.1 mg | 1.15 mM |
| MnCl2·4H2O | 44.5 mg | 0.22 mM |
| CuSO4·5H2O | 3.7 mg | 23.18 μM |
| ZnCl2 | 10.2 mg | 74.84 μM |
| Na2MoO4·2H2O | 1.2 mg | 4.96 μM |
표 6: 1/2-Hoagland 배지를 준비하는 데 사용되는 50x 마이크로 원소 스톡 용액의 조성.
| 이식의 나이 | 혁신 효율성 |
| 젊은 | 69.4 ± 6.2% (n = 2) |
| 중장 년 | 18.3 ± 10.2% (n = 15) |
표 7: P. 앤더슨의변환 효율 . 여기서, 변형 효율은 적어도 1개의 형질전환 캘러스 또는 촬영을 형성하는 이식의 백분율로 정의된다. 변환 효율은 6주 후 변환에서 점수를 매겨졌으며 평균 ±SD. n은 변형 효율이 결정된 변형 실험의 수를 나타낸다.
보충 파일 1: CRISPR/Cas9 돌연변이 발생에 사용되는 레벨 1 및 레벨 2 구성의 개요. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
콩과 식물과 먼 관련 칸나바세아 속 Parasponia질소 고정 뿌리 줄기와 내인 대 관계를 설정할 수 있는 식물 종의 유일한 두 clades를 나타냅니다 및 루트 작은 혹을 형성. 두 clades의 종 사이 비교 연구 는 이 공생을 허용하는 핵심 유전 네트워크에 통찰력을 제공하기 위하여 높게 관련있습니다. 현재, 유전 연구는 주로 콩과 식물에서 이루어집니다. 특히 두 가지 모델 종 M. 트렁카툴라와 L. japonicus. 추가 실험 플랫폼을 제공하고 비 콩과 함께 비교 연구를 용이하게하기 위해, 우리는 P. andersonii에서안정적인 변환 및 역유전 분석을위한 자세한 프로토콜을 여기에 설명합니다. 제시된 프로토콜은 T0 형질전환 P. 앤더슨이 라인의 시험관 내 전파를 사용하여 A. tumefaciens 공동 재배 후 4 개월 이내에 표현형 분석을 시작할 수 있습니다. 이는 콩류(33)의 안정적인 변형을 위해 확립된현재 프로토콜보다 실질적으로 빠르다. 이것은 P. 앤더슨이 매력적인 연구 모델을 만든다.
여기에 설명된 프로토콜에는 몇 가지 중요한 단계가 포함되어 있습니다. 첫 번째는 종자 발아와 관련이 있습니다. 발아를 위한 P. andersonii 씨앗을 준비하려면 씨앗을 열매에서 분리해야합니다. 이것은 티슈 페이퍼 또는 차 체 의 내부에 열매를 문지르는 것으로 수행됩니다. 이 절차는 종자 코트의 손상을 방지하기 위해 부드럽게 수행되어야합니다. 종자 털이 손상되면 표백제가 멸균 중에 씨앗에 들어갈 수 있어 종자 생존가능성이 줄어듭니다. 종자 휴면을 깰, 씨앗은 10 일 온도 주기를 실시한다. 그러나,이 치료에도 불구하고 발아는 완전히 동기화되지 않습니다. 일반적으로, 첫 번째 씨앗 후 복사 출현을 보여 7 일, 하지만 다른 발아 하는 데 몇 일 이상 걸릴 수 있습니다.
변환 절차의 임계점은 시작 물질의 선택과 공동 재배 단계의 지속 기간에 관한 것입니다. 효율적인 변환에 도달하기 위해, 그것은 시작 재료로 비 살균 온실 재배 식물의 건강하고 젊은 줄기 또는 petioles를 사용하는 것이 가장 좋습니다. 젊은 가지의 성장을 유도하기 위해, 파라스포니아 나무를 2-3 개월마다 손질하고 일년에 한 번 나무를 새로 고치는 것이 좋습니다. 또한 공동 재배 단계는 2 일 동안만 수행해야합니다. 장기간 공동 재배는 A. tumefaciens에 의해 조직 이식의 과잉 식민지를 촉진하고 일반적으로 변환 효율을 감소시킨다. A. tumefaciens에 의해 과잉 식민지를 방지 하기 위해 그것은 또한 정기적으로 이식 재배 하는 판을 새로 고침 하는 것이 중요 하다. 과잉 식민지가 발생하는 경우, 조직 이식은 씻어 수 (섹션 3.8 참조) A. tumefaciens 세포를 제거하기 위해. 세척에 사용되는 SH-10 용액에 표백제를 첨가하는 것이 좋습니다 (최종 농도 : ~ 2 % 하이포 염화산). 이 추가 세척 단계는 심하게 감염된 이식(그림 2B)에서작동하지 않을 수 있다는 점에 유의해야 합니다. CRISPR/Cas9 구성을 가진 변환이 제한된 수의 putatively 형질전환 된 싹을 산출하거나 특정 유전자의 돌연변이 발생이 재생에 문제를 일으킬 것으로 예상되는 경우, 빈 벡터 제어 구조를 포함하는 것이 좋습니다. 긍정적 인 제어. 마지막으로, 선택된 모든 형질전환 라인이 독립적인 T-DNA 통합 이벤트에서 발생하도록 하는 것이 중요합니다. 따라서, 우리는 이식의 각 측면에서 단 하나의 putatively-transgenic 촬영을 지시합니다. 그러나 이렇게 하면 잠재적인 회선이 줄어듭니다. 많은 라인이 요구되는 경우에, 연구원은 이 캘리 가 니 (≥2 mm)의 크기와 배양이 칼리를 독립적으로 배양 할 때 원래 의 외식에서 putatively 변형 된 칼리를 분리하기로 결정할 수 있습니다. 이러한 방식으로, 여러 라인은 잠재적 인 형질 전환 라인의 수를 제기 각 배양에서 분리 될 수있다.
현재 프로토콜에서, P. andersonii의 형질 전환 라인은 시험관 내 전파를 통해 식물적으로 전파된다. 이것의 장점은 많은 형질전환 식물이 비교적 짧은 기간에 생성될 수 있다는 것이다. 그러나 이 방법에는 몇 가지 제한 사항이 있습니다. 첫째, 시험관 내 전파를 통한 T0 형질전환라인의 유지는 노동집약적이며 원치 않는 유전적 또는 후생유전학적 변화를 초래할 수 있다34,35. 둘째, T0 라인은 여전히 항생제 내성 카세트를 포함하는 T-DNA의 사본을 함유한다. 이렇게 하면 각 재변환에 대해 서로 다른 선택 마커가 필요하므로 가능한 재변환 횟수가 제한됩니다. 현재, 우리는 카나마이신 또는 히그로 마이신 선택을 사용하여 변형을 테스트했습니다 (데이터는 표시되지 않음). 더욱이, T0 형질전환 선에 있는 Cas9 인코딩 서열 및 sgRNAs의 존재는 보완 연구 결과를 복잡하게 합니다. 상보성 공산학은 가능하지만 sgRNA 표적 부위(들)가 보체화 구조의 유전자 편집이 방지되도록 돌연변이되어야 한다. 셋째, T0 라인으로 작업의 단점은 CRISPR / Cas9 돌연변이가 키메라 될 수 있다는 것입니다. 키메라 돌연변이 선의 표현형 분석을 방지하기 위해, 우리는 적어도 3 개의 다른 싹에 시험관 내 전파 후 지질 형질 분석반복하는 것이 좋습니다. 여기에 기재된 프로토콜을 사용하여 수득된 키메라 돌연변이체의 수는 제한적이지만, 이들은 때때로10을관찰한다. T0 라인작업의 한계를 극복하기 위해 P. andersonii 돌연변이 선은 생성적으로 전파될 수 있습니다. P. 앤더슨 나무는 디오이와 바람 수분2. 이것은 각 형질전환 선이 남성과 여성의 꽃이 한 개인에 생성되도록 조작될 필요가 있고, 이후에 교차 수분이 일어나지 않는 것과 같이 성장한다는 것을 의미합니다. P. andersonii는 빠르게 성장하는 나무이므로 열대 온실에서 상당한 양의 공간이 필요합니다 (28 °C, ~ 85 % 상대 습도). 따라서 기술적으로 가능하지만 P. andersonii 형질전환 라인의 생성 전파는 물류적으로 어렵습니다.
프로토콜 섹션에서, 우리는 P. 앤더슨의절제에 대한 3 가지 방법을 설명 . 플레이트와 파우치 시스템의 장점은 뿌리가 쉽게 접근 할 수 있다는 것입니다, 이는 박테리아의 반점 접종을 허용하고 시간이 지남에 따라 다음 적두 형성을 할 수있다. 그러나, 플레이트 시스템은 매우 노동 집약적, 대규모 끄덕임 실험에 덜 적합하게. 파우치 시스템의 단점은 곰팡이 오염을 방지하기가 어렵다는 것입니다. 파우치는 멸균되지 않으므로 주머니의 위쪽 절반에서 곰팡이 성장이 종종 관찰됩니다. 그러나, 이것은 P. andersonii 성장에 영향을 미치지 않으며, 그러므로 끄덕인 asays를 방해하지 않습니다. 또한 파우치 시스템은 모종에만 적합합니다. 여러 시도에도 불구 하 고, 우리는 파우치에 체 외 전파를 통해 얻은 식물을 성장 수 없습니다.
여기에 기술된 P. andersonii 역유전학 파이프라인은 기존 A. 근성 계근형변환 방법(11)에 비해 상당한 개선을 제공한다. 기재된 절차를 사용하여, 안정적인 형질전환 라인을 효율적으로 생성할 수 있고 시험관 내 전파를 통해 유지될 수 있다. 대조적으로, A. 뿌리 줄기 변환은 일시적이며 형질전환 뿌리의 형성만을 초래합니다. 각 형질전환 뿌리는 독립적인 형질전환에서 유래하기 때문에, A. 근위계 형질전환계 분석제는 실질적인 현상기 변화때문에 손해를 입는다. 이 변화는 시험관 내 전파도 변화의 어떤 수준을 생성하지만, 안정적인 라인의 경우 훨씬 적습니다. 이 감소된 변이 및 다중 식물이 각 안정한 선에 대해 표현될 수 있다는 사실 때문에, 안정된 선은 A. rhizogenes-형질전환된 뿌리에 비해 정량적 분석에 더 적합합니다. 부가적으로, 안정한 형질전환은 내인성 호르몬 균형에 영향을 미치는 궤적(rol)을 유도하는 A. 뿌리줄기(rol)의 도입에 의존하지 않는다15. 따라서, 안정한 선은 A. 뿌리줄기-형질전환된 뿌리에 비해 호르몬 항상성에 관여하는 유전자의 역유전적 분석에 더 적합하다. 연구 모델로서 P. andersonii의 더 일반적인 이점은 최근 전체 게놈 중복 (WGD)을 경험하지 않았다는 것입니다. 모델 콩류 를 포함하는 콩과 식물 파필리오노마데아제 서브 패밀리 M. 트렁카툴라 와 L. japonicus,뿐만 아니라 모델 트리포러스 트리코카르파 경험 WGDs ~ 65를 포함하는 살리카과 (주문 말피기알레스) 백만 년 전36,37. 이러한 WGDs에서 유래 하는 많은 paralogous 유전자 복사본 M. truncatula의게놈에 유지 됩니다., L. japonicus 와 P. trichocarpa37,38,39,생성 역유전분석을 복잡하게 할 수 있는 중복성. P. 앤더슨은 최근 WGD를 경험하지 않았기 때문에, P. andersonii에 역 유전 분석은 paralogous 유전자 사본의 중복 기능에 의해 덜 영향을 받을 수 있습니다.
종합하면, 우리는 P. andersonii에서역유전 분석을위한 상세한 프로토콜을 제공합니다. 이 프로토콜을 사용하여, 단일 돌연변이 라인은 2-3 개월10의기간 내에 효율적으로 생성 될 수있다. 이 프로토콜은 다른 식물 종40,41,42에도시된 바와 같이 동시에 다른 유전자를 표적화하는 sgRNAs의 다중화를 통해 더 높은 차수돌연변이를 생성하도록 확장될 수 있다. 추가적으로, 여기에서 기술된 안정한 변환 절차는 CRISPR/Cas9 유전자 표적화에 한정되지 않습니다 그러나 또한 구조물의 그밖 모형을 소개하기 위하여 이용될 수 있었습니다 (예를 들면, 프로모터 리포터 assays, 자궁 외 발현 또는 trans를 위해- 보완)을 참조하십시오. 우리는 질소 고정 뿌리 줄기 또는 내분근 성 균류와 상호 공생을 연구하는 비교 연구 모델로 P. andersonii를 설립했다. 그러나, 여기에 설명 된 프로토콜은 또한 이 열대 나무의 생물학의 다른 측면을 연구하는 도구를 제공합니다, 이러한 나무 형성등, 이중 성적 꽃의 개발 또는 칸 나베아 과 특정 보조 대사 산물의 생합성.
공개
저자는 공개 할 것이 없다.
감사의 말
저자는 애드진 데이터베이스를 통해 골든 게이트 복제 부품을 사용할 수 있도록 마크 유레스, 소피엔 카문과 실베스트레 마릴론넷을 인정하고 싶어. 또한, 우리는 이 제임스, P. 하도바, 그리고 P. J. 히겐스 P. 앤더슨이 씨앗에 감사드립니다. 이 작품은 과학 연구를위한 네덜란드 기구에 의해 지원되었다 (NWO-VICI 교부금 865.13.001; NWO-오픈 공모전 은 819.01.007) 및 인도네시아 공화국의 연구, 기술 및 고등 교육부 (RISET-PRO 보조금 8245-ID).
자료
| Name | Company | Catalog Number | Comments |
| Sigma-Aldrich | N0640 | NAA | |
| Duchefa Biochemie | M1503.0250 | MES | |
| Sigma-Aldrich | D134406 | Acetosyringone | |
| Duchefa Biochemie | X1402.1000 | X-Gal | |
| Merck | 101236 | For nucleic acid electrophoresis gel | |
| - | - | Pouches box material, hangers | |
| Merck | 101188 | NH4NO3 | |
| Sigma-Aldrich | B3408-1G | BAP | |
| Merck | 100156 | H3BO3 | |
| Thermo-Fisher | ER1011 | Used as restriction enzyme in Golden Gate cloning assembly | |
| Thermo-Fisher | 15561020 | Used in Golden Gate cloning assembly | |
| Merck | 137101 | CaCl2·2H2O | |
| Duchefa Biochemie | C0111.0025 | C16H16N5O7S2Na | |
| Thermo-Fisher | K1231 | Used for cloning the blunt-ended PCR amplicons in genotyping procedure | |
| Agronutrition | AP2011 | Containing Rhizophagus irregularis DAOM 197198 (1,000 spores/mL), used for mychorrization assay | |
| Merck | 102790 | CuSO4·5H2O | |
| Duchefa Biochemie | D1004.1000 | Used for plant tissue culture agar-based medium | |
| Merck | 105101 | K2HPO4 | |
| VWR Chemicals | 20302.293 | Na2·EDTA | |
| Duchefa Biochemie | M0803.1000 | C6H14O6 | |
| Thermo-Fisher | ER0291 | Used as restriction enzyme in Golden Gate cloning assembly | |
| Merck | 100983 | C2H5OH | |
| VWR Chemicals | BDH9232-500G | EDTA | |
| Sigma-Aldrich | Z377600-1PAK | Cellophane membrane | |
| Biomatters, Ltd. | R9 or higher | Bioinformatics software for in silico cloning and designing of sgRNAs | |
| Mega International | - | Technical information at https://mega-international.com/tech-info/ | |
| Sigma-Aldrich | 65882 | Used for fixating nodule tissues | |
| VWR Chemicals | 24385.295 | - | |
| Vink | 219341 | Pouches box material, bottom part | |
| Leica Biosystems | 14702218311 | Used as a template for plastic embedding | |
| Merck | 100317 | HCl | |
| Sigma-Aldrich | I5386-1G | IBA | |
| Merck | 103862 | C6H5FeO7 | |
| Merck | 103965 | FeSO4O·7H2O | |
| Duchefa Biochemie | I1401.0005 | IPTG | |
| Duchefa Biochemie | K0126.0010 | ||
| Sigma-Aldrich | L2000 | ||
| Merck | 105886 | MgSO4O·7H2O | |
| Merck | 105934 | MnCl2·4H2O | |
| Merck | 102786 | MnSO4O | |
| Duchefa Biochemie | M1002.1000 | Used for bacterial culture agar-based medium | |
| Manutan | 92007687 | Pouches material | |
| Paraxisdienst | 130774 | Elastic sealing foil | |
| Pull Rhenen | Agra-Perlite No.3 | Used as growing substrate in pots for nodulation assay | |
| VWR Chemicals | 391-0581 | Used as container for cellophane membranes | |
| Thermo-Fisher | F130WH | For genotyping transgenic lines | |
| Addgene | 50337 | Level 0 terminator, 3'UTR, 35s (Cauliflower Mosaic Virus) | |
| Addgene | 48017 | End-link 2 for assembling 2 level one part into a level 2 acceptor | |
| Addgene | 48018 | End-link 3 for assembling 3 level one part into a level 2 acceptor | |
| Addgene | 48001 | Level 1 acceptor. Position 5. Forward orientation | |
| Addgene | 48007 | Level 1 Acceptor. Position 1. Reverse orientation | |
| Addgene | 50268 | Level 0 promoter (0.4 kb), 35s (Cauliflower Mosaic Virus) + 5'UTR, Ω (Tobacco Mosaic Virus) | |
| Addgene | 46966 | Used for designing CRISPR/Cas9 module | |
| Addgene | 46968 | Used for designing CRISPR/Cas9 module | |
| Addgene | 50334 | Level 0 Kanamycin/Neomycin/Paromomycin resistance cassette | |
| Topzeven | - | Used as filters for washing spore suspension | |
| Sigma-Aldrich | 8.17003 | PEG400 | |
| Duchefa Biochemie | E1674.0001 | Pots to grow Parasponia plantlets/seedlings | |
| Merck | 104871 | KH2PO4 | |
| Merck | 105033 | KOH | |
| Merck | 105153 | K2SO4O | |
| Van Leusden b.v. | - | Used as growing substrate for mychorrhization assay | |
| Duchefa Biochemie | S0225.0050 | SH-basal salt medium | |
| Duchefa Biochemie | S0411.0250 | SH-vitamin mixture | |
| Lehle Seeds | VIS-02 | Used as non-ionic surfactant in the washing step of stable transformation | |
| Merck | 137017 | NaCl | |
| VWR Chemicals | 89230-072 | C6H11NaO7 | |
| Merck | 106521 | Na2MoO4·2H2O | |
| Merck | 106574 | Na2HPO4·7H2O | |
| Merck | 567549 | NaH2PO4·H2O | |
| Sigma-Aldrich | 239313 | Na2SO4O | |
| Duchefa Biochemie | S0809.5000 | C12H22O11 | |
| Thermo-Fisher | B69 | Used in Golden Gate cloning assembly | |
| Thermo-Fisher | EL0013 | Used in Golden Gate cloning assembly | |
| Kulzer-Mitsui Chemicals Group | 64708806 | Methyl methacrylate-based resin powder | |
| Kulzer-Mitsui Chemicals Group | 64709003 | HEMA (2-hydroxyethyl methacrylate)-based resin solution | |
| Kulzer-Mitsui Chemicals Group | 66022678 | Methyl methacrylate-based resin solution | |
| Merck | 1159300025 | ||
| Acros | 189350250 | ||
| VWR Chemicals | 663684B | Polysorbate 20 | |
| Stout Perspex | - | pouches box material, lid | |
| Duchefa Biochemie | Y1333.1000 | ||
| Merck | 108816 | ZnCl2 | |
| Alfa Aesar | 33399 | ZnSO4O·7H2O |
참고문헌
- Clason, E. W. THE VEGETATION OF THE UPPER-BADAK REGION OF MOUNT KELUT (EAST JAVA). Bulletin du Jardin Botanique de Buitenzorg. Serie III, 509-518 (1936).
- Soepadmo, E. Ulmaceae. Flora Malesiana-Series 1, Spermatophyta. 8, 31-76 (1974).
- Becking, J. H. The Rhizobium symbiosis of the nonlegume Parasponia. Biological Nitrogen Fixation. , 497-559 (1992).
- Oldroyd, G. E. D. Speak, friend, and enter: signalling systems that promote beneficial symbiotic associations in plants. Nature Reviews Microbiology. 11, 252-263 (2013).
- Gutjahr, C., Parniske, M. Cell and developmental biology of arbuscular mycorrhiza symbiosis. Annual Review of Cell and Developmental Biology. 29, 593-617 (2013).
- van Velzen, R., et al. Comparative genomics of the nonlegume Parasponia reveals insights into evolution of nitrogen-fixing rhizobium symbioses. Proceedings of the National Academy of Sciences of the United States of America. 115, E4700-E4709 (2018).
- van Velzen, R., Doyle, J. J., Geurts, R. A Resurrected Scenario: Single Gain and Massive Loss of Nitrogen-Fixing Nodulation. Trends in Plant Science. 24, 49-57 (2019).
- Griesmann, M., et al. Phylogenomics reveals multiple losses of the nitrogen-fixing root nodule symbiosis. Science. 1743, eaat1743 (2018).
- Becking, J. H. Root-Nodule Symbiosis Between Rhizobium And Parasponia (Ulmaceae). Plant and Soil. 51, 289-296 (1979).
- van Zeijl, A., et al. CRISPR/Cas9-Mediated Mutagenesis of Four Putative Symbiosis Genes of the Tropical Tree Parasponia andersonii Reveals Novel Phenotypes. Frontiers in Plant Science. 9, 284 (2018).
- Cao, Q., et al. Efficiency of Agrobacterium rhizogenes–mediated root transformation of Parasponia and Trema is temperature dependent. Plant Growth Regulation. 68, 459-465 (2012).
- Limpens, E., et al. RNA interference in Agrobacterium rhizogenes-transformed roots of Arabidopsis and Medicago truncatula. Journal of Experimental Botany. 55, 983-992 (2004).
- Boisson-Dernier, A., et al. Agrobacterium rhizogenes-Transformed Roots of Medicago truncatula for the Study of Nitrogen-Fixing and Endomycorrhizal Symbiotic Associations. Molecular Plant-Microbe Interactions. 14, 695-700 (2001).
- Kumagai, H., Kouchi, H. Gene Silencing by Expression of Hairpin RNA in Lotus japonicus Roots and Root Nodules. Molecular Plant-Microbe Interactions. 16, 663-668 (2003).
- Nilsson, O., Olsson, O. Getting to the root: The role of the Agrobacterium rhizogenes rol genes in the formation of hairy roots. Physiologia Plantarum. 100, 463-473 (1997).
- Davey, M. R., et al. Effective Nodulation of Micro-Propagated Shoots of the Non-Legume Parasponia andersonii by Bradyrhizobium. Journal of Experimental Botany. 44, 863-867 (1993).
- Webster, G., Poulton, P. R., Cocking, E. C., Davey, M. R. The nodulation of micro-propagated plants of Parasponia andersonii by tropical legume rhizobia. Journal of Experimental Botany. 46, 1131-1137 (1995).
- Op den Camp, R., et al. LysM-type mycorrhizal receptor recruited for rhizobium symbiosis in nonlegume Parasponia. Science. 331, 909-912 (2011).
- Weber, E., Engler, C., Gruetzner, R., Werner, S., Marillonnet, S. A Modular Cloning System for Standardized Assembly of Multigene Constructs. PLOS ONE. 6, e16765 (2011).
- Nekrasov, V., Staskawicz, B. J., Weigel, D., Jones, J. D. G., Kamoun, S. Targeted mutagenesis in the model plant Nicotiana benthamiana using Cas9 RNA-guided endonuclease. Nature Biotechnology. 31, 691-693 (2013).
- Bertani, G. Studies On Lysogenesis. I. The Mode Of Phage Liberation By Lysogenic Escherichia Coli. Journal of Bacteriology. 62, 293-300 (1951).
- Engler, C., et al. A Golden Gate modular cloning toolbox for plants. ACS Synthetic Biology. 3, 839-843 (2014).
- Fauser, F., Schiml, S., Puchta, H. Both CRISPR/Cas-based nucleases and nickases can be used efficiently for genome engineering in Arabidopsis thaliana. The Plant Journal. 79, 348-359 (2014).
- Lazo, G. R., Stein, P. A., Ludwig, R. A. A DNA Transformation-Competent Arabidopsis Genomic Library in Agrobacterium. Biotechnology. 9, 963-967 (1991).
- Op den Camp, R. H. M., et al. N Nonlegume Parasponia andersonii Deploys A Broad Rhizobium Host Range Strategy Resulting in Largely Variable Symbiotic Effectivenes. Molecular Plant-Microbe Interactions. 25, 954-963 (2012).
- Graham, P. H., Viteri, S. E., Mackie, F., Vargas, A. T., Palacios, A. Variation in acid soil tolerance among strains of Rhizobium phaseoli. Field Crops Research. 5, 121-128 (1982).
- Martinez-Romero, E., et al. Rhizobium tropici, A Novel Species Nodulating Phaseolus vulgaris L. Beans and Leucaena sp. Trees. International Journal of Systematic and Evolutionary Microbiology. 41, 417-421 (1991).
- Felten, J., et al. The Ectomycorrhizal Fungus Laccaria bicolor Stimulates Lateral Root Formation in Poplar and Arabidopsis through Auxin Transport and Signaling. Plant Physiology. 151, 1991-2005 (1991).
- Trouvelot, A., Kough, J. L., Gianinazzi-Pearson, V. Mesure du taux de mycorhization VA d’un systeme radiculaire. Recherche de methods d’estimation ayant une signification fonctionnelle. Aspects Physiologiques et Genetiques des Mycorhizes. , 217-221 (1986).
- Schenk, R. U., Hildebrandt, A. C. Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures. Canadian Journal of Botany. 50, 199-204 (1972).
- Becking, J. H. The Parasponia parviflora - Rhizobium symbiosis. Host specificity, growth and nitrogen fixation under various conditions. Plant and Soil. 75, 309-342 (1983).
- Hoagland, D. R., Arnon Revised, D. I., Arnon, D. I. The Water-Culture Method for Growing Plants without Soil. Circular California Agricultural Experiment Station. 347, 1-32 (1950).
- Wang, K. . Methods in Molecular Biology: Agrobacterium Protocols. 1, (2015).
- Smulders, M. J. M., de Klerk, G. J. Epigenetics in plant tissue culture. Plant Growth Regulation. 63, 137-146 (2011).
- Larkin, P. J., Scowcroft, W. R. Somaclonal variation — a novel source of variability from cell cultures for plant improvement. Theoretical and Applied Genetics. 60, 197-214 (1981).
- Cannon, S. B., et al. Legume genome evolution viewed through the Medicago truncatula and Lotus japonicus genomes. Proceedings of the National Academy of Sciences of the United States of America. 103, 14959-14964 (2006).
- Tuskan, G. A., et al. The Genome of Black Cottonwood, Populus trichocarpa (Torr. & Gray). Science. 313, 1596-1604 (2006).
- Young, N. D., et al. The Medicago genome provides insight into the evolution of rhizobial symbioses. Nature. 480, 520 (2011).
- Sato, S., et al. Genome Structure of the Legume, Lotus japonicus. DNA Research. 15, 227-239 (2008).
- Xing, H. L., et al. A CRISPR/Cas9 toolkit for multiplex genome editing in plants. BMC Plant Biology. 14, 327 (2014).
- Lowder, L. G., et al. A CRISPR/Cas9 Toolbox for Multiplexed Plant Genome Editing and Transcriptional Regulation. Plant Physiology. 169, 971 (2015).
- van Zeijl, A. . Dissecting Hormonal Pathways in Nitrogen-Fixing Rhizobium Symbioses. , (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유