Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Preparación de muestras en Mediciones de microbalance de cristal de cuarzo de adsorción de proteínas y mecánica de polímeros
En este artículo
Resumen
El microbalance de cristal de cuarzo puede proporcionar propiedades precisas de masa y viscoelástica para películas en el rango de micras o submicrones, lo que es relevante para investigaciones en detección biomédica y ambiental, recubrimientos y ciencia de polímeros. El espesor de la muestra influye en qué información se puede obtener del material en contacto con el sensor.
Resumen
En este estudio, presentamos varios ejemplos de cómo la preparación de película delgada para experimentos de microbalanza de cristal de cuarzo informa el modelado adecuado de los datos y determina qué propiedades de la película se pueden cuantificar. El microbalance de cristal de cuarzo ofrece una plataforma únicamente sensible para medir los cambios finos en las propiedades mecánicas y/o de masa de una película aplicada observando los cambios en la resonancia mecánica de un cristal de cuarzo que oscila a alta frecuencia. Las ventajas de este enfoque incluyen su versatilidad experimental, la capacidad de estudiar los cambios en las propiedades en una amplia gama de longitudes de tiempo experimentales y el uso de pequeños tamaños de muestra. Demostramos que, en base al espesor y el módulo de cizallamiento de la capa depositada en el sensor, podemos adquirir información diferente del material. Aquí, este concepto se explota específicamente para mostrar parámetros experimentales que resultan en cálculos de masa y viscoelástica de colágeno adsorbida en complejos de oro y polielectrolitos durante la hinchazón en función de la concentración de sal.
Introducción
El microbalance de cristal de cuarzo (QCM) aprovecha el efecto piezoeléctrico de un cristal de cuarzo para controlar su frecuencia resonante, que depende de la masa adherida a la superficie. La técnica compara la frecuencia resonante y el ancho de banda de un sensor de cristal de cuarzo cortado AT (normalmente en el rango de 5 MHz)1 en aire o un fluido con la frecuencia y el ancho de banda del sensor después de la deposición de una película. Hay varios beneficios para el uso del QCM para estudiar las propiedades e interfaces de película delgada, incluyendo la alta sensibilidad a la masa y potencialmente a los cambios de propiedad viscoelástica (dependiendo de la uniformidad y el grosor de la muestra), la capacidad de realizar estudios en el lugar2,y la capacidad de sondear una escala de tiempo reológica mucho más corta que la reología de cizallamiento tradicional o el análisis mecánico dinámico (DMA). Sondear una escala temporal reológica corta permite la observación de cómo la respuesta en este intervalo de tiempo cambia tanto en tiempos extremadamente cortos (ms)3 y largas (años) duraciones4. Esta capacidad es beneficiosa para el estudio de una variedad de procesos cinéticos y también es una extensión útil de las técnicas reométricas tradicionales5,6.
La alta sensibilidad del QCM también ha llevado a su uso intensivo en aplicaciones biológicas que estudian las interacciones fundamentales de biomoléculas extremadamente pequeñas. Una superficie de sensor no recubierta o funcionalizada se puede utilizar para investigar la adsorción de proteínas; aún más, el bioensión a través de eventos de unión complejos entre enzimas, anticuerpos y aptámeros se puede examinar en función de los cambios en la masa7,8,9. Por ejemplo, la técnica se ha utilizado para entender la transformación de las vesículas a una bicapa lipídica plana como un proceso bifásico bifásico de adsorción de vesículas que contienen líquidos a una estructura rígida observando cambios correlacionados en la frecuencia y la viscoelasticidad10. En los últimos años, el QCM ha ofrecido además una plataforma robusta para monitorear la administración de fármacos por vesículas o nanopartículas11. En la intersección de la ingeniería de materiales y la biología molecular y celular, podemos utilizar el QCM para dilucidar interacciones clave entre materiales y componentes bioactivos como proteínas, ácidos nucleicos, liposomas y células. Por ejemplo, la adsorción de proteínas a un biomaterial media respuestas celulares aguas abajo como la inflamación y a menudo se utiliza como un indicador positivo de biocompatibilidad, mientras que en otros casos la unión de proteína extracelular a recubrimientos que interactúan con la sangre podría inducir coagulación peligrosa en los vasos12,13. Por lo tanto, el QCM se puede utilizar como una herramienta para seleccionar candidatos óptimos para diferentes necesidades.
Dos enfoques comunes para realizar experimentos qCM recopilan datos análogos del experimento: el primer enfoque registra el cambio de frecuencia y la mitad del ancho de banda() del pico de conductividad. El segundo enfoque, QCM con disipación (QCM-D), registra el cambio de frecuencia y el factor de disipación, que es directamente proporcional a la ecuación 1,14
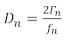 (1)
(1)
donde D es el factor de disipación y es la frecuencia. Tanto D como é están relacionados con el efecto de amortiguación que la película tiene en el sensor, lo que indica la rigidez de la película. El subíndice n denota el armónico o armónico de frecuencia, que son las frecuencias resonantes impares del sensor de cuarzo (n a 1, 3, 5, 7...). Más discusión de modelos utilizando múltiples armónicos para obtener la masa y las propiedades viscoelásticas de una película se puede encontrar en una revisión de Johannsmann14 y documentos anteriores del grupo Shull15,16,17,18.
Una consideración clave para preparar muestras QCM es cómo aplicar la película delgada en la superficie del sensor. Algunos métodos comunes incluyen recubrimiento de espín, recubrimiento por inmersión, recubrimiento de gotas o adsorción de la película en la superficie del sensor durante el experimento19,20. Hay cuatro regiones para las muestras qCM: el límite de Sauerbrey, el régimen viscoelástico, el régimen a granel y el régimen sobreamplificado. Para películas suficientemente delgadas, se aplica el límite de Sauerbrey, donde el cambio de frecuencia(o)proporciona la densidad de masa de la superficie de la película. Dentro del límite de Sauerbrey, las escalas de cambio de frecuencia linealmente con el armónico resonante, n, y los cambios en el factor de amortiguación (D o )son generalmente pequeños. En este régimen no se dispone de suficiente información para determinar de forma exclusiva las propiedades reológicas de la capa sin hacer suposiciones adicionales. Los datos de este régimen se utilizan para calcular la densidad de masa superficial (o el grosor si la densidad se conoce a priori)de la película. En el régimen a granel en el que el medio en contacto con el cristal es lo suficientemente grueso, la onda cortante evanescente se propaga en el medio antes de ser completamente amortiguada. Aquí, no se puede obtener ninguna información de masa utilizando. Sin embargo, en esta región, las propiedades de viscoelástica se determinan de forma fiable utilizando la combinación delos números 15,18. En el régimen a granel, si el medio es demasiado rígido, la película amortiguará la resonancia del sensor, evitando la recopilación de datos fiables del QCM. El régimen viscoelástico es el régimen intermedio donde la película es lo suficientemente delgada como para que la onda cortante se propague completamente a través de la película, así como para tener valores fiables para el factor de amortiguación. A continuación, se puede utilizar el factor de amortiguación yel factor de amortiguación para determinar las propiedades viscoelásticas de la película, así como su masa. Aquí, las propiedades viscoelásticas son dadas por el producto de la densidad y la magnitud del módulo de cizallamiento complejo . G* p y el ángulo de fase dado por el valor de arctan(G" / G'). Cuando las películas se preparan en el límite de Sauerbrey, la masa por unidad de área se puede calcular directamente sobre la base de la ecuación de Sauerbrey que se muestra a continuación21,
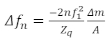 (2)
(2)
Donde el n es el cambio en la frecuencia resonante, n es el tono de interés, 1es la frecuencia resonante del sensor,m / A es la masa por área de la película, y Zq es la impedancia acústica del cuarzo, que para el cuarzo cortado AT es Zq a 8,84 x 106kg / m2s. El régimen viscoelástico es más adecuado para el estudio de películas poliméricas, y el límite a granel es útil para el estudio de polímero viscoso22 o soluciones proteicas16. Los diferentes regímenes dependen de las propiedades del material de interés, con el espesor óptimo para la caracterización viscoelástica completa y de masa sin aumentar generalmente con la rigidez de la película. La Figura 1 describe las cuatro regiones con respecto a la densidad areal de la película, el módulo de cizallamiento complejo y el ángulo de fase, donde hemos asumido una relación específica entre el ángulo de fase y la rigidez de la película que se ha demostrado que es relevante para los materiales de este tipo. Muchas películas de interés práctico son demasiado gruesas para estudiar las propiedades viscoelásticas con QCM, como ciertas biopelículas, donde los espesores están en el orden de decenas a cientos de micras23. Estas películas gruesas generalmente no son apropiadas para estudiar usando el QCM, pero pueden medirse usando resonadores de frecuencia mucho más baja (como resonadores torsionales)23,permitiendo que la onda cortante se propague aún más en la película.
Para determinar qué régimen es relevante para una muestra QCM determinada, es importante entender el parámetro d /n, que es la relación entre el espesor de la película (d) y la longitud de onda de cizallamiento de la oscilación mecánica del sensor de cristal de cuarzo(n)15,16,18. El régimen viscoelástico ideal es d /n á 0,05 - 0,218, donde los valores por debajo de 0,05 están dentro del límite de Sauerbrey y los valores por encima de 0,2 se acercan al régimen a granel. En otros lugaresseproporciona una descripción más rigurosa de d /n, pero es un parámetro cuantitativo que desentraña el límite de Sauerbrey y el límite viscoelástico. Los programas de análisis utilizados a continuación proporcionan este parámetro directamente.
Hay algunas limitaciones adicionales para analizar películas delgadas con el QCM. Los cálculos Sauerbrey y viscoelástico suponen que la película es homogénea tanto en todo el espesor de la película como lateralmente a través de la superficie del electrodo del QCM. Si bien esta suposición hace difícil estudiar películas que tienen vacíos o rellenos presentes, ha habido algunas investigaciones de QCM sobre películas consistentes en nanopartículas injertadas6. Si las heterogeneidades son pequeñas en comparación con el espesor total de la película, todavía se pueden obtener propiedades viscoelásticas fiables del sistema compuesto. Para sistemas más heterogéneos, los valores obtenidos a partir de un análisis viscoelástico siempre deben ser vistos con mucha precaución. Idealmente, los resultados obtenidos de sistemas con heterogeneidad desconocida deben validarse contra sistemas que se sabe que son homogéneos. Este es el enfoque que hemos adoptado en el sistema de ejemplo descrito en este documento.
Un punto importante que ilustramos en este documento es la correspondencia exacta entre las mediciones de QCM realizadas en el dominio de frecuencia (donde se informa de la palabra ) y los experimentos de dominio de tiempo (donde se informa D). Se describen los resultados de dos experimentos QCM diferentes, un dominio de tiempo y un dominio de frecuencia, cada uno de los que implica un sistema de modelo diferente pero conceptualmente relacionado. El primer sistema es un ejemplo simple de fijación de colágeno al sensor para ilustrar la cinética de unión representativa y el equilibrio de adsorción a lo largo del tiempo durante una medición de dominio de tiempo (QCM-D). El colágeno es la proteína más abundante en el cuerpo, conocida por su versatilidad de comportamientos de unión y morfología. La solución de colágeno utilizada aquí no requiere funcionalización adicional de la superficie de oro del sensor para inducir la adsorción9. El segundo sistema experimental es un complejo de polielectrolitos (PEC) compuesto por sulfonato de poliestireno aniónico (PSS) y policatiónico catiónico (diallyldimethylammonium) (PDADMA) preparado de la misma manera que Sadman et al.22. Estos materiales se hinchan y se vuelven suaves en soluciones de sal (KBr en este caso), ofreciendo una plataforma simple para el estudio de la mecánica de polímeros utilizando un enfoque de dominio de frecuencia (QCM-Z). Para cada protocolo, el proceso de preparación, toma y análisis de una medición se muestra en la Figura 2. El esquema muestra que la principal diferencia entre los enfoques QCM-Z y QCM-D está en el paso de recopilación de datos y la instrumentación utilizada en el experimento. Todas las técnicas de preparación de muestras mencionadas son compatibles con ambos enfoques, y cada enfoque puede analizar muestras en las tres regiones representadas en la Figura 1.
Nuestros datos demuestran que la preparación de muestras, ya sea mediante recubrimiento de sensor antes o durante una medición, dicta la capacidad de extraer las propiedades viscoelásticas de un sistema. Al diseñar las primeras etapas de un experimento adecuadamente, podemos determinar qué información podemos recopilar con precisión durante el paso de análisis.
Protocolo
Adsorción de colágeno QCM-D
1. Preparación de muestras y prelimpieza del sensor
- Preparar 20 ml de tampón de acetato de 0,1 M, ajustando el pH con HCl y NaOH según sea necesario para lograr el pH a 5,6.
- Añadir la solución de colágeno de cola de rata a los 20 ml de tampón de acetato en condiciones estériles a una concentración final de 10 g/ml.
- Limpie el sensor de cuarzo recubierto de oro para eliminar el material orgánico y biológico25,26.
- Coloque el lado activo del sensor hacia arriba en una cámara UV/Ozono y trate la superficie durante aproximadamente 10 minutos.
- Calentar una mezcla de agua desionizada 5:1:1 (dH2O), amoníaco (25%) y peróxido de hidrógeno (30%) a 75 oC. Coloque el sensor en la solución durante 5 min.
- Enjuague el sensor con dH2O y séquelo con una corriente de gas nitrógeno.
- Coloque el lado activo del sensor hacia arriba en una cámara UV/Ozono y trate la superficie durante 10 minutos.
NOTA: El procedimiento de limpieza debe realizarse inmediatamente antes de una medición para minimizar la contaminación ambiental en la superficie del sensor.
2. Adquisición de datos de medición QCM-D
- Encienda todo el equipo necesario para realizar una medición, incluida la bomba, la unidad electrónica y el software informático.
- Retire el módulo de flujo de la plataforma de la cámara y desenrosque los tornillos grandes del pulgar para abrir el módulo.
- Si el sensor se ha dejado fuera después de la limpieza inicial (pasos 1.3.1-1.3.4), enjuague el sensor con agua desionizada (dH2O) y seque con una corriente de gas nitrógeno para asegurarse de que no haya contaminantes en la superficie.
- Monte el sensor en el módulo de flujo en la placa tórica expuesta, primero secando el área con una corriente de gas nitrógeno y comprobando que la placa tórica está acostada. El sensor debe colocarse con el lado de la superficie activa hacia abajo y el electrodo en forma de anclaje orientado hacia el marcador en el módulo de flujo.
- Gire los tornillos del pulgar para sellar el módulo de flujo y reemplácelo en la plataforma de la cámara. Conecte cualquier tubo de bomba de PTFE necesario al módulo de flujo y a la bomba externa.
- Usando el software informático adecuado, ajuste la temperatura del módulo de flujo a 37 oC. Supervise la temperatura cambiante durante 10-15 minutos para asegurarse de que se equilibra al valor deseado.
- Encuentre las frecuencias de resonancia iniciales del sensor. Si el software no encuentra ninguna frecuencia de resonancia, compruebe que el módulo de flujo esté correctamente colocado en la plataforma de la cámara o vuelva a montar el sensor en el módulo de flujo para asegurarse de que está centrado y haciendo el contacto eléctrico adecuado.
- Coloque el tubo de la bomba de entrada en la solución salina 1x con búfer de fosfato (PBS). Encienda el flujo de la bomba externa a 25 l/min e inspeccione visualmente el tubo para asegurarse de que el fluido fluye a través del tubo.
NOTA: El flujo de fluidos puede ser más fácil de ver aumentando momentáneamente el caudal de fluido a 100 l/min o más. Si el fluido no parece moverse a través del tubo, lo más probable es que las dos partes del módulo de flujo no estén creando un sello adecuado. Intente apretar los tornillos del pulgar, apretando los conectores del tubo a la entrada y la salida, o vuelva a montar el sensor para asegurarse de que la placa tórica está plana y centrada. - Permita el flujo de fluido del 1x PBS a través del módulo de flujo durante al menos 15 minutos para equilibrar correctamente.
- Inicie la medición en el software informático para iniciar la adquisición de datos. Supervise los valores de frecuencia y disipación durante al menos 5 minutos para garantizar una línea de base estable.
- Detenga la bomba y mueva el tubo de entrada a la solución tampón de colágeno y acetato y reanude el flujo de fluidos. Observe la hora de este evento para su análisis posterior.
- Permita que los nuevos valores de frecuencia y disipación se equilibren en un valor estable. Aquí, esperamos que esta estabilización ocurra después de 8-12 h.
- Detenga la bomba, vuelva a mover el tubo de entrada a la solución 1x PBS y reanude el flujo de fluidos. Observe la hora de este evento para su análisis posterior.
- Permita que los nuevos valores de frecuencia y disipación se equilibren en un valor estable. Aquí, esta estabilización se produce después de 30 min.
NOTA: Los pasos 2.13 y 2.14 se pueden repetir para cada nuevo período de flujo de fluido en experimentos más rigurosos con un mayor número de etapas. - Finalice la adquisición de datos de la medición y guarde los datos.
- Limpie y desmonte el equipo QCM.
- Aumente el caudal de fluido de la bomba externa a 500 ml/min o superior y coloque el tubo de entrada en una solución de 2% de solución de limpieza Hellmanex durante al menos 20 minutos.
NOTA: Para otros experimentos, si desea realizar un análisis adicional del sensor, retire el sensor antes del paso 2.16.1 y coloque otro sensor de limpieza en el módulo. - Detenga la bomba y mueva el tubo de entrada a dH2O, y reanude el flujo de fluido para vaciar aún más el sistema durante al menos 20 minutos.
- Detenga el flujo de fluidos y retire el sensor del módulo de flujo. Seque el sensor y el interior del módulo de flujo con una corriente de gas nitrógeno. Apague el software de la computadora, la unidad electrónica y la bomba peristáltica.
NOTA: Los sensores recubiertos de oro se pueden limpiar correctamente, como se detalla en los pasos 1.3.1-1.3.4, y reutilizarse para varias mediciones. Las indicaciones de que un sensor ya no se puede reutilizar para mediciones fiables pueden incluir, entre otros, una gran variabilidad en las frecuencias de resonancia iniciales y derivas significativas en las mediciones de línea de base con flujo de búfer. Los datos se pueden abrir y analizar en el software preferido, incluidos los proporcionados por empresas especializadas en equipos QCM-D.
- Aumente el caudal de fluido de la bomba externa a 500 ml/min o superior y coloque el tubo de entrada en una solución de 2% de solución de limpieza Hellmanex durante al menos 20 minutos.
QCM Polielectrolito Complejo Hinchazón
3. Preparación de muestras
NOTA: Este experimento se realizó utilizando un programa MATLAB desarrollado dentro del grupo de investigación Shull para la recopilación y análisis de datos.
- En primer lugar, coloque un sensor de cristal de cuarzo desnudo en un soporte de muestra conectado al analizador de red vectorial y al ordenador. Encienda el analizador para aplicar un voltaje oscilante al sensor y recopile un espectro de conductancia de referencia para el sensor en el aire.
- Sumerja el soporte de muestra en un vaso de precipitados sin labios de 100 ml lleno de agua destilada y recoja un espectro de conductancia de referencia para el sensor desnudo en agua.
- Preparar una solución de 0,5 M de bromuro de potasio (KBr).
- Disolver 1,79 g de KBr en 30 ml de agua destilada. Agitar hasta que se disuelva.
- Inserte una pequeña oblea de silicio en la solución KBr en un ángulo para crear una corredera para el sensor de cuarzo durante el paso de recocido para evitar que la película salga del sensor.
- Prepare el sensor para el recubrimiento de giro.
- Establezca los parámetros de la capa de giro en 10.000 rpm, 8.000 de aceleración y 5 s.
- Inserte el sensor en la capa de giro y encienda el vacío.
- Cubra la superficie del sensor con etanol y ejecute la capa de giro para limpiar la superficie del sensor.
- Agregue el PEC (PSS:PDADMA preparado de la misma manera que se detalla en Sadman et al. 22) a la superficie del sensor.
- Si el complejo se encuentra en dos fases (ricaen en polímeros y pobres en polímeros), inserte lentamente el pipeteo en la solución. Evacuar el pipeta soplando burbujas mientras mueve la tubería en la fase rica en polímeros más densos.
- Después de liberar un par de burbujas en la fase rica en polímeros, dibuje 0.5-0.75 ml de la solución rica en polímeros en el pipeteo. Mantener la presión sobre la bombilla de tubería para no permitir que la fase deficiente del polímero entre en la tubería, extraiga el pipeteo de la solución.
- Limpie el exterior de la tubería con un Kimwipe. Agregue suficiente solución con gota a la superficie del sensor de cuarzo para cubrir completamente la superficie. Asegúrese de que no haya burbujas visibles en la solución en la superficie del sensor.
- Gire la capa de la muestra PEC y sumerja inmediatamente el sensor en la solución KBr de 0,5 M para evitar la cristalización de sal en la película.
NOTA: Este paso a veces es difícil de coordinar. Suelte el sensor justo encima de la solución KBr para obtener los mejores resultados. - Deje que la película se retrase durante al menos 12 h.
NOTA: Para facilitar la realización del experimento, prepare el paso 4 por la noche y permita que la película se retrase durante la noche.
4. Medición de la película en el aire y el agua
- Transfiera el sensor a un vaso de precipitados lleno de agua destilada para eliminar el exceso de KBr de la película y la parte posterior del sensor. Deje el sensor en la solución durante 30-60 min.
- Tome una medida de la película en el aire. Referencia al sensor desnudo en el aire. Permita que los datos de la película se equilibren.
- Inserte el sulfato de calcio seco en un vaso de precipitados sin labios de 100 ml y mida el espesor de la película completamente seca. Retire el sulfato de calcio del vaso de precipitados y enjuague el vaso con agua destilada.
- Llene el vaso de precipitados sin labios de 100 ml con 30 ml de agua destilada. Inserte una barra de agitación para asegurarse de que el agua está circulando alrededor de la película. Mida la película en agua durante unos 30-45 minutos o hasta que los datos de la película estén equilibrados. Referencia al sensor desnudo en agua.
- Preparar una solución de 15 ml de 3 M KBr en agua destilada. Mida 5,35 g de KBr en un cilindro graduado y llene a 15 ml con agua destilada. Gire hasta que se disuelva.
- Agregue la solución KBr al vaso de precipitados con agua destilada en incrementos de 0,1 M. La Tabla 1 describe los incrementos de 0,1 M en ml de solución KBr de 3 M. Frente a la película lejos de donde la solución KBr se está añadiendo al agua para que la película no se disuelva. Asegúrese de que el sistema se ha equilibrado antes de agregar otra adición de la solución KBr.
- Una vez adquiridos todos los datos, retire la película del soporte y colóquela en un vaso de agua destilada. Deje que la sal deje la película (30-60 min) y seque al aire la película.
- Para limpiar la película PEC del sensor, añada KBr al vaso de precipitados y gire suavemente la solución. Dejar sentar sea durante 5-10 min. Repita este proceso 2-3 veces, luego enjuague el sensor con agua destilada.
NOTA: El sensor se puede limpiar y reutilizar si la respuesta del sensor sigue siendo buena. Esto puede ser comprobado por el sensor que tiene pequeñas lecturas de ancho de banda absoluto para los armónicos de interés (<100 Hz).
5. Análisis de datos
- Abra el análisis de datos QCM-D MATLAB GUI creado por Sadman (https://github.com/sadmankazi/QCM-D-Analysis-GUI)27. Abra la película en el archivo de datos de aire seleccionando "Cargar QCM."
NOTA: El grupo Shull ha desarrollado una GUI de Python similar para la recopilación y análisis de datos para QCM (https://github.com/shullgroup/rheoQCM). Una parte del código de análisis se proporciona en la información complementaria tanto para analizar los datos como para generar las cifras de este documento. - Seleccione el cálculo deseado (3,5,3 o 3,5,5), gammay película en iconos de aire. Haga clic en Trazar QCM.
- Determine el grosor de la película seca utilizando el punto de datos más equilibrado (normalmente el último punto de datos) del experimento. Registre este valor.
- Abra la película en el archivo de datos de agua. Seleccione los mismos parámetros que en el paso 5.2, excepto para la película en agua en lugar de la película en el aire.
- Después de cada paso de equilibrio del experimento de hinchazón, determine el grosor de la película, el módulo de cizallamiento complejo y el ángulo de fase viscoelástico. Registre estos valores junto con la fuerza iónica (que van desde 0-1 M en incrementos de 0,1 M).
- Determinar el porcentaje de hinchazón como
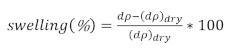 (3)
(3)
donde dp es el espesor de la película de la solución y dpseco es el espesor de la película seca.
Resultados
Los cambios en la frecuencia con el tiempo durante la adsorción de proteínas muestran una curva y meseta característica que se muestran en la Figura 3A-B. El lavado tampón inicial de 1pbS a través de la superficie del sensor desnudo induce sólo cambios insignificantes en la frecuencia, ofreciendo una línea de base constante para actuar como referencia para los puntos de datos futuros. La introducción de la solución de colágeno hace que comience la adsorción de pro...
Discusión
Los resultados de la adsorción de colágeno abarcan los regímenes de Sauerbrey y viscoelástico. Al trazar los cambios de frecuencia normalizados al número armónico correspondiente, observamos que el límite de Sauerbrey se mantiene fiel para aproximadamente las primeras 2 h de la medición. Con el aumento de la masa de adcejo al sensor, sin embargo, los cambios de frecuencia normalizados para el tercer y quinto armónicos comienzan a desviarse unos de otros(t > 2 h), lo que indica una capacidad para determi...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el NSF (DMR-1710491, OISE-1743748). J.R. y E.S. reconocen el apoyo de la NSF (DMR-1751308).
Materiales
| Name | Company | Catalog Number | Comments |
| Acetic acid | Sigma-Aldrich | A6283 | For collagen adsorption |
| Ammonium hydroxide solution | Sigma-Aldrich | 221228 | For collagen adsorption |
| Aqueous QCM probe | AWSensors | CLS 00050 A | For polyelectrolyte swelling |
| Collagen I Rat Protein, Tail | Thermo Fisher Scientific | A1048301 | For collagen adsorption |
| Distilled water | Sigma-Aldrich | EM3234 | For polyelectrolyte swelling; generally easy to acquire in research labs, but there is a catalog number in case it is not accessible |
| Ethanol | Sigma-Aldrich | 793175-1GA-PB | For polyelectrolyte swelling |
| Gibco Phosphate Buffered Saline | Thermo Fisher Scientific | 20012-027 | For collagen adsorption |
| Hellmanex III | Sigma-Aldrich | Z805939 | For collagen adsorption |
| Hydrogen peroxide solution | Sigma-Aldrich | 216763 | For collagen adsorption |
| Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers, 1-Ply | Fisher Scientific | 06-666A | For polyelectrolyte swelling |
| NP2K VNA | Makarov Instruments | For polyelectrolyte swelling | |
| Poly(diallyldimethylammonium chloride), MW 200,000 | Sigma-Aldrich | 409022 | For polyelectrolyte swelling; for full synthesis procedure see Sadman et al. |
| Poly(styrene-sulfonate) sodium salt 30% weight in water | Sigma-Aldrich | 561967-500G | For polyelectrolyte swelling; for full synthesis procedure see Sadman et al. |
| Potassium Bromide | Sigma-Aldrich | 793604-1KG | For polyelectrolyte swelling |
| QSense QCM Explorer System | Biolin Scientific | For collagen adsorption | |
| Sodium acetate, anhydrous | Sigma-Aldrich | S2889 | For collagen adsorption |
| Spin coater, Model WS-650MZ-23NPP | Laurell technologies | For polyelectrolyte swelling |
Referencias
- Marx, K. A. Quartz crystal microbalance: A useful tool for studying thin polymer films and complex biomolecular systems at the solution - Surface interface. Biomacromolecules. 4 (5), 1099-1120 (2003).
- Kleber, C., Hilfrich, U., Schreiner, M. In situ QCM and TM-AFM investigations of the early stages of degradation of silver and copper surfaces. Applied Surface Science. 253 (7), 3712-3721 (2007).
- Yeh, C. J., Hu, M., Shull, K. R. Oxygen Inhibition of Radical Polymerizations Investigated with the Rheometric Quartz Crystal Microbalance. Macromolecules. 51 (15), 5511-5518 (2018).
- Sturdy, L. F., Yee, A., Casadio, F., Shull, K. R. Quantitative characterization of alkyd cure kinetics with the quartz crystal microbalance. Polymer. 103, 387-396 (2016).
- Delgado, D. E., Sturdy, L. F., Burkhart, C. W., Shull, K. R. Validation of quartz crystal rheometry in the megahertz frequency regime. Journal of Polymer Science, Part B: Polymer Physics. , 1-9 (2019).
- Bilchak, C. R., Huang, Y., Benicewicz, B. C., Durning, C. J., Kumar, S. K. High-Frequency Mechanical Behavior of Pure Polymer-Grafted Nanoparticle Constructs. ACS Macro Letters. 8 (3), 294-298 (2019).
- Hook, F., Rodahl, M., Brzezinski, P., Kasemo, B. Energy dissipation kinetics for protein and antibody-antigen adsorption under shear oscillation on a quartz crystal microbalance. Langmuir. 14, 729-734 (1998).
- Liss, M., Petersen, B., Wolf, H., Prohaska, E. An aptamer-based quartz crystal protein biosensor. Analytical Chemistry. 74 (17), 4488-4495 (2002).
- Felgueiras, H. P., Murthy, N. S., Sommerfeld, S. D., Brás, M. M., Migonney, V., Kohn, J. Competitive Adsorption of Plasma Proteins Using a Quartz Crystal Microbalance. ACS Applied Materials and Interfaces. 8 (21), 13207-13217 (2016).
- Keller, C. A., Kasemo, B. Surface specific kinetics of lipid vesicle adsorption measured with a quartz crystal microbalance. Biophysical Journal. 75, 1397-1402 (1998).
- Olsson, A. L. J., Quevedo, I. R., He, D., Basnet, M., Tufenkji, N. Using the quartz crystal microbalance with dissipation monitoring to evaluate the size of nanoparticles deposited on surfaces. ACS Nano. 7 (9), 7833-7843 (2013).
- Xu, X., Zhang, C., Zhou, Y., Cheng, Q. L. J., Yao, K., Chen, Q. Quartz crystal microbalance study of protein adsorption on chitosan, chitosan/poly(vinyl pyrrolidone) blends and chitosan-graft-poly(vinyl pyrrolidone) surfaces. Journal of Bioactive and Compatible Polymers. 22, 195-206 (2007).
- Weber, N., Pesnell, A., Bolikal, D., Zeltinger, J., Kohn, J. Viscoelastic properties of fibrinogen adsorbed to the surface of biomaterials used in blood-contacting medical devices. Langmuir. 23, 3298-3304 (2007).
- Johannsmann, D. Viscoelastic, mechanical, and dielectric measurements on complex samples with the quartz crystal microbalance. Physical Chemistry Chemical Physics. 10 (31), 4516-4534 (2008).
- Denolf, G. C., Sturdy, L. F., Shull, K. R. High-frequency rheological characterization of homogeneous polymer films with the quartz crystal microbalance. Langmuir. 30 (32), 9731-9740 (2014).
- Martin, E. J., Mathew, M. T., Shull, K. R. Viscoelastic properties of electrochemically deposited protein/metal complexes. Langmuir. 31 (13), 4008-4017 (2015).
- Sturdy, L., Casadio, F., Kokkori, M., Muir, K., Shull, K. R. Quartz crystal rheometry: A quantitative technique for studying curing and aging in artists' paints. Polymer Degradation and Stability. 107, 348-355 (2014).
- Sadman, K., Wiener, C. G., Weiss, R. A., White, C. C., Shull, K. R., Vogt, B. D. Quantitative Rheometry of Thin Soft Materials Using the Quartz Crystal Microbalance with Dissipation. Analytical Chemistry. 90 (6), 4079-4088 (2018).
- Wasilewski, T., Szulczyński, B., Kamysz, W., Gębicki, J., Namieśnik, J. Evaluation of three peptide immobilization techniques on a qcm surface related to acetaldehyde responses in the gas phase. Sensors (Switzerland). 18 (11), 1-15 (2018).
- Lvov, Y., Ariga, K., Kunitake, T., Ichinose, I. Assembly of Multicomponent Protein Films by Means of Electrostatic Layer-by-Layer Adsorption. Journal of the American Chemical Society. 117 (22), 6117-6123 (1995).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift für Physik. 155 (2), 206-222 (1959).
- Sadman, K., Wang, Q., Chen, Y., Keshavarz, B., Jiang, Z., Shull, K. R. Influence of Hydrophobicity on Polyelectrolyte Complexation. Macromolecules. 50 (23), 9417-9426 (2017).
- Sievers, P., Moß, C., Schröder, U., Johannsmann, D. Use of torsional resonators to monitor electroactive biofilms. Biosensors and Bioelectronics. 110, 225-232 (2018).
- Ringberg, J. Q-Sense Explorer Operator Manual. Biolin Scientific. , (2017).
- Ringberg, J. Q-Sense User Guide: Instrument care and sensor pre-cleaning. Biolin Scientific. , (2015).
- Kern, W. The Evolution of Silicon Wafer Cleaning Technology. Journal of The Electrochemical Society. 137 (6), 1887 (1990).
- Sadman, K. . sadmankazi/QCM-D-Analysis-GUI: QCMD-Analyze. , (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados