Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation d'échantillons dans Quartz Crystal Microbalance Measurements of Protein Adsorption and Polymer Mechanics
Dans cet article
Résumé
Le microbalance de cristal de quartz peut fournir la masse précise et les propriétés viscoélastiques pour des films dans la gamme de micron ou de submicron, qui est pertinent pour des investigations dans la détection biomédicale et environnementale, les revêtements, et la science de polymère. L'épaisseur de l'échantillon influence les informations qui peuvent être obtenues à partir du matériau en contact avec le capteur.
Résumé
Dans cette étude, nous présentons divers exemples de la façon dont la préparation mince du film pour les expériences de microbalance cristal l'indique la modélisation appropriée des données et détermine quelles propriétés du film peuvent être quantifiées. Le microbalance de cristal de quartz offre une plate-forme particulièrement sensible pour mesurer les changements fins dans la masse et/ou les propriétés mécaniques d'un film appliqué en observant les changements dans la résonance mécanique d'un cristal de quartz oscillant à haute fréquence. Les avantages de cette approche comprennent sa polyvalence expérimentale, sa capacité d'étudier les changements de propriétés sur un large éventail de durées expérimentales et l'utilisation de petites tailles d'échantillons. Nous démontrons que, en fonction de l'épaisseur et du modulus de cisaillement de la couche déposée sur le capteur, nous pouvons acquérir différentes informations à partir du matériau. Ici, ce concept est spécifiquement exploité pour afficher des paramètres expérimentaux résultant en des calculs de masse et viscoélastiques de collagène adsorbed sur l'or et les complexes de polyélectrolyte pendant le gonflement en fonction de la concentration de sel.
Introduction
Le microbalance de cristal de quartz (QCM) tire parti de l'effet piézoélectrique d'un cristal de quartz pour surveiller sa fréquence de résonance, qui dépend de la masse adhérée à la surface. La technique compare la fréquence et la bande passante résonnantes d'un capteur de cristal de quartz coupé AT (généralement de l'ordre de 5 MHz)1 dans l'air ou un fluide à la fréquence et à la bande passante du capteur après le dépôt d'un film. Il y a plusieurs avantages à utiliser le QCM pour étudier les propriétés et les interfaces minces de film, y compris la sensibilité élevée à la masse et potentiellement aux changements viscoélastiques de propriété (selon l'uniformité et l'épaisseur d'échantillon), la capacité d'exécuter des études in situ2,et la capacité de sonder une échelle de temps rhéologique beaucoup plus courte que la rhéologie traditionnelle de cisaillement ou l'analyse mécanique dynamique (DMA). Sonder un court laps de temps rhéologique permet d'observer comment la réponse à cette échelle de temps change à la fois sur des durées extrêmement courtes (ms)3 et longues (années)4. Cette capacité est bénéfique pour l'étude d'une variété de processus cinétiques et est également une extension utile des techniques rhéométriques traditionnelles5,6.
La sensibilité élevée du QCM a également conduit à son utilisation intensive dans des applications biologiques étudiant les interactions fondamentales des biomolécules extrêmement petites. Une surface de capteur non couchée ou fonctionnalisée peut être utilisée pour étudier l'adsorption protéique; encore plus loin, la biodétection par des événements de liaison complexes entre les enzymes, les anticorps et les aptamers peut être examinée en fonction des changements de masse7,8,9. Par exemple, la technique a été utilisée pour comprendre la transformation des vésicules en une bicouche lipidique planaire comme un processus en deux phases d'adsorption des vésicules contenant du liquide à une structure rigide en observant les changements de corrélation de la fréquence et la viscoélasticité10. Au cours des dernières années, le QCM a en outre offert une plate-forme robuste pour surveiller l'administration de médicaments par vésicules ou nanoparticules11. À l'intersection de l'ingénierie des matériaux et de la biologie moléculaire et cellulaire, nous pouvons utiliser le QCM pour élucider les interactions clés entre les matériaux et les composants bioactifs comme les protéines, les acides nucléiques, les liposomes et les cellules. Par exemple, l'adsorption protéique à un biomatériau sert de médiateur aux réponses cellulaires en aval comme l'inflammation et est souvent utilisée comme indicateur positif de biocompatibilité, tandis que dans d'autres cas, l'attachement extracellulaire des protéines aux revêtements qui interagissent avec le sang pourrait induire une coagulation dangereuse dans les vaisseaux12,13. Le QCM peut donc être utilisé comme un outil pour sélectionner les candidats optimaux pour différents besoins.
Deux approches communes pour l'exécution d'expériences QCM recueillent des données analogues de l'expérience : la première approche enregistre le décalage de fréquence et la demi-bande passante() du pic de conductance. La deuxième approche, qcM avec dissipation (QCM-D), enregistre le décalage de fréquence et le facteur de dissipation, qui est directement proportionnel à l'équation 1,14
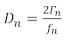 (1)
(1)
où D est le facteur de dissipation et la fréquence est la fréquence. Les deux D et Les ' sont liés à l'effet d'amortissement du film sur le capteur, ce qui donne une indication de la rigidité du film. Le sous-scripte n désigne la fréquence de tonalité ou d'harmonique, qui sont les fréquences de résonance impaires du capteur de quartz (n ' 1, 3, 5, 7...). D'autres discussions sur les modèles utilisant plusieurs harmoniques pour obtenir la masse et les propriétés viscoélastiques d'un film peuvent être trouvées dans une critique par Johannsmann14 et les documents précédents du groupe Shull15,16,17,18.
Une considération clé pour la préparation des échantillons de QCM est de savoir comment appliquer le film mince sur la surface du capteur. Certaines méthodes courantes incluent le revêtement de spin, revêtement de trempette, revêtement de chute, ou adsorption du film sur la surface du capteur au cours de l'expérience19,20. Il y a quatre régions pour les échantillons de QCM : la limite de Sauerbrey, le régime viscoélastique, le régime en vrac, et le régime surdalé. Pour les films suffisamment minces, la limite Sauerbrey s'applique, où le décalage de fréquence(en)fournit la densité de masse de surface du film. Dans la limite de Sauerbrey, les échelles de décalage de fréquence linéairement avec l'harmonique résonnante, n, et les changements dans le facteur d'amortissement (D ou )sont généralement petits. Dans ce régime, il n'y a pas suffisamment d'information disponible pour déterminer uniquement les propriétés rhéologiques de la couche sans faire d'hypothèses supplémentaires. Les données de ce régime sont utilisées pour calculer la densité de masse de surface (ou l'épaisseur si la densité est connue a priori) du film. Dans le régime en vrac où le milieu en contact avec le cristal est suffisamment épais, l'onde de cisaillement évanescente se propage dans le milieu avant d'être complètement amortie. Ici, aucune information de masse ne peut être obtenue à l'aide de l'adresse '' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' Cependant, dans cette région, les propriétés viscoélastiques sont déterminées de façon fiable à l'aide de la combinaison de 15euros et de15euros. Dans le régime en vrac, si le support est trop rigide, le film amortira la résonance du capteur, empêchant la collecte de données fiables de la QCM. Le régime viscoélastique est le régime intermédiaire où le film est assez mince pour que l'onde de cisaillement se propage complètement à travers le film ainsi que des valeurs fiables pour le facteur d'amortissement. Le facteur d'amortissement etle facteur d'amortissement et le facteur d'amortissement peuvent ensuite être utilisés pour déterminer les propriétés viscoélastiques du film ainsi que sa masse. Ici, les propriétés viscoélastiques sont données par le produit de la densité et de l'ampleur du modulus complexe de cisaillement. G. p et l'angle de phase donné par 'arctan' (G" / G'). Lorsque les films sont préparés dans la limite de Sauerbrey, la masse par unité de surface peut être calculée directement sur la base de l'équation de Sauerbrey montrée ci-dessous21,
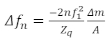 (2)
(2)
où lenest le changement de la fréquence de résonance, n est la tonalité d'intérêt,n 1 est la fréquence de résonance du capteur, m / A est la masse par zone du film, et Zq est l'impedance acoustique du quartz, qui pour AT quartz coupé est Zq 8,84 x 106kg / m2s. Le régime viscoélastique est le plus approprié pour l'étude des films polymères, et la limite en vrac est utile pour étudier le polymère visqueux22 ou les solutions protéiques16. Les différents régimes dépendent des propriétés du matériau d'intérêt, avec l'épaisseur optimale pour la caractérisation viscoélastique complète et de masse augmentant généralement avec la rigidité du film. La figure 1 décrit les quatre régions en ce qui concerne la densité aréale du film, le modulus complexe de cisaillement, et l'angle de phase, où nous avons supposé une relation spécifique entre l'angle de phase et la rigidité du film qui s'est avéré pertinent pour les matériaux de ce type. Beaucoup de films d'intérêt pratique sont trop épais pour étudier les propriétés viscoélastiques avec QCM, comme certains biofilms, où les épaisseurs sont de l'ordre de dizaines à des centaines de microns23. Ces films épais ne sont généralement pas appropriés pour l'étude à l'aide de la QCM, mais peuvent être mesurés à l'aide de résonateurs à basse fréquence (tels que les résonateurs de torsion)23, permettant à l'onde de cisaillement de se propager plus loin dans le film.
Pour déterminer quel régime est pertinent pour un échantillon qcM donné, il est important de comprendre le paramètre d /n, qui est le rapport de l'épaisseur du film (d) à la longueur d'onde de cisaillement de l'oscillation mécanique du capteur de cristal de quartz(n)15,16,18. Le régime viscoélastique idéal est d /n - 0,05 - 0,218, où les valeurs inférieures à 0,05 sont dans la limite de Sauerbrey et les valeurs supérieures à 0,2 approche nt le régime en vrac. Une description plus rigoureuse de d /n est fournie ailleurs15,18, mais il s'agit d'un paramètre quantitatif délimitant la limite Sauerbrey et la limite viscoélastique. Les programmes d'analyse utilisés ci-dessous fournissent ce paramètre directement.
Il y a quelques limites supplémentaires à l'analyse des films minces avec le QCM. Les calculs Sauerbrey et viscoélastique supposent que le film est homogène à la fois tout au long de l'épaisseur du film et latéralement à travers la surface de l'électrode de la QCM. Bien que cette hypothèse rend difficile l'étude des films qui ont des vides ou des charges présentes, il ya eu quelques enquêtes QCM dans les films composés de nanoparticules greffées6. Si les hétérogénéités sont faibles par rapport à l'épaisseur globale du film, des propriétés viscoélastiques fiables du système composite peuvent encore être obtenues. Pour les systèmes plus hétérogènes, les valeurs obtenues à partir d'une analyse viscoélastique doivent toujours être considérées avec une grande prudence. Idéalement, les résultats obtenus à partir de systèmes avec une hétérogénéité inconnue devraient être validés contre des systèmes qui sont connus pour être homogènes. C'est l'approche que nous avons adoptée dans le système d'exemple décrit dans le présent document.
Un point important que nous éclairons dans cet article est la correspondance exacte entre les mesures DE QCM effectuées dans le domaine de la fréquence (où est rapporté) et les expériences de domaine temporel (où D est signalé). Les résultats de deux expériences QCM différentes, un domaine temporel et un domaine de fréquence, sont décrits, chacun impliquant un système modèle différent mais conceptuellement lié. Le premier système est un exemple simple d'attachement au collagène au capteur pour illustrer la cinétique de liaison représentative et l'équilibre de l'adsorption au fil du temps au cours d'une mesure de domaine temporel (QCM-D). Le collagène est la protéine la plus abondante dans le corps, connue pour sa polyvalence des comportements de liaison et de morphologie. La solution de collagène utilisée ici ne nécessite pas de fonctionnalisation supplémentaire de la surface d'or du capteur pour induire l'adsorption9. Le deuxième système expérimental est un complexe de polyélectrolytes (PEC) composé de sulfonate de polystyrène anionique (PSS) et de poly cationique (diallyldimethylammonium) (PDADMA) préparé de la même manière que Sadman et al.22. Ces matériaux gonflent et deviennent mous dans le sel (KBr dans ce cas) solutions, offrant une plate-forme simple pour étudier la mécanique des polymères en utilisant une approche de domaine de fréquence (QCM-Z). Pour chaque protocole, le processus de préparation, de prise et d'analyse d'une mesure est indiqué à la figure 2. Le schéma montre que la principale différence entre les approches QCM-Z et QCM-D réside dans l'étape de collecte de données et l'instrumentation utilisée dans l'expérience. Toutes les techniques de préparation d'échantillons mentionnées sont compatibles avec les deux approches, et chaque approche peut analyser des échantillons dans les trois régions représentées à la figure 1.
Nos données démontrent que la préparation d'échantillons, que ce soit par revêtement de capteur avant ou pendant une mesure, dicte la capacité d'extraire les propriétés viscoélastiques d'un système. En concevant les premières étapes d'une expérience de manière appropriée, nous pouvons déterminer quelles informations nous pouvons recueillir avec précision au cours de l'étape d'analyse.
Protocole
Adsorption de collagène DE QCM-D
1. Préparation de l'échantillon et pré-nettoyage du capteur
- Préparer 20 ml de tampon d'acétate de 0,1 M, en ajustant le pH avec HCl et NaOH au besoin pour atteindre le pH 5,6.
- Ajouter la solution de collagène de queue de rat à la 20 ml de tampon d'acétate dans des conditions stériles à une concentration finale de 10 g/mL.
- Nettoyer le capteur de quartz enduit d'or pour enlever le matériel organique et biologique25,26.
- Placez le capteur côté actif vers le haut dans une chambre UV/Ozone et traitez la surface pendant environ 10 min.
- Chauffer un mélange de 5:1:1 d'eau déionisée (dH2O), d'ammoniac (25%) peroxyde d'hydrogène (30%) à 75 oC. Placez le capteur dans la solution pendant 5 min.
- Rincer le capteur avec dH2O et sécher avec un jet de gaz azoté.
- Placez le capteur côté actif vers le haut dans une chambre UV/Ozone et traitez la surface pendant 10 min.
REMARQUE : La procédure de nettoyage doit être immédiatement effectuée avant une mesure afin de minimiser la contamination de l'environnement à la surface du capteur.
2. Acquisition de données de mesure QCM-D
- Activez tout l'équipement nécessaire pour prendre une mesure, y compris la pompe, l'unité électronique et le logiciel informatique.
- Retirez le module d'écoulement de la plate-forme de la chambre et dévisser les grandes vis de pouce pour ouvrir le module.
- Si le capteur a été laissé de côté après le nettoyage initial (étapes 1.3.1-1.3.4), rincez le capteur avec de l'eau déionisée (dH2O) et séchez avec un jet de gaz azoté pour s'assurer qu'il n'y a pas de contaminants à la surface.
- Montez le capteur dans le module d'écoulement sur l'anneau O exposé, en séchant d'abord la zone avec un jet de gaz azoté et en vérifiant que l'anneau O est couché à plat. Le capteur doit être placé avec le côté de surface actif vers le bas et l'électrode en forme d'ancre orientée vers le marqueur dans le module d'écoulement.
- Tournez les vis du pouce pour sceller le module d'écoulement et remplacez-le sur la plate-forme de la chambre. Fixez tout tube de pompe PTFE nécessaire au module d'écoulement et à la pompe externe.
- À l'aide du logiciel informatique approprié, définir la température du module d'écoulement à 37 oC. Surveillez la température changeante pendant 10-15 min pour s'assurer qu'elle équilibre à la valeur désirée.
- Trouvez les fréquences de résonance initiales du capteur. Si aucune fréquence de résonance n'est trouvée par le logiciel, vérifiez que le module de débit est correctement positionné sur la plate-forme de la chambre ou re-montez le capteur dans le module de débit pour s'assurer qu'il est centré et qu'il fait un contact électrique approprié.
- Placez le tube de pompe d'insee dans la solution saline aphatée 1x tamponnée par le phosphate (PBS). Démarrez le débit externe de la pompe à 25 l/min et inspectez visuellement le tube pour vous assurer que le liquide circule dans le tube.
REMARQUE : Le débit des fluides peut être plus facile à voir en augmentant momentanément le débit de fluide à 100 l/min ou plus. Si le liquide ne semble pas se déplacer à travers le tube, il est très probable que les deux parties du module d'écoulement ne créent pas un joint approprié. Essayez de serrer les vis du pouce, de serrer les connecteurs de la tubulure à l'insee et à la sortie, ou de remontage du capteur pour être sûr que l'anneau O est plat et centré. - Laisser le flux fluide du 1x PBS à travers le module de débit pendant au moins 15 min pour bien réquilibrer.
- Démarrer la mesure dans le logiciel informatique pour commencer l'acquisition de données. Surveillez les valeurs de fréquence et de dissipation pendant au moins 5 minutes afin d'assurer une ligne de base stable.
- Arrêtez la pompe et déplacez le tube d'entrée vers la solution tampon collagène-acétate, et reprenez le flux de fluide. Notez l'heure de cet événement pour une analyse ultérieure.
- Laissez les nouvelles valeurs de fréquence et de dissipation s'équilibrer à une valeur stable. Ici, nous nous attendons à ce que cette stabilisation se produise après 8-12 h.
- Arrêtez la pompe, déplacez le tube d'entrée vers la solution 1x PBS et reprenez le flux de fluide. Notez l'heure de cet événement pour une analyse ultérieure.
- Laissez les nouvelles valeurs de fréquence et de dissipation s'équilibrer à une valeur stable. Ici, cette stabilisation se produit après 30 min.
REMARQUE : Les étapes 2.13 et 2.14 peuvent être répétées pour chaque nouvelle période de flux de fluide dans des expériences plus rigoureuses avec un plus grand nombre d'étapes. - Mettre fin à l'acquisition de données de la mesure et enregistrer les données.
- Nettoyer et démonter l'équipement QCM.
- Augmentez le débit de fluide de la pompe externe à 500 l/min ou plus et placez le tube d'entrée dans une solution de 2 % de solution de nettoyage Hellmanex pendant au moins 20 min.
REMARQUE : Pour d'autres expériences, si une analyse plus approfondie du capteur est souhaitée, retirez le capteur avant l'étape 2.16.1 et placez un autre capteur de nettoyage dans le module. - Arrêtez la pompe et déplacez le tube d'entrée à dH2O, et reprendre le flux de fluide pour rincer davantage le système pendant au moins 20 min.
- Arrêtez le flux de fluide et retirez le capteur du module d'écoulement. Séchez le capteur et l'intérieur du module d'écoulement avec un flux de gaz azoté. Éteignez le logiciel informatique, l'unité électronique et la pompe péristétique.
REMARQUE : Les capteurs enduits d'or peuvent être nettoyés correctement, comme détaillé dans les étapes 1.3.1-1.3.4, et réutilisés pour plusieurs mesures. Les indications qu'un capteur ne peut plus être réutilisé pour des mesures fiables peuvent inclure, mais ne sont pas limités à une grande variabilité des fréquences de résonance initiales et des dérives significatives dans les mesures de base avec le débit tampon. Les données peuvent être ouvertes et analysées dans le logiciel préféré, y compris ceux fournis par les entreprises qui se spécialisent dans l'équipement QCM-D.
- Augmentez le débit de fluide de la pompe externe à 500 l/min ou plus et placez le tube d'entrée dans une solution de 2 % de solution de nettoyage Hellmanex pendant au moins 20 min.
Enflure du complexe de polyélectrolytes de QCM
3. Préparation de l'échantillon
REMARQUE : Cette expérience a été réalisée à l'aide d'un programme MATLAB développé au sein du groupe de recherche Shull pour la collecte et l'analyse de données.
- Tout d'abord, placez un capteur de cristal de quartz nu dans un support d'échantillon connecté à l'analyseur de réseau vectoriel et à l'ordinateur. Allumez l'analyseur pour appliquer une tension oscillante au capteur, et de recueillir un spectre de conductance de référence pour le capteur dans l'air.
- Immerger le porte-échantillon dans un bécher sans lèvres de 100 ml rempli d'eau distillée et recueillir un spectre de conductance de référence pour le capteur nu dans l'eau.
- Préparer une solution de 0,5 M de bromure de potassium (KBr).
- Dissoudre 1,79 g de KBr dans 30 ml d'eau distillée. Agiter jusqu'à dissolution.
- Insérez une petite plaquette de silicium dans la solution KBr à un angle pour créer une diapositive pour le capteur de quartz pendant l'étape d'annealing pour empêcher le film de sortir du capteur.
- Préparer le capteur pour le revêtement de spin.
- Définiz les paramètres du spin coat à 10 000 tr/min, 8 000 accélérations et 5 s.
- Insérez le capteur sur le coucheur de spin et allumez le vide.
- Couvrez la surface du capteur avec de l'éthanol et exécutez le porte-couches pour nettoyer la surface du capteur.
- Ajouter le PEC (PSS:PDADMA préparé de la même manière que détaillé dans Sadman et al. 22) à la surface du capteur.
- Si le complexe est en deux phases (polymère riche et polymère pauvre), insérez lentement le tuyau dans la solution. Évacuez la tuyauterie en soufflant des bulles tout en déplaçant la tuyauterie dans la phase plus dense riche en polymères.
- Après avoir libéré quelques bulles dans la phase riche en polymères, élaborer 0,5-0,75 ml de la solution riche en polymères dans le pipet. Maintenir la pression sur l'ampoule de pipet pour ne pas permettre à la phase pauvre de polymère d'entrer dans le pipet, tirer le pipet hors de la solution.
- Essuyez l'extérieur de la pipet à l'aide d'un Kimwipe. Ajoutez suffisamment de solution dans le sens de la goutte sur la surface du capteur de quartz pour couvrir complètement la surface. Assurez-vous qu'il n'y a pas de bulles visibles dans la solution sur la surface du capteur.
- Enrobez l'échantillon PEC et submergez immédiatement le capteur dans la solution 0,5 M KBr pour éviter la cristallisation du sel sur le film.
REMARQUE : Cette étape est parfois difficile à coordonner. Relâchez le capteur juste au-dessus de la solution KBr pour de meilleurs résultats. - Laisser le film annexer pendant au moins 12 h.
REMARQUE : Pour faciliter l'exécution de l'expérience, préparez l'étape 4 le soir et laissez le film s'enliquer toute la nuit.
4. Mesure du film dans l'air et l'eau
- Transférer le capteur dans un bécher rempli d'eau distillée pour retirer l'excès de KBr du film et du côté arrière du capteur. Laissez le capteur dans la solution pendant 30-60 min.
- Prenez une mesure du film dans l'air. Référence au capteur nu dans l'air. Permettre aux données du film d'être alquissés.
- Insérez du sulfate de calcium séché dans un bécher sans lèvres de 100 ml et mesurez l'épaisseur du film complètement sec. Retirer le sulfate de calcium du bécher et rincer le bécher à l'eau distillée.
- Remplir le bécher sans lèvres de 100 ml avec 30 ml d'eau distillée. Insérez une barre d'agitation pour vous assurer que l'eau circule autour du film. Mesurer le film dans l'eau pendant environ 30-45 min ou jusqu'à ce que les données du film soient libés. Référence au capteur nu dans l'eau.
- Préparer une solution de 15 ml de 3 M KBr dans de l'eau distillée. Mesurer 5,35 g de KBr dans un cylindre gradué et remplir à 15 ml d'eau distillée. Tourbillonner jusqu'à dissolution.
- Ajouter la solution KBr au bécher avec de l'eau distillée par incréments de 0,1 M. Le tableau 1 décrit les incréments de 0,1 M en mL de 3 M KBr solution. Affrontez le film loin de l'endroit où la solution KBr est ajoutée à l'eau afin que le film ne se dissolve pas. Assurez-vous que le système a réquilibé avant d'ajouter un autre ajout de la solution KBr.
- Une fois que toutes les données ont été acquises, retirez le film du support et placez-le dans un bécher d'eau distillée. Laisser le sel quitter le film (30-60 min) et sécher le film à l'air.
- Pour nettoyer le film PEC du capteur, ajouter KBr au bécher et faire tourbillonner doucement la solution. Laisser reposer de 5 à 10 min. Répétez ce processus 2 à 3 fois, puis rincez le capteur avec de l'eau distillée.
REMARQUE : Le capteur peut être nettoyé et réutilisé si la réponse du capteur est toujours bonne. Cela peut être vérifié par le capteur ayant de petites lectures de bande passante absolue pour les harmoniques d'intérêt (lt;100 Hz).
5. Analyse des données
- Ouvrez l'analyse de données QCM-D MATLAB GUI créée par Sadman (https://github.com/sadmankazi/QCM-D-Analysis-GUI)27. Ouvrez le film dans le fichier de données d'air en sélectionnant « Charger QCM ».
REMARQUE : Le groupe Shull a développé une interface graphique Python similaire pour la collecte et l'analyse de données pour QCM(https://github.com/shullgroup/rheoQCM). Une partie du code d'analyse est fournie dans les informations supplémentaires pour analyser les données et générer les chiffres dans ce document. - Sélectionnez le calcul souhaité (soit 3,5,3 ou 3,5,5), gamma, et le film dans les icônes de l'air. Cliquez sur Terrain QCM.
- Déterminez l'épaisseur du film sec à l'aide du point de données le plus équilibrant (généralement le dernier point de données) de l'expérience. Enregistrez cette valeur.
- Ouvrez le film dans le fichier de données sur l'eau. Sélectionnez les mêmes paramètres que dans l'étape 5.2, à l'exception du film dans l'eau au lieu du film dans l'air.
- Après chaque étape d'équilibre de l'expérience de gonflement, déterminez l'épaisseur du film, le modulus complexe de cisaillement et l'angle de phase viscoélastique. Enregistrez ces valeurs avec la force ionique (allant de 0-1 M par incréments de 0,1 M).
- Déterminer le pourcentage d'enflure
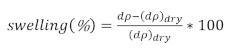 (3)
(3)
où dp est l'épaisseur du film de la solution et dpsec est l'épaisseur du film sec.
Résultats
Les changements de fréquence avec le temps pendant l'adsorption protéique présentent une courbe et un plateau caractéristiques montrés dans la figure 3A-B. Le lavage tampon initial de 1x PBS à travers la surface du capteur nu n'induit que des changements négligeables de fréquence, offrant une base de référence stable pour agir comme une référence pour les points de données futurs. L'introduction de la solution de collagène provoque l'adsorption protéique de co...
Discussion
Les résultats d'adsorption de collagène couvrent les régimes sauerbrey et viscoélastique. En traçant les décalages de fréquence normalisés au nombre harmonique correspondant, nous observons que la limite de Sauerbrey est vraie pour environ les 2 premières heures de la mesure. Avec l'augmentation de la masse adhérant au capteur, cependant, les changements de fréquence normalisés pour les troisième et cinquième harmoniques commencent à s'écarter les uns des autres(t 'gt; 2 h), indiquant une capacit...
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Ces travaux ont été soutenus par le FNS (DMR-1710491, OISE-1743748). J.R. et E.S. reconnaissent le soutien du FNS (DMR-1751308).
matériels
| Name | Company | Catalog Number | Comments |
| Acetic acid | Sigma-Aldrich | A6283 | For collagen adsorption |
| Ammonium hydroxide solution | Sigma-Aldrich | 221228 | For collagen adsorption |
| Aqueous QCM probe | AWSensors | CLS 00050 A | For polyelectrolyte swelling |
| Collagen I Rat Protein, Tail | Thermo Fisher Scientific | A1048301 | For collagen adsorption |
| Distilled water | Sigma-Aldrich | EM3234 | For polyelectrolyte swelling; generally easy to acquire in research labs, but there is a catalog number in case it is not accessible |
| Ethanol | Sigma-Aldrich | 793175-1GA-PB | For polyelectrolyte swelling |
| Gibco Phosphate Buffered Saline | Thermo Fisher Scientific | 20012-027 | For collagen adsorption |
| Hellmanex III | Sigma-Aldrich | Z805939 | For collagen adsorption |
| Hydrogen peroxide solution | Sigma-Aldrich | 216763 | For collagen adsorption |
| Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers, 1-Ply | Fisher Scientific | 06-666A | For polyelectrolyte swelling |
| NP2K VNA | Makarov Instruments | For polyelectrolyte swelling | |
| Poly(diallyldimethylammonium chloride), MW 200,000 | Sigma-Aldrich | 409022 | For polyelectrolyte swelling; for full synthesis procedure see Sadman et al. |
| Poly(styrene-sulfonate) sodium salt 30% weight in water | Sigma-Aldrich | 561967-500G | For polyelectrolyte swelling; for full synthesis procedure see Sadman et al. |
| Potassium Bromide | Sigma-Aldrich | 793604-1KG | For polyelectrolyte swelling |
| QSense QCM Explorer System | Biolin Scientific | For collagen adsorption | |
| Sodium acetate, anhydrous | Sigma-Aldrich | S2889 | For collagen adsorption |
| Spin coater, Model WS-650MZ-23NPP | Laurell technologies | For polyelectrolyte swelling |
Références
- Marx, K. A. Quartz crystal microbalance: A useful tool for studying thin polymer films and complex biomolecular systems at the solution - Surface interface. Biomacromolecules. 4 (5), 1099-1120 (2003).
- Kleber, C., Hilfrich, U., Schreiner, M. In situ QCM and TM-AFM investigations of the early stages of degradation of silver and copper surfaces. Applied Surface Science. 253 (7), 3712-3721 (2007).
- Yeh, C. J., Hu, M., Shull, K. R. Oxygen Inhibition of Radical Polymerizations Investigated with the Rheometric Quartz Crystal Microbalance. Macromolecules. 51 (15), 5511-5518 (2018).
- Sturdy, L. F., Yee, A., Casadio, F., Shull, K. R. Quantitative characterization of alkyd cure kinetics with the quartz crystal microbalance. Polymer. 103, 387-396 (2016).
- Delgado, D. E., Sturdy, L. F., Burkhart, C. W., Shull, K. R. Validation of quartz crystal rheometry in the megahertz frequency regime. Journal of Polymer Science, Part B: Polymer Physics. , 1-9 (2019).
- Bilchak, C. R., Huang, Y., Benicewicz, B. C., Durning, C. J., Kumar, S. K. High-Frequency Mechanical Behavior of Pure Polymer-Grafted Nanoparticle Constructs. ACS Macro Letters. 8 (3), 294-298 (2019).
- Hook, F., Rodahl, M., Brzezinski, P., Kasemo, B. Energy dissipation kinetics for protein and antibody-antigen adsorption under shear oscillation on a quartz crystal microbalance. Langmuir. 14, 729-734 (1998).
- Liss, M., Petersen, B., Wolf, H., Prohaska, E. An aptamer-based quartz crystal protein biosensor. Analytical Chemistry. 74 (17), 4488-4495 (2002).
- Felgueiras, H. P., Murthy, N. S., Sommerfeld, S. D., Brás, M. M., Migonney, V., Kohn, J. Competitive Adsorption of Plasma Proteins Using a Quartz Crystal Microbalance. ACS Applied Materials and Interfaces. 8 (21), 13207-13217 (2016).
- Keller, C. A., Kasemo, B. Surface specific kinetics of lipid vesicle adsorption measured with a quartz crystal microbalance. Biophysical Journal. 75, 1397-1402 (1998).
- Olsson, A. L. J., Quevedo, I. R., He, D., Basnet, M., Tufenkji, N. Using the quartz crystal microbalance with dissipation monitoring to evaluate the size of nanoparticles deposited on surfaces. ACS Nano. 7 (9), 7833-7843 (2013).
- Xu, X., Zhang, C., Zhou, Y., Cheng, Q. L. J., Yao, K., Chen, Q. Quartz crystal microbalance study of protein adsorption on chitosan, chitosan/poly(vinyl pyrrolidone) blends and chitosan-graft-poly(vinyl pyrrolidone) surfaces. Journal of Bioactive and Compatible Polymers. 22, 195-206 (2007).
- Weber, N., Pesnell, A., Bolikal, D., Zeltinger, J., Kohn, J. Viscoelastic properties of fibrinogen adsorbed to the surface of biomaterials used in blood-contacting medical devices. Langmuir. 23, 3298-3304 (2007).
- Johannsmann, D. Viscoelastic, mechanical, and dielectric measurements on complex samples with the quartz crystal microbalance. Physical Chemistry Chemical Physics. 10 (31), 4516-4534 (2008).
- Denolf, G. C., Sturdy, L. F., Shull, K. R. High-frequency rheological characterization of homogeneous polymer films with the quartz crystal microbalance. Langmuir. 30 (32), 9731-9740 (2014).
- Martin, E. J., Mathew, M. T., Shull, K. R. Viscoelastic properties of electrochemically deposited protein/metal complexes. Langmuir. 31 (13), 4008-4017 (2015).
- Sturdy, L., Casadio, F., Kokkori, M., Muir, K., Shull, K. R. Quartz crystal rheometry: A quantitative technique for studying curing and aging in artists' paints. Polymer Degradation and Stability. 107, 348-355 (2014).
- Sadman, K., Wiener, C. G., Weiss, R. A., White, C. C., Shull, K. R., Vogt, B. D. Quantitative Rheometry of Thin Soft Materials Using the Quartz Crystal Microbalance with Dissipation. Analytical Chemistry. 90 (6), 4079-4088 (2018).
- Wasilewski, T., Szulczyński, B., Kamysz, W., Gębicki, J., Namieśnik, J. Evaluation of three peptide immobilization techniques on a qcm surface related to acetaldehyde responses in the gas phase. Sensors (Switzerland). 18 (11), 1-15 (2018).
- Lvov, Y., Ariga, K., Kunitake, T., Ichinose, I. Assembly of Multicomponent Protein Films by Means of Electrostatic Layer-by-Layer Adsorption. Journal of the American Chemical Society. 117 (22), 6117-6123 (1995).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift für Physik. 155 (2), 206-222 (1959).
- Sadman, K., Wang, Q., Chen, Y., Keshavarz, B., Jiang, Z., Shull, K. R. Influence of Hydrophobicity on Polyelectrolyte Complexation. Macromolecules. 50 (23), 9417-9426 (2017).
- Sievers, P., Moß, C., Schröder, U., Johannsmann, D. Use of torsional resonators to monitor electroactive biofilms. Biosensors and Bioelectronics. 110, 225-232 (2018).
- Ringberg, J. Q-Sense Explorer Operator Manual. Biolin Scientific. , (2017).
- Ringberg, J. Q-Sense User Guide: Instrument care and sensor pre-cleaning. Biolin Scientific. , (2015).
- Kern, W. The Evolution of Silicon Wafer Cleaning Technology. Journal of The Electrochemical Society. 137 (6), 1887 (1990).
- Sadman, K. . sadmankazi/QCM-D-Analysis-GUI: QCMD-Analyze. , (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon