Method Article
Dissezione dei Gangli autonomi pelvici e dei nervi associati nei ratti maschi e Femmine
In questo articolo
Riepilogo
I principali gangli pelvici contengono neuroni parasimpatici e simpatici che innervare gli organi pelvici. Qui descriviamo un metodo di dissezione e forniamo schemi per l'identificazione di questi gangli e dei loro nervi associati. Questi metodi possono essere applicati alla manipolazione sperimentale di questi gangli in vivo o alla rimozione post-mortem per ulteriori studi.
Abstract
I principali gangli pelvici bilaterali (MPG; sinonimo, gangli pelvici) sono la fonte primaria di neuroni simpatici e parasimpatici postganglionici e parasimpatici che innernomiano gli organi pelvici dei roditori; la struttura funzionalmente equivalente negli esseri umani è il plesso ipogastrico inferiore. I principali gangli pelvici forniscono anche il percorso mediante il quale gli assoni sensoriali lombare e sacrale raggiungono gli organi pelvici. Questi gangli complessi e misti possono rivelarsi difficili da identificare e sezionare per un ulteriore studio sperimentale dei normali meccanismi autonomici o per stabilire modelli preclinici di malattia, lesioni o dolore viscerale. Qui descriviamo un protocollo per accedere e visualizzare questi gangli e i loro tratti nervosi associati. Forniamo questo protocollo con schemi per i ratti maschi e femmine, in quanto le dimensioni del ganglio e i punti di riferimento per l'identificazione differiscono tra i sessi. Il protocollo descrive la rimozione dei gangli per studi in vitro, ma questo metodo può essere integrato in un protocollo di recupero chirurgico per interventi sperimentali (ad esempio, frantuma nervosa, resezione nervosa) o per la mappatura di circuiti neuronali (ad esempio, mediante microiniezione di traccianti neurali). Dimostriamo anche le strutture primarie del ganglio e i relativi nervi immediatamente dopo la dissezione e la colorazione immunoistochimica.
Introduzione
Il ratto è una delle specie più caratterizzate utilizzate nello studio della fisiologia e dell'anatomia dell'organo pelvico. Sebbene esistano risorse eccellenti per le descrizioni di questi organi1,2, generalmente non forniscono informazioni sulle strutture neurali correlate o lo fanno a risoluzione insufficiente per guidare uno studio sperimentale. Come descritto più avanti, l'organizzazione dei gangli autonomi che regolano la funzione degli organi pelvici è molto diversa dal resto del sistema nervoso autonomo, rendendo difficile dedurre con precisione le caratteristiche di innervazione pelvica dalle informazioni neuroanatomiche disponibili per altri gangli autonomici. Questa carenza di risorse per guidare i ricercatori che entrano in questa zona può aver rallentato la ricerca sulla regolazione neurale degli organi pelvici. Qui descriviamo i protocolli per l'accesso a questa regione del sistema nervoso per ulteriori studi in vitro o interventi sperimentali.
I principali gangli pelvici bilaterali (MPG; sinonimi: gangli pelvici; gangli paracervici [femmina]; Il ganglio [femmina] di Frankenh-user) è la fonte primaria di neuroni postganglionici simpatici e parasimpatici che innervagano gli organi pelvici dei roditori; il plesso ipogastrico inferiore comprende la struttura neuronale equivalente in esseri umani3,4,5,6. Proiezioni sensoriali da gangli di radice dorsale lombare e sacrale viaggiano anche attraverso il MPG per raggiungere gli organi pelvici. Pertanto, la comprensione del circuito neurale e della biologia del MPG è fondamentale per gli studi preclinici su una miriade di condizioni cliniche relative allo sviluppo e alla funzione adulta degli organi pelvici. Diverse descrizioni eccellenti di roditori MPG sono state pubblicate7,8, ma la nostra esperienza è che in generale queste descrizioni non sempre forniscono una guida sufficiente per praticamente informare una dissezione sperimentale o manipolazione di queste strutture quando è richiesto il recupero dell'animale. Inoltre, la maggior parte degli studi MPG si concentra sui ratti maschi. Nei ratti femminili, gli MPG sono più piccolidi 9 e hanno distinti punti di riferimento anatomici, e quindi richiedono una guida distintamente su misura per la visualizzazione e la dissezione.
Percorsi simpatici e parasimpatici si distinguono per la loro anatomia, in particolare la posizione dei loro neuroni preganinici, con percorsi simpatici che hanno neuroni preganinici nel midollo spinale toracico-lombare e i neuroni preganglioni parasimpatici prembali situati nel tronco (proiezioni nervo cranico) e nel midollo spinale sacrale. Nella maggior parte delle altre regioni del sistema autonomo, i loro neuroni gangliari bersaglio si trovano in distinti gangli simpatici o parasimpatici. Tuttavia, il MPG è insolito nell'essere mescolato gangli simpatici-parasimpatici, e quindi su scala macroscopica sono siti di convergenza da assoni preganinici di entrambe le regioni spinali toraco-lombare e sacrali. Abbiamo quindi incluso nei nostri protocolli la posizione e la descrizione di questi tratti nervosi primari che collegano ogni regione spinale con l'MPG, facilitando l'analisi sperimentale o la manipolazione separata di questi componenti neurali. Notiamo inoltre per i lettori che confrontano specificamente questi gangli tra le specie, che nei roditori preganglionici che sono 'funzionalmente sacrali', ad esempio, sono attivi e richiesti durante la miturizione, la defecazione e l'erezione del pene, si trovano a livelli spinali L6-S1 piuttosto che esclusivamente in segmenti sacrali10; allo stesso modo i gangli della radice dorsale L6 e S1 forniscono il principale input sensoriale 'sacrale' agli organi pelvici. Nei roditori, l'input sensoriale e preganglionico da circuiti neurali più rostrali è concentrato nei livelli spinali L1 e L210.
Qui descriviamo un protocollo per accedere al MPG e ai relativi tratti nervosi nei ratti maschi e femmine, e lo sosteniamo con schemi per illustrare punti di riferimento specifici. Questo protocollo guida l'accesso chirurgico a queste strutture in un contesto sperimentale di rimozione del tessuto per studi in vitro, ad esempio isolando i neuroni MPG per la caratterizzazione molecolare o la coltura primaria. Può anche essere adattato alla rimozione di MPG dopo la perfusione intracardiaca con fissativo, anche se questa è una dissezione più difficile perché il tessuto neurale diventa più difficile da visualizzare quando i tessuti adiacenti sono privi di sangue. Questo protocollo può anche essere integrato in un ambiente chirurgico per l'intervento sperimentale di queste vie nervose (ad esempio, resezione nervosa, microiniezione di traccianti neurali). Questi tipi di dissezioni sono sempre più importanti per il crescente campo della medicina bioelettronica, dove si stanno sviluppando nuovi obiettivi e approcci per la neuromodulazione per il trattamento delle condizioni cliniche delle viscere pelviche11. Vi presentiamo il protocollo completo prima per i ratti maschi, poi una replica del protocollo su misura per i ratti femminili.
Protocollo
Tutte le procedure devono essere condotte in base ai requisiti istituzionali e dell'organismo di finanziamento per la sperimentazione animale. L'uso di animali per questa dissezione e il protocollo per l'eutanasia sono stati approvati dal Comitato Etico Animale presso l'Università di Melbourne (numero di protocollo 1814639).
NOTA: Le dissezioni qui illustrate sono state eseguite sui ratti Sprague-Dawley maschi e femmine adulti (Biomedical Sciences Animal Facility, Università di Melbourne), del peso di 280 g (femmina) e 350 g (maschio). Prima di queste dissezioni, i ratti sono stati eutanasia in una camera di CO2 per 4-5 min. Subito dopo la morte, MPG sono stati sezionati. Se si seziona il tessuto di un animale che ha subito perfusioni transcardiali con fissativo, prendere precauzioni per proteggere l'operatore dall'esposizione a fissativi, cioè eseguire la dissezione nell'armadio dei fumi o nell'armadio a valle e indossare attrezzature protettive personali adeguate. Un protocollo per la perfusione transcardiale è stato pubblicato nel dettaglio12.
1. Principali gangli pelvici e nervi adiacenti: accesso e resezione in un ratto maschio
NOTA: La figura 1 mostra i punti di riferimento anatomici per la visualizzazione MPG in un ratto maschio.
- Accesso alla cavità addominale e al bacino
- Mettere il ratto in posizione supina e accedere all'addome e al bacino attraverso un'incisione mediana ventrale, avendo cura di evitare la contaminazione del campo chirurgico con la pelliccia.
- Spostare delicatamente gli organi addominali da un lato utilizzando pinze o applicatori con punta di cotone. Si noti la posizione dei lobi ventrali della ghiandola prostatica e della vescica urinaria.
- Spostare la vescica seminale sul lato contralaterale.
- Tagliare i vas deferens per fornire un migliore accesso alla zona sovrastante il ganglio.
NOTA: Da questo punto della dissezione, il tessuto non deve asciugarsi; mantenere il tessuto umido con salina fisiologica (per la dissezione dei tessuti freschi) o fissativo (per l'animale fissato per perfusione). Mantenere il tessuto umido con salina non solo beneficia la struttura del tessuto, ma rende anche la dissezione più facile come nervi secchi sono più fragili e strappare più facilmente durante la manipolazione. - Identificare il lobo dorsolaterale della ghiandola prostatica, sulla cui superficie dorsale è la posizione del ganglio; questo non sarà ancora visibile.
- Per visualizzare il ganglio, sgombrare con cura i tessuti vicini e sovrastanti il ganglio. Se necessario, utilizzare un retrattore per mantenere il campo di dissezione libero.
- Rimuovere un aggregato vicino di tessuto adiposo e aprire la fascia laterale del bacino.
- Dissezione dell'MPG e dei nervi associati
- Identificare i seguenti luoghi che forniscono punti di riferimento per i prossimi passi della dissezione: il lobo dorsolaterale della ghiandola prostatica (il ganglio si trova sulla superficie di questo lobo, leggermente più caudale rispetto alla giunzione tra vescicola seminale e la prostata) e le vesciche seminali (dove convergono alla linea mediana indica la posizione del ganglio sull'asse rostrocaudaldelle dell'animale).
- Come richiesto da questo punto, rimuovere con attenzione qualsiasi tessuto che impedisca la visione completa delle strutture neurali, evitando danni alla capsula sottile della ghiandola prostatica o dei vasi principali.
- Identificare il nervo pelvico visualizzando i seguenti punti di riferimento e caratteristiche.
- Trova la vena iliaca interna e il suo ramo fine proiettando verso l'MPG e la vescica. Questo ramo vascolare corre parallelo ed è talvolta incorporato all'interno del nervo pelvico, quindi attraversa il ganglio.
- Posizionare delicatamente le pinze angolate a punta fine sotto il nervo pelvico e far scorrere le pinze lungo per liberarlo dal tessuto circostante.
NOTA: Può anche essere possibile isolare il nervo pelvico dal piccolo vaso che corre parallelo ad esso, ma per la maggior parte dei tipi di esperimenti questo non è essenziale. Confermare che la struttura è il nervo pelvico osservando in alta ingrandimento per determinare che il nervo contiene diversi fascicoli vagamente aggregati, che si distinguono facilmente al microscopio sezionante e sono caratteristici del pelvico nervo, come nessuno degli altri nervi principali associati con il ganglio mostrano questa netta fascicolazione.
- Identificare il nervo cavernoso visualizzando i seguenti punti di riferimento e caratteristiche.
- Dopo aver seguito il nervo pelvico alla sua giunzione con il ganglio, seguire il nervo cavernoso mentre viaggia attraverso la prostata e poi caudalmente verso i corpi cavernosi del pene.
- Se l'ingrandimento del microscopio lo consente, si noti che c'è un piccolo gruppo di nervi delicati che emergono dal ganglio tra i nervi pelvici e cavernosi; questi sono i nervi rettali che viaggiano verso l'intestino inferiore.
- Identificare il nervo ipogastrico visualizzando i seguenti punti di riferimento e caratteristiche.
- Identificare dove il nervo ipogastrico si unisce al ganglio sul suo bordo cranico, dopo aver viaggiato a fianco dell'ureteria.
- Confermare che il nervo ipogastrico è molto più sottile dei nervi pelvici o cavernosi e non è accompagnato da grandi vasi.
- Identificare mpG visualizzando le seguenti funzionalità.
- Visualizza i bordi ventrali, dorsali e cranici del ganglio, formando una forma triangolare.
- Confermare la posizione di ogni nervo maggiore: i nervi pelvici che emergono dal bordo dorsale del ganglio, il nervo cavernoso all'angolo più caudale del ganglio, il nervo ipogastrico dal suo bordo cranico e i nervi accessori che emergono dal ganglio bordo ventrale.
- Identificare i nervi accessori visualizzando i seguenti punti di riferimento e caratteristiche.
- Dopo aver sgomberato il tessuto per consentire la visualizzazione del bordo ventrale del ganglio, identificare un gruppo di nervi che si proiettano verso i tratti urinari e riproduttivi.
- Se l'ingrandimento del microscopio lo consente, identificare un gruppo caudale di nervi che entrano tra i lobi della prostata e un gruppo rostrale tra la vescica seminale e la vescica.
- Rimozione dell'MPG con i nervi associati
- Scivolare delicatamente le pinze tra il ganglio e la ghiandola prostatica sottostante, facendo attenzione a non forare la capsula sottile della prostata. Interrompere qualsiasi connessione tra il ganglio e la prostata.
- Cancellare eventuali connessioni finali con i tessuti circostanti per le lunghezze dei nervi necessari per l'esperimento, quindi tagliare ogni nervo.
- Utilizzando pinze sottili, spostare il ganglio con i nervi alla soluzione appropriata per l'esperimento e confermare che ciascuno dei nervi principali sono intatti.
2. Principali gangli pelvici e nervi adiacenti: accesso e resezione in un ratto femminile
NOTA: la figura 2 mostra i punti di riferimento anatomici per la visualizzazione MPG in un ratto femminile.
- Accesso alla cavità addominale e al bacino
- Mettere il ratto in posizione supina e accedere all'addome e al bacino attraverso un'incisione mediana ventrale, avendo cura di evitare la contaminazione del campo chirurgico con la pelliccia.
NOTA: Da questo punto della dissezione, il tessuto non deve asciugarsi; mantenere il tessuto umido con salina fisiologica (per la dissezione dei tessuti freschi) o fissativo (per l'animale fissato per perfusione). - Spostare delicatamente gli organi addominali da un lato utilizzando pinze o applicatori con punta di cotone. Si noti la posizione del corno uterino, vescica urinaria e retto.
- Tagliare i vasi ovarici e uterini e ritrarre il corno uterino.
- Immettere lo spazio peritoneale e eliminare delicatamente un aggregato di tessuto adiposo situato vicino alla cervice uterina.
- Mettere il ratto in posizione supina e accedere all'addome e al bacino attraverso un'incisione mediana ventrale, avendo cura di evitare la contaminazione del campo chirurgico con la pelliccia.
- Dissezione dell'MPG e dei nervi associati
- Identificare la parete laterale della cervice uterina, appena caudale alla sua giunzione con le corna uterine; questa regione è il punto di riferimento principale per definire la posizione MPG sull'asse rostrocaudaldell dell'animale.
- Come richiesto da questo punto, rimuovere con attenzione qualsiasi tessuto che impedisce una visione completa delle strutture neurali, evitando danni ai vasi principali.
- Identificare il nervo pelvico visualizzando i seguenti punti di riferimento e caratteristiche.
- Trova la vena iliaca interna e il suo ramo fine proiettando verso l'MPG e la vescica. Questo ramo corre parallelo ed è talvolta incorporato all'interno del nervo pelvico, quindi attraversa il ganglio.
- Confermare che la struttura è il nervo pelvico osservando in alta ingrandimento per determinare che il nervo contiene diversi fascicoli vagamente aggregati, che si distinguono facilmente al microscopio sezionante e sono caratteristici del pelvico nervo, come nessuno degli altri nervi principali associati con il ganglio mostrano questa netta fascicolazione.
- Identificare il nervo ipogastrico visualizzando i seguenti punti di riferimento e caratteristiche.
- Identificare dove il nervo ipogastrico si unisce al ganglio sul suo bordo cranico, dopo aver viaggiato a fianco dell'ureteria.
- Confermare che il nervo ipogastrico è molto più sottile dei nervi pelvici o cavernosi e non è accompagnato da grandi vasi.
- Identificare il nervo cavernoso visualizzando i seguenti punti di riferimento e caratteristiche.
- Dopo aver seguito il nervo pelvico alla sua giunzione con il ganglio, seguire il nervo cavernoso mentre viaggia caudalmente lungo la parete laterale della cervice verso la vagina.
- Se l'ingrandimento del microscopio lo consente, si noti che c'è un piccolo gruppo di nervi delicati che emergono dal ganglio tra i nervi pelvici e cavernosi; questi sono i nervi rettali che viaggiano verso l'intestino inferiore.
- Identificare i nervi accessori visualizzando i seguenti punti di riferimento e caratteristiche.
NOTA: I nervi accessori sono difficili da vedere, ma proiettano dall'aspetto mediale del MPG. Dopo aver sgomberato il tessuto per consentire la visualizzazione del bordo ventrale del ganglio, identificare un ammasso di nervi molto delicati che si proiettano verso i tratti urinari e riproduttivi. - Identificare mpG visualizzando le seguenti funzionalità.
- Visualizza i bordi ventrali, dorsali e cranici del ganglio, che formano una forma triangolare.
- Confermare la posizione di ogni nervo maggiore: i nervi pelvici che emergono dal bordo dorsale del ganglio, il nervo cavernoso all'angolo più caudale del ganglio, il nervo ipogastrico dal suo bordo cranico e i nervi accessori che emergono dal ganglio bordo ventrale.
- Rimozione dell'MPG con i nervi associati
- Posizionare delicatamente le pinze angolate a punta fine sotto il nervo pelvico e far scorrere le pinze lungo per liberarlo dalla cervice uterina sottostante e dal tessuto circostante.
NOTA: Può anche essere possibile isolare il nervo pelvico dal piccolo vaso che corre parallelo ad esso, ma per la maggior parte dei tipi di esperimenti questo non è essenziale. Se si dimostra la dissezione, posizionare una sutura sotto il nervo pelvico, per facilitarne la visualizzazione. - Ripetere il processo per il nervo cavernoso, quindi il nervo ipogastrico, e infine i nervi accessori.
- Scivolare delicatamente le pinze tra il ganglio e la cervice uterina sottostante. Interrompere eventuali connessioni tra il ganglio e la cervice.
- Cancellare eventuali connessioni finali con i tessuti circostanti per le lunghezze dei nervi necessari per l'esperimento, quindi tagliare ogni nervo.
- Utilizzando pinze sottili, spostare il ganglio con i nervi alla soluzione appropriata per l'esperimento e confermare che ciascuno dei nervi principali sono intatti.
- Posizionare delicatamente le pinze angolate a punta fine sotto il nervo pelvico e far scorrere le pinze lungo per liberarlo dalla cervice uterina sottostante e dal tessuto circostante.
3. Conferma dei componenti gangliari (opzionale)
- Dopo la rimozione del ganglio, immergere il ganglio in un tradizionale fissativo istologico (ad esempio, 4% di formalina tamponata) per un minimo di 1 h, lavare il fissativo con buffer di fosfato da 0,1 M e il tessuto di processo per criosezione e immunosinfocenza fluorescenza, come descritto in precedenza13.
NOTA: Molti anticorpi di alta qualità che riconoscono specificamente questi tre marcatori neurali sono disponibili in commercio. Vedere Tabella dei materiali per i reagenti utilizzati per l'etichettatura illustrata nella Figura 3. - In alternativa, i gangli di processo intatti (invano) per l'immunohistochimica utilizzando un metodo simile a quello precedente, ma aumentando i tempi di incubazione per gli anticorpi a 4 giorni (anticorpo primario) e 2 giorni (anticorpo secondario).
- Per dimostrare una popolazione importante di assoni sensoriali, utilizzare anticorpi contro il peptide legato al gene della calcitonina (CGRP).
NOTA: La diluizione raccomandata dell'anticorpo utilizzato in questo studio è 1:5.000. - Per dimostrare i neuroni simpatici noradrenergici, utilizzare anticorpi contro l'idralosillasi di tirosina (TH).
NOTA: La diluizione raccomandata dell'anticorpo utilizzato in questo studio è 1:5.000. - Per dimostrare una popolazione maggiore di neuroni colinergici, utilizzare anticorpi contro la synthasi dell'ossido nitrico neuronale (NOS).
NOTA: La diluizione raccomandata dell'anticorpo utilizzato in questo studio è 1:500.
Risultati
Una dissezione di successo non solo rimuoverà l'intero corpo dell'MPG intatto, ma manterrà anche il primo segmento di ciascuno dei nervi principali ancora attaccati. Questi nervi sono preziosi indicatori dell'orientamento dei gangli in vivo e forniscono quindi informazioni essenziali per molti tipi di studi anatomici (ad esempio, modelli di espressione di mappatura o cambiamenti cellulari dopo una perturbazione sperimentale). Sebbene la conservazione dei nervi associati possa essere meno importante per alcuni tipi di esperimenti (ad esempio, la dissociazione dei gangli per la coltura di neuroni isolati), la presenza di nervi fornisce anche un modo per gestire il ganglio senza toccare (e potenzialmente danneggiando) i corpi cellulari neuronali.
Una dissezione fallita avrà un ganglio incompleto o danneggiato, o dove i nervi primari non sono più attaccati. È anche possibile che i gangli o i nervi siano inconsapevolmente danneggiati durante la dissezione, sia perché il danno fisico è troppo sottile da rilevare al microscopio di dissezione o perché il danno diventa evidente solo durante alcuni tipi di saggi. Ad esempio, se il tessuto gangliato diventa asciutto durante la dissezione, il tessuto può apparire normale durante la manipolazione successiva, ma mostrerà alti livelli di fluorescenza non specifica sulla superficie.
Esempi di MPG sezionato sono illustrati nella Figura 3, che fornisce esempi dell'intero ganglio completo di spessore (Figura 3A) e un MPG che è stato criosezione per l'esecuzione di immunofluorescenza per dimostrare neuroni noradrenergici e colinergici (Figura 3B,C).
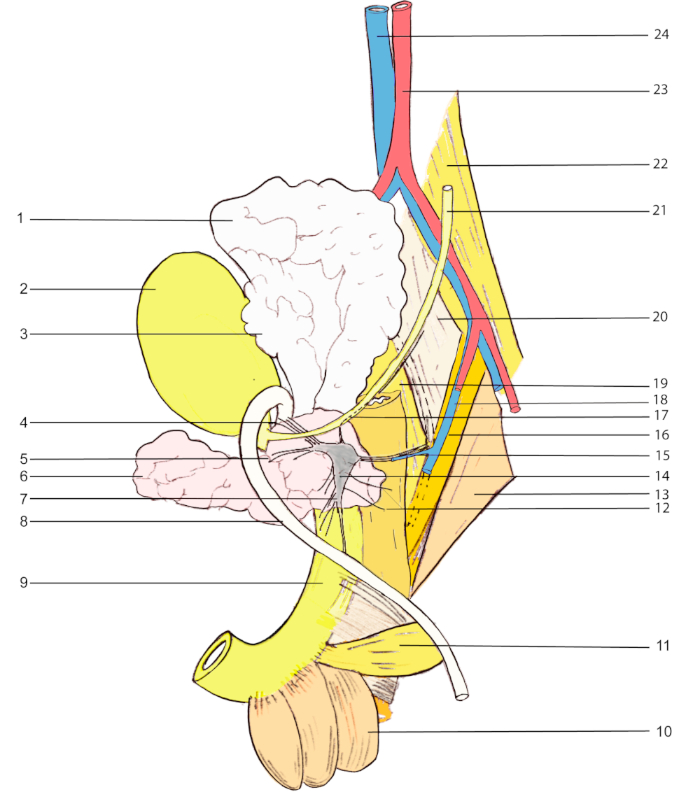
Figura 1: Punti di riferimento anatomici per la visualizzazione MPG in un ratto maschio. 1, vescica seminale; 2, vescica urinaria; 3, ghiandola coagulante; 4 & 5, nervi accessori; 6, prostata (lobo ventrale); 7, nervo cavernoso; 8, vas deferens; 9, uretra; 10, muscolo bulbocavernosus; 11, muscolo ischiocavernosus; 12, nervi rettali; 13, rapitore caudae externus; 14, principale ganglio pelvico; 15, nervo pelvico; 16, l'internoso del rapitore caudae; 17, nervo ipogastrico; 18, vena iliaca interna; 19, cavolo flessore; 20, flessore caudae longus; 21, ueter; 22, psoas maggiore; 23, aorta addominale; 24, vena cava inferiore. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Punti di riferimento anatomici per la visualizzazione MPG in un ratto femminile. 1, colon disal; 2, vescica urinaria; 3, corpo uterino; 4, nervo ipogastrico; 5, nervi accessori; 6, principali gangli pelvici; 7, nervo cavernoso; 8, vagina; 9, uretra; 10, retto; 11, rapitore caudae externus; 12, nervi rettali; 13, cavolo flessore caudae brevis; 14, nervo pelvico; 15, vena iliaca interna; 16, l'internoso del rapitore caudae; 17, flessore caudae longus; 18, arteria iliaca esterna; 19, udirettore; 20, psoas maggiore; 21, corno uterino; 22, aorta addominale. Fare clic qui per visualizzare una versione più grande di questa figura.
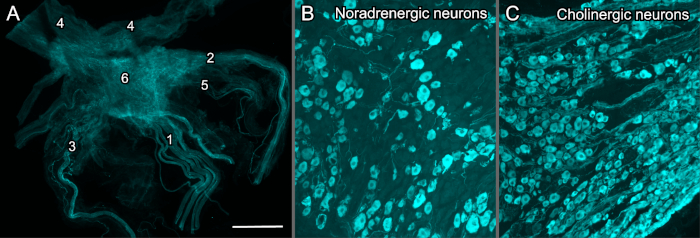
Figura 3: MPG etichettato immunositochimicamente da ratti maschi adulti. Tutti i preparati vie sono stati visualizzati con un microscopio a fluorescenza widefield convenzionale dotato di una fotocamera monocromatica, poi digitalmente colorata. (A) Wholemount (spessore completo), MPG fisso con nervi associati, immunohistochimicamente etichettato per i nervi sensoriali che esprimono peptide legato al gene di calcitonina (CGRP); 1, nervo pelvico (che mostra i fascicoli multipli); 2, nervo cavernoso; 3, nervo ipogastrico; 4, nervi accessori; 5, nervi rettali; 6, principale ganglio pelvico (MPG). (B, C) Criosezioni (14 m) di MPG fisso, immunohistochimicamente etichettato per dimostrare la natura mista noradrenergica-colinergica del ganglio; (B) neuroni noradrenergici dimostrati dall'anticorpo per l'idralolasi da tirosina e (C) una popolazione importante di neuroni colinergici per anticorpo per la synthasi dell'ossido nitrico neuronale. La barra di calibrazione rappresenta (A) 1.000 m, (B,C) 200 m. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Il controllo neurale degli organi pelvici è mediato da percorsi complessi tra cui componenti sensoriali somatici, parasimpatici, simpatici e viscerali14,15,16,17. La maggior parte di questi percorsi hanno origine o passano attraverso l'MPG. I protocolli di dissezione qui descritti forniscono un'introduzione all'anatomia MPG, ai nervi associati e ai punti di riferimento anatomici macroscopici nelle vicinanze; questi ultimi sono illustrati da schemi anatomici. Altri approcci alla dissezione di MPG possono anche avere successo, ma troviamo quello qui descritto per essere robusto e adatto per un ricercatore nuovo in questa zona del sistema nervoso.
Gli aspetti più critici del protocollo sono la corretta identificazione di ogni nervo maggiore e la completa rimozione del tessuto MPG. Con un'attenta visione e gestione dei tessuti, i tessuti MPG possono essere rimossi per studi anatomici, molecolari ed elettrofisiologici in vitro18,19,20,21,22. Il protocollo può anche essere adattato per la manipolazione sperimentale in vivo23,24,25, notando che in questo caso, è necessario prestare grande attenzione per ridurre al minimo il contatto con i nervi primari associati al ganglio o per danneggiare il vascolatura nelle vicinanze. Se l'esperimento richiede la denervazione selettiva per interruzione di uno o più nervi, si raccomanda di legarsi il nervo reciso per prevenire il reinnervazione e il confondere le analisi. Questo protocollo di dissezione potrebbe essere utilizzato anche per il mouse, dove c'è anche un MPG con funzione comparabile26,27,28.
Per gli studi neuroanatomici, la migliore conservazione degli antigeni e della struttura dei tessuti si ottiene sezionando il MPG da un animale anesteticato che è stato perfuso trasimportatialmente con fissativo istologico appropriato all'esperimento29; tuttavia, l'identificazione dei gangli e delle strutture nervose sono più difficili dopo questo processo, poiché la colorazione dei tessuti viene persa. Si raccomanda di diventare abile nell'identificare e sezionare il ganglio da animali non perfusi prima di tentare questa dissezione dopo la perfusione. Allo stesso modo, si raccomanda di diventare prima abile nella dissezione nei maschi perché per gli animali di età equivalente e dimensioni del corpo, l'MPG e i suoi nervi associati sono molto più piccoli nelle femmine.
Per convalidare che il tessuto rimosso è effettivamente il MPG, il ricercatore è prima consigliato di controllare la posizione e le caratteristiche di ogni nervo primario. Molti dispati svelato trovano il nervo pelvico e il nervo cavernoso il più facile da identificare in situ; i nervi ipogastrici e accessori sono più delicati e più difficili da distinguere dal tessuto circostante. Se questi nervi non sono più disponibili a causa di problemi durante la dissezione, o se c'è incertezza per quanto riguarda la loro struttura, si raccomanda che le dissezioni MPG iniziali siano caratterizzate da istologia convenzionale (per confermare la presenza di corpi cellulari neuronali8) e in secondo luogo con immunohistochimica (per identificare che entrambi i neuroni colinergici e noradrenergici sono presenti30, 31 ) e in secondo luogo con immunohistochimica (per identificare che entrambi i neuroni colinergici e noradrenergici sono presenti 30,31) ( Figura3). Per convalidare la corretta identificazione dei nervi maggiori, i nervi cavernosi sono facilmente identificabili dalla loro alta densità di corpi cellulari neuronali nella loro porzione iniziale vicino all'MPG; la maggior parte di questi neuroni esprimono marcatori di neuroni colinergici e nitrergici32,33. I nervi pelvici, ipogastrici e accessori hanno pochissimi corpi cellulari neuronali34.
Ci sono diverse insidie comuni nell'esecuzione di questa dissezione. Se i dissettorianti alle prime armi hanno difficoltà a trovare uno qualsiasi dei nervi principali o il MPG, sono incoraggiati a tornare ai passaggi che descrivono i punti di riferimento chiave. È molto comune diventare così concentrati sulla ricerca delle microstrutture che si perde traccia del contesto macroscopico. Più comunemente, i dispatie alle prime armi o si muovono troppo rostrali nel loro sito di dissezione o rimangono troppo "superficiali"-cioè troppo vicini all'apertura ventrale dell'addome, piuttosto che esaminare strutture più profonde (cioè più dorsali). Un problema comune durante la dissezione è il danno alla vascolatura durante la dissezione. Se inizia il sanguinamento, tenere delicatamente un applicatore con punta di cotone sulla sorgente fino a quando il sanguinamento non si ferma, quindi lavare l'area liberamente con salina prima di ripartire la dissezione. È possibile che l'MPG non sia utilizzabile per esperimenti se contaminato con troppo sangue o se la dissezione è ritardata troppo a lungo in attesa che il sanguinamento si fermi. Un altro errore di dissezione comune è il danno alla capsula della ghiandola prostatica che compromette significativamente la visualizzazione e la rimozione MPG. Questa capsula è una struttura molto delicata che viene facilmente forata rimuovendo il grasso dalla parete laterale della prostata, anche se si utilizza solo un applicatore con punta di cotone. Infine, i principali nervi associati all'MPG sono facilmente danneggiati durante il processo di identificazione di ciascuno e poi durante la rimozione dell'MPG. I dissettoriati sono incoraggiati a sviluppare una routine in cui ogni nervo è isolato a sua volta, in un ordine particolare, in modo che ci sia meno possibilità di confusione durante le fasi finali della rimozione dei gangli.
Questa dissezione non ha cercato di tracciare ciascuno dei componenti dei nervi accessori a organi specifici, né di identificare ciascuno dei molti microgangli che si trovano in vari punti tra i gangli pelvici e gli organi pelvici8. Questi sono abbastanza difficili da visualizzare in vivo senza l'uso di macchie specifiche; tuttavia, possono essere rimossi seguendo ciascuno dei tratti nervosi verso gli organi, e utilizzando specifiche macchie neurali post hoc per determinare la posizione del ganglio. Questi microganglia, anche se che comprendono solo una piccola frazione della popolazione neuronale rispetto al MPG, possono fornire tipi specifici di input agli organi a cui sono più vicini. Notiamo qui una limitazione nel campo che né questi microganglia né molti dei piccoli tratti nervosi che escono dal MPG per viaggiare verso gli organi pelvici hanno ancora ricevuto nomi ampiamente accettati. Inoltre, uno studio altrettanto dettagliato dei microganglia non è ancora stato condotto nei ratti femminili.
In sintesi, il protocollo e gli schemi qui forniti forniscono ai ricercatori strumenti per studiare le strutture primarie che forniscono l'apporto di nervi autonomi agli organi pelvici, così come i principali condotti periferici dei nervi sensoriali dalla radice dorsale del lumbosacrale gangli che viaggiano attraverso il MPG agli organi pelvici.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
La ricerca riportata in questa pubblicazione è stata sostenuta dall'Ufficio del Direttore, Istituti Nazionali di Sanità, Stimolante Attività Periferica per Alleviare le Condizioni (SPARC) Program, Award Number OT2OD023872. Il contenuto è di esclusiva responsabilità degli autori e non rappresenta necessariamente le opinioni ufficiali dei National Institutes of Health. La borsa di studio del Dr. Bertrand nel laboratorio del Dr. Keast è stata finanziata da: The University Hospital of N'mes, la facoltà di medicina di Montpellier-Nomes, l'Associazione Francese de Chirurgia (AFC), La Société Interdisciplinaire Francofond'UroDyna et de Pelvipérinéologie (SIFUD-PP) e il Programma Per la Famiglia (Azioni Marie Curie) del settimo programma quadro dell'Unione europea (FP7/2007-2013) nell'ambito dell'accordo di sovvenzione REA No PCOFUND-GA-2013-609102, attraverso il programma PRESTIGE coordinato da Campus Francia.
Materiali
| Name | Company | Catalog Number | Comments |
| Anti-calcitonin gene-related peptide; RRID AB_259091 | Merck | C8198 | |
| Anti-nitric oxide synthase, RRID AB_2533937 | Invitrogen | 61-7000 | |
| Anti-rabbit IgG, Cy3 tag, RRID AB_2307443 | Jackson | 711-165-152 | |
| Anti-tyrosine hydroxylase, RRID AB_390204 | Millipore | AB152 | |
| Dissecting microscope | Olympus | SZ40, SC | |
| Dumont AA epoxy coated forceps | Fine Science Tools | 11210-10 | |
| Dumont #5 forceps | Fine Science Tools | 11255-20 | |
| Dumont #5/45 curved forceps | Fine Science Tools | 11251-35 | |
| LED light source | Schott | KL 1600 | |
| Micro-Adson forceps | Fine Science Tools | 11019-12 | |
| Student Vannas spring scissors | Fine Science Tools | 91500-09 | |
| Surgical scissors | Fine Science Tools | 14054-13 |
Riferimenti
- Greene, E. C. . Anatomy of the Rat. , (1935).
- Krinke, G. J. . The Laboratory Rat. , (2000).
- Keast, J. R., McLachlan, E. M. Pelvic ganglia. Autonomic Ganglia. , 445-480 (1995).
- Keast, J. R. Unusual autonomic ganglia: connections, chemistry, and plasticity of pelvic ganglia. International Review of Cytology. 193, 1-69 (1999).
- Alsaid, B., et al. Coexistence of adrenergic and cholinergic nerves in the inferior hypogastric plexus: anatomical and immunohistochemical study with 3D reconstruction in human male fetus. Journal of Anatomy. 214 (5), 645-654 (2009).
- Keast, J. R., Smith-Anttila, C. J., Osborne, P. B. Developing a functional urinary bladder: a neuronal context. Frontiers in Cell and Developmental Biology. 3, 53 (2015).
- Purinton, P. T., Fletcher, T. F., Bradley, W. E. Gross and light microscopic features of the pelvic plexus in the rat. Anatomical Record. 175 (4), 697-705 (1973).
- Arellano, J., Xelhuantzi, N., Mirto, N., Hernández, M. E., Cruz, Y. Neural interrelationships of autonomic ganglia from the pelvic region of male rats. Autonomic Neuroscience. 217, 26-34 (2019).
- Greenwood, D., Coggeshall, R. E., Hulsebosch, C. E. Sexual dimorphism in the numbers of neurons in the pelvic ganglia of adult rats. Brain Research. 340 (1), 160-162 (1985).
- Nadelhaft, I., Booth, A. M. The location and morphology of preganglionic neurons and the distribution of visceral afferents from the rat pelvic nerve: a horseradish peroxidase study. Journal of Comparative Neurology. 226 (2), 238-245 (1984).
- Kessler, T. M., Birder, L. A., Gomery, P. Neuromodulation of urinary tract function. New England Journal of Medicine. 380 (21), 2067-2069 (2019).
- . Intracardiac perfusion with fixative for anatomical studies [keast-001-stage02] Available from: https://www.protocols.io/view/intracardiac-perfusion-with-fixative-for-anatomica-w3ffgjn (2019)
- . Immunohistochemical analysis of ganglion neurons innervating the lower urinary tract [keast-001-stage03] Available from: https://www.protocols.io/view/immunohistochemical-analysis-of-ganglion-neurons-i-w3efgje (2019)
- Fowler, C. J., Griffiths, D., de Groat, W. C. The neural control of micturition. Nature Reviews Neuroscience. 9 (6), 453-466 (2008).
- Keast, J. R., Booth, A., de Groat, W. C. Distribution of neurons in the major pelvic ganglion of the rat which supply the bladder, colon or penis. Cell and Tissue Research. 256 (1), 105-112 (1989).
- Dail, W. G., Minorsky, N. Composition of the pelvic nerve. Experimental Neurology. 92 (1), 278-283 (1986).
- Dail, W. G. The pelvic plexus: innervation of pelvic and extrapelvic visceral tissues. Microscopy Research and Technique. 35 (2), 95-106 (1996).
- Purves-Tyson, T. D., Arshi, M. S., Handelsman, D. J., Cheng, Y., Keast, J. R. Androgen and estrogen receptor-mediated mechanisms of testosterone action in male rat pelvic autonomic ganglia. Neuroscience. 148 (1), 92-104 (2007).
- Nangle, M. R., Keast, J. R. Semaphorin 3A inhibits growth of adult sympathetic and parasympathetic neurones via distinct cyclic nucleotide signalling pathways. British Journal of Pharmacology. 162 (5), 1083-1095 (2011).
- Tan, H., Mawe, G. M., Vizzard, M. A. Electrical properties of neurons in the intact rat major pelvic ganglion. Autonomic Neuroscience. 134 (1-2), 26-37 (2007).
- Park, K. S., et al. An alpha3beta4 subunit combination acts as a major functional nicotinic acetylcholine receptor in male rat pelvic ganglion neurons. Pflügers Archiv - European Journal of Physiology. 452 (6), 775-783 (2006).
- Park, K. S., et al. Modulation of N-type Ca2+ currents by A1-adenosine receptor activation in male rat pelvic ganglion neurons. Journal of Pharmacology and Experimental Therapeutics. 299 (2), 501-508 (2001).
- Payne, S. C., Belleville, P. J., Keast, J. R. Regeneration of sensory but not motor axons following visceral nerve injury. Experimental Neurology. 266, 127-142 (2015).
- Nangle, M. R., Proietto, J., Keast, J. R. Impaired cavernous reinnervation after penile nerve injury in rats with features of the metabolic syndrome. Journal of Sexual Medicine. 6 (11), 3032-3044 (2009).
- Kepper, M. E., Keast, J. R. Specific targeting of ganglion cell sprouts provides an additional mechanism for restoring peripheral motor circuits in pelvic ganglia after spinal nerve damage. Journal of Neuroscience. 18 (19), 7987-7995 (1998).
- Yan, H., Keast, J. R. Neurturin regulates postnatal differentiation of parasympathetic pelvic ganglion neurons, initial axonal projections, and maintenance of terminal fields in male urogenital organs. Journal of Comparative Neurology. 507 (2), 1169-1183 (2008).
- Ritter, K. E., Wang, Z., Vezina, C. M., Bjorling, D. E., Southard-Smith, E. M. Serotonin receptor 5-HT3A affects development of bladder innervation and urinary bladder function. Frontiers in Neuroscience. 11, 690 (2017).
- Tompkins, J. D., Girard, B. M., Vizzard, M. A., Parsons, R. L. VIP and PACAP effects on mouse major pelvic ganglia neurons. Journal of Molecular Neuroscience. 42 (3), 390-396 (2010).
- Forrest, S. L., Payne, S. C., Keast, J. R., Osborne, P. B. Peripheral injury of pelvic visceral sensory nerves alters GFRα (GDNF family receptor alpha) localization in sensory and autonomic pathways of the sacral spinal cord. Frontiers in Neuroanatomy. 9, 43 (2015).
- Keast, J. R., Luckensmeyer, G. B., Schemann, M. All pelvic neurons in male rats contain immunoreactivity for the synthetic enzymes of either noradrenaline or acetylcholine. Neuroscience Letters. 196 (3), 209-212 (1995).
- Keast, J. R., de Groat, W. C. Immunohistochemical characterization of pelvic neurons which project to the bladder, colon, or penis in rats. Journal of Comparative Neurology. 288 (3), 387-400 (1989).
- Dail, W. G., Moll, M. A., Weber, K. Localization of vasoactive intestinal polypeptide in penile erectile tissue and in the major pelvic ganglion of the rat. Neuroscience. 10 (4), 1379-1386 (1983).
- Keast, J. R. A possible neural source of nitric oxide in the rat penis. Neuroscience Letters. 143 (1-2), 69-73 (1992).
- Kepper, M. E., Keast, J. R. Transmitter profile and spinal inputs of pelvic ganglion cells projecting with preganglionic axons along the hypogastric and pelvic nerves of the male rat. Neuroscience Letters. 280 (2), 123-126 (2000).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon