Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Bioengineering
Manipulatie van enkele neurale stamcellen en neuronen in hersenschijfjes met behulp van roboticamicroïsjectie
Dit protocol toont het gebruik van een robotplatform voor micro-injectie in enkele neurale stamcellen en neuronen in hersenschijfjes. Deze techniek is veelzijdig en biedt een methode om cellen te volgen in weefsel met een hoge ruimtelijke resolutie.
Een centrale vraag in ontwikkelingsneurobiologie is hoe neurale stam- en voorlopercellen de hersenen vormen. Om deze vraag te beantwoorden, moet men labelen, manipuleren, en volgen enkele cellen in het hersenweefsel met een hoge resolutie na verloop van tijd. Deze taak is zeer uitdagend vanwege de complexiteit van weefsels in de hersenen. We hebben onlangs een robot ontwikkeld, die een micro-injectienaald in hersenweefsel leidt bij het gebruik van beelden die uit een microscoop zijn verkregen om femtolitervolumes van oplossing in enkele cellen te leveren. De robotoperatie verhoogt een totale opbrengst die groter is dan handmatige microinjectie en zorgt voor nauwkeurige etikettering en flexibele manipulatie van enkele cellen in levend weefsel. Hiermee kan men honderden cellen microinjecteren in een enkel organotypisch plakje. Dit artikel toont het gebruik van de micro-injectie robot voor geautomatiseerde micro-injectie van neurale voorloper cellen en neuronen in de hersenen weefsel plakjes. Meer in het algemeen, het kan worden gebruikt op elk epitheelweefsel met een oppervlak dat kan worden bereikt door de pipet. Eenmaal ingesteld, kan de micro-injectierobot 15 of meer microinjecties per minuut uitvoeren. De micro-injectie robot vanwege de doorvoer en versaliteit zal micro-injectie een breed eenvoudige high-performance cel manipulatie techniek worden gebruikt in bio-engineering, biotechnologie, en biofysica voor het uitvoeren van eencellige analyses in organotypic hersenen plakjes.
Dit protocol beschrijft het gebruik van een robot om enkele cellen in plakjes hersenweefsel te targeten en te manipuleren, met name gericht op enkele neurale stamcellen en neuronen. De robot werd ontwikkeld om een centrale vraag in ontwikkelingsneurobiologie aan te pakken, dat is hoe neurale stam- en voorlopercellen bijdragen aan de hersenmorfogenese1,2,3,4,5. Om deze vraag te beantwoorden, moet men enkele neurale stamcellen labelen en volgen en hun afstammingprogressie na verloop van tijd volgen om enkelcellig gedrag te correleren met weefselmorfogenese. Dit kan op verschillende manieren worden bereikt, bijvoorbeeld door hersenweefsel in de baarmoeder te elektroporeren of door eencellige te labelen met lipofiele matrijzen. Hoewel krachtig, deze methoden missen nauwkeurige eencellige resolutie (elektroporatie) en / of de mogelijkheid om de intracellulaire ruimte (lipofiele kleurstof) te manipuleren. Microinjectie in enkele cellen werd ontwikkeld om deze uitdaging te overwinnen6,7,8. Tijdens microinjectie wordt een pipet kort in een enkele cel in intact weefsel ingebracht onder druk om femtolitervolumes van reagentia te microinjecteren9. We hebben eerder een handmatige procedure beschreven voor het microinjecteren van enkele neurale stamcellen in organotypisch weefsel(figuur 1A)10,11. Microinjectie in neurale stamcellen is afhankelijk van het gebruik van een micropipet die wordt ingebracht in enkele neurale stamcellen om een oplossing te injecteren die een fluorescerende kleurstof bevat, samen met andere moleculen van belang. De selectieve targeting van neurale stamcellen wordt bereikt door het benaderen van de zich ontwikkelende telencephalon via het ventriculaire oppervlak (of ventrikel, zie cartoon in figuur 1A), dat wordt gevormd door het apicale plasmamembraan van apicale voorlopers (cartoon in figuur 1A). Dit proces moet worden herhaald voor elke cel die de onderzoeker wil injecteren. Verder is het succes van microinjectie afhankelijk van de nauwkeurige controle van de diepte en duur van micropipet injectie in het weefsel. Dus, ondanks de unieke voordelen, handmatige microinjectie is uiterst vervelend en vereist aanzienlijke oefening uit te voeren op redelijke doorvoer en opbrengst, waardoor deze techniek moeilijk te gebruiken in een schaalbare manier. Om deze beperking te overwinnen, hebben we onlangs een beeldgeleide robot ontwikkeld, de Autoinjector12 (of microinjection robot) die automatisch micro-injecties in enkele cellen kan uitvoeren.
De micro-injectierobot maakt gebruik van microscopische beeldvormings- en computervisiealgoritmen om specifieke locaties in 3D-ruimte in weefsel nauwkeurig te targeten voor microinjectie(figuur 1B). De microinjectierobot kan worden gebouwd door relatief eenvoudige wijzigingen aan te brengen in een bestaande microinjectie-setup. Het algemene schema van de microinjectierobot wordt weergegeven in figuur 1C. Een pipet is gemonteerd in een pipethouder bevestigd aan een drieassige manipulator. Een microscoopcamera wordt gebruikt om beelden van het weefsel en de microinjectienaald te verkrijgen. Een aangepaste drukregulatie systeem wordt gebruikt om de druk in de pipet te controleren en een programmeerbare micromanipulator wordt gebruikt om de positie van de microinjector pipet te controleren. De camerabeelden van het weefsel en de microinjectiepipet worden gebruikt om de ruimtelijke locatie van de microinjectiepipetpunt te bepalen en de locaties waar microinjecties moeten worden uitgevoerd. De software berekent vervolgens trajecten die nodig zijn om de pipet in het weefsel te verplaatsen. Alle hardware wordt gecontroleerd door de software die we eerder hebben ontwikkeld. Alle software is geschreven in codeertaal (bijvoorbeeld Python en Arduino) en kan worden gedownload van https://github.com/bsbrl/Autoinjector met instructies. De grafische gebruikersinterface (GUI) stelt de gebruiker in staat om het weefsel en micropipet in beeld te brengen en het traject van microinjectie aan te passen. Ons systeem kan worden vastgesteld met behulp van relatief eenvoudige wijzigingen aan een omgekeerde microscoop uitgerust met brightfield en epi-fluorescentie filters.
Ten eerste geven we instructies over het voorbereiden van hersenorganotypische weefselplakken voor microinjectie. Vervolgens illustreert het protocol het starten van de microinjectierobot gevolgd door voorbereidende stappen, zoals pipetbewegingkalibratie, die moeten worden gedaan voordat de microinjectie wordt geïnjecteerd. Dit wordt gevolgd door het definiëren van de injectieparameters. Hierna kan de gebruiker het traject definiëren dat door de microinjectierobot wordt gebruikt en de injectieprocedure starten. Het microinjected weefsel (in dit geval hersenorganotypische weefselschijfjes) kan gedurende verschillende perioden in de kweek worden bewaard, afhankelijk van het experimentele ontwerp10,11. Het weefsel kan worden verwerkt om de identiteit en het lot van de geïnjecteerde cellen en hun nakomelingen te volgen en te bestuderen. Als alternatief kunnen de microinjected cellen worden gevolgd met behulp van live beeldvorming. Binnen het toepassingsgebied van dit protocol, tonen we het gebruik van de robot om automatisch micro-injectie neurale voorloper cellen in organotypic plakjes van de muis E14.5 dorsale telencephalon. De robot is verder in staat microinjectie in pasgeborenen neuronen in de muis telencephalon, evenals in de menselijke foetale telencephalon12.
Samengevat beschrijven we een robotplatform dat kan worden gebruikt om enkele cellen in weefsel te volgen en te manipuleren. Het platform maakt gebruik van druk en is daarom zeer veelzijdig wat betreft de chemische aard van de verbinding om te injecteren. Bovendien kan het worden aangepast aan andere doelcellen dan stamcellen. We verwachten dat ons systeem ook eenvoudig kan worden aangepast aan andere modelsystemen.
Alle dierproeven werden uitgevoerd in overeenstemming met de Duitse wetgeving inzake dierenwelzijn, en de nodige vergunningen werden verkregen van de regionale Ethische Commissie voor Dierproeven van Dresden, Duitsland (Tierversuchskommission, Landesdirektion Dresden). Organotypic plakjes werden bereid van E14.5 of E16.5 C57BL/6 muis embryonale telencephalon (Janvier Labs).
1. Installatie van software
- Volg instructies om de software van https://github.com/bsbrl/Autoinjector te installeren.
2. Bereiding van reagentia en pipetten
- Agarose: Bereid 3% agarose door afzonderlijk oplossen van 3 g van breed scala agarose en 3 g laag-smeltpunt agarose in 100 mL van cel cultuur-grade PBS in twee afzonderlijke 200 mL glazen flessen, respectievelijk. Bewaar maximaal 3 maanden op kamertemperatuur.
- Tyrode-oplossing: Los 1 g natriumbicarbonaat en Tyrodes zout op (gebruik het gehalte aan de gehele fles) en 13 mL van 1 M HEPES in 1 L gedestilleerd water. Pas de pH aan op 7,4. Filter de oplossing door een 0,2 μm flestopfilter.
- Slice kweekmedium (SCM): Voeg 10 mL rattenserum toe, 1 mL van 2 mM glutamine, 1 mL penicilline-streptomycine (100x), 1 mL N-2 supplement (100x), 2 mL B27 supplement (50x) en 1 mL HEPES (pH 7.3) buffer in 84 mL neurobasal medium. Aliquot 5 mL SCM in 15 mL buizen. Bewaar bij -20 °C.
- CO2-IndependentMicroinjection Medium (CIMM): Bereid 5x DMEM gemodificeerde low-glucose oplossing (zonder fenol rood) door het oplossen van het poeder in 200 mL gedestilleerd water. Filteroplossing door een 0,2 μm bottle-top filter (gebruik voor het DMEM poeder de inhoud van de gehele fles). Om 100 mL CIMM voor te bereiden, meng 20 mL 5x DMEM gemodificeerde oplossing, 1 mL HEPES buffer, 1 mL N2 supplement (100x), 2 mL B27 supplement (50x), 1 mL penicilline-streptomycine (100x), 1 mL van 2 m glutamine en 74 mL gedestilleerd water. Bewaar de oplossing op 4 °C.
- Reconstitutiebuffer: Bereid de reconstitutiebuffer voor door 262 mM NaHCO3, 0,05 N NaOH, 200 mM HEPES in gedestilleerd water op te lossen. Steriliseer de oplossing door filtratie door middel van een fles-top 0,22 μm filtersysteem in een steriele glazen fles. Aliquot 500 μL reconstitution buffer in luchtdichte microcentrifuge buizen. Bewaar bij 4 °C.
- Microinjectie kleurstof voorraad: Los de fluorescerende gelabeld Dextran in RNase vrij gedestilleerd water (uiteindelijke concentratie 10 μg/μL). Bereid 5 μL aliquots voor en bewaar bij -20 °C tot gebruik.
- Trek de micro-injectiepipetten uit borosilicaatglazen haarvaten (1,2 mm buitendiameter, binnendiameter van 0,94 mm) met behulp van de micropipettrekker. Bescherm de pipetten tegen stof. Bewaar pipetten niet langer dan 2 – 3 dagen. Voor dit experiment waren de trekparameters HEAT: hellingstemperatuur +1 – 5; PULL: 100; VEL: 110; DEL: 100. HEAT en VEL zijn de parameters die de meeste vorm en grootte van de pipet beïnvloeden.
LET OP: De optimale microinjectiepipet heeft een lange en flexibele punt, om celschade tijdens microinjectie te voorkomen.
3. Preparaat van weefselschijf
- Smelt de 3% breed scala agarose met behulp van een magnetron voorafgaand aan de hersenweefsel dissectie. Laat de agarose niet stollen door in een waterbad op 37 °C te blijven voordat u inbedding krijgt. Zorg ervoor dat de pipetten beschermd zijn tegen stof. Bewaar pipetten niet langer dan 2 – 3 dagen.
- Ontdooi een aliquot van SCM en warm 10 – 12 mL CIMM en 20 mL van Tyrode's oplossing tot 37 °C met behulp van een waterbad.
- Meng de fluorescerende tracer (Dextran-3000 of Dextran-10000-Alexa vervoegt; eindconcentratie 5 – 10 μg/μL) met de andere chemische(s) die moet worden geïnjecteerd. Centrifugeer de microinjectieoplossing op 16, 000 x g gedurende 30 minuten bij 4 °C. Verzamel de supernatant en breng over in een nieuwe buis. Houd de microinjectieoplossing op ijs tot gebruik.
- Gebruik de hoofden van E13.5 – E16.5 muisembryo's om organotypische weefselplakken van de telencephalon voor te bereiden. Verwijder de huid en open de schedel met behulp van de tang, bewegen langs de middellijn. Ontleden de embryonale hersenen uit de open schedel en verwijder de hersenvliezen die het hersenweefsel vanaf de ventrale kant van de hersenen. Laat het ontleede hele brein in Tyrode's oplossing op een 37 °C verwarmingsblok.
OPMERKING: Alle in punt 3.4 beschreven dissectiestappen moeten worden uitgevoerd in de oplossing van voorgewarmd Tyrode. - Giet het brede scala gesmolten agarose in een wegwerp inbedding schimmel. Wanneer de agarose wordt gekoeld tot 38 – 39 °C, breng je de hersenen (maximaal 4) er voorzichtig in met behulp van een Pasteur pipet. Gebruik altijd cut tips voor deze stap.
- Roer de agarose rond het weefsel, hetzij met behulp van een spatel of een paar Dumont #1 tangen zonder het weefsel aan te raken. Laat de agarose stollen bij kamertemperatuur. Zodra de agarose is gestold, trim de overtollige agarose rond het weefsel.
- Vul de bufferlade met PBS. Oriënteer de hersenen met de rostro-caudal as van het weefsel loodrecht op de lade (gebruik als oriëntatiepunt de reukbollen, die het rostral-grootste deel van de hersenen vertegenwoordigen). Snijd 250 μm plakjes met behulp van een vibratome.
- Vul een petrischaaltje van 3,5 cm met 2 mL voorverwarmde media. Met behulp van een plastic Pasteur pipet, breng plakjes (10 - 15) naar dit gerecht. Eenmaal gedaan, verschuif de petrischaal met de plakjes in de slice cultuur incubator. Houd de plakjes op 37 °C in een bevochtigde atmosfeer met 40% O2 / 5% CO2 / 55% N2 tot gebruik.
4. Microinjectie
- Zet de computer, microscoop, microscoop camera, manipulators, druk tuig, en druksensor. Laad de toepassing door op het bestand" launchapp.py" te klikken in de hoofdmap die is gedownload van GitHub en geef de apparaatinstellingen op in het pop-upscherm (zie stap 1.1 voor installatie-instructies).
- Maak een uitgaande druk om ongewenste verstopping te voorkomen voordat u de pipet in de oplossing dompelt. Als u druk wilt uitoefenen op de pipet, schuift u de compensatiedrukbalk naar 24 – 45% en klikt u op Waarden instellen. Stem vervolgens de druk af op voldoende druk door de mechanische drukklepknop op 1 – 2 PSI (69 – 138 mbar) te draaien, zoals aangegeven door de druksensor.
- Breng de plakjes over op een petrischaal van 3,5 cm met 2 mL voorverwarmde CIMM. Plaats de te microïnjecte plakjes in het midden van de petrischaal. Breng de petrischaal naar de voorverwarmde microinjectiefase (37 °C).
- Laad de microinjectiepipet met 1,4 –1,6 μL microinjected solution (vanaf stap 3.3) met behulp van een plastic pipet met lange puntjes. Plaats de microinjectiepipet op de pipethouder.
- Met behulp van de laagste vergroting op de microscoop, breng het segment in focus en begeleiden de micropipet naar dit gezichtsveld (FOV), zodat het is gericht op hetzelfde vlak als de slice doel. Schakel de uitgang van de microscoop naar de camera om de FOV in de toepassing te zien.
- Klik op de vergrotingsknop linksboven in de interface om apparaatkalibratie te starten. Een venster vraagt om de vergroting te selecteren. Selecteer de 10x vergroting, of welke vergroting de lens is ingesteld op (bijvoorbeeld 4x, 10x, 20x, 40x) en druk op Ok. De software gaat ervan uit dat de interne objectieve lens is 10x (de meest voorkomende objectieve lens vergroting).
- Richt de pipetpunt opnieuw met behulp van het micrometrische wiel van de microscoop en klik met de cursor op de pipetpunt. Druk vervolgens op de knop stap 1.1 en druk op OK in het pop-upvenster. De pipet beweegt in de Y-richting. Klik op de punt van de pipet en druk op de stap 1.2 knop. Voer ten slotte 45 in de pipettehoekkast en druk op de instelhoek.
- Voer de gewenste parameters in het paneel Automatische microinjectiebesturingselementen in. Voor micro-injectie in apicale voorlopers stelt u de injectieafstand in op 20 – 40 μm en diepte op 10 – 15 μm. Voor microinjectie in neuronen stel de injectieafstand 30 – 40 μm van de basale kant, en diepte tot 10 – 30 μm, afhankelijk van wat wordt gericht. Stel de snelheid altijd in op 100%. Klik op Waarden instellen.
OPMERKING: De naderingsafstand is de afstand die de pipet uit het weefsel trekt voordat hij naar de volgende injectieafstand gaat, diepte is de diepte in het weefsel dat de microinjectie gaat, afstand is de afstand langs de lijn tussen sequentiële injecties, snelheid is de snelheid van de pipet in μm/s. - Klik op de knop Rand tekenen en sleep de cursor langs de gewenste baan in het pop-upvenster om de baan van de injectie te definiëren. Voor microinjecterende voorloperstamcellen is de ventrale zijde van het telencephalonoppervlak gericht, zoals blijkt uit figuur 2A. Breng de pipet naar het begin van de lijn en klik op de punt van de pipet. Klik op Traject uitvoeren om te beginnen met microinjecteren. Herhaal deze stap voor elk vliegtuig van injectie gericht (meestal gedaan voor 3 - 4 vliegtuigen met 40 – 75 injecties per vliegtuig).
5. Weefselkweek en weefselschijfverwerking voor immunofluorescentie
- Bereid het collageenmengsel (1,5 mg/mL): Voeg aan een buis 1,25 mL van de matrixoplossing, 0,5 mL gedestilleerd water, 0,5 mL 5x DMEM-F12-oplossing en 0,25 mL reconstitutiebuffer toe. Houd het op ijs tot gebruik.
- Verkrijg de petrischaal met de microinjected plakjes uit de segmentcultuur incubatiekamer en dompel de plakjes onder in het collageenmengsel.
- Breng de plakjes samen met 200 – 300 μL collageenmengsel over in een 14 mm put van een schotel met glazen bodem van 35 mm. Zorg ervoor dat de plakjes zijn bedekt met zeer minder collageen. Deze opstelling zorgt voor de optimale omstandigheden voor voedingsstoffen en zuurstofopname.
- Oriënteer de segmenten en zorg ervoor dat er voldoende ruimte is tussen de segmenten met behulp van twee paar tangen. Broed de petrischaal 5 min bij 37 °C uit met behulp van een verwarmingsblok om het collageen te laten stollen. Beschouw deze tijd als t = 0 van slice cultuur.
- Verplaats de petrischaal terug naar de slice cultuur incubator voor nog eens 40 minuten. Voeg vervolgens 2 mL van de voorverwarmde SCM toe. Plakjes worden bewaard in de cultuur tot het gewenste tijdstip.
- Haal de plakjes uit de slice cultuur incubator en aspirate de SCM. Was de collageen-ingebedde plakjes met 1x PBS. Voeg 4% (wt/vol) paraformaldehyde (in 120 mM fosfaatbuffer, pH 7.4) toe en laat het weefsel 30 minuten in RT liggen. Verplaats het vervolgens naar 4 °C om 's nachts fixatie mogelijk te maken.
- Aspirate de paraformaldehyde oplossing de volgende dag en uit te voeren 1x PBS wasbeurten. Als u de plakjes uit het collageen wilt verwijderen, gebruikt u twee paar tangen om de plakjes onder een stereomicroscoop voorzichtig te extraheren.
- Gebruik een magnetron om de 3% (wt / vol) laag smeltpunt agarose smelten voor de verwerking van de microinjected plakjes. Giet de gesmolten agarose in een wegwerp inbeddingsvorm en laat het afkoelen tot ongeveer 38 – 39 °C.
- Breng de weefselplakjes van stap 5.7 in deze mal met een laag smeltende agarose met behulp van een plastic Pasteur pipet. Zorg ervoor dat de pialzijde van het segment omhoog is en dat het ventriculaire oppervlak naar beneden kijkt. Indien nodig oriënteren dienovereenkomstig. Laat de agarose afkoelen tot RT om te stollen.
- Trim de extra agarose rond de plakjes. Oriënteer het agaroseblok om ervoor te zorgen dat het snijoppervlak parallel loopt met het snijblad van de vibratome. Snijd met vibratome 50 μm dikke delen.
- Vul een 24 put schotel met 1x PBS. Breng de secties in deze schotel met behulp van een fine-tip penseel. Immunofluorescentie uitvoeren volgens de standaardprotocollen.
Microinjectie dient het doel van het bijhouden en manipuleren van enkele neurale stamcellen en hun nakomelingen in levend weefsel en om hun afstammingprogressie te volgen in een fysiologische omgeving. In dit artikel hebben we aangetoond dat de micro-injectierobot wordt gebruikt voor het targeten en automatisch microinjecteren van organotypische plakjes van de muistelencefalon. Figuur 2 illustreert representatieve beelden van met succes geïnjecteerde voorlopercellen en figuur 3 illustreert geïnjecteerde pasgeboren neuronen. Wanneer geïnjecteerd met Dextran Alexa-488 (of Alexa-A555) kleurstof, cellen verschijnen volledig gevuld met de kleurstof. Wat apicale voorouders(figuur 2) confocale beeldvorming maakt het reconstrueren met een hoge ruimtelijke resolutie van de celmorfologie, de aanwezigheid -of afwezigheid- van de apicale en basale gehechtheid, en om de morfologische onderzoek te combineren met marker expressie. Door deze criteria te combineren, kan de gebruiker een specifiek cellot toewijzen aan de microinjected cellen en hun nakomelingen. Wat betreft de neuron injectie, kan de gebruiker de neuronale morfologie reconstrueren, met inbegrip van de structuur en kenmerken van apicale dendriet en axon. Geautomatiseerde microinjectie kan een aanzienlijk hogere doorvoer opleveren in vergelijking met handmatige microinjectie(figuur 2B). Verder bevestigt EdU-etikettering dat de levensvatbaarheid van cellen niet wordt aangetast door automatisering(figuur 2C). Het houden van de organotypic slice in de cultuur maakt het mogelijk volgende afstamming progressie van de microinjected cellen (we getoond 4 - 24h in figuur 2D). Als de micro-injectieoplossing genetisch materiaal bevat (DNA, mRNA, CRISPR-Cas9-geleiders) of recombinante eiwitten, dan maakt dit het mogelijk om te bestuderen of en hoe de afstammingprogressie wordt beïnvloed door de manipulatie.
Microinjectie in enkele neurale stamcellen in weefsel biedt een uitstekende eencellige resolutie en om die reden is het gebruikt om de celbiologie van neurale stamcelprogressie en de overgang van het lot te ontleden(figuur 3A). Microinjectie maakt de levering van complexe mengsel van chemicaliën mogelijk. We maakten eerder gebruik van deze functie om junctionele koppeling in neurale voorlopercellen te bestuderen door gap-junctional doorlatend te mengen met gap junctional impermeerbare fluorescente kleurstoffen12. We breidden eerder werk uit door junctional koppeling in pasgeboren neuronen te bestuderen, door Lucifer Yellow te injecteren samen met Dextran-A555(figuur 3B). Zoals blijkt uit figuur 3B,wordt een deel van de pasgeboren piramidale neuronen via gap-knooppunten gekoppeld aan naburige neuronen. Deze observatie komt overeen met het idee dat onrijpe neuronen communiceren via gap-junction13,14. Bovendien, targeting neuronen blijkt dat het gebruik van de micro-injectie robot kan worden gegeneraliseerd tot verschillende celtypes in de zich ontwikkelende zoogdier hersenen. Deze experimentele opzet zal nuttig zijn om de celbiologie van neuronen in weefsel te ontleden, bijvoorbeeld door specifieke oligopeptiden te leveren om de interacties tussen eiwiteiwit te verstoren.
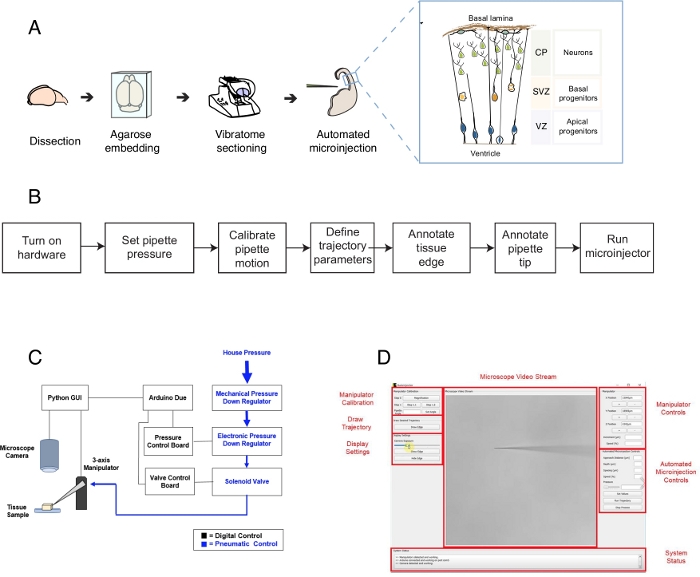
Figuur 1: Geautomatiseerde microinjectie setup en protocol. (A) Algemeen protocol voor weefselbereiding en geautomatiseerde micro-injecties met behulp van de micro-injectierobot. Juiste inzet: Cartoon schema van de muis Telencephalon gericht op microinjectie in dit protocol. (B) Stroomdiagram van de geautomatiseerde microinjectiestappen. (C) Schematisch van de microinjectierobothardware. (D) Grafische gebruikersinterface (GUI) van de software die wordt gebruikt om de microinjectierobot te bedienen en te bedienen. Dit cijfer is aangepast van ref.12. Klik hier om een grotere versie van dit cijfer te bekijken.
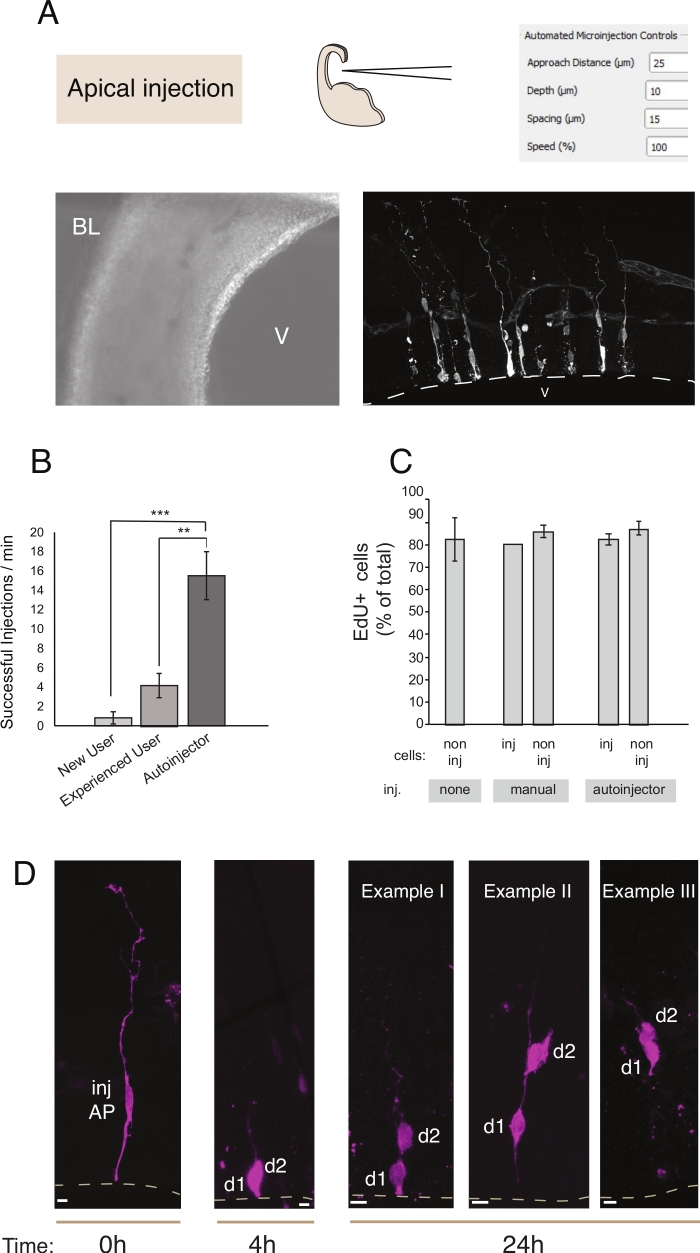
Figuur 2: Robotmicroinjectie in apicale voorlopers. Schematische en verwachte resultaten bij het gebruik van de microinjectierobot om apicale voorlopers (AP's) te targeten via het apicale oppervlak (apicale injectie). (A) Bovenste rij. Aan de linkerkant: schema van het proces. Aan de rechterkant: GUI met relevante parameters voor apicale injectie. Onderste rij. Aan de linkerkant: fasecontrastbeeld dat tijdens de injectieprocedure is genomen (V: ventrikel; BL: basale lamina). Aan de rechterkant: representatieve resultaten met microinjected AP's. Stippellijn staat voor de ventrikel (V). Schaalbalk: 10 μm. (B) Succesvolle injecties per minuut voor een beginnende gebruiker op het handmatige microinjectiesysteem, een ervaren gebruiker op het handmatige microinjectiesysteem en de microinjectierobot. (C) EdU-integratie in microinjecte cellen en in niet-geïnjecteerde cellen in het geïnjecteerde gebied. Organotypic plakjes muis E14.5 dorsale telencephalon werden ofwel (i) niet geïnjecteerd of (ii) onderworpen aan handmatige of geautomatiseerde microinjectie (geïnjecteerde slice) met behulp van Dextran-A488 (voor handmatige en autoinjector). Plakjes werden bewaard in de cultuur in de aanwezigheid van EdU voor 24 uur, dan waren ze vast en gekleurd voor DAPI en EdU. Geïnjecteerde en niet-geïnjecteerde cellen in het geïnjecteerde gebied werden gescoord voor EdU-positiviteit. (D) Gebruik van de micro-injectierobot Lineage tracing. Een fluorescerende kleurstof (Dx3-A555, magenta) wordt geïnjecteerd in enkele neurale stamcel (t = 0 h). De fluorescerende kleurstof wordt verdeeld over de dochtercellen (d1, d2) tijdens mitose. Dit maakt het mogelijk om het nageslacht van de geïnjecteerde cel te volgen (t = 4 uur en 24 uur) en de afstammingprogressie in de loop van de tijd te onthullen. Voor t = 24 uur, tonen we een aantal voorbeelden van het nageslacht men verwacht te vinden. Schaalbalken: 10 μm. Grafieken in B en C zijn afkomstig van ref.12Klik hier om een grotere versie van dit cijfer te bekijken.
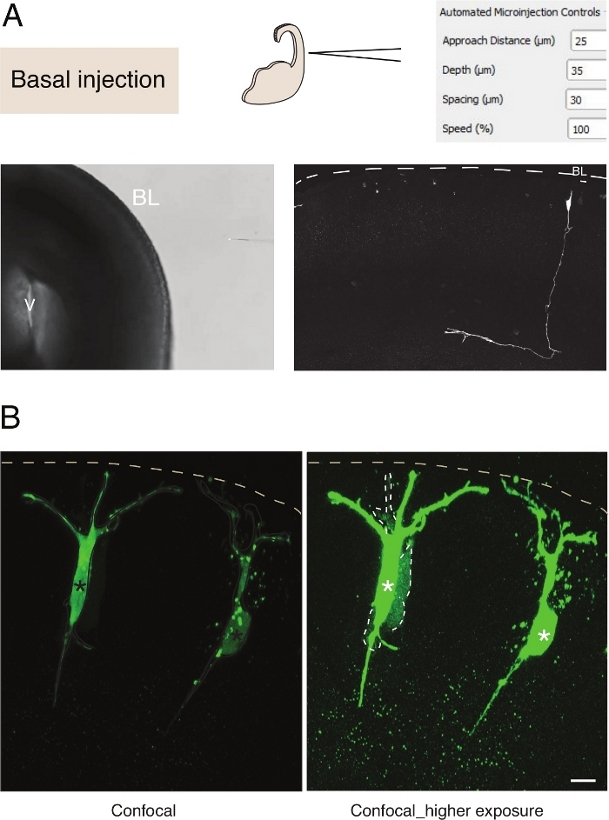
Figuur 3: Robotmicroinjectie in neuronen. Schematische en verwachte resultaten bij het gebruik van de microinjectierobot om piramidale neuronen (N) te targeten via het basale oppervlak (basale injectie). (A) Bovenste rij. Aan de linkerkant: schema van het proces. Aan de rechterkant: GUI met relevante parameters voor basale injectie. Onderste rij. Aan de linkerkant: fasecontrastbeeld dat tijdens de injectieprocedure is genomen (V: ventrikel; BL: basale lamina). Aan de rechterkant: representatieve resultaten met een microinjected N. Stippellijn vertegenwoordigt de basale lamina (BL). Schaalbalk: 10 μm. (B) Gebruik van de autoinjector om gap junctional communicatie in weefsel te bestuderen. Piramidale neuronen werden geïnjecteerd met een oplossing die twee kleurstoffen: de gap junctional-ondoordringbare Dx-A555 (niet getoond) en de gap-junctional permeabele Lucifer Geel (groen). Dx-A555 is beperkt tot de beoogde cel (sterretjes), terwijl het LY verspreidt zich naar cellen die zijn aangesloten via gap junction naar de beoogde cel (stippellijnen). Linkerpaneel: Lage belichting, alleen de microinjected cellen zijn zichtbaar. Rechterpaneel: Hoge belichting maakt visualisatie van de geïnjecteerde cellen en de gekoppelde cellen (stippellijnen) mogelijk. Schaalbalk: 10 μm. Klik hier om een grotere versie van dit cijfer te bekijken.
Aanvullend bestand: problemen met het oplossen van een aantal veelvoorkomende fouten die zich voordoen tijdens het injecteren van microinjectie. Klik hier om dit bestand te downloaden.
Microinjectie in enkele neurale stamcellen in weefsel biedt een uitstekende eencellige resolutie en om die reden is het gebruikt om de celbiologie van neurale stamcelprogressie en de overgang van het lot te ontleden(figuur 2; zie ook10,11,12). De geautomatiseerde micro-injectie procedure kan worden uitgevoerd op andere soorten cellen in zowel embryonale muizen en menselijk hersenweefsel. Representatieve resultaten van micro-injectie van pasgeboren neuronen door zich te richten op het basale oppervlak van de telencephalon worden weergegeven in figuur 3.
Het principe dat hier is vastgesteld, kan worden toegepast om verschillende celtypen in embryonale muizenhersenen en menselijke hersenen te targeten. We hebben eerder aangetoond dat de micro-injectierobot ook kan worden gebruikt om enkele voorlopercellen in de achterhersenen van de muis en de telencephalon en pasgeboren neuronen in de muis en de mens die neocortex12ontwikkelt, te targeten. Om de beste resultaten van de injectieprocedure te verkrijgen, moet men alle stappen optimaliseren voordat u met de injectie begint. Het is belangrijk om de voorbereiding van levensvatbare en goed bewaarde organotypische weefselschijfjes uit hersenweefsel zorgvuldig te overwegen en te optimaliseren(figuur 1). Het is van cruciaal belang om snel te zijn in de in figuur 1geïllustreerde ontledings- en snijprocedure . Voor apicale injectie gericht op de AP's, moet men kiezen voor de segmenten met de ideale oriëntatie van het apicale oppervlak. Voor AP's injectie, de ideale oriëntatie is de apicale oppervlak loodrecht op de bodem van de petrischaal. Elke andere oriëntatie zal ook tolerant zijn, maar het apicale oppervlak loodrecht op de Petri schotel biedt een breder oppervlak voor injectie, waardoor het succes van de injectie. Voor injectie in neuronen speelt de oriëntatie van het segment weinig tot geen effect.
Zodra de te injecteren plakjes zijn geselecteerd, duurt de injectieprocedure per schijf ongeveer 5 minuten. Gezien het feit dat men werkt met levend weefsel, is het sterk aanbevolen om de injectieprocedure te versnellen. Hiertoe raden we aan om alle parameters voor injectie via de GUI(figuur 1D)in te stellen voordat het weefsel klaar is, om onnodige wachttijden te verkorten. Voor het oplossen van problemen verwijzen wij u naar het aanvullende bestand.
In het geval van de lange termijn slice cultuur, stappen na de geautomatiseerde micro-injectie procedure kan invloed hebben op de gezondheid van de cellen en daarmee het experiment. Daarom is het ten zeerste aan te raden om een kwaliteitscontroletest uit te voeren en de segmentcultuuromstandigheden te optimaliseren. Om de levensvatbaarheid van cellen na de snij- en injectieprocedure te evalueren, voerden we EdU-etikettering uit tijdens de cultuur en kwantificeerden we het aantal pyknotische kernen (een proxy voor apoptotische cellen) in de culturen en geïnjecteerd weefsel12. Deze kwantificeringen hebben geen significante invloed van micro-injectie op de levensvatbaarheid van weefsels aan het licht gebracht (figuur 2C). We raden aan om vergelijkbare kwaliteitscontroles uit te voeren terwijl de organotypische weefsels en micro-injectiepijpleiding in het lab worden ingesteld.
In vergelijking met handmatige microinjectie biedt de microinjectierobot verschillende voordelen. Ten eerste is de leercurve voor de gebruiker minder steil in vergelijking met handmatige injectie: een nieuwe gebruiker bereikt een hoge vaardigheid na een beperkt aantal sessies, meestal 1 of 2. Ten tweede, in het geval van handmatige microinjectie, een vergelijkbare vaardigheid vereist maanden van opleiding. De injectieprocedure is sneller en efficiënter(figuur 2B). We kwantificeerden deze parameters en vonden dat de micro-injectierobot beter presteerde dan een ervaren handmatige gebruiker met betrekking tot het injectiesucces (% van succesvolle injectie/totaal aantal injecties) en in het totale aantal injecties per eenheidstijd12. Dit resulteert in een totale 300% verhoging van de injectie-efficiëntie (% van succesvolle injectie / min) voor de micro-injectie robot in vergelijking met een ervaren gebruiker. De toename van de efficiëntie was nog duidelijker bij het vergelijken van de micro-injectie robot met een beginnende gebruiker en bereikte 700%. Last but not least kan de microinjectierobot eenvoudig worden geprogrammeerd om systematisch alle ruimtelijke parameters te verkennen. Dit is vooral voordelig bij het aanpassen van de micro-injectierobot om nieuwe cellen of weefsels te targeten, of bij het gebruik van de microinjectierobot voor doeleinden die verschillende ruimtelijke resolutie vereisen.
Het bouwen van de micro-injectierobot vereist minimale veranderingen in een bestaande epifluorescentiemicroscoop12. We hebben eerder instructies gegeven voor deze aanpassing op https://github.com/bsbrl/Autoinjector. Zodra de hardware is ingesteld, biedt dit protocol belangrijke methodologische details voor het succesvol uitvoeren van geautomatiseerde microinjecties. Over het algemeen heeft de microinjectierobot een succesvolle injectiesnelheid van 15,52 + 2,48 injecties/min, wat 15x groter is dan een onervaren gebruiker (1,09 ± 0,67 injecties/min), en 3x groter dan een deskundige gebruiker (4,95 ± 1,05 injecties/min)12. Deze verbetering in succesvolle injectie tarief machtigt zowel beginnende als deskundige gebruikers om meer cellen te injecteren in een kortere tijd die essentieel is om weefsel levensvatbaarheid te behouden. Bovendien is de microinjectierobot aanpasbaar en kan de baan, diepte van de injectie, het aantal injecties, de afstand tussen de injecties allemaal worden afgestemd met behulp van de GUI. Deze functies maken het mogelijk de microinjectierobot te gebruiken als een hulpmiddel om eerder moeizame experimenten te optimaliseren en fundamenteel nieuwe experimenten te verkennen die een hogere opbrengst vereisen dan voorheen mogelijk was.
De belangrijkste beperkingen van de micro-injectieprocedure die we hier beschreven zijn gerelateerd aan de voorbereiding van weefselschijfjes, een cruciale stap die uitgebreide optimalisatie nodig heeft. Bovendien is microinjectie afhankelijk van de aanwezigheid van een oppervlak dat door de glazen pipet kan worden benaderd. Deze functie beperkt het type weefsel en weefsel locaties die kunnen worden gericht via micro-injectie met behulp van de huidige setup.
De micro-injectie robot maakt momenteel gebruik van brightfield imaging en is gebruikt in in vitro brain slice preparaten. In de toekomst kan de micro-injectierobot worden gecombineerd met 2-fotonbeeldvorming om de specificiteit van eencellige targeting in vivo voor moleculaire of kleurstoftagging te vergroten. Dergelijke inspanningen zijn reeds gedaan voor eencellige elektrofysiologie15,16. Het huidige apparaat vereist handmatige observatie van de micro-injectieprocedure. Toekomstige versies kunnen strategieën omvatten voor het reinigen van verstopte micro-injectiepipettes17 of integratie van vloeistofbehandelingsrobots18 voor multiplexed, volledig autonome micro-injecties. Deze apparaten kunnen de schaal van micro-injectie verhogen door ordes van grootte. Het aanpassen van algoritmen voor parallelle controle van meerdere micro-injectiepipetten19 zou de levering van tientallen kleurstoffen en moleculaire reagentia in dezelfde cellen binnen dezelfde experimenten mogelijk kunnen maken. Dit heeft het potentieel om nieuwe wegen te openen voor moleculaire screening in weefsel.
De microinjectierobot kan worden gebruikt om functioneel geïdentificeerde cellen te taggen met behulp van DNA- of RNA-barcodes. Dit kan op zijn beurt worden gecombineerd met andere eencellige analysetechnieken, zoals eencellige RNA-sequencing (scRNAseq) en elektronenmicroscopie. Onze voorlopige resultaten tonen aan dat microinjected cellen en hun nakomelingen kunnen worden hersteld en geïsoleerd met behulp van weefseldissociatie, gevolgd door FACS sortering (Taverna, ongepubliceerde resultaten). De FACS gesorteerde cellen kunnen vervolgens worden gebruikt voor scRNAseq. Bovendien tonen voorlopige resultaten aan dat de single cell resolutie mogelijkheden van de micro-injectie robot kan worden gebruikt in combinatie met elektronenmicroscopische analyse om de celbiologie op neurale stamcellen in weefsel bij hoge ruimtelijke resolutie te verkennen (Taverna en Wilsch-Bräuninger, ongepubliceerde resultaten). Deze gegevens suggereren dat de micro-injectierobot kan worden gebruikt als een hulpmiddel voor correlatief licht en elektronenmicroscopie in weefsel en in bredere zin, voor de multimodale analyse van celidentiteit en -gedrag in weefsel.
Microinjectie is afhankelijk van het gebruik van druk en men kan zich injectieoplossingen veroorloven met een hoge moleculaire complexiteit (bijvoorbeeld een hele transcriptie). Dit kenmerk van microinjectie is in het verleden misbruikt voor het isoleren en klonen van ligand-gated receptoren20. Langs deze lijn, de micro-injectie robot kan worden gebruikt voor het modelleren en bestuderen van multi-geniale eigenschappen op cellulair niveau. In combinatie met een subpoolingstrategie kan de microinjectierobot ook worden gebruikt als platform om de minimale set genen te identificeren die een bepaald eigenschap/cellulair gedrag aansturen. Tot nu toe is de micro-injectierobot gebruikt om de biochemie van de cel te manipuleren via de levering van mRNA, DNA of recombinant eiwitten10,21,22. We voorzien een toepassing van de microinjectierobot in het onderzoeken van de biofysica van de intracellulaire ruimte, bijvoorbeeld door het leveren van nanomaterialen of nanomachines die het mogelijk maken de biofysische eigenschappen van de intracellulaire ruimte te beslokken en/of te manipuleren.
De auteurs hebben niets te onthullen.
De auteurs willen de Nomis Foundation (ET) erkennen. SBK erkent fondsen van de afdeling Werktuigbouwkunde, College of Science and Engineering, MnDRIVE RSAM initiatief van de Universiteit van Minnesota, Minnesota afdeling van het hoger onderwijs, National Institutes of Health (NIH) 1R21NS103098-01, 1R01NS111028, 1R34NS11654, 1R21NS112886 en 1R21 NS111196. GS werd ondersteund door National Science Foundation Graduate Research Fellowship en NSF IGERT opleidingsbeurs.
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Agarose, Low Melt | Carl Roth | Cat# 6351.2 | |
| Agarose, Wild Range | Sigma-Aldrich | Cat# A2790 | |
| Best-CA 221 Glue | Best Klebstoffe GmbH & Co.KG | Cat# CA221-10ml | |
| B-27 Supplement | Thermo Fisher Scientific | Cat# 17504044 | |
| Cellmatrix Type-IA (Collagen, Type !) | FUJIFILM Wako Chemicals | Cat# 637-00653 | |
| Distilled Water | |||
| DMEM-F12, CO2 independent (w/o Phenol red) | Sigma-Aldrich | Cat# D2906 | |
| DMEM-F12, CO2 independent (with Phenol red) | Sigma-Aldrich | Cat# D8900 | |
| HEPES-NAOH, pH 7.2, 1M (HEPES buffer) | Carl Roth | Cat# 9105.3 | |
| L-Glutamine, 200 mM | Thermo Fisher Sientific | Cat# 25030024 | |
| Mowiol 4-88 | Sigma-Aldrich | Cat# 81381 | |
| N-2 Supplement | Thermo Fisher Scientific | Cat# 17502048 | |
| Neurobasal Medium | Thermo Fisher Scientific | Cat# 21103049 | |
| Nuclease-free water | Thermo Fisher Scientific | Cat# AM9937 | |
| O2 (40%), CO2 (5%), N2 (55%) Mix, 50 liters | |||
| Paraformaldehyde | Merck | Cat# 818715 | |
| PBS | |||
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | Cat# 15140122 | |
| Rat serum | Charles River Laboratories | ||
| Japan | |||
| Sodium bicarbonate (NaHCO3) | Merck | Cat# 106323 | |
| Sodium hydroxide (NaOH) | Merck | Cat# 106482 | |
| Tyrode’s salt | Sigma | Cat# T2145-10x1L) | |
| Equipment | |||
| Borosilicate glass capillaries, 1.2 mm outer diameter x 0.94 mm inner diameter | Sutter Instruments | Cat# BF-120-94-10 | |
| Bottle-top filter system, 500 mL | Corning | Cat# 430769 | |
| Computer PC | |||
| Custom pressure rig | Custom pressure rig | ||
| Electronic pressure regulator | Parker Hannifin | Cat# 990-005101-002 | |
| Falcon tubes, 15 mL | Corning | Cat# 430791 | |
| Falcon tubes, 50 mL | Corning | Cat# 430829 | |
| Fine-tip paintbrush | |||
| Flaming/ Brown micropipette puller | Sutter Instruments | Cat# P-97 | |
| Forceps, Dumont no. 3 | Fine Science Tools | Cat# 11231-30 | |
| Forceps, Dumont no. 5 | Fine Science Tools | Cat# 11255-20 | |
| Forceps, Dumont no. 55 | Fine Science Tools | Cat# 11252-20 | |
| Heating block | Labtech International | Cat # Dri block Digi2 | |
| Inverted fluorescence microscope | Zeiss | Cat# Axiovert 200 | |
| Light source | Olympus | Cat# Highlight 3100 | |
| Manual pressure regulator | McMaster Carr | Cat# 0-60 PSI 41795K3 | |
| Microloader Tips | Eppendorf | Cat# 5242956.003 | |
| Microcontroller | Arduino | Cat# Arduino Due | |
| Microscope camera Hamamatsu Orca Flash 4.0 V3 | |||
| Motorized stage XY for microscope | |||
| Multiwell plate, 24 wells | Nunc | Cat# 142475 | |
| Pasteur pipettes, plastic | |||
| Petri dish, 60 x 15 mm | Greiner | Cat# 628102 | |
| Petri dish, 35 x 10 mm | Nunc | Cat# 153066 | |
| Petri dish, 34 x 14 mm, including Microwell no. 1.5 cover glass | MatTek | Cat# P35G-1.5-14-C | |
| Pipette holder | Warner Instruments | Cat# 64-2354 MP-s12u | |
| Pipette and tips | |||
| Puller filament, 3.0-mm square box filament | Sutter Instrument | Cat# FB330B | |
| Slice culture incubation box | MPI-CBG | Cat# custom made | |
| Solenoid valve | Cat# LHDA053321H-A | ||
| Stereomicroscope | Olympus | Cat# SZX12 | |
| Tabletop centrifuge | Heraeus | Cat# 5431622 | |
| Thermometer | |||
| Three-axis Manipulator | Sensapex Inc | Cat# tree-axis uMP | |
| Vibratome | Leica | Cat# VT1000s | |
| Whole-embryo-culture-system incubator | Ikemoto Company | Cat# RKI-10-0310 | |
| Waterbath | |||
| Software and Algorithms | |||
| Arduino | Arduino | ||
| Fiji | RRID: SCR_002285 | ||
| Python | Python Software foundation | Python 2.7.12 | |
| ZEN | RRID: SCR_013672 |
- Taverna, E., Götz, M., Huttner, W. B. The Cell Biology of Neurogenesis: Toward an Understanding of the Development and Evolution of the Neocortex. Annual Review of Cell and Developmental Biology. 30 (1), 465-502 (2014).
- Götz, M., Huttner, W. B. The cell biology of neurogenesis. Nature Reviews Molecular Cell Biology. 6 (10), 777-788 (2005).
- Di Lullo, E., Kriegstein, A. R. The use of brain organoids to investigate neural development and disease. Nature Reviews Neuroscience. 18 (10), 573-584 (2017).
- Lancaster, M. A., Knoblich, J. A. Organogenesisin a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Kretzschmar, K., Clevers, H. Organoids: Modeling Development and the Stem Cell Niche in a Dish. Developmental Cell. 38 (6), 590-600 (2016).
- Pepperkok, R. et al. Automatic microinjection system facilitates detection of growth inhibitory mRNA. Proceedings of the National Academy of Sciences of the United States of America. 85 (18), 6748-6752 (1988).
- Pepperkok, R., Lowe, M., Burke, B., Kreis, T. E. Three distinct steps in transport of vesicular stomatitis virus glycoprotein from the ER to the cell surface in vivo with differential sensitivities to GTPγS. Journal of Cell Science. 111 (13), 1877-1888 (1998).
- Pepperkok, R. et al. β-COP is essential for biosynthetic membrane transport from the endoplasmic reticulum to the Golgi complex in vivo. Cell. 74 (1), 71-82 (1993).
- Ansorge, W., Pepperkok, R. Performance of an automated system for capillary microinjection into living cells. Journal of Biochemical and Biophysical Methods. 16 (4), 283-292 (1988).
- Taverna, E., Haffner, C., Pepperkok, R., Huttner, W. B. A new approach to manipulate the fate of single neural stem cells in tissue. Nature Neuroscience. 15 (2), 329-337 (2012).
- Wong, F. K., Haffner, C., Huttner, W. B., Taverna, E. Microinjection of membrane-impermeable molecules into single neural stem cells in brain tissue. Nature Protocols. 9 (5), 1170-1182 (2014).
- Shull, G., Haffner, C., Huttner, W. B., Kodandaramaiah, S. B., Taverna, E. Robotic platform for microinjection into single cells in brain tissue. EMBO Reports. 20 (10), e47880 (2019).
- Jabeen, S., Thirumalai, V. The interplay between electrical and chemical synaptogenesis. Journal of Neurophysiology. 120 (4), 1914-1922 (2018).
- Nagy, J. I., Pereda, A. E., Rash, J. E. Electrical synapses in mammalian CNS: Past eras, present focus and future directions. Biochimica et Biophysica Acta - Biomembranes. 1860 (1), 102-123 (2018).
- Suk, H.J. et al. Closed-loop real-time imaging enables fully automated cell-targeted patch-clamp neural recording in vivo. Neuron. 95 (5), 1037-1047 (2017).
- Annecchino, L. A. et al. Robotic automation of in vivo two-photon targeted whole-cell patch-clamp electrophysiology. Neuron. 95 (5), 1048-1055 (2017).
- Kolb, I. et al. Cleaning patch-clamp pipettes for immediate reuse. Scientific Reports. 6, 35001 (2016).
- Holst, G. L. et al. Autonomous patch-clamp robot for functional characterization of neurons in vivo: development and application to mouse visual cortex. Journal of Neurophysiology. 121 (6), 2341-2357 (2019).
- Kodandaramaiah, S. B. et al. Multi-neuron intracellular recording 1 in vivo via interacting autopatching 2 robots. ELife. 7, 24656 (2018).
- Lubbert, H. et al. cDNA cloning of a serotonin 5-HT1c receptor by electrophysiological assays of mRNA-injected Xenopus oocytes (RNA fractionation/hybrid depletion/hybrid selection/choroid plexus/voltage clamp). Neurobiology. 84 (2) 4332-4336 (1987).
- Florio, M. et al. Human-specific gene ARHGAP11B promotes basal progenitor amplification and neocortex expansion. Science. 347 (6229), 1465-1470 (2015).
- Kalebic, N. et al. CRISPR/Cas9-induced disruption of gene expression in mouse embryonic brain and single neural stem cells in vivo. EMBO Reports. 17 (3), 338-348 (2016).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved