Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Bioengineering
रोबोटिक माइक्रोइंजेक्शन का उपयोग करके मस्तिष्क स्लाइस में एकल तंत्रिका स्टेम सेल और न्यूरॉन्स का हेरफेर
यह प्रोटोकॉल मस्तिष्क स्लाइस में एकल तंत्रिका स्टेम कोशिकाओं और न्यूरॉन्स में माइक्रोइंजेक्शन के लिए एक रोबोट मंच के उपयोग को दर्शाता है। यह तकनीक बहुमुखी है और उच्च स्थानिक संकल्प के साथ ऊतक में कोशिकाओं को ट्रैक करने की एक विधि प्रदान करती है।
विकासात्मक न्यूरोबायोलॉजी में एक केंद्रीय प्रश्न यह है कि तंत्रिका स्टेम और जनक कोशिकाएं मस्तिष्क कैसे बनाती हैं। इस सवाल का जवाब देने के लिए, किसी को समय के साथ उच्च संकल्प के साथ मस्तिष्क के ऊतकों में एकल कोशिकाओं को लेबल, हेरफेर और पालन करने की आवश्यकता होती है। मस्तिष्क में ऊतकों की जटिलता के कारण यह कार्य बेहद चुनौतीपूर्ण है। हमने हाल ही में एक रोबोट विकसित किया है, जो एक माइक्रोजेक्शन सुई को एक माइक्रोस्कोप से प्राप्त छवियों का उपयोग करने पर मस्तिष्क के ऊतकों में मार्गदर्शन करता है ताकि समाधान की फेमोलीटर मात्रा को एकल कोशिकाओं में वितरित किया जा सके। रोबोटिक ऑपरेशन एक समग्र उपज है कि मैनुअल माइक्रोइंजेक्शन से अधिक परिमाण का एक आदेश है और सटीक लेबलिंग और जीवित ऊतक में एकल कोशिकाओं के लचीले हेरफेर के लिए अनुमति देता है जिसके परिणामस्वरूप बढ़ जाती है । इसके साथ, कोई भी एक ऑर्गैजिपिक स्लाइस के भीतर सैकड़ों कोशिकाओं को माइक्रोजेक्ट कर सकता है। यह लेख मस्तिष्क के ऊतकों के स्लाइस में तंत्रिका जनक कोशिकाओं और न्यूरॉन्स के स्वचालित माइक्रोइंजेक्शन के लिए माइक्रोइंजेक्शन रोबोट के उपयोग को दर्शाता है। अधिक मोटे तौर पर, इसका उपयोग किसी भी एपिथेलियल ऊतक पर किया जा सकता है जिसमें सतह होती है जिसे पिपेट द्वारा पहुंचा जा सकता है। एक बार सेट होने के बाद माइक्रोइंजेक्शन रोबोट प्रति मिनट 15 या उससे अधिक माइक्रोइंजेक्शन को अंजाम दे सकता है । अपने थ्रूपुट और वर्साय के कारण माइक्रोइंजेक्शन रोबोट बायोइंजीनियरिंग, बायोटेक्नोलॉजी और बायोफिजिक्स में ऑर्गेनोटिक ब्रेन स्लाइस में सिंगल-सेल एनालिसिस करने के लिए इस्तेमाल की जाने वाली मोटे तौर पर सीधी हाई-परफॉर्मेंस सेल हेरफेर तकनीक बनाएगा ।
यह प्रोटोकॉल मस्तिष्क के ऊतक स्लाइस में एकल कोशिकाओं को लक्षित करने और हेरफेर करने के लिए रोबोट के उपयोग का वर्णन करता है, विशेष रूप से एकल तंत्रिका स्टेम कोशिकाओं और न्यूरॉन्स पर ध्यान केंद्रित करता है। रोबोट को विकासात्मक न्यूरोबायोलॉजी में एक केंद्रीय प्रश्न का समाधान करने के लिए विकसित किया गया था, इसी तरह तंत्रिका स्टेम और जनक कोशिकाएं मस्तिष्क मॉर्फोजेनेसिस1,2,3,4, 5में योगदान देती हैं। इस सवाल का जवाब देने के लिए, किसी को एकल तंत्रिका स्टेम कोशिकाओं को लेबल और ट्रैक करने और ऊतक मॉर्फोजेनेसिस के साथ एकल कोशिका व्यवहार को सहसंबंधित करने के लिए समय के साथ उनके वंश प्रगति का पालन करने की आवश्यकता है। यह विभिन्न तरीकों से प्राप्त किया जा सकता है, उदाहरण के लिए, गर्भाशय में मस्तिष्क के ऊतकों को इलेक्ट्रोपोरा करके या लिपोफिलिक मरने का उपयोग करके एकल कोशिका को लेबल करके। हालांकि शक्तिशाली, इन तरीकों सटीक एकल सेल संकल्प (इलेक्ट्रोपॉरेशन) और/या इंट्रासेल्युलर अंतरिक्ष (लिपोफिलिक डाई) में हेरफेर करने की संभावना की कमी है । इसचुनौतीसे पार पाने के लिए माइक्रोइंजेक्शन को एकल कोशिकाओं में विकसित किया गया था। माइक्रोइंजेक्शन के दौरान, एक पिपेट को रिएजेंट्स 9 के माइक्रोइंजेक्ट फेमेटोलिटर वॉल्यूम के दबाव में अक्षुण्ण ऊतक के भीतर एक कोशिका में संक्षेप में डालाजाताहै। हमने पहले ऑर्गेनोटीपिक टिश्यू(चित्र 1ए) 10,11में एकल तंत्रिका स्टेम कोशिकाओं को माइक्रोइंजेक्ट करने के लिए एक मैनुअल प्रक्रिया का वर्णन कियाहै। तंत्रिका स्टेम कोशिकाओं में माइक्रोइंजेक्शन एक माइक्रोपिपेट के उपयोग पर निर्भर करता है जिसे एकल तंत्रिका स्टेम कोशिकाओं में डाला जाता है ताकि ब्याज के अन्य अणुओं के साथ फ्लोरोसेंट डाई युक्त समाधान इंजेक्ट किया जा सके। तंत्रिका स्टेम कोशिकाओं के चयनात्मक लक्ष्यीकरण को वेंट्रिकुलर सतह (या वेंट्रिकल, चित्रा 1 एमें कार्टून देखें) के माध्यम से विकासशील टेलेंसेफलन के पास पहुंचने से प्राप्त किया जाता है, जो एपिकल प्रोजेनर्स (चित्र 1 एमें कार्टून) के एपिकल प्लाज्मा झिल्ली द्वारा बनाया जाता है। इस प्रक्रिया को प्रत्येक कोशिका के लिए दोहराया जाना चाहिए जो प्रयोगकर्ता इंजेक्शन लगाने की इच्छा रखता है। इसके अलावा, माइक्रोइंजेक्शन की सफलता ऊतक में माइक्रोपिपेट इंजेक्शन की गहराई और अवधि के सटीक नियंत्रण पर निर्भर है। इस प्रकार, अद्वितीय फायदों के बावजूद, मैनुअल माइक्रोइंजेक्शन बेहद थकाऊ है और उचित थ्रूपुट और उपज पर प्रदर्शन करने के लिए काफी अभ्यास की आवश्यकता होती है, जिससे इस तकनीक को स्केलेबल फैशन में उपयोग करना मुश्किल हो जाता है। इस सीमा को दूर करने के लिए, हमने हाल ही में एक छवि निर्देशित रोबोट, ऑटोइंजेक्टर12 (या माइक्रोइंजेक्शन रोबोट) विकसित किया है जो स्वचालित रूप से एकल कोशिकाओं में माइक्रोइंजेक्शन कर सकता है।
माइक्रोइंजेक्शन रोबोट माइक्रोइंजेक्शन(चित्रा 1B)के लिए ऊतक के भीतर 3-डी अंतरिक्ष में विशिष्ट स्थानों को ठीक से लक्षित करने के लिए सूक्ष्म इमेजिंग और कंप्यूटर विजन एल्गोरिदम का उपयोग करता है। माइक्रोइंजेक्शन रोबोट का निर्माण मौजूदा माइक्रोइंजेक्शन सेटअप में अपेक्षाकृत सरल संशोधन करके किया जा सकता है। माइक्रोइंजेक्शन रोबोट की समग्र योजना चित्रा 1Cमें दिखाया गया है । एक पिपेट एक पिपेट धारक में घुड़सवार है जो तीन-एक्सिस जोड़तोड़ से जुड़ा होता है। एक माइक्रोस्कोप कैमरे का उपयोग ऊतक और माइक्रोइंजेक्शन सुई की छवियों को प्राप्त करने के लिए किया जाता है। पिपेट के अंदर दबाव को नियंत्रित करने के लिए एक कस्टम प्रेशर रेगुलेशन सिस्टम का उपयोग किया जाता है और माइक्रोइंजेक्टर पिपेट की स्थिति को नियंत्रित करने के लिए एक प्रोग्रामेबल माइक्रोमैनीपुलेटर का उपयोग किया जाता है। ऊतक और माइक्रोइंजेक्शन पिपेट की कैमरा छवियों का उपयोग माइक्रोइंजेक्शन पिपेट टिप के स्थानिक स्थान और उन स्थानों को निर्धारित करने के लिए किया जाता है जिन पर माइक्रोइंजेक्शन किए जाने की आवश्यकता होती है। सॉफ्टवेयर तो ऊतक के भीतर पिपेट स्थानांतरित करने के लिए आवश्यक प्रक्षेप वक्र की गणना करता है । सभी हार्डवेयर सॉफ्टवेयर है कि हम पहले विकसित द्वारा नियंत्रित किया जाता है। सभी सॉफ्टवेयर कोडिंग भाषा (जैसे, अजगर और Arduino) में लिखा है और निर्देशों के साथ https://github.com/bsbrl/Autoinjector से डाउनलोड किया जा सकता है। ग्राफिकल यूजर इंटरफेस (जीयूआई) उपयोगकर्ता को ऊतक और माइक्रोपिपेट की छवि और माइक्रोइंजेक्शन के प्रक्षेपवक्र को अनुकूलित करने की अनुमति देता है। हमारी प्रणाली को ब्राइटफील्ड और एपीई-फ्लोरेसेंस फिल्टर से लैस उल्टे माइक्रोस्कोप में अपेक्षाकृत सरल संशोधनों का उपयोग करके स्थापित किया जा सकता है।
सबसे पहले, हम माइक्रोइंजेक्शन के लिए ब्रेन ऑर्गेनोटिपिक टिश्यू स्लाइस तैयार करने के निर्देश प्रदान करते हैं। फिर प्रोटोकॉल माइक्रोइंजेक्शन रोबोट को शुरू करता है जिसके बाद प्रारंभिक कदम, जैसे पिपेट मोशन कैलिब्रेशन, जिसे माइक्रोइंजेक्शन से पहले किए जाने की आवश्यकता होती है। इसके बाद इंजेक्शन के मापदंडों को परिभाषित किया जाता है। इसके बाद, उपयोगकर्ता माइक्रोइंजेक्शन रोबोट द्वारा उपयोग किए जाने वाले प्रक्षेपवक्र को परिभाषित कर सकता है और इंजेक्शन प्रक्रिया शुरू कर सकता है। माइक्रोजेक्टेड टिश्यू (इस मामले में ब्रेन ऑर्गेनोविटिक टिश्यू स्लाइस) को प्रायोगिक डिजाइन10, 11के आधार पर विभिन्न समय अवधियों के लिए संस्कृति में रखा जासकताहै। ऊतक का पालन करें और पहचान और इंजेक्शन कोशिकाओं और उनकी संतान के भाग्य का अध्ययन करने के लिए संसाधित किया जा सकता है । वैकल्पिक रूप से, माइक्रोइंजेक्टेड कोशिकाओं को लाइव इमेजिंग का उपयोग करके पीछा किया जा सकता है। इस प्रोटोकॉल के दायरे में, हम माउस E14.5 पृष्ठीय टेलेंसेफलन के ऑर्गेनोटिपिक स्लाइस में स्वचालित रूप से तंत्रिका जनक कोशिकाओं को माइक्रोइंजेक्शन करने के लिए रोबोट के उपयोग को प्रदर्शित करते हैं। रोबोट माउस टेलेंसेफेलन में नवजात शिशुओं न्यूरॉन्स में माइक्रोइंजेक्शन के साथ-साथ मानव भ्रूण टेलेंसेफेलन12में भी सक्षम है।
संक्षेप में, हम एक रोबोट मंच का वर्णन करते हैं जिसका उपयोग ऊतक में एकल कोशिकाओं का पालन करने और हेरफेर करने के लिए किया जा सकता है। मंच दबाव का उपयोग करता है और इसलिए, यह यौगिक की रासायनिक प्रकृति के रूप में बेहद बहुमुखी है इंजेक्ट करने के लिए । इसके अलावा, इसे स्टेम सेल के अलावा अन्य कोशिकाओं को लक्षित करने के लिए अनुकूलित किया जा सकता है। हम उम्मीद करते हैं कि हमारी प्रणाली को अन्य मॉडल प्रणालियों के लिए भी आसानी से अनुकूलित किया जाए।
सभी पशु अध्ययन जर्मन पशु कल्याण कानून के अनुसार आयोजित किए गए थे, और ड्रेसडेन, जर्मनी (टियरवेइसस्कोममिशन, लैंडेसडिरेशन ड्रेसडेन) के पशु प्रयोग के लिए क्षेत्रीय नैतिक आयोग से आवश्यक लाइसेंस प्राप्त किए गए थे। ऑर्गेनोथिक स्लाइस E14.5 या E16.5 C57BL/6 माउस भ्रूणीय टेलेंसेफलन (Janvier लैब्स) से तैयार किए गए थे ।
1. सॉफ्टवेयर की स्थापना
- https://github.com/bsbrl/Autoinjector से सॉफ्टवेयर इंस्टॉल करने के निर्देशों का पालन करें।
2. रिएजेंट्स और पिपेट की तैयारी
- एगर उठे: क्रमशः दो अलग-अलग 200 एमएल ग्लास बोतलों में सेल कल्चर-ग्रेड पीबीएस के 100 एमएल में अलग-अलग 3 ग्राम विस्तृत रेंज एग्रंज और 3 ग्राम कम पिघलने वाले बिंदु को अलग-अलग भंग करके 3% एगर उठे तैयार करें। 3 महीने तक कमरे के तापमान पर स्टोर करें।
- टायरोड समाधान: सोडियम बाइकार्बोनेट और टायरोड के नमक (पूरी बोतल की सामग्री का उपयोग करें) के 1 ग्राम और 1 एम एचईपी के 13 एमएल को 1 एल आसुत पानी में भंग करें। पीएच को 7.4 पर समायोजित करें। 0.2 माइक्रोन बोतल-टॉप फ़िल्टर के माध्यम से समाधान को फ़िल्टर करें।
- स्लाइस कल्चर मीडियम (एससीएम): चूहे सीरम के 10 एमएल जोड़ें, 2 एमएम ग्लूटामीन का 1 एमसीएल, 1 एमएल पेनिसिलिन-स्ट्रेप्टोमाइसिन (100x), एन-2 सप्लीमेंट (100x) का 1 एमसीएल, बी 27 सप्लीमेंट (50x) का 2 एमसीएल और एचईपीपीएस का 1 एमएल (पीएच 7.3) बफर न्यूरोबासल मीडियम के 84 एमल में बफर। अलीकोट 15 एमएल ट्यूब में सीएम का 5 एमएल। -20 डिग्री सेल्सियस पर स्टोर करें।
- सीओ2-इंडिपेंडेंट माइक्रोइंजेक्शन मीडियम (सीआईएमएम): 200 एमएल डिस्टिल्ड वॉटर में पाउडर को घोलकर 5x डीएमईएम संशोधित लो-ग्लूकोज सॉल्यूशन (बिना फिनॉल रेड) तैयार करें। 0.2 माइक्रोन बोतल-टॉप फ़िल्टर के माध्यम से समाधान फ़िल्टर करें (डीएमईएम पाउडर के लिए, पूरी बोतल की सामग्री का उपयोग करें)। सीआईएमएम के 100 मिलियन एमएल तैयार करने के लिए, 5x डीएमईएम संशोधित समाधान के 20 एमएल, एचईपीईएस बफर के 1 एमसीएल, एन2 पूरक (100x) के 1 मिलीलीटर, बी 27 पूरक (50x) के 2 एमएल, पेनिसिलिन-स्ट्रेप्टोमाइसिन (100x) की 1 मिलीलीटर, 2 मीटर ग्लूटामाइन की 1 एमएलएम ग्लूटामाइन की 1 एमएल और 74 एमएल डिस्टिल्ड पानी मिलाएं। समाधान को 4 डिग्री सेल्सियस पर स्टोर करें।
- पुनर्गठन बफर: आसुत पानी में 262 mM NaHCO3,0.05 N NaOH, 200 mm HEPES को भंग करके पुनर्गठन बफर तैयार करें। एक बाँझ कांच की बोतल में एक बोतल शीर्ष 0.22 माइक्रोन फिल्टर सिस्टम के माध्यम से छानने का काम करके समाधान को निष्फल करें। एयरटाइट माइक्रोसेंट्रफ्यूज ट्यूबों में पुनर्गठन बफर का 500 माइक्रोल। 4 डिग्री सेल्सियस पर स्टोर करें।
- माइक्रोइंजेक्शन डाई स्टॉक: आरएनएनएसई फ्री डिस्टिल्ड वॉटर (अंतिम एकाग्रता 10 μg/μL) में फ्लोरोसेंटली लेबल डेक्सट्रान को भंग करें। 5 माइक्रोन एलिकोट तैयार करें और उपयोग होने तक -20 डिग्री सेल्सियस पर स्टोर करें।
- माइक्रोपिपेट खींचने वाले का उपयोग करके बोरोसिलिकेट ग्लास केशिकाओं (1.2 मिमी बाहरी व्यास, 0.94 मिमी आंतरिक व्यास) से माइक्रोइंजेक्शन पिपेट खींचें। पिपेट को धूल से बचाएं। 2 - 3 दिनों से अधिक समय तक पिपेट स्टोर न करें। इस प्रयोग के लिए, पुलिंग पैरामीटर हीट थे: रैंप तापमान +1 - 5; पुल: 100; VEL: 110; डीईएल: 100. हीट और वेल पैरामीटर हैं जो पिपेट के सबसे आकार और आकार को प्रभावित करते हैं।
नोट: माइक्रोइंजेक्शन के दौरान सेल क्षति से बचने के लिए इष्टतम माइक्रोइंजेक्शन पिपेट में एक लंबी और लचीली टिप होती है।
3. ऊतक टुकड़ा तैयारी
- मस्तिष्क ऊतक विच्छेदन से पहले माइक्रोवेव ओवन का उपयोग करके 3% विस्तृत श्रृंखला को पिघलाएं। एम्बेड करने से पहले 37 डिग्री सेल्सियस पर पानी के स्नान में रखकर एगरेज़ को जमना न दें। पिपेट को धूल से बचाकर संरक्षित करना सुनिश्चित करें। 2 - 3 दिनों से अधिक समय तक पिपेट स्टोर न करें।
- सीएम का एक एलिकोट और गर्म 10 - 12 एमएल सीआईएमएम और 20 एमएल टायरोड के समाधान को 37 डिग्री सेल्सियस पानी स्नान का उपयोग करके गल लें।
- फ्लोरोसेंट ट्रेसर (डेक्सट्रान-3000 या डेक्सट्रान-10000-एलेक्सा संयुक्त्रा; अंतिम एकाग्रता 5 -10 माइक्रोग्राम/माइक्रोन) को इंजेक्शन के साथ मिलाएं। 4 डिग्री सेल्सियस पर 30 मिनट के लिए 16, 000 x ग्राम पर माइक्रोइंजेक्शन समाधान को सेंट्रलाइज करें। सुपरनैंट ले लीजिए और एक नई ट्यूब में स्थानांतरित करें। उपयोग होने तक बर्फ पर माइक्रोइंजेक्शन समाधान रखें।
- टेलेंसेफेलॉन के ऑर्गेनोथिपिक ऊतक स्लाइस तैयार करने के लिए E13.5 - E16.5 माउस भ्रूण से सिर का उपयोग करें। त्वचा को हटा दें और मिडलाइन के साथ चलते हुए, संदंश का उपयोग करके खोपड़ी खोलें। भ्रूण मस्तिष्क को खुली खोपड़ी से बाहर निकालें और मस्तिष्क के वेंट्रल साइड से शुरू होने वाले मस्तिष्क के ऊतकों को कवर करने वाले मेनिंग्स को हटा दें। 37 डिग्री सेल्सियस हीटिंग ब्लॉक पर टायरोड के समाधान में विच्छेदित पूरे मस्तिष्क को छोड़ दें।
नोट: 3.4 में वर्णित सभी विच्छेदन चरणों को प्रीवार्म्ड टायरोड के समाधान में किया जाना चाहिए। - एक डिस्पोजेबल एम्बेडिंग मोल्ड में विस्तृत श्रृंखला पिघला एगर उठी डालो। जब एगर उठी को 38 - 39 डिग्री सेल्सियस तक ठंडा किया जाता है, तो ध्यान से एक पाश्चर पिपेट का उपयोग करके दिमाग (अधिकतम 4) को स्थानांतरित करें। इस स्टेप के लिए हमेशा कट टिप्स का इस्तेमाल करें।
- ऊतक के चारों ओर उठने वाली हलचल या तो एक स्पैटुला या ड्यूमोंट की एक जोड़ी का उपयोग करके #1 ऊतक को छूने के बिना संदंश। अगेन कमरे के तापमान पर जमना करते हैं। एक बार जब एगर उठे जम जाते हैं, तो ऊतक के आसपास अतिरिक्त एगर उठे ट्रिम करें।
- पीबीएस के साथ बफर ट्रे भरें। ट्रे के लिए लंबवत ऊतक के रोस्ट्रो-कौडल धुरी के साथ मस्तिष्क उन्मुख (घ्राण बल्ब को लैंडमार्क के रूप में उपयोग करें, मस्तिष्क के सबसे अधिक हिस्से का प्रतिनिधित्व करते हुए)। वाइब्रेटम का उपयोग करके 250 माइक्रोन स्लाइस काटें।
- प्रीवार्मेड मीडिया के 2 एमएल के साथ 3.5 सेमी पेट्री डिश भरें। प्लास्टिक पाश्चर पिपेट का उपयोग करके, इस डिश में स्लाइस (10 - 15) स्थानांतरित करें। एक बार किया, स्लाइस के साथ पेट्री डिश को स्लाइस कल्चर इनक्यूबेटर में शिफ्ट करें। उपयोगतक 40% O 2 / 5% सीओ2 / 55% एन2 वाले आर्द्र वातावरण में 37 डिग्री सेल्सियस पर स्लाइस बनाए रखें।
4. माइक्रोइंजेक्शन
- कंप्यूटर, माइक्रोस्कोप, माइक्रोस्कोप कैमरा, जोड़तोड़, दबाव रिग, और दबाव सेंसर चालू करें। गिटहब से डाउनलोड किए गए मुख्य फ़ोल्डर में फ़ाइल"launchapp.py"पर क्लिक करके एप्लिकेशन लोड करें और पॉपअप स्क्रीन में डिवाइस सेटिंग्स को निर्दिष्ट करें (निर्देश स्थापित करने के लिए चरण 1.1 देखें)।
- समाधान में पिपेट को जलमग्न करने से पहले अवांछित क्लोजिंग को रोकने के लिए एक जावक दबाव बनाएं। पिपेट पर दबाव लागू करने के लिए, मुआवजा दबाव बार को 24 -45% तक स्लाइड करें और सेट मानों पर क्लिक करें। इसके बाद, दबाव सेंसर द्वारा इंगित यांत्रिक दबाव वाल्व घुंडी को 1 - 2 पीएसआई (69 - 138 एमबार) में बदलकर पर्याप्त दबाव में डाल दें।
- स्लाइस को 3.5 सेमी पेट्री डिश में स्थानांतरित करें जिसमें 2 एमएल प्री-गर्म सीआईएमएम होता है। स्लाइस को माइक्रोइंजेक्टेड होने के लिए पेट्री डिश के केंद्र में रखें। पेट्री डिश को प्रीहीटेड (37 डिग्री सेल्सियस) माइक्रोइंजेक्शन स्टेज पर ट्रांसफर करें।
- लंबे समय तक टिप वाले प्लास्टिक पिपेट का उपयोग करके माइक्रोइंजेक्शन पिपेट को माइक्रोइंजेक्टेड समाधान (चरण 3.3 से) के 1.4 -1.6 माइक्रोल के साथ लोड करें। पिपेट धारक पर माइक्रोइंजेक्शन पिपेट डालें।
- माइक्रोस्कोप पर सबसे कम आवर्धन का उपयोग करना, स्लाइस को ध्यान में लाएं और माइक्रोपिपेट को इस क्षेत्र (एफओवी) में मार्गदर्शन करें ताकि यह स्लाइस लक्ष्य के रूप में एक ही विमान पर केंद्रित हो। आवेदन में FOV देखने के लिए माइक्रोस्कोप के आउटपुट को कैमरे में स्विच करें।
- डिवाइस अंशांकन शुरू करने के लिए इंटरफ़ेस के शीर्ष बाईं ओर आवर्धन बटन पर क्लिक करें। एक विंडो आवर्धन का चयन करने के लिए संकेत देगी। 10x आवर्धन का चयन करें, या जो कुछ भी आवर्धन लेंस के लिए सेट है (जैसे, 4x, 10x, 20x, 40x) और प्रेस ठीक है। सॉफ्टवेयर मानता है कि आंतरिक उद्देश्य लेंस 10x (सबसे आम उद्देश्य लेंस आवर्धन) है।
- माइक्रोस्कोप के माइक्रोमेट्रिक व्हील का इस्तेमाल करते हुए पिपेट टिप को फिर से फोकस करें और कर्सर के साथ पिपेट टिप पर क्लिक करें। इसके बाद, स्टेप 1.1 बटन दबाएं और पॉपअप विंडो में ओके दबाएं। पिपेट वाई दिशा में आगे बढ़ेगा। पिपेट की नोक पर क्लिक करें और स्टेप 1.2 बटन दबाएं। अंत में, पिपेट कोण बॉक्स में 45 दर्ज करें और सेट कोण दबाएं।
- स्वचालित माइक्रोइंजेक्शन नियंत्रण पैनल में वांछित मापदंडों दर्ज करें। एपिकल प्रोजेनिटर्स में माइक्रोइंजेक्शन के लिए इंजेक्शन की दूरी 20 -40 माइक्रोन और गहराई को 10 - 15 माइक्रोन तक सेट करें। न्यूरॉन्स में माइक्रोइंजेक्शन के लिए बेसल की ओर से इंजेक्शन की दूरी 30 - 40 माइक्रोन सेट करें, और गहराई से 10 - 30 माइक्रोन करें जो लक्षित किया जा रहा है इसके आधार पर। हमेशा 100% करने के लिए गति निर्धारित किया है। सेट मानोंपर क्लिक करें .
नोट: दृष्टिकोण दूरी दूरी है पिपेट अगले इंजेक्शन दूरी पर जाने से पहले ऊतक से बाहर खींचती है, गहराई ऊतक में गहराई माइक्रोइंजेक्शन जाता है, रिक्ति अनुक्रमिक इंजेक्शन के बीच लाइन के साथ दूरी है, गति μm में पिपेट की गति है/ - ड्रा एज बटन पर क्लिक करें और इंजेक्शन के प्रक्षेपवक्र को परिभाषित करने के लिए पॉपअप विंडो में वांछित प्रक्षेपवक्र के साथ कर्सर खींचें। माइक्रोइंजेक्टिंग जनक स्टेम सेल के लिए, टेलेंसेफेलन सतह के वेंट्रल साइड को चित्र 2 एमें दिखाया गया है। पिपेट को लाइन की शुरुआत में लाएं और पिपेट की नोक पर क्लिक करें। माइक्रोइंजेक्टिंग शुरू करने के लिए रन प्रक्षेप पथ पर क्लिक करें। लक्षित इंजेक्शन के हर विमान के लिए इस कदम को दोहराएं (आमतौर पर 40 - 75 इंजेक्शन प्रति विमान के साथ 3 - 4 विमानों के लिए किया जाता है)।
5. ऊतक संस्कृति और ऊतक स्लाइस प्रसंस्करण के लिए इम्यूनोफ्लोरेसेंस
- कोलेजन मिश्रण (1.5 मिलीग्राम/एमएल): एक ट्यूब में मैट्रिक्स समाधान का 1.25 एमएल, आसुत पानी का 0.5 एमएल, 5x डीएमईएम-एफ 12 समाधान का 0.5 एमएल और पुनर्गठन बफर का 0.25 एमएल जोड़ें। उपयोग होने तक इसे बर्फ पर रखें।
- स्लाइस संस्कृति इनक्यूबेशन कक्ष से माइक्रोइंजेक्टेड स्लाइस युक्त पेट्री डिश प्राप्त करें और स्लाइस को कोलेजन मिश्रण में विसर्जित करें।
- स्लाइस को 200 - 300 माइक्रोन मिश्रण के साथ 35 मिमी ग्लास-बॉटम डिश के 14 मिमी कुएं में स्थानांतरित करें। सुनिश्चित करें कि स्लाइस बहुत कम कोलेजन में कवर किए गए हैं। यह सेट अप पोषक तत्वों और ऑक्सीजन तेज के लिए इष्टतम स्थितियों के लिए अनुमति देता है।
- स्लाइस को ओरिएंट करते हुए यह सुनिश्चित करते हुए कि दो जोड़ी संदंश का उपयोग करके स्लाइस के बीच पर्याप्त जगह है। कोलेजन को जमना करने की अनुमति देने के लिए एक हीटिंग ब्लॉक का उपयोग करके 37 डिग्री सेल्सियस पर 5 मिनट के लिए पेट्री डिश को इनक्यूबेट करें। स्लाइस संस्कृति के टी = 0 के रूप में इस समय पर विचार करें ।
- पेट्री डिश को अतिरिक्त 40 मिनट के लिए स्लाइस कल्चर इनक्यूबेटर में वापस ले जाएं। इसके बाद प्रीवारमेड सीएम की 2 एमएल डालें। स्लाइस वांछित समय बिंदु तक संस्कृति में रखा जाता है।
- स्लाइस कल्चर इनक्यूबेटर से स्लाइस लें और सीएम को एस्पिरेट करें । कोलेजन एम्बेडेड स्लाइस को 1x पीबीएस के साथ धोएं। 4% (wt/vol) पैराफॉर्मलडिहाइड (120 mm फॉस्फेट बफर, पीएच 7.4 में) जोड़ें और 30 मिनट के लिए आरटी पर ऊतक छोड़ दें। फिर रात भर निर्धारण के लिए अनुमति देने के लिए इसे 4 डिग्री सेल्सियस पर ले जाएं।
- अगले दिन पैराफॉर्मल्डिहाइड समाधान को एस्पिरेट करें और 1x पीबीएस वॉश करें। कोलेजन से स्लाइस को हटाने के लिए, एक स्टीरियोमाइक्रोस्कोप के तहत स्लाइस को धीरे से निकालने के लिए दो जोड़ी संदंश का उपयोग करें।
- माइक्रोइंजेक्टेड स्लाइस को प्रोसेस करने के लिए 3% (wt/vol) कम पिघलने वाले पॉइंट को पिघलाने के लिए माइक्रोवेव का इस्तेमाल करें । पिघले हुए एगर को डिस्पोजेबल एम्बेडिंग मोल्ड में डालें और इसे लगभग 38 - 39 डिग्री सेल्सियस तक ठंडा होने दें।
- एक प्लास्टिक पाश्चर पिपेट का उपयोग करके कम पिघलने वाले एगर से युक्त इस मोल्ड में चरण 5.7 से ऊतक स्लाइस स्थानांतरित करें। सुनिश्चित करें कि स्लाइस का पियाल पक्ष ऊपर है और वेंट्रिकुलर सतह नीचे का सामना करना पड़ता है। यदि तदनुसार ओरिएंट की जरूरत है। अग उठे आरटी को शांत करने के लिए जमना ।
- स्लाइस के आसपास अतिरिक्त agarose ट्रिम करें। यह सुनिश्चित करने के लिए एगर उठे ब्लॉक को ओरिएंट करें कि कट सतह वाइब्रेकोम के काटने वाले ब्लेड के समानांतर है। वाइब्रेटम का उपयोग करके, 50 माइक्रोन मोटी धाराओं को काट लें।
- 1x पीबीएस के साथ एक 24 अच्छी तरह से पकवान भरें। एक ठीक टिप तूलिका का उपयोग कर इस डिश में वर्गों को स्थानांतरित करें। मानक प्रोटोकॉल के अनुसार इम्यूनोफ्लोरेसेंस करें।
माइक्रोइंजेक्शन एकल तंत्रिका स्टेम कोशिकाओं और जीवित ऊतक में उनकी संतानों को ट्रैक करने और हेरफेर करने और शारीरिक वातावरण में उनकी वंश प्रगति का पालन करने के उद्देश्य से कार्य करता है। इस लेख में, हमने माउस टेलीसेफलॉन के ऑर्गेनोटीपिक स्लाइस को लक्षित करने और स्वचालित रूप से माइक्रोजेक्टिंग के लिए माइक्रोइंजेक्शन रोबोट के उपयोग का प्रदर्शन किया है। चित्रा 2 सफलतापूर्वक इंजेक्शन जनक कोशिकाओं के प्रतिनिधि छवियों को दिखाता है और चित्रा 3 इंजेक्शन नवजात न्यूरॉन्स दिखाता है । जब डेक्सट्रान एलेक्सा-488 (या एलेक्सा-A555) डाई के साथ इंजेक्शन दिया जाता है, तो कोशिकाएं पूरी तरह से डाई से भरी दिखाई देती हैं। एपिकल प्रोजेनिटर्स(चित्रा 2)कॉन्फोकल इमेजिंग के लिए उच्च स्थानिक संकल्प सेल आकृति विज्ञान, एपिकल और बेसल अटैचमेंट की उपस्थिति -या अनुपस्थिति के साथ पुनर्निर्माण की अनुमति देता है, और मार्कर अभिव्यक्ति के साथ रूपात्मक पूछताछ को संयोजित करने के लिए। इन मानदंडों के संयोजन से, उपयोगकर्ता माइक्रोइंजेक्टेड कोशिकाओं और उनकी संतान के लिए एक विशिष्ट सेल भाग्य आवंटित कर सकता है। न्यूरॉन इंजेक्शन के लिए, उपयोगकर्ता एप्लॉजिकल डेंड्राइट और एक्सॉन की संरचना और विशेषताओं सहित न्यूरोनल आकृति विज्ञान का पुनर्निर्माण कर सकता है। मैनुअल माइक्रोइंजेक्शन(चित्रा 2B)की तुलना में स्वचालित माइक्रोइंजेक्शन काफी अधिक थ्रूपुट प्रदान कर सकता है। इसके अलावा, एडू लेबलिंग इस बात की पुष्टि करता है कि सेल व्यवहार्यता स्वचालन(चित्रा 2सी)से प्रभावित नहीं होती है। संस्कृति में ऑर्गेनोटिपिक स्लाइस को ध्यान में रखते हुए माइक्रोइंजेक्टेड कोशिकाओं की वंश प्रगति का पालन करने की अनुमति देता है (हमने चित्र 2डी में 4 - 24h दिखाया)। यदि माइक्रोइंजेक्शन समाधान में आनुवंशिक सामग्री (डीएनए, एमआरएनए, CRISPR-Cas9 गाइड) या पुनर्संयोजन प्रोटीन होते हैं, तो यह अध्ययन करने की अनुमति देता है कि क्या और कैसे वंश प्रगति हेरफेर से प्रभावित होती है।
ऊतक में एकल तंत्रिका स्टेम कोशिकाओं में माइक्रोइंजेक्शन उत्कृष्ट एकल सेल रिज़ॉल्यूशन प्रदान करता है और इसी कारण से इसका उपयोग तंत्रिका स्टेम सेल प्रगति और भाग्य संक्रमण(चित्रा 3 ए)के सेल जीव विज्ञान को विच्छेदन करने के लिए किया गया है। माइक्रोइंजेक्शन रसायनों के जटिल मिश्रण की डिलीवरी की अनुमति देता है। हमने पहले इस सुविधा का उपयोग तंत्रिका जनक कोशिकाओं में जंक्शनल युग्मन का अध्ययन करने के लिए किया था, जिसमें गैप-जंक्शनल पारगम्य गैप-अभेद्य फ्लोरोसेंट रंगों12के साथ मिलाया गया था। हमने डेक्सट्रान-A555(चित्रा 3B)के साथ लूसिफ़ेर येलो इंजेक्शन द्वारा नवजात न्यूरॉन्स में जंक्शनल युग्मन का अध्ययन करके पिछले काम को बढ़ाया। जैसा कि चित्रा 3Bमें दिखाया गया है, नवजात पिरामिड न्यूरॉन्स का अनुपात गैप जंक्शनों के माध्यम से पड़ोसी न्यूरॉन्स के लिए युग्मित होता है। यह अवलोकन इस विचार के अनुरूप है कि अपरिपक्व न्यूरॉन्स गैप-जंक्शन13, 14के माध्यम से संवादकरतेहैं। इसके अलावा, न्यूरॉन्स को लक्षित करने से पता चलता है कि माइक्रोइंजेक्शन रोबोट के उपयोग को विकासशील स्तनधारी मस्तिष्क में कई सेल प्रकारों के लिए सामान्यीकृत किया जा सकता है। यह प्रयोगात्मक सेटअप ऊतक में न्यूरॉन्स के सेल जीव विज्ञान को विच्छेदन करने के लिए उपयोगी होगा, उदाहरण के लिए प्रोटीन-प्रोटीन इंटरैक्शन में हस्तक्षेप करने के लिए विशिष्ट ओलिइगोपेप्टाइड्स वितरित करके।
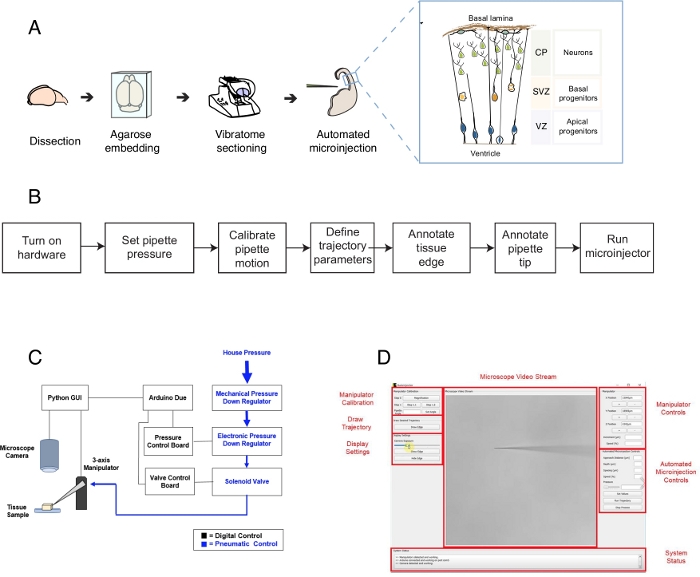
चित्रा 1: स्वचालित माइक्रोइंजेक्शन सेटअप और प्रोटोकॉल। (ए)माइक्रोइंजेक्शन रोबोट का इस्तेमाल करते हुए टिश्यू तैयार करने और ऑटोमेटेड माइक्रोइंजेक्शन के लिए ओवरऑल प्रोटोकॉल। सही इनसेट: माउस टेलेंसेफेलन के कार्टून योजनाबद्ध इस प्रोटोकॉल में माइक्रोइंजेक्शन के लिए लक्षित। (ख)ऑटोमेटेड माइक्रोइंजेक्शन स्टेप्स का फ्लोचार्ट । (ग)माइक्रोइंजेक्शन रोबोट हार्डवेयर की योजनाबद्ध। (घ)माइक्रोइंजेक्शन रोबोट को नियंत्रित करने और संचालित करने के लिए इस्तेमाल किए जाने वाले सॉफ्टवेयर का ग्राफिक यूजर इंटरफेस (जीयूआई) । यह आंकड़ा रेफरी12से अनुकूलित है । कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।
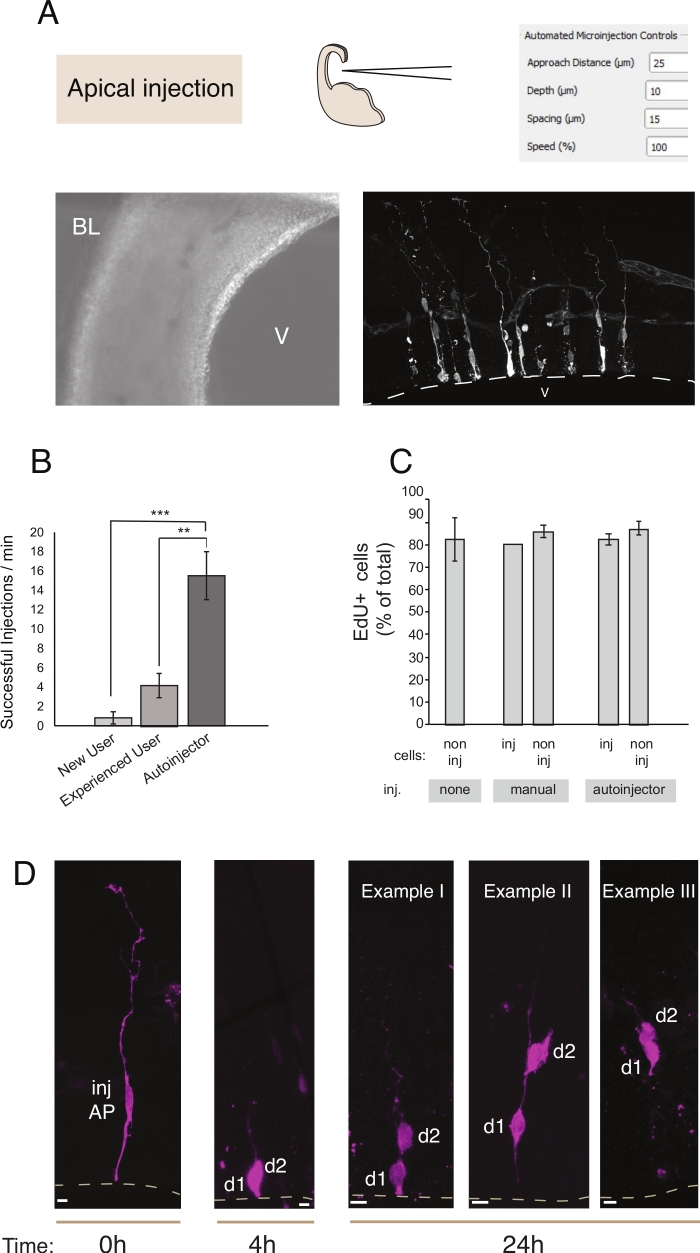
चित्रा 2: एपिकल प्रोजेनिटर में रोबोटिक माइक्रोइंजेक्शन। एपिकल सतह (एपिकल इंजेक्शन) के माध्यम से एपिकल प्रोजेनिटर्स (एपीएस) को लक्षित करने के लिए माइक्रोइंजेक्शन रोबोट का उपयोग करते समय योजनाबद्ध और अपेक्षित परिणाम। (A)टॉप रो । बाईं ओर: प्रक्रिया की योजनाबद्ध। दाईं ओर: एपिकल इंजेक्शन के लिए प्रासंगिक मापदंडों के साथ जीयूआई। नीचे पंक्ति। बाईं ओर: इंजेक्शन प्रक्रिया के दौरान ली गई चरण विपरीत छवि (वी: वेंट्रिकल; बीएल: बेसल लैमिना) । दाईं ओर: प्रतिनिधि परिणाम माइक्रोइंजेक्टेड एपीएस दिखा रहा है । धराशायी रेखा वेंट्रिकल (वी) का प्रतिनिधित्व करता है। स्केल बार: मैनुअल माइक्रोइंजेक्शन सिस्टम पर नौसिखिए उपयोगकर्ता के लिए प्रति मिनट 10 माइक्रोन (बी)सफल इंजेक्शन, मैनुअल माइक्रोइंजेक्शन सिस्टम पर एक अनुभवी उपयोगकर्ता, और माइक्रोइंजेक्शन रोबोट। (ग)इंजेक्शन क्षेत्र में माइक्रोइंजेक्टेड कोशिकाओं में और गैर-इंजेक्शन कोशिकाओं में एडू निगमन। माउस E14.5 पृष्ठीय टेलेंसेफलन के ऑर्गेनोटिपिक स्लाइस या तो (i) गैर इंजेक्शन या (ii) डेक्सट्रान-A488 (मैनुअल और ऑटोइंजेक्टर के लिए) का उपयोग करके मैनुअल या स्वचालित माइक्रोइंजेक्शन (इंजेक्शन स्लाइस) के अधीन थे। स्लाइस 24 घंटे के लिए EdU की उपस्थिति में संस्कृति में रखा गया था, तो वे तय किया गया और DAPI और EdU के लिए दाग । इंजेक्शन क्षेत्र में इंजेक्शन और गैर इंजेक्शन कोशिकाओं EdU सकारात्मकता के लिए रन बनाए गए थे । (घ)माइक्रोइंजेक्शन रोबोट वंश ट्रेसिंग का उपयोग करें। एक फ्लोरोसेंट डाई (Dx3-A555, मजेंटा) को एकल तंत्रिका स्टेम सेल (टी = 0 एच) में इंजेक्ट किया जाता है। फ्लोरोसेंट डाई को माइटोसिस के दौरान बेटी कोशिकाओं (d1, d2) में विभाजित किया जाता है। यह इंजेक्शन सेल (टी = 4 एच और 24 एच) की संतान का पालन करने और समय के साथ वंश प्रगति का खुलासा करने की अनुमति देता है। टी = 24 घंटे के लिए, हम संतान के कई उदाहरण दिखाते हैं जो किसी को खोजने की उम्मीद करता है। स्केल बार: 10 माइक्रोन। बी और सी में रेखांकन रेफरी से लिया जाता है। 12कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।
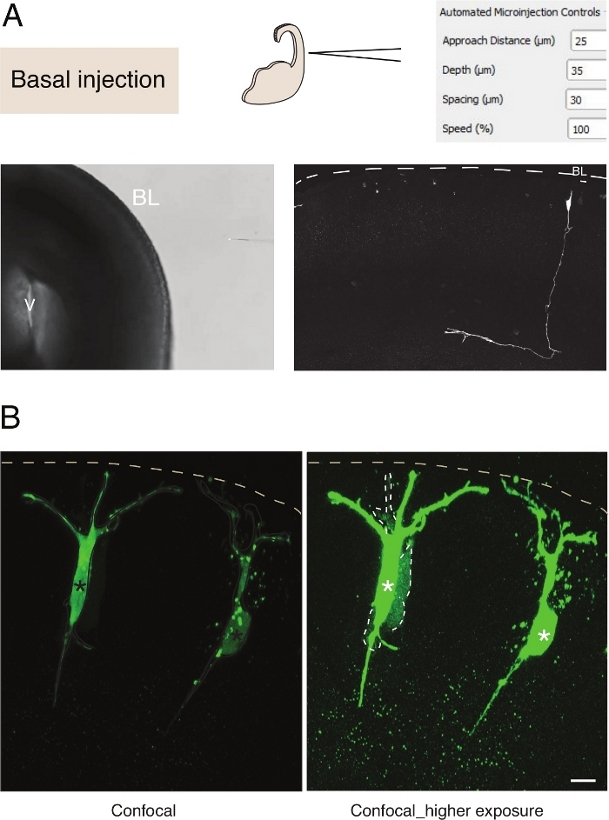
चित्रा 3: न्यूरॉन्स में रोबोट माइक्रोइंजेक्शन। बेसल सतह (बेसल इंजेक्शन) के माध्यम से पिरामिड न्यूरॉन्स (एन) को लक्षित करने के लिए माइक्रोइंजेक्शन रोबोट का उपयोग करते समय योजनाबद्ध और अपेक्षित परिणाम। (A)टॉप रो । बाईं ओर: प्रक्रिया की योजनाबद्ध। दाईं ओर: बेसल इंजेक्शन के लिए प्रासंगिक मापदंडों के साथ जीयूआई। नीचे पंक्ति। बाईं ओर: इंजेक्शन प्रक्रिया के दौरान ली गई चरण विपरीत छवि (वी: वेंट्रिकल; बीएल: बेसल लैमिना) । दाईं ओर: प्रतिनिधि परिणाम एक माइक्रोइंजेक्टेड एन धराशायी लाइन दिखा बेसल लैमिना (बीएल) का प्रतिनिधित्व करता है । स्केल बार: ऊतक में गैपजंक्शनल संचार का अध्ययन करने के लिए ऑटोइंजेक्टर का उपयोग करें। पिरामिड न्यूरॉन्स को दो रंगों वाले समाधान के साथ इंजेक्ट किया गया था: गैप जंक्शनल-अभेद्य Dx-A555 (दिखाया नहीं गया) और गैप-जंक्शनल पारगरेबल लूसिफ़ेर पीला (हरा)। Dx-A555 लक्षित सेल (तारांकन) तक ही सीमित है, जबकि LY उन कोशिकाओं को फैलाता है जो गैप जंक्शन के माध्यम से लक्षित कोशिका (धराशायी लाइनों) से जुड़े होते हैं। बाएं पैनल: कम एक्सपोजर, केवल माइक्रोइंजेक्टेड कोशिकाएं दिखाई देती हैं। सही पैनल: उच्च एक्सपोजर इंजेक्शन कोशिकाओं के साथ-साथ युग्मित कोशिकाओं (धराशायी लाइनों) के दृश्य की अनुमति देता है। स्केल बार: 10 माइक्रोन करें इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।
अनुपूरक फाइल: माइक्रोइंजेक्शन के दौरान उत्पन्न होने वाली कई सामान्य त्रुटियों का निवारण करना। इस फाइल को डाउनलोड करने के लिए यहां क्लिक करें।
ऊतक में एकल तंत्रिका स्टेम कोशिकाओं में माइक्रोइंजेक्शन उत्कृष्ट एकल कोशिका संकल्प प्रदान करता है और इसी कारण से इसका उपयोग तंत्रिका स्टेम सेल प्रगति और भाग्य संक्रमण के कोशिका जीव विज्ञान को विच्छेदन करने के लिए किया गया है(चित्रा 2, यह भीदेखें 10,11,12)। स्वचालित माइक्रोइंजेक्शन प्रक्रिया भ्रूण चूहों और मानव मस्तिष्क ऊतक दोनों में अन्य प्रकार की कोशिकाओं पर की जा सकती है। टेलेंसेफेलन की बेसल सतह को लक्षित करके नवजात न्यूरॉन्स के माइक्रोइंजेक्शन के प्रतिनिधि परिणाम चित्र 3में दिखाए गए हैं ।
यहां स्थापित सिद्धांत भ्रूण माउस दिमाग और मानव दिमाग में कई अलग सेल प्रकार को लक्षित करने के लिए लागू किया जा सकता है । हमने पहले यह दर्शाया है कि माइक्रोइंजेक्शन रोबोट का उपयोग माउस हिंडब्रेन और टेलेंसेफेलन और नवजात न्यूरॉन्स में एक जनक कोशिकाओं को निशाना बनाने के लिए भी किया जा सकता है और मानव विकासशील नियोकॉर्टेक्स12. इंजेक्शन प्रक्रिया का सबसे अच्छा परिणाम प्राप्त करने के लिए, इंजेक्शन शुरू करने से पहले सभी चरणों को अनुकूलित करना चाहिए। मस्तिष्क के ऊतकों(चित्रा 1)से व्यवहार्य और अच्छी तरह से संरक्षित ऑर्गेनोटिपिक ऊतक स्लाइस की तैयारी पर सावधानीपूर्वक विचार करना और अनुकूलित करना महत्वपूर्ण है। चित्र 1में दर्शाए गए विच्छेदन और टुकड़ा करने की प्रक्रिया में शीघ्र होना महत्वपूर्ण है । एपीस को लक्षित करने वाले एपिकल इंजेक्शन के लिए, किसी को एपिकल सतह के आदर्श अभिविन्यास को दिखाने वाले स्लाइस चुनना चाहिए। एपीएस इंजेक्शन के लिए, आदर्श अभिविन्यास पेट्री डिश के नीचे तक एपिकल सतह लंबवत है। किसी भी अन्य अभिविन्यास के रूप में अच्छी तरह से स्वतंत्र हो जाएगा, हालांकि, पेट्री डिश के लिए एपिकल सतह लंबवत इंजेक्शन के लिए एक व्यापक सतह क्षेत्र प्रदान करता है, इस प्रकार इंजेक्शन की सफलता में वृद्धि। न्यूरॉन्स में इंजेक्शन के लिए, टुकड़ा का अभिविन्यास कोई प्रभाव नहीं करने के लिए थोड़ा खेलता है ।
एक बार इंजेक्ट करने के लिए स्लाइस का चयन किया जाता है, प्रति स्लाइस इंजेक्शन प्रक्रिया लगभग 5 मिनट लगते हैं। यह देखते हुए कि एक जीवित ऊतक के साथ काम करता है, इंजेक्शन प्रक्रिया को गति देने के लिए अत्यधिक अनुशंसित है। इस उद्देश्य के लिए हम ऊतक तैयार होने से पहले जीयूआई(चित्रा 1D)के माध्यम से इंजेक्शन के लिए सभी मापदंडों को निर्धारित करने की सलाह देते हैं, ताकि किसी भी अनावश्यक प्रतीक्षा समय को कम किया जा सके। समस्या निवारण के लिए कृपया अनुपूरक फाइल का उल्लेख करें।
दीर्घकालिक स्लाइस संस्कृति के मामले में, स्वचालित माइक्रोइंजेक्शन प्रक्रिया के बाद कदम कोशिकाओं के स्वास्थ्य को प्रभावित कर सकते हैं और इस तरह प्रयोग कर सकते हैं। इसलिए, गुणवत्ता नियंत्रण परीक्षण चलाने और स्लाइस संस्कृति की स्थिति को अनुकूलित करने के लिए अत्यधिक सिफारिश की जाती है। टुकड़ा करने की क्रिया और इंजेक्शन प्रक्रिया के बाद सेल व्यवहार्यता का मूल्यांकन करने के लिए, हमने संस्कृति के दौरान एडू लेबलिंग का प्रदर्शन किया और हमने संस्कृतियों में पाइक्नोटिक नाभिक (एपोप्टिक कोशिकाओं के लिए एक प्रॉक्सी) की संख्या निर्धारित की और ऊतक12को इंजेक्ट किया। इन मात्राओं ने ऊतक व्यवहार्यता(चित्रा 2 सी)पर माइक्रोइंजेक्शन के किसी भी महत्वपूर्ण प्रभाव को प्रकट नहीं किया। हम प्रयोगशाला में ऑर्गेनोटिपिक ऊतक स्लाइसिंग और माइक्रोइंजेक्शन पाइपलाइन की स्थापना करते समय समान गुणवत्ता नियंत्रण चलाने की सलाह देते हैं।
मैनुअल माइक्रोइंजेक्शन की तुलना में माइक्रोइंजेक्शन रोबोट कई फायदे प्रदान करता है। सबसे पहले, मैनुअल इंजेक्शन की तुलना में उपयोगकर्ता के लिए सीखने की अवस्था कम खड़ी है: एक नया उपयोगकर्ता सीमित संख्या में सत्रों के बाद उच्च प्रवीणता तक पहुंच जाएगा, आमतौर पर 1 या 2। दूसरा, मैनुअल माइक्रोइंजेक्शन के मामले में, एक तुलनीय प्रवीणता के लिए महीनों के प्रशिक्षण की आवश्यकता होती है। इंजेक्शन प्रक्रिया तेज और अधिक कुशल(चित्रा 2B) है। हमने इन मापदंडों की मात्रा निर्धारित की और पाया कि माइक्रोइंजेक्शन रोबोट ने इंजेक्शन की सफलता (सफल इंजेक्शन का%/इंजेक्शन की कुल संख्या) और प्रति यूनिट समय12प्रति इंजेक्शन की कुल संख्या में एक कुशल मैनुअल उपयोगकर्ता से बेहतर प्रदर्शन किया । इसके परिणामस्वरूप एक कुशल उपयोगकर्ता की तुलना में माइक्रोइंजेक्शन रोबोट के लिए इंजेक्शन दक्षता (सफल इंजेक्शन/न्यूनतम का%) की कुल 300% वृद्धि होती है। शुरुआती उपयोगकर्ता के साथ माइक्रोइंजेक्शन रोबोट की तुलना करते समय दक्षता में वृद्धि और भी स्पष्ट थी और 700% तक पहुंच गई थी। अंतिम लेकिन कम से कम नहीं, माइक्रोइंजेक्शन रोबोट को सभी स्थानिक मापदंडों का व्यवस्थित रूप से पता लगाने के लिए आसानी से प्रोग्राम किया जा सकता है। यह विशेष रूप से लाभप्रद है जब माइक्रोइंजेक्शन रोबोट को नई कोशिकाओं या ऊतकों को लक्षित करने के लिए अनुकूल बनाते हैं, या विभिन्न स्थानिक संकल्प की आवश्यकता वाले उद्देश्यों के लिए माइक्रोइंजेक्शन रोबोट का उपयोग करते समय।
माइक्रोइंजेक्शन रोबोट का निर्माण करने के लिए मौजूदा एपि-फ्लोरेसेंस माइक्रोस्कोप12में न्यूनतम परिवर्तन की आवश्यकता होती है। हमने पहले https://github.com/bsbrl/Autoinjector में इस अनुकूलन के लिए निर्देश प्रदान किए हैं। एक बार हार्डवेयर सेटअप होने के बाद, यह प्रोटोकॉल स्वचालित माइक्रोइंजेक्शन को सफलतापूर्वक शुरू करने के लिए महत्वपूर्ण पद्धतिगत विवरण प्रदान करता है। कुल मिलाकर, माइक्रोइंजेक्शन रोबोट में 15.52 + 2.48 इंजेक्शन/मिनट की सफल इंजेक्शन दर है, जो एक अनुभवहीन उपयोगकर्ता (1.09 ± 0.67 इंजेक्शन/न्यूनतम) से 15x अधिक है, और एक विशेषज्ञ उपयोगकर्ता (4.95 ± 1.05 इंजेक्शन/मिनट)12से 3x अधिक है। सफल इंजेक्शन दर में यह सुधार नौसिखिए और विशेषज्ञ उपयोगकर्ताओं दोनों को कम समय में अधिक कोशिकाओं को इंजेक्ट करने का अधिकार देता है जो ऊतक व्यवहार्यता को संरक्षित करने के लिए आवश्यक है। इसके अतिरिक्त, माइक्रोइंजेक्शन रोबोट अनुकूलन योग्य है और प्रक्षेपवक्र, इंजेक्शन की गहराई, इंजेक्शन की संख्या, इंजेक्शन के बीच अंतर सभी जीयूआई का उपयोग करके ट्यून किया जा सकता है। ये विशेषताएं माइक्रोइंजेक्शन रोबोट को पहले श्रमसाध्य प्रयोगों को अनुकूलित करने के लिए एक उपकरण के रूप में उपयोग करने और मौलिक रूप से नए प्रयोगों का पता लगाने की अनुमति देती हैं जिन्हें पहले संभव से अधिक उपज की आवश्यकता होती है।
माइक्रोइंजेक्शन प्रक्रिया की मुख्य सीमाएं हमने यहां वर्णित की हैं, ऊतक स्लाइस की तैयारी से संबंधित हैं, एक महत्वपूर्ण कदम है कि व्यापक अनुकूलन की जरूरत है । इसके अलावा, माइक्रोइंजेक्शन एक सतह की उपस्थिति पर निर्भर करता है जिसे ग्लास पिपेट से संपर्क किया जा सकता है। यह सुविधा ऊतकों और ऊतक स्थानों के प्रकार को सीमित करती है जिन्हें वर्तमान सेटअप का उपयोग करके माइक्रोइंजेक्शन के माध्यम से लक्षित किया जा सकता है।
माइक्रोइंजेक्शन रोबोट वर्तमान में ब्राइटफील्ड इमेजिंग का उपयोग करता है और इन विट्रो ब्रेन स्लाइस तैयारी में इस्तेमाल किया गया है। भविष्य में, माइक्रोइंजेक्शन रोबोट को आणविक या डाई टैगिंग के लिए वीवो में एकल सेल लक्ष्यीकरण की विशिष्टता बढ़ाने के लिए 2-फोटॉन इमेजिंग के साथ जोड़ा जा सकता है। सिंगल सेल इलेक्ट्रोफिजियोलॉजी15,16के लिए इस तरह के प्रयास पहले ही किए जा चुके हैं . वर्तमान डिवाइस माइक्रोइंजेक्शन प्रक्रिया के मैनुअल अवलोकन की आवश्यकता है। भविष्य के संस्करणों में भरा माइक्रोइंजेक्शन पिपेट17 की सफाई के लिए रणनीतियां या मल्टीप्लेक्स के लिए18 द्रव हैंडलिंग रोबोटों का एकीकरण, पूरी तरह से स्वायत्त माइक्रोइंजेक्शन शामिल हो सकते हैं। इन उपकरणों परिमाण के आदेश से माइक्रोइंजेक्शन के पैमाने में वृद्धि हो सकती है । कई माइक्रोइंजेक्शन पिपेट19 के समानांतर नियंत्रण के लिए एल्गोरिदम को अनुकूल बनाने से एक ही प्रयोग के भीतर एक ही कोशिकाओं में दर्जनों रंगों और आणविक अभिकर्मकों के मल्टीप्लेक्स वितरण को सक्षम किया जा सकता है । इससे टिश्यू में मॉलिक्यूलर स्क्रीनिंग के लिए नए रास्ते खोलने की क्षमता है।
माइक्रोइंजेक्शन रोबोट का उपयोग डीएनए या आरएनए बारकोड का उपयोग करके कार्यात्मक रूप से पहचानी गई कोशिकाओं को टैग करने के लिए किया जा सकता है। इसके बदले में अन्य एकल सेल विश्लेषण तकनीकों के साथ जोड़ा जा सकता है, जैसे कि एकल सेल आरएनए अनुक्रमण (scRNAseq) और इलेक्ट्रॉन माइक्रोस्कोपी। हमारे प्रारंभिक परिणाम बताते हैं कि माइक्रोजेक्टेड कोशिकाओं और उनकी संतान को ऊतक वियोजन का उपयोग करके अलग किया जा सकता है और FACS छंटाई (Taverna, अप्रकाशित परिणाम) के बाद अलग किया जा सकता है। FACS हल कोशिकाओं तो scRNAseq के लिए इस्तेमाल किया जा सकता है । इसके अलावा, प्रारंभिक परिणाम बताते हैं कि माइक्रोइंजेक्शन रोबोट की एकल सेल रिज़ॉल्यूशन क्षमताओं का उपयोग इलेक्ट्रॉन सूक्ष्म विश्लेषण के संयोजन में उच्च स्थानिक संकल्प (टैवराना और विल्श-ब्राउंगर, अप्रकाशित परिणाम) पर ऊतक में तंत्रिका स्टेम कोशिकाओं पर सेल जीव विज्ञान का पता लगाने के लिए किया जा सकता है। इन आंकड़ों से पता चलता है कि माइक्रोइंजेक्शन रोबोट का उपयोग ऊतक में सहसंबद्ध प्रकाश और इलेक्ट्रॉन माइक्रोस्कोपी के लिए एक उपकरण के रूप में और व्यापक अर्थों में, ऊतक में कोशिका पहचान और व्यवहार के बहुमॉडल विश्लेषण के लिए किया जा सकता है।
माइक्रोइंजेक्शन दबाव के उपयोग पर निर्भर करता है और कोई उच्च आणविक जटिलता (उदाहरण के लिए, एक संपूर्ण ट्रांसक्रिप्टोम) के साथ इंजेक्शन समाधान का खर्च उठा सकता है। माइक्रोइंजेक्शन की इस सुविधा का फायदा अतीत में लिगांड-गेटेड रिसेप्टर्स20को अलग-थलग करने और क्लोनिंग करने के लिए किया गया है । इस लाइन के साथ, माइक्रोइंजेक्शन रोबोट का उपयोग सेलुलर स्तर पर बहु-जेनिक लक्षणों के मॉडलिंग और अध्ययन के लिए किया जा सकता है। एक उप पूलिंग रणनीति के साथ संयुक्त, माइक्रोइंजेक्शन रोबोट भी एक मंच के रूप में इस्तेमाल किया जा सकता है एक निश्चित विशेषता ड्राइविंग जीन के ंयूनतम सेट की पहचान/ इस प्रकार अब तक, माइक्रोइंजेक्शन रोबोट का उपयोग एमआरएनए, डीएनए या रिकॉम्बिनेंट प्रोटीन10, 21, 22की डिलीवरी के माध्यम से कोशिका की बायोकेमिस्ट्री में हेरफेर करने के लिए किया गया है। हम इंट्रासेलुलर स्पेस के बायोफिजिक्स की जांच में माइक्रोइंजेक्शन रोबोट के एक आवेदन की उम्मीद करते हैं, उदाहरण के लिए, नैनोमैटेरियल्स या नैनोमशीनों को वितरित करके जो इंट्रासेलुलर स्पेस के बायोफिजिकल गुणों को संवेदन और/या हेरफेर की अनुमति देते हैं ।
लेखकों के पास खुलासा करने के लिए कुछ नहीं है ।
लेखक नोमिस फाउंडेशन (ईटी) को स्वीकार करना चाहेंगे । एसबीके ने मैकेनिकल इंजीनियरिंग विभाग से धन स्वीकार किया, कॉलेज ऑफ साइंस एंड इंजीनियरिंग, मिनेसोटा विश्वविद्यालय के एमएनड्राइव आरएसएएम पहल, मिनेसोटा उच्च शिक्षा विभाग, राष्ट्रीय स्वास्थ्य संस्थान (एनआईएच) 1R21NS103098-01, 1R01NS1111028, 1R34NS1111654, 1R21NS11286 और 1R21 NS111196। जीएस को नेशनल साइंस फाउंडेशन ग्रेजुएट रिसर्च फेलोशिप और एनएसएफ आईजीईआरटी ट्रेनिंग ग्रांट ने सपोर्ट किया ।
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Agarose, Low Melt | Carl Roth | Cat# 6351.2 | |
| Agarose, Wild Range | Sigma-Aldrich | Cat# A2790 | |
| Best-CA 221 Glue | Best Klebstoffe GmbH & Co.KG | Cat# CA221-10ml | |
| B-27 Supplement | Thermo Fisher Scientific | Cat# 17504044 | |
| Cellmatrix Type-IA (Collagen, Type !) | FUJIFILM Wako Chemicals | Cat# 637-00653 | |
| Distilled Water | |||
| DMEM-F12, CO2 independent (w/o Phenol red) | Sigma-Aldrich | Cat# D2906 | |
| DMEM-F12, CO2 independent (with Phenol red) | Sigma-Aldrich | Cat# D8900 | |
| HEPES-NAOH, pH 7.2, 1M (HEPES buffer) | Carl Roth | Cat# 9105.3 | |
| L-Glutamine, 200 mM | Thermo Fisher Sientific | Cat# 25030024 | |
| Mowiol 4-88 | Sigma-Aldrich | Cat# 81381 | |
| N-2 Supplement | Thermo Fisher Scientific | Cat# 17502048 | |
| Neurobasal Medium | Thermo Fisher Scientific | Cat# 21103049 | |
| Nuclease-free water | Thermo Fisher Scientific | Cat# AM9937 | |
| O2 (40%), CO2 (5%), N2 (55%) Mix, 50 liters | |||
| Paraformaldehyde | Merck | Cat# 818715 | |
| PBS | |||
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | Cat# 15140122 | |
| Rat serum | Charles River Laboratories | ||
| Japan | |||
| Sodium bicarbonate (NaHCO3) | Merck | Cat# 106323 | |
| Sodium hydroxide (NaOH) | Merck | Cat# 106482 | |
| Tyrode’s salt | Sigma | Cat# T2145-10x1L) | |
| Equipment | |||
| Borosilicate glass capillaries, 1.2 mm outer diameter x 0.94 mm inner diameter | Sutter Instruments | Cat# BF-120-94-10 | |
| Bottle-top filter system, 500 mL | Corning | Cat# 430769 | |
| Computer PC | |||
| Custom pressure rig | Custom pressure rig | ||
| Electronic pressure regulator | Parker Hannifin | Cat# 990-005101-002 | |
| Falcon tubes, 15 mL | Corning | Cat# 430791 | |
| Falcon tubes, 50 mL | Corning | Cat# 430829 | |
| Fine-tip paintbrush | |||
| Flaming/ Brown micropipette puller | Sutter Instruments | Cat# P-97 | |
| Forceps, Dumont no. 3 | Fine Science Tools | Cat# 11231-30 | |
| Forceps, Dumont no. 5 | Fine Science Tools | Cat# 11255-20 | |
| Forceps, Dumont no. 55 | Fine Science Tools | Cat# 11252-20 | |
| Heating block | Labtech International | Cat # Dri block Digi2 | |
| Inverted fluorescence microscope | Zeiss | Cat# Axiovert 200 | |
| Light source | Olympus | Cat# Highlight 3100 | |
| Manual pressure regulator | McMaster Carr | Cat# 0-60 PSI 41795K3 | |
| Microloader Tips | Eppendorf | Cat# 5242956.003 | |
| Microcontroller | Arduino | Cat# Arduino Due | |
| Microscope camera Hamamatsu Orca Flash 4.0 V3 | |||
| Motorized stage XY for microscope | |||
| Multiwell plate, 24 wells | Nunc | Cat# 142475 | |
| Pasteur pipettes, plastic | |||
| Petri dish, 60 x 15 mm | Greiner | Cat# 628102 | |
| Petri dish, 35 x 10 mm | Nunc | Cat# 153066 | |
| Petri dish, 34 x 14 mm, including Microwell no. 1.5 cover glass | MatTek | Cat# P35G-1.5-14-C | |
| Pipette holder | Warner Instruments | Cat# 64-2354 MP-s12u | |
| Pipette and tips | |||
| Puller filament, 3.0-mm square box filament | Sutter Instrument | Cat# FB330B | |
| Slice culture incubation box | MPI-CBG | Cat# custom made | |
| Solenoid valve | Cat# LHDA053321H-A | ||
| Stereomicroscope | Olympus | Cat# SZX12 | |
| Tabletop centrifuge | Heraeus | Cat# 5431622 | |
| Thermometer | |||
| Three-axis Manipulator | Sensapex Inc | Cat# tree-axis uMP | |
| Vibratome | Leica | Cat# VT1000s | |
| Whole-embryo-culture-system incubator | Ikemoto Company | Cat# RKI-10-0310 | |
| Waterbath | |||
| Software and Algorithms | |||
| Arduino | Arduino | ||
| Fiji | RRID: SCR_002285 | ||
| Python | Python Software foundation | Python 2.7.12 | |
| ZEN | RRID: SCR_013672 |
- Taverna, E., Götz, M., Huttner, W. B. The Cell Biology of Neurogenesis: Toward an Understanding of the Development and Evolution of the Neocortex. Annual Review of Cell and Developmental Biology. 30 (1), 465-502 (2014).
- Götz, M., Huttner, W. B. The cell biology of neurogenesis. Nature Reviews Molecular Cell Biology. 6 (10), 777-788 (2005).
- Di Lullo, E., Kriegstein, A. R. The use of brain organoids to investigate neural development and disease. Nature Reviews Neuroscience. 18 (10), 573-584 (2017).
- Lancaster, M. A., Knoblich, J. A. Organogenesisin a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Kretzschmar, K., Clevers, H. Organoids: Modeling Development and the Stem Cell Niche in a Dish. Developmental Cell. 38 (6), 590-600 (2016).
- Pepperkok, R. et al. Automatic microinjection system facilitates detection of growth inhibitory mRNA. Proceedings of the National Academy of Sciences of the United States of America. 85 (18), 6748-6752 (1988).
- Pepperkok, R., Lowe, M., Burke, B., Kreis, T. E. Three distinct steps in transport of vesicular stomatitis virus glycoprotein from the ER to the cell surface in vivo with differential sensitivities to GTPγS. Journal of Cell Science. 111 (13), 1877-1888 (1998).
- Pepperkok, R. et al. β-COP is essential for biosynthetic membrane transport from the endoplasmic reticulum to the Golgi complex in vivo. Cell. 74 (1), 71-82 (1993).
- Ansorge, W., Pepperkok, R. Performance of an automated system for capillary microinjection into living cells. Journal of Biochemical and Biophysical Methods. 16 (4), 283-292 (1988).
- Taverna, E., Haffner, C., Pepperkok, R., Huttner, W. B. A new approach to manipulate the fate of single neural stem cells in tissue. Nature Neuroscience. 15 (2), 329-337 (2012).
- Wong, F. K., Haffner, C., Huttner, W. B., Taverna, E. Microinjection of membrane-impermeable molecules into single neural stem cells in brain tissue. Nature Protocols. 9 (5), 1170-1182 (2014).
- Shull, G., Haffner, C., Huttner, W. B., Kodandaramaiah, S. B., Taverna, E. Robotic platform for microinjection into single cells in brain tissue. EMBO Reports. 20 (10), e47880 (2019).
- Jabeen, S., Thirumalai, V. The interplay between electrical and chemical synaptogenesis. Journal of Neurophysiology. 120 (4), 1914-1922 (2018).
- Nagy, J. I., Pereda, A. E., Rash, J. E. Electrical synapses in mammalian CNS: Past eras, present focus and future directions. Biochimica et Biophysica Acta - Biomembranes. 1860 (1), 102-123 (2018).
- Suk, H.J. et al. Closed-loop real-time imaging enables fully automated cell-targeted patch-clamp neural recording in vivo. Neuron. 95 (5), 1037-1047 (2017).
- Annecchino, L. A. et al. Robotic automation of in vivo two-photon targeted whole-cell patch-clamp electrophysiology. Neuron. 95 (5), 1048-1055 (2017).
- Kolb, I. et al. Cleaning patch-clamp pipettes for immediate reuse. Scientific Reports. 6, 35001 (2016).
- Holst, G. L. et al. Autonomous patch-clamp robot for functional characterization of neurons in vivo: development and application to mouse visual cortex. Journal of Neurophysiology. 121 (6), 2341-2357 (2019).
- Kodandaramaiah, S. B. et al. Multi-neuron intracellular recording 1 in vivo via interacting autopatching 2 robots. ELife. 7, 24656 (2018).
- Lubbert, H. et al. cDNA cloning of a serotonin 5-HT1c receptor by electrophysiological assays of mRNA-injected Xenopus oocytes (RNA fractionation/hybrid depletion/hybrid selection/choroid plexus/voltage clamp). Neurobiology. 84 (2) 4332-4336 (1987).
- Florio, M. et al. Human-specific gene ARHGAP11B promotes basal progenitor amplification and neocortex expansion. Science. 347 (6229), 1465-1470 (2015).
- Kalebic, N. et al. CRISPR/Cas9-induced disruption of gene expression in mouse embryonic brain and single neural stem cells in vivo. EMBO Reports. 17 (3), 338-348 (2016).
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved