Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Bioengineering
Manipulering av enkle nevrale stamceller og nevroner i hjerneskiver ved hjelp av Robotic Microinjection
Denne protokollen demonstrerer bruken av en robotplattform for mikroinjeksjon i enkelt nevrale stamceller og nevroner i hjerneskiver. Denne teknikken er allsidig og tilbyr en metode for å spore celler i vev med høy romlig oppløsning.
Et sentralt spørsmål i utviklingsnevrobiologi er hvordan nevrale stamceller og stamceller danner hjernen. For å svare på dette spørsmålet må man merke, manipulere og følge enkeltceller i hjernevevet med høy oppløsning over tid. Denne oppgaven er ekstremt utfordrende på grunn av kompleksiteten av vev i hjernen. Vi har nylig utviklet en robot, som guider en mikroinjeksjonsnål inn i hjernevev ved bruk av bilder hentet fra et mikroskop for å levere femtolitervolumer av løsning i enkeltceller. Robotoperasjonen øker resulterer i et samlet utbytte som er en størrelsesorden som er større enn manuell mikroinjeksjon og muliggjør presis merking og fleksibel manipulering av enkeltceller i levende vev. Med dette kan man mikroinjisere hundrevis av celler i en enkelt organotypisk skive. Denne artikkelen demonstrerer bruken av mikroinjeksjonsroboten for automatisert mikroinjeksjon av nevrale stamceller og nevroner i hjernevevsskiver. Mer generelt kan den brukes på ethvert epitelvev med en overflate som kan nås av pipetten. Når den er satt opp, kan mikroinjeksjonsroboten utføre 15 eller flere mikroinjeksjoner per minutt. Mikroinjeksjonsroboten på grunn av gjennomstrømningen og versaliteten vil gjøre mikroinjeksjon til en bredt enkel høyytelses cellemanipuleringsteknikk som skal brukes i bioteknologi, bioteknologi og biofysikk for å utføre encellede analyser i organotypiske hjerneskiver.
Denne protokollen beskriver bruken av en robot for å målrette og manipulere enkeltceller i hjernevevskiver, spesielt med fokus på enkelt nevrale stamceller og nevroner. Roboten ble utviklet for å ta opp et sentralt spørsmål i utviklingsnevrologi, det er hvordan nevrale stamceller og stamceller bidrar til hjernens morfogenese1,2,3,4,5. For å svare på dette spørsmålet, man trenger å merke og spore enkelt nevrale stamceller og følge deres avstamning progresjon over tid for å korrelere encellede atferd med vev morphogenesis. Dette kan oppnås på forskjellige måter, for eksempel ved å elektroporere hjernevev i utero eller ved å merke enkeltcelle ved hjelp av lipofile dør. Selv om de er kraftige, mangler disse metodene nøyaktig enkeltcelleoppløsning (elektroporasjon) og/eller muligheten til å manipulere det intracellulære rommet (lipofil fargestoff). Mikroinjeksjon i enkeltceller ble utviklet for å overvinne denneutfordringen 6,7,8. Under mikroinjeksjon settes en pipette kort inn i en enkelt celle i intakt vev under trykk for å mikroinjisere femtolitervolumer av reagenser9. Vi har tidligere beskrevet en manuell prosedyre for mikroinjisering av enkeltnevrale stamceller i organotypisk vev (figur 1A)10,11. Mikroinjeksjon i nevrale stamceller er avhengig av bruk av en mikropipette som settes inn i enkle nevrale stamceller for å injisere en løsning som inneholder et fluorescerende fargestoff, sammen med andre molekyler av interesse. Selektiv målretting av nevrale stamceller oppnås ved å nærme seg den utviklende telencephalon via ventrikulær overflate (eller ventrikkel, se tegneserie i figur 1A), som er dannet av den alektiske plasmamembranen av aksiske stamceller (tegneserie i figur 1A). Denne prosessen må gjentas for hver celle som eksperimentereren ønsker å injisere. Videre er suksessen til mikroinjeksjon avhengig av nøyaktig kontroll av dybden og varigheten av mikropipetteinjeksjon i vevet. Dermed, til tross for de unike fordelene, er manuell mikroinjeksjon ekstremt kjedelig og krever betydelig praksis for å utføre med rimelig gjennomstrømning og utbytte, noe som gjør denne teknikken vanskelig å bruke på en skalerbar måte. For å overvinne denne begrensningen har vi nylig utviklet en bildestyrt robot, Autoinjector12 (eller mikroinjeksjonsrobot) som automatisk kan utføre mikroinjeksjoner i enkeltceller.
Mikroinjeksjonsroboten bruker mikroskopiske bilde- og datavisjonsalgoritmer for å målrette nøyaktig bestemte steder i 3D-plass i vev for mikroinjeksjon (figur 1B). Mikroinjeksjonsroboten kan konstrueres ved å gjøre relativt enkle endringer i et eksisterende mikroinjeksjonsoppsett. Den generelle skjematiske mikroinjeksjonsroboten er vist i figur 1C. En pipette er montert i en pipetteholder festet til en treakse manipulator. Et mikroskopkamera brukes til å skaffe bilder av vevet og mikroinjeksjonsnålen. Et tilpasset trykkreguleringssystem brukes til å kontrollere trykket inne i pipetten, og en programmerbar mikromanipulator brukes til å kontrollere posisjonen til mikroinjektorpipetten. Kamerabildene av vevet og mikroinjeksjonspipetten brukes til å bestemme den romlige plasseringen av mikroinjeksjonspipettespissen og stedene hvor mikroinjeksjoner må utføres. Programvaren beregner deretter baner som trengs for å flytte pipetten i vevet. All maskinvaren styres av programvaren som vi tidligere utviklet. All programvare er skrevet i kodespråk (f.eks Python og Arduino) og kan lastes ned fra https://github.com/bsbrl/Autoinjector med instruksjoner. Det grafiske brukergrensesnittet (GUI) gjør det mulig for brukeren å bilde vevet og mikropipetten, og for å tilpasse banen til mikroinjeksjon. Vårt system kan etableres ved hjelp av relativt enkle modifikasjoner på et omvendt mikroskop utstyrt med brightfield og epi-fluorescensfiltre.
Først gir vi instruksjoner om å forberede hjernens organotypiske vevskiver for mikroinjeksjon. Deretter illustrerer protokollen å starte mikroinjeksjonsroboten etterfulgt av forberedende trinn, for eksempel pipettebevegelseskalibrering, som må gjøres før mikroinjeksjon. Dette etterfølges av å definere injeksjonsparametrene. Etter dette kan brukeren definere banen som brukes av mikroinjeksjonsroboten og starte injeksjonsprosedyren. Det mikroskopiske vevet (i dette tilfellet hjerneorganotypiske vevskiver) kan holdes i kultur i ulike tidsperioder avhengig av eksperimentell design10,11. Vevet kan behandles for å følge og studere identiteten og skjebnen til de injiserte cellene og deres avkom. Alternativt kan de mikroinjekte cellene følges ved hjelp av levende bildebehandling. Innenfor rammen av denne protokollen demonstrerer vi bruken av roboten for å automatisk mikroinjeksjon nevrale stamceller i organotypiske stykker av mus E14.5 dorsal telencephalon. Roboten er ytterligere i stand til mikroinjeksjon i nyfødte nevroner i musen telencephalon, så vel som i den menneskelige fosterets telencefalon12.
Oppsummert beskriver vi en robotplattform som kan brukes til å følge og manipulere enkeltceller i vev. Plattformen gjør bruk av trykk, og det er derfor ekstremt allsidig om den kjemiske naturen av forbindelsen å injisere. I tillegg kan den tilpasses målceller enn stamceller. Vi forventer at systemet vårt også enkelt tilpasses andre modellsystemer.
Alle dyrestudier ble utført i samsvar med tysk dyrevelferdslovgivning, og de nødvendige lisensene ble hentet fra den regionale etiske kommisjonen for dyreeksperimentering i Dresden, Tyskland (Tierversuchskommission, Landesdirektion Dresden). Organotypisk skiver ble utarbeidet fra E14.5 eller E16.5 C57BL/6 mus embryonisk telencefalon (Janvier Labs).
1. Installasjon av programvare
- Følg instruksjonene for å installere programvaren fra https://github.com/bsbrl/Autoinjector.
2. Tilberedning av reagenser og pipetter
- Agarose: Forbered 3% agarose ved separat oppløsning av 3 g bredt spekter agarose og 3 g lavt smeltepunkt oppsto i 100 ml cellekultur-grade PBS i to separate 200 ml glassflasker, henholdsvis. Oppbevares ved romtemperatur i opptil 3 måneder.
- Tyrodeoppløsning: Løs opp 1 g natriumbikarbonat og Tyrodes salt (bruk innholdet i hele flasken) og 13 ml 1 M HEPES i 1 L destillert vann. Juster pH-en til 7,4. Filtrer oppløsningen gjennom et 0,2 μm flaskefilter.
- Slice kultur medium (SCM): Tilsett 10 ml rotte serum, 1 ml 2 mM glutamin, 1 ml penicillin-streptomycin (100x), 1 ml N-2 supplement (100x), 2 ml B27 supplement (50x) og 1 ml HEPES (pH 7.3) buffer i 84 ml Neurobasal medium. Aliquot 5 ml SCM i 15 ml rør. Oppbevares ved -20 °C.
- CO2-Independent Microinjection Medium (CIMM): Klargjør 5x DMEM modifisert lavglukoseoppløsning (uten fenolrød) ved å oppløse pulveret i 200 ml destillert vann. Filtrer oppløsningen gjennom et 0,2 μm flaskefilter (for DMEM-pulveret, bruk innholdet i hele flasken). For å forberede 100 ml CIMM, bland 20 ml 5x DMEM modifisert løsning, 1 ml HEPES buffer, 1 ml N2 supplement (100x), 2 ml B27 supplement (50x), 1 ml penicillin-streptomycin (100x), 1 ml 2 mM glutamin og 74 ml destillert vann. Oppbevar oppløsningen ved 4 °C.
- Rekonstitueringsbuffer: Klargjør rekonstitueringsbufferen ved å oppløse 262 mM NaHCO3,0,05 N NaOH, 200 mM HEPES i destillert vann. Steriliser oppløsningen ved filtrering gjennom et filtersystem på flaske 0,22 μm i en steril glassflaske. Aliquot 500 μL rekonstitueringsbuffer i lufttette mikrocentrifugerør. Oppbevares ved 4 °C.
- Mikroinjeksjonsfargestoff: Løs opp fluorescerende merket Dextran i RNase fritt destillert vann (endelig konsentrasjon 10 μg/μL). Forbered 5 μL aliquots og oppbevar ved -20 °C til bruk.
- Trekk mikroinjeksjonspipettene fra borosilikatglasskapillærer (1,2 mm ytre diameter, 0,94 mm indre diameter) ved hjelp av mikropipettetrekkeren. Beskytt pipettene mot støv. Ikke oppbevar pipetter i mer enn 2 – 3 dager. For dette eksperimentet var trekkparametrene HEAT: rampetemperatur +1 – 5; TREKK: 100; VEL: 110; 100. HEAT og VEL er parametrene som påvirker pipettens mest form og størrelse.
MERK: Den optimale mikroinjeksjonspipetten har en lang og fleksibel spiss for å unngå celleskade under mikroinjeksjon.
3. Preparat av vevsskive
- Smelt den 3% brede rekkevidden oppsto ved hjelp av en mikrobølgeovn før hjernevevsdeksjonen. Ikke la agarosestørkning ved å holde i et vannbad ved 37 °C før innebygging. Sørg for at pipettene er beskyttet mot støv. Ikke oppbevar pipetter i mer enn 2 – 3 dager.
- Tin en aliquot av SCM og varm 10 - 12 ml CIMM og 20 ml Tyrodes løsning til 37 ° C ved hjelp av et vannbad.
- Bland den fluorescerende tracer (Dextran-3000 eller Dextran-10000-Alexa konjugert; endelig konsentrasjon 5 – 10 μg/μL) med de andre kjemikaliene som skal injiseres. Sentrifuger mikroinjeksjonsoppløsningen ved 16 000 x g i 30 min ved 4 °C. Samle supernatant og overføre til et nytt rør. Oppbevar mikroinjeksjonsoppløsningen på is til bruk.
- Bruk hodene fra E13.5 – E16.5 museembryoer til å forberede organotoniske vevskiver av telencephalon. Fjern huden og åpne skallen ved hjelp av tangen, beveger seg langs midtlinjen. Disseker ut den embryonale hjernen fra den åpne skallen og fjern meningene som dekker hjernevevet fra den ventrale siden av hjernen. La den dissekerte hele hjernen i Tyrodes løsning på en 37 °C varmeblokk.
MERK: Alle disseksjonstrinn som er beskrevet i 3,4 må utføres i førkrigstydes oppløsning. - Hell det brede spekteret smeltet agarose i en engangs innebygging mold. Når agarose er avkjølt til 38 – 39 °C, forsiktig overføre hjernen (maksimalt 4) inn i den ved hjelp av en Pasteur pipette. Bruk alltid kuttespisser for dette trinnet.
- Rør agarose rundt vevet enten ved hjelp av en slikkepott eller et par Dumont #1 tang uten å berøre vevet. La agarose stivne ved romtemperatur. Når agarose har størknet, trim overflødig agarose rundt vevet.
- Fyll bufferskuffen med PBS. Orienter hjernen med rostro-caudal aksen av vevet vinkelrett på brettet (bruk som landemerke olfaktoriske pærer, som representerer rostral-mest delen av hjernen). Skjær 250 μm skiver med en vibratome.
- Fyll en 3,5 cm petriskål med 2 ml forhåndsvarsmedia. Bruk en limerør i plast til å overføre skiver (10 - 15) til denne parabolen. Når du er ferdig, skift petriskålen med skivene inn i skivekulturinkubatoren. Vedlikehold skiver ved 37 °C i en fuktet atmosfære som inneholder 40 % O2 / 5 % CO2 / 55 % N2 til bruk.
4. Mikroinjeksjon
- Slå på datamaskinen, mikroskopet, mikroskopkameraet, manipulatorene, trykkriggen og trykksensoren. Last inn programmet ved å klikke på filen "launchapp.py" i hovedmappen lastet ned fra GitHub og angi enhetsinnstillingene i popup-skjermen (se trinn 1.1 for installasjonsinstruksjoner).
- Lag et ytre trykk for å hindre uønsket tilstopping før pipetten senkes ned i løsningen. Hvis du vil legge trykk på pipetten, skyver du kompensasjonstrykkstangen til 24 – 45 % og klikker Angi verdier. Deretter stiller du trykket på et tilstrekkelig trykk ved å dreie den mekaniske trykkventilknappen til 1 – 2 PSI (69 – 138 mbar) som angitt av trykksensoren.
- Overfør skivene til en 3,5 cm petriskål som inneholder 2 ml forhåndsoppvarmet CIMM. Plasser skivene som skal mikroinjiseres i midten av petriskålen. Overfør petriskålen til det forvarmede (37 °C) mikroinjeksjonsstadiet.
- Legg mikroinjeksjonspipetten med en mikroinjisert oppløsning (fra trinn 3,3) med en langspiss plastpipette. Sett mikroinjeksjonspipetten på pipetteholderen.
- Bruk den laveste forstørrelsen på mikroskopet, sett skiven i fokus og før mikropipetten til dette synsfeltet (FOV), slik at det er fokusert på samme plan som skivemålet. Sett utgangen av mikroskopet til kameraet for å se FOV i programmet.
- Klikk på forstørrelsesknappen øverst til venstre i grensesnittet for å starte enhetskalibrering. Et vindu vil be om å velge forstørrelsen. Velg 10x forstørrelsen, eller hvilken forstørrelse linsen er satt til (f.eks. 4x, 10x, 20x, 40x) og trykk Ok. Programvaren forutsetter at den interne objektive linsen er 10x (den vanligste objektive linseforstørrelse).
- Refokuser pipettespissen på nytt ved hjelp av mikrometrisk hjul på mikroskopet, og klikk på pipettespissen med markøren. Deretter trykker du på trinn 1.1-knappen og trykker på OK i popup-vinduet. Pipetten vil bevege seg i Y-retningen. Klikk på tuppen av pipetten og trykk på trinn 1.2-knappen. Til slutt skriver du inn 45 i pipettevinkelboksen og trykker på Angi vinkel.
- Angi ønskede parametere i kontrollpanelet Automatisert mikroinjeksjon. For mikroinjeksjon i a apiske stamfarer sette injeksjonsavstanden til 20 – 40 μm og dybde til 10 – 15 μm. For mikroinjeksjon i nevroner sette injeksjon avstand 30 - 40 μm fra basalsiden, og dybde til 10 - 30 μm avhengig av hva som blir målrettet. Sett alltid hastighet til 100 %. Klikk Angi verdier.
MERK: Inntrekksavstanden er avstanden pipetten trekker ut av vevet før den beveger seg til neste injeksjonsavstand, dybden er dybden inn i vevet mikroinjeksjonen går, avstand er avstanden langs linjen mellom sekvensielle injeksjoner, hastigheten er hastigheten på pipetten i μm / s. - Klikk tegnkant-knappen, og dra markøren langs ønsket bane i popup-vinduet for å definere injeksjonsbanen. For mikroinjiserende stamceller er ventral side av telencephalonoverflaten målrettet som vist i figur 2A. Ta pipetten til starten av linjen og klikk på tuppen av pipetten. Klikk Kjør bane for å starte mikroinjisering. Gjenta dette trinnet for hvert injeksjonsplan målrettet (vanligvis gjort for 3 – 4 fly med 40 – 75 injeksjoner per plan).
5. Vevskultur og vevsskivebehandling for immunofluorescence
- Klargjør kollagenblandingen (1,5 mg/ml): Til et rør tilsett 1,25 ml av matriseoppløsningen, 0,5 ml destillert vann, 0,5 ml 5x DMEM-F12-oppløsning og 0,25 ml rekonstitueringsbuffer. Oppbevar den på is til bruk.
- Få petriskålen som inneholder de mikroinjektede skivene fra skivekulturinkubasjonskammeret og dypp skivene i kollagenblandingen.
- Overfør skivene sammen med 200 – 300 μL kollagenblanding til en 14 mm brønn av en 35 mm glassbunnsfat. Sørg for at skivene er dekket av svært mindre kollagen. Dette oppsettet gir optimale forhold for næringsstoffer og oksygenopptak.
- Orienter skivene samtidig som du sikrer at det er nok plass mellom skivene ved hjelp av to par tang. Inkuber petriskålen i 5 min ved 37 °C ved hjelp av en varmeblokk for å tillate kollagen å stivne. Tenk på denne gangen som t = 0 av skivekultur.
- Flytt petriskålen tilbake til skivekulturinkubatoren i ytterligere 40 min. Deretter legger du til 2 ml av den forhåndswarmed SCM. Skiver holdes i kultur til ønsket tidspunkt.
- Ta skivene ut av skivekulturinkubatoren og aspirer SCM. Vask de kollagen-innebygde skiver med 1x PBS. Tilsett 4% (wt / vol) paraformaldehyd (i 120 mM fosfatbuffer, pH 7,4) og la vevet stå ved RT i 30 min. Deretter flytter du den til 4 °C for å tillate fiksering over natten.
- Aspirer paraformaldehydoppløsningen neste dag og utfør 1x PBS vasker. For å fjerne skivene fra kollagen, bruk to par tang til å forsiktig trekke ut skivene under et stereomikroskop.
- Bruk en mikrobølgeovn til å smelte 3% (wt / vol) lavt smeltepunkt agarose for behandling av mikroinjekte skiver. Hell smeltet agarose i en engangsinnbygging mold og la den avkjøles til rundt 38 - 39 ° C.
- Overfør vevsskiver fra trinn 5,7 til denne formen som inneholder lavsmelting agarose ved hjelp av en plast Pasteur pipette. Sørg for at pialsiden av skiven er opp og ventrikulær overflate vender ned. Om nødvendig orientere tilsvarende. La agarose kjøle seg ned til RT for å stivne.
- Trim den ekstra agarose rundt skiver. Orienter agaroseblokken for å sikre at kuttoverflaten er parallell med vibratomens skjæreblad. Bruk vibratom, kutt 50 μm tykke seksjoner.
- Fyll en 24 brønnrett med 1x PBS. Overfør seksjonene til denne parabolen ved hjelp av en finspiss pensel. Utfør immunofluorescence i henhold til standardprotokollene.
Mikroinjeksjon tjener formålet med å spore og manipulere enkelt nevrale stamceller og deres avkom i levende vev og å følge deres avstamningsprogresjon i et fysiologisk miljø. I denne artikkelen har vi demonstrert bruken av mikroinjeksjonsroboten for målretting og automatisk mikroinjiserende organotypiske skiver av museteleskopcephalon. Figur 2 illustrerer representative bilder av vellykket injiserte stamceller og figur 3 illustrerer injiserte nyfødte nevroner. Når de injiseres med Dextran Alexa-488 (eller Alexa-A555) fargestoff, vises cellene fullt ut fylt med fargestoffet. Som for apical stamfar (Figur 2) confocal imaging tillater rekonstruering med høy romlig oppløsning cellemorfologi, tilstedeværelse -eller fravær- av apical og basal vedlegg, og å kombinere morfologisk forespørsel med markør uttrykk. Ved å kombinere disse kriteriene, kan brukeren tildele en bestemt celle skjebne til mikroinjektede celler og deres avkom. Som for nevron injeksjon, brukeren kan rekonstruere neuronal morfologi, inkludert strukturen og funksjonene i apical dendritt og axon. Automatisert mikroinjeksjon kan gi betydelig høyere gjennomstrømning sammenlignet med manuell mikroinjeksjon (figur 2B). Videre bekrefter EdU-merking at celle levedyktighet ikke påvirkes av automatisering (figur 2C). Holde organotypisk skive i kultur tillater følgende avstamning progresjon av mikroinjektede celler (vi viste 4 - 24h i figur 2D). Hvis mikroinjeksjonsløsningen inneholder genetisk materiale (DNA, mRNA, CRISPR-Cas9 guider) eller rekombinante proteiner, gjør dette det mulig å studere om og hvordan avstamningsprogresjon påvirkes av manipulasjonen.
Mikroinjeksjon i enkelt nevrale stamceller i vev gir utmerket enkeltcelleoppløsning, og derfor har den blitt brukt til å dissekere cellebiologien til nevrale stamcelleprogresjon og skjebneovergang (figur 3A). Mikroinjeksjon tillater levering av kompleks blanding av kjemikalier. Vi har tidligere gjort bruk av denne funksjonen for å studere junctional kobling i nevrale stamceller ved å blande gap-junctional gjennomtrengelig med gap junctional ugjennomtrengelig fluorescerende fargestoffer12. Vi utvidet tidligere arbeid ved å studere junctional kobling i nyfødte nevroner, ved å injisere Lucifer Yellow sammen med Dextran-A555 (Figur 3B). Som vist i figur 3B,er en andel nyfødte pyramidenevroner koblet via gapkryss til nærliggende nevroner. Denne observasjonen er i samsvar med ideen om at umodne nevroner kommuniserer via gap-junction13,14. Videre viser målretting av nevroner at bruken av mikroinjeksjonsroboten kan generaliseres til flere celletyper i den utviklende pattedyrhjernen. Dette eksperimentelle oppsettet vil være nyttig for å dissekere cellebiologien til nevroner i vev, for eksempel ved å levere spesifikke oligopeptider for å forstyrre proteinproteininteraksjoner.
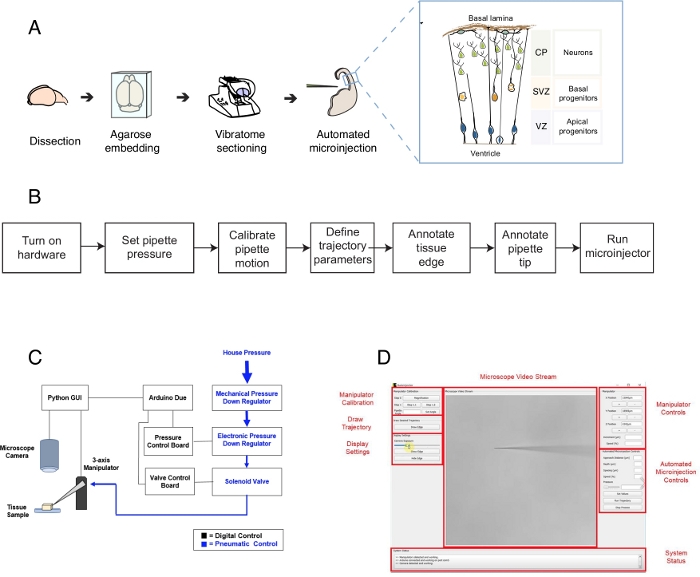
Figur 1: Automatisert oppsett og protokoll for mikroinjeksjon. (A)Total protokoll for vevsforberedelse og automatiserte mikroinjeksjoner ved hjelp av mikroinjeksjonsroboten. Rett innfall: Tegneserie skjematisk av mus Telencephalon målrettet for mikroinjeksjon i denne protokollen. (B) Flytskjema for de automatiserte mikroinjeksjonstrinnene. (C) Skjematisk av mikroinjeksjon robot maskinvare. (D) Grafisk brukergrensesnitt (GUI) av programvaren som brukes til å kontrollere og betjene mikroinjeksjonsroboten. Dette tallet er tilpasset fra ref.12. Vennligst klikk her for å se en større versjon av denne figuren.
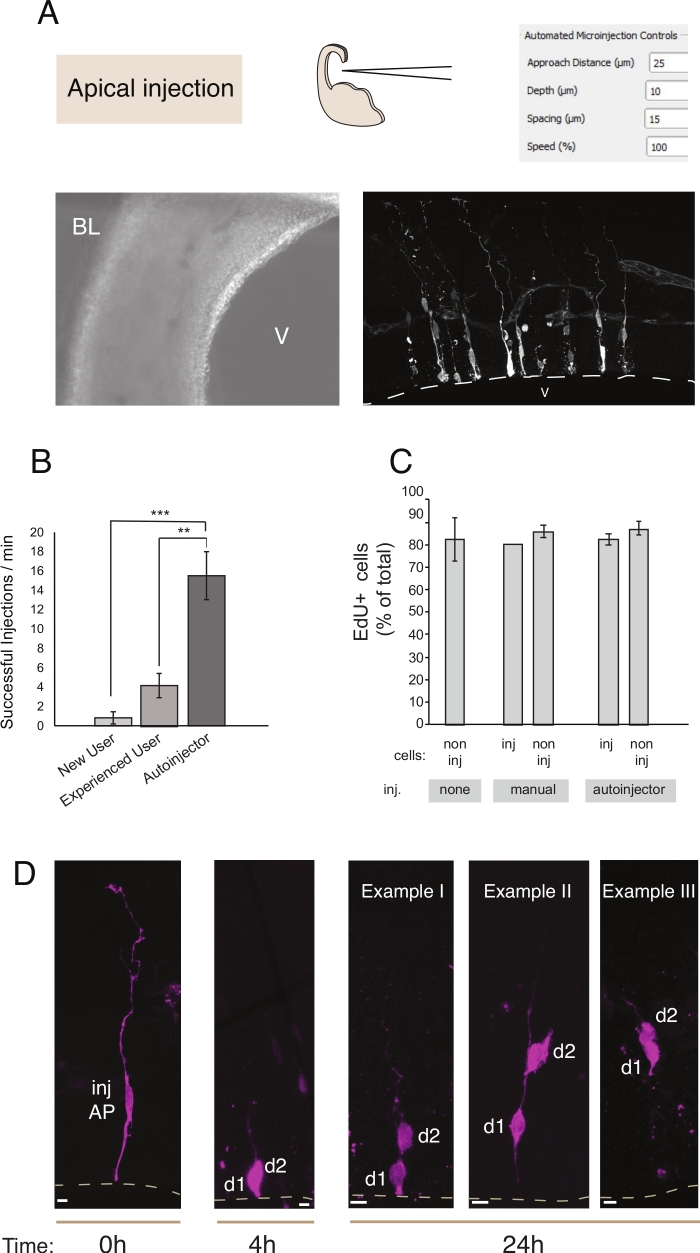
Figur 2: Robotmikroinjeksjon i a apiske forfedre. Skjematiske og forventede resultater ved bruk av mikroinjeksjonsroboten til å målrette a apiske stamfarer (AP- via den a apiske overflaten (aksuell injeksjon). (A) Øverste rad. Til venstre: skjematisk av prosessen. Til høyre: GUI med relevante parametere for apical injeksjon. Nederste rad. Til venstre: fasekontrastbilde tatt under injeksjonsprosedyren (V: ventrikkel; BL: basal lamina). Til høyre: representative resultater som viser mikroinjektede fastleger. Stiplet linje representerer ventrikkelen (V). Vektstangen: 10 μm. (B) Vellykkede injeksjoner per minutt for en nybegynner på det manuelle mikroinjeksjonssystemet, en erfaren bruker på det manuelle mikroinjeksjonssystemet og mikroinjeksjonsroboten. (C) EdU inkorporering i mikroinjektede celler og i ikke-injiserte celler i injisert område. Organotypiske stykker mus E14.5 dorsal telencephalon ble enten (i) ikke injisert eller (ii) utsatt for manuell eller automatisert mikroinjeksjon (injisert skive) ved hjelp av Dextran-A488 (for manuell og autoinjektor). Skiver ble holdt i kultur i nærvær av EdU i 24 timer, så ble de fikset og farget for DAPI og EdU. Injiserte og ikke-injiserte celler i det injiserte området ble scoret for EdU positivitet. (D)Bruk av mikroinjeksjonsroboten Lineage sporing. Et fluorescerende fargestoff (Dx3-A555, magenta) injiseres i en enkelt nevrale stamcelle (t = 0 timer). Den fluorescerende fargestoff er partisjonert til datterceller (d1, d2) under mitose. Dette gjør det mulig å følge avkom av den injiserte cellen (t = 4 t og 24 h) og avsløre avstamningsprogresjonen over tid. For t = 24 h, viser vi flere eksempler på avkom man forventer å finne. Vektstenger: 10 μm. Grafer i B og C er hentet fra ref.12 Vennligstklikk her for å se en større versjon av denne figuren.
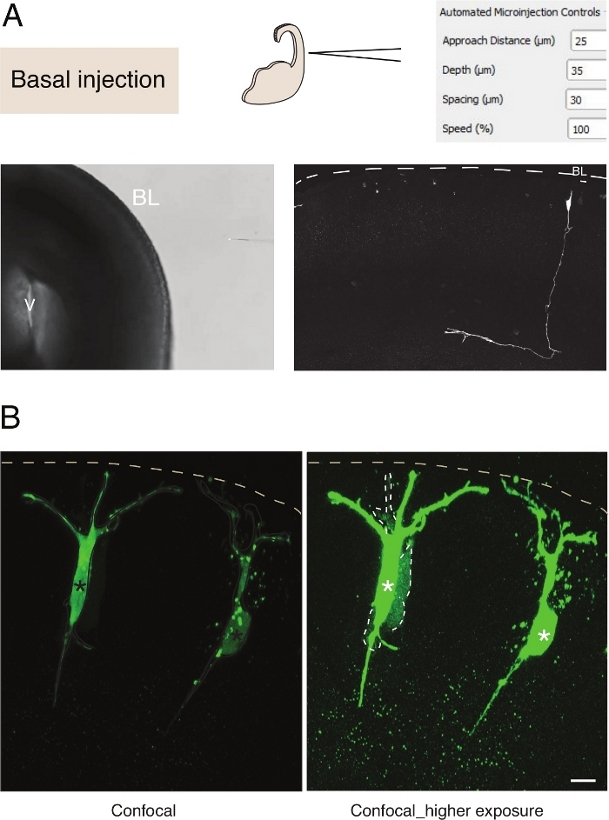
Figur 3: Robotmikroinjeksjon i nevroner. Skjematiske og forventede resultater ved bruk av mikroinjeksjonsroboten til å målrette pyramidale nevroner (N) via basaloverflaten (basal injeksjon). (A) Øverste rad. Til venstre: skjematisk av prosessen. Til høyre: GUI med relevante parametere for basal injeksjon. Nederste rad. Til venstre: fasekontrastbilde tatt under injeksjonsprosedyren (V: ventrikkel; BL: basal lamina). Til høyre: representative resultater som viser en mikroinjisert N. Stiplet linje representerer basal lamina (BL). Vektstangen: 10 μm. (B) Bruk av autoinjektoren til å studere gap junctional kommunikasjon i vev. Pyramidale nevroner ble injisert med en løsning som inneholder to fargestoffer: gapet junctional-impermeable Dx-A555 (ikke vist) og gap-junctional gjennomtrengelig Lucifer Yellow (grønn). Dx-A555 er begrenset til den målrettede cellen (stjerner), mens LY sprer seg til celler som er koblet via gapkrysset til den målrettede cellen (stiplede linjer). Venstre panel: Lav eksponering, bare de mikroinjeerte cellene er synlige. Høyre panel: Høy eksponering tillater visualisering av de injiserte cellene samt de sammenslåtte cellene (stiplede linjer). Skala bar: 10 μm. Vennligst klikk her for å se en større versjon av denne figuren.
Tilleggsfil: Feilsøking av flere vanlige feil som oppstår under mikroinjeksjon. Vennligst klikk her for å laste ned denne filen.
Mikroinjeksjon i enkelt nevrale stamceller i vev gir utmerket enkeltcelleoppløsning, og derfor har den blitt brukt til å dissekere cellebiologien til nevrale stamcelleprogresjon og skjebneovergang (figur 2; seogså 10,11,12). Den automatiserte mikroinjeksjonsprosedyren kan utføres på andre typer celler i både embryonale mus og menneskelig hjernevev. Representative resultater av mikroinjeksjon av nyfødte nevroner ved å målrette basaloverflaten av telencefalon er vist i figur 3.
Prinsippet som er etablert her kan brukes til å målrette flere forskjellige celletyper i embryonale musehjerner og menneskelige hjerner. Vi har tidligere vist at mikroinjeksjonsroboten også kan brukes til å målrette enkelt stamceller i musen hindbrain og telencephalon og nyfødte nevroner i musen og menneskelig utvikling neocortex12. For å oppnå de beste resultatene av injeksjonsprosedyren, bør man optimalisere alle trinnene før injeksjonen startes. Det er viktig å nøye vurdere og optimalisere utarbeidelsen av levedyktige og godt bevarte organotypiske vevskiver fra hjernevev (figur 1). Det er avgjørende å være rask i disseksjons- og kuttprosedyren illustrert i figur 1. For akical injeksjon rettet mot AP, bør man plukke skiver som viser den ideelle retningen av den a apical overflaten. For AP-injeksjon er den ideelle orienteringen den a apiske overflaten vinkelrett på bunnen av petriskålen. Enhver annen orientering vil være tillatt også, men den a apical overflaten vinkelrett på Petri parabolen gir et bredere overflateareal for injeksjon, og dermed øke suksessen til injeksjon. For injeksjon i nevroner spiller orienteringen av skiven liten eller ingen effekt.
Når skivene som skal injiseres er valgt, tar injeksjonsprosedyren per skive ca. 5 minutter. Tatt i tanke på at man arbeider med levende vev, anbefales det sterkt å fremskynde injeksjonsprosedyren. For dette formål anbefaler vi å sette alle parametrene for injeksjon via GUI (Figur 1D) før vevet er klart, for å redusere unødvendig ventetid. For feilsøking, se tilleggsfilen.
Ved langsiktig skivekultur kan trinn etter den automatiserte mikroinjeksjonsprosedyren påvirke cellenes helse og dermed eksperimentet. Derfor anbefales det sterkt å kjøre en kvalitetskontrolltest og optimalisere skivekulturforholdene. For å evaluere celle levedyktighet etter kutting og injeksjon prosedyre, utførte vi EdU merking under kulturen, og vi kvantifisert antall pyknotiske kjerner (en proxy for apoptotiske celler) i kulturer og injisertvev 12. Disse kvantifiseringene viste ingen signifikant innvirkning av mikroinjeksjon på vevs levedyktighet (figur 2C). Vi anbefaler at du kjører lignende kvalitetskontroll samtidig som organotypisk vev kuttes og mikroinjeksjonsrørledningen i laboratoriet.
Sammenlignet med manuell mikroinjeksjon gir mikroinjeksjonsroboten flere fordeler. For det første er læringskurven for brukeren mindre bratt sammenlignet med manuell injeksjon: en ny bruker vil nå en høy ferdighet etter et begrenset antall økter, vanligvis 1 eller 2. For det andre, i tilfelle av manuell mikroinjeksjon, krever en sammenlignbar ferdighet måneder med trening. Injeksjonsprosedyren er raskere og mer effektiv (figur 2B). Vi kvantifiserte disse parametrene og fant at mikroinjeksjonsroboten overgikk en dyktig manuell bruker med hensyn til injeksjonssuksessen (% av vellykket injeksjon / totalt antall injeksjoner) og i det totale antall injeksjoner per enhetstid12. Dette resulterer i en samlet 300% økning av injeksjon effektivitet (% av vellykket injeksjon / min) for mikroinjeksjon robot sammenlignet med en dyktig bruker. Økningen i effektivitet var enda mer uttalt når man sammenligner mikroinjeksjonsroboten med en nybegynner og nådde 700%. Sist men ikke minst kan mikroinjeksjonsroboten enkelt programmeres til systematisk å utforske alle romlige parametere. Dette er spesielt en fordel når du tilpasser mikroinjeksjonsroboten for å målrette mot nye celler eller vev, eller når du bruker mikroinjeksjonsroboten til formål som krever forskjellig romlig oppløsning.
Bygging av mikroinjeksjonsroboten krever minimale endringer i et eksisterende epifluorescensmikroskop12. Vi har tidligere gitt instruksjoner for denne tilpasningen på https://github.com/bsbrl/Autoinjector. Når maskinvaren er konfigurert, gir denne protokollen viktige metodiske detaljer for vellykket gjennomføring av automatiserte mikroinjeksjoner. Samlet sett har mikroinjeksjonsroboten en vellykket injeksjonshastighet på 15,52 + 2,48 injeksjoner/min, som er 15 ganger større enn en uerfaren bruker (1,09 ± 0,67 injeksjoner/min), og 3x større enn en ekspertbruker (4,95 ± 1,05 injeksjoner/min)12. Denne forbedringen i vellykket injeksjon rate gir både nybegynnere og ekspertbrukere til å injisere flere celler i en kortere tid som er viktig for å bevare vev levedyktighet. I tillegg er mikroinjeksjonsroboten passelig og banen, dybden av injeksjonen, antall injeksjoner, avstand mellom injeksjoner kan alle justeres ved hjelp av GUI. Disse funksjonene gjør at mikroinjeksjonsroboten kan brukes som et verktøy for å optimalisere tidligere arbeidskrevende eksperimenter, og å utforske fundamentalt nye eksperimenter som krever høyere utbytte enn tidligere mulig.
De viktigste begrensningene i mikroinjeksjonsprosedyren vi beskrev her, er relatert til fremstilling av vevskiver, et avgjørende skritt som trenger omfattende optimalisering. I tillegg er mikroinjeksjon avhengig av tilstedeværelsen av en overflate som kan nærmet seg av glasspipetten. Denne funksjonen begrenser typen vev og vev steder som kan målrettes via mikroinjeksjon ved hjelp av dagens oppsett.
Mikroinjeksjonsroboten bruker for tiden brightfield imaging og har blitt brukt i in vitro hjerneskivepreparater. I fremtiden kan mikroinjeksjonsroboten kombineres med 2-fotonavbildning for å øke spesifisiteten til enkeltcellemålretting in vivo for molekylær eller fargestoffmerking. Slike tiltak er allerede gjort for encellet elektrofysiologi15,16. Den nåværende enheten krever manuell observasjon av mikroinjeksjonsprosedyren. Fremtidige versjoner kan omfatte strategier for rengjøring av tette mikroinjeksjonspipetter17 eller integrering av væskehåndteringsroboter18 for multipleksede, helt autonome mikroinjeksjoner. Disse enhetene kan øke omfanget av mikroinjeksjon etter størrelsesordener. Tilpasning av algoritmer for parallell kontroll av flere mikroinjeksjonspipetter19 kan muliggjøre multipleksede levering av dusinvis av fargestoffer og molekylære reagenser i de samme cellene i de samme eksperimentene. Dette har potensial til å åpne nye veier for molekylær screening i vev.
Mikroinjeksjonsroboten kan brukes til å tagge funksjonelt identifiserte celler ved hjelp av DNA- eller RNA-strekkoder. Dette kan igjen kombineres med andre enkeltcelleanalyseteknikker, for eksempel encellede RNA-sekvensering (scRNAseq) og elektronmikroskopi. Våre foreløpige resultater viser at mikroinjiserte celler og deres avkom kan gjenopprettes og isoleres ved hjelp av vevdissosiasjon etterfulgt av FACS sortering (Taverna, upubliserte resultater). De vanlige sorteringscellene kan deretter brukes til scRNAseq. Videre viser foreløpige resultater at enkeltcelleoppløsningsfunksjonene til mikroinjeksjonsroboten kan brukes i kombinasjon med elektronmikroskopisk analyse for å utforske cellebiologien på nevrale stamceller i vev ved høy romlig oppløsning (Taverna og Wilsch-Bräuninger, upubliserte resultater). Disse dataene tyder på at mikroinjeksjonsroboten kan brukes som et verktøy for korrelativ lys og elektronmikroskopi i vev og i bredere forstand, for multimodal analyse av celleidentitet og atferd i vev.
Mikroinjeksjon er avhengig av bruk av trykk, og man har råd til å injisere løsninger med høy molekylær kompleksitet (f.eks. en hel transkripsjon). Denne funksjonen av mikroinjeksjon har blitt utnyttet i det siste for å isolere og kloning ligand-gatedreseptorer 20. Langs denne linjen kan mikroinjeksjonsroboten brukes til modellering og studier av multigene egenskaper på cellenivå. Kombinert med en underpooling strategi, mikroinjeksjon roboten kan også brukes som en plattform for å identifisere minimum sett av gener som driver en viss egenskap / cellulær atferd. Så langt har mikroinjeksjonsroboten blitt brukt til å manipulere cellens biokjemi via levering av mRNA, DNA eller rekombinante proteiner10,21,22. Vi forutser en anvendelse av mikroinjeksjonsroboten i å sondere biofysikken til det intracellulære rommet, for eksempel ved å levere nanomaterialer eller nanomaskiner som tillater sensing og / eller manipulering av de biofysiske egenskapene til det intracellulære rommet.
Forfatterne har ingenting å avsløre.
Forfatterne ønsker å anerkjenne Nomis Foundation (ET). SBK anerkjenner midler fra maskinteknikkavdelingen, College of Science and Engineering, MnDRIVE RSAM initiativ fra University of Minnesota, Minnesota avdeling for høyere utdanning, National Institutes of Health (NIH) 1R21NS103098-01, 1R01NS111028, 1R34NS111654, 1R21NS112886 og 1R21 NS111196. GS ble støttet av National Science Foundation Graduate Research Fellowship og NSF IGERT opplæring stipend.
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Agarose, Low Melt | Carl Roth | Cat# 6351.2 | |
| Agarose, Wild Range | Sigma-Aldrich | Cat# A2790 | |
| Best-CA 221 Glue | Best Klebstoffe GmbH & Co.KG | Cat# CA221-10ml | |
| B-27 Supplement | Thermo Fisher Scientific | Cat# 17504044 | |
| Cellmatrix Type-IA (Collagen, Type !) | FUJIFILM Wako Chemicals | Cat# 637-00653 | |
| Distilled Water | |||
| DMEM-F12, CO2 independent (w/o Phenol red) | Sigma-Aldrich | Cat# D2906 | |
| DMEM-F12, CO2 independent (with Phenol red) | Sigma-Aldrich | Cat# D8900 | |
| HEPES-NAOH, pH 7.2, 1M (HEPES buffer) | Carl Roth | Cat# 9105.3 | |
| L-Glutamine, 200 mM | Thermo Fisher Sientific | Cat# 25030024 | |
| Mowiol 4-88 | Sigma-Aldrich | Cat# 81381 | |
| N-2 Supplement | Thermo Fisher Scientific | Cat# 17502048 | |
| Neurobasal Medium | Thermo Fisher Scientific | Cat# 21103049 | |
| Nuclease-free water | Thermo Fisher Scientific | Cat# AM9937 | |
| O2 (40%), CO2 (5%), N2 (55%) Mix, 50 liters | |||
| Paraformaldehyde | Merck | Cat# 818715 | |
| PBS | |||
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | Cat# 15140122 | |
| Rat serum | Charles River Laboratories | ||
| Japan | |||
| Sodium bicarbonate (NaHCO3) | Merck | Cat# 106323 | |
| Sodium hydroxide (NaOH) | Merck | Cat# 106482 | |
| Tyrode’s salt | Sigma | Cat# T2145-10x1L) | |
| Equipment | |||
| Borosilicate glass capillaries, 1.2 mm outer diameter x 0.94 mm inner diameter | Sutter Instruments | Cat# BF-120-94-10 | |
| Bottle-top filter system, 500 mL | Corning | Cat# 430769 | |
| Computer PC | |||
| Custom pressure rig | Custom pressure rig | ||
| Electronic pressure regulator | Parker Hannifin | Cat# 990-005101-002 | |
| Falcon tubes, 15 mL | Corning | Cat# 430791 | |
| Falcon tubes, 50 mL | Corning | Cat# 430829 | |
| Fine-tip paintbrush | |||
| Flaming/ Brown micropipette puller | Sutter Instruments | Cat# P-97 | |
| Forceps, Dumont no. 3 | Fine Science Tools | Cat# 11231-30 | |
| Forceps, Dumont no. 5 | Fine Science Tools | Cat# 11255-20 | |
| Forceps, Dumont no. 55 | Fine Science Tools | Cat# 11252-20 | |
| Heating block | Labtech International | Cat # Dri block Digi2 | |
| Inverted fluorescence microscope | Zeiss | Cat# Axiovert 200 | |
| Light source | Olympus | Cat# Highlight 3100 | |
| Manual pressure regulator | McMaster Carr | Cat# 0-60 PSI 41795K3 | |
| Microloader Tips | Eppendorf | Cat# 5242956.003 | |
| Microcontroller | Arduino | Cat# Arduino Due | |
| Microscope camera Hamamatsu Orca Flash 4.0 V3 | |||
| Motorized stage XY for microscope | |||
| Multiwell plate, 24 wells | Nunc | Cat# 142475 | |
| Pasteur pipettes, plastic | |||
| Petri dish, 60 x 15 mm | Greiner | Cat# 628102 | |
| Petri dish, 35 x 10 mm | Nunc | Cat# 153066 | |
| Petri dish, 34 x 14 mm, including Microwell no. 1.5 cover glass | MatTek | Cat# P35G-1.5-14-C | |
| Pipette holder | Warner Instruments | Cat# 64-2354 MP-s12u | |
| Pipette and tips | |||
| Puller filament, 3.0-mm square box filament | Sutter Instrument | Cat# FB330B | |
| Slice culture incubation box | MPI-CBG | Cat# custom made | |
| Solenoid valve | Cat# LHDA053321H-A | ||
| Stereomicroscope | Olympus | Cat# SZX12 | |
| Tabletop centrifuge | Heraeus | Cat# 5431622 | |
| Thermometer | |||
| Three-axis Manipulator | Sensapex Inc | Cat# tree-axis uMP | |
| Vibratome | Leica | Cat# VT1000s | |
| Whole-embryo-culture-system incubator | Ikemoto Company | Cat# RKI-10-0310 | |
| Waterbath | |||
| Software and Algorithms | |||
| Arduino | Arduino | ||
| Fiji | RRID: SCR_002285 | ||
| Python | Python Software foundation | Python 2.7.12 | |
| ZEN | RRID: SCR_013672 |
- Taverna, E., Götz, M., Huttner, W. B. The Cell Biology of Neurogenesis: Toward an Understanding of the Development and Evolution of the Neocortex. Annual Review of Cell and Developmental Biology. 30 (1), 465-502 (2014).
- Götz, M., Huttner, W. B. The cell biology of neurogenesis. Nature Reviews Molecular Cell Biology. 6 (10), 777-788 (2005).
- Di Lullo, E., Kriegstein, A. R. The use of brain organoids to investigate neural development and disease. Nature Reviews Neuroscience. 18 (10), 573-584 (2017).
- Lancaster, M. A., Knoblich, J. A. Organogenesisin a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Kretzschmar, K., Clevers, H. Organoids: Modeling Development and the Stem Cell Niche in a Dish. Developmental Cell. 38 (6), 590-600 (2016).
- Pepperkok, R. et al. Automatic microinjection system facilitates detection of growth inhibitory mRNA. Proceedings of the National Academy of Sciences of the United States of America. 85 (18), 6748-6752 (1988).
- Pepperkok, R., Lowe, M., Burke, B., Kreis, T. E. Three distinct steps in transport of vesicular stomatitis virus glycoprotein from the ER to the cell surface in vivo with differential sensitivities to GTPγS. Journal of Cell Science. 111 (13), 1877-1888 (1998).
- Pepperkok, R. et al. β-COP is essential for biosynthetic membrane transport from the endoplasmic reticulum to the Golgi complex in vivo. Cell. 74 (1), 71-82 (1993).
- Ansorge, W., Pepperkok, R. Performance of an automated system for capillary microinjection into living cells. Journal of Biochemical and Biophysical Methods. 16 (4), 283-292 (1988).
- Taverna, E., Haffner, C., Pepperkok, R., Huttner, W. B. A new approach to manipulate the fate of single neural stem cells in tissue. Nature Neuroscience. 15 (2), 329-337 (2012).
- Wong, F. K., Haffner, C., Huttner, W. B., Taverna, E. Microinjection of membrane-impermeable molecules into single neural stem cells in brain tissue. Nature Protocols. 9 (5), 1170-1182 (2014).
- Shull, G., Haffner, C., Huttner, W. B., Kodandaramaiah, S. B., Taverna, E. Robotic platform for microinjection into single cells in brain tissue. EMBO Reports. 20 (10), e47880 (2019).
- Jabeen, S., Thirumalai, V. The interplay between electrical and chemical synaptogenesis. Journal of Neurophysiology. 120 (4), 1914-1922 (2018).
- Nagy, J. I., Pereda, A. E., Rash, J. E. Electrical synapses in mammalian CNS: Past eras, present focus and future directions. Biochimica et Biophysica Acta - Biomembranes. 1860 (1), 102-123 (2018).
- Suk, H.J. et al. Closed-loop real-time imaging enables fully automated cell-targeted patch-clamp neural recording in vivo. Neuron. 95 (5), 1037-1047 (2017).
- Annecchino, L. A. et al. Robotic automation of in vivo two-photon targeted whole-cell patch-clamp electrophysiology. Neuron. 95 (5), 1048-1055 (2017).
- Kolb, I. et al. Cleaning patch-clamp pipettes for immediate reuse. Scientific Reports. 6, 35001 (2016).
- Holst, G. L. et al. Autonomous patch-clamp robot for functional characterization of neurons in vivo: development and application to mouse visual cortex. Journal of Neurophysiology. 121 (6), 2341-2357 (2019).
- Kodandaramaiah, S. B. et al. Multi-neuron intracellular recording 1 in vivo via interacting autopatching 2 robots. ELife. 7, 24656 (2018).
- Lubbert, H. et al. cDNA cloning of a serotonin 5-HT1c receptor by electrophysiological assays of mRNA-injected Xenopus oocytes (RNA fractionation/hybrid depletion/hybrid selection/choroid plexus/voltage clamp). Neurobiology. 84 (2) 4332-4336 (1987).
- Florio, M. et al. Human-specific gene ARHGAP11B promotes basal progenitor amplification and neocortex expansion. Science. 347 (6229), 1465-1470 (2015).
- Kalebic, N. et al. CRISPR/Cas9-induced disruption of gene expression in mouse embryonic brain and single neural stem cells in vivo. EMBO Reports. 17 (3), 338-348 (2016).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved