Method Article
小型猪载体上 RPE 的视网膜下植入:术前准备、手术技术和术后护理指南
* 这些作者具有相同的贡献
摘要
视网膜下植入视网膜色素上皮(RPE)是治疗退行性视网膜疾病的最有希望的方法之一。然而,对大眼动物模型进行临床前研究仍然具有挑战性。本报告介绍了将细胞载体上的RPE移植到小型猪的视网膜下指南。
摘要
视网膜退行性疾病(包括年龄相关性黄斑变性)主要起源于视网膜色素上皮(RPE)层或内部,导致视网膜解剖结构进行性紊乱和视觉功能恶化。使用视网膜下细胞载体用体外培养的RPE细胞替换受损的RPE细胞(RPE)已显示出重建视网膜 外 层解剖结构的潜力,因此正在进一步研究。在这里,我们提出了一种手术技术的原理,该技术允许将具有培养RPE的细胞载体有效地移植到小型猪的视网膜下。手术在全身麻醉下进行,包括标准晶状体保留三端口扁平部玻璃体切除术(PPV),视网膜下应用平衡盐溶液(BSS),2.7毫米视网膜切开术,通过额外的3.0毫米硬化切开术将纳米纤维细胞载体植入视网膜下间隙,流体 - 空气交换(FAX),硅油填塞和闭合所有菌核切除术。在过去的8年中,这种手术方法被用于29次手术(18只动物),成功率为93.1%。使用 体内 眼底成像(眼底摄影和光学相干断层扫描)对手术位置进行解剖学验证。在迷你猪眼睛的载体上植入视网膜下RPE的推荐手术步骤可用于未来使用大眼动物模型的临床前研究。
引言
年龄相关性黄斑变性(AMD)被认为是发达国家中心视力丧失的主要原因,也是与视网膜色素上皮(RPE)功能障碍相关的许多疾病之一1,2。RPE位于基底的布鲁赫膜(BM)上,为光感受器提供必要的维护。RPE层的进行性变性是AMD早期萎缩形式的标志,它也伴随着AMD晚期渗出形式的发展。尽管视网膜疾病治疗取得了许多进展,但开发有效的治疗方式仍然具有挑战性3。其中一种有前途的方法是使用体外培养的RPE层进行RPE替代。这种治疗与使用人类胚胎干细胞衍生RPE(hESC-RPE)和诱导多能干细胞衍生RPE(iPSC-RPE)的干细胞研究进展有关3,4,5,6,7。近年来,许多研究小组专注于开发不同的RPE替代方法,使用最初接受的概念验证8,9,10,11,12,13,14,15。RPE细胞(RPE)通常以细胞悬浮液,自支撑细胞片或由人工载体支撑的细胞单层的形式输送到视网膜下空间3,16,17,18,19,20,21。注射细胞悬液是最简单的方法,但BM的受损状况通常会阻止移植细胞的附着。这可能导致RPE的顶基底方向不正确,并且无法形成单层22,23。另外两种方法(即,自支撑细胞片和由人造基质支撑的细胞单层)的主要优点是,当细胞直接植入视网膜下空间24时,细胞已经处于分化的单层状态。
近年来已经发表了许多描述细胞载体输送到视网膜下空间的手术技术8,9,10,11,12,13,14,15。这些研究描述了大眼动物模型的使用,细胞载体的类型,移植细胞培养物的使用,植入器械以及手术技术,作者主要关注视网膜下植入的结果。2015年,Popelka等人报道了使用框架支撑的超薄静电纺聚合物膜将RPE移植到猪尸体眼睛中8。这里描述的细胞载体的视网膜下植入手术技术允许相对精确地处理载体,并且支架易于定位在视网膜下空间。Kozak等人评估了猪眼中尺寸约为2 mm x 5 mm的载体的递送技术的可行性9。细胞载体的独特设计允许其正确放置,防止细胞单层折叠和起皱6。Al-Nawaiseh等人首先提出了兔子视网膜下支架植入的详细分步指南25。Stanzel 等人随后在 2019 年发表了类似的方案,用于小型啮齿动物、兔子、猪和非人灵长类动物的移植26.如前所述,与其他递送技术相比,在固体载体上移植分化和极化的RPE单层可提高移植物的存活率和更好的整合(补充文件1)27。
在体内进行的任何临床前动物研究的目的是揭示手术经玻璃体视网膜下植入细胞载体的各个方面,重点是手术安全性、移植细胞的存活、组织对视网膜下操作的反应以及短期和长期术后结果。据报道,使用猪眼睛作为大眼动物模型在所获得的数据范围方面是相关的,这可能是有用的,并且可能适用于人类10,11,14。我们的研究报告了用于大眼动物模型中细胞载体体内视网膜下植入的手术技术。我们根据过去8年的经验,详细介绍了术前准备,视网膜下细胞载体植入的手术技术以及迷你猪眼睛的术后护理。我们描述了可用于体内实验研究的基本手术原理,涉及植入不同类型的细胞和细胞载体。
大型动物模型
Liběchov迷你猪的实验群是由1967年从美国进口荷美尔菌株的五只动物而建立的。这些动物与其他几个品种或品系杂交用于猪血型研究:地方品种、大白猪、康沃尔猪、越南猪和哥廷根起源的微型猪28,29。在 5 个月大和大约 20 公斤体重 (BW) 时,迷你猪达到性成熟。据报道,亲本迷你猪品种(荷美尔和哥廷根)的存活期为12-20年。细胞载体的视网膜下植入针对视网膜的中央部分。迷你猪的视网膜缺乏黄斑和中央凹。然而,它具有高度浓缩的锥形光感受器区域,称为中央区域和视觉条纹30,31。这些区域负责最高的视力。
手术由四名经验丰富的玻璃体视网膜外科医生在经验丰富的外科设施助理(TA)的协助下进行。在 体内 实验之前,外科医生接受了教育并获得迷你猪眼解剖学的专业知识,例如晶状体与玻璃体体积的比例较低,轴向长度较短(15-19毫米),角膜中没有Bowman膜,玻璃体体积较小(2.8-3.2mL),黄斑和中央凹缺失, 没有Zinn环,以及视盘直径(垂直/水平:1.5毫米/ 2.1毫米)。在所有情况下,手术都是在专门组织的手术室中进行全身麻醉的,并实施标准的无菌和防腐措施。
研究方案
这项研究遵循《赫尔辛基宣言》准则的原则和涉及人类受试者的医学研究的伦理原则。所有实验均根据《实验动物护理和使用指南》和视觉和眼科研究协会(ARVO)进行,用于眼科和视觉研究。该研究方案已获得捷克科学院动物生理学和遗传学研究所(捷克共和国利贝霍夫)动物实验项目批准中科院度假村专业委员会批准(批准方案编号60/2016和No.64/2019)。
1.将载体上的细胞移植到小型猪的视网膜下过程中的注意事项
- 动物选择
- 获取和使用 12-36 个月大的 Liběchov 迷你猪,无论性别如何,体重约为 40-80 公斤 (BW)。
- 将迷你猪饲养在室内的空调动物房中,温度在18-22°C之间,暴露于人工13小时/ 11小时光照/黑暗循环,标准化的个人围栏,免费饮水,每天喂食两次。
- 手术前的准备
- 检查眼睛的手术方向并绘制眼底方案。为此,使用垂直线的笔将眼底图上的迷你猪的视网膜示意图划分为颞部(从视盘朝向耳朵)、鼻部(从视盘朝向猪的鼻子)和中央(在鼻侧的主要视网膜血管之间)区域(图 1A,B)。
- 仅选择没有任何行为和神经病理学的健康动物,并且皮肤,体孔,粪便和食物消耗质量正常。让熟练的兽医进行临床观察并选择动物。
- 手术当天肌内注射3毫克/千克盐酸头孢噻呋(1毫升/千克)。
- 术前免疫抑制
- 制备他克莫司洗脱聚合物微球,如Wang等人和Sevc等人 32,33 中所述的修饰。
- 确保聚合物微球中他克莫司的浓度为51.3mg / g,由HPLC(材料表)确定。
- 在眼科手术前 6 天以 0.25 mg/kg BW 的剂量皮下注射装载他克莫司的聚合物微球,以阻止细胞移植排斥反应。这样做是为了确保人类RPE供体细胞在异源移植到迷你猪眼睛期间的存活。
- 根据体重,在手术当天肌肉注射80mg甲羟孕酮和苄基青霉素,浓度为1mL / 10kg。
- 麻醉
- 在手术前,肌肉注射替他明(2mg / kg),唑拉西泮(2mg / kg),氯胺酮(2mg / kg)和甲苯噻嗪(0.4mg / kg)-TKX34,35 的混合物诱导全身麻醉。通过无意识状态和检查踏板反射(捏后腿的指间皮肤)、角膜反射(角膜的轻微触摸)、瞳孔反射(对光的反应)和睑反射(触摸眼睑)来检查麻醉深度。确保动物不眨眼。确认心脏和呼吸频率规律。
- 诱导麻醉后,用升降推车将镇静动物运送到手术室(图2A)。
- 将动物放在左侧的手术台上,以便在右眼上进行手术(图2B)。
- 使用聚苯乙烯泡沫塑料垫调整动物的头部,以实现中央视网膜最适合植入的位置(即水平和平行于地板)(图2C)。
- 将0.5%盐酸丙帕卡因眼药水滴眼液放入结膜囊中三次,间隔1分钟诱导局部麻醉。
- 插入静脉套管并用气管插管动物,使用配备患者监护仪的麻醉机(1.5%异氟醚)吸入维持麻醉(1.5%异氟醚)(图2A,B)。
- 在眼科手术开始前约15分钟肌内注射每16公斤体重1毫升Eficur和20毫克甲羟孕酮1(材料表)。
- 通过用等温箔覆盖动物来维持生理体温,并按照第 3 节所述进行手术。
- 在手术过程中,使用耳夹和患者监护仪监测动物的温度以及心率和血氧饱和度。在手术过程中避免将体温降低到38°C以下,这被认为是安全限值36。在整个实验过程中保持氧饱和度(>96%)和脉搏率(每分钟70-90次)。
- 手术完成后,关闭异氟醚的流动并拔管动物。
- 自主呼吸和醒来后,将动物转移到它们的围栏。
- 手术室设置
- 根据大眼动物模型眼睛手术的需要安排手术室(图3A,B)。调整外科医生椅子的高度以及显微镜的高度,以使外科医生相对于猪鼻子的位置保持舒适的位置。
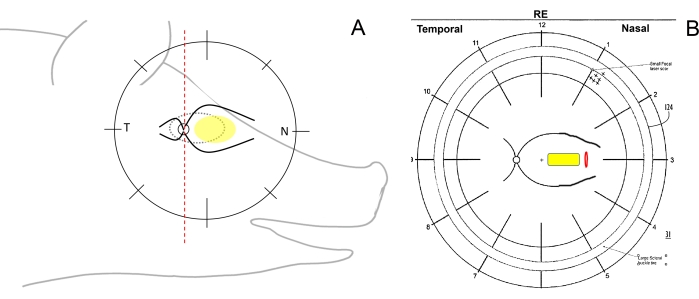
图1:迷你猪视网膜区域的示意图。 (A)相对于迷你猪头部的视网膜区域的示意图;黄色椭圆表示视网膜下植入的所需区域,T表示颞视网膜区域,N表示鼻视网膜区域。(B)通过视网膜切开术(红色)植入细胞载体(黄色)后的眼底方案示例。 请点击此处查看此图的大图。
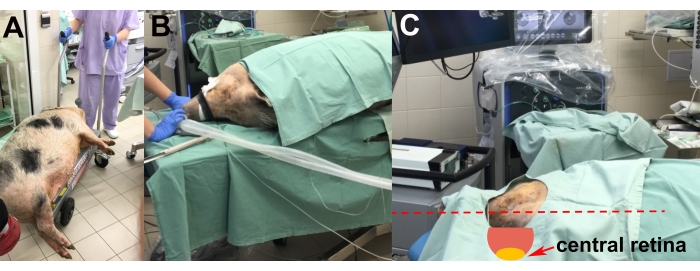
图2:动物的运输和放置 。 (A)将镇静动物运送到手术室。(B)插管期间动物的放置。(C)调整动物头部,以便在手术过程中最佳地进入中央视网膜(红色箭头)。 请点击此处查看此图的大图。
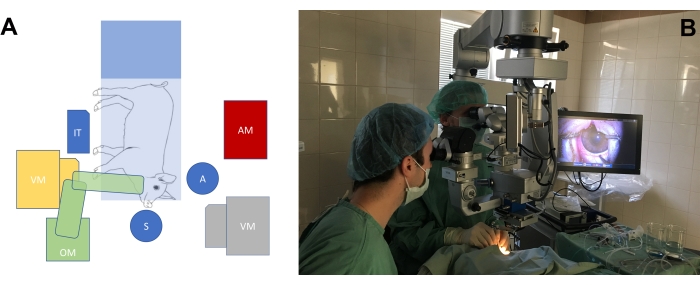
图 3:标准手术室设置。 (A)外科医生的位置(S =外科医生,A =助手)相对于手术台的位置的示意图,包括迷你猪,手术显微镜(OM),玻璃体切除机(VM),器械台(IT)和麻醉机(AM)。玻璃体切除机有两个可能的位置(黄色和灰色)。(B)手术室的真实环境。 请点击此处查看此图的大图。
2. 细胞载体、培养细胞培养物和植入注射器
- 细胞载体
- 使用飞秒激光器从双向定向的 36 μm 厚的聚对苯二甲酸乙二醇酯 (PET) 箔上切割外部尺寸为 1.7 mm x 4.8 mm 的 30 μm 宽椭圆形框架,配备不对称位于框架上的三角形突起(图 4A)。
- 在吡啶中制备浓度为 11 wt% 的聚(L-丙交酯-co-DL-丙交酯)(LLA/DLLA 90/10,MW 868,270 g/mol)聚合物溶液,每 1 g 溶液加入 2.2 μL 甲酸。
- 通过聚合物溶液的静电纺丝在三个步骤8中制备具有嵌入式支撑框架的纳米纤维膜(图4B):(1)将第一层纳米纤维沉积在硅衬底上,(2)将框架放在该层上,以及(3)沉积第二层纳米纤维。
注意:每层沉积7分钟,以达到3.7μm的总膜厚度。使用以下参数获得由380 nm粗纤维组成,平均孔径为0.4 μm,孔隙率约为70%37的膜:20 G全钢针,电压为7.1 kV,间隙为10 cm,流速为250 μL/min,温度为25.0°C±0.5°C。 - 小心地从硅衬底上取下带有嵌入框架的膜,并将其固定在没有原始膜的商业 12 孔细胞培养插入物的主体上,以促进细胞的接种和生长。
- 在等离子清洁器中以70W的功率将细胞接种在空气等离子体中30秒之前处理纳米纤维膜。
- 用于在细胞载体上培养的细胞培养物
注意:可以使用以下细胞载体:1)没有任何细胞的纳米纤维细胞载体;2)具有原代人RPEs(hRPEs)的纳米纤维细胞载体;3)具有人iPSC衍生RPE细胞的纳米纤维细胞载体。- 培养初级 hRPE
- 根据先前报道的技术从人类供体眼睛中分离原代hRPE细胞38。
- 通过酶法处理视网膜30分钟来获得细胞。然后,在补充有 10% 胎牛血清 (FBS) 的 DMEM/F12 中培养原代 hRPE 细胞(第 0 代)长达 2 周。
- 一旦细胞培养物达到汇合,将培养基更换为1%FBS并再培养30天。
- 将初级hRPE接种到反式孔板和层粘连蛋白包被的纳米纤维细胞载体上,密度为2,000个细胞/ mm2。在1%FBS中再孵育30天后,使用具有原代hRPE的细胞载体将视网膜下植入迷你猪体内。
- 人 iPSC 衍生的 RPE
- 使用源自 MERTK 相关视网膜色素变性患者来源的成纤维细胞39 ,这些成纤维细胞使用 CRISPR/Cas9 系统 (RP1-FiPS4F1-GC2)40 在两个等位基因中进行基因校正,以及源自健康受试者成纤维细胞 (Ctrl2-FiPS5F2)41 的 hiPSC,用作对照。
- 生成并随后将两种hiPSCs细胞系分化为RPE细胞(hiPSC-RPE),如前所述42。
- 将 hiPSC-RPE 以 200,000 个细胞/cm2 接种在层粘连蛋白包被的细胞培养插入物上,该插入物具有聚(L-丙交酯-co-DL-丙交酯)纳米纤维膜,椭圆形植入框架,在含有敲除 DMEM、20% 敲除血清、0.1 mM 非必需氨基酸、0.23 mM β-巯基乙醇、100 U/mL 青霉素、0.1 mg/mL 链霉素和 10 mM 烟酰胺的 RPE 培养基中。
- 每隔一天更换培养基,并在植入前培养hiPSC-RPE2个月以促进极化生长。
- 植入注射器
- 通过吹塑成型,从外径 1.75 mm/ID 1.10 mm 的塑料管中吹塑制备矩形横截面为 2.8 mm x 0.8 mm 的塑料毛细管。
- 在距离末端 6 毫米的塑料毛细管中切割一个 4 毫米 x 2.2 毫米的加载窗口。
- 用塑料毛细管、硅胶手柄、钢刀片柱塞和活塞组装注射器(图 5A)。
- 如步骤3.5.2(图5B)所述,通过加载窗口将载体装入注射器,然后通过推动柱塞将其弹出到视网膜下空间。
- 纳米纤维载体的制备和注射器的加载
- 用 2 mL 磷酸盐缓冲盐水 (PBS) 填充一个小塑料培养皿。取出带有准备好的细胞层的插入物,将其放在半软的聚苯乙烯培养皿上,并在光学显微镜下居中。使用定制修改的冲头,使用显微镜沿椭圆形框架切出载体。托架尺寸应为 2 毫米 x 5 毫米。
- 使用带有扁平透明管的定制喷油器装载载体;距离毛细管远端6毫米,有一个用于装载载体的窗口。用PBS填充注射器的窗口。
- 使用镊子,从培养皿底部释放样品,将其从液体中提起,然后将其运送到注射器的窗口,同时首先检查框架上的侧面方向标记,以便检测载体的顶部贴壁细胞。椭圆形框架便于使用载体进行操作。
- 使用牙科探头(具有尖头的不锈钢牙科器械),将载体放置在注射器的窗口中。使用柱塞将托架推入注射器的封闭且安全的上部。然后,准备携带者进行手术。
- 在每一步检查托架的侧面方向。通过推动金属柱塞从注射器中卸载纳米纤维载体。

图 4:带有嵌入式支撑 PET 框架的纳米纤维载体。 (A) 框架上的三个可见标记允许控制载体的侧面方向(白色箭头)。(B)嵌入细胞载体纳米纤维膜(白色箭头)中的PET框架片段的放大图。 请点击此处查看此图的大图。

图5:植入式注射器 。 (A)注射器的部件。(B)纳米纤维细胞载体,将嵌入支撑PET框架加载到植入注射器的塑料矩形毛细管上。 请点击此处查看此图的大图。
3. 外科手术
- 手术设备
- 使用以下手术设备:眼科手术显微镜、用于前眼节和后眼节手术的操作系统、非接触式玻璃体视网膜手术系统、激光光凝装置和数码相机。
注意:玻璃体切除术、外切和内切以及激光光凝设备中使用的标准参数如 表 1 所示。
- 使用以下手术设备:眼科手术显微镜、用于前眼节和后眼节手术的操作系统、非接触式玻璃体视网膜手术系统、激光光凝装置和数码相机。
- 手术器械
- 根据标准方案,使用移动式高压灭菌器蒸汽灭菌器或类似设备对可重复使用的手术器械进行消毒。手术过程中所需的一次性手术器械和材料列在 材料表中。
- 手术步骤的准备
- 如步骤1.4.1所述麻醉动物后,在手术前15分钟在结膜囊中施用1%托品酰胺溶液滴眼液和10%盐酸去氧肾上腺素溶液,以引起药物诱导的瞳孔散大。
- 接近手术台,外科医生在上部位置,助手在侧面位置(图3)。
- 使用一次性剃须刀剃除眼睛周围的区域,并去除粗糙的污垢。
- 用5%聚维酮碘溶液消毒结膜囊5分钟。
- 用棉签从眼睑到眼睑周围擦洗,对眶周区域进行消毒。使用10%聚维酮碘溶液重复该过程三次,并保持5分钟。
- 使用带有粘性透明箔的标准无菌眼科窗帘将眼睛放在中间覆盖手术区域。将睫毛从眼球上移开。避免剪睫毛以降低术后眼内炎的风险。
- 插入眼睑窥器(利伯曼型或库克眼窥器)。或者,用8-0将蕨膜固定在皮肤上聚乳糖缝合线。
- 从牙缘打开鼻侧 2 mm 至 3 mm 的结膜,以便使用手术钳和 Westcott 结膜剪刀露出巩膜以进行菌核切除术。
- 将三阀 25 G 穿刺器从边缘插入扁平区 2.5-3 毫米(将它们放在 7 点钟、10 点钟和 11 点钟位置)。在插入过程中以稍微倾斜的方式(100°-110°)向视网膜后部旋转运动,并用镊子握住穿刺器(图6)。
- 在整个手术过程中保持角膜湿润或涂上甲基纤维素,以防止渗透性角膜水肿。
- 扁平部玻璃体切除术 (PPV)
- 用标准的三端口扁平部玻璃体切除术切除玻璃体的中间部分。小心地去除晶状体后面的玻璃体在未来大硬化切开术区域。
- 使用玻璃体内注射2-4mg曲安奈德(TA)注射液(50-100μL)染色玻璃体后部,玻璃体后部通常仍粘附在视网膜上,以进行受控的玻璃体后脱离。
- 之后,用更中心的41 G套管缓慢进行0.05-0.1mL BSS的视网膜下注射,避免向外围形成气泡。
- 在视网膜下注射期间,使用冲洗系统将眼内压设置降低至 15 mmHg,以防止短暂的视网膜血管闭塞。
- 使用靠近鼻泡底部 3 mm 的 27 G 内透热探头对视网膜进行线性大内透热。
- 之后,用 3 G MVR 刀片或垂直剪刀进行 25 mm 大的视网膜切开术,将冲洗系统置于高达 60 mmHg 的眼内压 (IOP) 设置,持续 3 分钟至 5 分钟。确保视网膜切开术没有出血,然后将眼压降至 25 mmHg。
- 用27 G内透热探头对巩膜表面的两个鼻穿刺器之间的巩膜外膜血管进行外渗热处理。
- 在扩大硬体切开术之前检查输液瓶的液位,因为在硬体切开术扩大后,液体消耗暂时很高。
- 使用 2.75 mm 的 phaco 刀进行 3.0 毫米大的硬皮切开术,距离角膜缘 3 毫米。
- 注意大巩膜切开术内的巩膜血管和睫状体可能出血。在出血的情况下,使用27 G内透热探头凝固受损血管。用缎面刀将硬皮切开术扩大到 3.0 毫米,以容纳注射器的尖端 (0.8 毫米 x 2.8 毫米)。
- 用玻璃体切除大硬化术部位脱垂的玻璃体。用玻璃体切除术系统将BSS的输注保持在25-30 mmHg的水平,以避免眼球塌陷。
- 细胞载体植入
- 用惯用手轻轻地将注射器通过大硬化术插入玻璃体腔。在抵抗的情况下,扩大硬化切开术的大小。
- 通过视网膜切开术将细胞载体植入视网膜下空间。如有必要,使用双手技术,增加硬体切开术和枝形吊灯,以改善植入的控制。
- 从眼睛中取出注射器并以 8-0 关闭大硬化切开术多乳素缝合以避免与眼内张力低下相关的并发症。
- 使用硅胶套管进行完整的流体-空气交换 (FAX) 和视网膜下液引流。
- 之后,使用玻璃体切除术系统和用于硅油注射的管道系统将硅油(1,000 cSt)注入玻璃体腔,直到眼压正常。
- 术中影像学检查和记录
- 在整个手术过程中进行视频录制,并使用视频录制系统记录植入关键步骤的照片。
- 通过记录菌核切除术、视网膜切开术、视网膜下植入物的位置以及使用眼底绘图方案发生的任何并发症来完成眼底绘图。
- 术后步骤
- 手术结束时,取出套管并以8-0关闭三个菌核切除术和结膜聚乳糖缝合线。
- 用5%聚维酮碘溶液冲洗结膜囊。
- 进行 0.3 mL 结膜下注射 20 mg 庆大霉素、2 mg 地塞米松和 2% 木卡因。
- 使用显微镜检查眼底和晶状体的状况。
- 使用手术镊子和Westcott结膜剪刀(可选)从结膜上拆下缝合线。
- 将新霉素软膏或氧氟沙星眼药膏涂抹到结膜囊中。
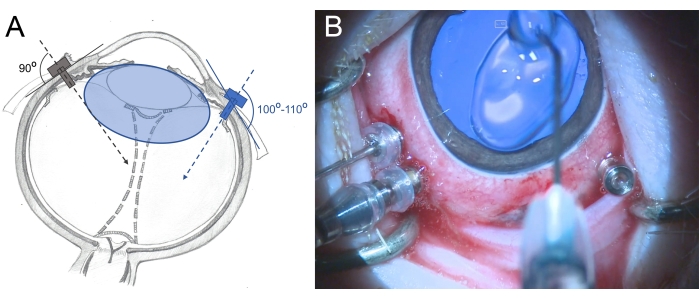
图 6:将 穿刺器插入迷你猪的眼睛。 (A)穿刺器的示意图,穿刺器垂直插入巩膜,朝向人眼玻璃体腔的中心(灰色),并以倾斜方式朝向迷你猪眼的后视网膜(蓝色),以避免损坏晶状体。迷你猪(蓝色)的晶状体比人类大,相对于玻璃体腔的大小。(B)三端口PPV中插入穿刺器的术中视图。角膜覆盖有甲基纤维素,以防止干燥和肿胀。 请点击此处查看此图的大图。
4. 术后护理
- 将局部杆菌肽锌/醋酸氢化可的松/硫酸新霉素或0.3%氧氟沙星涂抹到动物的结膜囊中,每天五次。
- 术后,检查以下眼睛参数:使用触诊使眼睛软组织膨胀,眼睛表面的炎症反应,以及使用手持裂隙灯或间接检眼镜眯眼作为眼睑的保护反应。
- 对于全身术后护理,请使用以下抗生素:
- 在稳定的第二天和第三天肌内注射盐酸头孢噻呋,剂量为3毫克/千克体重(1毫升/千克)。
- 术后72小时注射托拉菌素(1mL/40 kg BW),以预防继发性细菌感染。
- 手术后每24小时肌内注射氟尼辛(2mL / 45kg活重)和盐酸曲马多(100mg),持续3天,以防止疼痛。
- 将迷你猪饲养在专门的空调设施中,温度范围为18-22°C,人工13小时/ 11小时亮/暗状态。
- 确保他们能够免费获得水和标准喂养(每天两次)。
5. 术后程序
- 术后眼科检查
- 在术后期间,用间接检眼镜检查眼睛是否存在炎症(即结膜囊发红、组织肿胀或粘液充血)。使用触诊方法测量手术眼睛的眼内压。
- 术后影像学检查
- 在眼底摄影和OCT检查前,通过肌肉注射TKX混合物诱导迷你猪镇静。将1%托吡卡胺和10%盐酸去氧肾上腺素滴眼液滴入迷你猪的结膜囊中,以诱导瞳孔散大。
- 使用眼睑窥器保持眼睛睁开。为了滋润眼睛表面并获得清晰的OCT图像,每30-60秒用盐溶液(0.9%NaCl)清洗动物的角膜。
- 以与操作期间相同的方式将迷你猪放置在手术台上(图2B,C,图3A)。主要要求是将磁头放在侧面并垂直于OCT设备的扫描件。在动物鼻子下方使用聚苯乙烯泡沫塑料垫来稳定头部,使眼睛表面处于水平位置。
- 使用彩色非散瞳底相机收集彩色眼底图像,因为这可以记录前段、视网膜和视盘。此外,使用非散瞳眼底相机拍摄视网膜的无红色图像。
- 使用光谱域OCT系统进行光学相干断层扫描成像。在OCT或眼底成像期间,手动将迷你猪的头部向OCT镜片或眼底相机镜片倾斜,以优化视网膜后部和植入区域的视图(图2C)。为了在眼底上对植入的载体进行最佳成像,请应用OCT装置的红外反射光以聚焦在植入物上(图2C)。使用 OCT 交叉线和视网膜地图扫描模式。
- 在检查结束时在动物眼睛的眼睑下涂抹氧氟沙星眼膏。
- 将迷你猪移至室内设施并观察其一般状况,直到镇静结束(约2小时至5小时)。
6.安乐死后眼部剜除
- 肌肉注射TKX混合物使迷你猪镇静,然后静脉(通过22-G耳套管)推注1%丙泊酚(20mL/动物),然后放血。不要使用一般固定剂。
- 在细胞移植植入后 7 天、14 天、28 天和 42 天,在深度全身麻醉期间通过放血处死动物。
- 用镊子和剪刀去除上下眼睑。取下第三眼睑,切开结膜。切断眼部肌肉和视神经。
- 死后使用手术剪刀和手术镊子对眼睛进行眼球摘除。确保该程序由有经验的人执行。
结果
Liběchov迷你猪细胞载体的视网膜下植入结果在 Table 2中呈现。成功的植入被定义为获得足够的数据进行组织学和免疫组织化学研究。失败的病例被定义为具有严重术中并发症的眼睛,这使得无法进一步观察眼组织。
使用硅油填塞应用所提出的技术允许使用成像方式控制视网膜下移植的状况,从手术后的第二天开始直到眼球摘除的时间(图7,图8和图9)。
眼底成像和SD-OCT
在术后使用眼底成像、无红成像和光谱域光学相干断层扫描检查小型猪(图7)。通过使用透明的光学介质(包括透明晶状体和使用硅油填塞)来实现高质量的眼底成像(图7A)。视网膜切开部位没有显示出增殖反应的迹象(图7A,黄色箭头),细胞载体的PTE框架通过猪视网膜的半透明层清晰可见。在无红成像中,培养的hRPE在载体上的反射率与内源性猪RPE层的反射率没有差异(图7B)。在SD-OCT上,PTE框架仅引起底层解剖结构的轻微阴影和视网膜的轻微增厚(图7C,红色箭头)。在SD-OCT上没有发现非典型的低反射区或超反射区,布鲁赫的膜似乎也没有受损。图8显示了手术后1个月用原代人RPE细胞培养的支架的眼底和iOCT图像(图8)。细胞载体本身(没有任何细胞)没有引起视网膜厚度的显着增加(图9C)。这些发现表明,植入物的术中医源性影响很小,并且植入的细胞载体经历了植入细胞对上覆光感受细胞和神经视网膜组织的充分适应。
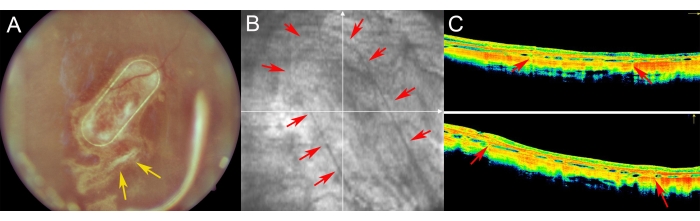
图7:迷你猪视网膜的术后成像 。 (A)眼底成像,(B)无红图像和(C)在迷你猪眼视网膜下移植后1周随访中,纳米纤维载体与原代人RPE细胞的光学相干断层扫描成像。(A)黄色箭头表示视网膜切开术的部位。(B)红色箭头表示纳米纤维细胞载体的边缘。(C)红色箭头表示由植入视网膜下间隙的纳米纤维载体的支撑PET框架引起的OCT信号的轻微阴影。 请点击此处查看此图的大图。
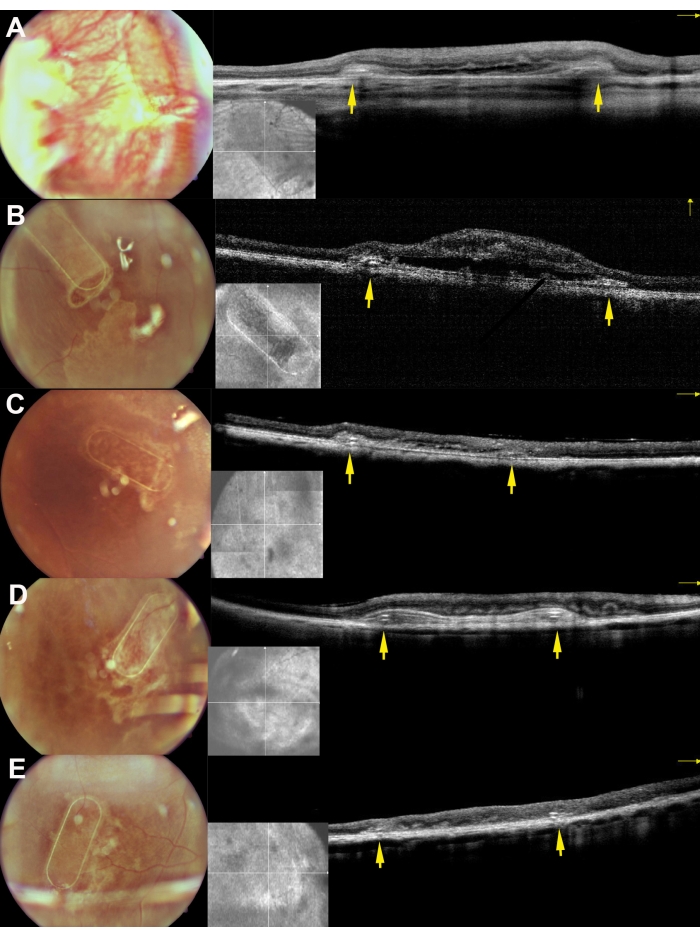
图 8:小型猪视网膜下植入后 30 天支架的眼底成像和 iOCT 图像。 A、 B、 C、 D 和 E 分别对应于猪 169、182、179、199 和 224。黄色箭头描绘了脚手架的框架。 请点击此处查看此图的大图。
组织学和免疫组织化学分析
动物安乐死后,将整个迷你猪的眼睛取出并在4%多聚甲醛(PFA)中固定24小时。切除眼睛的前部,在鼻中央视网膜中鉴定植入的纳米纤维载体,并附着巩膜进行分离。将所有组织在分级蔗糖溶液中冷冻保护,并切割垂直冷冻切片,如详细描述43所示。植入4周后没有RPE细胞的纳米纤维膜的组织学显示视网膜没有炎症和退行性变化(图9A)。在偏振光中检测到纳米纤维膜的存在(图9B)。
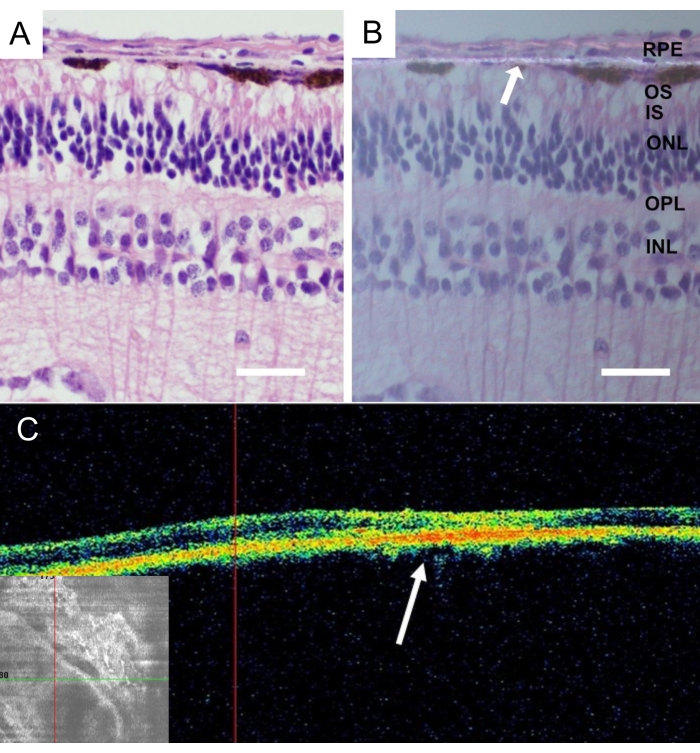
图9:植入的无细胞纳米纤维膜的组织学分析。 植入后4周对无细胞纳米纤维膜进行苏木精-伊红染色(A)用标准照明和(B)用偏振光显微镜。白色箭头表示纳米纤维膜定位(比例尺:50 μm)。(C)植入后4周后无细胞纳米纤维膜的 体内 光学相干断层扫描图片描绘了纳米纤维膜在视网膜下空间的良好接受和粘附。白色箭头表示植入物在视网膜横截面图像中的位置。 请点击此处查看此图的大图。
图10显示了迷你猪眼中纳米纤维载体(黄色箭头)上含有植入原代hRPE细胞的视网膜区域的苏木精 - 伊红(H&E)染色。植入的初级hRPE的色素外观形成了连续但不规则的色素层(图10,红色箭头)。经过较长时间的观察(6周),植入物下方的神经视网膜在视网膜切开部位周围显示出玫瑰花状或肥厚反应样外观,可能是医源性操作的结果。这些形态学结果与SD-OCT结果相当,并支持载体递送对视网膜组织影响最小的证据。
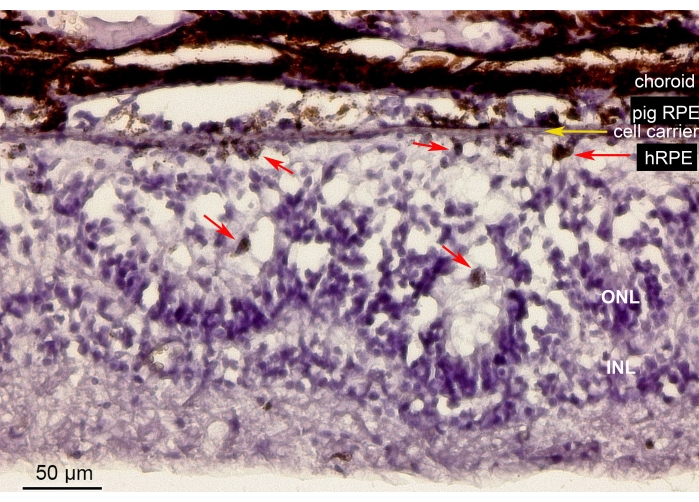
图 10:具有初级 hRPE 的植入纳米纤维膜的组织学分析。 苏木精-伊红染色含有植入的纳米纤维载体(黄色箭头)的视网膜区域,小猪眼中的初级 hRPE。该动物在植入后6周被安乐死并进行分析。初级hRPEs通过它们的大小,圆形和光感受器对面的视网膜下空间中的色素沉着(红色箭头)可以清楚地区分。ONL中的感光细胞核构建玫瑰花状结构。视网膜下间隙出现肥厚。缩写:hRPE = 原代人视网膜色素上皮,ONL = 外核层,INL = 内核层。 请点击此处查看此图的大图。
免疫染色采用两步间接方法进行。将切片在室温下在单克隆一抗CRALBP中以1:100的稀释度孵育过夜。使用Alexa Fluor 488偶联的二抗进行免疫荧光。
植入的原代hRPE存在于植入区域,并表达类似于内源性迷你猪RPE细胞的典型RPE CRALBP标志物(图11A)。相比之下,植入细胞的形态在植入后似乎没有呈现单层形状,但仍位于定义的视网膜下空间内(图11A,B,白色箭头)。以下 RPE/视网膜标志物和形态学外观在植入后 6 周后保持阳性:色素/黑色素颗粒的存在、视杆双极 (PKC-α) 和视锥光感受器 (PNA) 的终末期视网膜特异性神经元标志物,以及 GFAP 阳性 - 小胶质细胞激活的标志。
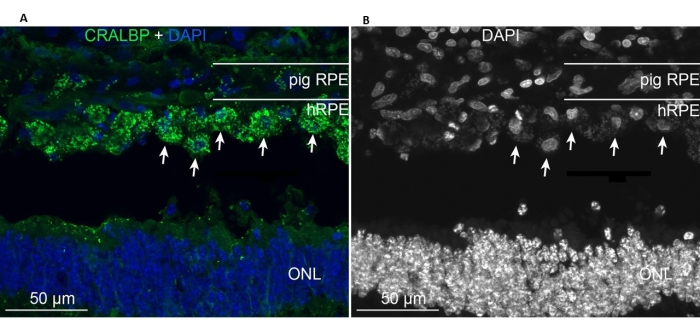
图 11:植入原代 hRPE 后 6 个月在迷你猪中使用 RPE 细胞标记物 CRALBP(细胞视黄醛结合蛋白)进行 免疫标记。 (A)用CRALBP单克隆抗体(绿色)免疫标记处理猪眼的垂直冷冻切片并用DAPI(蓝色)复染。(B)用黑白DAPI标记细胞核的单一描述,因为高对比度揭示了单个hRPE细胞的圆形(有些用白色箭头显示)。缩写:hRPE = 人视网膜色素上皮,ONL = 外核层。 请点击此处查看此图的大图。
眼部并发症
总共有29个(93.1%)成功执行了手术中的27个。"成功进行手术"的定义适用于手术眼直到眼球摘除时才显示任何临床上显着的术后并发症,这可能会影响组织学和免疫组织化学研究的病例。光学介质透明度降低影响术后影像学4例(13.7%);尽管如此,这些眼睛还是经过了进一步的组织学和免疫组织化学分析。
术中发生外周视网膜脱离4例(13.8%)。在两种情况下,通过在液气交换期间抽吸视网膜下液体和在脱离区域应用视网膜激光光凝来管理它。在另外两个病例(6.9%)中,视网膜脱离与大量视网膜和视网膜下出血有关,这使得细胞载体无法植入,并导致手术终止和迷你猪在手术台上立即安乐死。
| 不 | 参数 | 标准使用的设置 |
| 1 | 玻璃体切除术速度(切割速率) | 高达 20,000 次/分钟 |
| 2 | 文丘里泵 | 50-180 毫米汞柱 |
| 3 | 上升时间 | 1 秒 |
| 4 | 灌溉压力 | 18-25 毫米汞柱 |
| 5 | 空气注入压力 | 20-25 毫米汞柱 |
| 6 | 双相外热疗法 | 18-26% |
| 7 | 单极内透热术 | 16-18% |
| 8 | 视网膜的激光光凝,532 nm | 功率 100-150 mW |
| 间隔 100 ms | ||
| 持续时间 100 ms |
表 1: 玻璃体切除术和激光光凝术中使用的标准参数。
| 动物总数,n | 18 |
| 总眼数,n | 36 |
| 手术眼,n | 29 |
| 成功植入,n | 27 |
| 失败案例,n | 2 |
| 平均手术时间,最小值 | 57 |
| 成功率,% | 93.1 |
表 2: 2016 年至 2020 年间在 Liběchov 迷你猪中视网膜下植入细胞载体的标准化手术技术的结果。
补充文件1: 致力于将RPE细胞植入细胞在细胞载体上的视网膜下的研究摘要。 请点击此处下载此文件。
讨论
不同来源的RPE细胞的视网膜下植入是治疗视网膜退行性疾病的眼科研究的一个非常有前途的趋势,例如AMD3,4,8,9,10,11,12,13,14,15,25.该方法的主要思想是用离体培养的健康RPE代替受损的RPE(补充文件1)44,45,46,47,48。使用细胞载体移植培养的RPE细胞是最合理的方法,因为多孔膜将偏振的RPE细胞层保持在相对于光感觉层的正确方向。
最佳动物模型
开发这种治疗方法的关键步骤是使用最佳动物模型49。过去曾使用过小型和大型动物模型,包括兔子、狗、猪和非人灵长类动物8、9、10、11、12、13、14、15、27、29。在本文中,我们提出了使用Liběchov迷你猪模型,并描述了能够实现强大移植效率的术前,手术和术后步骤。Liběchov迷你猪最初是在大约20年前培育的,并经常用于神经退行性疾病领域的生物医学研究,例如帕金森氏症和亨廷顿病29,50。由于猪拥有相对较大的大脑,血液供应和免疫反应与人类相似,因此它也被用作同种异体移植实验的动物模型51,52,53,54。尽管迷你猪的视网膜不具有类似人类的黄斑和中央凹,但它包含中央区域和视觉条纹,它们是视网膜中具有高浓度视锥光感受器的区域30。与人眼相似的大小,富集视锥细胞的中央视网膜的存在,描述良好的免疫系统以及评估术后形态和功能的方法的存在是在所提出的研究中使用这种大型动物模型的重要论据。
手术
据我们所知,没有标准化和广泛接受的手术技术用于载体上RPE细胞的玻璃体视网膜移植。细胞替代疗法的关键问题之一是具有挑战性的手术技术,该技术存在与视网膜脱离、肌张力低下、巩膜、脉络膜和/或视网膜出血以及高眼内湍流相关的术中和术后并发症的风险,这可能导致支架损伤。术后存在增殖性玻璃体视网膜病变、眼内炎、肌张力低下、视网膜脱离和白内障形成的风险4,10,13,14,15。
关于使用细胞载体的方法的首次研究是在龙猫私生兔13,16,25中进行的。尽管这些动物代表小动物模型,但专注于手术技术方面的结果对于大型动物模型中程序的开发至关重要,因此总结如下。
定制的23 G输液插管最初用于两个侧端口,以重定向喷射流,这有助于解决水泡的塌陷和随之而来的视网膜脱离13。在本研究中,我们没有注意到任何这种气泡的坍塌。其可能的原因可能是眼球的尺寸更大,以及核心玻璃体切除术的性能,在套管输注部位的外围保留玻璃体,这可能会降低定向射流的力量。
细胞载体从仪器中弹出过程中的困难是小动物模型中的另一个术中障碍,这些模型被归类为"被仪器困住"。此外,作者认为,视网膜表面残留的玻璃体可能导致植入后载体向后"跳"出视网膜切开口。这个问题可以通过酶辅助玻璃体切除术来解决,该切除术使细胞载体能够平稳、连续地喷射到视网膜下空间。在大多数情况下,作者重新定位载体,以获得远离视网膜切开术的植入物位置。在我们的案例系列中,我们还经历了细胞载体仍然附着在注射器尖端的情况。然而,这是通过缓慢而温和地操纵光导管和注射器尖端来管理的。在我们的任何病例中,我们都没有在视网膜切开术部位观察到任何残留的玻璃体。建议在手术中使用TA辅助PPV作为降低残留玻璃体附着风险的方法。可能需要用 TA 进行多次染色以完全去除上覆的玻璃体。
在另一项研究中,报告了在聚酯膜上以极化细胞单层形式生长的人RPE干细胞的视网膜下植入的结果24。在实验过程中,使用了先前描述的相同手术技术13,但应用了双端口PPV方法。最后,随后发表了兔细胞载体手术视网膜下植入的分步方案25。这项研究对外科手术进行了非常详细且易于重复的描述,包括术前和术后护理,这也是基于以前的经验。
在随后的研究中使用大型动物模型期间,不仅解决了技术问题,还解决了有关移植细胞的免疫反应以及细胞载体大小相关问题的问题。一项使用食蟹猴(Macaca fascicularis)的研究描述了人类干细胞衍生的RPE单层视网膜下植入的结果15。所有动物均接受全身免疫抑制,其包括西罗莫司(负荷剂量为2mg,日剂量为1mg)和四环素(7.5mg / kg-BW ),从手术前7天开始,持续手术后3个月。手术按照前面描述的方案进行24,25。作者使用带有枝形吊灯内照明的25 G三端口PPV方法。重要的是,TA辅助PVD用于排除后视网膜上残留的玻璃体视网膜粘附。作为最初描述的程序的补充,作者使用20 G定制的可扩展环形仪器去除了未来植入区域的宿主RPE层。
在我们的迷你猪研究中,我们还使用了全身免疫抑制。然而,免疫抑制的类型与上述不同。我们以0.25mg / kg BW的剂量皮下注射他克莫司洗脱聚合物微球作为储存库,以阻碍细胞移植排斥反应和炎症反应。我们没有在手术过程中去除宿主RPE细胞层,因为我们的主要目的是分析手术的安全性和植入细胞的活力,而不是它们与宿主视网膜的整合。
此前,在14头雌性尤卡坦迷你猪10中评估了在可折叠的不可降解网状支撑的亚微米Parylene-C膜(6.25 mm x 3.5 mm,0.4 μm厚)上植入单层hESC衍生RPE的安全性和可行性。培养后,将细胞接种到网状支撑的膜上。使用全身施用他克莫司(无方案和剂量)和在手术结束时玻璃体内注射0.7mg地塞米松植入物进行免疫抑制。PPV采用20 G方法进行。作者使用玻璃体内注射曲安奈德乙酮,以更好地观察玻璃体。大硬化切开术的大小为2毫米至3毫米。视网膜下注射后,用临时注射全氟化碳液体使视网膜变平。流体-空气交换后,进行硅油填塞(1,000/5,000 cSt)。术后护理包括在手术后1周眼部应用地塞米松/新霉素/多粘菌素B软膏。作者报告的成功率为91%(即有效的视网膜下植入和足够的术后成像数据)。在我们的研究中,玻璃体内注射TA晶体用于术中,主要用于可视化玻璃体。然而,该药物的局部免疫抑制作用尚不清楚。我们研究中使用的纳米纤维细胞载体为5.2 mm x 2.1 mm和3.7 μm厚,孔径为0.4 μm。在手术过程中,我们进行了直接传真而不是注射全氟化碳液体。我们的手术成功率(93.1%)与Koss等人一致,略好10。
用于视网膜下植入的完全可降解细胞载体(支架)的视网膜下移植于 2019 年在约克郡猪14 中首次研究。该研究主要集中在纤维蛋白水凝胶植入物的可生物降解特性上。作者指出,在家猪上使用的侵袭性免疫抑制可以抑制纤维蛋白水凝胶植入物生物降解过程中可能引起的局部炎症反应。然而,他们没有具体说明猪使用的免疫抑制疗法。在PPV期间,他们进行了3.6毫米长的硬膜切开术,以插入平行于视角膜缘并在其后方约3.5毫米的视网膜下植入装置。此外,他们使用气动驱动的注射系统,旨在减少手指操作引起的手部放置不稳定性。在我们的病例系列中,所有菌核切除术距离角膜缘 2.5 mm 至 3.0 mm。用于插入注射器的大硬化切开术长3毫米。我们研究中使用的植入注射器是手动操作的。彻底烧灼睫状体扁平部和大巩膜切开术内充分切口似乎对于避免术中并发症(如医源性外周视网膜脱离、出血和植入物丢失)至关重要。
总之,我们描述了使用Liběchov迷你猪模型在可生物降解的载体上移植RPE细胞作为遗传性和获得性视网膜疾病的治疗选择。眼睛解剖学和生理学以及免疫系统的相似性使我们能够开发和改进用于视网膜下细胞植入的手术技术和仪器,这些技术和仪器可以很容易地转移到治疗人眼疾病。重要的是要确保在人类手术中使用相同的仪器(包括植入输送工具)对迷你猪进行手术,从而促进将获得的经验和专业知识应用于人类。存在黄斑区域的替代大眼动物模型,例如非人灵长类动物,可用于跟踪和分析视网膜中央区域视网膜下植入后的解剖和功能变化。术前、手术和术后护理程序的详细描述将通过提高高效和标准化的数据生成来对未来的研究有用。
披露声明
没有。
致谢
该项目得到了捷克科学基金会(项目编号18-04393S)和捷克共和国挪威赠款和技术局(KAPPA计划,项目编号TO01000107)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Technical equipment | |||
| Wato EX-65 with a Mindray iMEC10 | Mindray, Shenzhen, China | Wato Ex-65 | anesthesia machine |
| R-Evolution CR | Optikon, Rome, Italy | R-Evolution CR | phacoemulsifier/vitrectome |
| Green laser Merilas 532α | Meridian, Thun, Switzerland | Merilas 532α | ophthalmic green laser |
| Microscope Hi-R NEO 900A | Haag-Streit Surgical, Wedel, Germany) | Hi-R NEO 900A | ophthalmic surgery microscope |
| Camera Sony PMW-10MD | Sony, Tokyo, Japan | PMW-10MD | full HD medical 2-piece |
| Non-contact vitreoretinal surgical system MERLIN BIOM | Volk, Mentor, OH, USA | MERLIN BIOM | BIOM |
| Steam sterilizer | Tuttnauer Europe B.V., Breda, NL | 3870 HSG | sterilizer |
| iCam100 | Optovue, Fremont, CA, USA | iCAM100 | funduscamera |
| iVue OCT100-2 | Optovue, Fremont, CA, USA | iVue OCT100-2 | OCT |
| Microsurgical instruments and devices | |||
| Cook Eye Speculum | Katena, New Jersey, US | K1-5403 | 15mm blades |
| Ophthalmology surgical drape | Hylyard, Alpharetta, Georgie, USA | 79304 | 132 x 142cm |
| Disposable Two step vitrectomy system. (23 gauge/ 0.6 mm) | DORC, Zuidland, Netherlands | 1272.ED06 | |
| Infusion line for 23G / 0.6 mm infusion cannula | DORC, Zuidland, Netherlands | 1279.P | |
| knife 2.75mm, IQ Geometry Tm Slit Knife Angled, Bevel Up | Surgical Specialties Corporation, Reading, USA | 72-2761G | |
| Extendible 41G subretinal injection needle. (23 gauge / 0.6 mm) | DORC, Zuidland, Netherlands | 1270.EXT | |
| Omnifix 3ml Luer Lock Solo siringe | BBraun, Melsungen, Germany | 4617022V | 3ml |
| 1ml soft-inject Tuberculin | Henke Sass Wolf, Tuttlingen, Germany | 5010.200V0 | 1ml |
| 8-0 Coated Vicryl | Ethicon, Puerto Rico, USA | J409G | |
| Purified Silicone Oil (in syringe) 10 ml | (FCI, Paris, France) | S5.7170 | 1000cSt |
| Pinnacle 360 Morris Vertical Scissors 23Ga | Synergetics, O'Fallon, USA | 10.24.23PIN | 23Ga |
| Revolution DSP 23Ga ILM forceps | Alcon, Geneva, Switzerland | 706.44 | Griesharber revolution |
| 23ga Straight Laser Probe | Synergetics, O’Fallon, USA | 55.21.23 | |
| FCI Protect 2.0% | FCI Ophthalmics, Paris, France | S5.9100 | viscoelastic |
| DK Westcott style Stitch Scissors, Curve | Duckworth & Kent, Hertfordshire, England | 1-501 | Curve |
| Pierse Notched Forceps, 0,3mm Straigh | Duckworth & Kent, Hertfordshire, England | 2-100-1E | 0,3mm straigh |
| DK Harms-Tubingen Straight Tying Forceps | Duckworth & Kent, Hertfordshire, England | 2-504E | 6mm |
| DK Needle Holder, Straigh | Duckworth & Kent, Hertfordshire, England | 3-201 | 9mm straigh |
| Medications and solutions | |||
| Unitropic 1% gtt. | UNIMED PHARMA spol. s r.o., Bratislava, Slovak republic | tropicamidum 10 mg/ml | eye drops |
| Diprophos | Merck Sharp & Dohme B.V., Haarlem, Netherlands | betamethasonum 7 mg/ml | 1ml |
| Alcon BSS Irrigation Solution | Alcon, Geneva, Switzerland | balance salt solution (BSS) | 500ml |
| Betaisodona | Mundipharma, Cambridge, United Kingdom | povidon-Iodine 1g/10ml | 30ml |
| Depo-medrol 120mg | Pfizer, New Yourk, USA | methylprednisolon | 5ml/200mg |
| Shotapen | Virbac Carros Cedex, France | benzylpenicillin, dihydrostreptomycin | 250ml |
| Flunixin a.u.v. | Norbrook, Newry, Northern Ireland | flunixinum 50,0 mg | 250ml |
| Tramal 100MG/2ML | Stada Arzneimittel AG, Bad Vilbel, Deutschland | tramadol | 2ml |
| Zoletil 100 | Virbac Carros Cedex, France | tiletamine, zolazepam | 100mg |
| Narkeran 10 | Vetoquinol, Magny-Vernois, France | ketamin | 2ml |
| Rometar 20mg/ml | Spofa pharmaceutica, Prague, Czech republic | xylazinum | 20mg |
| Braunol 75mg/g | B.Braun medical, Prague, Czech republic | povidone iodine | 75mg/g |
| Propofol 1% MCT/LCT | Fresenius Kabi, Bad Homburg, Deutschland | propofol | 10mg/1ml |
| Isoflurane 100% Inhalation vapour, liquid | Piramal Critical Care Limited, West Drayton, United Kingdom | isoflurane | 100% |
| Benoxi gtt. 4mg/1ml | Unimed pharma, Bratislava, Slovakia | oxybuprakaine | 10ml |
| Neosynephrin POS 10% gtt. | Ursapharm , Saarbrücken, Deutschland | fenylefrin chloride | 10ml |
| Ophthalmo-framykoin 1X5GM | Zentiva a.s., Prague, Czech republic | bacitracin zinc/hydrocortisone acetate/hydrocortisoneacetate/neomycin sulfate | 5mg |
| Floxal ung. | Dr. Gerhard Mann Chem.-Pharm. Fabrik, Berlin, Germany | ofloxacin | 0.30% |
| Eficur inj. | Hipra, Amer, Spain | ceftiofurum hydrochloridum | 50mg / 1ml |
| Draxxin | Zoetis Inc., New Jersey, USA | tulathromycinum | 100mg / 1ml |
| Tramal | Stada Arzneimittel AG, Bad Vilbel, Deutschland | tramadoli hydrochloridum | 100mg / 2ml |
| Xylapan | Vetoquinol, Magny-Vernois, France | xylazinum | 0.4 mg/kg |
| Proparacaine hydrochlorid ophthalmic solution 0,5% | Bausch&Lomb Incorporated Tampa, FL, USA | Proparacaine hydrochlorid | 0.50% |
| Prograf | Astellas Pharma, Deerfield, Illinois, USA | Tacrolimus powder | 1mg |
| Cell carrier, cultivated cells cultures, and implantation injector | |||
| Falcon Cell Culture Inserts | Corning Inc., Kenneburg, ME, USA | 353103 | |
| TrypLE Express Enzyme (1X) | Thermo Fisher Scientific, MA, USA | 12604021 | |
| DMEM/F-12 | Thermo Fisher Scientific, MA, USA | 11320033 | |
| Biolaminin 521 LN (LN521) | BioLamina, Sundbyberg, Sweden | LN521-02 | |
| GlutaMAX Supplement | Thermo Fisher Scientific, MA, USA | 35050061 | |
| 2-Mercaptoethanol | Thermo Fisher Scientific, MA, USA | J66742.0B | |
| Penicillin-Streptomycin | Sigma-Aldrich, San Luis, Mi, USA | P4333 | |
| CRALBP | Novus Biologicals, Abingdon, UK | NB100-74392 | |
| Alexa Fluor 488 | Thermo Fisher Scientific, Germany | 21202 |
参考文献
- Pascolini, D., Mariotti, S. P. Global estimates of visual impairment: 2010. British Journal of Ophthalmology. 96 (5), 614-618 (2011).
- Bressler, N. M., Bressler, S. B., Fine, S. L. Age-related macular degeneration. Survey of Ophthalmology. 32 (6), 375-413 (1988).
- Binder, S., Stanzel, B. V., Krebs, I., Glittenberg, C. Transplantation of the RPE in AMD. Progress in Retinal and Eye Research. 26 (5), 516-554 (2007).
- Mano, F., et al. Methodological approach to improve surgical outcomes of a pig subretinal implantation model. Translational Vision Science & Technology. 11 (4), 24 (2022).
- Ramsden, C. M., et al. Stem cells in retinal regeneration: Past, present and future. Development. 140 (12), 2576-2585 (2013).
- Carr, A. -. J. F., et al. Development of human embryonic stem cell therapies for age-related macular degeneration. Trends in Neurosciences. 36 (7), 385-395 (2013).
- Tezel, T. H., Kaplan, H. J., Del Priore, L. V. Fate of human retinal pigment epithelial cells seeded onto layers of human Bruch's membrane. Investigative Ophthalmology & Visual Science. 40 (2), 467-476 (1999).
- Popelka, S., et al. A frame-supported ultrathin electrospun polymer membrane for transplantation of retinal pigment epithelial cells. Biomedical Materials. 10 (4), 045022 (2015).
- Kozak, I., et al. Safety and feasibility of new nanofiber subretinal delivery system with injector for RPE cell transplantation. Investigative Ophthalmology & Visual Science. 59 (9), 5670 (2018).
- Koss, M. J., et al. Subretinal implantation of a monolayer of human embryonic stem cell-derived retinal pigment epithelium: a feasibility and safety study in Yucatan minipigs. Graefe's Archive for Clinical and Experimental Ophthalmology = Albrecht von Graefes Archiv fur Klinische und Experimentelle Ophthalmologie. 254 (8), 1553-1565 (2016).
- Ghosh, F., Wong, F., Johansson, K., Bruun, A., Petters, R. M. Transplantation of full-thickness retina in the rhodopsin transgenic pig. Retina. 24 (1), 98-109 (2004).
- Christiansen, A. T., et al. Subretinal implantation of electrospun, short nanowire, and smooth poly(epsilon-caprolactone) scaffolds to the subretinal space of porcine eyes. Stem Cells International. 2012, 454295 (2012).
- Stanzel, B. V., et al. Subretinal delivery of ultrathin rigid-elastic cell carriers using a metallic shooter instrument and biodegradable hydrogel encapsulation. Investigative Ophthalmology & Visual Science. 53 (1), 490-500 (2012).
- Gandhi, J. K., et al. Fibrin hydrogels are safe, degradable scaffolds for sub-retinal implantation. PloS One. 15 (1), 0227641 (2020).
- Liu, Z., et al. Surgical transplantation of human RPE stem cell-derived RPE monolayers into non-human primates with immunosuppression. Stem Cell Reports. 16 (2), 237-251 (2021).
- Mandai, M., et al. Autologous induced stem-cell-derived retinal cells for macular degeneration. New England Journal of Medicine. 376 (11), 1038-1046 (2017).
- Schwartz, S. D., et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: Follow-up of two open-label phase 1/2 studies. Lancet. 385 (9967), 509-516 (2015).
- Kashani, A. H., et al. Surgical method for implantation of a biosynthetic retinal pigment epithelium monolayer for geographic atrophy: Experience from a phase 1/2a study. Ophthalmology Retina. 4 (3), 264-273 (2020).
- Kashani, A. H., et al. Subretinal implantation of a human embryonic stem cell-derived retinal pigment epithelium monolayer in a porcine model. Advances in Experimental Medicine and Biology. 1185, 569-574 (2019).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), 4097 (2018).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Diniz, B., et al. Subretinal implantation of retinal pigment epithelial cells derived from human embryonic stem cells: Improved survival when implanted as a monolayer. Invest Ophthalmol Vis Sci. 54 (7), 5087-5096 (2013).
- Sharma, R., et al. Clinical-grade stem cell-derived retinal pigment epithelium patch rescues retinal degeneration in rodents and pigs. Science Translational Medicine. 11 (475), 7624 (2019).
- Stanzel, B., et al. Human RPE stem cells grown into polarized RPE monolayers on a polyester matrix are maintained after grafting into rabbit subretinal space. Stem Cell Reports. 2 (1), 64-77 (2014).
- Al-Nawaiseh, S., et al. A step by step protocol for subretinal surgery in rabbits. Journal of Visualized Experiments. (115), e53927 (2016).
- Stanzel, B., et al. Surgical approaches for cell therapeutics delivery to the retinal pigment epithelium and retina. Advances in Experimental Medicine and Biology. 1186, 141-170 (2019).
- Yaji, N., Yamato, M., Yang, J., Okano, T., Hori, S. Transplantation of tissue-engineered retinal pigment epithelial cell sheets in a rabbit model. Biomaterials. 30 (5), 797-803 (2009).
- Hruban, V., et al. Inheritance of malignant melanoma in the MeLiM strain of miniature pigs. Veterinarni Medicina. 49 (12), 453-459 (2004).
- Vodicka, P., et al. The miniature pig as an animal model in biomedical research. Annals of the New York Academy of Sciences. 1049, 161-171 (2005).
- Vízina, M., Wier, A. B., Collins, M. Comparative Ocular Anatomy in Commonly Used Laboratory Animals. Ocular Toxicology in Laboratory Animals. , 9-12 (2013).
- Chandler, M. J., Smith, P. J., Samuelson, D. A., MacKay, E. O. Photoreceptor density of the domestic pig retina. Veterinary Ophthalmology. 2 (3), 179-184 (1999).
- Wang, Q. X., et al. Biodegradable microsphere-loaded tacrolimus enhanced the effect on mice islet allograft and reduced the adverse effect on insulin secretion. American Journal of Transplantation. 4 (5), 721-727 (2004).
- Sevc, J., et al. Effective long-term immunosuppression in rats by subcutaneously implanted sustained-release tacrolimus pellet: Effect on spinally grafted human neural precursor survival. Experimental Neurology. 248, 85-99 (2013).
- Juhásová, J., et al. Osteogenic differentiation of miniature pig mesenchymal stem cells in 2D and 3D environment. Physiological Research. 60 (3), 559-571 (2011).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomedical Papers of the Medical Faculty of the University Palacky, Olomouc, Czech Republic. 156 (2), 128-134 (2012).
- Soerensen, D. D., Pedersen, L. J. Infrared skin temperature measurements for monitoring health in pigs: a review. Acta Veterinaria Scandinavica. 57 (1), 5 (2015).
- Eichhorn, S. J., Sampson, W. W. Statistical geometry of pores and statistics of porous nanofibrous assemblies. Journal of the Royal Society Interface. 2 (4), 309-318 (2005).
- Szatmári-Tóth, M., et al. Clearance of autophagy-associated dying retinal pigment epithelial cells - a possible source for inflammation in age-related macular degeneration. Cell Death & Disease. 7 (9), 2367 (2016).
- Lukovic, D., et al. Human iPSC derived disease model of MERTK-associated retinitis pigmentosa. Scientific Reports. 5, 12910 (2015).
- Artero Castro, A., et al. Generation of gene-corrected human induced pluripotent stem cell lines derived from retinitis pigmentosa patient with Ser331Cysfs*5 mutation in MERTK. Stem Cell Research. 34, 101341 (2019).
- Artero Castro, A., León, M., Del Buey Furió, V., Erceg, S., Lukovic, D. Generation of a human iPSC line by mRNA reprogramming. Stem Cell Research. 28, 157-160 (2018).
- Artero-Castro, A., et al. correction recovers phagocytosis in retinal pigment epithelium derived from retinitis pigmentosa-human-induced pluripotent stem cells. International Journal of Molecular Sciences. 22 (4), 2092 (2021).
- Müller, B., Wagner, F., Lorenz, B., Stieger, K. Organotypic cultures of adult mouse retina: Morphologic changes and gene expression. Investigative Ophthalmology & Visual Science. 58 (4), 1930-1940 (2017).
- Sheridan, C. M., et al. Replacement of the RPE monolayer. Eye. 23 (10), 1910-1915 (2009).
- Radtke, N. D., et al. Vision improvement in retinal degeneration patients by implantation of retina together with retinal pigment epithelium. American Journal of Ophthalmology. 146 (2), 172-182 (2008).
- Maaijwee, K. J. M., et al. Histological evidence for revascularisation of an autologous retinal pigment epithelium--choroid graft in the pig. The British Journal of Ophthalmology. 91 (4), 546-550 (2007).
- Ghosh, F., Engelsberg, K., English, R. V., Petters, R. M. Long-term neuroretinal full-thickness transplants in a large animal model of severe retinitis pigmentosa. Graefe's Archive for Clinical and Experimental Ophthalmology = Albrecht von Graefes Archiv fur Klinische und Experimentelle Ophthalmologie. 245 (6), 835-846 (2007).
- Radtke, N. D., Seiler, M. J., Aramant, R. B., Petry, H. M., Pidwell, D. J. Transplantation of intact sheets of fetal neural retina with its retinal pigment epithelium in retinitis pigmentosa patients. American Journal of Ophthalmology. 133 (4), 544-550 (2002).
- Slijkerman, R. W., et al. The pros and cons of vertebrate animal models for functional and therapeutic research on inherited retinal dystrophies. Progress in Retinal and Eye Research. 48, 137-159 (2015).
- Schramke, S., et al. The Libechov minipig as a large animal model for preclinical research in Huntington's disease - Thoughts and perspectives. Czech and Slovak Neurology and Neurosurgery. 78/111, 55-60 (2015).
- Tohyama, S., Kobayashi, E. Age-appropriateness of porcine models used for cell transplantation. Cell Transplantation. 28 (2), 224-228 (2019).
- Dall, A. M., et al. Quantitative [18F] fluorodopa/PET and histology of fetal mesencephalic dopaminergic grafts to the striatum of MPTP-poisoned minipigs. Cell Transplantation. 11 (8), 733-746 (2002).
- Shrader, S. M., Greentree, W. F. Göttingen minipigs in ocular research. Toxicologic Pathology. 46 (4), 403-407 (2018).
- Duarri, A., et al. Transplantation of human induced pluripotent stem cell-derived retinal pigment epithelium in a swine model of geographic atrophy. International Journal of Molecular Sciences. 22 (19), 10497 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。