Method Article
ミニブタのキャリアへのRPEの網膜下移植:術前準備、手術手技、および術後ケアのガイドライン
* これらの著者は同等に貢献しました
要約
網膜色素上皮(RPE)の網膜下移植は、変性網膜疾患の治療のための最も有望なアプローチの1つです。しかし、大眼動物モデルでの前臨床試験の実施は依然として困難です。このレポートは、ミニブタへの細胞キャリア上のRPEの網膜下移植のガイドラインを提示します。
要約
主に網膜色素性上皮(RPE)層またはその内部で発生する網膜の変性疾患(加齢黄斑変性症を含む)は、網膜解剖学的構造の進行性の混乱および視覚機能の悪化をもたらす。網膜下細胞キャリアを用いた in vitro 培養RPE細胞による損傷したRPE細胞(RPE)の置換は、網膜外層の解剖学的構造を再確立する可能性を示しており、したがって、さらなる研究が行われている。ここでは、培養RPEを含む細胞キャリアのミニブタへの効果的な網膜下移植を可能にする外科的手法の原理を紹介します。手術は全身麻酔下で行われ、標準的なレンズ温存3ポートパースプラナ硝子体切除術(PPV)、平衡塩溶液(BSS)の網膜下塗布、2.7 mm網膜切開術、追加の3.0 mm硬化切開術、流体空気交換(FAX)、シリコーンオイルタンポナーデ、およびすべての硬化切開術の閉鎖による網膜下腔へのナノ線維細胞キャリアの移植が含まれていました。この外科的アプローチは、過去8年間で29回の手術(18匹)で使用され、成功率は93.1%でした。外科的留置の解剖学的検証は、 in vivo 眼底イメージング(眼底写真および光干渉断層撮影)を用いて行った。ミニブタの眼のキャリアへのRPEの網膜下移植に推奨される外科的ステップは、大眼動物モデルを使用した将来の前臨床試験で使用できます。
概要
加齢黄斑変性症(AMD)は、先進国における中心視力喪失の主な原因と考えられており、網膜色素性上皮(RPE)機能障害に関連する多くの状態の1つです1,2。RPEは、基本的に位置するブルッフ膜(BM)上にあり、光受容体に必要なメンテナンスを提供します。RPE層の進行性変性は、AMDの初期萎縮型の特徴であり、後期滲出型AMDの開発にも伴います。網膜疾患治療には多くの進歩があるにもかかわらず、効果的な治療法の開発は依然として困難です3。有望な方法の1つは、in vitro培養RPE層を用いたRPE置換である。この治療法は、ヒト胚性幹細胞由来RPE(hESC-RPE)や人工多能性幹細胞由来RPE(iPSC-RPE)を用いた幹細胞研究の進展と関連しています3,4,5,6,7。近年、多くの研究グループは、最初に受け入れられた概念実証8,9,10,11,12,13,14,15を使用して、RPE置換のためのさまざまなアプローチの開発に焦点を合わせています。RPE細胞(RPE)は、通常、細胞懸濁液、自立性細胞シート、または人工担体によって支持された細胞単層の形態で網膜下腔に送達される3、16、17、18、19、20、21。細胞懸濁液の注入が最も簡単な方法ですが、BMの妥協した状態はしばしば移植細胞の付着を妨げる可能性があります。これは、RPEsの不正確な尖頭基底配向および単層の形成の失敗をもたらし得る22、23。他の2つの方法(すなわち、自己支持性細胞シートおよび人工基質によって支持された細胞単層)の主な利点は、細胞が網膜下腔24に直接移植されたときに既に分化した単層状態にあることである。
網膜下腔への細胞キャリアの送達を記述する多くの外科的技術が、近年公開されている8、9、10、11、12、13、14、15。これらの研究では、大眼動物モデルの使用、細胞キャリアの種類、移植細胞培養の使用、移植器具、および外科的技術が説明されており、著者は主に網膜下移植の結果に焦点を当てていました。2015年、Popelkaらは、ブタの死体の目へのRPEの移植にフレーム支持された極薄電界紡糸ポリマー膜の使用を報告しました8。細胞キャリアの網膜下移植を伴うここで説明する外科的手法は、キャリアの比較的正確な取り扱いおよび網膜下腔における足場の容易な位置決めを可能にした。Kozakらは、ブタの目で約2 mm x 5 mmのサイズのキャリアの送達技術の実現可能性を評価しました9。セルキャリアのユニークな設計により、正しい配置が可能になり、セルラー単層が折りたたまれてしわになるのを防ぎました6。Al-Nawaisehらは、ウサギへの網膜下足場移植に関する詳細な段階的ガイドラインを最初に提示した25。その後、Stanzelらは、2019年に小型げっ歯類、ウサギ、ブタ、および非ヒト霊長類への移植のための同様のプロトコルを発表しました26。以前に発表されたように、分化および分極されたRPE単層を固体担体に移植すると、他の送達技術と比較して、生存率が向上し、移植片のより良い統合がもたらされました(補足ファイル1)27。
in vivoで実施される前臨床動物研究の目的は、手順の安全性、移植された細胞の生存、網膜下操作に対する組織反応、および短期および長期の術後転帰に焦点を当てた、細胞キャリアの外科的経硝子体網膜下移植のさまざまな側面を明らかにすることです。大眼動物モデルとしてのブタの目の使用は、得られたデータの範囲に関して関連性があると報告されており、これは有用であり、ヒトに適用できる可能性がある10,11,14。私たちの研究は、大眼動物モデルにおける細胞キャリアのin vivo網膜下移植に使用される外科的技術を報告しています。術前準備,網膜下細胞キャリア移植術の手技,ミニブタ眼の術後ケアについて,過去8年間の経験をもとに詳述する.さまざまな種類の細胞や細胞キャリアの移植を含むin vivo実験研究に使用できる基本的な手術原理について説明します。
大型動物モデル
Liběchovミニブタの実験的な群れは、1967年に米国からホーメル株から5匹の動物を輸入することによって設立されました。これらの動物は、ブタの血液型研究のために、他のいくつかの品種または系統(ランドレース、ラージホワイト、コーンウォール、ベトナム豚、およびゲッティンゲン起源のミニチュア豚)と交配されました28,29。生後5か月、体重(BW)が約20 kgになると、ミニブタは性的成熟に達します。親のミニブタ品種(ホーメルとゲッティンゲン)の生存率は12〜20年と報告されています。細胞キャリアの網膜下移植は、網膜の中央部分を標的とする。ミニブタの網膜には黄斑と中心窩がありません。しかし、それは領域セントラリスおよび視覚縞30,31と呼ばれる高濃度の錐体光受容体の領域を有する。これらの領域は最高の視力の原因です。
手術は、経験豊富な外科施設助手(TA)の助けを借りて、4人の経験豊富な硝子体網膜外科医によって行われました。 in vivo 実験の前に、外科医は教育を受け、硝子体容積に対する水晶体の比率が低いこと、軸方向の長さが短い(15〜19 mm)、角膜にボーマン膜がないこと、硝子体容積が小さいこと(2.8〜3.2 mL)、黄斑と中心窩がないことなど、ミニブタの目の解剖学に関する特別な知識を得ました。 ジンの輪がないこと、および視神経乳頭の直径(垂直/水平:1.5 mm / 2.1 mm)。すべての場合において、手術は、標準的な無菌および消毒措置の実施を伴う特別に組織された手術室で全身麻酔下で行われた。
プロトコル
この研究は、ヘルシンキ宣言のガイドラインの信条と、人間を対象とする医学研究の倫理原則に準拠しています。すべての実験は、実験動物の世話と使用のためのガイドライン、および眼科および視覚研究における動物の使用に関する視覚眼科学研究協会(ARVO)に従って実施されました。研究プロトコルは、チェコ科学アカデミーの動物生理学および遺伝学研究所(チェコ共和国リビェホフ)の動物実験プロジェクトの承認のためにCASのリゾート専門家委員会によって承認されました(承認されたプロトコル番号60/2016および第64/2019)。
1. 担体上の細胞のミニブタへの網膜下移植時の考察
- 動物の選択
- 生後12〜36か月、性別を問わず、体重(BW)が約40〜80 kgのLiběchovミニブタを入手して使用します。
- ミニブタを、温度が18〜22°C、人工的な13時間/ 11時間の明暗サイクル、標準化された個々のペン、水への無料アクセス、および1日2回の給餌で、エアコン付きの動物小屋で屋内に保管してください。
- 手術前の準備
- 目の外科的向きを確認し、眼底スキームを描きます。そのためには、縦線のペンを使用して、眼底図のミニブタの網膜を側頭(視神経乳頭から耳に向かって)、鼻(視神経乳頭からブタの鼻に向かって)、および中央(鼻側の主要な網膜血管の間)領域に概略的に分割します(図1A、B)。
- 行動的および神経学的病理がなく、皮膚、体の開口部、糞便、および食物消費の質が正常な健康な動物のみを選択してください。熟練した獣医師に臨床観察を行ってもらい、動物を選択します。
- 手術当日に塩酸セフチオフル(1 mL / kg)の3 mg / kgBWを筋肉内注射します。.
- 術前免疫抑制
- タクロリムス溶出ポリマーミクロスフェアを改変してWangらおよびSevcら32,33に記載されているように調製する。
- ポリマーミクロスフェア中のタクロリムスの濃度がHPLC(材料表)によって決定されるように51.3 mg / gであることを確認してください。.
- 細胞移植片の拒絶反応を妨げるために、眼科手術の6日前にタクロリムスを装填したポリマーミクロスフェアを0.25 mg / kg BWの用量で皮下注射します。.これは、ミニブタの眼への異種移植中のヒトRPEドナー細胞の生存を確実にするために行われる。
- 手術当日に、体重に応じて80 mgのデポメドロールとベンジルペニシリンを1 mL / 10 kgで筋肉内注射します。.
- 麻酔
- 手術前に、チレタミン(2 mg / kg)、ゾラゼパム(2 mg / kg)、ケタミン(2 mg / kg)、およびキシラジン(0.4 mg / kg)-TKX34,35の混合物の筋肉内注射で全身麻酔を誘発します。.意識不明の状態と、ペダル反射(後脚の指間皮膚のつまみ)、角膜反射(角膜のわずかな接触)、瞳孔反射(光への反応)、眼瞼反射(まぶたへの接触)をチェックして、麻酔の深さを確認します。動物が点滅しないようにしてください。心臓と呼吸数の規則性を確認します。
- 麻酔導入後、鎮静動物をリフトトロリーで手術室に輸送する(図2A)。
- 動物を左側の手術台に置き、右目の手術を可能にします(図2B)。
- 発泡スチロールパッドを使用して動物の頭の調整を行い、移植に最適な中央網膜の位置(つまり、床に対して水平および平行)を実現します(図2C)。
- 0.5%塩酸プロパラカイン点眼液の点眼薬を結膜嚢に1分間隔で3回入れ、局所麻酔を誘発します。.
- 静脈カニューレを挿入し、患者モニターを備えた麻酔器を使用して麻酔(1.5%イソフルラン)の吸入維持のために気管内チューブで動物に挿管します(図2A、B)。
- 眼科手術開始の約15分前に、16 kg BWあたり1 mLのエフィカーと20 mgのデポメドロール1の筋肉内注射を投与します(材料表)。
- 動物を等温ホイルで覆うことによって生理学的体温を維持し、セクション3で説明されているように手術を行います。
- 手術中は、イヤークリップと患者モニターを使用して、心拍数と血中酸素飽和度とともに動物の体温を監視します。安全限界36と見なされる処置中の体温の38°C未満の低下は避けてください。実験全体を通して、酸素飽和度(>96%)と脈拍数(毎分70〜90拍)を維持します。
- 手術が完了したら、イソフルランの流れを止めて動物を抜管します。
- 自発呼吸と目覚めの後、動物をペンに移します。
- 手術室のセットアップ
- 大眼動物モデルの目の手術の必要性に応じて手術室を配置します(図3A、B)。外科医の椅子の高さと顕微鏡の高さを調整して、ブタの鼻の位置に関して外科医にとって快適な位置を実現します。
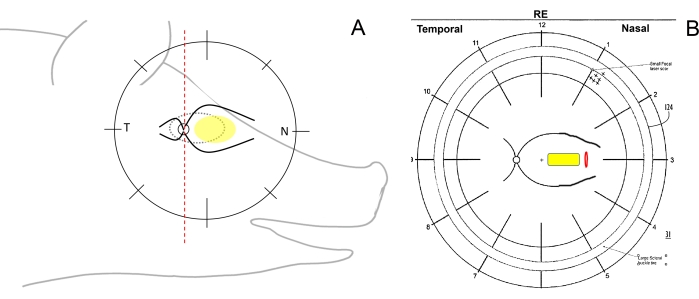
図1:ミニブタの網膜帯の模式図。 (A)ミニブタの頭部に対する網膜帯の模式図。黄色の楕円は網膜下移植の所望の領域を示し、Tは側頭網膜領域を指し、Nは鼻網膜領域を指す。(B)網膜切開術(赤)による細胞キャリア(黄色)の網膜下移植後の眼底スキームの例。この図の拡大版を表示するには、ここをクリックしてください。
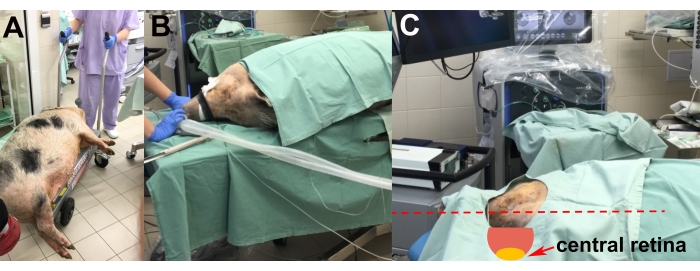
図2:動物の輸送と配置 。 (A)鎮静された動物の手術室への輸送。(B)挿管中の動物の配置。(C)手術中に中心網膜への最適なアクセスのための動物の頭部の調整(赤い矢印)。 この図の拡大版を表示するには、ここをクリックしてください。
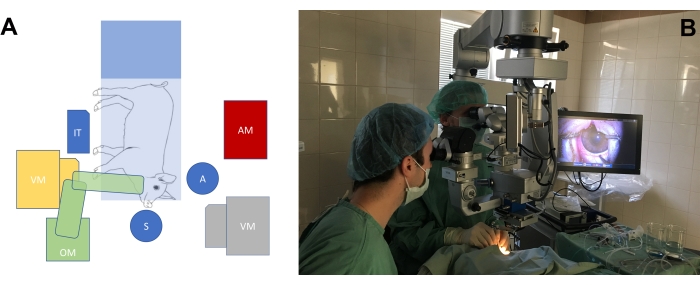
図3:標準的な手術室のセットアップ 。 (A)ミニブタ、手術顕微鏡(OM)、硝子体切除装置(VM)、器械台(IT)、麻酔器(AM)を備えた手術台の位置に対する外科医の位置(S =外科医、A =助手)の概略図。硝子体切除術機には2つの可能な位置(黄色と灰色)があります。(B)手術室での実際の設定。 この図の拡大版を表示するには、ここをクリックしてください。
2.細胞キャリア、培養細胞培養、および移植インジェクター
- セルキャリア
- 厚さ36μmのポリエチレンテレフタレート(PET)箔から、フレーム上に非対称に配置された三角形の突起を備えた、外形寸法1.7mm x 4.8mmの幅30μmの楕円形フレーム(図4A)を、フェムト秒レーザーを使用して切断します。
- 溶液1 gあたり2.2 μLのギ酸を添加して、ピリジン中のポリ(L-ラクチド-co-DL-ラクチド)(LLA/DLLA 90/10、MW 868、270 g / mol)ポリマー溶液を11 wt%の濃度で調製します。
- ポリマー溶液のエレクトロスピニングにより、支持フレームが埋め込まれたナノファイバー膜(図4B)を3つのステップ8で準備します:(1)シリコン基板上にナノファイバーの第1層を堆積し、(2)層上にフレームを配置し、(3)ナノファイバーの第2層を堆積します。
注:すべての層を7分間堆積させて、膜の総厚さ3.7μmに到達します。厚さ380 nmの繊維で構成され、平均孔径が0.4 μm、空隙率が約70%37のメンブレンを得るには、20 Gの全鋼針、電圧7.1 kV、ギャップ10 cm、流速250 μL/min、温度25.0 °C±0.5 °Cのパラメータを使用します。 - フレームが埋め込まれたメンブレンをシリコン基板から慎重に取り外し、元のメンブレンのない市販の12ウェル細胞培養インサートの本体に固定して、細胞の播種と成長を促進します。
- 細胞播種前にナノ繊維膜をプラズマ中で70Wの電力で30秒間プラズマクリーナーで処理します。
- 細胞担体上での培養に用いる細胞培養
注:以下の細胞担体を使用することができる:1)細胞を含まないナノ繊維状細胞担体。2)初代ヒトRPE(hRPE)を有するナノファイバー状細胞キャリア;3)ヒトiPS細胞由来RPE細胞を有するナノファイバー状細胞キャリア。- 初代hRPEの培養
- 初代hRPE細胞をヒトドナー眼から単離することは、既報の技術に従って38である。
- 網膜を30分間酵素処理して細胞を得る。その後、初代hRPE細胞(継代0)を、10%ウシ胎児血清(FBS)を添加したDMEM/F12中で最大2週間培養します。
- 細胞培養がコンフルエントに達したら、培地を1%FBSに変更し、さらに30日間培養します。
- 初代hRPEをトランスウェルプレート上およびラミニンコーティングされたナノファイバー状細胞担体上に2,000細胞/mm2の密度で播種します。1%FBSでさらに30日間インキュベートした後、ミニブタへの網膜下移植に一次hRPEを含む細胞キャリアを使用します。
- ヒトiPS細胞由来RPE
- CRISPR/Cas9システムを用いて2つの対立遺伝子で遺伝子補正されたMERTK関連網膜色素変性症患者由来の線維芽細胞39 由来のhiPSC(RP1-FiPS4F1-GC2)40、および対照として使用される健常者の線維芽細胞由来のhiPSC(Ctrl2-FiPS5F2)41 を使用します。
- 以前に報告されているようにRPE細胞(hiPSC-RPE)に向けて両方のhiPSC細胞株を生成し、続いて分化させる42。
- ノックアウトDMEM、20%ノックアウト血清、0.1 mM非必須アミノ酸、0.23 mM β-メルカプトエタノール、100 U/mLペニシリン、0.1 mg/mLストレプトマイシン、および10 mMニコチンアミドを含むRPE培地に、楕円形の移植フレームを備えたポリ(L-ラクチド-co-DL-ラクチド)のナノファイバー膜を備えたラミニンコーティング細胞培養インサートにhiPSC-RPEを200,000細胞/cm2 でプレートします。
- 1日おきに培地を交換し、移植前に2ヶ月間hiPSC-RPEを培養して分極増殖を促します。
- 埋め込み型インジェクター
- 外径1.75 mm/内径1.10 mmのプラスチックチューブからブロー成形により、断面2.8 mm x 0.8 mmの長方形のプラスチックキャピラリーを準備します。
- 端から4 mmのプラスチックキャピラリーで2.2 mm x 6 mmのローディングウィンドウを切り取ります。
- プラスチックキャピラリー、シリコンハンドル、スチールブレードプランジャー、およびピストンからインジェクターを組み立てます(図5A)。
- ローディングウィンドウを介してキャリアをインジェクターにロードし、後で手順3.5.2(図5B)で説明されているように、プランジャーを押して網膜下腔に排出します。
- ナノ繊維状担体の調製およびインジェクタの装填
- 小さなプラスチック製のペトリ皿に2 mLのリン酸緩衝生理食塩水(PBS)を入れます。準備した細胞層でインサートを取り出し、半柔らかいポリスチレン皿の上に置き、光学顕微鏡で中央に配置します。カスタム修正されたパンチを使用して、顕微鏡を使用して楕円形のフレームに沿ってキャリアを切り取ります。キャリアの寸法は2 mm x 5 mmです。
- キャリアを装填するために、平らな透明なチューブを備えたカスタムメイドのインジェクターを使用してください。キャピラリーの遠位端から6mmのところに、キャリアを装填するための窓がある。インジェクターのウィンドウをPBSで満たします。
- 鉗子を使用して、ディッシュの底からサンプルを放出し、液体から持ち上げ、最初にフレームの側面の向きマークを確認しながらインジェクターの窓に輸送し、接着細胞のあるキャリアの上面を検出します。楕円形のフレームは、キャリアの操作を容易にします。
- 歯科用プローブ(先端が鋭いステンレス鋼の歯科用器具)を使用して、キャリアをインジェクターの窓に配置します。プランジャーを使用して、キャリアをインジェクターの閉じた安全な上部に押し込みます。次に、手術のためにキャリアを準備します。
- 各ステップでキャリアの側面の向きを確認してください。金属プランジャーを押して、ナノファイバーキャリアをインジェクターからアンロードします。

図4:支持PETフレームが埋め込まれたナノ繊維キャリア。 (A)フレーム上の3つの目に見えるマークにより、キャリアの側面の向きを制御できます(白い矢印)。(b)細胞担体のナノ繊維膜に埋め込まれたPETフレーム断片の拡大図(白抜き矢印)。 この図の拡大版を表示するには、ここをクリックしてください。

図5:植込みインジェクター 。 (A)インジェクターの部品。(B)移植インジェクターのプラスチック長方形キャピラリーに装填された埋め込み支持PETフレームを備えたナノ繊維状細胞キャリア。 この図の拡大版を表示するには、ここをクリックしてください。
3.外科的処置
- 手術器具
- 次の手術機器を使用してください:眼科手術用顕微鏡、前眼部と後眼部の手術用のオペレーティングシステム、非接触硝子体網膜手術システム、レーザー光凝固装置、およびデジタルカメラ。
注:硝子体切除術、外焼灼および内視鏡、およびレーザー光凝固装置で使用される標準パラメータを 表1に示します。
- 次の手術機器を使用してください:眼科手術用顕微鏡、前眼部と後眼部の手術用のオペレーティングシステム、非接触硝子体網膜手術システム、レーザー光凝固装置、およびデジタルカメラ。
- 手術器具
- 再利用可能な手術器具は、標準的なプロトコルに従って、移動式オートクレーブ蒸気滅菌器または同様のもので滅菌します。手術中に必要な使い捨ての手術器具および材料は、 材料の表に記載されています。
- 手術ステップの準備
- ステップ1.4.1に記載されるように動物に麻酔をかけた後、薬物誘発散瞳を誘発する処置の15分前に結膜嚢に1%トロピカミド溶液点眼薬および10%塩酸フェニレフリン溶液を塗布する。
- 外科医を上の位置に、助手を横の位置にして手術台に近づきます(図3)。
- 使い捨てのシェービングカミソリで目元を剃り、ざらざらした汚れを取り除きます。
- 結膜嚢を5%ポビドンヨード溶液で5分間消毒する。
- まぶたから周辺までこすり洗いして、綿棒で眼窩周囲を消毒します。10%ポビドンヨード溶液を使用してこのプロセスを3回繰り返し、5分間そのままにします。
- 粘着性のある透明なホイルを備えた標準的な滅菌眼科用ドレープを使用して、中央の目で手術野を覆います。まつげをアイグローブから離します。術後の眼内炎のリスクを減らすためにまつげを切ることは避けてください。
- 蓋の検鏡(リーベルマンタイプまたはクックアイスペキュラム)を挿入します。必要に応じて、硝化膜を8-0で皮膚に固定しますポリグラクチン縫合糸。
- 外科用鉗子とウェストコット結膜ハサミを使用して強膜を露出させるために、リンバスから2 mmから3 mmの鼻側の結膜を開きます。
- 3バルブの25 Gトロカールをリンバスから2.5〜3 mm、パースプラナの領域に挿入します(7時、10時、11時に置きます)。挿入中は、後網膜に向かってわずかに斜め(100°〜110°)で回転運動を使用し、鉗子でトロカールを保持します(図6)。
- 浸透圧性角膜浮腫を防ぐために、手術中は角膜を濡らしておくか、メチルセルロースでコーティングしてください。
- 扁平硝子体切除術(PPV)
- 標準的な3ポートパープラナ硝子体切除アプローチで硝子体の中央部分を取り除きます。将来の大硬化切開術の領域でレンズの後ろの硝子体を慎重に取り除きます。
- 制御された後部硝子体剥離を行うために、硝子体内2〜4mgのトリアムシノロンアセトニド(TA)注射(50〜100μL)を使用して、通常は網膜に付着したままである後部硝子体を染色する。
- その後、0.05〜0.1 mLのBSSの網膜下注射をゆっくりと行い、41 Gのカニューレをより中央に行い、末梢に向かってブレブが形成されないようにします。
- 一過性の網膜血管閉塞を防ぐために、網膜下注射中に灌漑システムで眼圧設定を15mmHgまで下げます。.
- 鼻ブレブ基部の近くに27 Gのエンドジアテルミープローブを使用して、網膜の線形の大きなエンドジアテルミーを実行します。
- その後、25 G MVRブレードまたは垂直ハサミを使用して3 mmの大きな網膜切開を行い、灌漑システムの眼圧(IOP)設定を最大60 mmHgに3分間〜5分間上げます。網膜切開術による出血がないことを確認してから、IOPを25 mmHgに下げます。
- 強膜の表面に穏やかなタッチを適用することにより、27Gの内視鏡プローブを使用して、リンバスから2.5〜3 mmの2つの鼻トロカールの間の上膜血管のエキソジアテルミーを実行します。
- 強膜切開の拡大後、水分消費量が一時的に多いため、強膜切開を拡大する前に輸液ボトルの液面を確認してください。
- 2.75 mmのファコナイフを使用して、リンバスから3 mmのところに3.0 mmの大きな硬化性切開術を行います。
- 大強膜切開術内の強膜血管および毛様体からの出血の可能性に注意してください。出血の場合は、27 Gのエンドジアテルミープローブを使用して損傷した血管を凝固させます。インジェクターの先端(0.8 mm x 2.8 mm)を収容するために、サテンナイフで硬化切開術を3.0 mmに拡大します。
- 硝子体で大きな強膜切開部位の脱出した硝子体を取り除きます。地球儀の崩壊を避けるために硝子体切除術システムを使用してBSSの注入を25〜30 mmHgのレベルに維持します。
- 細胞担体の移植
- 利き手でインジェクターを大きな強膜切開術を通して硝子体腔にそっと挿入します。抵抗がある場合は、強膜切開のサイズを拡大します。
- 網膜切開術を通して細胞キャリアを網膜下腔に移植する。必要に応じて、移植の制御を改善するために、追加の硬化切開術とシャンデリアライトを備えたバイマニュアル技術を使用してください。
- インジェクターを目から引き出し、8-0で大硬化膜切開を閉じます眼内低張に関連する合併症を回避するためのポリグラクチン縫合糸。
- 完全な流体 - 空気交換(FAX)を行い、シリコンチップカニューレで網膜下液の排液を行います。
- その後、眼圧が正常になるまで、硝子体切除システムとシリコーンオイル注入用のチューブシステムを使用して、シリコーンオイル(1,000 cSt)を硝子体腔に注入します。
- 術中のイメージングとドキュメンテーション
- ビデオ録画システムを使用して、移植の重要なステップの写真文書化を使用して、手術全体を通してビデオ録画を実行します。
- 眼底採取スキーマを使用して、硬化切開、網膜切開術、網膜下インプラント、および発生した合併症の位置を文書化することにより、眼底図を完成させます。
- 手術後の手順
- 手術の終わりに、トロカールを取り除き、3つの硬化切開と結膜を8-0で閉じますポリグラクチン縫合糸。
- 結膜嚢を5%ポビドンヨード溶液ですすいでください。
- 20 mgのゲンタマイシン、2 mgのデキサメタゾン、および2%キシロカインの0.3 mL結膜下注射を行います。
- 眼底と水晶体の状態を顕微鏡で確認します。
- 外科用鉗子とウェストコット結膜はさみ(オプション)を使用して、乳炎膜から縫合糸を取り除きます。
- ネオマイシン軟膏またはオフロキサシン眼軟膏を結膜嚢に塗布する。
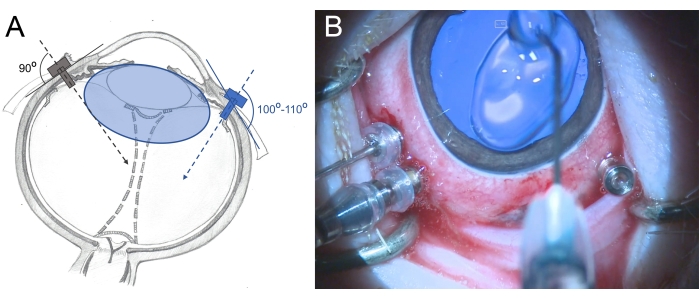
図6:ミニブタの目へのトロカールの挿入。 (A)水晶体の損傷を避けるために、ヒトの眼では硝子体腔の中心に向かって強膜に垂直に挿入され(灰色)、ミニブタの眼では後網膜に向かって斜めに挿入されるトロカールの概略図(青色)。ミニブタの水晶体(青色)は、ヒトのそれよりも大きく、硝子体腔のサイズに比べて大きい。(B)3ポートPPVに挿入されたトロカールの術中ビュー。角膜はメチルセルロースで覆われており、乾燥や腫れを防ぎます。 この図の拡大版を表示するには、ここをクリックしてください。
4.術後ケア
- 局所バシトラシン亜鉛/酢酸ヒドロコルチゾン/硫酸ネオマイシンまたは0.3%オフロキサシンを動物の結膜嚢に1日5回塗布します。.
- 術後、次の眼のパラメータを確認してください:触診を使用した眼の軟部組織の膨満、眼表面の炎症反応、およびハンドヘルドスリットランプまたは間接検眼鏡を使用したまぶたの保護反応としての斜視。
- 全身術後ケアには、以下の抗生物質を使用してください。
- 安定性の2日目と3日目に3 mg / kg BW(1 mL / kg)の用量で塩酸セフチオフルを筋肉内注射します。.
- 二次細菌感染の予防のために、術後72時間後にツラスロマイシン(1 mL / 40 kg BW)を注射します。.
- 痛みを防ぐために、フルニキシン(2 mL / 45 kgの生体重)と塩酸トラマドール(100 mg)を手術後3日間、24時間ごとに筋肉内注射を行います。.
- ミニブタは、18〜22°Cの温度範囲と人工的な13時間/ 11時間の明暗体制を備えた特殊な空調施設に保管してください。
- 彼らが水と標準的な給餌(1日2回)に自由にアクセスできるようにします。
5.術後処置
- 術後眼科検査
- 術後の期間に、間接検眼鏡で炎症の存在(すなわち、結膜嚢の発赤、組織の腫脹、または粘液の鬱血)を検査します。触診法を用いて手術眼の眼圧を測定します。
- 術後イメージング
- 眼底写真およびOCT検査の前にTKX混合物の筋肉内注射によってミニブタに鎮静を誘発する。散瞳を誘発するために、1%トロピカミドと10%塩酸フェニレフリン点眼薬をミニブタの結膜嚢に注入します。.
- 開いた目を維持するために蓋検鏡を使用します。目の表面に潤いを与え、鮮明なOCT画像を得るために、動物の角膜を生理食塩水(0.9%NaCl)で30〜60秒ごとに洗浄します。
- 手術中と同じ方法でミニピッグを手術台に置きます(図2B、C、図3A)。主な要件は、ヘッドをOCTデバイスのスキャンピースに対して垂直に側面に配置することです。動物の鼻の下に発泡スチロールのパッドを使用して頭を安定させ、目の表面を水平位置にします。
- カラー非散瞳眼底カメラでカラー眼底画像を収集すると、前眼部、網膜、視神経乳頭を記録できます。さらに、非散瞳眼底カメラで網膜の赤のない画像を撮ります。
- スペクトル領域OCTシステムを用いた光干渉断層撮影イメージングを行う。OCTまたは眼底イメージング中に、ミニブタの頭をOCTレンズまたは眼底カメラレンズに向かって手動で傾けて、後網膜の視野と移植領域を最適化します(図2C)。眼底に埋め込まれたキャリアを最適にイメージングするには、OCTデバイスの赤外線反射光をインプラントに焦点を合わせます(図2C)。OCT クロスラインおよび網膜マップ スキャン モードを使用します。
- 動物の眼の蓋の下に検査の最後にオフロキサシン眼科用軟膏を塗布する。
- ミニブタを屋内施設に移動し、鎮静が終了するまで(約2時間から5時間)その一般的な状態を観察します。
6.安楽死後の眼の摘出
- TKX混合物の筋肉内注射とそれに続く1%プロポフォール(20 mL /動物)の静脈内(22 G耳カニューレによる)ボーラス適用とそれに続く放血でミニブタを鎮静させます。.一般的な固定剤は使用しないでください。
- 細胞移植移植後7日、14日、28日、および42日の深部全身麻酔中に放血によって動物を屠殺する。
- 鉗子とはさみを使用して、上まぶたと下まぶたを取り外します。3番目のまぶたを外し、結膜を切ります。目の筋肉と視神経を切断します。
- 外科用ハサミと外科用鉗子を使用して死後に目を除核します。手順が経験豊富な人によって実行されることを確認してください。
結果
Liběchovミニブタにおける細胞キャリアの網膜下移植の結果を Table 2に示す。移植の成功は、組織学的および免疫組織化学的研究に十分なデータを得ることと定義した。失敗した症例は、重度の術中合併症を伴う眼と定義され、眼組織のさらなる観察は不可能でした。
提案技術をシリコーンオイルタンポナーデを用いて適用することで、術後翌日から除核時までの画像診断法を用いて網膜下移植の状態を制御することができる(図7、図8、図9)。
眼底イメージングとSD-OCT
ミニブタは、眼底イメージング、レッドフリーイメージング、およびスペクトルドメイン光コヒーレントトモグラフィーを使用して術後期間に検査されました(図7)。透明なレンズとシリコーンオイルタンポナーデの使用を含む透明な光学媒体を使用することにより、高品質の眼底イメージングが可能になりました(図7A)。網膜切開部位は増殖反応の徴候を示さず(図7A、黄色矢印)、細胞キャリアのPTEフレームはブタ網膜の半透明層を通してはっきりと見えた。赤を含まないイメージングでは、キャリア上で培養されたhRPEの反射率は、内因性ブタRPE層の反射率と異ならなかった(図7B)。SD-OCTでは、PTEフレームは、下にある解剖学的構造のわずかな影と網膜のわずかな肥厚を引き起こしました(図7C、赤い矢印)。SD-OCTには非定型の低反射帯や過反射帯は見られず、ブルッフの膜も損傷を受けていないように見えた。図8は、手術後1ヶ月の初代ヒトRPE細胞で培養した足場の眼底画像とiOCT画像を示しています(図8)。細胞キャリア自体(細胞なし)は、網膜の厚さの有意な増加を引き起こさなかった(図9C)。以上の結果から,移植による術中の医原性影響は軽微であり,移植した細胞キャリアは,移植した細胞がその上にある視細胞細胞および神経網膜組織に十分適応していることが示唆された。
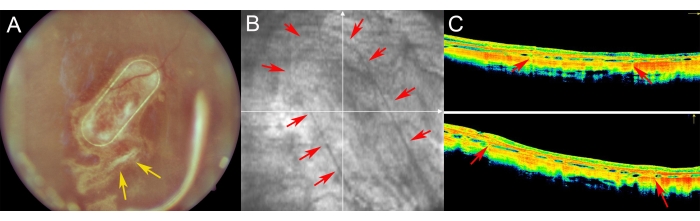
図7:ミニブタにおける網膜の術後イメージング 。 (A)眼底イメージング、(B)赤色フリー画像、および(C)ミニブタ眼における網膜下移植後1週間のフォローアップにおける初代ヒトRPE細胞によるナノファイバー状キャリアの光干渉断層撮影イメージング。(A)黄色の矢印は網膜切開部位を示す。(B)赤い矢印は、ナノ繊維状細胞担体の縁を示す。(C)赤い矢印は、網膜下腔に移植されたナノ繊維状担体の支持PETフレームによって引き起こされるOCTシグナルのわずかな影を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
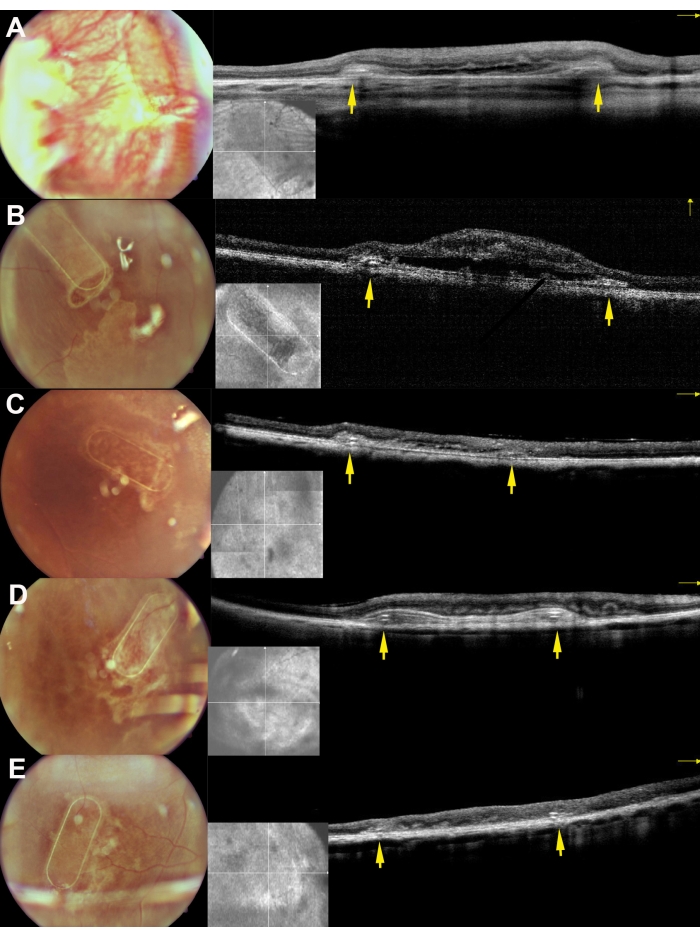
図8:ミニブタへの網膜下移植後30日目の足場の眼底画像とiOCT画像。 A、 B、 C、 D、およびEは、それぞれブタ169 、 182、179、199、および224に対応する。黄色の矢印は、足場のフレームを表しています。 この図の拡大版を表示するには、ここをクリックしてください。
組織学的および免疫組織化学的分析
動物の安楽死後、ミニブタの眼全体を取り除き、4%パラホルムアルデヒド(PFA)に24時間固定した。眼の前部を摘出し、鼻中央網膜に移植したナノ線維性キャリアを同定し、強膜を付着させて単離した。すべての組織を段階的スクロース溶液中で凍結保護し、そして詳細に説明するように垂直凍結切片を切断した43。移植の4週間後にRPE細胞を伴わないナノ線維膜の組織像は、炎症および変性変化を伴わない網膜を明らかにした(図9A)。ナノ繊維膜の存在を偏光で検出した(図9B)。
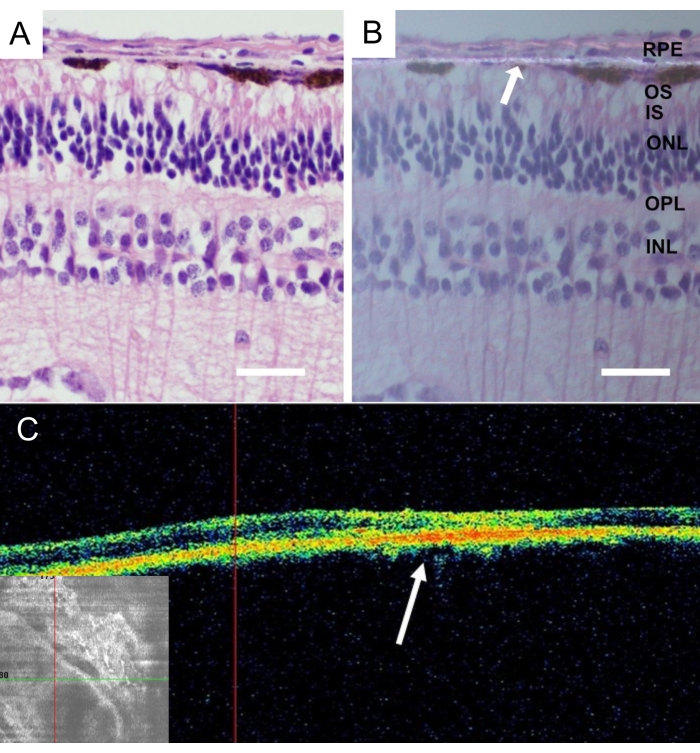
図9:移植した無細胞ナノファイバー膜の組織学的解析。 移植後4週間の無細胞ナノファイバー膜のヘマトキシリン-エオジン染色(A)標準照明および(B)偏光顕微鏡による染色。白い矢印はナノ繊維膜の局在を示す(スケールバー:50μm)。(c)移植後4週間後の無細胞ナノ線維膜の in vivo 光干渉断層撮影写真は、網膜下腔におけるナノ線維膜の良好な受容および接着を描写する。白い矢印は、網膜の断面画像におけるインプラントの位置を示す。 この図の拡大版を表示するには、ここをクリックしてください。
図10は、ミニブタ眼におけるナノファイバー状担体(黄色矢印)上に移植された初代hRPE細胞を含む網膜領域のヘマトキシリン-エオジン(H&E)染色を示す。移植された一次hRPEの色素沈着した外観は、連続的でありながら不規則な色素層を形成しました(図10、赤い矢印)。より長い観察期間(6週間)の後、インプラントの下の神経網膜は、おそらく医原性操作の結果として、網膜切開部位の周囲にロゼット様または肥大性反応のような外観を示しました。これらの形態学的結果はSD-OCTの所見に匹敵し、網膜組織に対するキャリア送達の影響が最小限であるという証拠を支持しています。
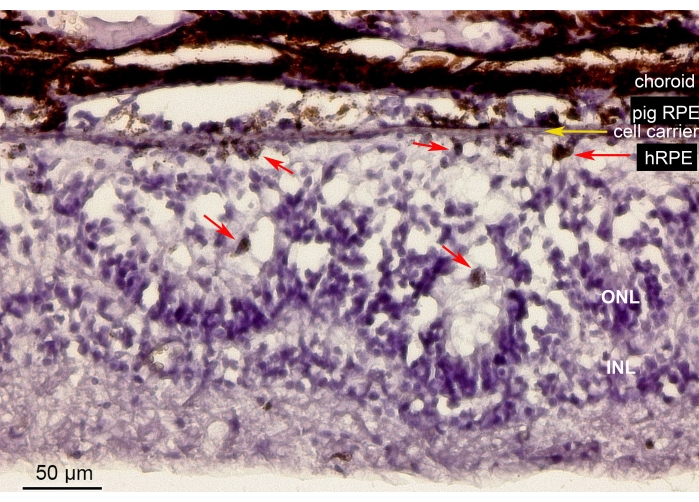
図10:一次hRPEを移植したナノファイバー膜の組織学的解析。 ミニブタ眼における一次hRPEによる移植されたナノ線維性キャリア(黄色矢印)を含む網膜領域のヘマトキシリン-エオジン染色。動物を安楽死させ、移植後6週間で分析した。一次hRPEは、その大きさ、丸い形状、および光受容体の反対側の網膜下腔の色素沈着(赤い矢印)によって明確に区別できました。ONLの視細胞核はロゼット様構造を構築します。網膜下腔は肥大しているように見えます。略語:hRPE =初代ヒト網膜色素性上皮、ONL =外顆粒層、INL =内顆粒層。 この図の拡大版を表示するには、ここをクリックしてください。
免疫染色は、2段階間接法を採用して行った。切片を、モノクローナル一次抗体であるCRALBP中で室温で一晩、1:100の希釈でインキュベートした。免疫蛍光は、Alexa Fluor 488結合二次抗体を用いて行った。
移植された初代hRPEは移植領域に存在し、内因性ミニブタRPE細胞と同様の典型的なRPE CRALBPマーカーを発現しました(図11A)。対照的に、移植された細胞の形態は、移植後に単層形状をとらないように見えたが、定義された網膜下腔内に局在したままであった(図11A、B、白矢印)。次のRPE/網膜マーカーと形態学的外観は、移植後6週間後も陽性のままでした:色素/メラニン顆粒の存在、桿体双極(PKC-α)および錐体光受容体(PNA)の末期網膜特異的ニューロンマーカー、およびGFAP陽性-ミクログリア活性化の兆候。
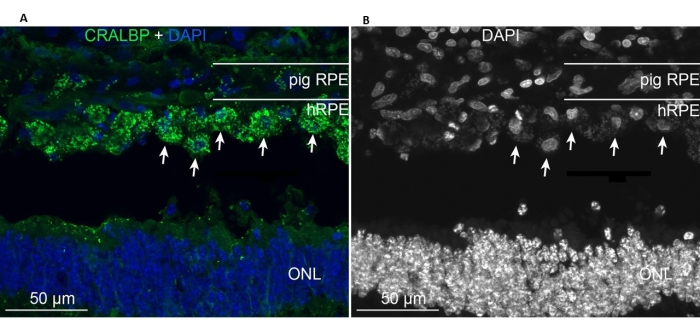
図11:初代hRPEの移植後6ヶ月のミニブタにおけるRPE細胞マーカーCRALBP(細胞レチンアルデヒド結合タンパク質)による免疫標識 。 (A)処理したブタ眼の垂直凍結切片をCRALBPモノクローナル抗体(緑色)で免疫標識し、DAPI(青色)で対比染色した。(B)DAPIによる細胞核標識の白黒の単一描写、高コントラストは個々のhRPE細胞の丸い形状を明らかにする(一部は白い矢印で示されている)。略語:hRPE =ヒト網膜色素上皮、ONL =外顆粒層。 この図の拡大版を表示するには、ここをクリックしてください。
眼の合併症
合計で、29のうち27(93.1%)が操作を正常に実行しました。「手術の成功」という定義は、組織学的および免疫組織化学的研究に影響を与える可能性のある核出時まで、手術眼が臨床的に有意な術後合併症を示さなかった場合に適用された。光学媒体の透明度の低下は、4例(13.7%)で術後イメージングに影響を与えました。それにもかかわらず、これらの眼は、さらなる組織学的および免疫組織化学的分析で処理された。
術中末梢網膜剥離は4例(13.8%)であった。2つのケースでは、流体 - ガス交換中の網膜下液の吸引および剥離領域における網膜のレーザー光凝固の適用によって管理された。他の2例(6.9%)では、網膜剥離は網膜および網膜下出血の大量出血と関連しており、細胞キャリアの移植が不可能になり、手術の終了と手術台上のミニブタの即時安楽死につながりました。
| いいえ | パラメーター | 標準で使用される設定 |
| 1 | 硝子体切除速度(切断率) | 最大20,000カット/分 |
| 2 | ベンチュリポンプ | 50〜180ミリメートルHg |
| 3 | 立ち上がり時間 | 1秒 |
| 4 | 灌漑圧力 | 18〜25ミリメートルHg |
| 5 | 空気注入圧力 | 20〜25ミリメートルHg |
| 6 | バイポーラエキソジアテルミー | 18-26% |
| 7 | モノポーラエンドジアテルミー | 16-18% |
| 8 | 網膜のレーザー光凝固、532 nm | パワー100-150 mW |
| 間隔 100 ミリ秒 | ||
| 期間 100 ミリ秒 |
表 1: 硝子体切除術およびレーザー光凝固中に使用される標準パラメータ。
| 総動物数、n | 18 |
| 総目、n | 36 |
| 手術眼、n | 29 |
| 成功した移植、n | 27 |
| 失敗したケース、n | 2 |
| 平均手術時間、分 | 57 |
| 成功率、% | 93.1 |
表 2: 2016年から2020年までのLiběchovミニブタにおける細胞キャリアの網膜下移植による標準化された外科的技術の結果。
補足ファイル1: 細胞キャリアへのRPE細胞の網膜下移植に特化した研究の要約。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
異なる起源を有するRPE細胞の網膜下移植は、AMD 3,4,8,9,10,11,12,13,14,15,25などの網膜変性疾患の治療のための眼科研究における非常に有望な傾向である.このアプローチの主なアイデアは、損傷したRPEをex vivoで培養された健康なRPEで置き換えることです(補足ファイル1)44、45、46、47、48。培養したRPE細胞を移植するための細胞キャリアの使用は、多孔質膜が偏光RPE細胞層を光感覚層に対して正しい方向に維持するため、最も合理的なアプローチです。
最適動物モデル
このような治療アプローチを開発する上で重要なステップは、最適な動物モデル49の使用である。過去には、ウサギ、イヌ、ブタ、および非ヒト霊長類を含む小型および大型動物モデルが使用されてきた8、9、10、11、12、13、14、15、27、29。この論文では、Liběchovミニブタモデルの使用を提案し、堅牢な移植効果を可能にする術前、外科的、および術後のステップについて説明します。Liběchovミニブタはもともと約20年前に飼育され、パーキンソン病やハンチントン病などの神経変性疾患の分野で生物医学研究で頻繁に使用されてきました29,50。ブタはヒトと同様の血液供給と免疫学的応答を持つ比較的大きな脳を持っているため、同種移植実験の動物モデルとしても使用されています51,52,53,54。ミニブタの網膜は、ヒトのような黄斑および中心窩を有していないが、高濃度の錐体光受容体30を有する網膜の領域である領域中心筋および視覚筋を含む。人間の目と同様のサイズ、錐体が豊富な中枢網膜の存在、よく説明されている免疫系、および手術後の形態と機能を評価する方法の存在は、提示された研究でこの大型動物モデルを使用するための重要な議論です。
手術
我々の知る限り、担体上のRPE細胞の硝子体網膜移植のための標準化され広く受け入れられている外科的技術はありません。細胞補充療法の重要な課題の1つは、網膜剥離、低張、強膜上膜、脈絡膜、および/または網膜出血に関連する術中および術後の合併症のリスクを伴う困難な手術技術であり、足場損傷につながる可能性があります。術後、増殖性硝子体網膜症、眼内炎、低張、網膜剥離、白内障形成のリスクがあります4,10,13,14,15。
細胞キャリアを使用するアプローチに関する最初の研究は、チンチラ野郎ウサギで行われました13、16、25。これらの動物は小動物モデルであるが、手術の技術的側面に焦点を当てた結果は、大型動物モデルにおける手技の開発において重要であるため、以下に要約する。
ジェット気流をリダイレクトするために、カスタムメイドの23 G注入カニューレが最初に2つのサイドポートで使用され、ブレブの崩壊とその結果としての網膜剥離を解決するのに役立ちました13。本研究では、このようなブレブの崩壊は認められなかった。その理由として考えられるのは、眼球のサイズが大きく、カニューレ注入部位の末梢に硝子体を温存したコア硝子体切除術のパフォーマンスであり、指向性ジェット気流の力を低下させる可能性があります。
器具からの細胞キャリアの排出中の困難は、「器具に閉じ込められた」と分類された小動物モデルにおける別の術中の障害でした。さらに、著者らは、網膜表面に硝子体が残っているため、移植後に網膜切開口からキャリアが後方に「ジャンプ」する可能性があることを示唆しています。この問題は、網膜下腔への細胞キャリアのスムーズで連続的な排出を可能にする酵素支援硝子体切除術で解決できます。ほとんどの場合、著者らは、網膜切開術から離れたインプラントのより遠い位置を取得するためにキャリアを再配置した。私たちのケースシリーズでは、セルキャリアがインジェクターの先端に取り付けられたままになる状況も経験しました。しかし、それはライトパイプとインジェクターの先端をゆっくりと穏やかに操作することによって管理されていました。いずれの症例においても網膜切開部位に硝子体の残存は認められなかった.手術におけるTA支援PPVの使用は、硝子体の残留付着のリスクを低減する方法として提案できます。TAによる多重染色は、上にある硝子体を完全に除去するために必要であり得る。
別の研究では、ポリエステル膜上に偏光細胞単層として増殖したヒトRPE幹細胞の網膜下移植の結果が報告された24。実験中、前述の同じ外科的手法が使用されましたが13、2ポートPPVアプローチが適用されました。最後に、ウサギにおける細胞キャリア手術の網膜下移植のための段階的なプロトコルがその後発表されました25。この研究は、以前の経験にも基づいた術前および術後のケアを含む、外科的処置の非常に詳細で簡単に再現可能な説明を提示します。
その後の研究では、大型動物モデルの使用中に、技術的な質問だけでなく、移植細胞に対する免疫反応に関する質問、および細胞キャリアのサイズに関連する問題も取り上げられました。カニクイザル(Macaca fascicularis)を用いた研究は、ヒト幹細胞由来RPE単層の網膜下移植の結果を記載した15。すべての動物は、手術の7日前から手術後3か月間続くシロリムス(負荷用量2 mg、1日用量1 mg)とテトラサイクリン(7.5 mg / kg-BW )からなる全身免疫抑制を受けました。外科的処置は、前述のプロトコール24、25に従って実施した。著者らは、シャンデリアエンドイルミネーションを備えた25Gの3ポートPPVアプローチを使用しました。重要なことに、TA支援PVDを使用して、後網膜上の硝子体網膜癒着を除外しました。最初に説明した手順に加えて、著者らは、20 Gのカスタムメイドの拡張可能なループ機器を使用して、将来の移植の領域でホストRPE層を除去しました。
私たちのミニブタの研究では、全身免疫抑制も使用しました。しかしながら、免疫抑制の種類は上記のものとは異なる。タクロリムス溶出ポリマーミクロスフェアをデポーとして0.25 mg/kg BWの用量で皮下注射し、細胞移植片拒絶反応と炎症反応を抑制しました。手術中に宿主RPE細胞層を除去しなかったのは、主な目的は移植された細胞の安全性と生存率を分析することであり、宿主網膜への組み込みを分析することではなかったためです。
これまで、折り畳み式の非分解性メッシュ支持サブミクロンパリレンC膜(6.25 mm x 3.5 mm、厚さ0.4 μm)にhESC由来のRPEの単層を網膜下移植することの安全性と実現可能性を、ユカタン州の雌ミニブタ14頭で評価しました10。培養後、細胞をメッシュ支持膜上に播種した。免疫抑制は、タクロリムスの全身投与(レジームおよび用量は示されていない)および手術終了時の0.7mgのデキサメタゾンインプラントの硝子体内注射を用いて行われた。PPVは20Gアプローチで実施されました。著者らは、硝子体のより良い視覚化のためにトリアムシノロンアセトノイドの硝子体内注射を使用しました。大硬化切開術は2mmから3mmの大きさであった。網膜下注射後、網膜をペルフルオロカーボン液の一時的な注入で平らにした。流体-空気交換後、シリコーンオイルタンポナーデ(1,000/5,000 cSt)を実施した。術後ケアには、術後1週間のデキサメタゾン/ネオマイシン/ポリミキシンB軟膏の眼内塗布が含まれていました。著者らは、91%の成功率(すなわち、効率的な網膜下移植および十分な術後画像データ)を報告した。本研究では,TA結晶の硝子体内注射を術中,主に硝子体の可視化に用いた.しかしながら、この薬物の局所免疫抑制作用は不明のままである。本研究で用いたナノファイバー状細胞担体は、厚さ5.2 mm x 2.1 mm、厚さ3.7 μm、孔径0.4 μmであった。手術中はパーフルオロカーボン液を注入する代わりに直接FAXを施行した.私たちの外科的成功率(93.1%)は、Kossらのそれと一致し、わずかに優れていました10。
網膜下移植のための完全分解性細胞キャリア(足場)の網膜下移植は、2019年にヨークシャーブタで最初に研究されました14。この研究は主にフィブリンヒドロゲルインプラントの生分解性特性に焦点を当てていました。著者らは、家畜豚に使用された積極的な免疫抑制が、フィブリンヒドロゲルインプラントの生分解中に引き起こされる可能性のある局所炎症反応を阻害する可能性があると指摘した。しかし、彼らはブタに使用される免疫抑制療法を特定しなかった。PPVでは、網膜下移植装置を辺縁部と平行に約3.5mm後方に挿入するために、長さ3.6mmの強膜切開術を行った。さらに、指の操作によって引き起こされる手の配置の不安定さを軽減することを目的とした空気圧駆動の噴射システムを使用しました。私たちのケースシリーズでは、すべての硬化切開は辺縁部から2.5mmから3.0mmでした。インジェクター挿入のための大硬化切開術は3mmの長さであった。本研究で使用した植込みインジェクターは手で操作した。毛様体扁平骨の徹底的な焼灼と大硬化切開術内の十分な切断は、医原性末梢網膜剥離、出血、インプラントの喪失などの術中合併症を回避するために重要であると考えられています。
要約すると、遺伝性および後天性網膜疾患の治療選択肢として、生分解性担体へのRPE細胞の移植のためのLiběchovミニブタモデルの使用について説明します。眼の解剖学および生理学、ならびに免疫系に関する類似性により、ヒトの眼疾患の治療に容易に移行することができる細胞の網膜下移植のための外科的技術および器具を開発し改善することができる。ミニブタの手術は、人間の手術で利用する場合、同じ器具(着床送達ツールを含む)を使用して行われるようにし、得られた経験とノウハウを人間に適用しやすくすることが重要です。非ヒト霊長類などの黄斑領域が存在する代替の大眼動物モデルは、網膜中央領域への網膜下移植後の解剖学的および機能的変化の追跡および分析に役立つ可能性があります。術前、外科、および術後のケア手順の詳細な説明は、効率的で標準化されたデータ生成を増やすことにより、将来の研究に役立ちます。
開示事項
何一つ。
謝辞
このプロジェクトは、チェコ科学財団(プロジェクト番号18-04393S)とチェコ共和国のノルウェー助成金技術庁(KAPPAプログラム、プロジェクト番号TO01000107)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Technical equipment | |||
| Wato EX-65 with a Mindray iMEC10 | Mindray, Shenzhen, China | Wato Ex-65 | anesthesia machine |
| R-Evolution CR | Optikon, Rome, Italy | R-Evolution CR | phacoemulsifier/vitrectome |
| Green laser Merilas 532α | Meridian, Thun, Switzerland | Merilas 532α | ophthalmic green laser |
| Microscope Hi-R NEO 900A | Haag-Streit Surgical, Wedel, Germany) | Hi-R NEO 900A | ophthalmic surgery microscope |
| Camera Sony PMW-10MD | Sony, Tokyo, Japan | PMW-10MD | full HD medical 2-piece |
| Non-contact vitreoretinal surgical system MERLIN BIOM | Volk, Mentor, OH, USA | MERLIN BIOM | BIOM |
| Steam sterilizer | Tuttnauer Europe B.V., Breda, NL | 3870 HSG | sterilizer |
| iCam100 | Optovue, Fremont, CA, USA | iCAM100 | funduscamera |
| iVue OCT100-2 | Optovue, Fremont, CA, USA | iVue OCT100-2 | OCT |
| Microsurgical instruments and devices | |||
| Cook Eye Speculum | Katena, New Jersey, US | K1-5403 | 15mm blades |
| Ophthalmology surgical drape | Hylyard, Alpharetta, Georgie, USA | 79304 | 132 x 142cm |
| Disposable Two step vitrectomy system. (23 gauge/ 0.6 mm) | DORC, Zuidland, Netherlands | 1272.ED06 | |
| Infusion line for 23G / 0.6 mm infusion cannula | DORC, Zuidland, Netherlands | 1279.P | |
| knife 2.75mm, IQ Geometry Tm Slit Knife Angled, Bevel Up | Surgical Specialties Corporation, Reading, USA | 72-2761G | |
| Extendible 41G subretinal injection needle. (23 gauge / 0.6 mm) | DORC, Zuidland, Netherlands | 1270.EXT | |
| Omnifix 3ml Luer Lock Solo siringe | BBraun, Melsungen, Germany | 4617022V | 3ml |
| 1ml soft-inject Tuberculin | Henke Sass Wolf, Tuttlingen, Germany | 5010.200V0 | 1ml |
| 8-0 Coated Vicryl | Ethicon, Puerto Rico, USA | J409G | |
| Purified Silicone Oil (in syringe) 10 ml | (FCI, Paris, France) | S5.7170 | 1000cSt |
| Pinnacle 360 Morris Vertical Scissors 23Ga | Synergetics, O'Fallon, USA | 10.24.23PIN | 23Ga |
| Revolution DSP 23Ga ILM forceps | Alcon, Geneva, Switzerland | 706.44 | Griesharber revolution |
| 23ga Straight Laser Probe | Synergetics, O’Fallon, USA | 55.21.23 | |
| FCI Protect 2.0% | FCI Ophthalmics, Paris, France | S5.9100 | viscoelastic |
| DK Westcott style Stitch Scissors, Curve | Duckworth & Kent, Hertfordshire, England | 1-501 | Curve |
| Pierse Notched Forceps, 0,3mm Straigh | Duckworth & Kent, Hertfordshire, England | 2-100-1E | 0,3mm straigh |
| DK Harms-Tubingen Straight Tying Forceps | Duckworth & Kent, Hertfordshire, England | 2-504E | 6mm |
| DK Needle Holder, Straigh | Duckworth & Kent, Hertfordshire, England | 3-201 | 9mm straigh |
| Medications and solutions | |||
| Unitropic 1% gtt. | UNIMED PHARMA spol. s r.o., Bratislava, Slovak republic | tropicamidum 10 mg/ml | eye drops |
| Diprophos | Merck Sharp & Dohme B.V., Haarlem, Netherlands | betamethasonum 7 mg/ml | 1ml |
| Alcon BSS Irrigation Solution | Alcon, Geneva, Switzerland | balance salt solution (BSS) | 500ml |
| Betaisodona | Mundipharma, Cambridge, United Kingdom | povidon-Iodine 1g/10ml | 30ml |
| Depo-medrol 120mg | Pfizer, New Yourk, USA | methylprednisolon | 5ml/200mg |
| Shotapen | Virbac Carros Cedex, France | benzylpenicillin, dihydrostreptomycin | 250ml |
| Flunixin a.u.v. | Norbrook, Newry, Northern Ireland | flunixinum 50,0 mg | 250ml |
| Tramal 100MG/2ML | Stada Arzneimittel AG, Bad Vilbel, Deutschland | tramadol | 2ml |
| Zoletil 100 | Virbac Carros Cedex, France | tiletamine, zolazepam | 100mg |
| Narkeran 10 | Vetoquinol, Magny-Vernois, France | ketamin | 2ml |
| Rometar 20mg/ml | Spofa pharmaceutica, Prague, Czech republic | xylazinum | 20mg |
| Braunol 75mg/g | B.Braun medical, Prague, Czech republic | povidone iodine | 75mg/g |
| Propofol 1% MCT/LCT | Fresenius Kabi, Bad Homburg, Deutschland | propofol | 10mg/1ml |
| Isoflurane 100% Inhalation vapour, liquid | Piramal Critical Care Limited, West Drayton, United Kingdom | isoflurane | 100% |
| Benoxi gtt. 4mg/1ml | Unimed pharma, Bratislava, Slovakia | oxybuprakaine | 10ml |
| Neosynephrin POS 10% gtt. | Ursapharm , Saarbrücken, Deutschland | fenylefrin chloride | 10ml |
| Ophthalmo-framykoin 1X5GM | Zentiva a.s., Prague, Czech republic | bacitracin zinc/hydrocortisone acetate/hydrocortisoneacetate/neomycin sulfate | 5mg |
| Floxal ung. | Dr. Gerhard Mann Chem.-Pharm. Fabrik, Berlin, Germany | ofloxacin | 0.30% |
| Eficur inj. | Hipra, Amer, Spain | ceftiofurum hydrochloridum | 50mg / 1ml |
| Draxxin | Zoetis Inc., New Jersey, USA | tulathromycinum | 100mg / 1ml |
| Tramal | Stada Arzneimittel AG, Bad Vilbel, Deutschland | tramadoli hydrochloridum | 100mg / 2ml |
| Xylapan | Vetoquinol, Magny-Vernois, France | xylazinum | 0.4 mg/kg |
| Proparacaine hydrochlorid ophthalmic solution 0,5% | Bausch&Lomb Incorporated Tampa, FL, USA | Proparacaine hydrochlorid | 0.50% |
| Prograf | Astellas Pharma, Deerfield, Illinois, USA | Tacrolimus powder | 1mg |
| Cell carrier, cultivated cells cultures, and implantation injector | |||
| Falcon Cell Culture Inserts | Corning Inc., Kenneburg, ME, USA | 353103 | |
| TrypLE Express Enzyme (1X) | Thermo Fisher Scientific, MA, USA | 12604021 | |
| DMEM/F-12 | Thermo Fisher Scientific, MA, USA | 11320033 | |
| Biolaminin 521 LN (LN521) | BioLamina, Sundbyberg, Sweden | LN521-02 | |
| GlutaMAX Supplement | Thermo Fisher Scientific, MA, USA | 35050061 | |
| 2-Mercaptoethanol | Thermo Fisher Scientific, MA, USA | J66742.0B | |
| Penicillin-Streptomycin | Sigma-Aldrich, San Luis, Mi, USA | P4333 | |
| CRALBP | Novus Biologicals, Abingdon, UK | NB100-74392 | |
| Alexa Fluor 488 | Thermo Fisher Scientific, Germany | 21202 |
参考文献
- Pascolini, D., Mariotti, S. P. Global estimates of visual impairment: 2010. British Journal of Ophthalmology. 96 (5), 614-618 (2011).
- Bressler, N. M., Bressler, S. B., Fine, S. L. Age-related macular degeneration. Survey of Ophthalmology. 32 (6), 375-413 (1988).
- Binder, S., Stanzel, B. V., Krebs, I., Glittenberg, C. Transplantation of the RPE in AMD. Progress in Retinal and Eye Research. 26 (5), 516-554 (2007).
- Mano, F., et al. Methodological approach to improve surgical outcomes of a pig subretinal implantation model. Translational Vision Science & Technology. 11 (4), 24 (2022).
- Ramsden, C. M., et al. Stem cells in retinal regeneration: Past, present and future. Development. 140 (12), 2576-2585 (2013).
- Carr, A. -. J. F., et al. Development of human embryonic stem cell therapies for age-related macular degeneration. Trends in Neurosciences. 36 (7), 385-395 (2013).
- Tezel, T. H., Kaplan, H. J., Del Priore, L. V. Fate of human retinal pigment epithelial cells seeded onto layers of human Bruch's membrane. Investigative Ophthalmology & Visual Science. 40 (2), 467-476 (1999).
- Popelka, S., et al. A frame-supported ultrathin electrospun polymer membrane for transplantation of retinal pigment epithelial cells. Biomedical Materials. 10 (4), 045022 (2015).
- Kozak, I., et al. Safety and feasibility of new nanofiber subretinal delivery system with injector for RPE cell transplantation. Investigative Ophthalmology & Visual Science. 59 (9), 5670 (2018).
- Koss, M. J., et al. Subretinal implantation of a monolayer of human embryonic stem cell-derived retinal pigment epithelium: a feasibility and safety study in Yucatan minipigs. Graefe's Archive for Clinical and Experimental Ophthalmology = Albrecht von Graefes Archiv fur Klinische und Experimentelle Ophthalmologie. 254 (8), 1553-1565 (2016).
- Ghosh, F., Wong, F., Johansson, K., Bruun, A., Petters, R. M. Transplantation of full-thickness retina in the rhodopsin transgenic pig. Retina. 24 (1), 98-109 (2004).
- Christiansen, A. T., et al. Subretinal implantation of electrospun, short nanowire, and smooth poly(epsilon-caprolactone) scaffolds to the subretinal space of porcine eyes. Stem Cells International. 2012, 454295 (2012).
- Stanzel, B. V., et al. Subretinal delivery of ultrathin rigid-elastic cell carriers using a metallic shooter instrument and biodegradable hydrogel encapsulation. Investigative Ophthalmology & Visual Science. 53 (1), 490-500 (2012).
- Gandhi, J. K., et al. Fibrin hydrogels are safe, degradable scaffolds for sub-retinal implantation. PloS One. 15 (1), 0227641 (2020).
- Liu, Z., et al. Surgical transplantation of human RPE stem cell-derived RPE monolayers into non-human primates with immunosuppression. Stem Cell Reports. 16 (2), 237-251 (2021).
- Mandai, M., et al. Autologous induced stem-cell-derived retinal cells for macular degeneration. New England Journal of Medicine. 376 (11), 1038-1046 (2017).
- Schwartz, S. D., et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: Follow-up of two open-label phase 1/2 studies. Lancet. 385 (9967), 509-516 (2015).
- Kashani, A. H., et al. Surgical method for implantation of a biosynthetic retinal pigment epithelium monolayer for geographic atrophy: Experience from a phase 1/2a study. Ophthalmology Retina. 4 (3), 264-273 (2020).
- Kashani, A. H., et al. Subretinal implantation of a human embryonic stem cell-derived retinal pigment epithelium monolayer in a porcine model. Advances in Experimental Medicine and Biology. 1185, 569-574 (2019).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), 4097 (2018).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Diniz, B., et al. Subretinal implantation of retinal pigment epithelial cells derived from human embryonic stem cells: Improved survival when implanted as a monolayer. Invest Ophthalmol Vis Sci. 54 (7), 5087-5096 (2013).
- Sharma, R., et al. Clinical-grade stem cell-derived retinal pigment epithelium patch rescues retinal degeneration in rodents and pigs. Science Translational Medicine. 11 (475), 7624 (2019).
- Stanzel, B., et al. Human RPE stem cells grown into polarized RPE monolayers on a polyester matrix are maintained after grafting into rabbit subretinal space. Stem Cell Reports. 2 (1), 64-77 (2014).
- Al-Nawaiseh, S., et al. A step by step protocol for subretinal surgery in rabbits. Journal of Visualized Experiments. (115), e53927 (2016).
- Stanzel, B., et al. Surgical approaches for cell therapeutics delivery to the retinal pigment epithelium and retina. Advances in Experimental Medicine and Biology. 1186, 141-170 (2019).
- Yaji, N., Yamato, M., Yang, J., Okano, T., Hori, S. Transplantation of tissue-engineered retinal pigment epithelial cell sheets in a rabbit model. Biomaterials. 30 (5), 797-803 (2009).
- Hruban, V., et al. Inheritance of malignant melanoma in the MeLiM strain of miniature pigs. Veterinarni Medicina. 49 (12), 453-459 (2004).
- Vodicka, P., et al. The miniature pig as an animal model in biomedical research. Annals of the New York Academy of Sciences. 1049, 161-171 (2005).
- Vízina, M., Wier, A. B., Collins, M. Comparative Ocular Anatomy in Commonly Used Laboratory Animals. Ocular Toxicology in Laboratory Animals. , 9-12 (2013).
- Chandler, M. J., Smith, P. J., Samuelson, D. A., MacKay, E. O. Photoreceptor density of the domestic pig retina. Veterinary Ophthalmology. 2 (3), 179-184 (1999).
- Wang, Q. X., et al. Biodegradable microsphere-loaded tacrolimus enhanced the effect on mice islet allograft and reduced the adverse effect on insulin secretion. American Journal of Transplantation. 4 (5), 721-727 (2004).
- Sevc, J., et al. Effective long-term immunosuppression in rats by subcutaneously implanted sustained-release tacrolimus pellet: Effect on spinally grafted human neural precursor survival. Experimental Neurology. 248, 85-99 (2013).
- Juhásová, J., et al. Osteogenic differentiation of miniature pig mesenchymal stem cells in 2D and 3D environment. Physiological Research. 60 (3), 559-571 (2011).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomedical Papers of the Medical Faculty of the University Palacky, Olomouc, Czech Republic. 156 (2), 128-134 (2012).
- Soerensen, D. D., Pedersen, L. J. Infrared skin temperature measurements for monitoring health in pigs: a review. Acta Veterinaria Scandinavica. 57 (1), 5 (2015).
- Eichhorn, S. J., Sampson, W. W. Statistical geometry of pores and statistics of porous nanofibrous assemblies. Journal of the Royal Society Interface. 2 (4), 309-318 (2005).
- Szatmári-Tóth, M., et al. Clearance of autophagy-associated dying retinal pigment epithelial cells - a possible source for inflammation in age-related macular degeneration. Cell Death & Disease. 7 (9), 2367 (2016).
- Lukovic, D., et al. Human iPSC derived disease model of MERTK-associated retinitis pigmentosa. Scientific Reports. 5, 12910 (2015).
- Artero Castro, A., et al. Generation of gene-corrected human induced pluripotent stem cell lines derived from retinitis pigmentosa patient with Ser331Cysfs*5 mutation in MERTK. Stem Cell Research. 34, 101341 (2019).
- Artero Castro, A., León, M., Del Buey Furió, V., Erceg, S., Lukovic, D. Generation of a human iPSC line by mRNA reprogramming. Stem Cell Research. 28, 157-160 (2018).
- Artero-Castro, A., et al. correction recovers phagocytosis in retinal pigment epithelium derived from retinitis pigmentosa-human-induced pluripotent stem cells. International Journal of Molecular Sciences. 22 (4), 2092 (2021).
- Müller, B., Wagner, F., Lorenz, B., Stieger, K. Organotypic cultures of adult mouse retina: Morphologic changes and gene expression. Investigative Ophthalmology & Visual Science. 58 (4), 1930-1940 (2017).
- Sheridan, C. M., et al. Replacement of the RPE monolayer. Eye. 23 (10), 1910-1915 (2009).
- Radtke, N. D., et al. Vision improvement in retinal degeneration patients by implantation of retina together with retinal pigment epithelium. American Journal of Ophthalmology. 146 (2), 172-182 (2008).
- Maaijwee, K. J. M., et al. Histological evidence for revascularisation of an autologous retinal pigment epithelium--choroid graft in the pig. The British Journal of Ophthalmology. 91 (4), 546-550 (2007).
- Ghosh, F., Engelsberg, K., English, R. V., Petters, R. M. Long-term neuroretinal full-thickness transplants in a large animal model of severe retinitis pigmentosa. Graefe's Archive for Clinical and Experimental Ophthalmology = Albrecht von Graefes Archiv fur Klinische und Experimentelle Ophthalmologie. 245 (6), 835-846 (2007).
- Radtke, N. D., Seiler, M. J., Aramant, R. B., Petry, H. M., Pidwell, D. J. Transplantation of intact sheets of fetal neural retina with its retinal pigment epithelium in retinitis pigmentosa patients. American Journal of Ophthalmology. 133 (4), 544-550 (2002).
- Slijkerman, R. W., et al. The pros and cons of vertebrate animal models for functional and therapeutic research on inherited retinal dystrophies. Progress in Retinal and Eye Research. 48, 137-159 (2015).
- Schramke, S., et al. The Libechov minipig as a large animal model for preclinical research in Huntington's disease - Thoughts and perspectives. Czech and Slovak Neurology and Neurosurgery. 78/111, 55-60 (2015).
- Tohyama, S., Kobayashi, E. Age-appropriateness of porcine models used for cell transplantation. Cell Transplantation. 28 (2), 224-228 (2019).
- Dall, A. M., et al. Quantitative [18F] fluorodopa/PET and histology of fetal mesencephalic dopaminergic grafts to the striatum of MPTP-poisoned minipigs. Cell Transplantation. 11 (8), 733-746 (2002).
- Shrader, S. M., Greentree, W. F. Göttingen minipigs in ocular research. Toxicologic Pathology. 46 (4), 403-407 (2018).
- Duarri, A., et al. Transplantation of human induced pluripotent stem cell-derived retinal pigment epithelium in a swine model of geographic atrophy. International Journal of Molecular Sciences. 22 (19), 10497 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved