Method Article
200KV透過型電子顕微鏡を用いた高分解能クライオEMデータセットのルーチンコレクション
* これらの著者は同等に貢献しました
要約
高分子の高解像度クライオEMマップは、200kV TEM顕微鏡を使用することによっても達成できます。このプロトコルは、200kV TEMを使用して高解像度データセットを正常に収集するために不可欠な、正確な光学系アライメント、データ収集スキーム、およびイメージング領域の選択を設定するためのベストプラクティスを示しています。
要約
クライオ電子顕微鏡(クライオEM)は、過去10年間にタンパク質構造決定の日常的な方法として確立され、公表された構造データのシェアは増え続けています。TEM技術と自動化の最近の進歩により、データ収集の速度と取得した画像の品質の両方が向上すると同時に、3 Å未満の解像度でクライオEMマップを取得するために必要な専門知識レベルが低下しています。このような高分解能構造のほとんどは、最先端の300kVクライオTEMシステムを使用して得られていますが、特にエネルギーフィルタを装備している場合、200kVクライオTEMシステムでも高分解能構造を得ることができます。さらに、リアルタイムの画質評価による顕微鏡アライメントとデータ収集の自動化により、システムの複雑さが軽減され、最適な顕微鏡設定が保証されるため、高品質の画像の収率とデータ収集の全体的なスループットが向上します。このプロトコルは、200kVのクライオ透過型電子顕微鏡に最近の技術的進歩と自動化機能を実装することを示し、 de novo 原子モデルの構築に十分な3Dマップの再構築のためのデータを収集する方法を示しています。このような高解像度のクライオEMデータセットの日常的な収集を可能にするために考慮する必要があるベストプラクティス、重要な変数、および一般的な問題に焦点を当てています。特に、i)顕微鏡アライメントの自動化、ii)データ収集に適した領域の選択、iii)高品質で高スループットのデータ収集に最適な光学パラメータ、iv)ゼロロスイメージングのためのエネルギーフィルタチューニング、v)データ管理と品質評価。エネルギーフィルターと直接電子検出器を備えた200kV TEMを使用して2.1-Åの分解能に再構築されたアポフェリチンと、エネルギーフィルターと直接電子検出器を備えた2.1-Åの分解能に再構築された サーモプラズマアシドフィラム 20Sプロテアソームの例で、エネルギーフィルターを使用して達成可能な分解能のベストプラクティスの適用と改善が実証されます。
概要
タンパク質構造の決定は、細胞代謝、シグナル伝達、宿主-病原体相互作用などの重要な細胞プロセスに関与するタンパク質複合体の分子構造、機能、および調節を理解するために重要です。クライオ電子顕微鏡(クライオEM)は、X線回折やNMR分光法などの従来の構造技術には難しすぎた多くのタンパク質とその複合体の3D構造を解くことができる強力な技術として浮上してきました。特に、クライオEMは、従来の構造技術では容易に結晶化または十分な量で調製することができない膜タンパク質に最適な方法として証明されており、重要な細胞受容体およびイオンチャネルの構造および機能に関する新しい洞察を提供しました1、2、3、4、5.最近では、クライオEMは、SARS-CoV-2感染のメカニズムを分子レベルで決定することにより、Covid-19パンデミックと戦う上で重要な役割を果たしており、Covid-19疾患の起源を解明し、効率的なワクチンと治療法の迅速な開発の基礎を提供しました6,7,8,9,10。
通常、ハイエンドの300kV透過型電子顕微鏡(TEM)は、クライオEM単粒子分析(SPA)による生体分子の高分解能構造決定に使用され、その立体構造と相互作用を明らかにします。最近、SPA技術は、冷電界放出ガン(E-CFEG)、直接電子検出器、およびエネルギーフィルタを備えた300kV TEMを使用して、共通のベンチマーククライオEMサンプルアポフェリチンが原子分解能(1.2Å)11,12で再構築されたときに新しいフロンティアに達しました。この分解能により、構造中の個々の原子の位置、個々のアミノ酸側鎖の立体構造、水素結合などの相互作用を明確に解き明かすことができ、構造に基づく新規標的の創薬や既存医薬品候補の最適化に新たな可能性が開かれました。
ミッドレンジの200kV TEM顕微鏡は、特に大規模なクライオEM施設で、ハイエンドTEM顕微鏡を使用した最終的な高解像度データ収集の前に、サンプルスクリーニングとサンプル最適化によく使用されます。通常、画像化されたサンプルは、最終的なデータ収集のためにハイエンドの300kV TEMに移行するのに十分な3~4Åの解像度範囲で解決できます。その結果、200kV TEMを使用したデータ収集は、可能な限り高い分解能の結果を得るためにさらに最適化されないことがよくあります。さらに、すべてのアミノ酸側鎖がすでに解決されているため、多くの興味深い生物学的疑問にすでに回答し、これらの分解能で公開することができ、リガンド結合部位の占有率も確実に決定することができる13。200kV TEMは、多数のサンプル14、15、16、17、18に対して3 Åを超える分解能に達することがすでに示されています。200 kV で撮影された画像は、画像化された粒子の本質的に高いコントラストを示し、300 kV TEM 画像と比較して高解像度でより減衰した信号にもかかわらず、粒子のより正確な初期アライメントを容易にすることさえあります。再構成されたクライ-EMマップの達成された分解能は、画像化されたサンプルの構造的柔軟性と立体配座の不均一性によっても制限され、200kVと300kVの両方の再構成に影響を与えることに注意することが重要です。実際、300kVシステムを使用して得られたクライオEM再構成は、高解像度19よりもはるかに多くのクライオEM再構成が3~4Åの分解能範囲で解決されました。200 kV TEM顕微鏡はそれほど複雑ではなく、小さな部屋に収まるため、これらの顕微鏡は、顕微鏡オートローダーシステム内に保存されている複数のサンプルからの長いデータ収集の自動化を維持しながら、クライオEMによる生物学的高分子の構造決定のための優れた低コストのオプションを表します。
高解像度の構造決定のためのクライオEMデータセットの収集には、顕微鏡光学系の正確な位置合わせが必要です。列の整列は、電子源から集光レンズ系、対物レンズ、電子検出器を備えたエネルギーフィルターまで体系的に進行します。通常、アライメントの完全なシーケンスは必要ありません。必要に応じて、顕微鏡ユーザーインターフェイス(ダイレクトアライメントコントロールパネル)のアライメント手順全体を通して、コンテキスト認識ヘルプウィンドウに各ステップの適切な説明とともに、半自動化された手順を介してユーザーに案内されます。顕微鏡が完全に整列すると、電子光学系は安定したままであり、少なくとも数ヶ月間は位置合わせを変更する必要はありません。サンプル平面の平行照明、客観的乱視、昏睡状態のない配置など、最も感度の高い配置のみを、各データセットのコレクションを開始する直前に調整する必要があります。収集されたデータの品質は、EPU Quality Monitor、cryoSPARC Live 20、Relion 21、Scipion22、WARP23、Appion 24などのさまざまなソフトウェアパッケージを使用して、データ収集中に監視できます。
顕微鏡の正確なアライメントに加えて、立体構造および組成の不均一性を最小限に抑えた高品質のよく精製されたサンプルも、高解像度データセットの収集と高解像度構造の解決の前提条件です。典型的なプロトコル、頻繁な課題、および可能な救済策の詳細については、このトピック専用の他のレビュー25,26,27を参照してください。基本的に、高解像度の情報を保存するのに十分な薄い氷があり、個々の粒子が重複することなくランダムな向きで密集して分布している特定のクライオEMグリッド上の領域を見つけることが不可欠です。しかし、一般的なクライオEMグリッドは氷の厚さが不均一であるため、イメージングに最適な領域を見つけて選択することが重要です。グリッド上の氷厚を推定するさまざまな手段は、EPU 2、Leginon28、SerialEM29などのクライオEMデータセットの自動収集専用のソフトウェアパッケージで利用できます。
高速で高感度な直接電子検出器の出現により、ビーム誘発運動の補償を可能にし、画像処理および最終的な3D再構成に使用されるデータの品質および量の大幅な増加をもたらしたムービーとして、多くの画分の画像の収集を可能にした30。同時に、自動化と高スループットのデータ収集は、データの保存とアクセスの課題を表す何千もの画像/ムービーを含む巨大なデータセットを提供します。数十から数百人のユーザーにサービスを提供する大規模なクライオEM施設を備えた採用モデルは、特に確立されたクライオEMパイプライン31、32において、適切な追跡とデータ共有を伴う組織的なデータ管理を必要とする。
この研究は、200kV Glacios TEM顕微鏡を用いた高解像度クライオEMデータセットの日常的な収集のためのプロトコルを記述している。顕微鏡光学系の必要なアライメントは、クライオEMサンプルの評価手順と、高解像度データ収集に適した領域の選択とともに説明されています。収集されたデータとサンプル情報を使用した関連メタデータの編成は、サンプル情報と収集されたデータのレビューを容易にするデータ管理プラットフォームであるAthenaで示されています。マウスアポフェリチンサンプルを用いて、1.6Å解像度13で3D再構成を達成することができた。記載されたプロトコルを使用して、我々はまた、2.1Åの解像度で サーモプラズマアシドフィラム からの20Sプロテアソームの3D密度マップを再構築した。
プロトコル
Selectris-Xエネルギーフィルター(以下、エネルギーフィルター)およびFalcon 4検出器(以下、直接電子検出器と呼ぶ)を備えた200kV Glacios TEMシステム(以下、200kV TEMと呼ぶ)について、プロトコルのすべてのステップが説明されています。プロトコルの手順は、各 Glacios システムにプレインストールされているデフォルトの SPA データ収集ソフトウェアである EPU アプリケーションに固有です。以下のプロトコル手順は EPU バージョン 2.14 に対応しており、別の EPU バージョンを使用する場合は、小さな変更が予想されます。このプロトコルの前提条件は、i)銃と柱のアライメントが良好にアライメントされていること、ii)EMキャリブレーションが正しいこと、iii)EPUの自動機能が正しくキャリブレーションされていることです。
1. 顕微鏡へのグリッドの読み込み
注:この実験で使用された200kV TEMは、顕微鏡のオートローダー内に装填され、サンプルの失透を防ぐために常に-170°C未満の温度に保たれるカセット内に最大12個のオートグリッド(すなわち、特別なカートリッジにクリップされた従来のTEMグリッド)を保持することができる。
- オートグリッドを液体窒素条件下でオートローダーカセットに挿入します。
- オートグリッド付きのカセットを液体窒素冷却移送カプセルに挿入します。
- カプセルを顕微鏡に挿入し、顕微鏡UIの [Dock] ボタンをクリックして、カプセルから顕微鏡のオートローダーにカセットをロードします。
- [インベントリ]ボタンをクリックして、ロードされたカセット内のオートグリッドの存在を確認します。
- 「ロード 」 ボタンと 「アンロード」 ボタンをクリックして、TEM イメージング用のカラムにオートグリッドを挿入します。
2. データ管理プラットフォームでのプロジェクトの設定(オプション)
メモ:サンプル情報と収集されたデータは、接続されているすべての計測器の構造化データを保存できる、付属のデータ管理プラットフォームで整理できます。任意のワークフローステップを定義して、レビューとエクスポートのために整理された方法で画像とメタデータをキャプチャできるプロジェクトを作成できます。
- データ管理ポータル・アプリケーションを開始し、ユーザー名とパスワードを使用してログインします。
- ポータル UI の左パネルで、[プロジェクト の追加] ボタンをクリックして新しいプロジェクトを作成するか、下の一覧にある既存のプロジェクトのボタンをクリックしてプロジェクトを開きます。
- [ 実験の追加] ボタンをクリックして、開いているプロジェクト内に新しい実験を作成します。
- 新しい実験の [ メタデータ ] パネルに説明を入力し、[ワークフロー の追加] ボタンをクリックして、実験内に新しいワークフロー (単粒子解析など) を作成します。
- 必要に応じて、中央パネルの [ステップの追加] ボタンをクリックして、カスタムメイドのワークフローを作成するか、定義済みの SPA ワークフローにステップを追加します (図 1 と 図 2)。
注:これらのステップは、サンプル調製、生化学技術によるサンプル特性評価、サンプルガラス化、クライオEMグリッドのスクリーニング、データ収集セッション、およびデータ分析を表す場合があります。 - 必要に応じて、各ステップの メモ に説明を入力します。これには、画像や写真を含めることができます。
- ワークフローでデータセット ステップを作成し、データセットの種類を EPU として選択します。
注:これにより、分析ソフトウェアは、データ取得中にすべての結果データ/メタデータをデータ管理ポータルの正しい場所に自動的に配置し、すべてのステップとデータ転送の完全な記録を維持しながら、データを優先先に自動的にエクスポートできます。 - 生化学ステップでサンプルグリッドとEMグリッドに関するテンプレートに入力し、各グリッドをサンプルに関連付けます(1つのサンプルを複数のグリッドに関連付けることができることに注意してください)。
- サンプルとグリッドの組み合わせを [ データセット] ステップのメタデータ セクションに関連付けます。
3. 解析ソフトウェアでイメージングプリセットと画像シフトキャリブレーションを設定する
- 表1に示すように、個々のイメージングモードのイメージングパラメータを設定します。特定の設定の選択に関する考慮事項については、「ディスカッション」セクションで詳しく説明します。
- 解析ソフトウェア のデータ集録 プリセットで選択した倍率の平行照明を設定する
注:この研究で使用された200kV TEMなどの2コンデンサーTEMシステム上で、所定のSPOTサイズ(すなわち、C1レンズのプリセット強度)でサンプルを平行に照射するためのC2レンズの設定は1つだけです。したがって、単位面積当たりの電子線量率(e-/Å2/s)は、SPOTサイズの設定を変更し、以下の手順に従ってC2強度(ビーム強度)を再調整することによってのみ調整することができる。- サポートカーボンホイルと薄いまたは氷のない場所に移動します。
- TEM UIの絞りメニューで100μmまたは70μmの対物レンズ アパーチャ を選択します。
- コントロールパネルの回折ボタンを押して、 回 折モードに切り替えます。
- 蛍光スクリーンを挿入し、FluCamモードを 高解像度に変更します。
- 中央の回折スポットを絞りの端に移動します。絞りエッジが表示されない場合は、拡大ノブを使用してカメラの長さを長くします。
- コントロールパネルの フォーカス ノブを慎重に回して、バックフォーカルプレーンにピントを合わせます。バックフォーカルプレーンは、絞りエッジが目に見えて鋭いときに焦点を合わせます。
- FluCam の感度を最低レベルまで下げ、中央の回折スポットを FluCam の中心に移動します。
- コントロールパネルの 強度 ノブを使用して、中央のスポットのサイズを最小限に抑えます。
- TEM UI で対物レンズ絞りを引っ込め、イメージングモードに戻します。
- 解析ソフトウェアの[ 取得 ]ボタンをクリックして、設定をデータ集録プリセットに保存します。
- 使用する検出器に最適なデータ集録プリセットで電子線量率を調整します。
- グリッド上の空の領域に移動する(例:カーボンホイルが壊れたグリッドの正方形)
- 分析ソフトウェアの[線量測定]ボタンをクリックして、電子 線量 率を測定します。
- 最適な線量率を達成するためにSPOTサイズを変更します。このプロトコルで使用される直接電子検出器の場合、4-5e-/pixel/sの線量レートは、通常、高解像度のデータ収集に使用されます。これは通常、SPOT サイズ 4 ~ 6 に対応します。
- 上記のように、新しいSPOTサイズ設定で平行照明を確認して調整します。
- フラクションの下のEERオプションを選択して、直接電子検出器33でEERモードを使用する。
- 解析ソフトウェアの[ 取得 ]ボタンをクリックして、設定をデータ集録プリセットに保存します。
- オートフォーカスプリセットに切り替えて、Get ボタンを押してフォーカス用の照明設定を保存します。露出時間を 1 秒、ビニングモード 2 に手動で変更します。
- Thon Ringsプリセットに切り替えて、Get ボタンを押してこのプリセットの照明設定を保存します。露出時間を 1 ~ 2 秒、ビニング モード 2 に手動で変更します。
- ゼロロスプリセットに切り替えて、Get ボタンを押してこのプリセットの照明設定を保存します。露出時間を 0.5 秒に手動で変更し、ビニング モードを 4 にします。
- 解析ソフトウェアのマニュアルの説明に従って、設定された光学設定間の画像シフトを、[準備]タブの[Image Shift Calibrat]タスクを使用して調整します(補足図1)。
表1:エネルギーフィルターと直接電子検出器を備えた200kVクライオTEMを使用した高解像度データ収集の典型的なイメージング設定。 設定は、自動データ収集の設定に使用される各光学プリセットについて表示されます(プロトコルのセクション3)。これらの設定は、本研究で使用した200kV TEM顕微鏡および直接電子検出器に固有のものです。 この表をダウンロードするには、ここをクリックしてください。
4. グリッドマッピングとデータ収集に最適なクライオEMグリッドの選択
- [ アトラス ]タブを選択し、[新しいセッション ]ボタンをクリックして新しいセッション を開きます。
- セッション名やデータ保存場所などの詳細を入力し、[ 適用] ボタンをクリックして新しい スクリーニング タスクウィンドウを開き、オートローダインベントリ内のすべてのグリッドのリストを表示します。必要に応じて、[グリッドの名前] を編集します。
- 対応するグリッド番号の横にあるチェックボックスをオンにして、目的のグリッドを選択します。
- [ スタート] ボタンをクリックすると、選択したすべてのグリッドのアトラスの完全自動コレクションが開始されます。
- 収集が完了したら、グリッドラベルをクリックして、取得したアトラスを確認します。
注: 個々のグリッドの正方形は、各アトラスの相対的なグレースケール値の評価に基づいて、相対的な氷の厚さに従って分類されます。分類されたグリッドの正方形は、データ収集領域の選択を導くために使用できるさまざまな配色で描かれています。Vitrobot Mk IVで生成されたグリッドは、通常、グリッド全体に氷厚の勾配を表示し、データ収集に理想的な氷厚を特定するのに役立ちます。最適なグリッドは、転写氷の汚染をできるだけ少なくし、十分な切れ目のない亀裂のないグリッドの正方形を示す必要があります(図3)。適切な氷分布を有するグリッドをさらに調査して、高倍率での氷中の粒子の分布(すなわち、個々の粒子の密度および配向)を評価することができる。 - トップメニューの [サンプルのロード] ボタンをクリックして、適切な氷分布を持つ選択したグリッドを顕微鏡列に挿入します。
- [ アトラス ] タブを選択し、アトラス画像内の適切なグリッド正方形を右クリックし、ドロップダウン メニューから [ステージを ここに移動] オプションを選択して、ステージをグリッド正方形に移動します。
- 「自動関数」タブを選択して、グリッドの正方形をユーセントリック高さに設定します。ユーセントリック高さプリセットに切り替え、選択したグリッド正方形の中央にあるビームチルトによる自動ユーセントリック自動機能をクリックし、[スタート]ボタンをクリックします。
- グリッドスクエアプリセットに切り替えて、画像を取得します。ステージを氷のある穴に移動し、汚染がまったくないか最小限に抑えるには、右クリックと「ステージをここに移動」オプションを使用します。
- 穴/ユーセントリック高さプリセットに切り替えて、画像を取得します。ステージを目的の穴の横にあるカーボン領域に移動するには、右クリックして「ステージをここに移動」オプションを選択します。
- オートフォーカスの自動機能をクリックし、目的のデ フォーカス の値を0 μmに設定し、反復の値を-2 μmに設定します。 オートフォーカス プリセットに切り替えて、[ スタート ]ボタンをクリックします。
- 「準備」タブをもう一度選択し、「穴/ユーセントリック高さ」プリセットに切り替えます。以前に取得した穴の画像で、穴内の関心領域を選択し、右クリックして「ステージをここに移動」オプションを選択して、ステージをこの位置に移動します。
- データ集録プリセットに切り替え、ビームシフト後の待ち時間を0.5秒、ステージ移動後の待ち時間を20秒に設定します。-3 μm ~ -5 μm のデフォーカスを使用して画像を取得し、低解像度のコントラストを高めて個々の粒子の視覚化を改善します。
- 必要に応じて、手順 4.7 ~ 4.13 を繰り返して、必要に応じて氷の厚さが異なる異なる穴や異なるグリッドの正方形のパーティクルを画像化します。
- 高解像度データ収集に最も適したグリッドを特定して選択したら、トップメニューの 「サンプル をロード」ボタンをクリックして、選択したグリッドをTEMにロードします。
注:あるいは、より多くの情報が必要な場合、および/またはこのスクリーニングプロセスの自動化が必要な場合は、セクション5を実行します。
5. 単一粒子分析ソフトウェアでのデータ収集セッションの設定
注:金箔グリッドを使用している場合、客観的な乱視と昏睡状態の調整(セクション6)は確実に機能しない場合があります。データ収集を設定する前に、カーボンフォイルグリッドまたはクロスグレーティングEMグリッドをロードし、これらの最終アライメントを実行することをお勧めします。
- 「EPU」タブを選択し、「セッション作成」ボタンをクリックして、左側のパネルに新しいセッションを作成します。「新規セッション」オプションを選択して現在の光プリセットを使用するか、「環境設定から新規」オプションを選択して、以前に書き出したセッション設定をロードします。
- セッション名とデータ保存場所を入力します。
注: この場所は、データ収集セッションからの統合イメージとメタデータを、セッション名の付いたサブフォルダーに保存するために使用されます。これらのデータは大量のストレージ領域を占有しませんが、EER カメラフレームは常にこのデータストレージのルートディレクトリのセッション名を持つディレクトリに格納されるため、これらのデータを DMP サーバーの Falcon オフロードデータストレージに保存することをお勧めします。 - セッションの 「手動」(Manual ) タイプを選択すると、プロトコルの後半でデータ収集用に選択されたグリッド正方形の個々の穴の選択を制御できます。
- データ収集に収差のない画像シフト(AFIS)を使用して、個々の穴間のステージ移動を減らし、サンプル全体のドリフトを低減し、画質を劣化させることなくデータ収集のスループットを向上させるには、 高速 集録モードを選択します。
- 保存する統合イメージのデフォルトの mrc 形式を選択します。
- 使用するグリッドとそのタイプを指定します。このプロトコルは、アポフェリチンにR-1.2/1.3 UltraAufoilを使用し、20SプロテアソームにR-2/1 Quantifoilグリッドを使用しました。試料キャリアの下のクォンティフォイルを選択し、クオンティフォイルタイプでR1.2/1.3または2/1を選択します。
- オプション: 右下隅にある Athena ログイン ボタンをクリックして、EPU 品質モニター (EQM) を利用します。
- ブラウザのポップアップウィンドウにログインの詳細を入力して、「 セッション設定」 概要の設定セクションをアクティブにします。
- [設定] セクションの [選択] ボタンをクリックし、以前に作成したデータセット (プロトコル セクション 2) を参照して、現在のデータ コレクションに関連付けます。 [品質モニターを有効にする] チェック ボックスをオンにします。
- 「 適用」 ボタンをクリックして、新しいセッションを作成します。
注: この操作により、左側の列メニューに新しいタスクが開きます。セッション中の任意の時点で、いくつかの詳細が正しくない場合、セッション設定タスクに戻り、詳細を変更/更新し、再度[適用]をクリックしてセッションを更新することができます。 - 左側のパネルで [正方形の選択] タスクを選択して、収集されたグリッドのアトラスを表示します。
- 必要に応じて、アトラスのタイルをダブルクリックして、グリッドの正方形の氷の品質をより適切に判断するために、より高品質の画像を表示します。画像をもう一度ダブルクリックすると、グリッドアトラスに戻ります。
- (i)グリッド正方形の支持箔は損傷することなく無傷である、(ii)箔穴内のガラス質の薄氷(穴は支持炭素箔よりも明るく見える)、(iii)グリッド正方形内の結晶性氷汚染(黒い斑点)を可能な限り少なくする、(iv)グリッド正方形全体および個々の箔穴内の輝度勾配が最小限に抑えられる。
注:プリセットを選択し、良好なグリッドを使用すると、この研究で使用した200kVクライオTEMは、〜200〜300ムービー/時間の速度で画像化できます。そのことを念頭に置いて、必要な数の正方形を選択するか、顕微鏡の時間の量に応じて正方形選択タスクに戻って後で追加します。参考までに、アポフェリチンの1.6 Å解像度を達成するために3000本の映画が収集されました。 - 完全なアトラスまたは高品質のタイル画像のいずれかでデータ収集用のグリッド正方形を選択する
- 目的のグリッド正方形を右クリックし、コンテキストメニューの [選択] オプションを選択します。
- または、キーボードの Ctrl キーを押し ながら、目的のグリッドの四角形を左クリックします。
- 逆に、右クリックして 選択を解除する か、Shift キー を押し ながら左クリックして四角形を削除します。
- 左側のパネルで 「穴の選択」 タスクを選択して、選択したグリッドの正方形の穴を選択します。
- 自動ユーセントリックボタンをクリックすると、最初に選択したグリッド正方形に自動的に移動し、 ユーセントリック の高さを調整して、箔穴を見つけるためのグリッド正方形画像を取得します。
- [穴を 探す] ボタンをクリックして、画像内の箔穴を見つけます。
メモ: 穴の検出がうまく機能しなかった場合 (つまり、画像にスキップされた穴やサイズが正しくない穴がある場合)、セッション設定タスクの Quantifoil Type エントリに正しい値が入力されていることを確認し、穴をもう一度見つけてください。それでも穴が正しく見つからない場合は、「穴のサイズを測定」(Measure Hole Size) ボタンをクリックして穴の直径と距離を手動で設定し、穴をもう一度見つけます。 - グリッドバーボタンの近くにある穴を削除ボタンをクリックして、グリッドバーの近くの 穴 の選択を解除します。
- 図4に示すように、Ice フィルターの明るさヒストグラム (ソフトウェア ウィンドウの右下) で制限を調整して、氷が厚すぎるすべての穴 (左側の制限線を使用) と空の穴 (右側の制限線を使用) をすべて削除します。
メモ: 絞り込みのために、特定の強度値を 「適用」(Apply ) ボタンの横にある対応するテキストボックスに入力することもできます。 - 必要に応じて、選択ブラシを使用して穴の選択を手動で絞り込みます。 ブラシを左クリックしてドラッグすると、不要な穴の選択が解除されます。 Ctrl キーを押しながら 左クリックすると、ホイル穴を再選択できます。 Shift キーを押しながらマウスホイールでスクロールし、ブラシサイズを調整します。
- データ収集中に繰り返し使用されるデータ集録テンプレートを設定およびテストする穴を選択する:グリッド正方形画像の穴を右クリックし、「ステージを位置に移動」オプションを選択します。
- 左側のパネルで 「テンプレート定義」 タスクを選択します。
- 穴/ユーセントリックプリセットを選択し、「取得」ボタンをクリックして画像を取得します。
- 「穴を見つけて中央揃え」ボタンをクリックして、画像内の 穴を中央 に配置します。
- 「イメージシフト後の遅延」の値を 0.5 秒(デフォルト)に設定し、「ステージシフト後の遅延」の値を 20 秒に設定します。
注:平行ビーム径は、本研究で用いた200kVクライオTEMシステムで固定されており、通常、50μmのアパーチャで1.6~1.7μmに相当するため、R-1.2/1.3グリッドでは1穴あたり1枚の画像しか取得できず、R-2/1またはR-2/2グリッドでは穴あたり2枚の画像(反対側のエッジ付近)しか取得できません。画面上の設定集録領域のサイズは、実際のビーム径に対応していませんのでご注意ください。画像スケールバーを利用して、適切な配置距離を推定することができる。 - [取得 領域の追加] ボタンを選択し、画像をクリックして、中央の穴で高倍率の画像取得が行われる位置を選択します。
- [オートフォーカス 領域の追加] ボタンを選択し、画像をクリックして、画像オートフォーカスが実行される中央の穴の横にあるサポート箔上の位置を選択します。
注:集束用のビームサイズは1.6〜1.7μmで、炭素上の隣接する穴から等距離に配置する必要があります。 - 緑色の集録領域をクリックして、ソフトウェアウィンドウの上部セクションにある デフォーカスリストに一連のデフォーカス 値を設定します。次の 「テンプレート実行」 タスクのテスト実行でパーティクルの視覚化を強化するために、最も高いデフォーカスを最初に入力します。
- 青いオートフォーカス領域をクリックして、同じ領域にオートフォーカス固有の設定を設定します。
- 各AFISクラスタの開始時にオートフォーカスする [センタリング後 ]オプションを選択します。
- オプションを選択すると、 オート フォーカスが速くなり、ステージドリフトが減少します。
- 「テンプレート実行」タスクを選択し、「実行」ボタンをクリックします。
- データ取得手順の個々のステップ(穴の中央揃え、選択した領域のオートフォーカス、および設定された領域の画像取得)を観察し、最終的な高倍率画像で画像化された粒子の品質を確認します。
- 高倍率画像ウィンドウの右下にあるFFTボタンをクリックして FFT 画像を確認し、トロンリングがFFT画像で複数の振動を示し、高解像度に拡張されているかどうかを視覚的に評価します。
- テンプレートの実行が正常に完了したら、[穴の選択] タスクの [すべての四角形を準備] ボタンをクリックすると、この最初のグリッド四角形で使用される設定に従って、選択した他のすべてのグリッド四角形にデータ コレクションが自動的に設定されます。
6. データ収集開始前の最終的な顕微鏡アライメント
メモ: 最高の高解像度結果を得るには、最も機密性の高いアライメントをデータ収集ソフトウェアのデータ集録モードとまったく同じ設定で、実際のデータ集録を開始する直前に行う必要があります。これらのアライメントは、グリッドの薄いサポートカーボンのある位置で、グリッドバーから十分に離れ、ユーセントリック高さでアライメントする必要があります。
- テンプレート実行タスクを選択し、新しい画像を取得し、右クリックでステージとともにカーボンフォイル上のクリーンな領域に移動し、メニューオプション「ステージをここに移動」を選択します。
- [自動機能]タブを選択し、[目的のデフォーカス]を0 μm、[反復]を-2 μmに設定します。オートフォーカスプリセットに切り替え、[スタート]ボタンをクリックしてオートフォーカス機能を実行します。
- 蛍光スクリーンを下げて、TEM UIの ダイレクトアライメント のメニューを開きます。
- 最良の結果を得るには、経験豊富なユーザーがピボットポイントのアライメントを確認することができます:ダイレクトアライメントメニューでnPビームチルトpp Xタスクを選択し、コントロールパネルの多機能ノブを使用してバウンスビームを最大限オーバーラップさせます。np ビーム傾斜 pp Y タスクについて、この手順を繰り返します。
- 蛍光スクリーンカメラメニューの EF ボタンをクリックすると、エネルギーフィルター入口を示す緑色の円が表示され、緑色の円の上にビームが中央に配置されます。
注:続行する前にターボポンプが停止していることを確認してください。そこからの振動は、目に見えるトンリングの数を減らし、しばしば自動機能を失敗させます。 - ソフトウェアウィンドウに戻り、メニューバーの [自動機能 ]タブを選択します。
- 「自動設定」タスクを選択し、「トーンリング」プリセットに切り替えて、「スタート」ボタンを押します。このプロセスを観察して、(i)撮影した画像が炭素上にあり、(ii)トンリングがはっきりと見え、(iii)計算されたCTFフィット(点線)がトンリングの最小値にうまく配置されていることを確認します(補足図2)。
- 自動昏睡タスクを選択し、[スタート]ボタンを押します。プロセスを観察して、撮影した画像が炭素上にあり、トン環がはっきりと見え、計算された適合値(点線)がトン環の最小値にうまく配置されていることを確認します。マウスのスクロールホイールを使用して、各トーンリング画像を拡大します(補足図3)。
メモ:顕微鏡にエネルギーフィルタが装備されている場合は、アライメントシーケンスの一部としてエネルギーフィルタのチューニングを行い、フィルタスリットをゼロロスピークに中央に配置し、エネルギーフィルタのプリズムの歪みを補正する必要があります(ステップ6.9-6.14)。これらの配置は、壊れたグリッドの正方形の内側など、グリッドの空の領域で実行する必要があります。 - Sherpa UI を開き、エネルギー フィルター アプリケーションを選択します (補足図 4)。
- [設定]ウィンドウでカメラをEF-Falcon、ビン4x、露出時間0.2秒に設定します。
- ゼロロスオプションの [ 中央]ボタンをクリックして、 ゼロロス エネルギーフィルタースリットを中央に配置します。
- [等色性]オプションの[調整]ボタンをクリックします(補足図4)。
- 幾何学的および色的歪みのオプションで、調整倍率と調整歪みをクリックします(補足図5、補足図6)
- 結果が示された仕様の範囲内でなく、出力レポートに赤色で表示される場合は、ステップ 6.11 のアライメントをもう一度繰り返します。
メモ: 直接電子検出器のゲインリファレンスは数か月にわたって安定していますが、空の領域の画像が均一な強度を示さず、ストライプやその他の明確な特徴を示す場合は、 Falcon 4リファレンスイメージマネージャ を使用して新しいゲインリファレンスを取得する必要があります。または、このような画像の高速フーリエ変換(FFT)を計算し、線が表示されていないことを確認します。 - ソフトウェアウィンドウで、「 準備」 タブを選択し、 データ集録 プリセットに切り替えます。
- 線量設定を40 e-/Å2 に設定し、[ 線量率の測定] ボタンをクリックします。
- EPUタブに移動し、自動取得タスクを選択し、オプションで自動ゼロロス機能をチェックします。[実行の開始]ボタンをクリックして、完全に自動化されたデータ収集を開始します。
7. データ収集中のデータ品質の監視と最適化
注: データ収集の進行中は、収集されたデータは、データ管理ポータルを介して EQM を使用してモニターできます。EQMは、モーション補正とCTF判定をオンザフライで実行し、その結果をポータルに表示します。ユーザーは、個々の集録の品質を判断し、さまざまな品質指標のグラフを表示し、不要な集録を除外し、データをオンザフライまたはバッチジョブとして最終ストレージにエクスポートできます。
- 分析ソフトウェアが Web ブラウザーを使用してデータを配置するデータセットに移動します。
- データセットの概要では、取得カードは、モーション補正とCTF決定に関する情報をグラフィック形式で表示します。個々のカードをクリックすると、詳細情報が表示されます。
- DataViz パネルに、集録ごとの焦点ずれ、乱視、CTF 信頼範囲を示すデータセット全体の集計グラフを表示できるようにします (補足図 7)。
- パネル上部のフィルターを使用して、要求された焦点除去範囲内にあり、乱視がゼロに近いデータのみを選択し、CTF を指定された (ターゲット) 解像度まで決定できます。フィルターを設定したら、[ 適用] ボタンを押して、選択したデータのみをデータセットの概要ウィンドウに表示します。
- 取得した画像のほとんどが設定された基準内に収まったら、データ収集セッションを完了まで継続させます。取得した画像のごく一部のみが設定された基準を満たす場合は、分析ソフトウェアの設定を再構成するか、サンプル上の別の領域に移動するか(分析ソフトウェアの 次のグリッド正方形 ボタンを押します)、またはデータ収集を停止します。
結果
データ管理ポータルは、複数の実験ワークフローから収集された画像、データ、メタデータを単一のソフトウェアプラットフォームで効率的で構造化されたストレージを提供します。作成されたプロジェクトで定義された各実験は、サンプル情報、収集されたデータ、および関連するメタデータを制約なしにキャプチャするためのユーザー定義のステップを含むワークフローで構成され、可能な実験とすべてのユースケースに最大限の柔軟性と使いやすさを提供します(図1、 図2)。データ管理ポータルには、中間結果を含む画像処理を含むワークフロー ステップを示すラボ ノート機能もあり、これらをすべてプロジェクトにまとめて関連付けることができ、レポートやパブリケーションの分析と作成のために可能な限り完全なレコードを提供できます。

図 1: データ管理プラットフォームで可能なデータとメタデータの編成の例。 各プロジェクトは、クライオEMや質量分析法(プロトコルステップ2.3)などの複数の実験で構成できます。各実験には、複数のユーザー定義ワークフロー (プロトコル ステップ 2.5) を含めることができ、それぞれが複数の構成可能なステップ (プロトコル ステップ 2.7) で構成されます。 この図の拡大版を表示するには、ここをクリックしてください。
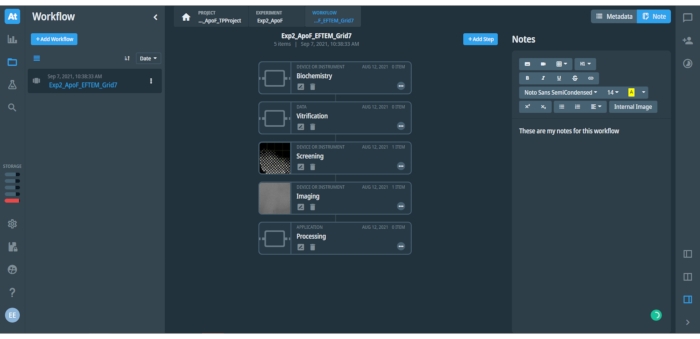
図 2: データ管理プラットフォームで開いているプロジェクト ワークフローを表示します。 この図は、ワークフローで開いているステップに関連付けられたメタデータとメモを示しています。アイコン付きの左側のバーでは、データ管理プラットフォームのさまざまなオプションやメニューにすばやくアクセスできます。左側のパネルには、保存されたワークフローのリスト (保存されたワークフロー "Exp2_ApoF_EFTEM_Grid7" が 1 つだけ表示) と、新しいワークフローを追加するための青いボタンが表示されます。中央パネルには、ここで SPA ワークフローに示されているように、開いているワークフローの個々のステップが表示されます。右上の青いボタンは、開いているワークフローにステップを追加できます。右側のパネルには、記録されたメタデータまたはワークフローのユーザー入力メモ用のスペースがあり、テキスト、表、画像などが含まれます。テキストにはさまざまな書式設定オプションを使用できます。 この図の拡大版を表示するには、ここをクリックしてください。
Vitrobotなどの従来のプランジ凍結装置で製造されたクライオEMグリッドは、通常、グリッド表面に氷厚の勾配を表示します。一部のグリッドは、手動処理および/またはオートグリッドリングキャリアへのクリッピング後に損傷(曲げ)されることもあります。 図 3 に、Atlas の概要に示すさまざまなグリッドの例を示します。厚い氷や損傷のあるグリッドは、さらなる調査から除外する必要があります。

図 3: アトラスの概要に見られるさまざまな グリッドのギャラリー。(A) 厚い氷のある悪いグリッド、(B) 氷と氷の汚染が悪い曲がったグリッド、(C) 氷の勾配が良い許容できるグリッド、(D) 薄い氷がよく、氷の勾配が小さい典型的なグリッド。 この図の拡大版を表示するには、ここをクリックしてください。
損傷がなく、最適な氷厚のグリッド正方形を選択することは、高解像度データセットを収集するために重要です。氷の厚さは個々のグリッド正方形のレベルでも変化する可能性があるため、選択した各グリッド正方形から最適に薄い氷の穴のみを選択することが重要です。 図4は 、中央に無傷の箔と薄い氷を持つ適切なグリッド正方形を示しています。示されているグリッド正方形は、異なる氷の厚さの範囲と氷のない空の穴が含まれているため、選択したすべてのグリッド正方形に薄い氷を含む穴を自動的に選択するためのフィルタを設定するのに適しています。これは、[穴の選択]タスクでアイスフィルタに適切な強度範囲を設定するのに非常に便利です。
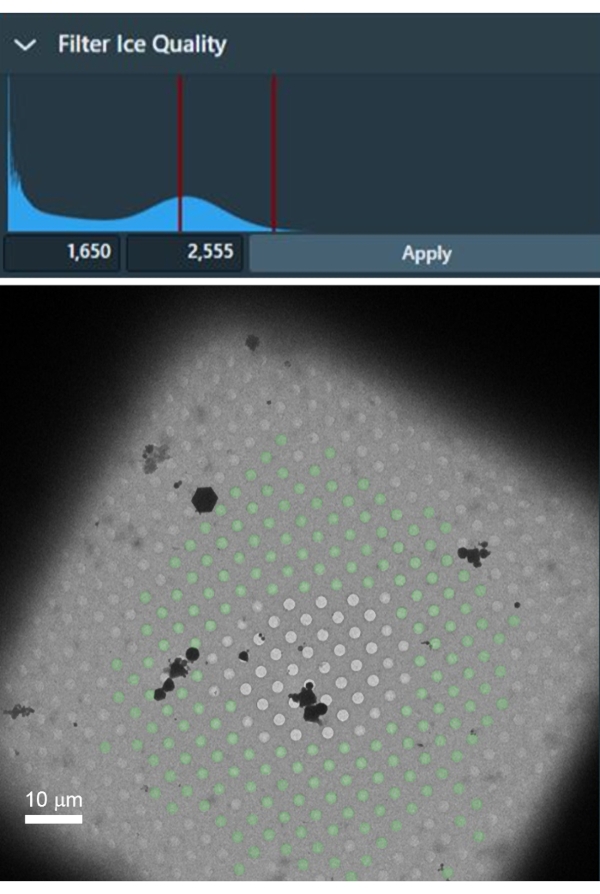
図 4: 中央の空のグリッド正方形とグリッド バーの近くの厚い氷から、氷の厚さのグラデーションを持つグリッド正方形の例。 氷質のフィルターを使用して、理想的な氷厚の穴内の強度の範囲を選択し、それに応じてグリッドの正方形(緑色のオーバーレイを持つ穴)で選択することができます。 この図の拡大版を表示するには、ここをクリックしてください。
記載されたプロトコールを用いたベンチマーク結果は、Kikkawaグループ11由来のマウスアポフェリチン(apoF)のサンプルを用いて得られた。ApoFは、非常に安定な八面体ケージを形成する高度にαらせん状のタンパク質である。高い安定性と高い対称性により、apoFは高解像度のクライオEMイメージングと画像処理に最適なサンプルです。したがって、ApoFは、クライオEM機器11、12、13の性能を評価するための標準サンプルとなっている。15 mg/mL の精製 apoF サンプルを含む凍結アリコートを氷上で解凍し、10,000 x g で 10 分間遠心分離することにより清澄化しました。上清を20 mM HEPES pH 7.5、150 mM NaClで5 mg/mLに希釈した。希釈サンプル3 μLを、グロー放電されたR-1.2/1.3、300メッシュのゴールドグリッド上に30秒間塗布した。次いで、グリッドを5秒間ブロットした後、液体窒素で冷却した液体エタンに急落凍結させた。プランジ凍結は、湿度100%および4°Cで全自動ガラス化保存システムを用いて行った。 すべてのグリッドはオートグリッドでクリップされ、200kVのクライオTEMにロードされました。約3000本の映画が300本の映画/時のスループットで収集された。i)Relion3.1 の代わりにRelion 4-betaバージョンが使用され、ii)以前のapoF再構成の2Dクラス平均を参照として使用して自動粒子ピッキングが行われ、iii)最初の3Dモデルが以前のapoF再構成から生成され、15-Å解像度にローパスされた。使用されるAFIS手順34は、報告された解像度で3D マップを再構築するためにデータ品質を制限しないビームチルト誘発位相シフトを効率的かつ確実に最小限に抑えることが証明されているため、このデータセットに対して光学のグループ化は行われなかった。ベイジアン研磨とCTF精錬後の3D精錬は、1.68 Å解像度マップをもたらしました。解像度はエヴァルト球補正によってさらに改善され、1.63 Å の解像度マップになりました。データ収集および処理パラメータの概要を 表2に示し、最終的に再構成された密度マップを図 5に示し、フーリエシェル相関(FSC)曲線を 補足図8に示す。
表2:アポフェリジンの3D再構成に使用されるデータ収集および画像処理パラメータ。この表をダウンロードするには、ここをクリックしてください。
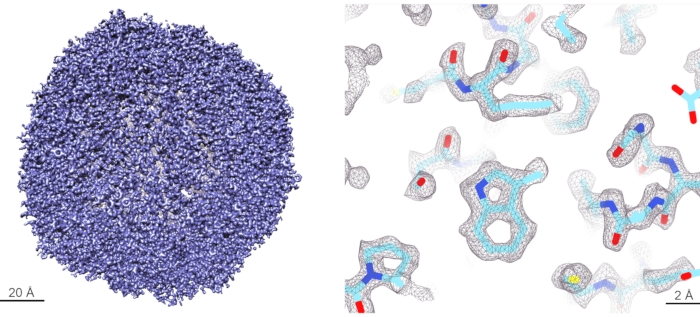
図 5: アポ フェリチン のクライオ EM 再構成 (左パネル) 1.6 Å の解像度で再構築された apoF クライオ EM マップの 3D レンダリング。(右パネル)個々のアミノ酸側鎖のレベルで再構成されたマップの詳細図。アミノ酸側鎖の密度はよく解かれており、原子モデルはこのマップ内で明確に構築することができます。 この図の拡大版を表示するには、ここをクリックしてください。
SPA再構成においてエネルギーフィルターを使用することの効果および利点を、T.アシ ドフィラムから単離された原核生物20Sプロテアソームを用いて評価した。原核生物20Sプロテアソームは、D7対称性を有するプロテアソーム複合体の安定な触媒コアを表すため、標準的なクライオEMサンプルとしても使用されている。グリッドは、精製 されたT.アシドフィルム 20Sプロテアソームサンプルをグロー放電された200メッシュR2/1銅グリッド上に4.5μL添加することによって調製した。サンプルは、ブロット力20、ブロットタイム4.5秒で湿度100%に設定した全自動ガラス化システムを使用して、液体エタン/プロパン混合物中でガラス化しました。
エネルギーフィルタの異なるスリット幅を使用して、同様のグリッド正方形を有する同じクライオEMグリッドから、i)全開スリット(スリット挿入なし)、ii)20eVスリット、iii)10eVスリットの順に、3つの異なるデータセットが収集された。グリッドの正方形は、解析ソフトウェア内の氷質フィルタを使用して選択しました。データ収集とデータ処理のための他のすべてのパラメーターは同じに保たれました。データセットは、合計4000本の映画で15時間収集され、Relion3.1を使用して11で説明した方法を使用して処理され、ラプラシアン・オブ・ガウス・パーティクル・ピッキング・アルゴリズムを使用して、完全なデータセットから参照ベースのパーティクル・ピッキングの初期2Dクラス平均が生成されました。ランダムに選択されたパーティクルの同じ数(102,200)が選択され、各データセットの最終反復と3D再構成に使用されました。データ処理変数は、補足図9に示すFSC曲線とともに図6に示す最終的な再構成EM密度マップを達成するために、以下の表(表3)に記述されています。光学系のグループ化とエワルド球補正も、これらのデータセットに対しては行われませんでした。
表3:T.アシドフィルム20Sプロテアソームの3D再構成に使用されるデータ収集および画像処理パラメータ。この表をダウンロードするには、ここをクリックしてください。
表4:異なるエネルギースリット幅を有するデータセットを用いたT. acidophilum 20SプロテアソームのクライオEM再構成のための達成された分解能およびB因子の要約。この表をダウンロードするには、ここをクリックしてください。
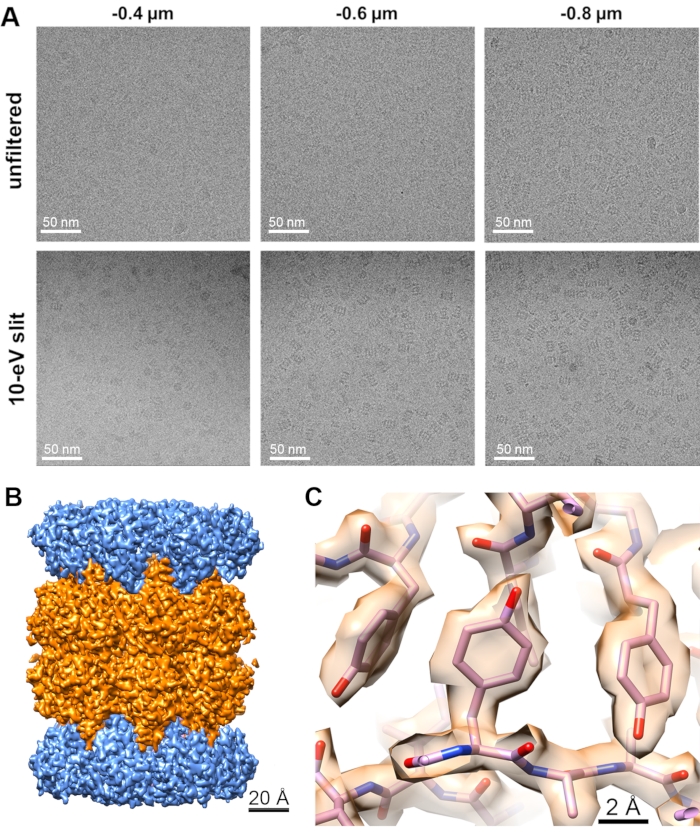
図6:クライオEM画像に対するエネルギーフィルタリングの影響。(A)10eVスリットの有無にかかわらず収集された異なるデフォーカス値でのクライオEM画像。(B)セグメント化されたサブユニットを有する20SプロテアソームクライオEMマップの概要。(C)適合原子モデルによる20Sプロテアソームマップのズームビュー。この図の拡大版を表示するには、ここをクリックしてください。
補足図1:100倍から165,000倍の全倍率範囲で見える六角形の氷の結晶を使用して、解析ソフトウェア内の異なる光学プリセット(赤色の楕円)間で画像シフトを整列させるための画像シフトタスク(黄色の楕円)のキャリブレーション。 (トップへ)データ集録プリセットと穴/ユーセントリック高さプリセット間のキャリブレーション、(中央)穴/ユーセントリック高さプリセットとグリッドスクエアプリセット間のキャリブレーション、(下)グリッドスクエアプリセットとアトラスプリセット間のキャリブレーション。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2:解析ソフトウェアの自動設定機能(黄色の楕円)。 (左画像)取得した画像。(右画像)同心円状のトン環とそのCTFフィットを示す取得した画像のフーリエ転写を放射状ビームで示す。 このファイルをダウンロードするには、ここをクリックしてください。
補足図3:昏睡状態整列のための解析ソフトウェア(黄色の楕円)のオートコマ機能のユーザインタフェース。 画像パネルには、異なるビーム傾斜で取得されたフーリエ転写画像と、コマの計算に使用されるCTF適合度が表示されます。 このファイルをダウンロードするには、ここをクリックしてください。
補足図4:エネルギーフィルタチューニングのユーザインタフェース 仕様内のすべてのパラメータ(緑色のテキストで表示)を持つエネルギーフィルタの等色度の良好なチューニングレポートの例。 このファイルをダウンロードするには、ここをクリックしてください。
補足図5:エネルギーフィルタチューニングのユーザインタフェース 仕様内のすべてのパラメータ(緑色のテキストで表示)を含むエネルギーフィルタ倍率歪みの良好なチューニングレポートの例。 このファイルをダウンロードするには、ここをクリックしてください。
補足図6:エネルギーフィルタチューニングのユーザインタフェース エネルギーフィルタの色歪みを仕様内のすべてのパラメータ(緑色のテキストで表示)で適切に調整した例。 このファイルをダウンロードするには、ここをクリックしてください。
補足図 7: EPU 品質モニターの DataViz パネルと、収集されたクライオ EM データセットのデータ品質の概要。 収集されたすべての画像/動画から集計されたデータを含むグラフは、CTF適合信頼度(青)、焦点ずれ(オレンジ)、乱視(緑)など、選択した重要な品質指標の値(ドットプロット)と分布(棒グラフ)を示します。収集された画像/動画のサブセットは、DataViz パネルの上部でパラメータフィルタを設定することで選択できます。フィルターを適用した後、選択した画像/ムービーをエクスポートして、RelionやCryoSparkなどの別の画像処理パッケージでさらに処理することができます。 このファイルをダウンロードするには、ここをクリックしてください。
補足図8:Relion 4-βによって報告された1.6Å分解能へのapoFの最終再構成のFSC曲線。 青い曲線は、相互に排他的な 2 つのハーフ データセットからの 2 つの独立して洗練された 3D 再構成からのマスクされた 3D マップの FSC を示しています。0.143 のゴールドスタンダード FSC によると、完全なデータセットから再構築された最終的な 3D マップの解像度は 1.6 Å に相当します。オレンジ色の曲線は、ランダム化された位相を持つマスクされた3D再構成のFSCを示しています。FSC曲線の急速な低下は、使用されたマスクが、〜2Å解像度を超えて元の再構成されたマップ(青色の曲線)の観察されたFSCに寄与しなかったことを示している。 このファイルをダウンロードするには、ここをクリックしてください。
補足図9:Relion 3.1によって報告されたように、エネルギーフィルターの異なるスリット幅を用いた T.アシドフィルム 20Sプロテアソームの最終再構成のFSC曲線。 青い曲線は、各データセットの 2 つの半分のデータセットからの 2 つの独立して洗練された再構成からのマスクされた 3D マップの FSC を示しています。0.143 のゴールドスタンダード FSC は、それぞれの完全なデータセットから再構築された最終的な 3D マップの達成解像度を示します (それぞれ 2.3 Å、2.2 Å、および 2.1 Å の解像度)。赤い曲線は、ランダム化された位相を持つマスクされたマップのFSCを示しています。赤色のFSC曲線の急速な低下は、使用されたマスクが〜3Åの解像度を超えて元の再構築されたマップのFSCに寄与しなかったことを示している。緑色の曲線は、マスクされていない 3D マップの FSC を示しており、再構築された 3D ボリューム全体のノイズの影響を受けるため、マスクされた 3D マップの FSC よりも早く低下します。 このファイルをダウンロードするには、ここをクリックしてください。
データの可用性: クライオEM密度マップは、アクセッション番号:アポフェリチン:EMD 14173、EMPIAR-10973の下でEMデータバンクに寄託されています。20Sプロテアソーム:EMD 14467、EMPIAR-10976。
ディスカッション
記載されたプロトコルは、使用されるTEM顕微鏡の光学系が良好に整列した状態にあることを前提としている。このプロトコルで使用される 200 kV TEM の場合、このようなカラム位置合わせは、顕微鏡の設置または重要なサービス介入後に経験豊富なサービスエンジニアによって行われ、検証され、保存されます。これらのアライメント設定は、顕微鏡UIでいつでも呼び出すことができます。ユーザーは、顕微鏡UIのダイレクトアライメント手順を使用して、重要なパラメータを再調整できます。銃の傾きや銃のシフトなど、一部のアライメントは安定しており、ユーザーが日常的に調整する必要はありません。顕微鏡監督者による銃の傾きとシフトのチェックと再調整(必要に応じて)は、年に2回アドバイスされます。一方、一部のアライメントは重要であり、上記のプロトコルで説明したように、各データ収集の前にアライメントする必要があります(客観的な乱視や昏睡状態のないアライメントなど)。解析ソフトウェアのオートコマ機能が収束しない場合は、ビーム傾斜ピボットポイントや回転中心の位置合わせを検証・調整し、C2アパーチャの正しいセンタリングを確認する必要があります。その後、客観的なスティグメータが昏睡状態の修正にも使用されるため、自動設定機能を実行する必要があります。これらの配置は、自動関数と自動昏睡関数の両方が最初の反復で成功するまで繰り返す必要があります。必要に応じて、別の領域(例えば、氷のないカーボン箔を支持する)、画像化された焦点ずれの調整、または画像取得時間の増大、取得された画像における信号対雑音比の最適化、および取得された画像のフーリエ変換における複数のThonリングの可視性が選択され得る。
最新のクライオEM顕微鏡は、データセットあたり1TBを超える大量のデータを生成し、特に対称性の低いタンパク質に対して高解像度の3D再構成を実現します。クライオEMのデータと結果は、通常、各科学プロジェクトにおける構造と機能の関係を完全に理解するために、直交法からのデータと結果によって補完されます。収集されたデータの編成、画像処理パイプラインへの転送、および結果として生じるクライオEM再構成の共有をコラボレーター間で行うことで、クライオEM方法論の新規採用者がローカルITインフラストラクチャをセットアップするための追加の要件が課せられます。Athenaなどのデータ管理ソフトウェアは、接続された機器または登録ユーザーが操作するソフトウェアによって取得されたデータの集中保存を容易にします。保存されたデータとメタデータには、ログイン資格情報と実験設定のデータ共有定義に基づいて、異なるアクセス権 (所有者、共同作業者、または閲覧者として) を持つプロジェクト内で異なるロールを持つことができる複数のユーザーが、シンプルな Web ブラウザー インターフェイスを使用してアクセスできます。この実験ワークフローのデジタル化は、不必要な重複なしにコラボレーター間でデータとメタデータを共有する手段を提供し、使用されるワークフローの生産性とトレーサビリティを向上させます。データ管理ソフトウェアにおけるプロジェクト、実験、およびワークフローの一般的でカスタマイズ可能な構造の実装は普遍的であり、補完的な方法を使用して直交実験のカスタマイズと単一のプロジェクトデータベースへの統合を可能にします。
クライオEMグリッド上のデータ収集領域の選択は、高解像度データセットの取得を成功させるために不可欠です。Vitrobot(完全自動ガラス化保存システム)などの従来のプランジ凍結装置で製造されたクライオEMグリッドは、通常、グリッド表面上の氷厚の勾配を表示します(図4)。グリッドには氷の厚さが異なる領域が含まれているため、これは有益です。ただし、データ収集に理想的な氷厚のエリアは、上記のプロトコルで説明されているように識別する必要があります。最適なクライオEMグリッドは、転写氷の汚染をできるだけ少なくし、無傷の穴あいた支持箔を備えた十分なグリッド正方形を含む必要があります。亀裂や壊れた領域を持つグリッド正方形に関するデータの収集は、収集された画像が、無傷の支持箔を有するグリッド正方形と比較して、電子ビームによる照明時に有意に強い全体的なドリフトの影響を受けるため、推奨されない。過剰な結晶氷は、箔穴の大部分を閉塞し、および/またはオートフォーカスを妨げる可能性があり、そのようなグリッド正方形も避けるべきである。薄い氷のあるグリッド正方形は、通常、大きなガラス質領域と、アトラスプリセットを使用して撮影された画像に見える多くの明るい箔穴を示します。グリッドバーの近くに厚い氷が発生することは、グリッド正方形のこれらの領域の箔穴が穴の選択手順中に除外されるため、予想され、重要ではありません。グリッドの正方形にいくつかの空の穴が存在することは、周囲の穴のガラス質の氷が非常に薄く、損傷した粒子または粒子がまったく含まれていない可能性があることを示している可能性があります。一般に、どの領域が高解像度データ収集に最適な条件を持ち、理想的な粒子密度と配向分布を示すかを理解するために、最初のスクリーニングと評価のためにグリッド上のさまざまな領域でさまざまな氷の厚さを持つグリッド正方形を選択することが賢明です。この研究で使用したapoFおよび20Sプロテアソームサンプルの場合、観察可能な氷が最も薄い領域には、これらのサンプルの高解像度イメージングに最適な条件が含まれています。
データ収集ソフトウェアを使用して選択したすべてのグリッド正方形の穴を自動的に選択する場合は、各グリッド正方形の代表的な穴に対してテンプレート実行タスクを実行して、過度に厚いか、過度に薄くないか、または予期せず非ガラス質の正方形がデータ収集のために選択されていないことを確認することをお勧めします。データ集録中に、EQMを使用して、画像ドリフトやCTFフィッティングなど、収集された画像の主要な品質指標を監視できます。データ収集は、低品質の画像を生成する領域をスキップすることによって最適化できます。ただし、高解像度のCTF適合画像には、いくつかの好ましい向きの粒子または薄すぎる氷層で変性した粒子を含む画像が含まれることがあります。収集された画像からのリアルタイムの粒子ピッキングと2D分類は、画像化された粒子の構造データの品質に関する追加情報を提供し、氷中の無傷の粒子の好ましい配向または(部分的に)変性した粒子の不整合な構造の両方を明らかにする。したがって、クラス平均の計算は、他のソフトウェアパッケージ23、28で既に実装および示されているように、データ収集のための適切な領域をさらに洗練させるのに役立つ可能性がある。
倍率、電子線量率、デフォーカス範囲などのデータ取得用のイメージング設定の選択は、ターゲット解像度、タンパク質のサイズ、サンプル濃度、所望の顕微鏡スループットなど、いくつかの基準に依存します。これらの実験で使用した直接電子検出器カメラでは、平行照明を維持するために適切なSPOTサイズと強度を選択することにより、電子線量率を4〜5e-/pix/sの範囲で選択した。 表1に示すように、穴/ユーセントリック高さプリセットで異なるSPOTサイズを使用して、データ収集中に穴をセンタリングするための十分な信号対雑音比を画像内で保証することができます。倍率は、ピクセルサイズがクライオEM再構成のターゲット解像度よりも少なくとも2〜3倍小さくなるように選択する必要があります。しかし、より高い倍率(すなわち、より小さいピクセルサイズ)が使用されるほど、画像にキャプチャされる視野が小さくなり、画像あたりの粒子が少なくなり、最終的に3Dマップを高解像度に再構築するのに十分な粒子を含む画像を収集するためのデータ収集時間が長くなる。apoFサンプルでは、画像内の粒子の高密度に十分なサンプル濃度があり、再構成の解像度が2 Å未満を目指したため、0.43 Åのピクセルサイズを使用しました。20Sプロテアソームサンプルでは、0.68 Åのピクセルサイズを使用して、取得した画像でより大きな視野をカバーしました。通常、200 kV TEM 顕微鏡では、クライオ EM 画像は 0.8 ~ 2.0 μm のデフォーカス範囲で取得されます。しかし、エネルギーフィルタを使用したコントラストと信号対雑音比の向上により、収差が小さくなり、CTFエンベロープ関数の減衰が低減されるため、データ取得を焦点に近づけて、取得した画像の高解像度情報をより適切に保存できます。また、対物絞りは、エネルギーフィルタを使用して画像コントラストがすでに十分に強化されている間、追加の画像収差を導入する可能性があるため、使用しません。apoFおよび20Sプロテアソームサンプルについては、0.5μm、0.7μm、および0.9μmのデフォーカス設定を使用しました。より小さなタンパク質(<200 kDa)の場合、-0.5 μm、-0.7 μm、および-0.9 μmのデフォーカス設定を使用して粒子のコントラストを改善し、3D再構成の3D微細化ステップで粒子の選択と初期の粗いアライメントを容易にし、約2.5 Åの解像度の3Dマップ(未発表の結果)をもたらしました。
エネルギーフィルタによるイメージングは、ハイエンドの300kV TEM顕微鏡11で収集されたクライオEM画像における信号対雑音比(SNR)を改善することをすでに示しました。実際、電子が試料を通過すると、主に2種類の相互作用が起こります:i)弾性散乱電子は、位相コントラスト機構を介して非散乱入射ビームとの干渉によってエネルギーを維持し、画像形成に寄与するii)非弾性散乱電子は試料中のエネルギーをいくらか失い、主に画像内のノイズに寄与する。したがって、入射ビームよりもエネルギーの低い非弾性散乱電子や弾性散乱電子を狭いエネルギースリットを用いてフィルタリングすることにより、SNRを大幅に向上させることができる。ただし、高解像度クライオEMデータセットの自動データ取得に長時間(12時間以上)にわたって非常に狭い(10eV以下)スリットを使用できるようにするには、SelectrisやSelectris-Xなどの十分に安定したエネルギーフィルタを使用することが重要です。
300 kV TEM顕微鏡と同じ条件で200 kV TEM顕微鏡で取得したクライオEM画像は、CTFエンベロープ機能の減衰が速いため、高解像度(特に<4 Å)でSNRが小さくなります。したがって、200 kV TEMを使用する場合、特定の解像度を達成するためには、より多くの粒子(したがって、より多くの収集された画像)が必要です。さらに、被写界深度(2-3 Å Å の解像度範囲で 10-25 nm)も 200 kV 画像 35 で約 20% 小さくなり、氷層内のより少ない粒子 (通常は厚さ 20 ~ 50 nm ) が完全に焦点を合わせ、3D 再構成手順の後期段階で各粒子に対して個別にデフォーカス値が調整されない限り、計算された3D 再構成のすべての高解像度特性に建設的に貢献します。より大きな粒子(二十面体ビリオンまたは他の高分子集合体など)の場合、粒径は、高解像度で被写界深度を超え、標準的な3D再構成アルゴリズム36におけるエワルド球の平面近似に起因する位相誤差を導入する可能性がある。これらの誤差は、共通のクライオEM画像処理パッケージ37、28、39に既に実装されている高度なアルゴリズムによって精緻化することができる。エワルド球は300kVデータよりも200kVデータにおける曲率が大きいため、200kV TEMを使用する場合、エワルド球補正は比較的低い分解能および/または比較的小さな高分子集合体に必要である。一方、200kVの画像は、200-300keVの電子平均自由行程(220-280nm)よりも著しく薄い、薄氷(20-50nm)中の粒子のより高いコントラストを示す。コントラストが高いほど、個々の粒子の正しいグローバルアライメント、特に構造がまだ不明で、3D参照モデルがまだ十分に確立されていない小さなタンパク質を弱く散乱させる場合に改善するのに役立ちます。
ここでは、200kV TEM顕微鏡を使用した場合、エネルギーフィルターで画像のコントラストと品質を同様に改善できることを、20Sプロテアソームの例で実証しました。同じ数の粒子を使用して、20eVスリットを使用して収集されたデータは、2.34Å分解能のみに再構築された完全に開いたエネルギースリットで収集されたデータと比較して、2.26Åの分解能に再構築された。最良の再構成は、2.14 Å の分解能に再構築された 10 eV スリットを使用して収集されたデータから達成されました。これらの結果は、 表4に要約されているように、非弾性散乱電子のフィルタリングが収集された画像のSNRを増加させ、所定の数の粒子からのクライオEM再構成におけるより高い分解能を促進するという理論的予測と一致している。これらの結果は、これらのデータセットから計算されたB因子によってさらに確認され、エネルギーフィルタリングされたデータセット内の画像の高品質を示す。
したがって、300 kV TEM顕微鏡はクライオEM再構成において最高のスループットと最高の分解能を提供する一方で、200 kV TEM顕微鏡は高解像度クライオEM再構成のための高品質のデータセットも提供すると結論付けることができます。我々はここで、エネルギーフィルターと直接電子検出器を備えた200kV TEMを使用することにより、取得した画像の品質、したがって構造までの全体的な時間をさらに改善できることを示した。提示されたプロトコルは、このセットアップを使用して高分解能クライオEMデータを日常的に取得し、構造生物学および構造ベースの薬物設計における重要な構造機能関係を理解するために不可欠な高分子3D構造の微細構造の詳細を明らかにする方法に必要なすべての手順を説明しています。
開示事項
サガル・ハヴネカールは利益相反はないと報告している。他の著者は、MSD-EM部門であるサーモフィッシャーサイエンティフィックの従業員です。
謝辞
何一つ。
資料
| Name | Company | Catalog Number | Comments |
| AutoGrid rings | Thermo Fisher Scientific | 1036173 | Package of 100x AutoGrid rings for the standard EM grids. |
| C-Clip | Thermo Fisher Scientific | 1036171 | Package of 100 clips that secure the standard EM grids inside the AutoGrid rings. |
| Data Management Platform | Thermo Fisher Scientific | 1160939 | Part of the Glacios base configuraiton; includes Athena Software |
| EPU Quality Monitor | Thermo Fisher Scientific | 1179770 | |
| EPU Software | Thermo Fisher Scientific | 1025080 | Part of the Glacios base configuration |
| Ethane 3.5 | Westfalen | A06010110 | Ethane gas used for making liquid ethane (puritiy at least N35, i.e. 99.95% vol) |
| Falcon 4 200kV | Thermo Fisher Scientific | 1166936 | Direct electron detector |
| Glacios | Thermo Fisher Scientific | 1149551 | 200 kV TEM |
| GloQube Plus Glow Discharge System for TEM Grids and surface modification | Quorum | N/A | also available via Thermo Fisher Scientific (PN 1160602) |
| QuantiFoil grids | Quantifoil | N/A | R-2/1, 300 mesh; carbon foil grid |
| Relion | MRC Laboratory of Molecular Biology | N/A | open source software: https://relion.readthedocs.io/en/release-3.1/ |
| Selectris with Falcon 4 for 200 kV | Thermo Fisher Scientific | 1191753 | Energy filter |
| Selectris X with Falcon 4 for 200 kV | Thermo Fisher Scientific | 1191755 | Energy filter |
| UltrAuFoil grids | Quantifoil | N/A | R-1.2/1.2, 300 mesh; gold foil grids |
| Vitrobot Mk. IV | Thermo Fisher Scientific | 1086439 | Automated vitrification system |
| Whatman 595 filter paper | Thermo Fisher Scientific | AA00420S |
参考文献
- Wang, J., Hua, T., Liu, Z. -. J. Structural features of activated GPCR signaling complexes. Current Opinions in Structural Biology. 63, 82-89 (2020).
- Chen, S., Gouaux, E. Structure and mechanism of AMPA receptor - auxiliary protein complexes. Current Opinions in Structural Biology. 54, 104-111 (2019).
- Kühlbrandt, W. Structure and mechanisms of F-Type ATP synthases. Annual Review of Biochemistry. 88, 515-549 (2019).
- Laverty, D., et al. Cryo-EM structure of the human α1β3γ2 GABA A receptor in a lipid bilayer. Nature. 565 (7740), 516-520 (2019).
- Liu, F., Zhang, Z., Csanády, L., Gadsby, D. C., Chen, J. Molecular structure of the Human CFTR ion channel. Cell. 169 (1), 85-95 (2017).
- Wrapp, D., et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science. 367 (6483), 1260-1263 (2020).
- Ke, Z., et al. Structures and distributions of SARS-CoV-2 spike proteins on intact virions. Nature. 588, 498-502 (2020).
- Yan, R., Zhang, Y., Li, Y., Xia, L., Guo, Y., Zhou, Q. Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2. Science. 367 (6485), 1444-1448 (2020).
- Walls, A. C., Park, Y. -. J., Tortorici, M. A., Wall, A., McGuire, A. T., Veesler, D. Structure, function, and antigenicity of the SARS-CoV-2 spike glycoprotein. Cell. 180, 281-292 (2020).
- Chiba, S., et al. Multivalent nanoparticle-based vaccines protect hamsters against SARS-CoV-2 after a single immunization. Communications Biology. 4 (1), 597 (2021).
- Nakane, T., et al. Single-particle cryo-EM at atomic resolution. Nature. 587, 152-156 (2020).
- Bai, X. C. Seeing atoms by single-particle Cryo-EM. Trends in Biochemical Sciences. 46 (4), 253-254 (2021).
- Koh, A., et al. High-resolution cryo-EM at 200kV enabled by Selectris-X and Falcon 4. Microscience Microscopy Congress 2021. , (2021).
- Herzik, M. A., Wu, M., Lander, G. C. Achieving better-than-3-Å resolution by single-particle cryo-EM at 200 keV. Nature Methods. 14 (11), 1075-1078 (2017).
- Herzik, M. A., Wu, M., Lander, G. C. High-resolution structure determination of sub-100 kDa complexes using conventional cryo-EM. Nature Communications. 10 (1), 1032 (2019).
- Wu, M., Lander, G. C., Herzik, M. A. Sub-2 Angstrom resolution structure determination using single-particle cryo-EM at 200 keV. Journal of Structural Biology X. 4, 100020-100029 (2020).
- Mori, T., et al. C-Glycoside metabolism in the gut and in nature: Identification, characterization, structural analyses and distribution of C-C bond-cleaving enzymes. Nature Communications. 12 (1), 6294 (2021).
- Hamdi, F., et al. 2.7 Å cryo-EM structure of vitrified M. musculus H-chain apoferritin from a compact 200 keV cryo-microscope. PLoS One. 15 (5), 0232540 (2020).
- Abbott, S., et al. EMDB web resources. Current Protocols in Bioinformatics. 61 (1), 1-12 (2018).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. CryoSPARC: algorithms for rapid unsupervised cryo-EM structure determination. Nature Methods. 14 (3), 290-296 (2017).
- Scheres, S. H. W. RELION: Implementation of a Bayesian approach to cryo-EM structure determination. Journal of Structural Biology. 180 (3), 519-530 (2012).
- Gómez-Blanco, J., et al. Using Scipion for stream image processing at Cryo-EM facilities. Journal of Structural Biology. 204 (3), 457-463 (2018).
- Tegunov, D., Cramer, P. Real-time cryo-electron microscopy data preprocessing with Warp. Nature Methods. 16 (11), 1146-1152 (2019).
- Lander, G. C., et al. Appion: an integrated, database-driven pipeline to facilitate EM image processing. Journal of Structural Biology. 166 (1), 95-102 (2009).
- Carragher, B., et al. Current outcomes when optimizing 'standard' sample preparation for single-particle cryo-EM. Journal of Microscopy. 276 (1), 39-45 (2019).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta Crystallographica. Section D, Structural Biology. 74 (6), 560-571 (2018).
- Bloch, M., Santiveri, M., Taylor, N. M. I. Membrane protein Cryo-EM: Cryo-grid optimization and data collection with protein in detergent. Methods in Molecular Biology. 2127, 227-244 (2020).
- Cheng, A., et al. Leginon: New features and applications. Protein Science. 30 (1), 136-150 (2021).
- Schorb, M., et al. Software tools for automated transmission electron microscopy. Nature Methods. 16 (6), 471-477 (2019).
- Li, X., et al. Electron counting and beam-induced motion correction enable near-atomic-resolution single-particle cryo-EM. Nature Methods. 10 (6), 584-590 (2013).
- Alewijnse, B., et al. Best practices for managing large CryoEM facilities. Journal of Structural Biology. 199, 225-236 (2017).
- Baldwin, P. R., et al. Big data in cryoEM: automated collection, processing and accessibility of EM data. Current Opinion in Microbiology. 43, 1-8 (2018).
- Guo, H., et al. Electron-event representation data enable efficient cryoEM file storage with full preservation of spatial and temporal resolution. International Union of Crystallography Journal. 7, 860-869 (2020).
- Weis, F., Hagen, W. J. H. Combining high throughput and high quality for cryo-electron microscopy data collection. Acta Crystallographica. Section D, Structural Biology. 76 (8), 724-728 (2020).
- Zhou, H., Chiu, W. Determination of icosahedral virus structures by electron cryomicroscopy at subnanometer resolution. Advances in Protein Chemistry. 64, 93-124 (2005).
- DeRosier, D. J. Correction of high-resolution data for curvature of the Ewald sphere. Ultramicroscopy. 81 (2), 83-98 (2000).
- Wolf, M., DeRosier, D. J., Grigorieff, N. Ewald sphere correction for single-particle electron microscopy. Ultramicroscopy. 106 (4-5), 376-382 (2006).
- Leong, P. A., Yu, X., Hong Zhou, Z., Jensen, G. J. Correcting for the ewald sphere in high-resolution single-particle reconstructions. Methods in Enzymology. 482, 369-380 (2010).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 42166 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved