Method Article
Raccolta di routine di set di dati crio-EM ad alta risoluzione utilizzando un microscopio elettronico a trasmissione da 200 KV
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Le mappe crio-EM ad alta risoluzione delle macromolecole possono essere ottenute anche utilizzando microscopi TEM da 200 kV. Questo protocollo mostra le best practice per l'impostazione di allineamenti ottici accurati, schemi di acquisizione dati e selezione di aree di imaging che sono tutti essenziali per la raccolta di set di dati ad alta risoluzione utilizzando un TEM da 200 kV.
Abstract
La microscopia crioelettronica (cryo-EM) è stata stabilita come metodo di routine per la determinazione della struttura proteica negli ultimi dieci anni, prendendo una quota sempre crescente di dati strutturali pubblicati. I recenti progressi nella tecnologia e nell'automazione TEM hanno aumentato sia la velocità di raccolta dei dati che la qualità delle immagini acquisite, riducendo contemporaneamente il livello di competenza richiesto per ottenere mappe crio-EM a risoluzioni inferiori a 3 Å. Mentre la maggior parte di tali strutture ad alta risoluzione sono state ottenute utilizzando sistemi crio-TEM a 300 kV all'avanguardia, le strutture ad alta risoluzione possono essere ottenute anche con sistemi crio-TEM da 200 kV, specialmente se dotati di un filtro di energia. Inoltre, l'automazione degli allineamenti dei microscopi e della raccolta dei dati con valutazione della qualità delle immagini in tempo reale riduce la complessità del sistema e assicura impostazioni ottimali del microscopio, con conseguente aumento della resa di immagini di alta qualità e throughput complessivo della raccolta dei dati. Questo protocollo dimostra l'implementazione dei recenti progressi tecnologici e delle funzionalità di automazione su un microscopio elettronico a criotrasmissione da 200 kV e mostra come raccogliere dati per la ricostruzione di mappe 3D sufficienti per la costruzione di modelli atomici de novo . Ci concentriamo sulle best practice, sulle variabili critiche e sui problemi comuni che devono essere considerati per consentire la raccolta di routine di tali set di dati crio-EM ad alta risoluzione. In particolare, vengono esaminati in dettaglio i seguenti argomenti essenziali: i) automazione degli allineamenti del microscopio, ii) selezione delle aree adatte per l'acquisizione dei dati, iii) parametri ottici ottimali per la raccolta di dati di alta qualità e ad alta produttività, iv) sintonizzazione del filtro energetico per l'imaging a perdita zero e v) gestione dei dati e valutazione della qualità. L'applicazione delle migliori pratiche e il miglioramento della risoluzione raggiungibile utilizzando un filtro energetico saranno dimostrati sull'esempio di apo-ferritina che è stata ricostruita a 1,6 Å e del proteasoma Thermoplasma acidophilum 20S ricostruito a risoluzione 2,1-Å utilizzando un TEM da 200 kV dotato di un filtro energetico e di un rivelatore di elettroni diretto.
Introduzione
La determinazione della struttura proteica è fondamentale per comprendere l'architettura molecolare, la funzione e la regolazione dei complessi proteici coinvolti nei processi cellulari chiave, come il metabolismo cellulare, la trasduzione del segnale o le interazioni ospite-patogeno. La crio-microscopia elettronica (cryo-EM) è emersa come una potente tecnica in grado di risolvere la struttura 3D di molte proteine e dei loro complessi che erano troppo impegnativi per le tecniche strutturali tradizionali, come la diffrazione a raggi X e la spettroscopia NMR. In particolare, la crio-EM è stata dimostrata come il metodo di scelta per le proteine di membrana, che non possono essere facilmente cristallizzate o preparate in quantità sufficienti per le tecniche strutturali tradizionali, e ha fornito nuove informazioni sulla struttura e la funzione di importanti recettori cellulari e canali ionici 1,2,3,4,5 . Più recentemente, la crio-EM ha svolto un ruolo importante nella lotta contro la pandemia di Covid-19 determinando il meccanismo dell'infezione da SARS-CoV-2 a livello molecolare, che ha chiarito le origini della malattia Covid-19 e ha fornito la base per il rapido sviluppo di vaccini e terapie efficienti 6,7,8,9,10.
Tipicamente, i microscopi elettronici a trasmissione da 300 kV di fascia alta (TEM) vengono utilizzati per la determinazione della struttura ad alta risoluzione delle biomolecole mediante analisi crio-EM a singola particella (SPA) per rivelare la loro conformazione e interazioni. Recentemente, la tecnica SPA ha raggiunto una nuova frontiera quando il campione comune di riferimento crio-EM apo-ferritina è stato ricostruito a risoluzione atomica (1,2 Å)11,12 utilizzando un TEM da 300 kV dotato della pistola a emissione di campo freddo (E-CFEG), un rivelatore di elettroni diretti e un filtro di energia. A questa risoluzione, è stato possibile risolvere in modo inequivocabile le posizioni dei singoli atomi nella struttura, la conformazione delle singole catene laterali di amminoacidi, nonché il legame idrogeno e altre interazioni, che aprono nuove possibilità per la scoperta di farmaci basati sulla struttura di nuovi bersagli e l'ottimizzazione dei farmaci candidati esistenti.
I microscopi TEM da 200 kV di fascia media sono spesso utilizzati per lo screening dei campioni e l'ottimizzazione dei campioni prima della raccolta finale dei dati ad alta risoluzione utilizzando i microscopi TEM di fascia alta, in particolare nelle strutture crio-EM più grandi. In genere, i campioni ripresi possono essere risolti nell'intervallo di risoluzione 3-4 Å che è sufficiente per passare a un TEM a 300 kV di fascia alta per la raccolta finale dei dati. Di conseguenza, la raccolta dei dati utilizzando il TEM da 200 kV spesso non viene ulteriormente ottimizzata per ottenere i risultati con la massima risoluzione possibile. Inoltre, molte interessanti domande biologiche possono già essere risolte e pubblicate a queste risoluzioni poiché tutte le catene laterali degli amminoacidi sono già risolte e l'occupazione dei siti di legame del ligando può anche essere determinata in modo affidabile13. È già stato dimostrato che i TEM a 200 kV possono raggiungere risoluzioni superiori a 3 Å per numerosi campioni 14,15,16,17,18. Le immagini scattate a 200 kV mostrano un contrasto intrinsecamente più elevato delle particelle fotografate, che può anche facilitare un allineamento iniziale più accurato delle particelle nonostante un segnale più attenuato ad alta risoluzione rispetto alle immagini TEM da 300 kV. È importante notare che la risoluzione raggiunta delle mappe crio-EM ricostruite è anche limitata dalla flessibilità strutturale e dall'eterogeneità conformazionale dei campioni ripresi, che influisce sia sulle ricostruzioni a 200 kV che a 300 kV. In effetti, molte più ricostruzioni crio-EM ottenute utilizzando i sistemi a 300 kV sono state risolte nell'intervallo di risoluzione 3-4 Å rispetto a risoluzioni più elevate19. Poiché i microscopi TEM da 200 kV sono meno complessi e si adattano a stanze più piccole, questi microscopi rappresentano una buona opzione a basso costo per la determinazione della struttura delle macromolecole biologiche mediante crio-EM, preservando l'automazione di lunghe raccolte di dati da più campioni memorizzati all'interno del sistema Autoloader del microscopio.
La raccolta di set di dati crio-EM per la determinazione della struttura ad alta risoluzione richiede un allineamento accurato dell'ottica del microscopio. Gli allineamenti delle colonne procedono sistematicamente dalla sorgente di elettroni fino al sistema di lenti del condensatore, alla lente dell'obiettivo e al filtro di energia con un rilevatore di elettroni. La sequenza completa di allineamenti non è in genere richiesta. Quando necessario, l'utente viene guidato tramite procedure semi-automatizzate con una descrizione corretta di ogni passaggio in una finestra di aiuto sensibile al contesto durante la procedura di allineamento nell'interfaccia utente del microscopio (pannello di controllo Direct Alignments). Una volta che il microscopio è completamente allineato, l'ottica elettronica rimane stabile e gli allineamenti non devono essere modificati per almeno alcuni mesi. Solo gli allineamenti più sensibili, come l'illuminazione parallela del piano campione, l'astigmatismo oggettivo e l'allineamento senza coma, devono essere perfezionati poco prima di iniziare la raccolta di ciascun set di dati. La qualità dei dati raccolti può quindi essere monitorata durante la raccolta dei dati utilizzando diversi pacchetti software, come EPU Quality Monitor, cryoSPARC Live20, Relion21, Scipion22, WARP23 o Appion24.
Oltre agli allineamenti accurati del microscopio, l'alta qualità di campioni ben purificati con una minima eterogeneità conformazionale e compositiva è anche un prerequisito per la raccolta di set di dati ad alta risoluzione e la risoluzione di strutture ad alta risoluzione. Maggiori dettagli sui protocolli tipici, le sfide frequenti e i possibili rimedi possono essere trovati in altre recensioni dedicate a questo argomento 25,26,27. In sostanza, è fondamentale trovare aree su una data griglia crio-EM che abbia ghiaccio sufficientemente sottile per preservare informazioni ad alta risoluzione e le singole particelle siano densamente distribuite con orientamenti casuali senza sovrapposizioni. Tuttavia, le tipiche griglie crio-EM hanno uno spessore di ghiaccio non uniforme ed è quindi importante trovare e selezionare le aree ottimali per l'imaging. Diversi mezzi per la stima dello spessore del ghiaccio sulla griglia sono disponibili in pacchetti software dedicati alla raccolta automatizzata di set di dati crio-EM, come EPU 2, Leginon28 o SerialEM29.
L'avvento di rivelatori di elettroni diretti veloci e sensibili ha permesso la raccolta di immagini in molte frazioni come filmati che hanno permesso la compensazione dei movimenti indotti dal fascio e ha comportato un sostanziale aumento della qualità e della quantità di dati utilizzati nell'elaborazione delle immagini e nella ricostruzione 3D finale30. Allo stesso tempo, l'automazione e la raccolta di dati ad alto throughput forniscono enormi set di dati con migliaia di immagini / filmati che rappresentano sfide per l'archiviazione e l'accesso ai dati. Il modello adottato con grandi strutture crio-EM che servono decine a centinaia di utenti richiede in particolare una gestione organizzata dei dati con un corretto tracciamento e condivisione dei dati in pipeline cryo-EM stabilite31,32.
Questo studio descrive un protocollo per la raccolta di routine di set di dati crio-EM ad alta risoluzione utilizzando il microscopio Glacios TEM da 200 kV. Vengono descritti gli allineamenti necessari dell'ottica del microscopio insieme alle procedure per la valutazione dei campioni crio-EM e la selezione delle aree idonee per la raccolta dei dati ad alta risoluzione. L'organizzazione dei dati raccolti e dei relativi metadati con informazioni di esempio è dimostrata in Athena, una piattaforma di gestione dei dati che facilita la revisione delle informazioni di esempio e dei dati raccolti. Utilizzando il campione di apo-ferritina del topo, è stato possibile ottenere una ricostruzione 3D con risoluzione 1,6 Å13. Utilizzando il protocollo descritto, abbiamo anche ricostruito la mappa di densità 3D del proteasoma 20S da Thermoplasma acidophilum a risoluzione 2.1 Å.
Protocollo
Tutte le fasi del protocollo sono descritte per il sistema TEM Glacios da 200 kV (di seguito denominato TEM da 200 kV) dotato del filtro di energia Selectris-X (di seguito denominato filtro di energia) e del rivelatore Falcon 4 (di seguito denominato rivelatore di elettroni diretti). I passaggi del protocollo sono specifici per l'applicazione EPU, che è il software di raccolta dati SPA predefinito preinstallato su ciascun sistema Glacios. I passaggi del protocollo riportati di seguito corrispondono alla versione EPU 2.14 e sono previste piccole modifiche quando si utilizza una versione EPU diversa. I prerequisiti per questo protocollo sono: i) gli allineamenti della pistola e della colonna sono ben allineati, ii) le calibrazioni EM sono corrette e iii) le funzioni automatiche dell'EPU sono correttamente calibrate.
1. Griglia di caricamento nel microscopio
NOTA: Il TEM da 200 kV utilizzato in questo esperimento può contenere fino a 12 autogrid (cioè griglie TEM convenzionali agganciate in una cartuccia speciale) all'interno di una cassetta che viene caricata all'interno dell'Autoloader del microscopio e costantemente mantenuta a temperature inferiori a -170 °C per prevenire la devitrificazione del campione.
- Inserire le cassette autogrid nella cassetta Autoloader in condizioni di azoto liquido.
- Inserire la cassetta con le griglie automatiche in una capsula di trasferimento raffreddata ad azoto liquido.
- Inserire la capsula nel microscopio e fare clic sul pulsante Dock nell'interfaccia utente del microscopio per caricare la cassetta dalla capsula nel caricatore automatico del microscopio.
- Fare clic sul pulsante Inventario per verificare la presenza di griglie automatiche nella cassetta caricata.
- Fare clic sui pulsanti Carica e Scarica per inserire le griglie automatiche nella colonna per l'imaging TEM.
2. Impostazione di un progetto in una piattaforma di gestione dei dati (facoltativo)
NOTA: le informazioni di esempio e i dati raccolti possono essere organizzati nella piattaforma di gestione dei dati fornita che consente l'archiviazione di dati strutturati per tutti gli strumenti collegati. È possibile creare un progetto per il quale è possibile definire tutti i passaggi del flusso di lavoro per acquisire le immagini e i metadati in modo organizzato per la revisione e l'esportazione.
- Avviare l'applicazione del portale di gestione dei dati e accedere con un nome utente e una password.
- Nel pannello di sinistra dell'interfaccia utente del portale, fare clic sul pulsante Aggiungi progetto per creare un nuovo progetto o fare clic su un pulsante di un progetto esistente nell'elenco seguente per aprire un progetto.
- Fare clic sul pulsante Aggiungi esperimento per creare un nuovo esperimento all'interno del progetto aperto.
- Compila la descrizione nel pannello Metadati del nuovo esperimento e fai clic sul pulsante Aggiungi flusso di lavoro per creare un nuovo flusso di lavoro all'interno dell'esperimento (ad esempio, Analisi delle singole particelle).
- Facoltativamente, fare clic sul pulsante Aggiungi passaggio nel pannello centrale per creare un flusso di lavoro personalizzato o aggiungere ulteriori passaggi al flusso di lavoro SPA predefinito (Figura 1 e Figura 2).
NOTA: Le fasi possono rappresentare la preparazione del campione, la caratterizzazione del campione mediante tecniche biochimiche, la vetrificazione del campione, lo screening delle griglie crio-EM, le sessioni di raccolta dei dati e l'analisi dei dati. - Facoltativamente, inserisci le descrizioni nelle Note di ogni passaggio, che possono includere immagini e foto.
- Creare un passaggio del set di dati nel flusso di lavoro e selezionare il tipo di set di dati come EPU.
NOTA: Ciò consentirà al software di analisi di posizionare automaticamente tutti i dati / metadati dei risultati nel posto corretto nel portale di gestione dei dati durante l'acquisizione dei dati ed esportare automaticamente i dati nella destinazione preferita mantenendo una registrazione completa di tutti i passaggi e il trasferimento dei dati. - Compilare i modelli relativi alle griglie Campione ed EM nel passaggio Biochimica e associare ogni griglia a un campione (si noti che un campione può essere associato a più griglie).
- Associare combinazioni di griglie di esempio nella sezione metadati del passaggio Dataset .
3. Impostare i preset di imaging e le calibrazioni dello spostamento dell'immagine nel software di analisi
- Impostare i parametri di imaging per le singole modalità di imaging come illustrato nella Tabella 1. Le considerazioni per la selezione di impostazioni specifiche sono descritte in dettaglio nella sezione Discussione.
- Impostare l'illuminazione parallela per l'ingrandimento scelto nel preset di acquisizione dati del software di analisi
NOTA: esiste una sola impostazione dell'obiettivo C2 per l'illuminazione parallela del campione alla dimensione SPOT specificata (cioè i punti di forza preimpostati dell'obiettivo C1) su sistemi TEM a 2 condensatori, come il TEM da 200 kV utilizzato in questo studio. La dose di elettroni per unità di area (e-/Å2/s) può quindi essere regolata solo modificando le impostazioni della dimensione SPOT e regolando la forza C2 (intensità del fascio) in base ai passaggi seguenti.- Spostati in un'area con lamina di carbonio di supporto e ghiaccio sottile o assente.
- Selezionate l'apertura obiettivo di 100 μm o 70 μm nel menu Apertura dell'interfaccia utente TEM.
- Premere il pulsante Diffrazione sui pannelli di controllo per passare alla modalità di diffrazione.
- Inserire lo schermo fluorescente e modificare la modalità FluCam in Alta risoluzione.
- Spostate il punto di diffrazione centrale su un bordo dell'apertura. Se il bordo dell'apertura non è visibile, aumentare la lunghezza della fotocamera (utilizzando la manopola Ingrandimento).
- Ruotare con attenzione la manopola Focus sul pannello di controllo per mettere a fuoco il piano retrofocale. Il piano retrofocale è messo a fuoco quando il bordo dell'apertura è visibilmente nitido.
- Ridurre la sensibilità della FluCam al livello più basso e spostare il punto di diffrazione centrale al centro della FluCam.
- Ridurre al minimo le dimensioni del punto centrale utilizzando la manopola Intensity sul pannello di controllo.
- Ritrae l'apertura dell'obiettivo nell'interfaccia utente TEM e torna alla modalità di imaging.
- Fare clic sul pulsante Ottieni nel software di analisi per salvare le impostazioni nel predefinito di acquisizione dati.
- Regolare la dose di elettroni nel preset di acquisizione dati ottimale per il rilevatore utilizzato:
- Spostarsi in un'area vuota sulla griglia (ad esempio un quadrato della griglia con un foglio di carbonio rotto)
- Fare clic sul pulsante Misura dose nel software di analisi per misurare la dose di elettroni.
- Modificare la dimensione spot per ottenere la dose ottimale. Nel caso del rivelatore di elettroni diretto utilizzato in questo protocollo, per l'acquisizione di dati ad alta risoluzione viene tipicamente utilizzata una dose di 4-5 e-/pixel/s. Questo in genere corrisponde alla dimensione SPOT 4-6.
- Controllare e regolare l'illuminazione parallela con la nuova impostazione delle dimensioni SPOT come descritto sopra.
- Selezionare l'opzione EER in Frazioni per utilizzare la modalità EER sul rivelatore di elettroni diretto33.
- Fare clic sul pulsante Ottieni nel software di analisi per salvare le impostazioni nel predefinito acquisizione dati.
- Passare al predefinito Autofocus e premere il pulsante Ottieni per salvare le impostazioni di illuminazione per la messa a fuoco. Modificare manualmente il tempo di esposizione a 1 s e la modalità di binning 2.
- Passare al preset Thon Rings e premere il pulsante Ottieni per salvare le impostazioni di illuminazione per questo preset. Modificare manualmente il tempo di esposizione a 1-2 s e la modalità di binning 2.
- Passare al preset Zero Loss e premere il pulsante Ottieni per salvare le impostazioni di illuminazione per questo preset. Modificare manualmente il tempo di esposizione a 0,5 s e la modalità di binning 4.
- Calibrare gli spostamenti dell'immagine tra le impostazioni ottiche impostate, come descritto nel manuale del software di analisi utilizzando l'attività Calibrazione spostamento immagine nella scheda Preparazione (Figura supplementare 1).
Tabella 1: Impostazioni di imaging tipiche per l'acquisizione di dati ad alta risoluzione utilizzando un crio-TEM da 200 kV dotato di un filtro di energia e di un rivelatore di elettroni diretto. Le impostazioni sono mostrate per ogni preset ottico utilizzato nella configurazione della raccolta automatica dei dati (sezione 3 del Protocollo). Queste impostazioni sono specifiche per il microscopio TEM da 200 kV e il rivelatore di elettroni diretto utilizzato in questo studio. Fare clic qui per scaricare questa tabella.
4. Mappatura delle griglie e selezione delle migliori griglie crio-EM per la raccolta dei dati
- Selezionare la scheda Atlante e fare clic sul pulsante Nuova sessione per aprire una nuova sessione.
- Inserisci dettagli come il nome della sessione e la posizione di archiviazione dei dati e fai clic sul pulsante Applica per aprire una nuova finestra dell'attività screening , che mostra un elenco di tutte le griglie nell'inventario del caricatore automatico. Facoltativamente, modificare i nomi delle griglie.
- Selezionare le griglie di interesse selezionando una casella di controllo accanto al numero di griglia corrispondente.
- Fare clic sul pulsante Start per avviare una raccolta completamente automatizzata di atlanti di tutte le griglie selezionate.
- Una volta completata la raccolta, fare clic sulle etichette della griglia per rivedere gli atlanti acquisiti.
NOTA: i singoli quadrati della griglia sono classificati in base al loro spessore relativo del ghiaccio, che si basa sulla valutazione del valore relativo in scala di grigi in ciascun atlante. I quadrati della griglia classificati sono rappresentati in diverse combinazioni di colori che possono essere utilizzate per guidare la selezione delle aree di acquisizione dati. Una griglia prodotta con un Vitrobot Mk IV in genere visualizza un gradiente di spessore del ghiaccio su tutta la griglia, che potrebbe aiutare a identificare lo spessore di ghiaccio ideale per la raccolta dei dati. Una griglia ottimale dovrebbe contenere il minor numero possibile di contaminazione da ghiaccio di trasferimento e mostrare abbastanza quadrati di griglia ininterrotti e privi di crepe (Figura 3). Le griglie con un'adeguata distribuzione del ghiaccio possono essere ulteriormente studiate per valutare la distribuzione delle particelle nel ghiaccio ad alto ingrandimento (cioè densità e orientamenti delle singole particelle). - Fare clic sul pulsante Carica campione nel menu in alto per inserire una griglia scelta con un'adeguata distribuzione del ghiaccio nella colonna del microscopio.
- Seleziona la scheda Atlante , fai clic con il pulsante destro del mouse su un quadrato della griglia adatto nell'immagine dell'atlante e seleziona l'opzione Sposta fase qui dal menu a discesa per spostare lo stage nel quadrato della griglia.
- Selezionare la scheda Funzioni automatiche per impostare la griglia quadrata sull'altezza eucentrica. Passare al preset Altezza eucentrica , fare clic sulla funzione automatica Auto-Eucentric by Beam Tilt al centro del quadrato della griglia scelto e fare clic sul pulsante Start .
- Passate al predefinito Grid Square e acquisite un'immagine. Spostare il palco in un foro con ghiaccio e nessuna o minima contaminazione facendo clic con il pulsante destro del mouse e l'opzione Sposta fase qui .
- Passate al predefinito Foro/Altezza eucentrica e acquisite un'immagine. Spostate lo stage in un'area di carbonio accanto al foro di interesse facendo clic con il pulsante destro del mouse e con l'opzione Sposta stage qui .
- Fare clic sulla funzione automatica AutoFocus e impostare i valori per la sfocatura desiderata su 0 μm e Iterare su -2 μm. Passare al preset Autofocus e fare clic sul pulsante Start .
- Selezionate nuovamente la scheda Preparazione (Preparation ) e passate al predefinito Foro/Altezza eucentrica (Eucentric Height ). Nell'immagine del foro acquisita in precedenza, selezionate un'area di interesse all'interno del foro e spostate lo stage in questa posizione facendo clic con il pulsante destro del mouse e selezionando l'opzione Sposta stage qui .
- Passare al preset acquisizione dati e impostare il tempo di attesa dopo lo spostamento del fascio a 0,5 s e il tempo di attesa dopo il passaggio alla fase a 20 s. Acquisisci un'immagine utilizzando la sfocatura tra -3 μm e -5 μm per aumentare il contrasto a bassa risoluzione per una migliore visualizzazione delle singole particelle.
- Facoltativamente, ripetere i passaggi 4.7-4.13 per visualizzare le particelle in fori diversi e quadrati di griglia diversi con spessori di ghiaccio diversi, se necessario.
- Una volta identificata e selezionata la griglia più adatta per la raccolta di dati ad alta risoluzione, fare clic sul pulsante Carica campione nel menu in alto per caricare la griglia selezionata nel TEM.
NOTA: in alternativa, se sono necessarie ulteriori informazioni e/o si desidera l'automazione di questo processo di screening, eseguire la sezione 5.
5. Impostazione di una sessione di raccolta dati nel software di analisi delle singole particelle
NOTA: Se si utilizzano le griglie in lamina d'oro, il perfezionamento dell'astigmatismo oggettivo e degli allineamenti del coma (sezione 6) potrebbe non funzionare in modo affidabile. Si consiglia di caricare una griglia di lamina di carbonio o una griglia EM a griglia incrociata ed eseguire questi allineamenti finali prima di impostare la raccolta dei dati.
- Seleziona la scheda EPU e fai clic sul pulsante Creazione sessione per creare una nuova sessione nel pannello di sinistra. Selezionare l'opzione Nuova sessione per utilizzare i predefiniti ottici correnti o l'opzione Nuovo da preferenze per caricare la configurazione della sessione esportata in precedenza.
- Inserisci il nome della sessione e il percorso di archiviazione dei dati.
NOTA: questa posizione verrà utilizzata per salvare immagini e metadati integrati dalla sessione di raccolta dati in una sottocartella con il nome della sessione. Sebbene questi dati non occupino una quantità significativa di spazio di archiviazione, si consiglia di salvare questi dati sull'archiviazione dei dati di offload Falcon del server DMP poiché i frame della telecamera EER sono sempre memorizzati nella directory principale di questo archivio dati in una directory con il nome della sessione. - Selezionare il tipo Manuale della sessione per avere il controllo sulla selezione dei singoli fori nei quadrati della griglia selezionati per la raccolta dei dati in un secondo momento nel protocollo.
- Selezionare la modalità di acquisizione più veloce per utilizzare lo spostamento dell'immagine senza aberrazione (AFIS) per la raccolta dei dati per ridurre i movimenti dello stadio tra i singoli fori, ridurre la deriva complessiva del campione e aumentare il throughput della raccolta dei dati senza deterioramento della qualità dell'immagine.
- Selezionare il formato mrc predefinito delle immagini integrate salvate.
- Specificare la griglia utilizzata e il relativo tipo. Questo protocollo utilizzava l'UltraAufoil R-1.2/1.3 per l'apo-ferritina e la griglia Quantifoil R-2/1 per il proteasoma 20S. Selezionare Quantifoil in Supporto per campioni e R1.2/1.3 o 2/1 in Tipo quantifoil.
- OPZIONALE: Fare clic sul pulsante Athena Login nell'angolo in basso a destra per utilizzare EPU Quality Monitor (EQM).
- Immettere i dettagli di accesso nella finestra pop-up del browser per attivare la sezione delle impostazioni nella panoramica della configurazione della sessione .
- Fare clic sul pulsante Seleziona nella sezione delle impostazioni e cercare il set di dati creato in precedenza (sezione Protocollo 2) per associarlo alla raccolta dati corrente. Attivare o disattivare la casella di controllo Abilita monitoraggio qualità .
- Fare clic sul pulsante Applica per creare una nuova sessione.
NOTA: questa azione aprirà nuove attività nel menu della colonna di sinistra. In qualsiasi momento della sessione, se alcuni dettagli non sono corretti, è possibile tornare all'attività Session Setup, modificare /aggiornare i dettagli e cliccare nuovamente su Applica per aggiornare la sessione. - Selezionate l'attività Selezione quadrata nel pannello di sinistra per visualizzare l'atlante raccolto della griglia.
- Facoltativamente, fai doppio clic su qualsiasi tessera dell'atlante per vedere un'immagine di qualità superiore per giudicare meglio la qualità del ghiaccio nei quadrati della griglia. Fare doppio clic sull'immagine per tornare all'atlante della griglia.
- Identificare i quadrati della griglia con le seguenti caratteristiche (Figura 4): (i) La lamina di supporto nel quadrato della griglia è intatta senza danni, (ii) Ghiaccio sottile vitreo in fori di alluminio (i fori appaiono più luminosi della lamina di carbonio di supporto), (iii) La minore contaminazione da ghiaccio cristallino (macchie nere) nel quadrato della griglia, (iv) Gradiente di luminosità minimo attraverso il quadrato della griglia e all'interno dei singoli fori di alluminio.
NOTA: Con i preset scelti e con una buona griglia, il TEM criogenico da 200 kV utilizzato in questo studio può visualizzare immagini ad una velocità di ~ 200-300 film / h. Con questo in mente, selezionare tutti i quadrati necessari o aggiungerne altri in seguito tornando all'attività di selezione del quadrato in base alla quantità di tempo disponibile al microscopio. Per riferimento, sono stati raccolti 3000 film per raggiungere una risoluzione di 1,6 Å di apo-ferritina. - Selezionare i quadrati della griglia per la raccolta dei dati nell'atlante completo o nelle immagini dei riquadri di alta qualità
- Fare clic con il pulsante destro del mouse su un quadrato della griglia di interesse e scegliere l'opzione Seleziona nel menu di scelta rapida
- In alternativa, tieni premuto il tasto Ctrl sulla tastiera e fai clic con il pulsante sinistro del mouse sui quadrati della griglia desiderati
- Al contrario, fare clic con il pulsante destro del mouse e deselezionare o tenere premuto il tasto Maiusc e fare clic con il pulsante sinistro del mouse per rimuovere i quadrati
- Selezionate l'attività Selezione fori (Hole Selection ) nel pannello di sinistra per selezionare i fori nei quadrati della griglia selezionati.
- Fare clic sul pulsante Auto-Eucentric per spostarsi automaticamente sul primo quadrato della griglia selezionato, regolare l'altezza eucentrica e acquisire un'immagine quadrata della griglia per trovare i fori della lamina.
- Fare clic sul pulsante Trova fori per trovare i fori di alluminio nell'immagine.
NOTA: se il rilevamento dei fori non ha funzionato correttamente (ad esempio, nell'immagine sono presenti fori saltati o di dimensioni errate), verificare che siano stati immessi valori corretti nella voce Tipo quantifoil dell'attività Impostazione sessione e trovare nuovamente i fori. Se i fori non vengono ancora trovati correttamente, fate clic sul pulsante Misura dimensione foro (Measure Hole Size) per impostare manualmente il diametro e la distanza del foro e trovare nuovamente i fori. - Fate clic sul pulsante Rimuovi fori vicino al pulsante della barra della griglia per deselezionare i fori vicino alle barre della griglia.
- Regolare i limiti nell'istogramma di luminosità del filtro Ice (in basso a destra della finestra del software) per rimuovere tutti i fori con ghiaccio troppo spesso (utilizzando la linea limite sinistra) e tutti i fori vuoti (utilizzando la linea limite destra), come mostrato nella Figura 4.
NOTA: per il perfezionamento, è possibile immettere valori di intensità specifici anche nelle caselle di testo corrispondenti accanto al pulsante Applica . - Facoltativamente, utilizzate il pennello di selezione per perfezionare manualmente la selezione dei fori: fate clic con il pulsante sinistro del mouse e trascinate il pennello per deselezionare i fori indesiderati. Tenere premuto il tasto Ctrl e fare clic con il pulsante sinistro del mouse per poter riselezionare i fori della lamina. Tieni premuto il tasto Maiusc e scorri con la rotellina del mouse per regolare le dimensioni del pennello.
- Selezionare un foro per impostare e testare un modello di acquisizione dati che verrà utilizzato ripetutamente durante la raccolta dei dati: fare clic con il pulsante destro del mouse su un foro nell'immagine quadrata della griglia e selezionare l'opzione Sposta stage in posizione.
- Selezionate l'attività Definizione modello nel pannello di sinistra.
- Selezionate il preset Foro/Eucentrico e cliccate sul pulsante Acquisisci per acquisire un'immagine.
- Fate clic sul pulsante Trova (Find and Center Hole) per centrare un foro nell'immagine.
- Impostate i valori per Delay After Image Shift su 0,5 s (impostazione predefinita) e Delay After Stage Shift su 20 s.
NOTA: poiché il diametro del fascio parallelo è fissato sul sistema crio-TEM da 200 kV utilizzato in questo studio e corrisponde tipicamente a 1,6-1,7 μm con un'apertura di 50 μm, è possibile acquisire solo 1 immagine per foro utilizzando le griglie R-1.2/1.3 e 2 immagini per foro (vicino ai bordi opposti) utilizzando le griglie R-2/1 o R-2/2. Si prega di notare che la dimensione delle aree di acquisizione impostate sullo schermo non corrisponde al diametro effettivo del fascio. La barra della scala dell'immagine può essere utilizzata per stimare una distanza di posizionamento appropriata. - Seleziona il pulsante Aggiungi area di acquisizione e fai clic sull'immagine per selezionare la posizione nel foro centrato da cui verrà prelevata l'acquisizione di immagini ad alto ingrandimento.
- Selezionare il pulsante Aggiungi area di messa a fuoco automatica e fare clic sull'immagine per selezionare la posizione sulla lamina di supporto accanto al foro centrato in cui verrà eseguita la messa a fuoco automatica dell'immagine.
NOTA: la dimensione del fascio per la messa a fuoco è di 1,6-1,7 μm e deve essere posizionata equidistante dai fori vicini sul carbonio. - Fare clic sull'area di acquisizione verde per impostare una sequenza di valori di sfocatura nell'elenco Di messa a fuoco nella sezione superiore della finestra del software. Immettere la sfocatura più alta come prima per migliorare la visualizzazione delle particelle in un'esecuzione di test della seguente attività di esecuzione del modello.
- Fare clic sull'area blu di messa a fuoco automatica per impostare le impostazioni specifiche dell'autofocus nella stessa area:
- Scegliere l'opzione Dopo la centratura per la messa a fuoco automatica all'inizio di ogni cluster AFIS.
- Scegli l'opzione Obiettivo obiettivo per una messa a fuoco automatica più veloce e una deriva dello stadio ridotta.
- Selezionare l'attività Esecuzione modello e fare clic sul pulsante Esegui.
- Osservare le singole fasi della procedura di acquisizione dei dati (centrare il foro, messa a fuoco automatica nell'area selezionata e acquisizione delle immagini nelle aree impostate) e controllare la qualità delle particelle riprese nell'immagine finale ad alto ingrandimento.
- Fare clic sul pulsante FFT in basso a destra nella finestra dell'immagine ad alto ingrandimento per controllare l'immagine FFT e valutare visivamente se gli anelli Thon mostrano più oscillazioni e si estendono ad alta risoluzione nell'immagine FFT.
- Se l'esecuzione del modello viene completata correttamente, fare clic sul pulsante Prepara tutti i quadrati nell'attività Selezione fori per impostare automaticamente la raccolta dei dati in tutti gli altri quadrati della griglia selezionati in base alle impostazioni utilizzate in questo primo quadrato della griglia.
6. Allineamenti finali del microscopio prima di iniziare la raccolta dei dati
NOTA: per ottenere i migliori risultati ad alta risoluzione, gli allineamenti più sensibili devono essere eseguiti esattamente con le stesse impostazioni della modalità di acquisizione dati nel software di raccolta dati e poco prima di iniziare l'acquisizione dei dati effettiva. Questi allineamenti dovrebbero essere effettuati in una posizione con carbonio di supporto sottile della griglia, sufficientemente distante da qualsiasi barra della griglia e allineato all'altezza eucentrica.
- Selezionare l'attività Esecuzione modello, acquisire una nuova immagine e spostarsi con lo stage in un'area pulita su un foglio di carbonio facendo clic con il pulsante destro del mouse e selezionare l'opzione di menu Sposta stage qui.
- Selezionare la scheda Funzioni automatiche e impostare lo stato di messa a fuoco desiderato su 0 μm e l'iterazione su -2 μm. Passare al preset Autofocus e fare clic sul pulsante Start per eseguire la funzione Autofocus.
- Abbassa lo schermo fluorescente e apri il menu di Allineamenti diretti nell'interfaccia utente TEM.
- Per ottenere risultati ottimali, gli utenti esperti possono verificare gli allineamenti dei punti di rotazione: scegliere l'attività nP Beam Tilt pp X nel menu Allineamenti diretti e sovrapporre al massimo i fasci di rimbalzo utilizzando le manopole multifunzione sui pannelli di controllo. Ripetere l'operazione per l'attività np Beam Tilt pp Y .
- Fare clic sul pulsante EF nel menu della fotocamera con schermo fluorescente per visualizzare un cerchio verde che indica l'apertura di ingresso del filtro energetico e centrare il raggio sul cerchio verde.
NOTA: Assicurarsi che la turbopompa sia ferma prima di continuare; le vibrazioni da esso riducono il numero di anelli thon visibili e spesso causano il fallimento delle funzioni automatiche. - Torna alla finestra del software e seleziona la scheda Funzioni automatiche nella barra dei menu.
- Selezionare l'attività Autostigmate , passare al predefinito Thon Ring e premere il pulsante Start . Osservare il processo per assicurarsi che (i) le immagini scattate siano su carbonio, (ii) gli anelli Thon siano chiaramente visibili e (iii) l'adattamento CTF calcolato (linee tratteggiate) sia ben posizionato ai minimi dell'anello Thon (Figura supplementare 2).
- Selezionare l'attività Autocoma e premere il pulsante Start . Osservare il processo per assicurarsi che le immagini scattate siano su carbonio e che gli anelli Thon siano chiaramente visibili e che gli adattamenti calcolati (linee tratteggiate) siano ben posizionati ai minimi Thon-ring. Ingrandire ogni immagine Thon-ring utilizzando la rotellina di scorrimento del mouse (Figura supplementare 3).
NOTA: Se il microscopio è dotato di un filtro di energia, la sintonizzazione del filtro energetico deve essere eseguita come parte della sequenza di allineamento per centrare la fessura del filtro al picco di perdita zero e per correggere eventuali distorsioni nel prisma del filtro di energia (passaggi 6.9-6.14). Questi allineamenti devono essere eseguiti in un'area vuota della griglia, ad esempio all'interno di un quadrato della griglia rotto. - Aprire Sherpa UI e selezionare l'applicazione Energy Filter (Figura 4 supplementare).
- Impostare la fotocamera su EF-Falcon, bin 4x, tempo di esposizione 0,2 s nella finestra Impostazioni .
- Fare clic sul pulsante Centrale nell'opzione Zero Loss per centrare la fessura del filtro energetico a perdita zero.
- Fare clic sul pulsante Sintonizza nell'opzione Isocromaticità (Figura supplementare 4).
- Fare clic su Tune Magnification e Tune Distortions nell'opzione di Distorsioni geometriche e cromatiche (Figura supplementare 5, Figura supplementare 6)
- Se i risultati non rientrano nelle specifiche indicate e vengono visualizzati in rosso nel report di output, ripetere nuovamente gli allineamenti dal passaggio 6.11.
NOTA: sebbene il riferimento di guadagno diretto del rivelatore di elettroni possa essere stabile per mesi, è necessario prendere un nuovo riferimento di guadagno utilizzando Falcon 4 Reference Image Manager se le immagini di aree vuote non mostrano un'intensità uniforme ma presentano strisce o altre caratteristiche distinte. In alternativa, calcolare una trasformata di Fourier veloce (FFT) di tale immagine e assicurarsi che non siano visibili linee. - Nella finestra del software, selezionare la scheda Preparazione e passare al predefinito Acquisizione dati .
- Impostare l'impostazione della dose su 40 e-/Å2 e fare clic sul pulsante Misura l'intensità di dose .
- Vai alla scheda EPU , seleziona l'attività acquisizione automatica e, facoltativamente, controlla la funzione Auto Zero Loss ; fare clic sul pulsante Avvia esecuzione per iniziare la raccolta dati completamente automatizzata.
7. Monitoraggio e ottimizzazione della qualità dei dati durante la raccolta dei dati
NOTA: mentre la raccolta dei dati è in corso, i dati raccolti possono essere monitorati utilizzando l'EQM attraverso il portale di gestione dei dati. EQM esegue la correzione del movimento e la determinazione CTF al volo e visualizza i risultati nel portale. L'utente è quindi in grado di giudicare la qualità delle singole acquisizioni, vedere i grafici su vari indicatori di qualità, filtrare le acquisizioni indesiderate ed esportare i dati nella loro memoria finale al volo o come lavoro batch.
- Passare al set di dati in cui il software di analisi inserisce i dati utilizzando un browser Web.
- Nella panoramica del set di dati, le schede di acquisizione visualizzano le informazioni sulla correzione del movimento e sulla determinazione CTF in un formato grafico. Clicca sulle singole carte per avere maggiori informazioni.
- Abilitare il pannello DataViz per mostrare i grafici aggregati del set di dati completo che mostrano il defocus, l'astigmatismo e l'intervallo di confidenza CTF per acquisizione (Figura supplementare 7).
- Utilizzare i filtri nella parte superiore del pannello per selezionare solo i dati che si trovano all'interno dell'intervallo di sfocatura richiesto, hanno astigmatismo vicino a zero e il CTF può essere determinato fino alla risoluzione specificata (target). Una volta impostati i filtri, premere il pulsante Applica per visualizzare solo i dati scelti nella finestra di panoramica del set di dati.
- Quando la maggior parte delle immagini acquisite rientra nei criteri impostati, lasciare che la sessione di raccolta dati continui fino al completamento. Se solo una piccola parte delle immagini acquisite soddisfa i criteri impostati, riconfigurare le impostazioni del software di analisi, spostarsi in un'altra area del campione (premere il pulsante Next Grid Square nel software di analisi) o interrompere la raccolta dei dati.
Risultati
Il portale di gestione dei dati fornisce un'archiviazione efficiente e strutturata di immagini, dati e metadati raccolti da più flussi di lavoro sperimentali in un'unica piattaforma software. Ogni esperimento definito in un progetto creato è costituito da un flusso di lavoro con passaggi definiti dal cliente per acquisire informazioni di esempio, dati raccolti e metadati correlati senza vincoli per fornire la massima flessibilità e usabilità per eventuali esperimenti possibili e tutti i casi d'uso (Figura 1, Figura 2). Il portale di gestione dei dati ha anche una funzionalità di nota di laboratorio per illustrare le fasi del flusso di lavoro, compresa l'elaborazione delle immagini con risultati intermedi, che possono essere tutti insieme associati a un progetto e fornire un record il più completo possibile per l'analisi e la creazione di report e pubblicazioni.

Figura 1: Esempio di possibile organizzazione di dati e metadati nella piattaforma di gestione dei dati. Ogni progetto può consistere in più esperimenti, come la crio-EM o la spettroscopia di massa (vale a dire il protocollo passo 2.3). Ogni esperimento può includere più flussi di lavoro definiti dall'utente (ad es. Passaggio del protocollo 2.5), ciascuno costituito da più passaggi configurabili (ad esempio il passaggio del protocollo 2.7). Fare clic qui per visualizzare una versione più grande di questa figura.
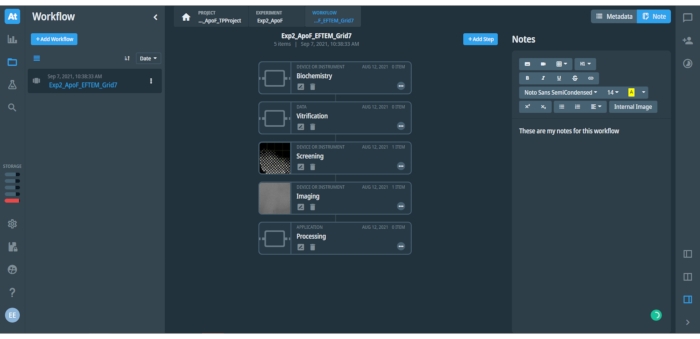
Figura 2: Visualizzazione in corrispondenza di un flusso di lavoro di progetto aperto nella piattaforma di gestione dei dati. La figura mostra i metadati e le note associati al passaggio aperto nel flusso di lavoro. La barra di sinistra con icone fornisce un rapido accesso a diverse opzioni e menu della piattaforma di gestione dei dati. Il pannello di sinistra include un elenco di flussi di lavoro salvati (mostrato solo un flusso di lavoro salvato "Exp2_ApoF_EFTEM_Grid7") e un pulsante blu per aggiungere un nuovo flusso di lavoro. Il pannello centrale mostra i singoli passaggi nel flusso di lavoro aperto, come mostrato per il flusso di lavoro SPA qui. Il pulsante blu in alto a destra può aggiungere un ulteriore passaggio al flusso di lavoro aperto. Il pannello di destra include spazio per i metadati registrati o le note di input dell'utente del flusso di lavoro, che possono includere testo, tabelle e immagini. Sono disponibili diverse opzioni di formattazione per il testo. Fare clic qui per visualizzare una versione più grande di questa figura.
Le griglie Cryo-EM prodotte con i tradizionali dispositivi di congelamento a immersione, come Vitrobot, in genere mostrano un gradiente di spessore del ghiaccio sulla superficie della griglia. Alcune griglie possono anche essere danneggiate (piegate) dopo la movimentazione manuale e / o il ritaglio in un supporto ad anello autogrid. La Figura 3 mostra esempi di griglie diverse, come mostrato nella panoramica dell'Atlante. Le griglie con ghiaccio spesso o danni dovrebbero essere escluse da ulteriori indagini.

Figura 3: Galleria di griglie diverse come si vede nella panoramica dell'Atlante. (A) Una griglia cattiva con ghiaccio spesso, (B) una griglia piegata con ghiaccio cattivo e contaminazione da ghiaccio, (C) una griglia accettabile con un buon gradiente di ghiaccio, (D) una griglia tipica con ghiaccio sottile buono e piccolo gradiente di ghiaccio. Fare clic qui per visualizzare una versione più grande di questa figura.
La selezione di quadrati di griglia senza danni e spessore ottimale del ghiaccio è fondamentale per la raccolta di set di dati ad alta risoluzione. Lo spessore del ghiaccio può variare anche a livello dei singoli quadrati della griglia ed è quindi importante selezionare solo fori con ghiaccio sottile in modo ottimale da ciascun quadrato della griglia selezionato. La Figura 4 mostra un quadrato a griglia adatto con lamina intatta e ghiaccio sottile al centro. Il quadrato della griglia mostrato è utile per impostare un filtro per la selezione automatica di fori con ghiaccio sottile in tutti i quadrati della griglia selezionati in quanto contiene una gamma di diversi spessori di ghiaccio e fori vuoti senza ghiaccio, che è estremamente utile per impostare un intervallo appropriato di intensità nel filtro del ghiaccio nell'attività di selezione dei fori.
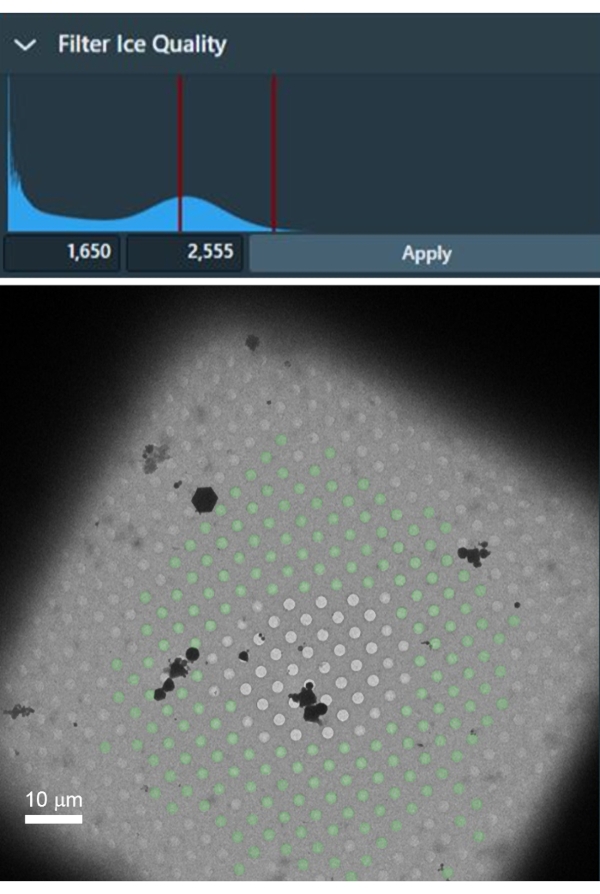
Figura 4: Un esempio di quadrato della griglia con un gradiente di spessore del ghiaccio, da quadrati della griglia vuoti al centro e ghiaccio spesso vicino alle barre della griglia. Il filtro di qualità del ghiaccio può essere utilizzato per selezionare l'intervallo di intensità all'interno dei fori con lo spessore di ghiaccio ideale che vengono di conseguenza selezionati nel quadrato della griglia (i fori con sovrapposizione verde). Fare clic qui per visualizzare una versione più grande di questa figura.
I risultati del benchmark utilizzando il protocollo descritto sono stati ottenuti utilizzando il campione di apo-ferritina di topo (apoF) del gruppo Kikkawa11. ApoF è una proteina altamente α-elicoidale che forma una gabbia ottaedrica molto stabile. L'elevata stabilità e l'elevata simmetria rendono apoF un campione ottimale per l'imaging crio-EM ad alta risoluzione e l'elaborazione delle immagini. ApoF è quindi diventato un campione standard per valutare le prestazioni degli strumenti crio-EM 11,12,13. Un'aliquota congelata contenente 15 mg/mL di campione di apoF purificato è stata scongelata su ghiaccio e chiarificata mediante centrifugazione a 10.000 x g per 10 minuti. Il surnatante è stato diluito a 5 mg/mL con 20 mM HEPES pH 7,5, 150 mM NaCl. 3 μL del campione diluito sono stati applicati su un R-1.2/1.3 a scarica a bagliore, griglie d'oro a 300 maglie per 30 s. Quindi le griglie sono state cancellate per 5 s prima di congelarsi in etano liquido raffreddato da azoto liquido. Il congelamento a tuffo è stato eseguito utilizzando un sistema di vetrificazione completamente automatizzato al 100% di umidità e 4 °C. Tutte le griglie sono state ritagliate in autogrid e caricate in un Cryo-TEM da 200 kV. Circa 3000 film sono stati raccolti con un throughput di 300 film / h. I dati sono stati elaborati utilizzando i metodi descritti11 con le seguenti modifiche: i) è stata utilizzata la versione Relion 4-beta al posto di Relion 3.1, ii) il prelievo automatico di particelle è stato effettuato utilizzando medie di classe 2D delle precedenti ricostruzioni apoF come riferimenti e iii) il modello 3D iniziale è stato generato dalla precedente ricostruzione apoF passata in basso a 15-Å risoluzione. Il raggruppamento ottico non è stato fatto per questo set di dati poiché la procedura AFIS34 utilizzata ha dimostrato di ridurre al minimo in modo efficiente e affidabile gli sfasamenti indotti dall'inclinazione del fascio che non limitano la qualità dei dati per ricostruire le mappe 3D alle risoluzioni riportate. Il perfezionamento 3D dopo la lucidatura bayesiana e il perfezionamento CTF hanno portato alla mappa di risoluzione 1,68 Å. La risoluzione è stata ulteriormente migliorata con la correzione della sfera di Ewald che ha portato a una mappa di risoluzione di 1,63 Å. La panoramica dei parametri di raccolta ed elaborazione dei dati è mostrata nella Tabella 2 e la mappa finale della densità ricostruita è mostrata nella Figura 5, con la curva FSC (Fourier Shell Correlation) mostrata nella Figura supplementare 8.
Tabella 2: Parametri di raccolta dati ed elaborazione delle immagini utilizzati per la ricostruzione 3D dell'apo-ferritina. Fare clic qui per scaricare questa tabella.
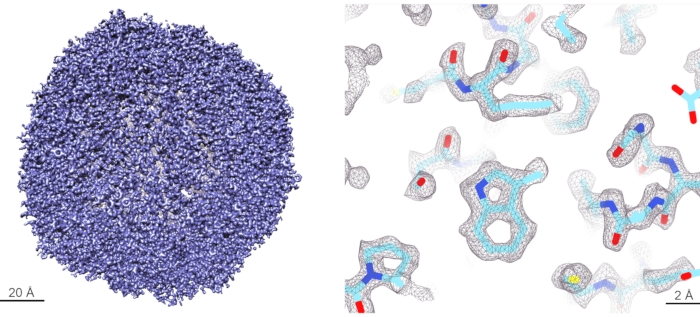
Figura 5: Ricostruzione crio-EM dell'apo-ferritina. (Pannello di sinistra) Rendering 3D della mappa crio-EM apoF ricostruita con risoluzione 1,6 Å. (Pannello di destra) Vista dettagliata della mappa ricostruita a livello delle singole catene laterali di amminoacidi. La densità delle catene laterali degli amminoacidi è ben risolta e il modello atomico può essere costruito in modo inequivocabile all'interno di questa mappa. Fare clic qui per visualizzare una versione più grande di questa figura.
Gli effetti e i benefici dell'utilizzo di un filtro energetico nelle ricostruzioni SPA sono stati valutati utilizzando il proteasoma procariotico 20S isolato da T. acidophilum. Il proteasoma procariotico 20S è stato utilizzato anche come campione crio-EM standard in quanto rappresenta il nucleo catalitico stabile del complesso proteasoma con la simmetria D7. Le griglie sono state preparate aggiungendo 4,5 μL del campione di proteasoma T. acidophilum 20S purificato su una griglia di rame R 2/1 a 200 maglie a scarica luminosa. I campioni sono stati vetrificati in una miscela liquida di etano/propano utilizzando un sistema di vetrificazione completamente automatizzato impostato a 4 °C e 100% di umidità con forza di macchia di 20 e tempo di macchia di 4,5 s.
Tre diversi set di dati sono stati raccolti dalla stessa griglia crio-EM con quadrati di griglia simili utilizzando una diversa larghezza della fessura del filtro di energia nell'ordine: i) fessura completamente aperta (nessuna fessura inserita), ii) fessura da 20 eV e iii) fessura da 10 eV. I quadrati della griglia sono stati selezionati utilizzando un filtro di qualità del ghiaccio all'interno del software di analisi. Tutti gli altri parametri per la raccolta e l'elaborazione dei dati sono stati mantenuti invariati. I set di dati sono stati raccolti per 15 ore con un totale di 4000 filmati ed elaborati utilizzando i metodi descritti11 utilizzando Relion 3.1 con la modifica che l'algoritmo di raccolta delle particelle Laplacian-of-Gaussian è stato utilizzato per produrre medie iniziali di classe 2D per il prelievo di particelle basato su riferimento dai set di dati completi. Lo stesso numero (102.200) di particelle selezionate casualmente è stato scelto e utilizzato per l'iterazione finale e la ricostruzione 3D di ciascun set di dati. Le variabili di elaborazione dei dati sono descritte nella tabella (Tabella 3) sottostante per ottenere la mappa finale della densità EM ricostruita mostrata nella Figura 6 con la curva FSC mostrata nella Figura supplementare 9. Anche il raggruppamento ottico e la correzione della sfera di Ewald non sono stati eseguiti per questi set di dati.
Tabella 3: Parametri di raccolta dei dati e di elaborazione delle immagini utilizzati per la ricostruzione 3D del proteasoma T. acidophilum 20S. Fare clic qui per scaricare questa tabella.
Tabella 4: Riepilogo della risoluzione raggiunta e del fattore B per le ricostruzioni crio-EM del proteasoma T. acidophilum 20S utilizzando set di dati con diversa larghezza di fessura energetica. Fare clic qui per scaricare questa tabella.
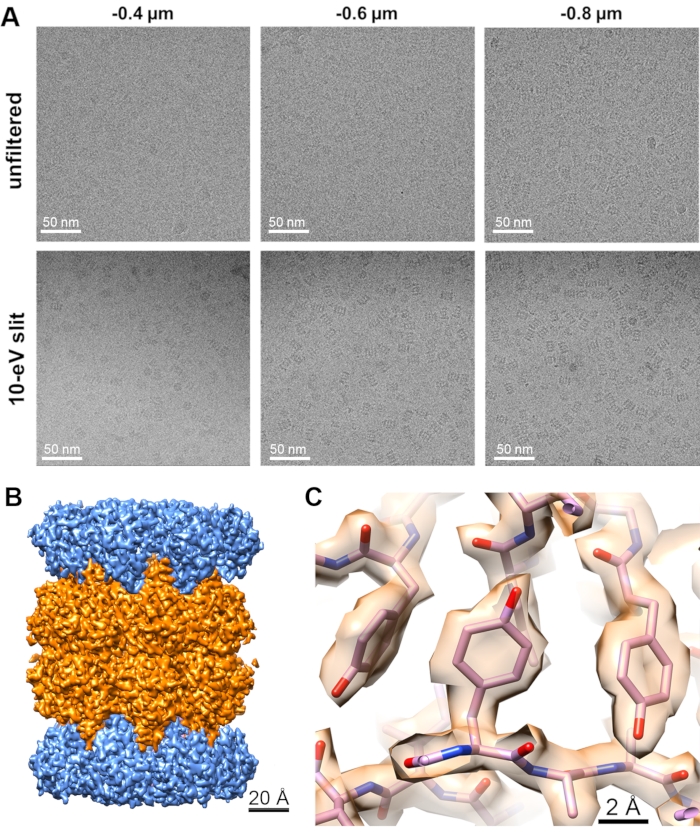
Figura 6: Effetto del filtraggio dell'energia sulle immagini crio-EM. (A) Immagini Cryo-EM a diversi valori di sfocatura raccolti con o senza fessura da 10 eV. (B) Panoramica della mappa crio-EM del proteasoma 20S con subunità segmentate. (C) Vista zoom sulla mappa del proteasoma 20S con un modello atomico adattato. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura 1 supplementare: Calibrazione dell'attività di spostamento dell'immagine (ellisse gialla) per allineare gli spostamenti dell'immagine tra diversi preset ottici (ellissi rosse) nel software di analisi, utilizzando un cristallo di ghiaccio esagonale visibile nell'intero intervallo di ingrandimento compreso tra 100x e 165.000x. (In alto) Calibrazione tra i preset Acquisizione dati e Foro/Altezza eucentrica, calibrazione (centrale) tra i preset Foro/Altezza eucentrica e Quadrato griglia, calibrazione (inferiore) tra i preset Grid Square e Atlas. Fare clic qui per scaricare questo file.
Figura 2 supplementare: Funzione di autostigmate nel software di analisi (ellisse gialla). (Immagine a sinistra) Immagine acquisita. (Immagine a destra) Trasferimento di Fourier dell'immagine acquisita che mostra gli anelli Thon concentrici e il loro adattamento CTF mostrato in fasci radiali. Fare clic qui per scaricare questo file.
Figura 3 supplementare: Interfaccia utente della funzione Autocoma nel software di analisi (ellisse gialla) per l'allineamento del coma. Il pannello immagine mostra le immagini di trasferimento di Fourier acquisite a diverse inclinazioni del fascio e i loro adattamenti CTF che vengono utilizzati per il calcolo del coma. Fare clic qui per scaricare questo file.
Figura 4 supplementare: Interfaccia utente della regolazione del filtro energetico. Esempio di un buon rapporto di tunning dell'isocromacità del filtro energetico con tutti i parametri (mostrati in testo verde) all'interno delle specifiche. Fare clic qui per scaricare questo file.
Figura supplementare 5: Interfaccia utente della regolazione del filtro energetico. Esempio di buon rapporto di messa a punto delle distorsioni di ingrandimento del filtro energetico con tutti i parametri (mostrati in testo verde) all'interno delle specifiche. Fare clic qui per scaricare questo file.
Figura supplementare 6: Interfaccia utente della regolazione del filtro energetico. Esempio di buona messa a punto delle distorsioni cromatiche del filtro energetico con tutti i parametri (mostrati in testo verde) all'interno delle specifiche. Fare clic qui per scaricare questo file.
Figura 7 supplementare: Pannello DataViz del monitor di qualità EPU con una panoramica della qualità dei dati in un set di dati cryo-EM raccolto. I grafici con i dati aggregati di tutte le immagini/filmati raccolti mostrano i valori (dot plot) e la distribuzione (grafici a barre) di indicatori di qualità critici selezionati, come il CTF fit confidence (blu), il defocus (arancione) e l'astigmatismo (verde). Un sottoinsieme delle immagini/filmati raccolti può essere selezionato impostando i filtri dei parametri nella parte superiore del pannello DataViz. Dopo aver applicato i filtri, le immagini / filmati selezionati possono essere esportati per un'ulteriore elaborazione in un altro pacchetto di elaborazione delle immagini, come Relion o CryoSpark. Fare clic qui per scaricare questo file.
Figura supplementare 8: Curva FSC della ricostruzione finale di apoF a risoluzione 1.6 Å, come riportato da Relion 4-beta. La curva blu mostra l'FSC di mappe 3D mascherate da due ricostruzioni 3D raffinate in modo indipendente da due semiset che si escludono a vicenda. Secondo il gold standard FSC a 0,143, la risoluzione della mappa 3D finale ricostruita dal set di dati completo corrisponde a 1,6 Å. La curva arancione mostra l'FSC delle ricostruzioni 3D mascherate con fasi randomizzate. La rapida caduta della curva FSC indica che la maschera utilizzata non ha contribuito all'FSC osservato delle mappe ricostruite originali (curva blu) oltre la risoluzione di ~ 2 Å. Fare clic qui per scaricare questo file.
Figura supplementare 9: Curve FSC della ricostruzione finale del proteasoma T. acidophilum 20S utilizzando diverse larghezze di fessura del filtro energetico, come riportato da Relion 3.1. Le curve blu mostrano l'FSC delle mappe 3D mascherate da due ricostruzioni raffinate in modo indipendente da due semiset di ciascun set di dati, rispettivamente. Il gold standard FSC a 0,143 indica le risoluzioni raggiunte delle mappe 3D finali ricostruite dai rispettivi set di dati completi (risoluzione 2,3 Å, 2,2 Å e 2,1 Å, rispettivamente). Le curve rosse mostrano l'FSC delle mappe mascherate con fasi randomizzate. Il rapido calo delle curve FSC rosse indica che la maschera utilizzata non ha contribuito all'FSC delle mappe originali ricostruite oltre la risoluzione di ~ 3 Å. Le curve verdi mostrano l'FSC delle mappe 3D smascherate, che sono influenzate dal rumore nell'intero volume 3D ricostruito e quindi scendono prima dell'FSC delle mappe 3D mascherate. Fare clic qui per scaricare questo file.
Disponibilità dei dati: Le mappe di densità crio-EM sono state depositate nella banca dati EM con i numeri di adesione: apoferritin: EMD 14173, EMPIAR-10973. Proteasoma 20S: EMD 14467, EMPIAR-10976.
Discussione
Il protocollo descritto presuppone che l'ottica del microscopio TEM utilizzato sia in uno stato ben allineato. Per il TEM da 200 kV utilizzato in questo protocollo, tali allineamenti di colonne vengono eseguiti, verificati e salvati da un tecnico dell'assistenza esperto dopo l'installazione del microscopio o qualsiasi intervento di assistenza significativo. Queste impostazioni di allineamento possono essere richiamate in qualsiasi momento nell'interfaccia utente del microscopio. Gli utenti possono utilizzare le procedure di allineamento diretto nell'interfaccia utente del microscopio per modificare nuovamente i parametri critici. Alcuni allineamenti, come l'inclinazione della pistola e lo spostamento della pistola, sono stabili e non devono essere regolati dagli utenti su base giornaliera. I controlli e i riallineamenti (se necessario) dell'inclinazione e dello spostamento della pistola da parte del supervisore del microscopio sono consigliati due volte l'anno. D'altra parte, alcuni allineamenti sono critici e devono essere allineati prima di ogni raccolta di dati come descritto nel protocollo sopra (come l'astigmatismo oggettivo e l'allineamento senza coma). Se la funzione Autocoma nel software di analisi non riesce a convergere, l'allineamento dei punti di rotazione dell'inclinazione del fascio e/o del centro di rotazione deve essere verificato e regolato e deve essere confermato il corretto centraggio dell'apertura C2. Successivamente, la funzione Autostigmate dovrebbe essere eseguita poiché gli stigmatizzatori oggettivi vengono utilizzati anche per la correzione del coma. Questi allineamenti devono essere ripetuti fino a quando sia Autostigmate che Autocomafunctions non hanno esito positivo alla loro prima iterazione. Se necessario, è possibile selezionare un'altra area (ad esempio, supportare la lamina di carbonio senza ghiaccio), regolare la sfocatura dell'immagine o aumentare il tempo di acquisizione dell'immagine per ottimizzare il rapporto segnale-rumore nelle immagini acquisite e la visibilità di più anelli Thon nella trasformata di Fourier delle immagini acquisite.
I moderni microscopi crio-EM generano grandi quantità di dati che spesso superano 1 TB per set di dati per ottenere ricostruzioni 3D ad alta risoluzione, in particolare per proteine con bassa simmetria. I dati e i risultati di Cryo-EM sono anche tipicamente integrati da dati e risultati di metodi ortogonali per comprendere appieno le relazioni struttura-funzione in ciascun progetto scientifico. L'organizzazione dei dati raccolti, il loro trasferimento in una pipeline di elaborazione delle immagini e la condivisione di una ricostruzione crio-EM risultante tra i collaboratori pongono requisiti aggiuntivi ai nuovi utenti della metodologia cryo-EM per configurare la loro infrastruttura IT locale. I software di gestione dei dati, come Athena, facilitano l'archiviazione centralizzata dei dati acquisiti da qualsiasi strumento o software collegato gestito da un utente registrato. I dati e i metadati archiviati sono accessibili tramite una semplice interfaccia del browser Web da più utenti, che possono avere ruoli diversi nel progetto con diritti di accesso diversi (come proprietario, collaboratore o visualizzatore) in base alle credenziali di accesso e alla definizione di condivisione dei dati nella configurazione dell'esperimento. Questa digitalizzazione dei flussi di lavoro sperimentali fornisce mezzi per la condivisione di dati e metadati tra i collaboratori senza inutili duplicazioni e aumenta la produttività e la tracciabilità dei flussi di lavoro utilizzati. L'implementazione di una struttura generale e personalizzabile di progetti, esperimenti e flussi di lavoro nel software di gestione dei dati è universale e consente la personalizzazione e l'integrazione di esperimenti ortogonali utilizzando metodi complementari in un unico database di progetto.
La selezione delle aree per la raccolta dei dati su una griglia crio-EM è fondamentale per il successo dell'acquisizione di set di dati ad alta risoluzione. Le griglie Cryo-EM prodotte con i tradizionali dispositivi di congelamento a immersione, come il Vitrobot (un sistema di vetrificazione completamente automatizzato), in genere mostrano un gradiente di spessore del ghiaccio sulla superficie della griglia (Figura 4). Questo può essere utile in quanto la griglia contiene aree con diversi spessori di ghiaccio; tuttavia, le aree con lo spessore di ghiaccio ideale per la raccolta dei dati devono essere identificate come descritto nel protocollo di cui sopra. Una griglia crio-EM ottimale dovrebbe contenere il minor numero possibile di contaminazione da ghiaccio di trasferimento e contenere abbastanza quadrati di griglia con una lamina di supporto bucata intatta. La raccolta di dati su quadrati di griglia che presentano crepe o aree rotte non è raccomandata in quanto le immagini raccolte saranno influenzate da una deriva complessiva significativamente più forte sull'illuminazione da parte di un fascio di elettroni rispetto ai quadrati della griglia con lamina di supporto intatta. L'eccesso di ghiaccio cristallino può occludere la maggior parte dei fori di alluminio e / o interferire con l'autofocus e anche tali quadrati della griglia dovrebbero essere evitati. I quadrati della griglia con ghiaccio sottile di solito mostrano grandi aree vitree e molti fori luminosi che sono visibili in un'immagine scattata utilizzando il preset Atlas. Il verificarsi di ghiaccio più spesso vicino alle barre della griglia è prevedibile e acritico poiché i fori di alluminio in queste aree del quadrato della griglia sono esclusi durante la procedura di selezione del foro. La presenza di diversi fori vuoti in un quadrato della griglia può significare che il ghiaccio vitreo nei fori circostanti è estremamente sottile e può contenere particelle danneggiate o nessuna particella. In generale, è consigliabile scegliere quadrati di griglia con una varietà di spessori di ghiaccio in diverse regioni della griglia per lo screening iniziale e la valutazione per capire quali aree hanno le migliori condizioni per la raccolta di dati ad alta risoluzione e mostrano la densità delle particelle ideale e la distribuzione dell'orientamento. Per i campioni di proteasoma apoF e 20S utilizzati in questo studio, le aree con il ghiaccio osservabile più sottile contengono le migliori condizioni per l'imaging ad alta risoluzione di questi campioni.
Quando si selezionano automaticamente i fori in tutti i quadrati della griglia selezionati utilizzando il software di raccolta dati, si consiglia di eseguire l'attività di esecuzione del modello su un foro rappresentativo in ciascun quadrato della griglia per verificare e assicurarsi che per la raccolta dei dati non siano stati scelti quadrati eccessivamente spessi né eccessivamente sottili o inaspettatamente non vitrei. Durante l'acquisizione dei dati, gli indicatori chiave di qualità delle immagini raccolte, come la deriva dell'immagine e il raccordo CTF, possono essere monitorati utilizzando EQM. La raccolta dei dati può quindi essere ottimizzata saltando le aree che producono immagini di scarsa qualità. Tuttavia, le immagini con adattamenti CTF ad alta risoluzione possono ancora contenere immagini con particelle in alcuni orientamenti preferiti o particelle denaturate in uno strato di ghiaccio troppo sottile. Il prelievo di particelle in tempo reale e la classificazione 2D dalle immagini raccolte fornirebbero ulteriori informazioni sulla qualità dei dati strutturali nelle particelle fotografate e rivelerebbero sia gli orientamenti preferiti delle particelle intatte nel ghiaccio che la struttura incoerente delle particelle (parzialmente) denaturate. Il calcolo delle medie di classe può quindi aiutare a perfezionare ulteriormente le regioni appropriate per la raccolta dei dati, come è già stato implementato e mostrato in altri pacchetti software23,28.
La selezione delle impostazioni di imaging per l'acquisizione dei dati, come l'ingrandimento, la dose di elettroni e l'intervallo di sfocatura, dipende da diversi criteri, come la risoluzione target, le dimensioni della proteina, la concentrazione del campione, la produttività desiderata del microscopio, ecc. Per la telecamera del rivelatore di elettroni diretto utilizzata in questi esperimenti, la dose di elettroni è stata scelta nell'intervallo di 4-5 e-/pix/s selezionando una dimensione e un'intensità SPOT appropriate per mantenere l'illuminazione parallela. Come mostrato nella Tabella 1, è possibile utilizzare una dimensione SPOT diversa nel preset Foro/Altezza eucentrica per garantire un rapporto segnale-rumore sufficiente nell'immagine per centrare i fori durante la raccolta dei dati. L'ingrandimento deve essere scelto in modo tale che la dimensione dei pixel sia almeno 2-3 volte inferiore alla risoluzione target per la ricostruzione crio-EM. Tuttavia, l'ingrandimento più elevato (cioè la dimensione dei pixel più piccola) viene utilizzato, il campo visivo più piccolo viene catturato nelle immagini e ci sono meno particelle per immagine, il che alla fine porta a tempi di raccolta dati più lunghi per raccogliere immagini con abbastanza particelle per ricostruire mappe 3D ad alta risoluzione. Per il campione apoF, abbiamo usato la dimensione dei pixel di 0,43 Å poiché avevamo una concentrazione di campione sufficiente per un'alta densità di particelle nelle immagini e una risoluzione inferiore a 2 Å della ricostruzione. Per il campione di proteasoma 20S, abbiamo utilizzato la dimensione in pixel di 0,68 Å per coprire un campo visivo più ampio nelle immagini acquisite. Tipicamente per i microscopi TEM da 200 kV, le immagini crio-EM vengono acquisite nell'intervallo di sfocatura da 0,8 a 2,0 μm. Tuttavia, con il contrasto migliorato e il rapporto segnale-rumore utilizzando il filtro energetico, le acquisizioni di dati possono essere eseguite molto più vicino alla messa a fuoco per preservare meglio le informazioni ad alta risoluzione nelle immagini acquisite a causa di aberrazioni più piccole e decadimento corrispondentemente ridotto della funzione di inviluppo CTF. Inoltre, non utilizziamo un'apertura oggettiva in quanto l'apertura potrebbe introdurre ulteriori aberrazioni dell'immagine mentre il contrasto dell'immagine è già sufficientemente migliorato utilizzando il filtro dell'energia. Per i campioni di proteasoma apoF e 20S, abbiamo utilizzato le impostazioni di sfocatura di 0,5 μm, 0,7 μm e 0,9 μm. Per le proteine più piccole (<200 kDa), abbiamo utilizzato impostazioni di sfocatura di -0,5 μm, -0,7 μm e -0,9 μm per migliorare il contrasto delle particelle e facilitare il prelievo delle particelle e l'allineamento grossolano iniziale nella fase di raffinamento 3D della ricostruzione 3D, che ha portato a mappe 3D con risoluzione ~ 2,5 Å (risultati non pubblicati).
Abbiamo già dimostrato che l'imaging con un filtro energetico migliora il rapporto segnale-rumore (SNR) nelle immagini crio-EM raccolte sui microscopi TEM da 300 kV di fascia alta11. Infatti, quando gli elettroni passano attraverso un campione, si verificano due tipi principali di interazioni: i) Gli elettroni sparsi elasticamente mantengono la loro energia e contribuiscono alla formazione dell'immagine interferendo con il fascio incidente non disperso tramite il meccanismo di contrasto di fase ii) gli elettroni sparsi inelasticamente perdono una certa energia nel campione e contribuiscono principalmente al rumore nelle immagini. Pertanto, l'SNR può essere significativamente migliorato filtrando gli elettroni dispersi inelasticamente, che hanno un'energia inferiore rispetto al fascio incidente e agli elettroni sparsi elasticamente, utilizzando una fessura di energia stretta. Tuttavia, è fondamentale utilizzare un filtro di energia sufficientemente stabile, come Selectris o Selectris-X, per poter utilizzare fessure molto strette (10 eV o più piccole) su lunghe (12+ ore) acquisizione dati automatizzata di set di dati crioEM ad alta risoluzione.
Le immagini Cryo-EM acquisite con microscopi TEM da 200 kV nelle stesse condizioni dei microscopi TEM da 300 kV mostrano un SNR più piccolo ad alta risoluzione (in particolare <4 Å) a causa del decadimento più rapido delle funzioni di inviluppo CTF. Di conseguenza, è necessario un numero maggiore di particelle (e quindi un numero maggiore di immagini raccolte) per ottenere una certa risoluzione quando si utilizzano TEM a 200 kV. Inoltre, la profondità di campo (10-25 nm nell'intervallo di risoluzione 2-3 Å) è anche circa il 20% più piccola nelle immagini da 200 kV35, il che significa che meno particelle nello strato di ghiaccio (in genere 20-50 nm di spessore) saranno completamente a fuoco e contribuiranno costruttivamente a tutte le caratteristiche ad alta risoluzione di una ricostruzione 3D calcolata a meno che i valori di sfocatura non vengano perfezionati per ciascuna particella in modo indipendente nelle fasi successive della procedura di ricostruzione 3D. Per le particelle più grandi (come i virioni icosaedrici o altri gruppi macromolecolari), la dimensione delle particelle può superare la profondità di campo ad alta risoluzione e introdurre errori di fase dovuti all'approssimazione planare della sfera di Ewald negli algoritmi di ricostruzione 3D standard36. Questi errori possono essere perfezionati da algoritmi avanzati che sono già implementati nei comuni pacchetti di elaborazione delle immagini crio-EM 37,28,39. Poiché la sfera di Ewald ha una curvatura maggiore nei dati a 200 kV rispetto ai dati a 300 kV, la correzione della sfera di Ewald è necessaria a risoluzioni relativamente più basse e/o per assemblaggi macromolecolari relativamente più piccoli quando si utilizzano TEM da 200 kV. D'altra parte, le immagini a 200 kV mostrano un maggiore contrasto di particelle nel ghiaccio sottile (20-50 nm) che è significativamente più sottile del percorso libero medio dell'elettrone 200-300 keV (220-280 nm). Il contrasto più elevato aiuta a migliorare il corretto allineamento globale delle singole particelle, in particolare per le proteine più piccole a dispersione debole la cui struttura non è ancora nota e il modello di riferimento 3D non è ancora ben consolidato.
Qui, abbiamo dimostrato sull'esempio di un proteasoma 20S che il contrasto e la qualità dell'immagine potrebbero essere migliorati in modo simile con un filtro di energia quando si utilizza un microscopio TEM da 200 kV. Utilizzando lo stesso numero di particelle, i dati raccolti utilizzando la fessura da 20 eV sono stati ricostruiti con una risoluzione di 2,26 Å rispetto ai dati raccolti con la fessura di energia completamente aperta che è stata ricostruita solo con una risoluzione di 2,34 Å. La migliore ricostruzione è stata ottenuta dai dati raccolti utilizzando la fessura da 10 eV che è stata ricostruita con una risoluzione di 2,14 Å. Questi risultati sono in accordo con la previsione teorica che il filtraggio degli elettroni sparsi in modo inelastico aumenta l'SNR nelle immagini raccolte e facilita una risoluzione più elevata nelle ricostruzioni crio-EM dal dato numero di particelle, come riassunto nella Tabella 4. Questi risultati sono stati ulteriormente confermati dai fattori B calcolati da questi set di dati che indicano una maggiore qualità delle immagini nei set di dati filtrati dall'energia.
Possiamo quindi concludere che mentre i microscopi TEM da 300 kV offrono la massima produttività e la più alta risoluzione possibile nelle ricostruzioni crio-EM, i microscopi TEM da 200 kV forniscono anche set di dati di alta qualità per ricostruzioni crio-EM ad alta risoluzione. Abbiamo dimostrato qui che la qualità delle immagini acquisite, e quindi il tempo complessivo di struttura, può essere ulteriormente migliorata utilizzando il TEM da 200 kV dotato di un filtro di energia e di un rivelatore di elettroni diretto. Il protocollo presentato descrive tutti i passaggi necessari su come ottenere regolarmente dati crio-EM ad alta risoluzione utilizzando questa configurazione e rivelare dettagli strutturali fini delle strutture 3D macromolecolari, che sono essenziali per comprendere le relazioni chiave struttura-funzione nella biologia strutturale e nella progettazione di farmaci basata sulla struttura.
Divulgazioni
Sagar Khavnekar non segnala conflitti di interesse. Gli altri autori sono dipendenti di Thermo Fisher Scientific, la divisione MSD-EM.
Riconoscimenti
Nessuno.
Materiali
| Name | Company | Catalog Number | Comments |
| AutoGrid rings | Thermo Fisher Scientific | 1036173 | Package of 100x AutoGrid rings for the standard EM grids. |
| C-Clip | Thermo Fisher Scientific | 1036171 | Package of 100 clips that secure the standard EM grids inside the AutoGrid rings. |
| Data Management Platform | Thermo Fisher Scientific | 1160939 | Part of the Glacios base configuraiton; includes Athena Software |
| EPU Quality Monitor | Thermo Fisher Scientific | 1179770 | |
| EPU Software | Thermo Fisher Scientific | 1025080 | Part of the Glacios base configuration |
| Ethane 3.5 | Westfalen | A06010110 | Ethane gas used for making liquid ethane (puritiy at least N35, i.e. 99.95% vol) |
| Falcon 4 200kV | Thermo Fisher Scientific | 1166936 | Direct electron detector |
| Glacios | Thermo Fisher Scientific | 1149551 | 200 kV TEM |
| GloQube Plus Glow Discharge System for TEM Grids and surface modification | Quorum | N/A | also available via Thermo Fisher Scientific (PN 1160602) |
| QuantiFoil grids | Quantifoil | N/A | R-2/1, 300 mesh; carbon foil grid |
| Relion | MRC Laboratory of Molecular Biology | N/A | open source software: https://relion.readthedocs.io/en/release-3.1/ |
| Selectris with Falcon 4 for 200 kV | Thermo Fisher Scientific | 1191753 | Energy filter |
| Selectris X with Falcon 4 for 200 kV | Thermo Fisher Scientific | 1191755 | Energy filter |
| UltrAuFoil grids | Quantifoil | N/A | R-1.2/1.2, 300 mesh; gold foil grids |
| Vitrobot Mk. IV | Thermo Fisher Scientific | 1086439 | Automated vitrification system |
| Whatman 595 filter paper | Thermo Fisher Scientific | AA00420S |
Riferimenti
- Wang, J., Hua, T., Liu, Z. -. J. Structural features of activated GPCR signaling complexes. Current Opinions in Structural Biology. 63, 82-89 (2020).
- Chen, S., Gouaux, E. Structure and mechanism of AMPA receptor - auxiliary protein complexes. Current Opinions in Structural Biology. 54, 104-111 (2019).
- Kühlbrandt, W. Structure and mechanisms of F-Type ATP synthases. Annual Review of Biochemistry. 88, 515-549 (2019).
- Laverty, D., et al. Cryo-EM structure of the human α1β3γ2 GABA A receptor in a lipid bilayer. Nature. 565 (7740), 516-520 (2019).
- Liu, F., Zhang, Z., Csanády, L., Gadsby, D. C., Chen, J. Molecular structure of the Human CFTR ion channel. Cell. 169 (1), 85-95 (2017).
- Wrapp, D., et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science. 367 (6483), 1260-1263 (2020).
- Ke, Z., et al. Structures and distributions of SARS-CoV-2 spike proteins on intact virions. Nature. 588, 498-502 (2020).
- Yan, R., Zhang, Y., Li, Y., Xia, L., Guo, Y., Zhou, Q. Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2. Science. 367 (6485), 1444-1448 (2020).
- Walls, A. C., Park, Y. -. J., Tortorici, M. A., Wall, A., McGuire, A. T., Veesler, D. Structure, function, and antigenicity of the SARS-CoV-2 spike glycoprotein. Cell. 180, 281-292 (2020).
- Chiba, S., et al. Multivalent nanoparticle-based vaccines protect hamsters against SARS-CoV-2 after a single immunization. Communications Biology. 4 (1), 597 (2021).
- Nakane, T., et al. Single-particle cryo-EM at atomic resolution. Nature. 587, 152-156 (2020).
- Bai, X. C. Seeing atoms by single-particle Cryo-EM. Trends in Biochemical Sciences. 46 (4), 253-254 (2021).
- Koh, A., et al. High-resolution cryo-EM at 200kV enabled by Selectris-X and Falcon 4. Microscience Microscopy Congress 2021. , (2021).
- Herzik, M. A., Wu, M., Lander, G. C. Achieving better-than-3-Å resolution by single-particle cryo-EM at 200 keV. Nature Methods. 14 (11), 1075-1078 (2017).
- Herzik, M. A., Wu, M., Lander, G. C. High-resolution structure determination of sub-100 kDa complexes using conventional cryo-EM. Nature Communications. 10 (1), 1032 (2019).
- Wu, M., Lander, G. C., Herzik, M. A. Sub-2 Angstrom resolution structure determination using single-particle cryo-EM at 200 keV. Journal of Structural Biology X. 4, 100020-100029 (2020).
- Mori, T., et al. C-Glycoside metabolism in the gut and in nature: Identification, characterization, structural analyses and distribution of C-C bond-cleaving enzymes. Nature Communications. 12 (1), 6294 (2021).
- Hamdi, F., et al. 2.7 Å cryo-EM structure of vitrified M. musculus H-chain apoferritin from a compact 200 keV cryo-microscope. PLoS One. 15 (5), 0232540 (2020).
- Abbott, S., et al. EMDB web resources. Current Protocols in Bioinformatics. 61 (1), 1-12 (2018).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. CryoSPARC: algorithms for rapid unsupervised cryo-EM structure determination. Nature Methods. 14 (3), 290-296 (2017).
- Scheres, S. H. W. RELION: Implementation of a Bayesian approach to cryo-EM structure determination. Journal of Structural Biology. 180 (3), 519-530 (2012).
- Gómez-Blanco, J., et al. Using Scipion for stream image processing at Cryo-EM facilities. Journal of Structural Biology. 204 (3), 457-463 (2018).
- Tegunov, D., Cramer, P. Real-time cryo-electron microscopy data preprocessing with Warp. Nature Methods. 16 (11), 1146-1152 (2019).
- Lander, G. C., et al. Appion: an integrated, database-driven pipeline to facilitate EM image processing. Journal of Structural Biology. 166 (1), 95-102 (2009).
- Carragher, B., et al. Current outcomes when optimizing 'standard' sample preparation for single-particle cryo-EM. Journal of Microscopy. 276 (1), 39-45 (2019).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta Crystallographica. Section D, Structural Biology. 74 (6), 560-571 (2018).
- Bloch, M., Santiveri, M., Taylor, N. M. I. Membrane protein Cryo-EM: Cryo-grid optimization and data collection with protein in detergent. Methods in Molecular Biology. 2127, 227-244 (2020).
- Cheng, A., et al. Leginon: New features and applications. Protein Science. 30 (1), 136-150 (2021).
- Schorb, M., et al. Software tools for automated transmission electron microscopy. Nature Methods. 16 (6), 471-477 (2019).
- Li, X., et al. Electron counting and beam-induced motion correction enable near-atomic-resolution single-particle cryo-EM. Nature Methods. 10 (6), 584-590 (2013).
- Alewijnse, B., et al. Best practices for managing large CryoEM facilities. Journal of Structural Biology. 199, 225-236 (2017).
- Baldwin, P. R., et al. Big data in cryoEM: automated collection, processing and accessibility of EM data. Current Opinion in Microbiology. 43, 1-8 (2018).
- Guo, H., et al. Electron-event representation data enable efficient cryoEM file storage with full preservation of spatial and temporal resolution. International Union of Crystallography Journal. 7, 860-869 (2020).
- Weis, F., Hagen, W. J. H. Combining high throughput and high quality for cryo-electron microscopy data collection. Acta Crystallographica. Section D, Structural Biology. 76 (8), 724-728 (2020).
- Zhou, H., Chiu, W. Determination of icosahedral virus structures by electron cryomicroscopy at subnanometer resolution. Advances in Protein Chemistry. 64, 93-124 (2005).
- DeRosier, D. J. Correction of high-resolution data for curvature of the Ewald sphere. Ultramicroscopy. 81 (2), 83-98 (2000).
- Wolf, M., DeRosier, D. J., Grigorieff, N. Ewald sphere correction for single-particle electron microscopy. Ultramicroscopy. 106 (4-5), 376-382 (2006).
- Leong, P. A., Yu, X., Hong Zhou, Z., Jensen, G. J. Correcting for the ewald sphere in high-resolution single-particle reconstructions. Methods in Enzymology. 482, 369-380 (2010).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 42166 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon