Method Article
デュアルチャンバー透過性サポートシステム内の犬腸オルガノイド
要約
ここでは、デュアルチャンバー透過性サポートシステムにおけるイヌ腸オルガノイドの培養を記述するプロトコルを提示する。透過性支持体におけるオルガノイド播種、単層維持、およびその後の薬物透過性実験が記載されている。
要約
透過性サポートシステムは、通常、新しい治療薬候補の経口透過性を評価するための in vitro ツールとして、従来の2次元(2D)細胞株と組み合わせて使用されます。しかしながら、これらの従来の細胞株の使用には、タイトジャンクションの発現の変化、部分的な細胞分化、および重要な核内受容体の欠如などの制限がある。これらの欠点にもかかわらず、Caco-2およびMDCKモデルは広く受け入れられており、ヒト のインビボ 経口透過性の予測のために検証されています。
イヌは、胃腸解剖学および腸内微生物叢とヒトとの類似性のために、生物医学研究に関連するトランスレーショナルモデルである。したがって、並行医薬品開発を支援するために、イヌおよびヒトの両方 におけるインビボ 薬物透過性特性を予測するための効率的かつ正確な インビ トロツールの精緻化が非常に望まれる。このようなツールは、イヌ腸オルガノイド系であり得、成体幹細胞に由来する三次元(3D)自己組織化上皮構造によって特徴付けられる。
(1)透過性支持体播種プロトコルは、インサート中のイヌオルガノイドを解離および播種するための実験方法を記載している。犬のオルガノイドの単離、培養、および収穫は、この特集号の別のプロトコルセットで以前に説明されています。犬腸オルガノイド単層の一般的な維持のための方法は、(2)単層維持プロトコルにおいて徹底的に議論されている。さらに、このプロトコルは、経上皮電気抵抗(TEER)測定および光学顕微鏡検査を介して単分子膜の構造的完全性を評価する方法を記載している。最後に、(3)透過性実験プロトコールは、実験結果の インビトロ 検証を含む、実験の直前のタスクを記述している。
全体として、犬オルガノイドモデルは、デュアルチャンバー細胞培養技術と組み合わせることで、2D実験モデルに関連する制限を克服し、それによって、犬およびヒト患者の両方における治療薬候補の見かけの経口透過性の予測の信頼性が向上する。
概要
透過性支持システムは、典型的には、腸上皮障壁1,2を通る治療薬候補の見かけの透過性を決定するために使用される。また、細胞分泌3、細胞遊走4、および薬物毒性5を評価するためにも使用することができる。インビトロ経口薬物透過性アッセイは、創薬および開発プロセス2における重要なステップであり、個々の薬物候補は薬物R&Dライフサイクルの初期段階でテストされています6。この透過性支持システムは、マルチウェルプレートに入れられた半多孔膜を備えたインサートからなるデュアルチャンバー細胞培養装置である。このシステムは、インサート7で増殖した細胞単層の頂端側および底辺側への直接アクセスを可能にする。これらの系で使用される単層は、典型的には、胃腸上皮細胞(例えば、ヒト結腸直腸腺癌Caco−2細胞株)に由来する8。細胞培養物は、腸上皮細胞の自然なマイクロアーキテクチャを模倣した分極状態で増殖し、さらなる細胞分化、同様のミクロ解剖学および機能を可能にする7。透水性サポートインサートの詳細については、図1を参照してください。インサートの2D細胞培養物による播種は、伝統的に腸管薬物透過性を評価するために使用され、比較的手頃な価格で培養が容易である9。これらの系は、治療薬候補10、11の腸内代謝を予測する能力が限られていることを含む、いくつかの主要な限界を提示する。これは、上皮細胞間のタイトジャンクションを通る受動的吸収、流出による能動的な経皮吸収、または取り込みトランスポーター(例えば、P-糖タンパク質、モノカルボキシレートトランスポーター1)、および腸細胞によって代謝される薬物など、薬物吸収のすべてのメカニズムに当てはまる。
犬は人間と共通の環境と食事を共有しています12.犬の腸の解剖学とマイクロバイオームの組成は、過去36,000年にわたる家畜化と共有食に起因するとされてきたヒト13の組成によく似ています14。残念なことに、これらの類似性は、疾患発症の一般的な原因/引き金にもなり得る。イヌは、肥満15、炎症性腸疾患16、結腸直腸腺癌17、胃腸間質腫瘍(GIST)18、およびそれらの相対的長寿に関連する様々な他の病状19など、ヒトと同様の慢性罹患率を発症する。したがって、イヌオルガノイドは、One Health Initiative20の精神において、これらの慢性多因子疾患の逆トランスレーショナル研究に首尾よく使用される可能性がある。
Caco−2細胞は、薬物経口吸収アッセイ21に最も使用される細胞株である。これらの細胞は現在、インビトロ腸透過性アッセイのための「ゴールドスタンダード」モデルと考えられている2、22、23。Caco-2細胞株は、異なる発現レベルであるが、ヒト腸管に見られる流出および取り込みトランスポーターを発現する24、25、26。Caco−2細胞はまた、薬物が腸流出トランスポーターの基質または阻害剤であるかどうかを決定するためのモデルとしても広く使用されている22、27。Caco-2細胞は結腸起源であるが、腸細胞を模倣する。残念なことに、Caco−2細胞は、小腸9の上皮層からの1つの細胞型のみを表しており、複雑な腸上皮細胞型組成物を正確に再現することができない。例えば、粘液産生専用の杯細胞はCaco−2培養物から欠如しており、粘液−薬物相互作用は他の細胞株28との共培養なしには評価できない。さらに、Caco−2培養物は、プレグナンX受容体(PXR)、ステロイドX受容体(SXR)、および構成的アンドロスタン受容体(CAR)29など、腸内に典型的に存在する重要な核内受容体のいくつかを発現しない29。その結果、Caco-2培養物は、これらの受容体の誘導因子である特定の薬物(例えば、リファンピン)による薬物輸送体および酵素の誘導をモデル化できない30。
3D腸オルガノイド技術は、これらの制限のいくつかに対処します19。オルガノイドは、成体幹細胞に由来する自己組織化構築物であり、マイクロ侵襲的技術を用いて採取された組織サンプルから樹立することができる20。ヒト誘導多能性幹細胞は、腸透過性モデル31、32に採用されている。イヌオルガノイドは、ヒト幹細胞研究が倫理的問題によって制限されているため、ヒトオルガノイドに関連する代替手段を提供する33。さらに、犬オルガノイドは、犬の薬物透過性、代謝、能動輸送、および薬物-薬物相互作用を探索するための in vitro システムを提供する。この技術ギャップに対処するために、透過性支持系における犬腸オルガノイドの一貫したかつ確実な成長が記載されている34。犬腸オルガノイドを用いた透過性アッセイは、現在使用されているアッセイ(Caco-2)と比較して、犬腸透過性および低分子薬物分子の代謝を潜在的に予測する可能性がある。これらの極めて重要な特徴の確認は、この新規 なin vitro システムを、細胞内代謝および能動的輸送に対する誘導物質の潜在的な影響を探求する将来の研究に役立てる。
イヌオルガノイドは、腸の上皮層に典型的に存在する全ての細胞型から構成される。機能的および微小解剖学的観点から、それらは犬腸の上皮層の環境を確実に複製する19,35。さらに、粘液、犬特異的薬物トランスポーターおよび酵素の存在、ならびに犬腸オルガノイドにおける全体的な細胞分化は、イヌにおいてインビボで見られるものに匹敵する34。したがって、オルガノイドは、罹患した獣医患者から単離され、犬の経口薬物透過性に対する様々な疾患プロセス(例えば、慢性腸の炎症)の効果をモデル化するために使用することができる19、36。犬腸オルガノイド系は、薬物透過性実験以外の設定でも使用することができる。これらの3D構造はまた、炎症性腸疾患、結腸直腸腺癌、および胃腸間質腫瘍についてChandraらによって以前に記載されたように、罹患患者から単離することもできる19。
透過性サポート播種プロトコルは、インサート中に犬腸オルガノイド培養物を確立するための方法を記載している。この第1のプロトコールは、細胞外膜マトリックスに播種された確立されたイヌオルガノイド培養物を解離させる方法を概説する。さらに、コラーゲンIおよび細胞外膜マトリックスによるインサートのプレコーティングは、このプロトコールにおいて議論される。犬オルガノイドを透過性支持体インサートに埋め込むことも詳細に説明される。
2番目のプロトコルは単層維持プロトコルで、インサートにメッキされた犬の3Dオルガノイドの一般的な維持管理が含まれています。培養物をリフレッシュするために使用されるオルガノイド培地の頻度および体積、ならびに細胞培養の損傷を防止する方法を、上皮単層のコンフルエンシーを評価するための実験方法とともに、この第2のプロトコールに提示する。
最後に、透過性実験プロトコルは、透過性アッセイにおける犬腸3Dオルガノイドが実験的使用の準備ができているかどうかを判断する方法と、実験を実施する前に必要な検証手順に焦点を当てています。このセクションでは、透過性実験のセットアップと成功裏の実行、ならびに単層培養のチャンバー内での治療薬候補のインキュベーションとサンプリングについても説明します。単層の完全性を監視するための低透過性フルオレセインイソチオシアネート(FITC−デキストラン)の使用も議論される。最後に、実験終了後の結果を検証するための インビトロ 評価方法について説明する。透磁率実験は非常に広大なトピックであり、Hubatschらによって非常によく要約されています。プロトコルのワークフローを 図 2 にまとめます。
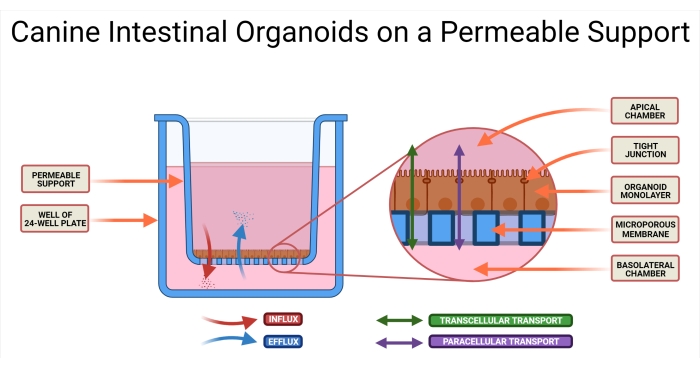
図1:透過性サポートシステム上の犬腸オルガノイド。 透過性サポートインサートは、24ウェルプレートのウェルに配置される。微多孔性膜は、解離したイヌ腸オルガノイドの播種を可能にし、これらの細胞は最終的にオルガノイド2D単分子層を形成する。この技術により、単層の AP 側と BL 側の両方にアクセスできます。オルガノイド培地は、透過性支持体のAPチャンバーおよびBLチャンバーの両方に導入される。薬物候補の吸収(AP→BL)および分泌(BL→AP)ならびに薬物輸送の2つの可能な様式が例示される。略語: AP = 頂端;BL = 側底側。 この図の拡大版を表示するには、ここをクリックしてください。
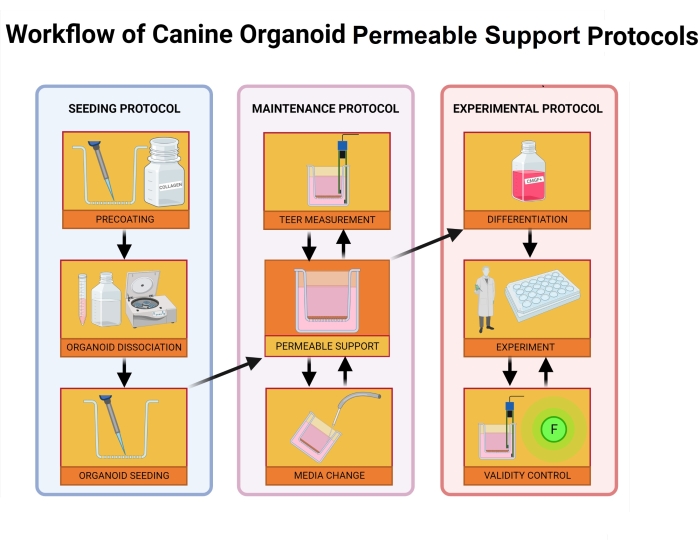
図2:犬用オルガノイド透過性サポートプロトコルのワークフロー。 透過性支持体インサートを細胞外膜マトリックスとコラーゲンIとの混合物でプレコーティングし、1時間インキュベートした。インキュベーションプロセスの間、オルガノイド培養物は解離する。個々のオルガノイド細胞はインサートに播種され、播種直後に基底チャンバー内の培地が添加され、一方、頂端チャンバーに培地が播種プロセスが終了してから24時間後に添加される。オルガノイドの維持とモニタリングには、定期的な培地交換、TEER値測定、および単層の完全性を評価するための光学顕微鏡検査が含まれます。実験の前に、オルガノイドは、培地からROCK阻害剤およびGSKiβを除去することによって分化されなければならない。TEER値は実験当日に測定され、オルガノイド単層は光学顕微鏡で細胞への損傷がないか検査されます。次いで、培地を適切な緩衝液と交換し、実験前にインキュベートする。FITC−デキストランアッセイは、単層完全性のマーカーとして腸透過性実験39 の間に使用される。TEER測定は実験後に行われ、光学顕微鏡は24時間後に結果を検証します。略語:TEER =経上皮電気抵抗;ROCK = rho関連キナーゼ;GSKiβ=グリコーゲン合成酵素キナーゼβ;F = 蛍光。 この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
この研究は、アイオワ州立大学の施設動物ケアおよび使用委員会(IACUC-19-337;IACUC-18-065;IACUC-19-017)。次のセクション (ステップ 1.1 ~ 1.3) では、透過性サポート シード プロトコルについて説明し、その手順を 図 3 にまとめます。
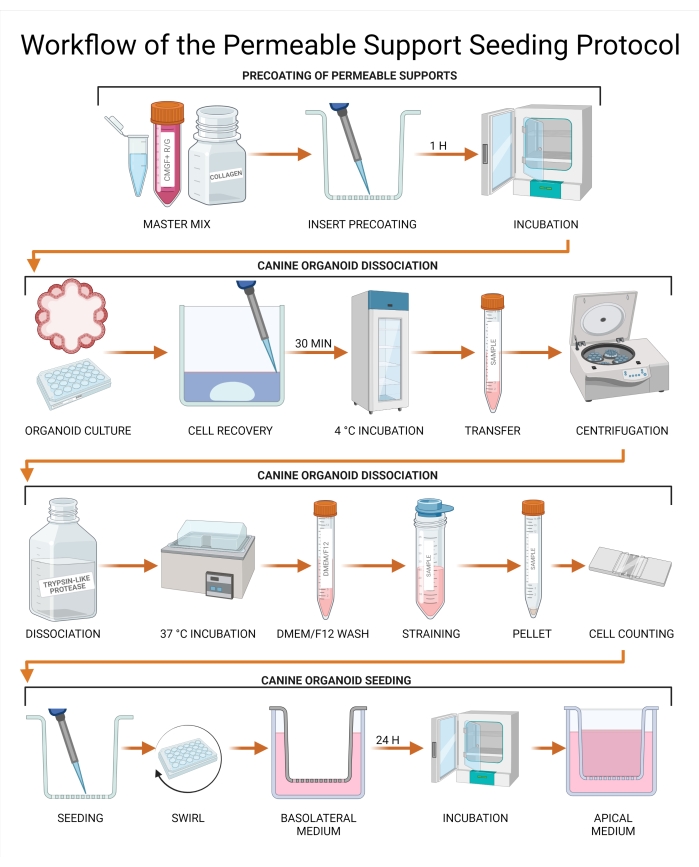
図3:透過性サポートシーディングプロトコルのワークフロー。 透過性支持体インサートは、CMGF+ R/G、コラーゲンI、および細胞外膜マトリックスの組み合わせでプレコーティングされ、続いてインキュベートされる。イヌオルガノイド培養物からの培地を吸引し、細胞回収溶液に交換し、続いて4°Cで30分間インキュベートした。 続いて培養物をチューブに移し、トリプシン様プロテアーゼを用いてオルガノイド解離を行う。解離していないオルガノイドは、ストレーナーを通過することによって除去され、単一細胞懸濁液を達成し、細胞濃度は血球計数器または自動細胞カウンターを使用して決定される。細胞を透過性支持体インサート上に播種し、CMGF+ R/Gを基底側チャンバーに添加する。次いで、培養物を24時間インキュベートし、残りの液体を頂端チャンバーから除去し、CMGF+ R/Gと置換する。GSKiβ=グリコーゲン合成酵素キナーゼβ;CMGF + R/G = ROCK阻害剤およびGSKiβで強化された成長因子を含む完全培地。 この図の拡大版を表示するには、ここをクリックしてください。
1. 透過性サポートシーディングプロトコル
- 透水性支持体インサートのプレコーティング
- 表1の情報に従って、Rho関連プロテインキナーゼ(ROCK)阻害剤およびグリコーゲン合成酵素キナーゼβ阻害剤(GSKiβ)(CMGF+R/G)で増強された成長因子を含む完全な培地を調製する。
- 氷バケツを準備し、氷上で細胞外膜マトリックスを融解し始める。必要な数のインサートを含む24ウェルプレートをインキュベーターに入れ、予温します。ラット尾コラーゲンI(3mg/mL)を集め、光から守りながら氷の上に置きます。CMGF + R / Gを収集し、氷の上に置きます。
- 実験に必要なインサートとブランクの総数を計算し、インサートごとに100μLのコーティング溶液を脇に置いておきます。
注:必要以上にコーティング溶液を調製してください。必要以上に少なくとも15%多く準備することをお勧めします。 - 15mLチューブで、CMGF+ R/Gを細胞外膜マトリックス(1%)およびコラーゲンI(1%)と混合し、穏やかにピペットミックスする。
- 各ポリエステルインサートを100μLのコーティング溶液でコーティングし、インサートをインキュベーター(37°C;5%CO2 雰囲気)に1時間置きます。
- インキュベーション後、インサートフィルターを乱さないように注意しながら、真空アスピレーターまたはP1000ピペットを使用して、コーティング溶液を各インサートから慎重に吸引します。プレコートプレートをインキュベーターに入れて保温します。
- 犬のオルガノイド解離
注:少なくとも4日間培養された犬のオルガノイドを使用してください。解離を開始する前に、Gabriel et al.38 を参照して、サンプルが健康で、密度が高く、実験に十分である時期を判断してください。すべてのウェルメッキ手順のためにオルガノイドの1つの余分なウェルを解離することが推奨される。さらに、不均一なオルガノイドの成長または不適切な操作によって引き起こされる損傷を説明するために、所望の挿入数を〜20%増加させることが推奨される。FITCデキストランの使用を計画している場合は、余分な井戸を準備してください。- アイスバケツと冷たい1x Advanced DMEM/F12ストックのバイアルをバイオセーフティキャビネットに用意します。
- 細胞外膜マトリックスを氷の上に置き、融解を開始し、急速な融解から保護し、凝固を避けるために氷に沈める。細胞外膜マトリックスのめっきのために冷凍庫にピペットチップ(P200)の箱を置く。
- 冷蔵遠心分離機を4°Cに予冷する。
- CMGF+ R/Gを冷凍庫/冷蔵庫から37°Cのウォーターバスに移動します。可能な限り、直接光への暴露を避けてください。
- 細胞外膜マトリックスを乱さないように注意しながら、適切な数のウェル(24ウェルプレートの1ウェルあたり2〜4インサート)のオルガノイド培養で24ウェルプレートからすべての培地を除去します。
メモ: この容量は、使用するセル計数システムによって異なる場合があります。 - ウェルあたり0.5 mLの予備冷却細胞回収溶液を加え、細胞外膜マトリックスドームを溶解する。
- プレートを冷蔵庫(4°C)中で30分間インキュベートする。
- 懸濁液をピペットでピペットし、すべてのオルガノイドを回収し、細胞外膜マトリックスを溶解し、それらを15mLチューブに移す。
- 遠心分離機(700 × g 、4°Cで5分間)し、レベルが0.5 mLマークに達するまで上清を除去し、ペレットを乱さないようにした。
- 1mLのトリプシン様プロテアーゼを加え、37°Cの水浴中で8分間インキュベートする。インキュベーション期間中にチューブを数回フリックして細胞を混合する。
- サンプルの入ったチューブをバイオセーフティキャビネットに移し、7 mLのプレチルドアドバンストDMEM/F12をゆっくりと加えて、トリプシン様プロテアーゼを不活性化し、細胞解離を停止します。
- 40 μm セルストレーナーを 1 mL のアドバンスト DMEM/F12 でプリウェットします。混合物を静かにピペッティングし、懸濁液を濾過する。追加の高度なDMEM/F12をピペットでつないでストレーナーをすすいでください。
- チューブ(700 × g を4°Cで5分間)遠心分離し、上清を除去する。ペレットを乱さないでください。
- 細胞ペレットを、分離したオルガノイドのウェルごとに約50〜100μLの培養培地(CMGF+ R/G)に再懸濁する。
- 血球計数器または適切な機械を使用して懸濁液のサブサンプル(〜10μL)をカウントし、懸濁液中の総細胞数を決定する。
- 犬のオルガノイド播種
- 細胞懸濁液を希釈または濃縮し、1mLあたり〜75,000細胞の細胞濃度を得る。
- 移入中の細胞接着を避けるために、BSA(1%)プレコートチップを使用して懸濁液の種子100μLを各インサートに注入する。コーティングされたインサートを無細胞ブランクとして1つ追加し、オルガノイドが成長することなく、定期的な培地交換を受けます。
- プレートを円運動で約30秒間静かに旋回させ、播種した細胞をインサート全体に分散させます。細胞の均一な分布を光学顕微鏡で確認する。
- 700 μL の CMGF + R/G を側底チャンバーに加え、プレートをインキュベーター (37 °C; 5% CO2 雰囲気) に24 時間置きます。
- 24 時間後、頂端チャンバーから細胞懸濁液を静かに取り出し、200 μL の CMGF + R/G と交換します。プレートをインキュベーターに戻します。
2. オルガノイド細胞単層維持プロトコル
メモ: 次のセクション(手順 2.1-2.2)では、オルガノイド細胞単層維持プロトコルについて説明します。このプロトコルで紹介する手順のワークフローを 図 4 にまとめます。TEER値測定の標準化に役立つメモを取るための表を 補足表1に示します。

図4:透水性支持培養維持のワークフロー TEER値は、電極(プローブ)とボルト/オームメーターを使用して測定されます。プローブは、ウェルに挿入する前に70%のアルコールで化学的に滅菌する必要があります。ブランクおよびオルガノイドセルインサートが測定され、TEER値が計算されます。培地はその後、頂端チャンバーおよび側底チャンバーの両方でリフレッシュされ、インサート上のイヌオルガノイド培養物を光学顕微鏡を用いて可視化する。オルガノイド培養物または微多孔性膜のいずれかの涙は、プロトコルに従って記録され、取り扱われる。略語:TEER =経上皮電気抵抗。 この図の拡大版を表示するには、ここをクリックしてください。
- TEER値測定
注:TEER値の測定は、箸が取り付けられた上皮ボルト/オームメーターを使用して行われます。製造元の取扱説明書を参照してください。TEER値は、犬のオルガノイド単層の完全性に関する情報を提供します。- 細胞培養増殖中の代替日ごとにTEER値測定を行います。
- 上皮ボルト/オームメーターとその電極をバイオセーフティキャビネットに移動します。使用前に電極を70%アルコールで化学的に滅菌してください。関数をオームに設定します。電極が乾くまで少なくとも1分間待ちます。
- 最初の測定を行う前に、ワイヤ電極をポートに挿入し、電源を入れます。メーターに、箸を測定する代わりにワイヤー電極インサートで 1,000 個のΩが表示されることを確認します。そうでない場合は、デバイスを調整します。
- 無細胞インサート(ブランク)の頂端チャンバと側底チャンバに電極を挿入し、頂端チャンバに短い電極が含まれ、側底チャンバに長い電極が含まれるようにします( 図4を参照)。膜に触れないでください、しかし同時に、電極が媒体に沈んでいることを確認してください。
- 値が安定するまで数秒間待ってから、ラボブックにその値を書き留めます。残りの犬のオルガノイド単層を測定し、異なるサンプルを測定するときは、電極を70%アルコールで滅菌してください。電極でオルガノイド単層に触れないように注意してください。
- 測定が行われた後、最後に電極を70%アルコールで滅菌します。不適切な操作による損傷から保護し、製造元の指示に従って保管してください。
- Eq (1) を使用して各ウェルの TEER 値を計算します。ここで、Rサンプル と R ブランクは、それぞれ単層ウェルとブランク ウェルのオーム (Ω) 値であり、面積 (cm²) はインサートの値です。
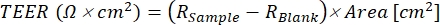 (1)
(1)
- 単層維持
メモ: 表 2 の推奨媒体変更計画を確認します。- 滅菌使い捨て9インチパスツールピペットと真空アスピレーターを使用して、頂端から培地を静かに吸引し、次に側底チャンバーから吸引します。プレートを傾けて、媒体の表面をはっきりと確認します。細胞単層の損傷を防ぐために、頂端チャンバ内の微多孔膜に近づきすぎないように吸引しないでください。
注: サンプル間を移動するときは、新しいパスツールピペットを使用してください。ピペットもこの手順の代替品として使用できます。 - 頂端または側底チャンバーの壁を狙ったP1000ピペットを使用してCMGF+ R / Gをゆっくりと加えます。単分子層の損傷を避けるために、頂端チャンバー内の培地交換を非常に慎重に行う。
- 光学顕微鏡下で1日おきにウェルをチェックし、培養物の健康状態を評価し、オルガノイド単層または微多孔膜の涙液を監視します。位相差顕微鏡を使用して、培養物の詳細を強調します。
注:犬のオルガノイド単層涙液の場合、単層には回復して再成長する時間が与えられます。微多孔膜涙液の場合、ウェルは実験から除外されなければならない。
- 滅菌使い捨て9インチパスツールピペットと真空アスピレーターを使用して、頂端から培地を静かに吸引し、次に側底チャンバーから吸引します。プレートを傾けて、媒体の表面をはっきりと確認します。細胞単層の損傷を防ぐために、頂端チャンバ内の微多孔膜に近づきすぎないように吸引しないでください。
表2:オルガノイド培養物に対する培地交換の推奨値。 CMGF+ R/Gは、代替日ごとに1日おきにウェルの頂端および側底チャンバー内で変化します。週末の培養期間が長くなるほど、側底チャンバーと頂端チャンバーの両方で培地量の増加が必要となり、金曜日の午後に適用され、月曜日に交換されます。略語:ROCK = rho関連キナーゼ;GSKiβ=グリコーゲン合成酵素キナーゼβ;CMGF + R/G = ROCK阻害剤およびGSKiβで強化された成長因子を含む完全培地。 この表をダウンロードするには、ここをクリックしてください。
3. 透過性実験プロトコール
メモ: 次のセクション(ステップ 3.1-3.5)では、透過性実験プロトコルについて説明します。薬物の インビトロ 透過性を測定するための実験プロトコルワークフローを 図5にまとめます。
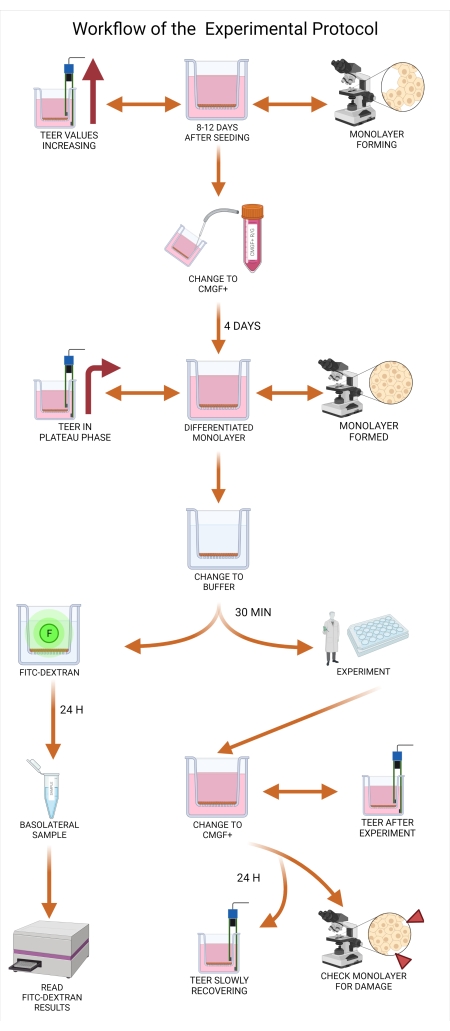
図5:実験プロトコールのワークフローオルガノイド培地は、インサートを播種してから8〜12日後にCMGF+ R/GからCMGF+に変更しなければならず、細胞分化を可能にする。培地(頂端および側底側の両方)をCMGF+に変更した後も、TEER値は依然として増加しており、犬のオルガノイド単層はほぼコンフルエントに達しているはずです。培地がCMGF+に変更されてから少なくとも4日後に、単層の調製性が評価される。単層が完全に形成され、TEER値がプラトー相(典型的には1,500〜2,500 Ω.cm2の間)に達すると、培地は輸送バッファーと30分間交換され、単層が新しい環境に適応できるようにします。実験の時間0分で、FITC−デキストランアッセイが行われ、そして20分の側底側サンプルが収集される。結果はその後、プレートリーダーで分析されます。実験後、頂端チャンバーおよび側底チャンバーの内容物を再びCMGF+に変更し、TEER値の読み取り値を取得します。単層を24時間インキュベートし、単層の完全性をTEER測定の繰り返しによって評価する。略語:TEER =経上皮電気抵抗;ROCK = rho関連キナーゼ;GSKiβ=グリコーゲン合成酵素キナーゼβ;CMGF + R/G = ROCK阻害剤およびGSKiβで強化された成長因子を含む完全培地;CMGF+ = 成長因子を含むが、ROCK阻害剤またはGSKiβを含まない完全培地;FITC=フルオレセインイソチオシアネート;F = 蛍光。この図の拡大版を表示するには、ここをクリックしてください。
- オルガノイド単層レディネスの評価
注:この手順は、シード後8〜14日で行われます。- 少なくとも1日おきに光学顕微鏡で単層を確認してください(位相差を使用して単層の完全性を視覚化します)。細胞単層が隙間や涙の明らかな兆候なしに完全に形成されたら、次のステップに進みます。
- オルガノイド培地をCMGF+ R/GからCMGF+に変更する(培地組成物からROCK阻害剤およびGSKiβを除く)。実験の少なくとも4日前に培地を交換することが推奨される。
注:このステップにより、オルガノイド単層の適切な分化が可能になります。 - ほぼ 1 日おきに TEER 値の測定を続けます。TEER値が約1,500~2,000 Ω × cm²(図6)で頭打ちになり始めたら、毎日TEER値を測定します。
メモ:この定常状態は約2〜3日間維持でき、これは透過性試験を実行するのに最適な時間枠です(通常は11〜13日目)。プラトーTEER値は、オルガノイドの腸内局在、測定温度、犬種、年齢、および疾患状態に基づいてわずかに振動する可能性がある。 - TEER値の急速な低下またはオルガノイド単層の複数の細胞層への過増殖を避けるために、薬物透過性アッセイを直ちにスケジュールする。
- 実験の準備
注:インキュベーターシェーカーは、攪拌されていない水層の影響を避けるために、実験中に使用することができます。一貫した温度でTEER値を測定します。- 実験当日、TEER値を測定し、値が定常状態に達し、急激に低下していないことを確認します。
- 実験を実行するために、20%を超えるインサートから(光学顕微鏡およびTEER値を介して)最良の単層を選択する。
- 光学顕微鏡下で単層を観察し、不完全、破れた、または成長したオルガノイド単層を除外する。
- 輸送バッファーを準備し、そのpHを所望の値に調整します。
注:実験バッファーの組成は、実験セットアップによって異なります。頻繁に使用されるバッファーは、ハンクス平衡塩溶液(HBSS)、グルコース(12.5 mM)、および4-(2-ヒドロキシエチル)-1-ピペラジンエタンスルホン酸(HEPES、25 mM)で構成されています。この組成物は、実験中のオルガノイド培養の生存率を保証する。 - 選択したウェルの頂端チャンバーおよび基底チャンバーから培地を慎重に吸引します。
- 200 μLの輸送バッファーを頂端チャンバーに、800 μLを側底チャンバーに加える。
注:輸送バッファーは、微多孔膜からの単層の剥離を避けるために、最初に頂端チャンバーに添加し、次に基底側チャンバーに追加する必要があります。 - プレートをインキュベーター(37°C;5%CO2 雰囲気)に30分間置き、平衡化した。
注:犬のオルガノイド単層は、薬物透過性実験の準備が整いました。
- 典型的な実験レイアウト-IgY濃度溶液
注:実験計画とレイアウトは、研究課題によって異なる場合があります。オルガノイド単分子膜を介した免疫グロブリンY(IgY)の透過性は、例としてプロトコルにおいて使用され、修飾され得る。ドナーチャンバーという用語は、薬物が最初に適用されるチャンバーを指し、一方、受容チャンバーは、ドナーチャンバーから薬物を受け入れるチャンバーを指す。典型的な実験では、2時間(例えば、15、30、60、90、120分)にわたって受信機チャンバー内のサンプルを収集します。- IgY溶液(選択した薬物または溶質)を所望の最終濃度まで輸送緩衝液に溶解して調製する。必要以上に薬液を調製する。
注:水溶解度の低い薬物は、緩衝液に添加する前に、まず有機溶媒(例えば、エタノール、DMSO)に溶解させることができる。溶媒の最終濃度は、細胞単層を損傷しないように1%未満にすべきである。 - 各ウェルのドナーチャンバー(頂端チャンバーまたは側底チャンバーのいずれか)からバッファーを除去します。
- IgY溶液(薬物溶液)をすべてのドナーチャンバーに加える。残りの溶液を初期薬物濃度の測定のための時間0ドナー溶液として使用する。
- 必要な時点で、50 μLを受容室から取り出し、ラベル付きチューブに入れます。最後の時点で、ドナーチャンバーからサンプルを取り出します。実験の終わりに、ドナーおよびレシーバーアリコートを-20°Cの冷凍庫に移す。
メモ:多くの時間ポイントが必要な場合は、受信チャンバ内のバッファの交換を行うことができますが、見かけの透磁率の計算では考慮する必要があります。受信機チャンバ内の濃度は、シンク条件44を維持するために実験の終了時にドナーチャンバの10%を超えてはならない。
- IgY溶液(選択した薬物または溶質)を所望の最終濃度まで輸送緩衝液に溶解して調製する。必要以上に薬液を調製する。
- オルガノイド細胞単層品質管理
注:FITC−デキストラン溶液は、実験中に単層完全性を確認するために使用することができる。FITC−デキストランは、単層完全性アッセイの一例として使用される。その他には、ルシファーイエロー、PEG-4000、放射性標識マンニトール、イヌリン44などがあります。- 時間0分で、頂端チャンバーの内容物を吸引し、各実験群の3連で250μLのFITC−デキストラン溶液(5mg/mL、4kDa)と交換する。
メモ: FITCデキストランを光にさらさないでください。 - 20分後、側底チャンバーから緩衝液を除去する。
- 蛍光プレートリーダーを用いて側底側サンプルの蛍光強度を測定する(検量線を使用;励起は485nmに設定し、発光値は528nmに)。
注:FITCのPアプリは 、ディスカッションで説明した方法を使用して計算することもできます。 - 実験が終了した後、頂端チャンバーおよび基底チャンバーから過剰な緩衝液を慎重に吸引する。
- 頂端チャンバーに200 μLのCMGF+を加え、側底チャンバーに700 μLを追加します。
- 個々のウェルのTEER値を測定します。
- プレートをインキュベーター(37°C;5%CO2 雰囲気)に24時間置きます。
- 該当する場合は、24時間後にTEER値を測定して、実験の品質管理部分中に単層に損傷を与える可能性を評価します。光学顕微鏡を使用して、犬のオルガノイド単層の完全性を視覚化します。
- 時間0分で、頂端チャンバーの内容物を吸引し、各実験群の3連で250μLのFITC−デキストラン溶液(5mg/mL、4kDa)と交換する。
- 下流分析のための細胞単層の固定
- ホルマリン・酢酸・アルコール溶液(FAA、 表1の組成)を調製する。
- P1000ピペットまたは滅菌使い捨て9インチパスツールピペットと真空アスピレーターを使用して、頂端チャンバーおよび側底チャンバーから輸送バッファーまたはCMGF+を取り外します。
- 頂端室と基底室をFAAで満たします。
- 24時間後、FAAを吸引し、70%エタノールと交換する。
- 蒸発を防ぐためにプレートを柔軟な実験用フィルムで包み、準備をブロックするために進んでください。

図6:実験群全体のTEER値。 TEER値は、単層のイヌ腸管オルガノイドの5群で測定した。3つのグループは犬の空腸腸薬で構成され、2つのグループはコロノイドで構成されていました。各群は、12〜22回の反復を含む。空腸腸内膜培養物のTEER値は4日目から14日目まで、コロノイド培養物は4日目から12日目まで示されている(オルガノイド単層が定常状態の値に達した時点で測定が終了し、単層が実験的使用の準備ができたことを示す)。エラーバーは測定値のSEMを表します。略語:TEER =経上皮電気抵抗。 この図の拡大版を表示するには、ここをクリックしてください。
結果
犬オルガノイドの培養のための標準的な操作手順は以前に記載されており33、犬オルガノイドプロトコルもこの特別号38で詳細に議論されている。透過性支持体上で培養した犬腸オルガノイドを固定し、パラフィン包埋し、単層および細胞集団のミクロ解剖学を調べた。パラフィン包埋プロセスは、以前にGabrielらによって議論された38。日常的な染色(ヘマトキシリンおよびエオジン)が行われており、アルシアンブルー染色技術を使用して、犬のオルガノイド単層中の杯細胞を検出しました( 図7参照)。
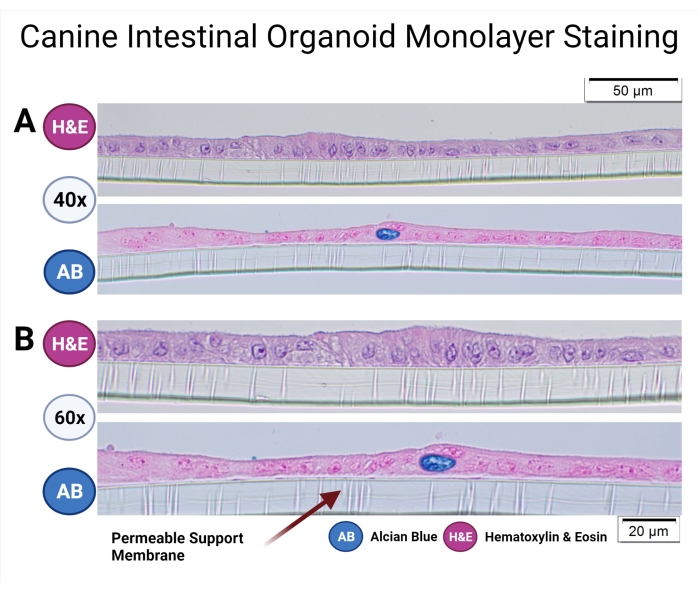
図7:犬腸オルガノイド単層染色。透水性支持体中の結腸起源の犬腸オルガノイドは、パラフィン包埋され、H&EおよびABで染色されている。H&E染色は柱状上皮単層を明らかにし、細胞の頂端部分の微小絨毛を60倍の倍率で観察することができる。AB染色はさらに、犬腸オルガノイド単層における杯細胞(濃い青色)の存在を明らかにする。スケールバー = 20 μm (A), 50 μm (B).略語:H&E =ヘマトキシリンおよびエオジン;AB = アルシアンブルー。この図の拡大版を表示するには、ここをクリックしてください。
透過性支持体上のオルガノイド培養物を、透過性実験の準備をするために10〜14日間増殖させるべきである。光学顕微鏡は、薬物候補の透過性試験のためのオルガノイド培養の準備を確認するために、TEER値測定と組み合わせて使用される。健常動物および罹患動物からの異なる犬腸オルガノイド単層の代表的な光顕微鏡画像を 図8に提示する。

図8:犬腸内オルガノイド単層顕微鏡。光学顕微鏡で見た成長単層の画像。健康なドナーに由来するオルガノイド単層は、空腸腸(10x;40x)およびコロノイド(20x;40x)培養によって表される。罹患ドナーのオルガノイド単層は、PLEと診断されたイヌ患者に由来する十二指腸(5x;10x)および回腸(5x;10x)エンテロイドによって表される。PLEオルガノイド培養物はいずれも、オルガノイドの播種中の不適切な細胞単離の例であり、これらの培養物は3Dオルガノイドの存在のために薬物透過性アッセイに使用することができなかった。単層涙(5倍)などの適切な単層形成からの逸脱の例は、生物学的サンプルの慎重な操作によって引き起こされます。オルガノイドの長期培養(10倍、20倍)は、オルガノイドが元の3D構造に似始めたときに、オルガノイドがインサート上に長時間維持されることによって引き起こされます。比較のために、薬物透過性研究に一般的に使用される透過性支持体上の従来の2D細胞株の画像を提示する(MDCK-10x;40x、およびCaco-2-10x;20x)。略語: PLE = タンパク質喪失腸症;MDCK = マディン・ダービー犬腎臓。スケールバー = 500 μm (5x)、200 μm (10x)、100 μm (20x)、50 μm (40x)。この図の拡大版を表示するには、ここをクリックしてください。
オルガノイド単層はまた、リン酸緩衝生理食塩水(PBS)中の3%パラホルムアルデヒド−3%グルタルアルデヒド中で固定した。透過型電子顕微鏡(TEM)は、透過性支持体上のオルガノイド培養物の超構造を特徴付けるために使用した。微小絨毛およびタイトジャンクションの微小解剖学的構造は、図9に見ることができる。

図9:健康な犬腸オルガノイド単層のTEM画像。 TEMを用いて、空腸(A)、回腸(B)、および結腸(C)オルガノイド単層の細胞マイクロアーキテクチャを明らかにした。透過性支持体インサートの微多孔膜は黄色の矢印でマークされている。微小絨毛(青色矢印)およびタイトジャンクション(赤色矢印)の存在が画像に描かれている。略語:TEM=透過型電子顕微鏡。スケールバー = 5 μm (A), 2 μm (B, C). この図の拡大版を表示するには、ここをクリックしてください。
TEER測定と光学顕微鏡の両方を実行して、システムが透過性試験の準備ができていることを確認する必要があります。このアッセイは、TEERが定常状態に達するとすぐに使用できますが、光学顕微鏡はオルガノイドの損傷または過増殖を排除するのに役立ちます。犬空腸腸およびコロノイドからなる5つの群の典型的なTEER測定値の要約を 図6に提示する。
表1:オルガノイド培地およびFAAの組成。 CMGF+、CMGF+ R/G、およびFAAの完全な組成をこの表にまとめます。略語:ROCK = rho関連キナーゼ;GSKiβ=グリコーゲン合成酵素キナーゼβ;CMGF + R/G = ROCK阻害剤およびGSKiβで強化された成長因子を含む完全培地;CMGF+ = 成長因子を含むが、ROCK阻害剤またはGSKiβを含まない完全培地;FAA = ホルマリン - 酢酸 - アルコール;EGF =上皮成長因子。この表は 38から適応されています。 この表をダウンロードするには、ここをクリックしてください。
補足表1:透水性支持系をイヌオルガノイドにメモを取るための表。 略語:TEER =経上皮電気抵抗;ROCK = rho関連キナーゼ;GSKiβ=グリコーゲン合成酵素キナーゼβ;CMGF + R/G = ROCK阻害剤およびGSKiβで強化された成長因子を含む完全培地;CMGF+ = 成長因子を含むが、ROCK阻害剤またはGSKiβを含まない完全培地。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
透過性支持装置における犬腸オルガノイド培養物は、従来の薬物透過性アッセイ40 を新規 なin vitro 犬モデル41と結びつけるユニークな概念である。さまざまな種類の犬腸オルガノイドを使用し、最小限の調整で実験の目的に基づいて評価することができます。1グループあたり3〜4ウェルで目的の薬物の複数の濃度を試験することが推奨される。濃度は、薬物の予想される腸内濃度に基づいてもよい。さらに、以前の研究を使用することは、研究デザインの適切な時点を決定するのに役立つ場合があります。再現性を高め、トラブルシューティングを支援するために、試験デザインの適切な文書化がなされるべきである。
この技術には、方法42の新規性のためにいくつかの制限があり、主に実験計画の標準化の欠如と実験室間でのプロトコルの実行によるものです。この標準化の欠如は他のグループ43によって認められており、犬の3Dオルガノイド単層プロトコルは実験室間の再現性につながり、このシステムに標準化を導入するでしょう。データ分析への標準化されたアプローチは、再現性を向上させ、異なる実験室にわたる透過性サポートシステムの犬オルガノイドを使用した予備薬物検査の結果を強化することができます。犬の3Dオルガノイドモデルには、Caco-2細胞44,45,46と同様に、モデル薬物のin vitro Pアプリ値を既知のヒトまたは犬のインビボ腸内吸収と比較するデータセットも欠けている。このようなデータが生成されると、この犬オルガノイドモデルは、医薬品開発中の腸透過性を評価するために利用され得る。
オルガノイドを透過性支持系に播種する際には、適切に解離した細胞の十分に高い密度を播種するように注意が払われることが重要です。システムのTEER値は、厳密な単層で成長させると、より信頼性が高く、再現性があります。単層の長期培養は、腸の生理学的値からさらに到達するTEER値の指数関数的な増加をもたらし得る。このような3D構造のH&Eセクションは、膜に近い腸細胞の構造が変化した状態で、細胞のいくつかの層が互いに重なっていることを示しています。
犬腸オルガノイド単層の拡張に成功した後、薬物の見かけの透過係数(Papp)式44を計算することによって、従来の2D細胞アッセイと同じ方法で結果を分析することができます。Pアプリ 値(Eq(2)参照)は、セルラー単分子膜47を横切る輸送速度を記述する。
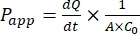 (2)
(2)
は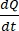 、濃度と時間曲線の初期傾き(例:nmol/s)です。Aはインサートの面積(cm2)であり、C0はドナーチャンバ37内の薬物または化合物の初期濃度である。単層の完全性の信頼性の高い認識は、標準化を必要とする透過性アッセイの重要な部分です。透過性サポートシステム内のイヌオルガノイドを評価し、実験の正しいタイミングを決定するのに役立つように、光学顕微鏡およびTEER測定が推奨されます。さらに、ゼロ分子透過性マーカー(例えば、FITC−デキストラン、ルシファーイエロー、PEG−400)を使用して、オルガノイド単分子膜完全性を機能的に評価することができる。試験した化合物がトランスポーターの影響を受けている場合は注意が必要です。P-糖タンパク質(P-gp)は、一般的な排出ポンプ例として用いられる。周知のP-gpプローブ基板と比較して、流出比(Pアプリ、BL-AP/Pアプリ、AP-BL)を生成する必要があります。
、濃度と時間曲線の初期傾き(例:nmol/s)です。Aはインサートの面積(cm2)であり、C0はドナーチャンバ37内の薬物または化合物の初期濃度である。単層の完全性の信頼性の高い認識は、標準化を必要とする透過性アッセイの重要な部分です。透過性サポートシステム内のイヌオルガノイドを評価し、実験の正しいタイミングを決定するのに役立つように、光学顕微鏡およびTEER測定が推奨されます。さらに、ゼロ分子透過性マーカー(例えば、FITC−デキストラン、ルシファーイエロー、PEG−400)を使用して、オルガノイド単分子膜完全性を機能的に評価することができる。試験した化合物がトランスポーターの影響を受けている場合は注意が必要です。P-糖タンパク質(P-gp)は、一般的な排出ポンプ例として用いられる。周知のP-gpプローブ基板と比較して、流出比(Pアプリ、BL-AP/Pアプリ、AP-BL)を生成する必要があります。
光学顕微鏡(プレーンまたは位相コントラストで強化)は、細胞の過増殖の可能性を評価しながら、2Dまたは3D単分子膜とフィルターインサートの完全性をチェックするための非常に貴重な方法です。 図7は 、健康なイヌ腸管オルガノイド細胞培養物を認識するためのガイドとして役立つことができる。TEER値は、細胞間接合部の形成およびオルガノイド培養物の無傷の腸上皮への分化の重要な尺度である。犬の腸オルガノイドは腸細胞と杯細胞に分化する(図6)。これらの粘液産生細胞は、従来の2D細胞培養物を用いて達成することが困難であった薬物-粘液相互作用の研究を可能にする48。腸内分泌細胞の存在は、Chandraらによって犬腸オルガノイドにおいて以前に確認されている33。
TEMを用いた空腸、回腸、および結腸オルガノイドに由来する犬オルガノイド単層のさらなる特徴付けが提供される。TEM画像は、タイトジャンクションおよび微小絨毛形成を含む細胞マイクロアーキテクチャを示し、翻訳医療におけるこれらのオルガノイドモデルの複雑さおよび有用性をさらに示す。実験結果に基づいて、透過性支持体上のオルガノイド培養物は、播種後11日目から13日目の間に実験の準備が整った(図9)。この時点でのTEER値は1,500〜2,500Ω.cm2の範囲であった。TEER値のプラトー段階は、TEER値がゆっくりと低下し始める前に実験を開始する必要がある非常に限られた時間枠の間持続します。TEER値は、一部の薬物または医薬品賦形剤が単分子層(タイトジャンクションなど)と相互作用する可能性があるため、TEER値の読み出しに大きな影響を与える可能性があるため、重要な実験結果を表示する上で重要な部分でもあります。これだけでも、実験のデータとして使用できます。
デュアルチャンバー細胞培養装置における犬腸オルガノイドは、得られる細胞単層のユニークなアーキテクチャのために経口薬物透過性以外の分野に適用することができる。例えば、それらは、微生物学研究(例えば、GI微生物叢の変化の影響)、ウイルス取り込み研究、薬物−薬物相互作用、および薬物輸送機構において使用され得る49。ドナーチャンバは、典型的には、選択された試験薬物または化合物で満たされ、そして、レシーバチャンバからのアリコートは、様々な時点で採取される。これらのアリコートは、高速液体クロマトグラフィー、質量分析、酵素結合免疫吸着アッセイ、またはその他の技術を使用して分析し、溶質が単分子膜を透過する量および速度を決定することができる。
これらの研究は、薬物透過性を正確に評価するために無傷の単分子膜を必要とする。これは通常、使用できない井戸を説明するために必要なものを超えて単層を成長させる必要があります。オルガノイド細胞単層はまた、ウイルスの細胞取り込みを検出するための抗体を利用する免疫蛍光アッセイを含む読み出しを用いて、単層の頂端側または基底側のいずれかからウイルスの取り込みを測定するために使用され得る。最後に、複数の薬物(すなわち、基質および阻害剤)をドナーチャンバーに適用して、トランスポーターベースの薬物−薬物相互作用を同定することができる。
現在の観察に基づいて、これらの方法は、培養インサート中のイヌオルガノイドに適用できるだけでなく、他の獣医種および器官系にも適しており、選択した種または器官モデルに最も適したわずかな修正が必要である。犬腸オルガノイド増殖のためのプロトコルは、培養物のユニークな特性に基づいて調整されなければならなかった。したがって、プロトコルは別の種に調整することができますが、プロトコルに微妙な変更が必要になります。改変は、細胞播種密度の変化から始まり、目的のオルガノイドを適切に分化するための培地組成物の変化に拡大し得る。
標準化、実験手順の詳細な文書化、および細胞単層の一貫したモニタリングは、透過性サポートアッセイ全体で必要な重要なプラクティスであり、犬系に限定されません。これらの可能な種または器官の改変は、この分野におけるさらなる進歩のために文書化および報告するために重要である。このモデルには、いくつかの制限、例えば、そのコスト要件、実験室間の変動性、および インビボでの腸内吸収を予測する能力に関する限られたデータがある。イヌは、場合によっては、ヒト50とは異なる薬物トランスポーターおよび代謝酵素を有する。
さらに、犬オルガノイド系は、そのようなモデルの適合性を決定するために、他の製造業者からの様々な他のデュアルチャンバー装置上で試験されなければならない(例えば、異なるフィルター膜組成物の適合性を決定しなければならない)。もう1つの欠点は、原稿の薬物透過性実験の部分が前の部分よりも説明的ではないことです。これは、このフィールドの過剰な情報が原因です。原稿のこの部分の目標は、これらの実験の礎石の端を切らずに、これらの方法を修正可能な方法で記述することでした。透過性実験に関するより詳細な情報は、Hubatschらによって収集されている37。さらに、透過性インサートは、共培養、細胞遊走、および浸潤アッセイ実験4において使用することができる。
結論として、デュアルチャンバー培養装置における犬腸オルガノイドは、生物医学分野やトランスレーショナル医療など、幅広い用途に使用される可能性を秘めています。このプロトコルは、実験を計画し、生物学の分野にわたるオルガノイドモデルの実験室間データの信頼性を促進するためのいくつかの戦略を作成します。
開示事項
K. Allenspachは、LifEngine Animal Health and 3D Health Solutionsの共同設立者です。彼女はCeva Animal Health、Bioiberica、LifeDiagnostics、Antech Diagnostics、Deerland Probiotics、Marsのコンサルタントを務めています。J.P. Mochelは、LifEngine Animal Health and 3D Health Solutionsの共同設立者であり、Ceva Animal HealthおよびEthos Animal Healthのコンサルタントを務めています。この記事は著者の見解を反映しており、食品医薬品局(FDA)の支持、見解、または方針を表すものと解釈されるべきではありません。他の著者は、宣言する利益相反を持っていません。
謝辞
アイオワ州立大学の獣医診断研究所の職員、すなわちヘイリー・ランバート、エミリー・ラヘ、ロザリン・ブラナマン、ビクトリア・グリーン、ジェニファー・グロエルツ・ツグミのサンプルのタイムリーな処理に感謝の意を表したいと思います。また、透過性実験のための材料を提供してくれたJodi SmithとBethann Valentineにも感謝します。また、図 9 の協力をしてくれた David Diaz-Reganon にも感謝します。図6を除き、すべての図は BioRender.com で作成した。著者らは、Faculty Startup、ISU VPR Miller Award、ISU VPR Miller Award、NSF SBIR SubawardのISU # 1912948への支援に感謝したいと考えている。
資料
| Name | Company | Catalog Number | Comments |
| Organoid media | |||
| ROCK inhibitor (Y-27632) | EMD Millipore Corp. | SCM 075 | |
| [Leu15]-Gastrin I human | Sigma | G9145-.5MG | |
| A-83-01 | PeproTech | 9094360 | |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| B27 supplement | Gibco | 17504-044 | |
| FBS | Corning | 35-010-CV | |
| Glutamax | Gibco | 35050-061 | glutamine substitute |
| HEPES | VWR Life Science | J848-500ML | |
| Human R-Spondin-1 | PeproTech | 120-38-500UG | |
| Murine EGF | PeproTech | 315-09-1MG | |
| Murine Noggin | PeproTech | 250-38-250UG | |
| Murine Wnt-3a | PeproTech | 315-20-10UG | |
| N2 supplement | Gibco | 17502-048 | |
| N-Acetyl-L-cysteine | Sigma | A9165-25G | |
| Nicotinamide | Sigma | N0636-100G | |
| Primocin | InvivoGen | ant-pm-1 | |
| SB202190 (P38 inhibitor) | Sigma | S7067-25MG | |
| Stemolecule CHIR99021 (GSK3β) | Reprocell | 04-0004-base | |
| TMS (trimethoprim sulfate) | Sigma | T7883-5G | |
| Reagents | |||
| Acetic Acid, Glacial | Fisher Chemical | A38-500 | |
| alpha-D(+)-Glucose, 99+%, anhydrous | Acros Organics | 170080010 | |
| Cell Recovery Solution | Corning | 354253 | |
| Collagen I, Rat Tail 3 mg/mL | Gibco | A10483-01 | |
| FITC-CM-Dextran | Millipore Sigma | 68059-1G | |
| Formaldehyde (37%) | Fisher Chemical | F79P-4 | |
| Glutaraldehyde solution | Sigma | G5882 | |
| HBSS (1x) | Gibco | 14025-076 | |
| Matrigel Matrix For Organoid Culture | Corning | 356255 | Extracellular Membrane Matrix |
| Paraformaldehyde, 97% | Alfa Aesar | A11313 | |
| PBS, 1x (Phosphate-Buffered Saline) | Corning | 21-040-CM | |
| TrypLE Express | Gibco | 12604-021 | Trypsin-like Protease |
| Materials and Equipment | |||
| 15 mL Centrifuge Tube | Corning | 430766 | |
| 9" Pasteur Pipets | Fisherbrand | 13-678-6B | |
| Corning Transwell 6.5 mm Polyester Membrane Inserts Preloaded in 24-Well Culture Plates, Pore Size: 0.4 µm, Sterile | Corning | 3470 | Permeable Support |
| Millicell ERS (Probes) | Millipore Sigma | MERSSTX01 | |
| Millicell ERS-2 Voltohmmeter | Millipore Sigma | MERS00002 | |
| Panasonic incubator | Panasonic | MCO-170ML-PA | |
| Parafilm M Wrapping Film | Bemis Company Inc | PM996/EMD | Flexible Laboratory Film |
| Tissue Culture Plate 24 wells | Fisherbrand | FB012929 |
参考文献
- Ghaffarian, R., Muro, S. Models and methods to evaluate transport of drug delivery systems across cellular barriers. Journal of Visualized Experiments JoVE. (80), e50638 (2013).
- Youhanna, S., Lauschke, V. M. The Past, present and future of intestinal in vitro cell systems for drug absorption studies. Journal of Pharmaceutical Sciences. 110 (1), 50-65 (2021).
- Belic, S., et al. Comparative analysis of inflammatory cytokine release and alveolar epithelial barrier invasion in a transwell®bilayer model of mucormycosis. Frontiers in Microbiology. 3204, 3204 (2019).
- Justus, C. R., Leffler, N., Ruiz-Echevarria, M., Yang, L. V. In vitro cell migration and invasion assays. Journal of Visualized Experiments: JoVE. (88), e51046 (2014).
- Rönkkö, S., Vellonen, K. S., Järvinen, K., Toropainen, E., Urtti, A. Human corneal cell culture models for drug toxicity studies. Drug Delivery and Translational Research. 6 (6), 660-675 (2016).
- Dahlgren, D., Lennernäs, H. Intestinal permeability and drug absorption: predictive experimental, computational and in vivo approaches. Pharmaceutics. 11 (8), 411 (2019).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. V. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909 (2020).
- Hilgers, A. R., Conradi, R. A., Burton, P. S. Caco-2 cell monolayers as a model for drug transport across the intestinal mucosa. Pharmaceutical Research. 7 (9), 902-910 (1990).
- Natoli, M., Leoni, B. D., D’Agnano, I., Zucco, F., Felsani, A. Good Caco-2 cell culture practices. Toxicology in Vitro. 26 (8), 1243-1246 (2012).
- Kapałczyńska, M., et al. 2D and 3D cell cultures – a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Sun, H., Chow, E. C. Y., Liu, S., Du, Y., Pang, K. S. The Caco-2 cell monolayer: Usefulness and limitations. Expert Opinion on Drug Metabolism and Toxicology. 4 (4), 395-411 (2008).
- Chandler, M., et al. Obesity and associated comorbidities in people and companion animals: a One Health perspective. Journal of Comparative Pathology. 156 (4), 296-309 (2017).
- Coelho, L. P., et al. Similarity of the dog and human gut microbiomes in gene content and response to diet. Microbiome. 6 (1), 72 (2018).
- Galeta, P., Lázničková-Galetová, M., Sablin, M., Germonpré, M. Morphological evidence for early dog domestication in the European Pleistocene: New evidence from a randomization approach to group differences. Anatomical Record. 304 (1), 42-62 (2021).
- Kleinert, M., et al. Animal models of obesity and diabetes mellitus. Nature Reviews Endocrinology. 14 (3), 140-162 (2018).
- Allenspach, K., Wieland, B., Gröne, A., Gaschen, F. Chronic enteropathies in dogs: Evaluation of risk factors for negative outcome. Journal of Veterinary Internal Medicine. 21 (4), 700-708 (2007).
- Wang, J., et al. Proliferative and invasive colorectal tumors in pet dogs provide unique insights into human colorectal cancer. Cancers. 10 (9), 330 (2018).
- Gillespie, V., Baer, K., Farrelly, J., Craft, D., Luong, R. Canine gastrointestinal stromal tumors: Immunohistochemical expression of CD34 and examination of prognostic indicators including proliferation markers Ki67 and AgNOR. Veterinary Pathology. 48 (1), 283-291 (2011).
- Chandra, L., et al. Derivation of adult canine intestinal organoids for translational research in gastroenterology. BMC Biology. 17 (1), 33 (2019).
- Schneider, B., et al. Model-based reverse translation between veterinary and human medicine: the One Health initiative. CPT: Pharmacometrics and Systems Pharmacology. 7 (2), 65-68 (2018).
- Artursson, P., Palm, K., Luthman, K. Caco-2 monolayers in experimental and theoretical predictions of drug transport. Advanced Drug Delivery Reviews. 22 (1-2), 67-84 (1996).
- Balimane, P. V., Han, Y. H., Chong, S. Current industrial practices of assessing permeability and P-glycoprotein interaction. AAPS Journal. 8 (1), 1-13 (2006).
- Sambuy, Y., et al. The Caco-2 cell line as a model of the intestinal barrier: Influence of cell and culture-related factors on Caco-2 cell functional characteristics. Cell Biology and Toxicology. 21 (1), 1-26 (2005).
- Calcagno, A. M., Ludwig, J. A., Fostel, J. M., Gottesman, M. M., Ambudkar, S. V. Comparison of drug transporter levels in normal colon, colon cancer, and caco-2 cells: Impact on drug disposition and discovery. Molecular Pharmaceutics. 3 (1), 87-93 (2006).
- Hilgendorf, C., et al. Expression of thirty-six drug transporter genes in human intestine, liver, kidney, and organotypic cell lines. Drug Metabolism and Disposition. 35 (8), 1333 (2007).
- Seithel, A., Karlsson, J., Hilgendorf, C., Björquist, A., Ungell, A. L. Variability in mRNA expression of ABC- and SLC-transporters in human intestinal cells: Comparison between human segments and Caco-2 cells. European Journal of Pharmaceutical Sciences. 28 (4), 291-299 (2006).
- Volpe, D. A. Transporter assays as useful in vitro tools in drug discovery and development. Expert Opinion on Drug Discovery. 11 (1), 91-103 (2016).
- Hoffmann, P., et al. Caco-2/HT29-MTX co-cultured cells as a model for studying physiological properties and toxin-induced effects on intestinal cells. PLoS ONE. 16 (10), 257824 (2021).
- Sun, H., Chow, E. C. Y., Liu, S., Du, Y., Pang, K. S. The Caco-2 cell monolayer: Usefulness and limitations. Expert Opinion on Drug Metabolism and Toxicology. 4 (4), 395-411 (2008).
- Thummel, K. E., et al. Transcriptional control of intestinal cytochrome P-4503A by 1α,25-dihydroxy vitamin D3. Molecular Pharmacology. 60 (6), 1399-1406 (2001).
- Kodama, N., et al. Characteristic analysis of intestinal transport in enterocyte-like cells differentiated from human induced pluripotent stem cells. Drug Metabolism and Disposition. 44 (10), 1662-1667 (2016).
- Akazawa, T., et al. Application of intestinal epithelial cells differentiated from human induced pluripotent stem cells for studies of prodrug hydrolysis and drug absorption in the small intestine. Drug Metabolism and Disposition: The Biological Fate of Chemicals. 46 (11), 1497-1506 (2018).
- Lo, B., Parham, L. Ethical issues in stem cell research. Endocrine Reviews. 30 (3), 204-213 (2009).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), 0231423 (2020).
- Zdyrski, C., et al. Su124 homology directed repair in canine duodenal enteroids to mimic the wild-type P-glycoprotein mutation. Gastroenterology. 160 (6), 625 (2021).
- Nantasanti, S., et al. Disease modeling and gene therapy of copper storage disease in canine hepatic organoids. Stem Cell Reports. 5 (5), 895-907 (2015).
- Hubatsch, I., Ragnarsson, E. G. E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Gabriel, V., et al. Standardization and maintenance of 3D canine hepatic and intestinal organoid cultures for use in biomedical research. Journal of Visualized Experiments: JoVE. (179), e63515 (2022).
- Frost, T. S., Jiang, L., Lynch, R. M., Zohar, Y. Permeability of epithelial/endothelial barriers in transwells and microfluidic bilayer devices. Micromachines. 10 (8), 533 (2019).
- van Breemen, R. B., Li, Y. Caco-2 cell permeability assays to measure drug absorption. Expert Opinion on Drug Metabolism and Toxicology. 1 (2), 175-185 (2005).
- Huch, M., Knoblich, J. A., Lutolf, M. P., Martinez-Arias, A. The hope and the hype of organoid research. Development. 144 (6), 938-941 (2017).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Olivatti, T. O. F., Alcantara, G. P., Lemos, A. C. C. E., Silva, M. G., Miot, H. A. Standardization of organoid culture for evaluation of melanogenesis induced by UVB, UVA and visible light. Anais Brasileiros de Dermatologia. 95 (1), 46-51 (2020).
- Volpe, D. A., et al. Classification of drug permeability with a Caco-2 cell monolayer assay. Clinical Research and Regulatory Affairs. 24 (1), 39-47 (2007).
- Chen, C., Ma, M. G., Fullenwider, C. L., Chen, W. G., Sadeque, A. J. M. Biopharmaceutics permeability classification of lorcaserin, a selective 5-hydroxytryptamine 2C agonist: Method suitability and permeability class membership. Molecular Pharmaceutics. 10 (12), 4739-4745 (2013).
- Jarc, T., et al. Demonstrating suitability of the Caco-2 cell model for BCS-based biowaiver according to the recent FDA and ICH harmonised guidelines. Journal of Pharmacy and Pharmacology. 71 (8), 1231-1242 (2019).
- Newby, D., Freitas, A. A., Ghafourian, T. Decision trees to characterise the roles of permeability and solubility on the prediction of oral absorption. European Journal of Medicinal Chemistry. 90, 751-765 (2015).
- Navabi, N., McGuckin, M. A., Lindén, S. K. Gastrointestinal cell lines form polarized epithelia with an adherent mucus layer when cultured in semi-wet interfaces with mechanical stimulation. PLoS ONE. 8 (7), 68761 (2013).
- Puschhof, J., et al. Intestinal organoid cocultures with microbes. Nature Protocols. 16 (10), 4633-4649 (2021).
- Martinez, M. N., Mochel, J. P., Neuhoff, S., Pade, D. Comparison of canine and human physiological factors: understanding interspecies differences that impact drug pharmacokinetics. The AAPS Journal. 23 (3), 59 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved