Method Article
Organoidi intestinali canini in un sistema di supporto permeabile a doppia camera
In questo articolo
Riepilogo
Qui, presentiamo un protocollo che descrive la coltura di organoidi intestinali canini in un sistema di supporto permeabile a doppia camera. Vengono descritti la semina organoide nei supporti permeabili, il mantenimento del monostrato e i successivi esperimenti di permeabilità ai farmaci.
Abstract
Il sistema di supporto permeabile viene tipicamente utilizzato in combinazione con le tradizionali linee cellulari bidimensionali (2D) come strumento in vitro per valutare la permeabilità orale di nuovi farmaci terapeutici candidati. Tuttavia, l'uso di queste linee cellulari convenzionali ha limitazioni, come l'espressione alterata di giunzioni strette, la differenziazione parziale delle cellule e l'assenza di recettori nucleari chiave. Nonostante queste carenze, i modelli Caco-2 e MDCK sono ampiamente accettati e convalidati per la previsione della permeabilità orale umana in vivo .
I cani sono un modello traslazionale rilevante per la ricerca biomedica a causa delle loro somiglianze nell'anatomia gastrointestinale e nella microflora intestinale con gli esseri umani. Di conseguenza, e a sostegno dello sviluppo parallelo di farmaci, è altamente auspicabile l'elaborazione di uno strumento in vitro efficiente e accurato per prevedere le caratteristiche di permeabilità dei farmaci in vivo sia nei cani che nell'uomo. Tale strumento potrebbe essere il sistema organoide intestinale canino, caratterizzato da strutture epiteliali tridimensionali (3D), autoassemblate derivate da cellule staminali adulte.
Il (1) Permeable Support Seeding Protocol descrive i metodi sperimentali per la dissociazione e la semina di organoidi canini negli inserti. L'isolamento, la coltura e la raccolta degli organoidi canini sono stati precedentemente descritti in una serie separata di protocolli in questo numero speciale. I metodi per il mantenimento generale del monostrato organoide intestinale canino sono discussi a fondo nel (2) Protocollo di mantenimento del monostrato. Inoltre, questo protocollo descrive i metodi per valutare l'integrità strutturale del monostrato tramite misurazioni della resistenza elettrica transepiteliale (TEER) e microscopia ottica. Infine, il (3) Protocollo sperimentale di permeabilità descrive i compiti che precedono direttamente un esperimento, compresa la convalida in vitro dei risultati sperimentali.
Nel complesso, il modello organoide canino, combinato con una tecnologia di coltura cellulare a doppia camera, supera i limiti associati ai modelli sperimentali 2D, migliorando così l'affidabilità delle previsioni dell'apparente permeabilità orale dei farmaci candidati terapeutici sia nel paziente canino che in quello umano.
Introduzione
I sistemi di supporto permeabili sono tipicamente utilizzati per determinare l'apparente permeabilità dei farmaci terapeutici candidati attraverso la barriera epiteliale intestinale 1,2. Possono anche essere impiegati per valutare la secrezione cellulare3, la migrazione cellulare4 e la tossicità del farmaco5. I saggi di permeabilità orale in vitro dei farmaci sono un passo chiave nel processo di scoperta e sviluppo dei farmaci2, con singoli farmaci candidati testati nella fase iniziale del ciclo di vita di ricerca e sviluppo dei farmaci6. Il sistema di supporto permeabile è un apparato di coltura cellulare a doppia camera costituito da un inserto con una membrana semiporosa posta in una piastra multiwell. Questo sistema consente l'accesso diretto ai lati apicale e basolaterale di una cellula-monostrato cresciuta nell'inserto7. Il monostrato utilizzato in questi sistemi è tipicamente derivato da cellule epiteliali gastrointestinali (ad esempio, linea cellulare Caco-2 dell'adenocarcinoma del colon-retto umano)8. Le colture cellulari crescono in uno stato polarizzato imitando la microarchitettura naturale delle cellule epiteliali intestinali, consentendo un'ulteriore differenziazione cellulare, microanatomia simile e funzione7. I dettagli dell'inserto di supporto permeabile sono disponibili nella Figura 1. La semina degli inserti con colture cellulari 2D, tradizionalmente utilizzata per valutare la permeabilità intestinale ai farmaci, è relativamente conveniente e facile dacoltivare 9. Questi sistemi presentano diverse limitazioni importanti, tra cui la loro limitata capacità di prevedere il metabolismo intestinale dei farmaci terapeutici candidati10,11. Questo è vero per tutti i meccanismi di assorbimento dei farmaci, sia che si tratti di assorbimento passivo attraverso le giunzioni strette tra le cellule epiteliali, assorbimento transepiteliale attivo attraverso l'efflusso o trasportatori di assorbimento (ad esempio, P-glicoproteina, trasportatore monocarbossilato 1) e farmaci che vengono metabolizzati dagli enterociti.
I cani condividono un ambiente e una dieta comuni con gli esseri umani12. L'anatomia intestinale canina e la composizione del microbioma assomigliano molto a quella degli esseri umani13, che è stata attribuita all'addomesticamento e alle diete condivise negli ultimi 36.000 anni14. Sfortunatamente, queste somiglianze possono anche essere cause / fattori scatenanti comuni per lo sviluppo della malattia. I cani sviluppano morbilità croniche simili all'uomo, come l'obesità15, la malattia infiammatoria intestinale16, l'adenocarcinomacolorettale 17, il tumore stromale gastrointestinale (GIST)18 e varie altre patologie associate alla loro relativa longevità19. Di conseguenza, gli organoidi canini possono essere utilizzati con successo per la ricerca traslazionale inversa di queste malattie croniche multifattoriali nello spirito della One Health Initiative20.
Le cellule Caco-2 sono le linee cellulari più utilizzate per i saggi di assorbimento orale dei farmaci21. Queste cellule sono attualmente considerate il modello "gold standard" per i saggi di permeabilità intestinale in vitro 2,22,23. La linea cellulare Caco-2 esprime trasportatori di efflusso e assorbimento presenti nel tratto intestinale umano, sebbene a diversi livelli di espressione 24,25,26. Le cellule caco-2 sono anche ampiamente utilizzate come modelli per determinare se un farmaco è un substrato o un inibitore dei trasportatori di efflusso intestinale22,27. Sebbene le cellule Caco-2 siano di origine colonica, imitano una cellula enterocitaria. Sfortunatamente, le cellule Caco-2 rappresentano solo un tipo di cellula dallo strato epiteliale dell'intestino tenue9, che non riesce a ricapitolare accuratamente la complessa composizione del tipo di cellula epiteliale intestinale. Ad esempio, le cellule calici dedicate alla produzione di muco sono assenti dalle colture Caco-2 in modo tale che le interazioni muco-farmaco non possono essere valutate senza cocoltura con altre linee cellulari28. Inoltre, le colture di Caco-2 non esprimono molti degli importanti recettori nucleari tipicamente presenti nell'intestino, come il recettore X della gravidanza (PXR), il recettore X steroideo (SXR) e il recettore costitutivo dell'androstano (CAR)29. Di conseguenza, le colture di Caco-2 non riescono a modellare l'induzione di trasportatori di farmaci ed enzimi da parte di alcuni farmaci che sono induttori di questi recettori (ad esempio, rifampicina)30.
La tecnologia organoide intestinale 3D affronta alcune di queste limitazioni19. Gli organoidi sono costrutti autoassemblati derivati da cellule staminali adulte che possono essere stabiliti da campioni di tessuto raccolti utilizzando tecniche microinvasive20. Le cellule staminali pluripotenti indotte dall'uomo vengono impiegate per i modelli di permeabilità intestinale31,32. Gli organoidi canini forniscono un'alternativa rilevante agli organoidi umani perché la ricerca sulle cellule staminali umane è limitata da questioni etiche33. Inoltre, gli organoidi canini forniscono un sistema in vitro per esplorare la permeabilità dei farmaci canini, il metabolismo, il trasporto attivo e le interazioni farmaco-farmaco. Per colmare questa lacuna tecnologica, è stata descritta la crescita costante e affidabile di organoidi intestinali canini in un sistema di supporto permeabile34. Un test di permeabilità con organoidi intestinali canini può potenzialmente predire la permeabilità intestinale canina e il metabolismo di piccole molecole di farmaci rispetto ai saggi attualmente utilizzati (Caco-2). La conferma di queste caratteristiche cardine presta questo nuovo sistema in vitro al lavoro futuro che esplora il potenziale impatto degli induttori sul metabolismo intracellulare e sul trasporto attivo.
Gli organoidi canini sono composti da tutti i tipi di cellule tipicamente presenti nello strato epiteliale dell'intestino. Da un punto di vista funzionale e microanatomico, replicano in modo affidabile l'ambiente dello strato epiteliale dell'intestino canino19,35. Inoltre, la presenza di muco, trasportatori di farmaci ed enzimi specifici per cani e la differenziazione cellulare complessiva negli organoidi intestinali canini è paragonabile a quanto osservato in vivo nei cani34. Pertanto, gli organoidi possono essere isolati da pazienti veterinari malati e utilizzati per modellare l'effetto di vari processi patologici (ad esempio, infiammazione intestinale cronica) sulla permeabilità ai farmaci orali canini19,36. Il sistema organoide intestinale canino può essere utilizzato anche in contesti diversi dagli esperimenti di permeabilità ai farmaci. Queste strutture 3D possono anche essere isolate da pazienti malati come precedentemente descritto da Chandra et al. per la malattia infiammatoria intestinale, l'adenocarcinoma del colon-retto e il tumore stromale gastrointestinale19.
Il Permeable Support Seeding Protocol descrive i metodi per stabilire colture organoidi intestinali canine negli inserti. Questo primo protocollo delinea i metodi per dissociare le colture organoidi canine stabilite placcate nella matrice della membrana extracellulare. Inoltre, la precoating degli inserti con collagene I e la matrice di membrana extracellulare è discussa in questo protocollo. Anche l'incorporamento di organoidi canini negli inserti di supporto permeabili è descritto in dettaglio.
Il secondo protocollo è il Monolayer Maintenance Protocol, che include la manutenzione generale degli organoidi 3D canini placcati in un inserto. La frequenza e i volumi dei mezzi organoidi utilizzati per rinfrescare la coltura e i modi per prevenire il danno da coltura cellulare sono presentati in questo secondo protocollo, insieme a metodi sperimentali per valutare la confluenza del monostrato epiteliale.
Infine, il protocollo sperimentale di permeabilità si concentra sui modi per determinare se gli organoidi 3D intestinali canini in un test di permeabilità sono pronti per l'uso sperimentale e le fasi di verifica necessarie prima di condurre qualsiasi esperimento. Questa sezione descrive anche l'impostazione e l'esecuzione di successo di un esperimento di permeabilità, insieme all'incubazione e al campionamento di farmaci candidati terapeutici nelle camere della coltura monostrato. Viene anche discusso l'uso dell'isotiocianato di fluoresceina a bassa permeabilità (FITC-destrano) per monitorare l'integrità del monostrato. Infine, viene descritto un metodo di valutazione in vitro per convalidare i risultati dopo la conclusione di un esperimento. Gli esperimenti di permeabilità sono un argomento estremamente vasto e sono molto ben riassunti da Hubatsch et al.37. Il flusso di lavoro dei protocolli è riepilogato nella Figura 2.
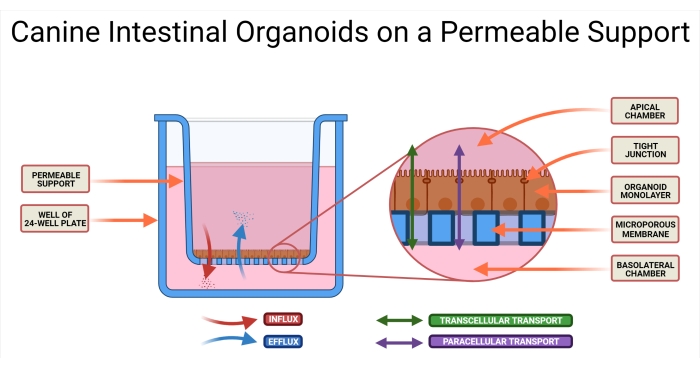
Figura 1: Organoidi intestinali canini su un sistema di supporto permeabile. L'inserto di supporto permeabile è posizionato in un pozzetto di una piastra a 24 pozzetti. La membrana microporosa consente la semina di organoidi intestinali canini dissociati e queste cellule alla fine formeranno un monostrato organoide 2D. Questa tecnologia consente l'accesso a entrambi i lati AP e BL del monostrato. Il mezzo organoide viene introdotto in entrambe le camere AP e BL del supporto permeabile. Vengono illustrati l'assorbimento (AP→BL) e la secrezione (BL→AP) del farmaco candidato, nonché due possibili modalità di trasporto del farmaco. Abbreviazioni: AP = apicale; BL = basolaterale. Fare clic qui per visualizzare una versione più grande di questa figura.
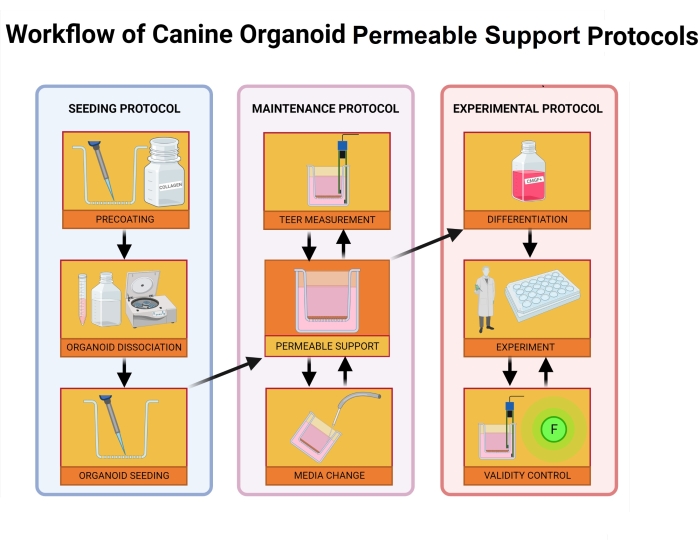
Figura 2: Flusso di lavoro dei protocolli di supporto permeabili agli organoidi canini. L'inserto di supporto permeabile viene precoato con una miscela della matrice di membrana extracellulare e collagene I e incubato per 1 ora. Durante il processo di incubazione, la coltura organoide viene dissociata. Le singole cellule organoidi vengono seminate nell'inserto, il mezzo nella camera basolaterale viene aggiunto immediatamente dopo la semina, mentre il mezzo alla camera apicale viene aggiunto 24 ore dopo la conclusione del processo di semina. La manutenzione e il monitoraggio degli organoidi includono cambi regolari del mezzo, misurazioni del valore TEER e microscopia ottica per valutare l'integrità del monostrato. Prima dell'esperimento, gli organoidi devono essere differenziati rimuovendo l'inibitore ROCK e GSKiβ dal mezzo. I valori TEER vengono misurati il giorno dell'esperimento e il monostrato organoide viene ispezionato tramite microscopia ottica per danni alle cellule. Il mezzo viene quindi scambiato con un buffer appropriato e incubato prima dell'esperimento. Il test FITC-destrano viene utilizzato durante gli esperimenti di permeabilità intestinale39 come marcatore di integrità monostrato. Le misurazioni TEER vengono effettuate dopo l'esperimento e la microscopia ottica convaliderà i risultati dopo 24 ore. Abbreviazioni: TEER = resistenza elettrica transepiteliale; ROCK = chinasi rho-associata; GSKiβ = glicogeno sintasi chinasi beta; F = fluorescenza. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocollo
La ricerca è stata approvata ed eseguita in conformità con l'Institutional Animal Care and Use Committee della Iowa State University (IACUC-19-337; IACUC-18-065; IACUC-19-017). Nella sezione seguente (passaggi 1.1-1.3) viene descritto il protocollo di seeding del supporto permeabile e le procedure sono riepilogate nella Figura 3.
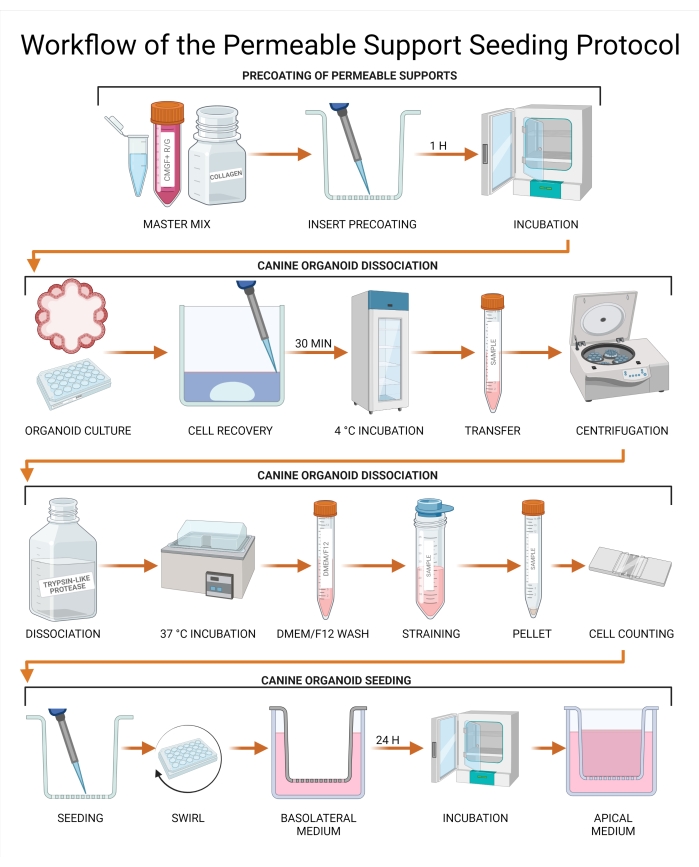
Figura 3: Flusso di lavoro del protocollo di seeding del supporto permeabile. Gli inserti di supporto permeabili vengono precoati con una combinazione di CMGF+ R/G, collagene I e matrice di membrana extracellulare e successivamente incubati. I mezzi della coltura organoide canina vengono aspirati e sostituiti con una soluzione di recupero cellulare, seguita da un'incubazione di 30 minuti a 4 °C. La coltura viene successivamente trasferita in un tubo e la dissociazione organoide viene eseguita utilizzando proteasi simile alla tripsina. Gli organoidi non distribuiti vengono rimossi mediante passaggio attraverso un colino per ottenere una sospensione unicellulare e la concentrazione cellulare viene determinata utilizzando un emocitometro o un contatore cellulare automatizzato. Le cellule vengono seminate su un inserto di supporto permeabile e CMGF+ R/G viene aggiunto alla camera basolaterale. La coltura viene quindi incubata per 24 ore e il liquido rimanente viene rimosso dalla camera apicale e sostituito con CMGF+ R/G. Abbreviazioni: ROCK = chinasi rho-associata; GSKiβ = glicogeno sintasi chinasi beta; CMGF + R/G = Mezzo completo con fattori di crescita potenziati con inibitore ROCK e GSKiβ. Fare clic qui per visualizzare una versione più grande di questa figura.
1. Protocollo di semina del supporto permeabile
- Precoating degli inserti di supporto permeabili
- Preparare un mezzo completo con fattori di crescita potenziati con inibitore della proteina chinasi associata a Rho (ROCK) e inibitore della glicogeno sintasi chinasi-beta (GSKiβ) (CMGF + R / G) secondo le informazioni nella Tabella 1.
- Preparare un secchiello per il ghiaccio e iniziare a scongelare la matrice della membrana extracellulare sul ghiaccio. Posizionare una piastra a 24 pozzetti contenente il numero necessario di inserti nell'incubatrice per prebellire. Raccogliere il collagene della coda di ratto I (3 mg/ml) e metterlo sul ghiaccio proteggendolo dalla luce. Raccogliere CMGF + R / G e metterlo sul ghiaccio.
- Calcola il numero totale di inserti e spazi vuoti necessari per l'esperimento, tenendo da parte 100 μL della soluzione di rivestimento per ciascun inserto.
NOTA: preparare più soluzione di rivestimento del necessario; si consiglia di preparare almeno il 15% in più del necessario. - In un tubo da 15 ml, mescolare CMGF+ R/G con la matrice di membrana extracellulare (1%) e collagene I (1%) e mescolare delicatamente il pipetto.
- Rivestire ogni inserto in poliestere con 100 μL della soluzione di rivestimento e posizionare gli inserti nell'incubatore (37 °C; 5% CO2 atmosfera) per 1 ora.
- Dopo l'incubazione, aspirare accuratamente la soluzione di rivestimento da ciascun inserto utilizzando un aspiratore sottovuoto o una pipetta P1000, facendo attenzione a non disturbare il filtro dell'inserto. Posizionare una piastra precoata nell'incubatrice per tenerla al caldo.
- Dissociazione organoide canina
NOTA: Utilizzare organoidi canini che sono stati coltivati per almeno quattro giorni. Prima di iniziare la dissociazione, fare riferimento a Gabriel et al.38 per determinare quando un campione è sano, denso e sufficiente per la sperimentazione. Si raccomanda di dissociare un pozzetto extra di organoidi per ogni procedura di placcatura del pozzo. Inoltre, si consiglia di aumentare il numero desiderato di inserti di ~ 20% per tenere conto della crescita disomogenea degli organoidi o dei danni causati da manipolazioni improprie. Se si prevede di utilizzare FITC-destrano, preparare pozzetti extra.- Preparare un secchiello per il ghiaccio e una fiala di stock freddo 1x Advanced DMEM/F12 nell'armadio di biosicurezza.
- Posizionare la matrice di membrana extracellulare sul ghiaccio per iniziare lo scongelamento, immergendola nel ghiaccio per proteggerla dal rapido scongelamento ed evitare la solidificazione. Posizionare una scatola di punte di pipetta (P200) nel congelatore per la placcatura della matrice di membrana extracellulare.
- Prechill una centrifuga refrigerata a 4 °C.
- Spostare CMGF+ R/G dal congelatore/frigorifero a un bagno d'acqua a 37 °C. Evitare l'esposizione diretta alla luce quando possibile.
- Rimuovere tutto il mezzo dalla piastra a 24 pozzetti con coltura organoide per un numero appropriato di pozzetti (1 pozzetto di una piastra a 24 pozzetti per 2-4 inserti) avendo cura di non disturbare la matrice di membrana extracellulare.
NOTA: il volume può variare a seconda del sistema di conteggio delle celle utilizzato. - Aggiungere 0,5 mL di soluzione di recupero cellulare prechilled per pozzetto per sciogliere le cupole della matrice di membrana extracellulare.
- Incubare la piastra in frigorifero (4 °C) per 30 min.
- Pipettare la sospensione, raccogliere tutti gli organoidi e la matrice di membrana extracellulare disciolta e trasferirli in un tubo da 15 ml.
- Centrifugare (700 × g per 5 min a 4 °C) e rimuovere il surnatante fino a quando il livello raggiunge il segno di 0,5 ml, assicurandosi di non disturbare il pellet.
- Aggiungere 1 mL di proteasi simile alla tripsina e incubare a bagnomaria a 37 °C per 8 minuti. Scorrere il tubo più volte durante il periodo di incubazione per mescolare le cellule.
- Trasferire la provetta con il campione in un armadio di biosicurezza e aggiungere lentamente 7 ml di DMEM / F12 avanzato prechilled per inattivare la proteasi simile alla tripsina e fermare la dissociazione cellulare.
- Prewet un filtro cellulare da 40 μm con 1 mL di Advanced DMEM/F12. Pipettare delicatamente la miscela e filtrare la sospensione; pipettare ulteriormente Advanced DMEM/F12 per risciacquare il filtro.
- Centrifugare il tubo (700 × g per 5 min a 4 °C) e rimuovere il surnatante. Non disturbare il pellet.
- Sospendere il pellet cellulare in ~ 50-100 μL di terreno di coltura (CMGF + R / G) per ogni pozzo di organoidi che è stato dissociato.
- Contare un sottocampione della sospensione (~10 μL) utilizzando un emocitometro o una macchina appropriata e determinare il numero totale di celle nella sospensione.
- Semina organoide canina
- Diluire o concentrare la sospensione cellulare per ottenere una concentrazione cellulare di ~ 75.000 cellule per ml.
- Seminare 100 μL della sospensione in ciascun inserto utilizzando punte precodate BSA (1%) per evitare l'adesione cellulare durante il trasferimento. Aggiungere un inserto rivestito come un bianco privo di cellule senza che gli organoidi crescano pur continuando a ricevere modifiche regolari dei supporti.
- Ruotare delicatamente la piastra con un movimento circolare per ~ 30 s per disperdere le cellule seminate attraverso l'inserto. Confermare tramite microscopia ottica la distribuzione uniforme delle cellule.
- Aggiungere 700 μL di CMGF + R/G alla camera basolaterale e posizionare la piastra nell'incubatore (37 °C; 5% CO2 atmosfera) per 24 ore.
- Dopo 24 ore, rimuovere delicatamente la sospensione cellulare dalla camera apicale e sostituirla con 200 μL di CMGF + R/G. Riportare la piastra all'incubatore.
2. Protocollo di manutenzione monostrato delle cellule organoidi
NOTA: la sezione seguente (passaggi 2.1-2.2) descrive il protocollo di manutenzione monostrato delle cellule organoidi. Il flusso di lavoro delle procedure presentate in questo protocollo è riepilogato nella Figura 4. Una tabella per prendere appunti che può aiutare con la standardizzazione delle misurazioni del valore TEER è presentata nella Tabella supplementare 1.

Figura 4: Flusso di lavoro della manutenzione della lingua di supporto permeabile. I valori TEER vengono misurati utilizzando elettrodi (sonde) e un misuratore volt/ohm. Le sonde devono essere sterilizzate chimicamente con alcool al 70% prima di essere inserite nei pozzetti. Vengono misurati gli inserti delle celle vuote e organoidi e vengono calcolati i valori TEER. Il mezzo viene successivamente rinfrescato in entrambe le camere apicali e basolaterali e la coltura organoide canina sull'inserto viene visualizzata utilizzando la microscopia ottica. Le lacrime nella coltura organoide o nella membrana microporosa vengono notate e gestite secondo il protocollo. Abbreviazione: TEER = resistenza elettrica transepiteliale. Fare clic qui per visualizzare una versione più grande di questa figura.
- Misurazione del valore TEER
NOTA: le misurazioni del valore TEER vengono eseguite utilizzando un misuratore epiteliale Volt/Ohm con attacco a bacchetta. Consultare le istruzioni per l'uso del produttore. I valori TEER forniscono informazioni sull'integrità del monostrato organoide canino.- Effettuare misurazioni del valore TEER ogni giorno alternativo durante la crescita della coltura cellulare.
- Spostare il misuratore epiteliale Volt/Ohm e i relativi elettrodi nell'armadio di biosicurezza. Sterilizzare chimicamente gli elettrodi in alcool al 70% prima dell'uso. Impostare la funzione su Ohm. Attendere almeno un minuto fino a quando gli elettrodi si asciugano.
- Prima di effettuare la prima misurazione, inserire l'elettrodo a filo nella porta e accendere l'alimentazione. Assicurarsi che il misuratore visualizzi 1.000 Ω con l'inserto dell'elettrodo a filo invece di misurare le bacchette. In caso contrario, regolare il dispositivo.
- Inserire gli elettrodi nella camera apicale e basolaterale dell'inserto privo di cellule (vuoto), in modo che la camera apicale contenga l'elettrodo più corto e la camera basolaterale contenga l'elettrodo più lungo (come si vede nella Figura 4). Non toccare la membrana, ma allo stesso tempo, assicurarsi che gli elettrodi siano immersi nel mezzo.
- Attendere alcuni secondi fino a quando il valore non si stabilizza e annotare il valore in un libro di laboratorio. Misurare i restanti monostrati organoidi canini, assicurandosi di sterilizzare gli elettrodi con alcool al 70% quando si misurano campioni diversi. Fare attenzione a non toccare il monostrato organoide con l'elettrodo.
- Dopo aver effettuato le misurazioni, sterilizzare gli elettrodi con alcol al 70% per l'ultima volta. Assicurati di proteggerli dai danni causati da manipolazioni inappropriate e conservali secondo le istruzioni del produttore.
- Calcola i valori TEER per ogni pozzo utilizzando Eq (1), dove ilcampione R e Rblank sono i valori di ohm (Ω) rispettivamente dal monostrato e dai pozzetti vuoti e l'area (cm²) è quella dell'inserto.
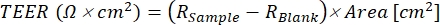 (1)
(1)
- Manutenzione monostrato
NOTA: esaminare il piano di modifica medio consigliato nella Tabella 2.- Utilizzando pipette Pasteur sterili monouso da 9" e un aspiratore sottovuoto, aspirare delicatamente il mezzo dalle camere apicali e poi basolaterali. Inclinare la piastra per vedere chiaramente la superficie media. Evitare di aspirare troppo vicino alla membrana microporosa nella camera apicale per evitare danni al monostrato cellulare.
NOTA: utilizzare una nuova pipetta Pasteur quando ci si sposta tra i campioni. Le pipette sono anche un possibile sostituto di questa procedura. - Aggiungere lentamente CMGF+ R/G utilizzando pipette P1000 puntando su una parete della camera apicale o basolaterale. Eseguire il cambio del mezzo nella camera apicale con molta attenzione per evitare di danneggiare il monostrato.
- Controllare i pozzetti a giorni alterni al microscopio ottico, valutando lo stato di salute della coltura e monitorando le lacerazioni nel monostrato organoide o nella membrana microporosa. Utilizzare la microscopia a contrasto di fase per evidenziare i dettagli della coltura.
NOTA: Nel caso di lacrime monostrato organoidi canine, al monostrato viene dato il tempo di recuperare e ricrescere. Nel caso di strappi di membrana microporosa, il pozzo deve essere escluso dall'esperimento.
- Utilizzando pipette Pasteur sterili monouso da 9" e un aspiratore sottovuoto, aspirare delicatamente il mezzo dalle camere apicali e poi basolaterali. Inclinare la piastra per vedere chiaramente la superficie media. Evitare di aspirare troppo vicino alla membrana microporosa nella camera apicale per evitare danni al monostrato cellulare.
Tabella 2: Raccomandazione per la modifica dei media per le colture organoidiche. CMGF+ R/G viene modificato nella camera apicale e basolaterale dei pozzi a giorni alterni in ogni giorno alternativo. Il periodo di coltura più lungo durante il fine settimana richiede un aumento del volume di mezzo sia nelle camere basolaterali che apicali, che viene applicato il venerdì pomeriggio e cambiato il lunedì. Abbreviazioni: ROCK = rho-associated kinase; GSKiβ = glicogeno sintasi chinasi beta; CMGF + R/G = Mezzo completo con fattori di crescita potenziati con inibitore ROCK e GSKiβ. Fare clic qui per scaricare questa tabella.
3. Protocollo sperimentale di permeabilità
NOTA: la sezione seguente (passaggi 3.1-3.5) descrive il protocollo sperimentale di permeabilità. Il flusso di lavoro del protocollo sperimentale per misurare la permeabilità in vitro di un farmaco è riassunto nella Figura 5.
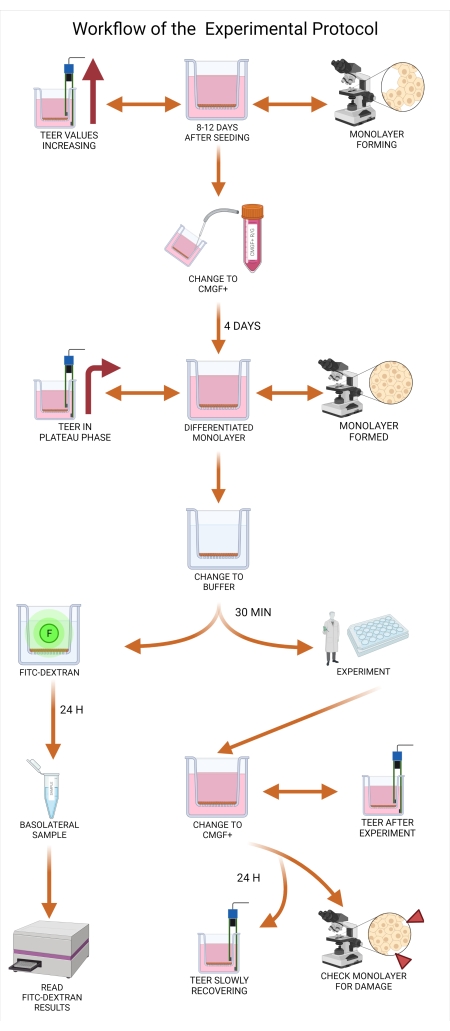
Figura 5: Flusso di lavoro del protocollo sperimentale. Il mezzo organoide deve essere cambiato da CMGF+ R/G a CMGF+ tra otto e dodici giorni dopo la semina degli inserti, consentendo la differenziazione cellulare. Dopo aver cambiato il mezzo (sia apicale che basolaterale) in CMGF+, i valori di TEER dovrebbero essere ancora in aumento, con il monostrato organoide canino che raggiunge quasi la confluenza. Almeno quattro giorni dopo che il mezzo è stato cambiato in CMGF +, viene valutata la prontezza dei monostrati. Quando il monostrato è completamente formato e i valori TEER raggiungono una fase di plateau (in genere tra 1.500 e 2.500 Ω,cm2), il mezzo viene scambiato per il buffer di trasporto per 30 minuti per consentire al monostrato di adattarsi al nuovo ambiente. Al tempo 0 min dell'esperimento, viene eseguito il test FITC-destrano e viene raccolto il campione basolaterale di 20 minuti. I risultati vengono successivamente analizzati su un lettore di lastre. Dopo l'esperimento, il contenuto della camera apicale e basolaterale viene nuovamente modificato in CMGF+ e vengono prese le letture dei valori TEER. I monostrati vengono incubati per 24 ore e l'integrità del monostrato viene valutata attraverso ripetute misurazioni TEER. Abbreviazioni: TEER = resistenza elettrica transepiteliale; ROCK = chinasi rho-associata; GSKiβ = glicogeno sintasi chinasi beta; CMGF + R/G = Mezzo completo con fattori di crescita potenziati con inibitore ROCK e GSKiβ; CMGF+ = Mezzo completo con fattori di crescita ma senza inibitore ROCK o GSKiβ; FITC = isotiocianato di fluoresceina; F = fluorescenza. Fare clic qui per visualizzare una versione più grande di questa figura.
- Valutazione della prontezza del monostrato organoide
NOTA: questo passaggio si verifica 8-14 giorni dopo la semina.- Controllare il monostrato almeno a giorni alterni al microscopio ottico (utilizzare il contrasto di fase per visualizzare l'integrità del monostrato). Continuare al passaggio successivo quando il monostrato cellulare è completamente formato senza spazi vuoti o segni apparenti di lacrime.
- Cambiare il mezzo organoide da CMGF+ R/G a CMGF+ (escludendo l'inibitore ROCK e GSKiβ dalla composizione del mezzo). Si consiglia di sostituire il mezzo almeno quattro giorni prima dell'esperimento.
NOTA: Questo passaggio consentirà una corretta differenziazione del monostrato organoide. - Continuare a misurare i valori TEER approssimativamente a giorni alterni. Quando i valori TEER iniziano a stabilizzarsi a circa 1.500-2.000 Ω × cm² (Figura 6), misurare i valori TEER ogni giorno.
NOTA: questo stato stazionario può essere mantenuto per circa 2-3 giorni, che è la finestra di tempo ottimale per eseguire il test di permeabilità (di solito nei giorni da 11 a 13). I valori di PLATEAU TEER possono oscillare leggermente in base alla localizzazione intestinale degli organoidi, alla temperatura di misurazione, alla razza, all'età e allo stato di malattia del cane. - Programmare immediatamente il test di permeabilità del farmaco per evitare una rapida diminuzione dei valori TEER o una crescita eccessiva del monostrato organoide a più strati cellulari.
- Preparazione per l'esperimento
NOTA: gli agitatori dell'incubatore possono essere utilizzati durante l'esperimento per evitare gli effetti dello strato d'acqua non agitato. Misurare i valori TEER a temperature costanti.- Il giorno dell'esperimento, misurare i valori TEER e confermare che i valori hanno raggiunto uno stato stazionario e non stanno diminuendo rapidamente.
- Scegli i migliori monostrati (tramite microscopia ottica e valori TEER) dall'eccesso di inserti del 20% per eseguire l'esperimento.
- Osservare i monostrati al microscopio ottico ed escludere monostrati organoidi incompleti, strappati o troppo cresciuti.
- Preparare il tampone di trasporto e regolarne il pH ai valori desiderati.
NOTA: la composizione del buffer sperimentale varia in base alla configurazione sperimentale. Un tampone di uso frequente è composto da Hank's Balanced Salt Solution (HBSS), glucosio (12,5 mM) e acido 4-(2-idrossietil)-1-piperazineetanosolfonico (HEPES, 25 mM). Questa composizione garantisce la vitalità della coltura organoide durante un esperimento. - Aspirare accuratamente il mezzo dalle camere apicali e basolaterali dei pozzetti selezionati.
- Aggiungere 200 μL di tampone di trasporto alla camera apicale e 800 μL alla camera basolaterale.
NOTA: Il tampone di trasporto deve essere prima aggiunto alla camera apicale e poi alla camera basolaterale per evitare il distacco del monostrato dalla membrana microporosa. - Posizionare la piastra nell'incubatore (37 °C; 5% CO2 atmosfera) per 30 minuti per equilibrare.
NOTA: I monostrati organoidi canini sono ora pronti per l'esperimento di permeabilità del farmaco.
- Tipica soluzione sperimentale di concentrazione IgY
NOTA: il design e il layout sperimentali possono cambiare a seconda della domanda di ricerca. La permeabilità dell'immunoglobulina Y (IgY) attraverso un monostrato organoide viene utilizzata nel protocollo come esempio e può essere modificata. Il termine camera donatrice si riferisce alla camera in cui il farmaco viene inizialmente applicato, mentre la camera ricevente si riferisce alla camera che accetta il farmaco dalla camera donatrice. Un tipico esperimento raccoglie campioni nelle camere del ricevitore per 2 ore (ad esempio, 15, 30, 60, 90, 120 min).- Preparare la soluzione di IgY (farmaco o soluto a scelta) sciogliendola nel tampone di trasporto alla concentrazione finale desiderata. Preparare più soluzioni farmacologiche del necessario.
NOTA: I farmaci con bassa solubilità acquosa possono essere prima sciolti in un solvente organico (ad esempio, etanolo, DMSO) prima di aggiungerli al tampone. La concentrazione finale del solvente deve essere inferiore all'1% in modo da non danneggiare il monostrato cellulare. - Rimuovere il tampone dalla camera donatrice (camera apicale o basolaterale) di ciascun pozzetto.
- Aggiungere la soluzione IgY (soluzione farmacologica) a tutte le camere del donatore. Utilizzare la soluzione rimanente come soluzione donatore tempo 0 per la misurazione della concentrazione iniziale del farmaco.
- Nei punti temporali richiesti, rimuovere 50 μL dalla camera di ricezione e posizionarlo in un tubo etichettato. All'ultimo punto temporale, rimuovere un campione dalla camera del donatore. Alla fine dell'esperimento, trasferire le aliquote del donatore e del ricevente in un congelatore a -20 °C.
NOTA: Se sono necessari molti punti temporali, la sostituzione del tampone nella camera ricevente può essere eseguita, ma deve essere presa in considerazione nel calcolo della permeabilità apparente. La concentrazione nella camera ricevente non deve raggiungere più del 10% della camera donatrice alla fine dell'esperimento per mantenere le condizioni di affondamento44.
- Preparare la soluzione di IgY (farmaco o soluto a scelta) sciogliendola nel tampone di trasporto alla concentrazione finale desiderata. Preparare più soluzioni farmacologiche del necessario.
- Controllo qualità monostrato a cella organoide
NOTA: la soluzione FITC-destrano può essere utilizzata per confermare l'integrità del monostrato durante l'esperimento. FITC-dextran è usato come esempio di un test di integrità monostrato. Altri includono il giallo lucifero, PEG-4000, mannitolo radiomarcato e inulina44.- Al tempo 0 min, aspirare il contenuto della camera apicale e sostituirlo con 250 μL di soluzione fitc-destrano (5 mg/mL, 4 kDa) in triplice copia per ciascun gruppo sperimentale.
NOTA: non esporre FITC-destrano alla luce. - Dopo 20 minuti, rimuovere il tampone dalla camera basolaterale.
- Misurare l'intensità di fluorescenza del campione basolaterale utilizzando un lettore di piastre di fluorescenza (utilizzare una curva di calibrazione; eccitazione impostata a 485 nm e valore di emissione a 528 nm).
NOTA:l'app P di FITC può anche essere calcolata utilizzando il metodo descritto nella discussione. - Al termine dell'esperimento, aspirare accuratamente il tampone in eccesso dalle camere apicali e basolaterali.
- Aggiungere 200 μL di CMGF+ nella camera apicale e 700 μL alla camera basolaterale.
- Misurare i valori TEER nei singoli pozzetti.
- Posizionare la piastra nell'incubatore (37 °C; 5% CO2 atmosfera) per 24 ore.
- Se applicabile, dopo 24 ore, misurare i valori TEER per valutare possibili danni al monostrato durante la parte di controllo qualità dell'esperimento. Utilizzare la microscopia ottica per visualizzare l'integrità del monostrato organoide canino.
- Al tempo 0 min, aspirare il contenuto della camera apicale e sostituirlo con 250 μL di soluzione fitc-destrano (5 mg/mL, 4 kDa) in triplice copia per ciascun gruppo sperimentale.
- Monostrati di celle di fissaggio per analisi a valle
- Preparare la soluzione di formalina-acido acetico-alcool (FAA, composizione nella Tabella 1).
- Rimuovere il tampone di trasporto o CMGF+ dalle camere apicali e basolaterali utilizzando un pipetto P1000 o pipette Pasteur monouso sterili da 9" e un aspiratore a vuoto.
- Riempire le camere apicali e basali con FAA.
- Dopo 24 ore, aspirare la FAA e sostituirla con etanolo al 70%.
- Avvolgere la piastra con un film flessibile da laboratorio per evitare l'evaporazione e procedere alla preparazione del blocco.

Figura 6: Valori TEER tra gruppi sperimentali. I valori di TEER sono stati misurati in cinque gruppi di monostrati organoidi intestinali canini. Tre gruppi erano composti da enteroidi digiunali canini e due gruppi consistevano di colonidi. Ogni gruppo comprendeva da 12 a 22 repliche. I valori TEER per le colture enteroidi digiunali sono mostrati dal giorno 4 al giorno 14 e le colture colonoidi sono mostrate dal giorno 4 al giorno 12 (le misurazioni sono terminate quando il monostrato organoide ha raggiunto valori di stato stazionario, indicando che il monostrato era pronto per l'uso sperimentale). Le barre di errore esprimono SEM delle misurazioni. Abbreviazione: TEER = resistenza elettrica transepiteliale. Fare clic qui per visualizzare una versione più grande di questa figura.
Risultati
Le procedure operative standard per la coltura di organoidi canini sono state precedentemente descritte33 e anche il protocollo organoide canino è stato discusso in dettaglio in questo numero speciale38. Gli organoidi intestinali canini coltivati su supporti permeabili sono stati fissati e incorporati in paraffina per esaminare la microanatomia del monostrato e le popolazioni cellulari. Il processo di incorporamento della paraffina è stato precedentemente discusso da Gabriel et al.38. È stata eseguita la colorazione di routine (ematossilina ed eosina) e la tecnica di colorazione Alcian Blue è stata utilizzata per rilevare le cellule del calice nel monostrato organoide canino (vedere Figura 7).
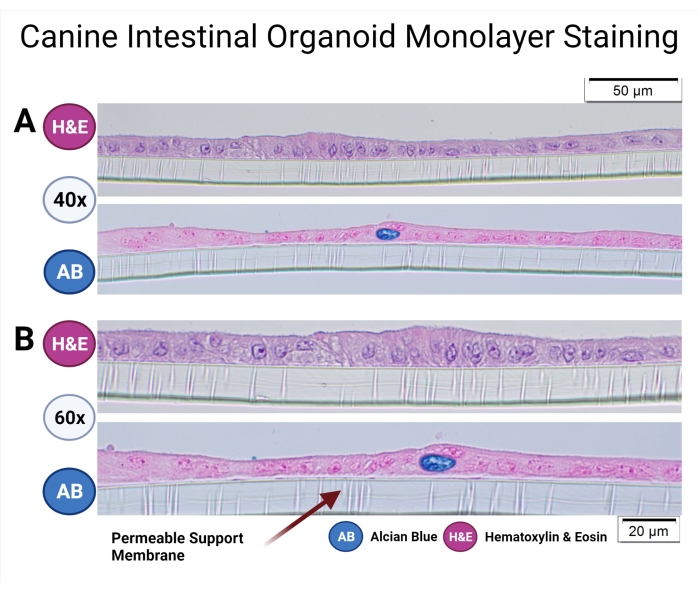
Figura 7: Colorazione monostrato organoide intestinale canino. Gli organoidi intestinali canini di origine colonica nel supporto permeabile sono stati incorporati in paraffina e colorati con H & E e AB. Le immagini rappresentative sono state scattate utilizzando la microscopia ottica con ingrandimento 40x (A) e 60x (B). La colorazione H& E rivela un monostrato epiteliale colonnare e i microvilli nella parte apicale delle cellule possono essere osservati con un ingrandimento di 60x. La colorazione AB svela ulteriormente la presenza di cellule caliciformi (blu scuro) nel monostrato organoide intestinale canino. Barre di scala = 20 μm (A), 50 μm (B). Abbreviazioni: H&E = ematossilina ed eosina; AB = Blu Alciano. Fare clic qui per visualizzare una versione più grande di questa figura.
La coltura organoide sul supporto permeabile deve essere coltivata per 10-14 giorni per essere pronta per un esperimento di permeabilità. La microscopia ottica viene utilizzata in combinazione con le misurazioni del valore TEER per confermare la prontezza della coltura organoide per i test di permeabilità dei farmaci candidati. Immagini microscopiche leggere rappresentative di diversi monostrati organoidi intestinali canini di animali sani e malati sono presentate nella Figura 8.

Figura 8: Microscopia monostrato organoide intestinale canina. Immagini di monostrati in crescita viste al microscopio ottico. I monostrati organoidi derivati da donatori sani sono rappresentati da colture enteroidi digiunali (10x; 40x) e colonoidi (20x; 40x). I monostrati organoidi di donatori malati sono rappresentati da enteroidi duodenali (5x; 10x) e ileali (5x; 10x) derivati da un paziente canino con diagnosi di PLE. Entrambe le colture organoidi PLE sono esempi di isolamento cellulare improprio durante la semina di organoidi e queste colture non possono essere utilizzate per saggi di permeabilità ai farmaci a causa della presenza di organoidi 3D. Esempi di deviazioni dalla corretta formazione di monostrato, come le lacrime monostrato (5x), sono causati da una manipolazione non curante dei campioni biologici. La coltura prolungata di organoidi (10x; 20x) è causata dalla lunga manutenzione degli organoidi sull'inserto quando gli organoidi iniziano ad assomigliare alla loro struttura 3D originale. Per confronto, vengono presentate immagini di linee cellulari 2D tradizionali sui supporti permeabili usati comunemente per gli studi di permeabilità ai farmaci (MDCK-10x; 40x e Caco-2-10x; 20x). Abbreviazioni: PLE = enteropatia che perde proteine; MDCK = Rene canino Madin-Darby. Barre di scala = 500 μm (5x), 200 μm (10x), 100 μm (20x), 50 μm (40x). Fare clic qui per visualizzare una versione più grande di questa figura.
I monostrati organoidi sono stati fissati anche nel 3% di paraformaldeide-3% di glutaraldeide in soluzione salina tamponata con fosfato (PBS). La microscopia elettronica a trasmissione (TEM) è stata utilizzata per caratterizzare l'ultrastruttura della coltura organoide sui supporti permeabili. Le strutture microanatomiche dei microvilli e le giunzioni strette possono essere viste nella Figura 9.

Figura 9: Immagini TEM di monostrati organoidi intestinali canini sani. TEM è stato utilizzato per rivelare la microarchitettura cellulare di monostrati organoidi digiunale (A), ileale (B) e colonico (C). La membrana microporosa dell'inserto di supporto permeabile è contrassegnata da una freccia gialla. La presenza di microvilli (freccia blu) e giunzioni strette (freccia rossa) è delineata nelle immagini. Abbreviazione: TEM = Microscopia elettronica a trasmissione. Barre di scala = 5 μm (A), 2 μm (B, C). Fare clic qui per visualizzare una versione più grande di questa figura.
Sia le misurazioni TEER che la microscopia ottica devono essere eseguite per garantire che il sistema sia pronto per i test di permeabilità. Il test è pronto per l'uso quando TEER raggiunge uno stato stazionario, mentre la microscopia ottica aiuterà ad escludere danni o crescita eccessiva degli organoidi. Un riassunto delle misurazioni tipiche di TEER di cinque gruppi costituiti da enteroidi e colonidi digiunali canini è presentato nella Figura 6.
Tabella 1: Composizione dei mezzi organoidi e FAA. La composizione completa di CMGF+, CMGF+ R/G e FAA è riassunta in questa tabella. Abbreviazioni: ROCK = rho-associated kinase; GSKiβ = glicogeno sintasi chinasi beta; CMGF + R/G = Mezzo completo con fattori di crescita potenziati con inibitore ROCK e GSKiβ; CMGF+ = Mezzo completo con fattori di crescita ma senza inibitore ROCK o GSKiβ; FAA = formalina-acido acetico-alcol; EGF = fattore di crescita epidermico. Questa tabella è adattata da 38. Fare clic qui per scaricare questa tabella.
Tabella supplementare 1: Tabella per prendere appunti sull'organoide canino il sistema di supporto permeabile. Abbreviazioni: TEER = resistenza elettrica transepiteliale; ROCK = chinasi rho-associata; GSKiβ = glicogeno sintasi chinasi beta; CMGF + R/G = Mezzo completo con fattori di crescita potenziati con inibitore ROCK e GSKiβ; CMGF+ = Mezzo completo con fattori di crescita ma senza inibitore ROCK o GSKiβ. Fare clic qui per scaricare questa tabella.
Discussione
Le colture organoidi intestinali canine nell'apparato di supporto permeabile sono un concetto unico che collega i tradizionali saggi di permeabilità ai farmaci40 con un nuovo modello canino in vitro 41. Diversi tipi di organoidi intestinali canini possono essere utilizzati e valutati in base all'obiettivo dell'esperimento con aggiustamenti minimi. Si raccomanda di testare più concentrazioni del farmaco di interesse in 3-4 pozzetti per gruppo. Le concentrazioni possono essere basate sulla concentrazione intestinale prevista del farmaco. Inoltre, l'utilizzo di ricerche precedenti può aiutare a determinare i punti temporali appropriati per il disegno dello studio. Dovrebbe essere fatta un'adeguata documentazione del progetto di studio per aumentare la replicabilità e assistere nella risoluzione dei problemi.
Questa tecnologia ha diverse limitazioni a causa della novità del metodo42, principalmente a causa della mancanza di standardizzazione nella progettazione sperimentale e nell'esecuzione del protocollo tra i laboratori. Questa mancanza di standardizzazione è stata riconosciuta da altri gruppi43 e i protocolli monostrato organoide 3D canino porteranno alla riproducibilità interlaboratorio e introdurranno la standardizzazione in questo sistema. Gli approcci standardizzati all'analisi dei dati migliorano la replicabilità e possono rafforzare i risultati dei test preliminari sui farmaci utilizzando gli organoidi canini nel sistema di supporti permeabili in diversi laboratori. Il modello organoide 3D canino manca anche di set di dati che confrontano i valoridell'app P in vitro dei farmaci modello con il loro noto assorbimento intestinale umano o canino in vivo, proprio come le cellule Caco-2 44,45,46. Una volta che tali dati sono stati generati, questo modello di organoide canino può essere utilizzato per valutare la permeabilità intestinale durante lo sviluppo del farmaco.
È fondamentale prestare attenzione quando si seminano gli organoidi sul sistema di supporto permeabile per seminare una densità sufficientemente elevata di cellule opportunamente dissociate. I valori TEER del sistema sono più affidabili e riproducibili se coltivati in monostrati rigorosi. La coltura prolungata dei monostrati può portare ad un aumento esponenziale dei valori TEER che vanno oltre i valori fisiologici dell'intestino. Le sezioni H & E di tali strutture 3D mostrano quindi diversi strati di cellule l'una sopra l'altra con strutture alterate di enterociti più vicini alla membrana.
Dopo l'espansione riuscita del monostrato organoide intestinale canino, i risultati possono essere analizzati allo stesso modo dei tradizionali saggi cellulari 2D calcolando il coefficiente di permeabilità apparente di un farmaco (Papp) formula44. Il valoredell'app P (vedere Eq (2)) descrive la velocità di trasporto attraverso il monostrato cellulare47.
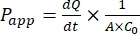 (2)
(2)
È 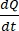 la pendenza iniziale della concentrazione rispetto alla curva temporale (ad esempio, nmol/s). A è l'area dell'inserto (cm2) e C0 è la concentrazione iniziale del farmaco o del composto nella camera del donatore37. Il riconoscimento affidabile dell'integrità del monostrato è una parte cruciale del test di permeabilità che richiede la standardizzazione. La microscopia ottica e le misurazioni TEER sono raccomandate per valutare gli organoidi canini in un sistema di supporto permeabile e aiutare a determinare i tempi corretti dell'esperimento. Inoltre, i marcatori di permeabilità molecolare zero (ad esempio, FITC-destrano, giallo Lucifero, PEG-400) possono essere utilizzati per valutare funzionalmente l'integrità del monostrato organoide. Bisogna prestare attenzione se il composto testato è interessato da un trasportatore. La glicoproteina P (P-gp) viene utilizzata come esempio comune di pompa di efflusso. Deve essere generato un rapporto di efflusso (app P, bl-AP / Papp, AP-BL) rispetto a un noto substrato della sonda P-gp.
la pendenza iniziale della concentrazione rispetto alla curva temporale (ad esempio, nmol/s). A è l'area dell'inserto (cm2) e C0 è la concentrazione iniziale del farmaco o del composto nella camera del donatore37. Il riconoscimento affidabile dell'integrità del monostrato è una parte cruciale del test di permeabilità che richiede la standardizzazione. La microscopia ottica e le misurazioni TEER sono raccomandate per valutare gli organoidi canini in un sistema di supporto permeabile e aiutare a determinare i tempi corretti dell'esperimento. Inoltre, i marcatori di permeabilità molecolare zero (ad esempio, FITC-destrano, giallo Lucifero, PEG-400) possono essere utilizzati per valutare funzionalmente l'integrità del monostrato organoide. Bisogna prestare attenzione se il composto testato è interessato da un trasportatore. La glicoproteina P (P-gp) viene utilizzata come esempio comune di pompa di efflusso. Deve essere generato un rapporto di efflusso (app P, bl-AP / Papp, AP-BL) rispetto a un noto substrato della sonda P-gp.
La microscopia ottica (semplice o potenziata con contrasto di fase) è un metodo inestimabile per verificare l'integrità del monostrato 2D o 3D e dell'inserto del filtro, valutando al contempo la possibile crescita eccessiva cellulare. La Figura 7 può servire come guida per riconoscere le colture di cellule organoidi intestinali canine sane. I valori teer sono una misura importante della formazione delle giunzioni intercellulari e della differenziazione delle colture organoidi in un epitelio intestinale intatto. Gli organoidi intestinali canini si differenziano in enterociti e cellule caliciformi (Figura 6). Queste cellule produttrici di muco consentono lo studio delle interazioni farmaco-muco, che è stato difficile da ottenere utilizzando le tradizionali colture cellulari 2D48. La presenza di cellule enteroendocrine è stata precedentemente confermata negli organoidi intestinali canini da Chandra et al.33.
Viene fornita un'ulteriore caratterizzazione dei monostrati organoidi canini derivati da organoidi digiunali, ileali e del colon utilizzando TEM. Le immagini TEM mostrano la microarchitettura cellulare, comprese le giunzioni strette e la formazione di microvilli, illustrando ulteriormente la complessità e l'utilità di questi modelli organoidi nella medicina traslazionale. Sulla base dei risultati sperimentali, le colture organoidi sul supporto permeabile erano pronte per la sperimentazione tra i giorni 11 e il giorno 13 dopo la semina (Figura 9). I valori TEER in questo momento variavano tra 1.500 e 2.500 Ω,cm2. La fase di plateau dei valori TEER dura per un periodo di tempo molto limitato in cui l'esperimento deve essere avviato prima che i valori TEER inizino a diminuire lentamente. I valori TEER possono anche essere una parte cruciale della visualizzazione di importanti risultati sperimentali in quanto alcuni farmaci o eccipienti di prodotti farmaceutici possono interagire con il monostrato (ad esempio, giunzioni strette), il che può influire notevolmente sulle letture del valore TEER. Questo da solo può servire come dati per un esperimento.
Gli organoidi intestinali canini in un apparato di coltura cellulare a doppia camera possono essere applicati in campi diversi dalla permeabilità orale ai farmaci a causa dell'architettura unica del monostrato cellulare risultante. Ad esempio, possono essere utilizzati nella ricerca microbiologica (ad esempio, l'impatto dell'alterazione della flora microbica gastrointestinale), studi di assorbimento virale, interazioni farmaco-farmaco e meccanismi di trasporto dei farmaci49. La camera del donatore è in genere riempita con il farmaco o il composto di scelta e le aliquote dalla camera ricevente vengono prese in vari punti temporali. Queste aliquote possono essere analizzate utilizzando cromatografia liquida ad alte prestazioni, spettrometria di massa, saggio immunoassorbente enzimatico o altre tecniche per determinare la quantità e la velocità con cui il soluto permea attraverso il monostrato.
Questi studi richiedono un monostrato intatto per valutare accuratamente la permeabilità al farmaco. Ciò richiede in genere la crescita di monostrati in eccesso rispetto a quelli necessari per tenere conto dei pozzi inutilizzabili. I monostrati di cellule organoidi possono anche essere utilizzati per misurare l'assorbimento virale dal lato apicale o basale di un monostrato, con letture che includono saggi di immunofluorescenza che utilizzano anticorpi per rilevare l'assorbimento cellulare del virus. Infine, più farmaci (cioè substrato e inibitore) possono essere applicati alla camera del donatore per identificare le interazioni farmaco-farmaco basate sul trasportatore.
Sulla base delle osservazioni attuali, questi metodi non saranno solo applicabili agli organoidi canini negli inserti di coltura, ma saranno adatti anche ad altre specie veterinarie e sistemi di organi, con piccole modifiche necessarie per adattarsi al meglio alla specie o al modello di organo scelto. I protocolli per la crescita degli organoidi intestinali canini dovevano essere regolati in base alle proprietà uniche della coltura. Pertanto, il protocollo può essere adattato a un'altra specie, ma richiederà sottili modifiche al protocollo. Le modifiche possono iniziare con cambiamenti nella densità di semina cellulare e espandersi in cambiamenti nella composizione dei media per differenziare correttamente gli organoidi di interesse.
La standardizzazione, la documentazione dettagliata delle procedure sperimentali e il monitoraggio coerente dei monostrati cellulari sono pratiche cruciali necessarie attraverso i saggi di supporto permeabili e non sono limitate al sistema canino. Queste possibili modifiche di specie o organi sono fondamentali per documentare e riferire per ulteriori progressi nel campo. Questo modello ha diverse limitazioni, ad esempio i suoi requisiti di costo, la variabilità interlaboratorio e i dati limitati sulla capacità di prevedere l'assorbimento intestinale in vivo. I cani, in alcuni casi, possiedono diversi trasportatori di droga ed enzimi metabolizzanti rispetto agli esseri umani50.
Inoltre, il sistema organoide canino deve essere testato su una varietà di altri apparecchi a doppia camera di altri produttori per determinare l'idoneità di tale modello (ad esempio, deve essere determinata l'idoneità di diverse composizioni di membrane filtranti). Un altro svantaggio è che la parte dell'esperimento di permeabilità al farmaco del manoscritto è meno descrittiva rispetto alle parti precedenti. Ciò è causato da un eccesso di informazioni in questo campo. L'obiettivo di questa parte del manoscritto era quello di descrivere questi metodi in modo modificabile senza tagliare i bordi dei capisaldi di questi esperimenti. Informazioni più dettagliate sugli esperimenti di permeabilità sono state raccolte da Hubatsch et al.37. Inoltre, gli inserti permeabili possono essere utilizzati negli esperimenti di cocoltura, migrazione cellulare e analisi di invasione4.
In conclusione, gli organoidi intestinali canini negli apparati di coltura a doppia camera hanno il potenziale per essere utilizzati in una vasta gamma di applicazioni, tra cui campi biomedici e medicina traslazionale, per citarne alcuni. I protocolli creano diverse strategie per pianificare un esperimento e promuovere l'affidabilità dei dati interlaboratorio per i modelli organoidi in tutto il campo della biologia.
Divulgazioni
K. Allenspach è co-fondatore di LifEngine Animal Health e 3D Health Solutions. È consulente per Ceva Animal Health, Bioiberica, LifeDiagnostics, Antech Diagnostics, Deerland Probiotics e Mars. J.P. Mochel è co-fondatore di LifEngine Animal Health e 3D Health Solutions e funge da consulente per Ceva Animal Health ed Ethos Animal Health. Questo articolo riflette le opinioni degli autori e non deve essere interpretato in modo da rappresentare l'approvazione, il punto di vista o le politiche della Food and Drug Administration. Altri autori non hanno alcun conflitto di interessi da dichiarare.
Riconoscimenti
Vogliamo esprimere gratitudine ai dipendenti del Veterinary Diagnostic Laboratory della Iowa State University, vale a dire Haley Lambert, Emily Rahe, Rosalyn Branaman, Victoria Green e Jennifer Groeltz-Thrush, per la tempestiva elaborazione dei campioni. Vorremmo anche ringraziare Jodi Smith e Bethann Valentine per aver fornito materiale per gli esperimenti di permeabilità. Vogliamo anche ringraziare David Diaz-Reganon per il suo aiuto con la Figura 9. Ad eccezione della Figura 6, tutte le figure sono state create in BioRender.com. Gli autori desiderano riconoscere il supporto di Faculty Startup, ISU VPR Miller Award, ISU VPR Miller Award e NSF SBIR subaward a ISU # 1912948.
Materiali
| Name | Company | Catalog Number | Comments |
| Organoid media | |||
| ROCK inhibitor (Y-27632) | EMD Millipore Corp. | SCM 075 | |
| [Leu15]-Gastrin I human | Sigma | G9145-.5MG | |
| A-83-01 | PeproTech | 9094360 | |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| B27 supplement | Gibco | 17504-044 | |
| FBS | Corning | 35-010-CV | |
| Glutamax | Gibco | 35050-061 | glutamine substitute |
| HEPES | VWR Life Science | J848-500ML | |
| Human R-Spondin-1 | PeproTech | 120-38-500UG | |
| Murine EGF | PeproTech | 315-09-1MG | |
| Murine Noggin | PeproTech | 250-38-250UG | |
| Murine Wnt-3a | PeproTech | 315-20-10UG | |
| N2 supplement | Gibco | 17502-048 | |
| N-Acetyl-L-cysteine | Sigma | A9165-25G | |
| Nicotinamide | Sigma | N0636-100G | |
| Primocin | InvivoGen | ant-pm-1 | |
| SB202190 (P38 inhibitor) | Sigma | S7067-25MG | |
| Stemolecule CHIR99021 (GSK3β) | Reprocell | 04-0004-base | |
| TMS (trimethoprim sulfate) | Sigma | T7883-5G | |
| Reagents | |||
| Acetic Acid, Glacial | Fisher Chemical | A38-500 | |
| alpha-D(+)-Glucose, 99+%, anhydrous | Acros Organics | 170080010 | |
| Cell Recovery Solution | Corning | 354253 | |
| Collagen I, Rat Tail 3 mg/mL | Gibco | A10483-01 | |
| FITC-CM-Dextran | Millipore Sigma | 68059-1G | |
| Formaldehyde (37%) | Fisher Chemical | F79P-4 | |
| Glutaraldehyde solution | Sigma | G5882 | |
| HBSS (1x) | Gibco | 14025-076 | |
| Matrigel Matrix For Organoid Culture | Corning | 356255 | Extracellular Membrane Matrix |
| Paraformaldehyde, 97% | Alfa Aesar | A11313 | |
| PBS, 1x (Phosphate-Buffered Saline) | Corning | 21-040-CM | |
| TrypLE Express | Gibco | 12604-021 | Trypsin-like Protease |
| Materials and Equipment | |||
| 15 mL Centrifuge Tube | Corning | 430766 | |
| 9" Pasteur Pipets | Fisherbrand | 13-678-6B | |
| Corning Transwell 6.5 mm Polyester Membrane Inserts Preloaded in 24-Well Culture Plates, Pore Size: 0.4 µm, Sterile | Corning | 3470 | Permeable Support |
| Millicell ERS (Probes) | Millipore Sigma | MERSSTX01 | |
| Millicell ERS-2 Voltohmmeter | Millipore Sigma | MERS00002 | |
| Panasonic incubator | Panasonic | MCO-170ML-PA | |
| Parafilm M Wrapping Film | Bemis Company Inc | PM996/EMD | Flexible Laboratory Film |
| Tissue Culture Plate 24 wells | Fisherbrand | FB012929 |
Riferimenti
- Ghaffarian, R., Muro, S. Models and methods to evaluate transport of drug delivery systems across cellular barriers. Journal of Visualized Experiments JoVE. (80), e50638(2013).
- Youhanna, S., Lauschke, V. M. The Past, present and future of intestinal in vitro cell systems for drug absorption studies. Journal of Pharmaceutical Sciences. 110 (1), 50-65 (2021).
- Belic, S., et al. Comparative analysis of inflammatory cytokine release and alveolar epithelial barrier invasion in a transwell®bilayer model of mucormycosis. Frontiers in Microbiology. 3204, 3204(2019).
- Justus, C. R., Leffler, N., Ruiz-Echevarria, M., Yang, L. V. In vitro cell migration and invasion assays. Journal of Visualized Experiments: JoVE. (88), e51046(2014).
- Rönkkö, S., Vellonen, K. S., Järvinen, K., Toropainen, E., Urtti, A. Human corneal cell culture models for drug toxicity studies. Drug Delivery and Translational Research. 6 (6), 660-675 (2016).
- Dahlgren, D., Lennernäs, H. Intestinal permeability and drug absorption: predictive experimental, computational and in vivo approaches. Pharmaceutics. 11 (8), 411(2019).
- Schoultz, I., Keita, ÅV. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909(2020).
- Hilgers, A. R., Conradi, R. A., Burton, P. S. Caco-2 cell monolayers as a model for drug transport across the intestinal mucosa. Pharmaceutical Research. 7 (9), 902-910 (1990).
- Natoli, M., Leoni, B. D., D’Agnano, I., Zucco, F., Felsani, A. Good Caco-2 cell culture practices. Toxicology in Vitro. 26 (8), 1243-1246 (2012).
- Kapałczyńska, M., et al. 2D and 3D cell cultures – a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Sun, H., Chow, E. C. Y., Liu, S., Du, Y., Pang, K. S. The Caco-2 cell monolayer: Usefulness and limitations. Expert Opinion on Drug Metabolism and Toxicology. 4 (4), 395-411 (2008).
- Chandler, M., et al. Obesity and associated comorbidities in people and companion animals: a One Health perspective. Journal of Comparative Pathology. 156 (4), 296-309 (2017).
- Coelho, L. P., et al. Similarity of the dog and human gut microbiomes in gene content and response to diet. Microbiome. 6 (1), 72(2018).
- Galeta, P., Lázničková-Galetová, M., Sablin, M., Germonpré, M. Morphological evidence for early dog domestication in the European Pleistocene: New evidence from a randomization approach to group differences. Anatomical Record. 304 (1), 42-62 (2021).
- Kleinert, M., et al. Animal models of obesity and diabetes mellitus. Nature Reviews Endocrinology. 14 (3), 140-162 (2018).
- Allenspach, K., Wieland, B., Gröne, A., Gaschen, F. Chronic enteropathies in dogs: Evaluation of risk factors for negative outcome. Journal of Veterinary Internal Medicine. 21 (4), 700-708 (2007).
- Wang, J., et al. Proliferative and invasive colorectal tumors in pet dogs provide unique insights into human colorectal cancer. Cancers. 10 (9), 330(2018).
- Gillespie, V., Baer, K., Farrelly, J., Craft, D., Luong, R. Canine gastrointestinal stromal tumors: Immunohistochemical expression of CD34 and examination of prognostic indicators including proliferation markers Ki67 and AgNOR. Veterinary Pathology. 48 (1), 283-291 (2011).
- Chandra, L., et al. Derivation of adult canine intestinal organoids for translational research in gastroenterology. BMC Biology. 17 (1), 33(2019).
- Schneider, B., et al. Model-based reverse translation between veterinary and human medicine: the One Health initiative. CPT: Pharmacometrics and Systems Pharmacology. 7 (2), 65-68 (2018).
- Artursson, P., Palm, K., Luthman, K. Caco-2 monolayers in experimental and theoretical predictions of drug transport. Advanced Drug Delivery Reviews. 22 (1-2), 67-84 (1996).
- Balimane, P. V., Han, Y. H., Chong, S. Current industrial practices of assessing permeability and P-glycoprotein interaction. AAPS Journal. 8 (1), 1-13 (2006).
- Sambuy, Y., et al. The Caco-2 cell line as a model of the intestinal barrier: Influence of cell and culture-related factors on Caco-2 cell functional characteristics. Cell Biology and Toxicology. 21 (1), 1-26 (2005).
- Calcagno, A. M., Ludwig, J. A., Fostel, J. M., Gottesman, M. M., Ambudkar, S. V. Comparison of drug transporter levels in normal colon, colon cancer, and caco-2 cells: Impact on drug disposition and discovery. Molecular Pharmaceutics. 3 (1), 87-93 (2006).
- Hilgendorf, C., et al. Expression of thirty-six drug transporter genes in human intestine, liver, kidney, and organotypic cell lines. Drug Metabolism and Disposition. 35 (8), 1333(2007).
- Seithel, A., Karlsson, J., Hilgendorf, C., Björquist, A., Ungell, A. L. Variability in mRNA expression of ABC- and SLC-transporters in human intestinal cells: Comparison between human segments and Caco-2 cells. European Journal of Pharmaceutical Sciences. 28 (4), 291-299 (2006).
- Volpe, D. A. Transporter assays as useful in vitro tools in drug discovery and development. Expert Opinion on Drug Discovery. 11 (1), 91-103 (2016).
- Hoffmann, P., et al. Caco-2/HT29-MTX co-cultured cells as a model for studying physiological properties and toxin-induced effects on intestinal cells. PLoS ONE. 16 (10), 257824(2021).
- Sun, H., Chow, E. C. Y., Liu, S., Du, Y., Pang, K. S. The Caco-2 cell monolayer: Usefulness and limitations. Expert Opinion on Drug Metabolism and Toxicology. 4 (4), 395-411 (2008).
- Thummel, K. E., et al. Transcriptional control of intestinal cytochrome P-4503A by 1α,25-dihydroxy vitamin D3. Molecular Pharmacology. 60 (6), 1399-1406 (2001).
- Kodama, N., et al. Characteristic analysis of intestinal transport in enterocyte-like cells differentiated from human induced pluripotent stem cells. Drug Metabolism and Disposition. 44 (10), 1662-1667 (2016).
- Akazawa, T., et al. Application of intestinal epithelial cells differentiated from human induced pluripotent stem cells for studies of prodrug hydrolysis and drug absorption in the small intestine. Drug Metabolism and Disposition: The Biological Fate of Chemicals. 46 (11), 1497-1506 (2018).
- Lo, B., Parham, L. Ethical issues in stem cell research. Endocrine Reviews. 30 (3), 204-213 (2009).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), 0231423(2020).
- Zdyrski, C., et al. Su124 homology directed repair in canine duodenal enteroids to mimic the wild-type P-glycoprotein mutation. Gastroenterology. 160 (6), 625(2021).
- Nantasanti, S., et al. Disease modeling and gene therapy of copper storage disease in canine hepatic organoids. Stem Cell Reports. 5 (5), 895-907 (2015).
- Hubatsch, I., Ragnarsson, E. G. E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Gabriel, V., et al. Standardization and maintenance of 3D canine hepatic and intestinal organoid cultures for use in biomedical research. Journal of Visualized Experiments: JoVE. (179), e63515(2022).
- Frost, T. S., Jiang, L., Lynch, R. M., Zohar, Y. Permeability of epithelial/endothelial barriers in transwells and microfluidic bilayer devices. Micromachines. 10 (8), 533(2019).
- van Breemen, R. B., Li, Y. Caco-2 cell permeability assays to measure drug absorption. Expert Opinion on Drug Metabolism and Toxicology. 1 (2), 175-185 (2005).
- Huch, M., Knoblich, J. A., Lutolf, M. P., Martinez-Arias, A. The hope and the hype of organoid research. Development. 144 (6), 938-941 (2017).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Olivatti, T. O. F., Alcantara, G. P., Lemos, A. C. C. E., Silva, M. G., Miot, H. A. Standardization of organoid culture for evaluation of melanogenesis induced by UVB, UVA and visible light. Anais Brasileiros de Dermatologia. 95 (1), 46-51 (2020).
- Volpe, D. A., et al. Classification of drug permeability with a Caco-2 cell monolayer assay. Clinical Research and Regulatory Affairs. 24 (1), 39-47 (2007).
- Chen, C., Ma, M. G., Fullenwider, C. L., Chen, W. G., Sadeque, A. J. M. Biopharmaceutics permeability classification of lorcaserin, a selective 5-hydroxytryptamine 2C agonist: Method suitability and permeability class membership. Molecular Pharmaceutics. 10 (12), 4739-4745 (2013).
- Jarc, T., et al. Demonstrating suitability of the Caco-2 cell model for BCS-based biowaiver according to the recent FDA and ICH harmonised guidelines. Journal of Pharmacy and Pharmacology. 71 (8), 1231-1242 (2019).
- Newby, D., Freitas, A. A., Ghafourian, T. Decision trees to characterise the roles of permeability and solubility on the prediction of oral absorption. European Journal of Medicinal Chemistry. 90, 751-765 (2015).
- Navabi, N., McGuckin, M. A., Lindén, S. K. Gastrointestinal cell lines form polarized epithelia with an adherent mucus layer when cultured in semi-wet interfaces with mechanical stimulation. PLoS ONE. 8 (7), 68761(2013).
- Puschhof, J., et al. Intestinal organoid cocultures with microbes. Nature Protocols. 16 (10), 4633-4649 (2021).
- Martinez, M. N., Mochel, J. P., Neuhoff, S., Pade, D. Comparison of canine and human physiological factors: understanding interspecies differences that impact drug pharmacokinetics. The AAPS Journal. 23 (3), 59(2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon