Method Article
Limpeza óptica rápida para análise semi-de alto rendimento de esferoides tumorais
Neste Artigo
Resumo
Os esferoides tumorais estão se tornando cada vez mais utilizados para avaliar as interações de microambientes de células tumorais e a resposta terapêutica. O presente protocolo descreve um método robusto, mas simples, para imagens semi-de alta produtividade de esferoides tumorais 3D usando limpeza óptica rápida.
Resumo
Os esferoides tumorais estão rapidamente se tornando comuns na pesquisa básica do câncer e no desenvolvimento de medicamentos. A obtenção de dados sobre a expressão proteica dentro do esferoide no nível celular é importante para análise, mas as técnicas existentes são muitas vezes caras, trabalhosas, usam equipamentos fora do padrão, causam distorção significativa do tamanho ou são limitadas a esferoides relativamente pequenos. Este protocolo apresenta um novo método de montagem e limpeza de esferoides que abordam essas questões, permitindo a análise confocal da estrutura interna dos esferoides. Em contraste com as abordagens existentes, este protocolo prevê a rápida montagem e limpeza de um grande número de esferoides usando equipamentos padrão e suprimentos de laboratório. A montagem de spheroids em uma solução de gel agarose-PBS neutra em pH antes de introduzir uma solução de compensação compatível com índices refrativos minimiza a distorção de tamanho comum a outras técnicas semelhantes. Isso permite uma análise quantitativa e estatística detalhada onde a precisão das medidas de tamanho é primordial. Além disso, em comparação com as soluções de compensação líquida, a técnica de gel de agarose mantém os esferoides fixos no lugar, permitindo a coleta de imagens tridimensionais (3D) confocal. O presente artigo elabora como o método produz imagens de alta qualidade de duas e 3D que fornecem informações sobre variabilidade intercelular e estrutura esferoide interna.
Introdução
Culturas celulares tridimensionais (3D), como esferoides, fornecem modelos biologicamente realistas e reprodutíveis de crescimento celular agregado 1,2. Esses modelos estão se tornando rapidamente comuns tanto na pesquisa básica quanto no desenvolvimento de medicamentos, onde diferenças no tamanho e estrutura esferoides são examinadas entre os tratamentos para verificar a eficácia da droga 3,4. Nesses contextos, a capacidade de coletar informações detalhadas de um grande número de esferoides é altamente vantajosa, tanto do ponto de vista estatístico de poder quanto de permitir uma rápida avaliação do comportamento celular em vários tratamentos.
Técnicas comumente utilizadas para a obtenção de imagens detalhadas de microscopia da estrutura esferoide são demoradas, caras ou produzem imagens de má qualidade que não retêm características quantitativas importantes, como o tamanho esferoide 4,5. Por exemplo, técnicas histológicas baseadas em criosectioning podem fornecer imagens de alta qualidade, mas muitas vezes são demoradas, exigem mão-de-obra qualificada e muitas vezes criam artefatos de secção 6,7, enquanto tecnologias elegantes, como microscopia de iluminação de plano único (SPIM)8 e microscopia multifotol9 requerem microscópios especializados que não estão prontamente disponíveis. As modernas tecnologias de microscopia permitiram recentemente a chamada seção óptica, onde os esferoides são colocados dentro de uma solução de compensação compatível com índice refrativo e as imagens são obtidas usando microscopia confocal 4,5. Embora essas técnicas tenham o potencial de produzir um alto rendimento, problemas comuns incluem o movimento esferoide enquanto a imagem, a distorção de tamanho durante a compensação e o alto gasto de soluções proprietárias de compensação. Além disso, muitos protocolos existentes aplicam-se apenas a esferoides relativamente pequenos de menos de 300 μm de diâmetro ou profundidade até 100 μm, limitando a tecnologia aos estágios iniciais do crescimento do tumor 5,10,11.
O presente protocolo permite uma coleta semi-alta e de alto rendimento de imagens esferoides detalhadas usando uma solução de compensação compatível com o índice de refração de baixo custo derivada de procedimentos completos de compensação de órgãos12,13. Para evitar o movimento esferoide durante a imagem e fornecer suporte estrutural para reduzir a distorção de tamanho, os esferoides são montados em gel agarose-PBS em uma placa inferior de vidro de 24 poços #1.5. Uma vez que esta técnica permite que vários esferoides sejam montados em cada poço em uma placa de 24 poços, até 360 esferoides (15 esferoides/bem) podem ser rapidamente montados e imagens em várias condições experimentais. Uma solução de compensação refrativa combinada com o índice construído a partir de consumíveis prontamente disponíveis é usada para limpar esferoides montados e o gel circundante de forma óptica. Após um período de assentamento de 24 horas, este protocolo fornece imagens 2D e 3D de alta qualidade da estrutura esferoide, mesmo para esferoides relativamente grandes (aproximadamente 700 μm de diâmetro), com menos de 2% de distorção de tamanho.
Protocolo
O protocolo descreve a preparação de uma quantidade suficiente de esferoides tumorais para montar uma placa de 24 poços (aproximadamente 240-360 esferoides ou 10-15 esferoides/bem) a 200 μL de gel agarose por poço e 500 μL de solução de compensação per bem. O procedimento completo é ilustrado na Figura 1.
1. 2% de preparação de gel agarose-PBS
- Pesar 0,5 g de agarose de baixo derretimento (ver Tabela de Materiais) em uma garrafa de vidro e adicionar 25 mL de soro fisiológico tamponado de fosfato (PBS).
- Derreta a agarose fervendo a solução em um micro-ondas para 30-60 s com a tampa fechada, mas não selada e com redemoinho constante. Certifique-se de que a agarose esteja totalmente dissolvida e que a solução não ferva.
NOTA: O gel pode ser armazenado à temperatura ambiente; verifique o volume antes de usar para explicar a evaporação. Leve ao estado líquido (micro-ondas; 20-60 s com redemoinho) antes de usar.
2. Elaboração da solução de compensação
- Pese 9 g de N,N,N′,N′-Tetrakis(2-Hidroxipropyl) etilenediamina, 22 g de ureia, 44 g de sacarose, 0,1 g de Triton X-100 e 24,9 g de água desionizada (ver Tabela de Materiais).
NOTA: É mais fácil pesar a quantidade aproximada de N,N,N′,N'-Tetrakis(2-Hidroxipropyl)etilenediamina e ajustar o peso de outros componentes para obter a concentração desejada. - Aqueça a solução em um banho de água de 56 °C com mistura constante e continue até que todos os cristais se dissolvam.
- Descanse a solução à temperatura ambiente para permitir que as bolhas formadas durante a mistura subam à superfície. A solução é estável à temperatura ambiente por até 2 meses.
3. Preparação esferoide
- Gerar esferoides usando o método de sobreposição de ágarose, como descrito anteriormente 1,3,14.
NOTA: Os spheroids gerados por outros métodos também são compatíveis com este protocolo de imagem. - Corte a ponta de uma ponta de pipeta de 1 mL usando um bisturi para ampliar o orifício.
NOTA: Todos os esferoides foram manuseados com pipetas de 1 mL ou 200 μL com pontas de corte. - Usando a pipeta, aspire os esferoides dos poços e transfira-os para um tubo cônico claro de 1,5 mL. Vários esferoides das mesmas condições podem ser combinados no mesmo tubo.
NOTA: Sempre permita que os esferoides se acomodem na parte inferior do tubo para aspirar o meio. - Lave os esferoides em 1 mL PBS duas vezes, adicione a solução de paraformaldeído pré-aquecido (PFA) neutra de 4% e incuba os esferoides a 37 °C por 20 minutos.
- Remova a solução PFA e lave os esferoides duas vezes com 1 mL de PBS.
4. Mancha sferóide
- Usando uma pipeta, transfira até 15 esferoides em um tubo PCR de 200 μL.
NOTA: Para esferoides frágeis, monte os esferoides em gel (passos 5.1-5.4) antes de prosseguir. - Permeabilize as células usando 200 μL de 0,5% Triton X-100 em PBS. Coloque tubos PCR dentro de tubos de tampa de parafuso de 50 mL e incubar os esferoides por 2 h em temperatura ambiente com agitação leve.
NOTA: Todas as incubações são feitas com agitação em um rotor, rolo ou shaker (ver Tabela de Materiais) a menos que especificado o contrário. Isso é importante para alcançar a coloração uniforme. Esferoides fixos em PBS às vezes podem grudar nas laterais da ponta da pipeta. Enxaguar a ponta em 0,5% Triton X-100 minimiza os esferoides de grudar nas pontas. - Substitua a solução (etapa 4.2) por 200 μL de tampão de diluição de anticorpos (ABDIL)15 e incubar durante a noite à temperatura ambiente.
- Retire ABDIL, adicione 75 μL de anticorpo primário em ABDIL e incubar a 4 °C por 2,5 dias.
- Retire o supernasal e lave com 200 μL de PBS com 0,1% Tween e 0,1% Triton X-100 (PBS-TT) duas vezes e incubar com 200 μL de PBS-TT para 4h à temperatura ambiente.
- Remova o PBS-TT, adicione 100 μL de anticorpo secundário em ABDIL e incuba a 4 °C por 2,5 dias.
NOTA: O DAPI ou outro corante nuclear pode ser adicionado nesta fase. A maioria dos corantes requer menos tempo de incubação do que anticorpos. - Retire o supernaspe e lave com 200 μL de PBS-TT duas vezes e incuba com 200 μL de PBS-TT por 4 h. Os esferoides estão prontos para montagem.
5. Montagem
- Usando uma pipeta de 200 μL, transfira e spheróides fixos e manchados para tubos PCR de 500 μL a um tubo por condição (aproximadamente 10-15 esferoides).
- Substitua a solução por 200 μL de 2% (w/v) gel de agarose líquida e centrífuga no giro rápido (na velocidade máxima fixa, ver Tabela de Materiais) em temperatura ambiente para 30 s.
NOTA: A menos que a montagem imediatamente, coloque em um bloco de aquecimento a 50 °C para evitar o endurecimento do gel. - Aspire os esferoides em ~50 μL de gel líquido agarose e dispense em poço de uma placa de fundo de vidro de 24 poços.
- Antes que o gel endureça, separe os esferoides usando uma ponta de pipeta no gel circundante e certifique-se de que os esferoides estejam cobertos com gel. Opcionalmente, coloque a placa no gelo para definir rapidamente o gel.
NOTA: O número de esferoides por poço depende do tamanho dos esferoides. Esferoides são colocados longe um do outro para que apenas um esferoide entre no campo de visão durante a imagem. Isso é importante para o processamento automatizado de imagens. - Adicione 500 μL de solução de compensação (passo 2) por poço, garantindo que o gel esteja submerso. Incubar na RT por pelo menos 24 horas e imagem dos esferoides na solução de compensação. Os spheróides são estáveis nesta solução por até um mês à temperatura ambiente e quando protegidos da evaporação.
6. Imagem
- Escolha um objetivo com uma distância de trabalho tempo suficiente para abranger todo o esferoide, incluindo a altura de montagem do esferoide no vaso.
NOTA: Objetivos com uma distância de trabalho de 3 mm ou mais são necessários para a imagem do plano equatorial dos esferoides. Objetivos de ampliação mais elevados com NA mais alto podem permitir uma melhor resolução, mas limitarão a profundidade máxima na qual os esferoides podem ser imagens. - Para identificar o plano equatorial, ajuste o foco até que a maior área de superfície seja atingida no plano XY e na imagem com a porcentagem de energia laser necessária, tensão do detector, ganho e configurações de deslocamento.
NOTA: A porcentagem de potência do laser, tensão do detector, ganho e deslocamento variam muito dependendo do fluorohore, intensidade de coloração, intensidade do laser, sensibilidade ao detector, etc. - Para imagens 3D, defina o início e o fim dos esferoides e escolha a intensidade apropriada do sinal em várias profundidades z usando configurações de correção de intensidade z antes da imagem.
NOTA: Para melhor resolução de imagem, use a taxa de amostragem de Nyquist para x, y e z (para detalhes, consulte referência16).
Resultados
Para demonstrar a capacidade deste método de compensação de fornecer imagens bi e tridimensionais de alta qualidade, esferoides com diâmetros de 300-600 μm foram cultivados a partir de Fluorescent ubiquitination baseado Cell Cycle Indicator (FUCCI) linhas celulares de melanoma transduzidas FUCCI-WM164 e FUCCI-WM983b 9,17 , que expressam a monomérica Kusabira Orange2 (mKO2) e a proteína monomérica Azami Green (mAG) quando em Gap1, e a fase S-phase/Gap2/mitosis precoces do ciclo celular, respectivamente, de acordo com procedimentos previstos na etapa 3 1,3,14. Os esferoides foram então fixados com 4% de solução de formaldeído a 37 °C, permeabilizados, e manchados com anti-p27kip1/anti-coelho Alexa Fluor 647 anti-pimonidazol/anti-mouse Alexa Fluor 647, DAPI ou DRAQ7 (ver Tabela de Materiais) (Figura 2). Todos os arquivos de microscopia são carregados no repositório do GitHub (https://github.com/ap-browning/SpheroidMounting). Em comparação com os esferoides montados em PBS, a solução de compensação fornece imagens de alta clareza com distorção de tamanho mínimo (Figura 2A). O protocolo permite imagens de alta resolução de detalhes de nível celular mais profundamente nos esferoides sem seção histológica, e a imagem transversal foi obtida a partir de um objetivo de ar de 20x (0,7 NA) em uma resolução de 4096 x 4096 px sem costura (Figura 2B). Utilizando uma ampliação mais baixa e um objetivo de abertura numérica mais baixa com uma distância de trabalho mais longa, imagens confocal 3D que fornecem detalhes de nível celular a uma profundidade de pelo menos 200 μm podem ser obtidas (Figura 2C). Os esferoides também foram criosedos e manchados conforme o protocolo de Spoerri et al.4 e comparados com manchas esferoides inteiras (Figura 2D,E). A Figura 2D mostra a região hipóxica do esferoide manchada por pimonidazol, e a Figura 2E mostra manchas p27kip1 que marcam a prisão do ciclo celular (amarelo) e a mancha nuclear DAPI (cinza). A localização da proteína e o padrão de coloração são semelhantes entre a criosecção e a limpeza e, portanto, não são afetados por este método de compensação.
A correção da intensidade do sinal em z permite a imagem de todo o esferoide. No entanto, a dispersão de luz devido ao núcleo necrosado limita a capacidade de imagem do lado distante do esferoide. A penetração mais profunda e a menor dispersão de um fluoróforo vermelho distante, como a mancha nuclear DRAQ7, permitem uma representação ainda maior da estrutura esferoide 3D (Figura 3). O filme 1 mostra a renderização 3D dos esferoides FUCCI manchados com DRAQ7. Uma fatia z mais fina pode permitir uma melhor resolução z, mas isso aumenta significativamente o tempo de imagem e o fotobleachamento dos fluoroforos.
Para determinar se a solução de compensação causa distorção de tamanho, doze esferoides em gel 2% agarose-PBS foram imagedos às 6h, 12h, 24h, 72 h e 168 h após a introdução da solução de compensação. As imagens foram resumidas pela determinação do diâmetro do esferoide, definido com base em uma esfera com a mesma área transversal que o esferoide (Figura 4A). Enquanto os esferoides são observados para um leve aumento de tamanho ao longo das primeiras 6 horas, indicados por uma variação de dobra de diâmetro entre 2% e 6% (Figura 4B), após 24h a 72 h, os esferoides retornam a um tamanho aproximadamente igual ao tamanho correspondente na fixação de PBS pós PFA (Figura 4C).
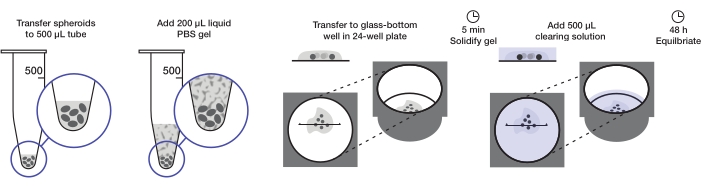
Figura 1: Ilustração do protocolo de montagem e limpeza de esferoides. Esferoides fixos e manchados são transferidos para um tubo de 500 μL; o excesso de fluido é substituído por 200 μL agarose-PBS gel e centrifusado. Os spheroids são então transferidos para um poço de fundo de vidro em uma placa de 24 poços. Depois que o gel é permitido solidificar, a solução de compensação de 500 μL é adicionada e os esferoides são autorizados a equilibrar. Clique aqui para ver uma versão maior desta figura.
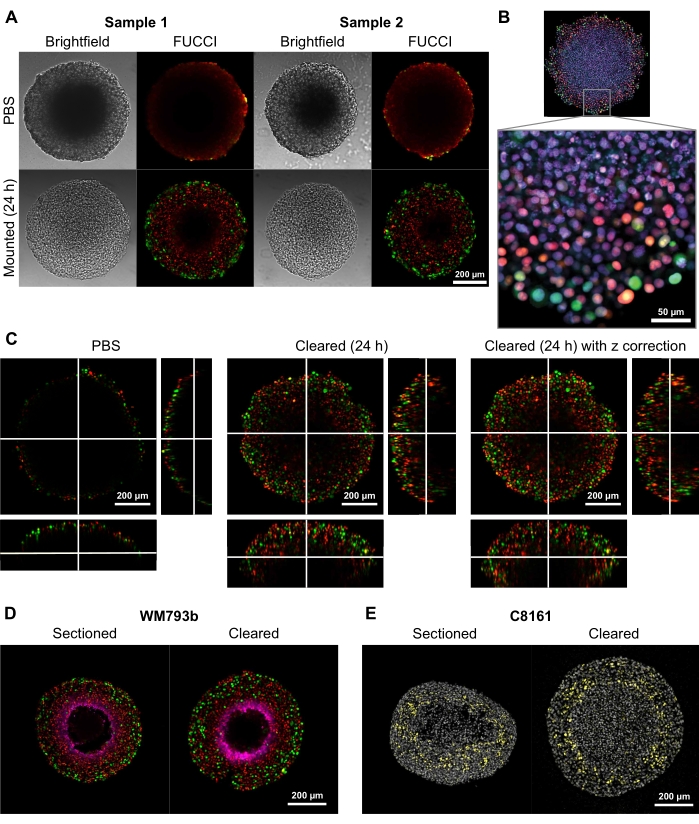
Figura 2: Comparação de esferoides de melanoma humano FUCCI limpos e não esclarecidos. A coloração indica núcleos celulares positivos para mKO2 (vermelho), o que indica células na lacuna 1; e núcleos celulares positivos para mAG (verde), o que indica células em gap 2. (A) Esferoides cultivados a partir de 5000 células FUCCI-WM983b, colhidas no dia 10 e imagens em gel agarose-PBS e 24 horas após a solução de compensação. Comparar imagens brightfield e confocal antes e depois da solução de compensação mostra uma distorção de tamanho mínimo e um grande ganho de clareza. As imagens são obtidas utilizando-se um objetivo de 10x. (B) Spheroids cultivados a partir de células FUCCI-WM164 permeabilizadas usando Triton X-100 e manchadas com DRAQ7, manchando todos os núcleos celulares. A imagem é obtida utilizando-se um objetivo de 20x (0,75 NA), demonstrando que a solução de compensação permite imagens de alta resolução de detalhes de nível celular. (C) imagens 3D (10x, 0,4 NA) foram obtidas de esferoides FUCCI-WM164 em PBS, e 24 horas após a solução de compensação ser adicionada. Ajustar a potência do laser, tensão e deslocamento em diferentes z-plane permite imagens mais profundas dentro do esferoide. (D,E) Comparação entre criosection e esferoide inteiro limpo manchado para pimonidazol e p27kip1. (D) A coloração de pimonidazol em magenta mostra a região hipóxica nos esferoides. Vermelho e verde indicam FUCCI. (E) Cryosections e esferoide limpo mostrando DAPI (cinza) e p27kip1 (amarelo). Clique aqui para ver uma versão maior desta figura.
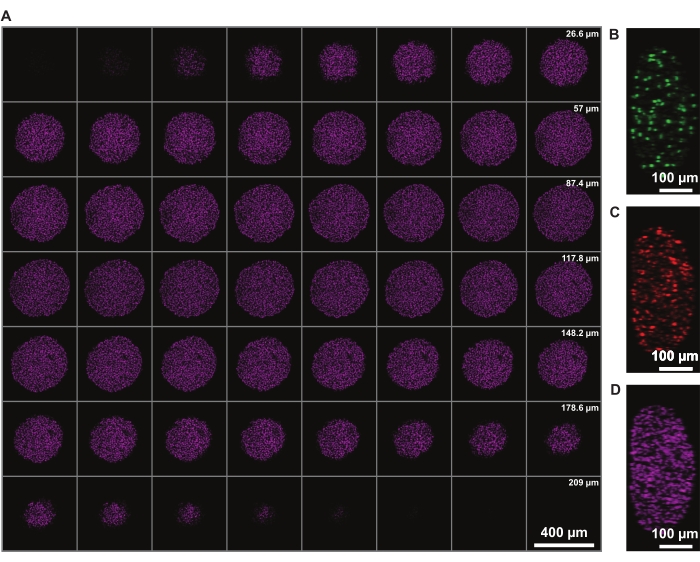
Figura 3: A limpeza permite imagens mais profundas no esferoide com perda mínima de luz. Imagens de microscopia confocal de um esferoide de melanoma humano FUCCI a 10x de ampliação e na inferior (0,4), permitindo imagens em maior profundidade z com perda mínima de sinal. (A) fatias de 3,88 μm de núcleos esferoides manchados com draq7. (B-D) y/z-resolução nos canais 488 (mAG), 568 (mKO2) e 647 nm (DRAQ7), respectivamente. Clique aqui para ver uma versão maior desta figura.
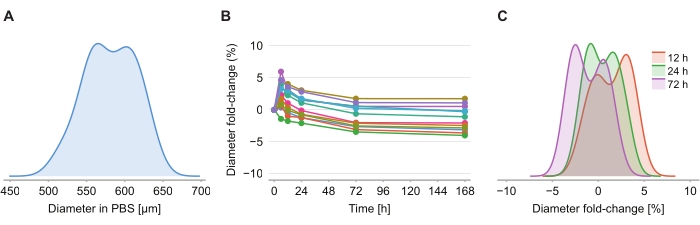
Figura 4: A solução de compensação tem impacto mínimo no tamanho do esferoide. (A) Distribuição do tamanho esferoide inicial (diâmetro equivalente) em gel PBS (n = 12 esferoides). (B) Variação de diâmetro ao longo do tempo desde a adição da solução de compensação. Às 0h, os spheroids estão apenas em gel PBS. (C) Distribuição de dobras de diâmetro a 12h, 24 h e 72 h. Por favor clique aqui para ver uma versão maior desta figura.
Filme 1: Renderização 3D de um esferoide FUCCI manchado com DRAQ7. Clique aqui para baixar este Filme.
Discussão
Um protocolo para a obtenção de imagens bi e tridimensionais de alta qualidade de esferoides tumorais é apresentado aqui. Métodos existentes, como CLARITY, See deep brain (SeeDB) e ScaleS, muitas vezes causam distorção de tamanho em até 30%, enquanto técnicas como Benzyl Alcohol/ Benzyl Benzoate (BABB) e imagem 3D de órgãos desmatados por solventes (3DISCO) podem saciar a proteína fluorescente18. Muitos desses métodos são projetados para limpar tecidos com integridade estrutural e distorcer o tamanho e a estrutura quando aplicados aos esferoides18. Em contraste com outros protocolos que utilizam soluções de compensação caras disponíveis comercialmente, este protocolo utiliza consumíveis prontamente disponíveis, mantendo a clareza óptica e fluorescência endógena e minimizando a distorção do tamanho. A incorporação de esferoides em gel agarose-PBS fornece suporte estrutural para esferoides e minimiza o choque osmótico quando a solução de compensação é adicionada. Isso é crucial quando a imagem de esferoides frágeis pós-tratamento medicamentoso. Supõe-se que este método de compensação óptica é adequado para esferoides formados por qualquer método, uma vez que este protocolo é adaptado de toda a limpeza tecidual. A suposição baseia-se na similaridade nos esferoides obtidos por diferentes métodos de formação esferoide. A escolha da fixação pode afetar o tamanho esferoide, bem como fluorescência endógena. Este método de compensação é adequado para esferoides fixos com solução PFA neutra de 4%. Outros testes são necessários para verificar sua compatibilidade com outros fixativos.
Dado que esta técnica permite que vários esferoides sejam montados simultaneamente em uma placa multi-poço, é bem adequado para dutos de análise quantitativa que requerem informações de estrutura esferoide de até 360 esferoides por placa de 24 poços. Microscópios com funções automatizadas de mapeamento de etapas e placas podem tornar a imagem menos manual. Embora este método seja mais rápido e fácil do que a secção, ele é atualmente inadequado para automação completa. No entanto, as imagens obtidas por este método são adequadas para o processamento automatizado de imagens 4,19, e a taxa na qual os esferoides podem ser montados usando este protocolo empresta à análise quantitativa da estrutura interna esferoide 20,21,22.
Para colorar esferoides inteiros, a concentração de anticorpos, volume e tempo de incubação precisam ser otimizados para cada anticorpo. Como guia, use 2,5x da concentração recomendada de anticorpos de imunofluorescência 2D e 100-200 μL de anticorpos, dependendo do número de esferoides por tubo. Certifique-se de que todos os esferoides estão cobertos pela solução de coloração quando estiverem no rotor. O tempo de incubação depende de muitos fatores, incluindo o tamanho e a densidade dos esferoides e do anticorpo, podendo variar de 16 a 72 h. Apesar do método que permite a detecção de sinal mais profunda dentro do esferoide, fluoroforos animados por UV causam dispersão significativa de luz, levando a uma baixa relação sinal-ruído. Deve-se tomar cuidado ao escolher fluoroforos para visualizar a proteína alvo. Por exemplo, manchas de proteínas menos abundantes e estruturais com lanças de comprimento de onda mais longas e proteínas ou manchas nucleares mais abundantes com lançadores de comprimento de onda mais curtos alcançarão o melhor resultado. Finalmente, os esferoides limpos ainda apresentam perda de luz devido à dispersão no núcleo necrosado, evidente na dimensão y/z das imagens obtidas de 600 μm spheroids (Figura 2C).
Imagens de ampliação mais altas com objetivos de NA mais elevados são possíveis com esferoides montados e limpos usando este protocolo, mas a distância de trabalho do objetivo limita a profundidade de imagem. Para uma lente de imersão em óleo, é importante usar óleo que tenha uma RI de 1,51 para obter o melhor resultado.
Resumindo, o método de compensação incorporado em gel agarose-PBS permite a visualização de células no interior dos esferoides usando consumíveis comumente disponíveis. Os esferoides montados e limpos usando este método sofrem distorção de tamanho mínimo e mantêm sua integridade estrutural, permitindo a coleta de dados de alta qualidade relacionados à estrutura esferoide interna e posterior quantificação automatizada.
Divulgações
O Olympus contribuiu para os custos de publicação.
Agradecimentos
Esta pesquisa foi realizada no Instituto de Pesquisa Translacional (TRI), Woolloongabba, QLD. A TRI é apoiada por uma subvenção do Governo australiano. Agradecemos aos funcionários da instalação do núcleo de microscopia da TRI por seu excelente apoio técnico. Agradecemos ao Prof. Atsushi Miyawaki, RIKEN, Wako-city, Japão, por fornecer as construções da FUCCI, Prof. Meenhard Herlyn e Patricia Brafford, The Wistar Institute, Filadélfia, PA, por fornecer as linhas celulares. Agradecemos à Dra Loredana Spoerri por fornecer imagens de crioseção C8161.
Este trabalho foi apoiado por subsídios de projeto para n.K.H.: Australian Research Council (DP200100177) e Meehan Project Grant (021174 2017002565).
Materiais
| Name | Company | Catalog Number | Comments |
| #1.5 glass bottom 24-well plate | Celvis | P24-1.5H-N | |
| 500 µL clear PCR tubes | Sigma | HS4422 | |
| Alexa Fluor 647 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson Immuno research | 715-605-151 | Dilution used 1:500 |
| Bovine serum albumin | Sigma | A7906 | Final concentration 2% w/v |
| DAPI | Sigma | D9542-10MG | Final concentration 5 µg/mL |
| Deionized water | MILLI Q | ||
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 647 | Thermofisher | A-31573 | Dilution used 1:500 |
| DRAQ7 | Thermofisher | D15106 | Dilution used 1:250 |
| Heating block | Ratek | DBH10 | or similar equipment |
| Hypoxyprobe Kits | Hypoxyprobe | HP1-1000Kit | Antibody dilution used 1:500 |
| Low-melting agarose powder | Sigma | A9414 | Final concentration 2% w/v |
| Microwave | Sharp | ||
| N,N,N′,N′-Tetrakis(2-Hydroxypropyl)ethylenediamine | Sigma | 122262 | Final concentration 9% w/w |
| NaCl | Sigma | S9888 | Final concentration 150 mM |
| NaN3 | Sigma | S2002 | Final concentration 0.10% w/v |
| p27 Kip1 (D69C12) XP | Cell Signalling technology | 3686S | Dilution used 1:500 |
| Paraformaldehyde solution | Proscitech | C004 | Final concentration 4% w/v |
| Phosphate Buffered Saline (PBS) | Thermofisher | 18912014 | Final concentration 1x |
| Pipette | Eppendorf | ||
| Quickspin minifuge | or similar equipment | ||
| Roller | Ratek | BTR10-12V | or similar equipment |
| Rotor | Ratek | RSM7DC | or similar equipment |
| Shaker | Ratek | EOM5 | or similar equipment |
| Sucrose | Sigma | S9378 | Final concentration 44% w/w |
| Tris-HCl pH 7.4 | Sigma | T5941 | Final concentration 20 mM |
| Triton X-100 | Sigma | X100 | Final concentration 0.10% v/v |
| Triton X-100 | Sigma | X100 | Final concentration 0.1% v/v |
| Tween 20 | Sigma | P1379 | Final concentration 0.1% v/v |
| Urea | Sigma | U5379 | Final concentration 22% w/w |
Referências
- Beaumont, K. A., Anfosso, A., Ahmed, F., Weninger, W., Haass, N. K. Imaging- and flow cytometry-based analysis of cell position and the cell cycle in 3D melanoma spheroids. Journal of Visualized Experiments. (106), e53486 (2015).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Smalley, K. S., Lioni, M., Noma, K., Haass, N. K., Herlyn, M. In vitro three-dimensional tumor microenvironment models for anticancer drug discovery. Expert Opinion on Drug Discovery. 3 (1), 1-10 (2008).
- Spoerri, L., Gunasingh, G., Haass, N. K. Fluorescence-based quantitative and spatial analysis of tumour spheroids: A proposed tool to predict patient-specific therapy response. Frontiers in Digital Health. 3, 668390 (2021).
- Nürnberg, E., et al. Routine optical clearing of 3D-cell cultures: Simplicity forward. Frontiers in Molecular Biosciences. 7, 20 (2020).
- Kabadi, P. K., et al. Into the depths: Techniques for in vitro three-dimensional microtissue visualization. BioTechniques. 59 (5), 279-286 (2015).
- Ivanov, D. P., Grabowska, A. M. Spheroid arrays for high-throughput single-cell analysis of spatial patterns and biomarker expression in 3D. Scientific Reports. 7, 41160 (2017).
- Spoerri, L., et al. Phenotypic melanoma heterogeneity is regulated through cell-matrix interaction-dependent changes in tumor microarchitecture. bioRxiv. , (2021).
- Haass, N. K., et al. Real-time cell cycle imaging during melanoma growth, invasion, and drug response. Pigment Cell & Melanoma Research. 27 (5), 764-776 (2014).
- Ahmad, A., et al. Clearing spheroids for 3D fluorescent microscopy: combining safe and soft chemicals with deep convolutional neural network. bioRxiv. , 428996 (2021).
- Villani, T., Rossi, A. E., Sherman, H. Image-based characterization of 3-D cell culture models grown in spheroid microplates. American Laboratory. 50 (6), 12 (2018).
- Lloyd-Lewis, B., et al. Imaging the mammary gland and mammary tumours in 3D: optical tissue clearing and immunofluorescence methods. Breast Cancer Research. 18 (1), 127 (2016).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159 (4), 911-924 (2014).
- Spoerri, L., Beaumont, K. A., Anfosso, A., Haass, N. K. Real-time cell cycle imaging in a 3D cell culture model of melanoma. Methods in Molecular Biology. 1612, 401-416 (2017).
- Cold Spring Harbor. Antibody Dilution Buffer (Abdil). Cold Spring Harbor Protocols. , (2018).
- Pawley, J. B., Pawley, J. B. . Handbook Of Biological Confocal Microscopy. , 20-42 (2006).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132 (3), 487-498 (2008).
- Tian, T., Yang, Z., Li, X. Tissue clearing technique: Recent progress and biomedical applications. Journal of Anatomy. 238 (2), 489-507 (2021).
- Browning, A. P., Murphy, R. J. . Zenodo. , (2021).
- Browning, A. P., et al. Quantitative analysis of tumour spheroid structure. eLife. 10, 73020 (2021).
- Klowss, J. J., et al. A stochastic mathematical model of 4D tumour spheroids with real-time fluorescent cell cycle labelling. Journal of The Royal Society Interface. 19 (189), 20210903 (2022).
- Murphy, R. J., Browning, A. P., Gunasingh, G., Haass, N. K., Simpson, M. J. Designing and interpreting 4D tumour spheroid experiments. Communications Biology. 5 (1), 91 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados