通过荧光体积排阻色谱快速评估膜蛋白质量
In This Article
Summary
本协议描述了对膜蛋白进行荧光体积排阻色谱(FSEC)的程序,以评估其用于下游功能和结构分析的质量。介绍了在洗涤剂溶解和无洗涤剂条件下收集的几种G蛋白偶联受体(GPCR)的代表性FSEC结果。
Abstract
在膜蛋白结构解析和生物物理表征过程中,通常会尝试许多包含不同标签、截断、缺失、融合伴侣插入和稳定突变的蛋白质构建体,以找到从膜中提取后未聚集的蛋白质构建体。此外,缓冲液筛选以确定为膜蛋白提供最稳定条件的去垢剂、添加剂、配体或聚合物是一项重要的实践。通过荧光体积排阻色谱法对膜蛋白质量进行早期表征提供了一种强大的工具,无需蛋白质纯化即可评估和分级不同的构建体或条件,并且该工具还最大限度地减少了样品需求。膜蛋白必须进行荧光标记,通常通过用GFP标签或类似标签表达它们。蛋白质可以直接从全细胞中溶解,然后通过离心粗略澄清;随后,将蛋白质传递到尺寸排阻柱中,并收集荧光痕量。本文介绍了一种运行FSEC的方法,并在GPCR靶向鞘氨醇-1-磷酸受体(S1PR1)和5-羟色胺受体(5HT2AR)上具有代表性的FSEC数据。
Introduction
体积排阻色谱(SEC),也称为凝胶过滤色谱法,通常用于蛋白质科学1。在SEC期间,蛋白质根据其流体动力学半径进行分离,该半径是蛋白质大小和形状的函数2。简而言之,这种分离是通过将流动下的蛋白质样品施加到充当分子筛的多孔珠子填充床上来实现的。使用的磁珠通常是交联琼脂糖,具有确定的孔径范围,以允许蛋白质进入或排除珠子的孔3,4,5,6,7。具有较小流体动力学半径的蛋白质在孔内花费的时间比例更大,因此以较慢的速度流过填充床,而较大的蛋白质在珠子外花费的时间比例更大(排除的体积)并以更快的速度通过填充床。当使用制备柱时,SEC可用作蛋白质纯化步骤1。当使用分析柱时,SEC可用于分析蛋白质的质量和性质2。例如,样品中可能存在的蛋白质聚集体表明蛋白质质量差,往往非常大,这意味着它们仅在排除的体积中移动,因此最早从色谱柱中洗脱;此体积称为列空隙或空隙体积。此外,分子量标准品可用于校准色谱柱,允许从标准曲线插值目标蛋白质的估计分子量。
通常,280 nm处的蛋白质吸光度用于监测尺寸排阻柱的蛋白质洗脱。这限制了SEC作为分析工具的使用,直到目标蛋白质基本上没有污染蛋白质,例如,在蛋白质纯化的最后一步。然而,荧光SEC(FSEC)利用荧光标记的目标蛋白质。因此,荧光信号可用于在其他蛋白质甚至粗混合物存在的情况下特异性监测目标蛋白质的洗脱情况8,9。此外,由于荧光信号高度灵敏,因此可以对蛋白质含量极低的样品进行成功的分析。目标蛋白通常通过在表达构建体中加入绿色荧光蛋白(GFP)或增强型GFP(eGFP)标签进行荧光标记。然后可以通过在395nm或488nm处激发荧光信号来监测荧光信号,并分别检测GFP或eGFP在509nm或507nm处的荧光发射10。
使用荧光信号监测SEC色谱柱的蛋白质洗脱的优点使FSEC成为分析膜蛋白样品的宝贵工具,当表达水平与可溶性蛋白相比特别差时。至关重要的是,膜蛋白的质量和性质可以在从粗裂解物中溶解后直接进行分析,而无需首先优化纯化过程11,12。由于这些原因,FSEC可用于快速分析膜蛋白质量,同时探索改善溶液中膜蛋白行为可能需要的不同因素。例如,通常会尝试包含不同标签、截断、缺失、融合伴侣插入和稳定突变的大量构建体,以找到从膜中提取后未聚集的构建体13,14。此外,缓冲液筛选以确定为膜蛋白提供最稳定条件的去垢剂、添加剂、配体或聚合物,可以确定蛋白质纯化或为下游用途(如生物物理测定或结构表征)提供稳定性的最佳缓冲液组成。
因此,FSEC方法的总体目标是收集目标膜蛋白的SEC色谱柱洗脱曲线。此外,由于使用荧光,在进行任何长时间的纯化之前,在优化构建体和条件的尽可能早的点收集该SEC迹线。FSEC痕量可用作比较工具,以判断使用不同缓冲条件或膜蛋白构建体纯化膜蛋白的成功可能性。通过这种方式,FSEC图谱的收集可以用作快速迭代过程,以在花费精力生成其他分析方法所需的纯蛋白质量之前获得最佳构建体设计和缓冲液组成。
Protocol
1. FSEC的洗涤剂和缓冲液制备
- 准备洗涤剂储备溶液。
- 要制备 20 mL 储备溶液,称取 4 g 十二烷基麦芽糖苷 (DDM) 粉末和 0.4 g 胆固醇半琥珀酸酯 (CHS) 粉末,然后用实验室级蒸馏 H2O 制备至 20 mL。
- 加入所有组分后,在4°C下以端到端倒置混合,直到组分完全溶解。建议在4°C下进行过夜端到端混合。
- 分装并将洗涤剂原料储存在-20°C直至使用。如果需要立即使用高汤,请将洗涤剂原料存放在冰上。
注意:这项工作中使用的标准洗涤剂原料是20%(w / v)DDM和2%(w / v)CHS混合物(见 材料表)。可以使用不同的洗涤剂(例如,月桂基麦芽糖新戊二醇;LMNG),或者使用苯乙烯-马来酸(SMA)等聚合物进行无洗涤剂萃取。这需要在设计要测试的实验条件时确定。
- 准备增溶缓冲液。
- 通过组合正确的重量或体积的组分来制备增溶缓冲液,以在烧杯中达到 100 mM HEPES、200 mM NaCl、20 % (v/v) 甘油和 1x 蛋白酶抑制剂混合物(参见 材料表)。
注意:在本研究中,制备50 mL增溶缓冲液足以处理五个样品。 - 向烧杯中加入 0.7 体积(例如,如果制成 50 mL 缓冲液,则为 35 mL)实验室级蒸馏 H2O。
- 在磁力搅拌器上混合,并使用pH计,通过滴加浓NaOH将缓冲液pH调节至7.5。
- 使用测量钢瓶,用实验室级蒸馏的 H2O 将缓冲液加满至最终所需体积。
- 通过组合正确的重量或体积的组分来制备增溶缓冲液,以在烧杯中达到 100 mM HEPES、200 mM NaCl、20 % (v/v) 甘油和 1x 蛋白酶抑制剂混合物(参见 材料表)。
- 准备 SEC 电泳缓冲液。
- 通过合并正确的重量或体积的组分来制备SEC电泳缓冲液,以在烧杯中达到100 mM HEPES,150 mM NaCl和10%(v / v)甘油的最终浓度。
注意:在本研究中,制备600 mL SEC缓冲液足以运行五个样品。 - 向烧杯中加入 0.7 体积(例如,如果制备 600 mL 缓冲液,则为 420 mL)的实验室级蒸馏 H2O。
- 在磁力搅拌器上混合,并使用pH计,通过滴加浓NaOH将缓冲液pH调节至7.5。
- 使用测量钢瓶,用实验室级蒸馏的 H2O 将缓冲液加满至最终所需体积。
- 在真空下通过瓶顶0.45μm孔过滤器过滤SEC缓冲液(参见 材料表)。
- 缓冲液通过过滤器后,将其留在真空下进行脱气,直到摇晃时不再出现气泡。
- 通过添加步骤1中制备的所需体积的洗涤剂原液,向SEC缓冲液中加入终浓度为0.03%(w/v)DDM和0.003%(w/v)CHS(例如,如果制成600 mLSEC缓冲液,则为0.9 mL)。
- 使用前预冷缓冲液。
注意:根据测试的条件,可以使用不同的缓冲液。例如,如果测试不同去垢剂对目标蛋白质的影响,理想情况下需要制造与用于溶解蛋白质的去垢剂相同的缓冲液。如果使用SMA测试无洗涤剂条件,则应从SEC缓冲液中完全省略去去洗涤剂。但是,有关洗涤剂筛选方案修改的更多详细信息,请参阅讨论部分。
- 通过合并正确的重量或体积的组分来制备SEC电泳缓冲液,以在烧杯中达到100 mM HEPES,150 mM NaCl和10%(v / v)甘油的最终浓度。
2. FSEC的样品制备
- 准备细胞沉淀。
注意:测定的起点是从目标的GFP标记(或其他荧光标记)蛋白的悬浮细胞表达培养物中收获细胞沉淀。收获的确切时间和条件将取决于所表达的蛋白质、使用的细胞系、细胞生长的条件以及诱导蛋白质表达的方法。这些细节超出了本协议的范围。在本研究中,每个待测试条件使用 0.5-1 g Sf21 细胞沉淀,相当于感染后 2-3 天用大约 4 x 106 活细胞/mL 的 P2 杆状病毒的 1:20 稀释度培养物 25-50 mL。请注意,此处描述的方案已经过测试,发现与其他真核细胞系(例如HEK293E)的类似湿重细胞沉淀同样有效。- 当悬浮培养物中的细胞准备好收获时,将 25-50 mL 培养物等分试样转移到 50 mL 锥形管中。
- 平衡管,并在室温下以2,000×g在外摆式桶(参见材料表)中使用台式离心机15分钟以沉淀细胞。
- 轻轻倾倒培养物上清液,将其取出并丢弃,如果细胞沉淀特别松散,则使用带有移液管填充剂的 50 mL 移液管。
- 如果细胞将立即用于分析,请将细胞沉淀放在冰上,然后直接进入步骤5。如果要保存细胞以供以后使用,请将细胞置于-80°C冷冻。
- 如果细胞沉淀已储存在-80°C,则通过在室温下孵育15分钟或直到样品不再冷冻来快速解冻。按照此步骤立即将样品移动到冰上。
- 重悬并溶解样品。
- 向细胞沉淀中加入2mL增溶缓冲液(步骤1.2)。
- 在4°C下以端到端倒置孵育15-30分钟,直到均匀。
- 加入预混合洗涤剂原液(步骤 1.1)(例如,100 μL 20% DDM/2% CHS 原液),最终浓度为 1% DDM/0.1% CHS。
- 在4°C下以端对端倒置溶解30分钟。
注意:如果需要,可以并行测试多个条件。一次可以处理的并行样品数量将取决于可用于运行SEC实验的系统。在这里描述的设置中,一次最多可以处理五个样品。
- 执行低速离心步骤。
- 将样品在预冷(4°C)台式离心机中以2,000× g 离心15分钟。
- 执行高速离心步骤。
- 使用连接到 5 mL 注射器的钝头将上清液从低速离心液转移到超速离心管(例如,0.5-2 mL 管),注意不要干扰低速旋转的沉淀。
- 将试管对平衡至0.05 g以内,并将它们放置在固定角度的超速离心转子中(参见 材料表)。
- 在4°C下以250,000× g离心30分钟。
3. 体积排阻色谱
- 制备快速蛋白液相色谱(FPLC)系统,并平衡色谱柱。
- 按照制造商的说明(参见 材料表)准备系统,例如,向系统填充SEC缓冲液并吹扫泵中的空气。
- 将SEC色谱柱连接到FPLC,确保没有空气进入色谱柱。这是通过使用装满水的注射器(连接到柱底)对SEC色谱柱施加背压来实现的,以便与FPLC系统的流路进行液滴到液滴的连接。
- 首先在1.5柱体积(24 mL色谱柱为36 mL)的实验室级蒸馏和过滤H2O中洗涤SEC色谱柱,然后以1.5柱体积的SEC缓冲液以推荐的色谱柱流速和压力洗涤SEC色谱柱(参见 材料表)。
注意:本研究中使用的用于执行FSEC的FPLC系统处于寒冷环境中,并安装了五位回路阀和六位板馏分收集器。此设置允许以自动方式在同一色谱柱上加载和顺序运行五个样品,而无需在两次运行之间进行手动干预。为了运行SEC实验,使用了市售的预包装24 mL色谱柱(参见 材料表),其中含有一种树脂,可以分离分子量范围为10-600 kDa的蛋白质。如果感兴趣的蛋白质特别大,则可以使用替代柱基质,从而分离分子量高达5,000 kDa的蛋白质。请注意,洗涤剂/脂质胶束的存在会使膜蛋白的总大小增加 >150 kDa,具体取决于所使用的蛋白质和洗涤剂。
- 将样品应用于色谱柱,然后运行 SEC 实验。
- 使用连接到注射器的钝头将上清液从高速离心步骤转移到1 mL注射器中。这允许在不干扰沉淀的情况下从离心管中回收样品。
- 将示例循环设置为加载。通过将注射器中的 600-700 μL 样品注入上样口,使 500 μL 样品环过量填充。根据所使用的系统,可以将此加载步骤编程到方法中,以确保不会出错。
- 在方法过程中,用4 mL SEC缓冲液以推荐的色谱柱流速和压力清空样品,将样品从环中注入色谱柱(参见 材料表)。
- 以相同的流速运行色谱柱,直到1.5色谱柱体积(24 mL色谱柱为36 mL)的缓冲液通过。
- 在柱体积的0.25(24 mL色谱柱为6 mL)时,开始收集0.2 mL馏分,以收集90个馏分。
注意:由于色谱柱的空隙体积预计为0.3色谱柱体积,因此在此之前开始收集馏分可确保监测所有蛋白质的洗脱,包括空隙体积中存在的任何蛋白质。
4. 荧光痕量采集与分析
- 将样品从馏分收集器(步骤3.2.5)转移到96孔板中,并读取荧光信号。
- 在获取荧光读数之前,稀释收集的样品。使用多通道移液器,将 90 μL 实验室级蒸馏 H2O 从储液器转移到不透明平底 96 孔板的每个孔中(参见 材料表)。
- 如果在步骤 3.2.5 期间将馏分收集到 96 孔模块中,请使用多通道移液器将 10 μL SEC 级分从模块转移到不透明的平底 96 孔板中,并通过上下移液进行混合。否则,如果在步骤3.2.5期间将SEC级分收集到单个管中,则将每个级分的10μL逐个转移到不透明的平底96孔板中,每次上下移液以混合样品。
- 将不透明的平底96孔板放入读板器中,并测量荧光。如果GFP是荧光标记(此处使用),请将激发设置为尽可能接近488 nm,并检测荧光发射尽可能接近507 nm。
注意:在获取荧光读数之前所需的稀释度将取决于表达培养物中存在的目标蛋白质的总量以及所用酶标器的灵敏度。在本研究所示的示例中,将样品在水中稀释10倍。作为起点的建议,在检测前,应将馏分在水或缓冲液中稀释5-10倍。如果记录的FSEC迹线信号特别低,则可以使用较小的稀释度甚至未稀释的样品代替。本研究中用于检测的装置是能够在488nm处激发并在507nm处检测荧光发射的酶标仪(见 材料表)。
- 绘制 FSEC 轨迹。
- 以原始格式(原始文本或逗号分隔值文件)从酶标仪导出数据。这些原始数据将绘制在 FSEC 迹线的 Y 轴上。
- 对于 X 轴,计算收集每个馏分的体积。第一个孔需要是收集第一级分时的洗脱体积,以考虑分馏延迟(本例中为6 mL)。在此之后的馏分必须按收集的馏分体积(本例中为 0.2 mL)依次增加。
- 计算完X轴和Y轴数据后,将数据复制并粘贴到绘图软件中(参见 材料表),以便根据荧光信号从色谱柱洗脱的体积绘制每个孔中的荧光信号。
注意: 图1 显示了运行FSEC实验所需步骤的示意图。
- 分析 FSEC 跟踪。
- 评估空隙体积处的蛋白质洗脱量(24 mL色谱柱约为8 mL),这表明蛋白质体积非常大,并且可能展开/聚集。
- 评估以后任何峰中洗脱的蛋白质量,这表明蛋白质折叠。对于24 mL色谱柱,预计该值在10 mL至16 mL之间,具体取决于蛋白质大小(与去垢剂/脂质胶束相关时)。请密切注意峰形,特别是如果峰跨度大于3-4 mL(对于24 mL色谱柱),因为这表明是多分散样品。
- 通过将单体峰中记录的最大信号除以空隙峰中的最大信号来计算单体峰高度与空隙峰高度之间的比率。
注意:该值代表单分散指数,可以定量测量蛋白质质量;较大的值表示最佳质量,而小于 1 的值表示有问题的样品,因为它们的聚集蛋白比折叠蛋白多。 - 如果要比较多个FSEC运行,并且最重要的特征是每种情况下的单体量,请将迹线绘制为酶标仪记录的原始信号(例如RFU)。
注意:如果单体的量与未折叠蛋白质的比较更重要,则必须使用迹线中的最小和最大读数将信号标准化为总信号的百分比,这将加剧痕量之间聚集蛋白和单体蛋白之间比例的差异。
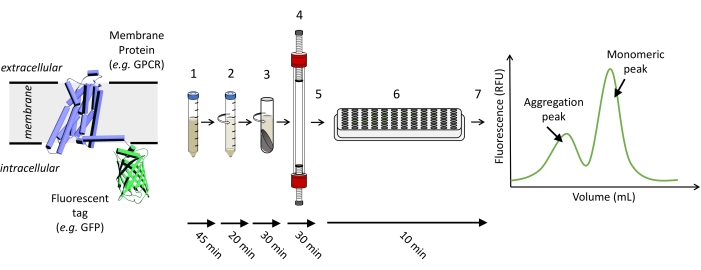
图 1:运行 FSEC 实验所需步骤的示意图。 (1)表达目标荧光标记蛋白的细胞被溶解。(2)粗增溶首先用低速自旋澄清,然后(3)高速自溶。(4)将澄清的样品上清液加载并在适当的SEC柱上运行,以及(5)收集馏分。(6) 将馏分样品转移到 96 孔板中,并使用读板器检测 GFP 荧光信号以 (7) 绘制 FSEC 迹线。请点击此处查看此图的大图。
Representative Results
首先,研究了本研究中使用的酶标仪eGFP检测的动态范围和下限。将已知浓度的纯化eGFP标准品在50 μL最终体积中稀释至50 ng·μL−1、25 ng·μL−1、12.5 ng·μL−1、6.25 ng·μL−1、3.125 ng·μL−1、1.5625 ng·μL−1、0.78125 ng·μL−1和0.390625 ng·μL−1,并使用488 nm的激发和507 nm的发射读取荧光(图2).该实验表明,在信号饱和之前,酶标仪的检测下限为每孔30 ng的eGFP标记蛋白,每孔的eGFP标记蛋白的动态范围高达500 ng。使用该下限值并假设蛋白质洗脱限制在色谱柱体积的0.33以内,SEC色谱柱上样只需1.28 μg目标eGFP标记蛋白,即可观察到可检测的FSEC信号。
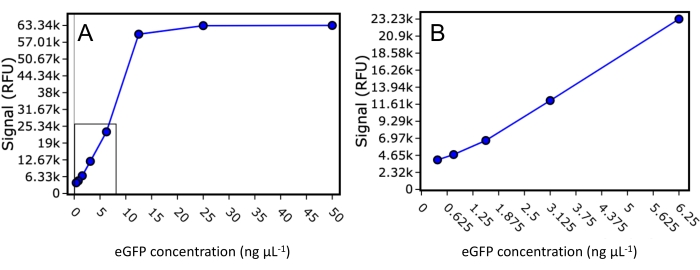
图 2:eGFP 标准曲线。纯化的eGFP标准品的荧光信号散射图,稀释至50 ng·μL−1、25 ng·μL−1、12.5 ng·μL−1、6.25 ng·μL−1、3.125 ng·μL−1、1.5625 ng·μL−1、0.78125和0.390625 ng·μL−1。(A) 显示所有稀释液,包括带有饱和信号的稀释液。(B) 放大散点图,仅包括落入读板器动态范围内的标准品。请点击此处查看此图的大图。
其次,使用分子量标准品校准用于本研究的24 mL色谱柱。使用与FSEC分析相同的缓冲液和运行条件,分别进样分子量标准品蓝色葡聚糖(>2,000 kDa)、铁蛋白(440 kDa)、醛缩酶(158 kDa)、白蛋白(75 kDa)和卵清蛋白(43 kDa)并通过色谱柱,并在280 nm吸收下收集洗脱迹线。记录的洗脱体积分别为8.9 mL、12.4 mL、15.2 mL、16.9 mL和18 mL。当将这些洗脱体积转换为Kav (公式1)并绘制与对数分子量的关系图时,可以拟合标准曲线。这允许通过标准曲线的插值来估计本研究中测试的GPCR的分子量(图3)。例如,在洗涤剂DDM中溶解后,GPCR血清素受体2A(5HT2AR)的FSEC迹线表明洗脱体积为13.4mL。该5HT2AR洗脱体积介于铁蛋白和醛缩酶记录的洗脱体积之间,估计分子量约为300 kDa。本研究中使用的5HT2AR构建体约为50 kDa(包括eGFP标签),这意味着如果假设5HT2AR是单体的,则250 kDa的分子量可归因于DDM洗涤剂/脂质胶束。洗脱体积的转换公式如下(公式1):
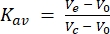 (公式1)
(公式1)
其中V e是洗脱体积,V 0是色谱柱空隙体积,Vc是总柱体积。
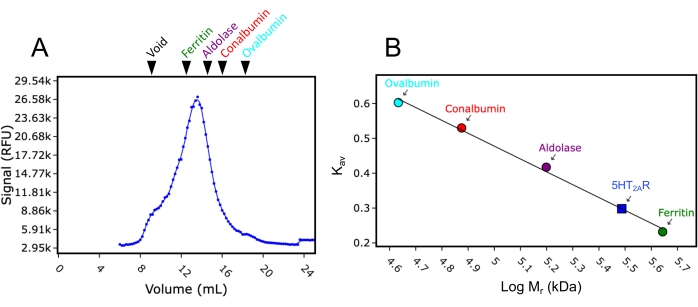
图3:使用分子量标准品的SEC色谱柱的校准曲线。 (A)在DDM中溶解的具有代表性的FSEC痕量5HT2AR,标示分子量标准品蓝色葡聚糖(Void)、铁蛋白、醛缩酶、白蛋白和卵清蛋白的相对洗脱位置。铁蛋白、醛缩酶、白蛋白和卵清蛋白分别呈绿色、紫色、红色和青色。(B)使用转换为Kav(公式1)后标准品的洗脱位置与对数分子量(Mr)绘制的分子量校准曲线。DDM中5HT2AR的Mr使用Kav从曲线插值,并显示在曲线上(蓝色方块)。请点击此处查看此图的大图。
然后使用FSEC评估GPCR鞘氨醇-1-磷酸受体(S1PR1)的质量和性质15。如协议中所述,对表达GFP标记的人S1PR 1的昆虫细胞进行FSEC处理(图1)。
首先,通过测试洗涤剂DDM和LMNG与SMA无洗涤剂萃取的对比,探索最佳的膜提取条件(图4A)。单分散指数用于评估蛋白质样品的质量以及空隙中蛋白质(~8 mL色谱柱保留)与单分散样品(14-15 mL色谱柱保留)之间的比率。在LMNG中溶解的样品表现出优异的FSEC谱,具有更好的单体峰形和较低的蛋白质聚集峰,表明LMNG中的增溶和纯化是该膜蛋白最稳定的条件。相比之下,在DDM中溶解的样品具有相对较差的FSEC谱,具有较大的聚集峰和更宽的单体峰,表明样品中的多分散性。
其次,通过在增溶过程中向样品中添加鞘氨醇-1-磷酸(S1P)来研究配体添加对FSEC谱的影响。在这种情况下,使用DDM作为增溶试剂,并比较S1PR1 在存在和不存在S1P的情况下的FSEC痕迹(图4B)。在S1P存在下溶解的样品显示出更好的FSEC痕量,聚集减少。这表明在配体存在下纯化有利于通过稳定溶液中的受体来提高蛋白质样品质量,但作为蛋白质活性的替代标志物也是有利的,因为结果表明蛋白质正确折叠并且能够结合配体。
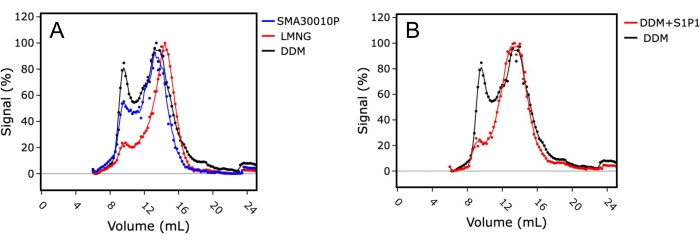
图 4:使用 S1PR1 的粗提取物的 FSEC 表明最佳膜提取条件和配体结合。 (A) 溶解在苯乙烯-马来酸共聚物 (SMA; 蓝色)、月桂基麦芽糖新戊二醇 (LMNG; 红色) 或十二烷基麦芽糖苷 (DDM; 黑色) 中的 FSEC 痕量比较。(B)在存在(红色)或不存在(黑色)激动剂鞘氨醇-1-磷酸(S1P)的情况下溶解在DDM中的FSEC痕迹S1PR1的比较。请点击此处查看此图的大图。
FSEC还用于研究5HT2AR在不同条件下的长期稳定性。将GFP标记的人5HT 2A R从昆虫细胞膜中溶解在洗涤剂(DDM)或SMA聚合物中,并在4°C或室温下储存后的几个时间点通过FSEC进行分析(图5)。孵育数天后,DDM中的5HT2AR在任一温度下单体峰高均显著下降,聚集峰显著增加。相比之下,SMA脂质颗粒(SMALP)中的5HT2AR在实验过程中没有显示出单体峰高的显着下降,这表明SMALP中的蛋白质即使在不利的温度下也能保持更长时间的稳定。在考虑用于下游生物物理应用的蛋白质制备时,这可能很重要,例如表面等离子体共振(SPR)实验,因为需要样品在很长一段时间内保持稳定和活性才能成功完成结合实验。
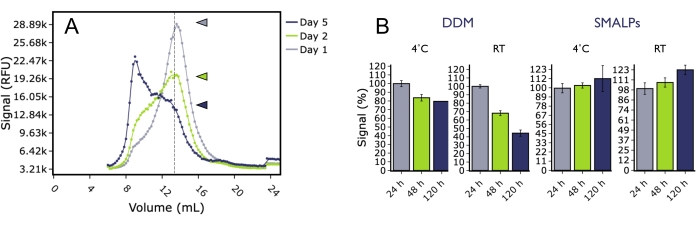
图 5:时间和温度对使用 DDM 或 SMALP 从膜中提取的 5HT2AR 质量的影响,由 FSEC 分析。 (A) 溶解在 DDM 中并在室温下储存 1 天(灰色)、2 天(绿色)或 5 天(蓝色)的代表性 FSEC 痕迹。(B)在4°C(蓝色)或RT(绿色)下储存的DDM样品与在4°C(灰色)或RT(黑色)下储存的SMALP样品的标准化单体峰高的直方图。误差线代表 SEM。 请点击此处查看此图的大图。
Discussion
这里介绍的FSEC条件筛选通用系统方法允许快速优化膜蛋白生产的增溶和纯化参数。这意味着可以快速生产稳定且具有功能活性的膜蛋白,用于生物物理和结构研究。此外,FSEC可以使用膜蛋白实验室中可能已经到位的实验室设备进行运行,因此,无需购买专业仪器即可运行测定。
关键步骤
从去垢剂中的细胞溶解点到样品通过SEC色谱柱(步骤2.1.5-3.2.5)所需的时间是时间关键,这些步骤之间不得有停顿。所有步骤都应在4°C或冰上进行,并且执行这些步骤所需的时间需要保持在尽可能少。这些时间和温度限制对于在任何潜在的展开或降解之前记录膜蛋白的FSEC谱是必要的。膜蛋白溶解后,即使在4°C下,也存在更大的展开,聚集和降解风险。理想情况下,要比较FSEC迹线的任何样品都应在增溶步骤后的相同时间内通过SEC色谱柱。在实践中,这很困难,特别是如果样品按顺序沿单根色谱柱向下传递,但可以在3小时内收集多达5条SEC迹线,并且在此时间范围内,不应有明显的降解。
故障 排除
如果在进行FSEC实验时,荧光信号低或没有荧光信号,则目标膜蛋白可能未表达所选细胞系,所选细胞系的表达非常低,或者未溶解在所选去垢剂中。如果在收集荧光信号并记录FSEC迹线之前稀释样品,则简单的第一步是尝试较低的稀释度或不稀释SEC馏分。如果这仍然不能产生可解释的FSEC痕迹,则应检查蛋白质的表达和溶解。
蛋白质表达的分析可以通过在步骤2.2.2之后检查样品的荧光来实现。如果该样品的荧光信号非常低或没有荧光信号(例如,非常接近背景的信号),则蛋白质表达可能存在问题。可以采取措施提高膜蛋白的表达水平,例如切换到替代细胞系或调整生长条件、诱导表达以及诱导/感染/转染与收获之间的时间。然而,特别差的蛋白质表达可能表明膜蛋白不稳定,因此构建体选择不佳。
如果在FSEC之前已经检查了表达并且背景上方有清晰的荧光信号,则可以通过测量步骤2.4.3(可溶性膜蛋白)后样品的剩余荧光信号与步骤2.2.2(总蛋白)之后的样品进行比较来检查增溶效率。溶解效率通常为20%-30%,并且仍然可以成功分析和纯化膜蛋白。但是,如果增溶效率低于20%,则可能需要不同的去溶剂进行增溶或不同的增溶条件。如果改善增溶性的尝试不成功,这可能表明膜蛋白特别不稳定,因此构建体选择不佳。
如果在FSEC痕量中观察到非常晚的洗脱峰(例如,18-24 mL),则表明荧光蛋白的蛋白质分子量远低于预期。这可能是由于感兴趣的膜蛋白被降解,导致“游离”GFP。应使用凝胶内GFP荧光在溶解前后检查蛋白质是否完整。如果感兴趣的蛋白质确实看起来正在降解或被蛋白水解,蛋白酶抑制剂的量可以增加两倍至四倍。然而,即使在溶解之前,对蛋白酶或降解蛋白的高敏感性也可能表明蛋白质特别不稳定,因此构建体选择不佳。
FSEC的修改和进一步应用
通常,FSEC中使用的荧光标签是GFP或eGFP,如本协议中所述。然而,有许多不同的荧光蛋白标签可用。要使用的荧光标签的选择取决于具有能够实现正确激发和发射参数的酶标仪,以记录所选荧光标签的荧光信号,并且具有在不同环境条件下量子产率几乎没有变化的荧光团。此外,FSEC不仅限于荧光蛋白,还可以与用荧光染料标记的蛋白质同样有效。例如,可以使用NTA染料,该染料将有利地与组氨酸标记的膜蛋白构建体结合。此外,用荧光染料化学标记并特异性结合目标膜蛋白的荧光标记抗体或膜蛋白构建体中包含的纯化标签都可以间接标记FSEC的靶标。
使用FSEC进行去垢剂筛选时,可以选择用于运行SEC色谱柱的缓冲液是否应包含蛋白质已溶解的匹配去垢剂,或者是否应在所有运行中使用标准去垢剂。如果整个实验全程使用匹配的洗涤剂进行,则将获得蛋白质行为的更准确表示。但是,如果在每次运行之前必须在新的洗涤剂中重新平衡色谱柱,则可能会非常耗时且浪费去垢剂。此外,由于洗涤剂筛选的主要目的是比较迹线,因此即使条件不理想,趋势也会保留在迹线中。因此,可以达成折衷方案,即蛋白质溶解在目标去垢剂中,但色谱柱在所有运行过程中使用单一去垢剂在标准缓冲液中运行(例如DDM)11,这可以节省时间和去垢剂耗材。
通过修改所使用的FLPC设备,可以显著提高FSEC方案的通量,并将样品需求降至最低。例如,FPLC或HPLC系统可以配备自动进样器、较小的床体积分析柱(例如3.2 mL分析SEC色谱柱)和在线荧光检测器,用于直接从色谱柱监测连续的FSEC迹线。由此产生的设置将允许在更短的时间内执行更多的FSEC运行,并消除手动绘图步骤,从而允许在更短的时间内测试更多的条件。此外,样品要求将进一步降低,因为每次运行需要制备和加载到FSEC色谱柱上的样品更少。这将为将表达培养物减少到基于板的形式开辟可能性,因为分析所需的材料很少。
与其他方法相比,FSEC的优势和劣势
FSEC的一个缺点是需要设计膜蛋白构建体以引入荧光标记,并且在引入时,标记物的位置可能会干扰目标膜蛋白的功能或折叠的可能性很小。此外,如此处所述,FSEC方案在细胞裂解物(蛋白质的粗混合物)存在下监测膜蛋白的特性。膜蛋白在这种环境中的行为可能与在纯化结束时将目标膜蛋白与其他蛋白质完全分离时经受制备型SEC色谱柱时的行为不同。此外,FSEC提供了蛋白质质量的定性衡量标准。然而,通过将FSEC痕量转换为单分散指数,如协议的步骤4.3.3中所述,可以获得蛋白质质量的定量测量。
FSEC并不是唯一可用于膜蛋白构建体、增溶条件和纯化缓冲液组成的早期分析的方法。与FSEC相比,替代方法既有优点也有缺点。例如,存在基于荧光团的热稳定性测定,特别是使用染料7-二乙氨基-3-(4′-马来酰亚胺基苯基)-4-甲基香豆素(CPM)16,17。这种方法的优点是,与提供蛋白质质量定性测量的FSEC不同,热稳定性测定以相对熔解温度的形式提供定量测量。此外,不需要在蛋白质构建体上引入荧光标签。然而,与FSEC相比,热稳定性测定的缺点是必须使用纯化的蛋白质,并且该测定与所有蛋白质构建体不兼容,因为它依赖于折叠蛋白质中天然半胱氨酸残基的优势位置。
另一种与FSEC和基于荧光团的热稳定性测定有相似之处的方法是测量膜蛋白的温度灵敏度的测定。在该测定中,蛋白质受到不同温度的挑战,并且检测离心后残留在溶液中的蛋白质。该方法的检测以多种方式进行,包括测量溶液18中的荧光、SDS-PAGE凝胶带19的荧光或蛋白质印迹20中的信号强度。然而,这些方法的一个显着缺点是该测定非常劳动密集型,并且结果中容易产生高噪声,因为每个单独的温度点必须独立收集。
最后,可以使用几种更先进的生物物理技术以类似于FSEC的方式评估膜蛋白质量,例如,流诱导分散分析21,微尺度热泳22或SPR。虽然这些方法非常强大,但缺点是需要高度专业化的仪器来运行分析。
总之,FSEC为膜蛋白生产活动提供了宝贵的工具,尽管它不是唯一的选择,但它与其他方法相比具有几个明显的优势,如上所述。始终建议通过正交测定对结果进行交叉验证,并且上面讨论的方法都不是相互排斥的。
Disclosures
Peak Protein是一家合同研究组织,提供收费的蛋白质表达、纯化、质谱和结构测定。
Acknowledgements
我们要感谢整个Peak Protein团队的帮助和支持。来自细胞科学团队,我们要感谢Ian Hampton在昆虫细胞表达方面的宝贵见解和指导。我们要感谢Mark Abbott提供资源和机会来开展这个项目。
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL and 5 mL plastic syringes | Generic | - | Syringes for transfer of samples |
| 10x EDTA Free Protease inhibitor cocktail | Abcam | ab201111 | Protease inhibitors |
| 15 mL tubes | Generic | - | 15 mL tubes for pellet preparation and solubilisation |
| 2 mL ultra-centrifuge tubes | Beckman Coulter | 344625 | Tubes for ultra-centrifuge rotor |
| 50 mL tubes | Generic | - | 50 mL tubes for cell harvest |
| 96 deep-well blocks | Greiner | 15922302 | For collecting 0.2 mL SEC fractions |
| ÄKTA V9-L loop valve | Cytiva | 29011358 | 5 posiiton loop valve for the ÄKTA FPLC system |
| ÄKTA F9-C fraction collector | Cytiva | 29027743 | 6 position plate fraction collector for the ÄKTA FPLC system |
| ÄKTA pure 25 L | Cytiva | 29018224 | FPLC system for running the experiment |
| Benchtop centrifuge (e.g. Fisherbrand GT4 3L) | Fisher Scientific | 15828722 | Centrifuge for low-speed spin |
| Blunt end filling needles | Generic | - | For transfer of samples |
| Bottle top vacuum filter | Corning | 10005490 | Bottle top vacuum filter for filtering SEC buffers |
| Cholesteryl hemisuccinate (CHS) | Generon | CH210-5GM | Additive for detergent solubilisation |
| Disposable multichannel reseviour | Generic | - | Resevior for addition of water or buffer to 96-well micro-plate |
| Dodecyl maltoside (DDM) | Glycon | D97002-C-25g | Detergent for solubilisation |
| eGFP protein standards | BioVision | K815-100 | eGFP standards for fluorescent calibration curve |
| Glycerol | Thermo Scientific | 11443297 | Glycerol for buffer preparation |
| HEPES | Thermo Scientific | 10411451 | HEPES for buffer preparation |
| High molecular weight SEC calibration standards kit | Cytiva | 28403842 | Molecular weight calibration kit for SEC |
| Lauryl maltose neopentylglycol (LMNG) | Generon | NB-19-0055-5G | Detergent for solubilisation |
| Low molecular weight SEC calibration standards kit | Cytiva | 28403841 | Molecular weight calibration kit for SEC |
| MLA-130 ultra-centrifuge rotor | Beckman Coulter | 367114 | Rotor for ultracentrifuge that fits 2 mL capacity tubes |
| Opaque 96-well flat-bottom micro-plate | Corning | 10656853 | 96-well for reading fluorescent signal in plate reader |
| Optima MAX-XP ultra-centrifuge | Beckman Coulter | 393315 | Centrifuge for high-speed spin |
| pH meter | Generic | - | For adjusting the pH of buffers during preparation |
| Prism | GraphPad | - | Graphing software for plotting traces |
| Rotary mixer | Fisher Scientific | 12027144 | Mixer for end over end mixing in the cold |
| Sodium chloride | Fisher Scientific | 10316943 | Sodium chloride for buffer preparation |
| Sodium hydroxide | Fisher Scientific | 10488790 | Sodium hydroxide for buffer preparation |
| Spectramax ID3 Plate Reader | Molecular Devices | 735-0391 | Micro-plate reader capable of reading fluorescence |
| Stirrer plate | Generic | - | For stirring buffers during preparation |
| Styrene maleic acid (SMA) | Orbiscope | SMALP 300 | Polymer for detergent free extraction |
| Superdex 200 Increase 10/300 GL | Cytiva | 28990944 | SEC column for running the experiment. The bed volume of this column is 24 mL. The recommended flow rate for this column in 0.9 ml/min (in water at 4 °C). The maximum pressure limit for this column is 5 MPa. |
| Vacuum pump | Sartorius | 16694-2-50-06 | For filtering and degassing buffers |
References
- Burgess, R. R. A brief practical review of size exclusion chromatography: Rules of thumb, limitations, and troubleshooting. Protein Expression and Purification. 150, 81-85 (2018).
- Erickson, H. P. Size and shape of protein molecules at the nanometer level determined by sedimentation, gel filtration, and electron microscopy. Biological Procedures Online. 11 (1), 32-51 (2009).
- Lathe, G. H., Ruthven, C. R. J. The separation of substances and estimation of their relative molecular sizes by the use of columns of starch in water. Biochemical Journal. 62 (4), 665-674 (1956).
- Lathe, G. H., Ruthven, C. R. The separation of substances on the basis of their molecular weights, using columns of starch and water. Biochemical Journal. 60 (4), (1955).
- Polson, A. Fractionation of protein mixtures on columns of granulated agar. Biochimica et Biophysica Acta. 50 (3), 565-567 (1961).
- Hjertén, S., Mosbach, R. 34;Molecular-sieve" chromatography of proteins on columns of cross-linked polyacrylamide. Analytical Biochemistry. 3 (2), 109-118 (1962).
- Porath, J., Flodin, P. Gel filtration: A method for desalting and group separation. Nature. 183 (4676), 1657-1659 (1959).
- Kawate, T., Gouaux, E. Fluorescence-detection size-exclusion chromatography for precrystallization screening of integral membrane proteins. Structure. 14 (4), 673-681 (2006).
- Hattori, M., Hibbs, R. E., Gouaux, E. A Fluorescence-detection size-exclusion chromatography-based thermostability assay for membrane protein precrystallization screening. Structure. 20 (8), 1293-1299 (2012).
- Shimomura, O., Johnson, F. H., Saiga, Y. Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. Journal of Cellular and Comparative Physiology. 59 (3), 223-239 (1962).
- Drew, D., et al. GFP-based optimization scheme for the overexpression and purification of eukaryotic membrane proteins in Saccharomyces cerevisiae. Nature Protocols. 3 (5), 784-798 (2008).
- Newstead, S., Kim, H., von Heijne, G., Iwata, S., Drew, D. High-throughput fluorescent-based optimization of eukaryotic membrane protein overexpression and purification in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences of the United States of America. 104 (35), 13936-13941 (2007).
- Vaidehi, N., Grisshammer, R., Tate, C. G. How can mutations thermostabilize G-protein-coupled receptors. Trends in Pharmacological Sciences. 37 (1), 37-46 (2016).
- Hardy, D., Bill, R. M., Jawhari, A., Rothnie, A. J. Overcoming bottlenecks in the membrane protein structural biology pipeline. Biochemical Society Transactions. 44 (3), 838-844 (2016).
- Hanson, M. A., et al. Crystal structure of a lipid G protein-coupled receptor. Science. 335 (6070), 851-855 (2012).
- Alexandrov, A. I., Mileni, M., Chien, E. Y. T., Hanson, M. A., Stevens, R. C. Microscale fluorescent thermal stability assay for membrane proteins. Structure. 16 (3), 351-359 (2008).
- Harborne, S. P. D., King, M. S., Kunji, E. R. S. Thermostability assays: A generic and versatile tool for studying the functional and structural properties of membrane proteins in detergents. Biophysical Journal. 118 (4), 105-121 (2020).
- Nji, E., Chatzikyriakidou, Y., Landreh, M., Drew, D. An engineered thermal-shift screen reveals specific lipid preferences of eukaryotic and prokaryotic membrane proteins. Nature Communications. 9 (1), 4253 (2018).
- Harborne, S. P. D., et al. IMPROvER: The Integral Membrane Protein Stability Selector. Scientific Reports. 10 (1), 15165 (2020).
- Ashok, Y., Nanekar, R., Jaakola, V. -. P. Defining thermostability of membrane proteins by western blotting. Protein Engineering Design and Selection. 28 (12), 539-542 (2015).
- Pedersen, M. E., Østergaard, J., Jensen, H. Flow-induced dispersion analysis (FIDA) for protein quantification and characterization. Methods Mol Biol. 1972, 109-123 (2019).
- Wienken, C. J., Baaske, P., Rothbauer, U., Braun, D., Duhr, S. Protein-binding assays in biological liquids using microscale thermophoresis. Nature Communications. 1 (1), 100 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved