Uso da Plataforma de Tecido de Barreira MicroSiM (μSiM) para Modelagem da Barreira Hematoencefálica
In This Article
Summary
Este relatório fornece protocolos para montagem, cultura de células e ensaios na plataforma μSiM para a construção de modelos de barreira hematoencefálica.
Abstract
O microSiM (μSiM) é uma plataforma de cultura baseada em membrana para modelagem da barreira hematoencefálica (BHE). Ao contrário das plataformas convencionais baseadas em membrana, o μSiM fornece aos experimentalistas novas capacidades, incluindo imagens de células vivas, sinalização parácrina sem obstáculos entre câmaras de "sangue" e "cérebro" e a capacidade de obter imagens diretas de imunofluorescência sem a necessidade de extração/remontagem de membranas. Aqui demonstramos o uso básico da plataforma para estabelecer modelos de monocultura (células endoteliais) e co-cultura (células endoteliais e pericitos) da BBB usando membranas de nitreto de silício nanoporosas ultrafinas. Demonstramos compatibilidade com culturas de células primárias e culturas de células-tronco pluripotentes induzidas por humanos (hiPSC). Fornecemos métodos para análise qualitativa de modelos de BBB via coloração por imunofluorescência e demonstramos o uso do μSiM para a avaliação quantitativa da função de barreira em um ensaio de permeabilidade de moléculas pequenas. Os métodos fornecidos devem permitir que os usuários estabeleçam seus modelos de barreira na plataforma, avançando no uso da tecnologia de chips de tecido para estudar tecidos humanos.
Introduction
Os tecidos vivos são compartimentalizados por células especializadas que criam e mantêm barreiras e regulam quais células e moléculas são transportadas de um compartimento para outro. A regulação inadequada das funções de barreira pode ser fonte tanto de doenças agudas quanto de doenças crônicas. A barreira hematoencefálica (BHE) é a barreira tecidual mais restritiva do corpo humano1. A disfunção da BHE está subjacente a uma ampla gama de doenças do sistema nervoso central (SNC), incluindo doença de Alzheimer2, doença de Parkinson 3,4 e esclerose múltipla 5,6. A lesão no BBB também está ligada ao comprometimento cognitivo de longo prazo como resultado de distúrbios agudos, como sepse7, COVID-198 e delírio pós-operatório9. O desenvolvimento de drogas com potencial para tratar distúrbios cerebrais tem sido frustrantemente difícil devido ao desafio de intencionalmente romper o BBB para entregar moléculas bioativas a alvos no cérebro10. Por essas razões, métodos para estudar a função da BHE in vitro são de suma importância para o entendimento e tratamento das doenças do SNC.
Os métodos básicos para medir a função de barreira in vitro envolvem o estabelecimento de uma monocamada ou co-cultura em uma membrana semipermeável e a medição da resistência conferida pelas células à difusão de pequenas moléculas ou pequenas correntes elétricas11,12,13,14. Embora o surgimento de sistemas microfisiológicos (MPS) tenha produzido uma abundância de opções para a modelagem da BBB em 3D15,16, a diversidade de geometrias de sistemas dificulta a comparação de medidas de permeabilidade entre MPS ou com valores estabelecidos na literatura. O estabelecimento de valores basais confiáveis é particularmente importante na pesquisa de BHE, onde, devido à extensa regulação de barreira pelas células endoteliais vasculares cerebrais, os valores de permeabilidade in vitro são altamente examinados12,17,18. Por essas razões, as medidas de permeabilidade através de monocamadas estabelecidas em membranas 2D permanecerão um grampo nos estudos de BBB nos próximos anos. Isso vale para outras barreiras teciduais, incluindo as barreiras epiteliais, onde valores absolutos de permeabilidade basal são utilizados para validar e comparar modelos in vitro 19,20,21.
Com o objetivo de estabelecer uma nova ferramenta valiosa para a comunidade de pesquisa BBB, introduzimos22 e avançamos23,24,25,26 o microdispositivo com uma plataforma de silicon membrane (μSiM) para uso em modelagem de tecidos de barreira nos últimos 5 anos. A característica habilitante da plataforma é uma membrana ultrafina (<100 nm de espessura) com centenas de milhões de nanoporos 27,28 ou uma mistura de nanoporos e microporos29. Os chips de membrana independentes são produzidos em um 'chip' de silício de 300 μm que estabiliza as estruturas ultrafinas30 e permite que elas sejam manuseadas por pinças para a montagem do dispositivo. Devido à sua natureza ultrafina, as membranas têm uma permeabilidade duas ordens de magnitude maior do que a das membranas convencionais condicionadas por esteira usadas em dispositivos comerciais de cultura de membranas31,32. Na prática, isso significa que o impedimento da membrana para a difusão de moléculas menores que os nanoporos (<60 nm) é desprezível33. Assim, para as barreiras celulares, somente as células e as matrizes por elas depositadas determinarão a taxa de transporte de pequenas moléculas dos compartimentos apical para os basais que estão separados pela membrana34. O design do dispositivo e a natureza ultrafina das membranas também fornecem muitas vantagens para a microscopia óptica. Estes incluem 1) a capacidade de seguir culturas vivas usando contraste de fase ou imagens de campo brilhante, 2) a capacidade de colorir fluorescentemente e obter imagens in situ sem a necessidade de extrair e transferir a membrana para um vidro de cobertura, e 3) o fato de que as membranas são mais finas do que "fatias" confocais, de modo que as coculturas diretas têm um espaçamento mais natural entre os tipos celulares do que pode ser alcançado com membranas gravadas por trilha de 6-10 μm de espessura.
Mais recentemente, avançamos a plataforma para um formato modular para facilitar a montagem rápida34 e a personalização35,36. Aproveitamos o formato modular para distribuir componentes de dispositivos entre nossos laboratórios de bioengenharia e laboratórios de barreira cerebral colaboradores. Em seguida, desenvolvemos conjuntamente protocolos para montagem de dispositivos, monocultura e co-cultura, coloração por imunofluorescência e permeabilidade de pequenas moléculas e mostramos que esses métodos eram reprodutíveis entre laboratórios. Usando esses protocolos, também mostramos que a plataforma modular suporta uma BHE validada desenvolvida usando o método de cultura endotelial estendida (EECM) para criar células endoteliais cerebrais semelhantes a microvasculares (BMEC) a partir de células-tronco pluripotentes induzidas humanas (hiPSCs)37. O objetivo do presente relatório é revisar esses métodos com mais detalhes e, com o auxílio do vídeo que o acompanha, facilitar a adoção mais ampla da plataforma na comunidade BBB.
Protocol
1. Montagem do dispositivo μSiM
Observação : este método descreve a montagem dos dispositivos. O chip de membrana tem um lado de trincheira e um lado plano, que podem ser montados de trincheira para cima ou para baixo. Dispositivos de trincheira são mais comumente usados para cultura de células.
- Em um ambiente estéril (ou seja, uma coifa de biossegurança), prepare todos os materiais para montagem, incluindo as luminárias de montagem, componentes, lascas de membrana e pinças.
- Coloque o chip de membrana no centro do acessório A1 usando pinças de cavacos. A superfície plana do chip fica voltada para baixo e a área da trincheira voltada para cima para dispositivos de trincheira para baixo, e vice-versa para dispositivos de trincheira.
Observação : as etapas de montagem a seguir são ilustradas usando o dispositivo de trincheira para baixo como um exemplo, que permite uma área de crescimento plana na câmara superior. - Vincule o componente 1 ao chip. Primeiro, retire as camadas protetoras azuis em ambos os lados do componente 1 usando uma pinça reta e coloque-a no acessório A1, câmara superior para baixo. Pressione suavemente o componente 1 para baixo até que o adesivo sensível à pressão (PSA) toque o chip.
- Coloque o acessório A2 no acessório A1 e aplique pressão firme em diferentes cantos para garantir um ajuste apertado do chip e do componente.
NOTA: Certifique-se de não retirar a camada PSA. É uma camada transparente e mais rígida em comparação com as camadas protetoras azuis. - Ligue o componente 2 ao componente 1 com o chip. Primeiro, prepare o componente 2 pegando um canto do componente 2 com uma pinça reta e retirando-o da folha. Em seguida, pegue a região do "triângulo" não-PSA do componente 2 e, juntos, remova a camada protetora espessa e transparente e a camada azul do componente 2, expondo a superfície do PSA. Coloque o componente 2 no acessório B1, PSA de lado para cima.
- Coloque o componente 1 com o chip de membrana no acessório B1, câmara superior voltada para cima.
- Coloque o acessório B2 no componente 1 e aplique pressão firme em diferentes cantos do acessório B2.
- Retire o dispositivo montado do dispositivo e use uma pinça reta para pressionar quaisquer bolhas de ar na parte inferior do dispositivo e selar as bordas do canalx', evitando o contato com a região da membrana. Antes de usar para cultura celular, ultravioleta (UV) esterilizar dispositivos recém-montados por 20 min.
2. Cultura celular
Observação : este método descreve protocolos para culturas primárias e hiPSC derivadas na plataforma. Os métodos descrevem monocultura de células endoteliais na câmara superior do dispositivo e co-cultura de células pericitárias e endoteliais com pericitos na câmara inferior e células endoteliais na câmara superior de dispositivos montados em trincheira. Para dimensões e volumes da câmara, ver Tabela 1. Estes são os formatos mais comuns; no entanto, outros layouts de cultura de células podem ser usados dependendo das necessidades do usuário.
- Preparação da câmara de cultura celular
- Monte os dispositivos de acordo com o protocolo detalhado na seção 1.
- Coloque os dispositivos em abraçadeiras de mangueira estéreis. Antes da cultura celular, esterilizar as pinças mergulhando-as em etanol por ≥20 min. Reesterilizar após cada experimento para reutilização.
- Cultivar os dispositivos em uma grande placa de Petri estéril. Para umidade extra, adicione uma pequena placa de Petri ou uma tampa de tubo cônico de 50 mL cheia de água estéril.
- Lave a câmara superior dos dispositivos duas vezes com 100 μL de água estéril. Para cultura de células da câmara inferior, lavar a câmara inferior com 20 μL de água estéril.
- Monocultura de linhagem celular hCMEC/D3 (BBB)
- Preparar a câmara de cultura celular de acordo com o ponto 2.1.
- Revestir as câmaras superiores com 25 μg/cm2 de colágeno I e 5 μg/cm2 de fibronectina humana misturada em solução salina tamponada com fosfato (PBS). Deixe descansar por 1-2 h a 37 °C ou durante a noite a 4 °C.
- Remova a solução de revestimento e adicione 100 μL de meio endotelial pré-aquecido com fator de crescimento depletizado (meio de ensaio) à câmara superior e 20 μL à câmara inferior. Para preparar o meio de ensaio, misturar 100 mL de meio endotelial basal + 400 μL de fator de crescimento fibroblástico humano + 40 μL de hidrocortisona + 100 μL de sulfato de gentamicina + 2 mL de soro fetal bovino.
- Passagem de células hCMEC/D3 de acordo com o protocolo do fabricante; tripsinizar as células em uma incubadora de 37 °C por 3-5 min e, em seguida, parar a tripsinização pela adição de meio endotelial pré-aquecido. Transfira a suspensão da célula para um tubo de centrífuga e centrífuga a 200 × g durante 5 min à temperatura ambiente. Ressuspender o pellet celular em meio de ensaio e semear as células nas câmaras superiores a uma densidade de 40.000-60.000 células/cm2. Incubar os dispositivos a 37 °C com 5% de dióxido de carbono (CO 2) durante2-4 h para facilitar a adesão celular. Por exemplo, para atingir 40.000 células/cm 2 no chip de 0,37 cm2, adicione 100 μL de uma solução celular com uma concentração de 150.000 células/mL à câmara superior.
NOTA: Cultivamos e passamos hCMEC/D3 de acordo com Hudecz et al.38, usando uma formulação modificada de meio de crescimento endotelial-2 (EGM-2) para manutenção celular e um "meio de ensaio" reduzido com fator de crescimento após subcultivo para ensaios. Outras formulações de meios devem ser compatíveis com os dispositivos, embora recomendemos as formulações de meios de Hudecz et al.38 se os usuários tiverem problemas com a sobrevivência do hCMEC/D3. - Após 2-4 h para adesão celular, trocar com meio de ensaio fresco em ambas as câmaras para remover células mortas ou desapegadas.
- Manter os dispositivos a 37 °C com 5% de CO 2, trocando o meio de ensaio em ambas as câmaras a cada2-3 dias até a experimentação. Os ensaios são tipicamente realizados após 2 semanas de cultura.
- Monocultura de células EECM-BMEC-like derivada de hiPSC
- Preparar a câmara de cultura celular de acordo com o ponto 2.1.
- Preparar o colagénio IV a partir de uma solução de placenta humana adicionando 5 ml de 0,5 mg/ml de ácido acético a 5 mg de colagénio IV para criar uma solução de 1 mg/ml. Deixe a solução descansar durante ≥4 h a 4 °C para se reconstituir totalmente. A solução é estável a 4 °C durante 2 semanas.
- Revestir as câmaras superiores com 100 μL de uma proporção de 4:1:5 de colágeno IV, fibronectina bovina e água estéril. Cubra a 37 °C por 2-4 h.
- Remova a solução de revestimento e adicione 100 μL de hECSR à temperatura ambiente à câmara superior e 20 μL à câmara inferior.
- Passagem de células EECM-BMEC-like de acordo com Nishihara et al.37; adicionar uma mistura de enzimas de desprendimento celular às células e transferir para uma incubadora a 37 °C durante 5-8 minutos. Pipetar a solução celular para singularizar e adicionar até 4x o volume do meio endotelial em um tubo de centrífuga. Centrifugar a 200 × g por 5 min à temperatura ambiente; ressuspender as células em hECSR e semear nas câmaras superiores a uma densidade de 40.000 células/cm2. Incubar os dispositivos a 37 °C com 5% de CO 2 por2-4 h para facilitar a adesão celular. Por exemplo, para atingir 40.000 células/cm2, adicione 100 μL de uma solução celular a 150.000 células/mL.
- Após 2-4 h para adesão celular, trocar com hECSR fresco em ambas as câmaras para remover células mortas ou desapegadas.
- Manter os dispositivos a 37 °C com 5% de CO 2, trocando hECSR em ambas as câmaras a cada1-2 dias até a experimentação. Os ensaios são tipicamente realizados no dia 6 de cultura.
- co-cultura hCMEC/D3 e pericito vascular cerebral humano primário (HBVP)
- Antes da montagem do dispositivo, revestir os chips de membrana com 2 μg/cm2 de poli-L-lisina (PLL) misturados em PBS. Aplicar 50-80 μL de PLL em uma gota apenas para o lado que estará voltado para baixo na montagem final do dispositivo. Complete o processo de revestimento em 1-2 h a 37 °C ou durante a noite a 4 °C.
- Remova a solução de revestimento. Lave os cavacos de membrana com água ultrapura estéril e deixe-os secar.
- Montar os dispositivos de acordo com o protocolo detalhado na secção 1 acima, com o lado revestido de PLL virado para baixo, e preparar a câmara de cultura celular de acordo com o ponto 2.1.
- Revestir as câmaras superiores de acordo com o ponto 2.2.2.
- Adicionar 50 μL de pericito pré-aquecido às câmaras superiores e adicionar 20 μL aos canais inferiores.
- Passagem de HBVPs de acordo com o protocolo do fabricante; tripsinizar as células em uma incubadora de 37 °C por 3-5 min, em seguida, parar a tripsinização pela adição de meio de pericito pré-aquecido. Transfira a suspensão celular para um tubo de centrífuga e centrifuga a 200 × g durante 5 minutos à temperatura ambiente. Ressuspender o pellet celular em meio pericito e semear as células nas câmaras de fundo a uma densidade de 14.000-25.000 células/cm2. Inverta os dispositivos, mas mantenha uma interface de ar com as câmaras superiores para facilitar as trocas gasosas.
NOTA: A interface de ar necessária durante a inversão pode ser obtida virando os dispositivos depois de colocá-los dentro de abraçadeiras de mangueira e empurrando para baixo em todos os cantos antes de virar, ou colocando os dispositivos de cabeça para baixo em tiras paralelas de acrílico ou silicone espaçadas o suficiente para manter as câmaras superiores desobstruídas. A densidade de semeadura pode precisar ser otimizada para cada usuário. Para atingir 14.000 células/cm2, adicione 20 μL de uma suspensão celular a ~590.000 células/mL. Note que 20 μL é pipetado para a câmara inferior para evitar bolhas, mas a densidade é calculada usando o volume da câmara inferior de 10 μL. - Incubar as células a 37 °C com 5% de CO 2 por2-4 h na posição invertida para facilitar a adesão celular.
- Após 2-4 h para adesão celular, vire os dispositivos na vertical e troque-os com meio de pericito fresco em ambas as câmaras para remover células mortas ou desconectadas.
- Após a semeadura dos pericitos, semear hCMEC/D3s na câmara superior, seguindo os passos 2.2.4-2.2.5. Alternar ambas as câmaras para o meio de ensaio.
- Manter os dispositivos a 37 °C com 5% de CO 2, trocando o meio de ensaio em ambas as câmaras a cada1-2 dias até a experimentação. A co-cultura celular primária é geralmente mantida por 6-8 dias antes dos ensaios.
NOTA: Se as monoculturas de HBVP forem comparadas com as monoculturas de hCMEC/D3 ou co-culturas de hCMEC/D3 e HBVP, então trocar o meio de pericito pelo meio de ensaio 2-3 dias após a semeadura dos HBVPs.
- co-cultura de células EECM-BMEC-like derivadas de hiPSC e células semelhantes a pericitos cerebrais (BPLC)
- Preparar a câmara de cultura celular de acordo com o ponto 2.1 e revestir as câmaras superiores de acordo com os passos 2.3.2-2.3.3.
- Retire a solução de revestimento e adicione 50 μL de Essential 6 Medium + 10% Fetal Bovine Serum (E6 + 10% FBS) à câmara superior.
- Passagem das BPLCs segundo Gastfriend et al.39; adicionar uma mistura de enzimas de desprendimento celular às células e transferir para uma incubadora de 37 °C por 5-15 min, até que ~90% das células sejam arredondadas. Pipetar a solução celular para singularizar e adicionar 4x o volume de DMEM/F12 em um tubo centrífugo de 50 mL, usando um filtro de células de 40 μm para filtrar e singularizar totalmente as células. Transferir para um tubo de centrífuga de 15 mL, centrifugar a 200 × g por 5 min à temperatura ambiente, ressuspender o pellet de células em E6 + 10% FBS e semear as células nas câmaras inferiores a uma densidade de 14.000-25.000 células/cm2. Inverta os dispositivos, mas mantenha uma interface de ar com a câmara superior para facilitar as trocas gasosas.
NOTA: A interface de ar necessária durante a inversão pode ser obtida virando os dispositivos depois de colocá-los dentro das braçadeiras da mangueira e empurrando para baixo em todos os cantos antes de virar, ou colocando os dispositivos de cabeça para baixo em tiras paralelas de acrílico ou silicone espaçadas o suficiente para manter as câmaras superiores desobstruídas. A densidade de semeadura pode precisar ser otimizada para cada usuário. Para atingir 14.000 células/cm2, adicione 20 μL de uma suspensão celular a ~590.000 células/mL. Note que 20 μL é pipetado para a câmara inferior para evitar bolhas, mas a densidade é calculada usando o volume da câmara inferior de 10 μL. - Incubar as células a 37 °C com 5% de CO 2 por2-4 h na posição invertida para facilitar a adesão celular.
- Após 2-4 h para adesão celular, vire os dispositivos na vertical e troque com E6 fresco + FBS a 10% em ambas as câmaras para remover células mortas ou desconectadas.
- Um dia após a semeadura dos perócitos, semear células EECM-BMEC-like na câmara superior, seguindo os passos 2.3.5-2.3.6. Mude ambas as câmaras para hECSR.
- Manter os dispositivos a 37 °C com 5% de CO 2, trocando o meio de ensaio em ambas as câmaras a cada1-2 dias até a experimentação. A co-cultura derivada de hiPSC é geralmente mantida por 7 dias para BPLCs e 6 dias para células EECM-BMEC-like antes dos ensaios.
NOTA: Se as monoculturas de BPLC forem comparadas com as monoculturas EECM-BMEC ou as coculturas EECM-BMEC e BPLC, então troque E6 + 10% FBS por hECSR 1 dia após a semeadura das BPLCs.
3. Imunocitoquímica
NOTA: Este método descreve um protocolo para coloração imunocitoquímica e imagem de células cultivadas no lado superior e/ou inferior da membrana. O objetivo deste experimento é determinar a presença e localização de proteínas-chave que devem ser encontradas na BBB, tais como aderentes e proteínas de junção apertada, e proteínas de identidade celular. Métodos alternativos e de coloração ao vivo também são compatíveis com a plataforma.
- Fixação e coloração nos dispositivos
- Coloque os anticorpos primários no gelo para descongelar.
- Preparar uma solução de paraformaldeído (PFA) a 4% à temperatura ambiente (por exemplo, diluir 16% de PFA em 3x o seu volume de PBS) ou resfriar 100% de metanol a -20 °C.
- Criar uma solução de bloqueio apropriada de acordo com a Tabela 2. Armazenar no gelo.
NOTA: Vórtice a solução pode ser necessário para dissolver completamente Triton X-100. - Fixe as células pipetando 20 μL de fixador (por exemplo, PFA ou metanol) na câmara inferior e 50 μL na câmara superior. Incubar os dispositivos durante 10 min (PFA) ou 2 min (metanol) à temperatura ambiente.
- Lave por 3 x 5 min pipetando 20 μL de PBS através da câmara inferior e 100 μL para a câmara superior.
- Bloquear durante 30 minutos à temperatura ambiente adicionando 20 μL da solução de bloqueio à câmara inferior e 50 μL de solução de bloqueio à câmara superior. Verifique se há bolhas na câmara inferior.
- Preparar a solução primária de anticorpos diluindo o(s) anticorpo(s) na solução de bloqueio de acordo com a Tabela 2. Armazenar no gelo.
- Corar com os anticorpos primários adicionando 20 μL da solução de anticorpos primários à câmara inferior e substituindo o volume da câmara superior por 50 μL da solução de anticorpos primários. Verifique se há bolhas na câmara inferior. Incubar durante 1 h à temperatura ambiente ou durante a noite a 4 °C.
- Lave por 3 x 5 min pipetando 20 μL de PBS através da câmara inferior e 100 μL para a câmara superior.
- Preparar a solução de anticorpos secundários diluindo o(s) anticorpo(s) na solução de bloqueio de acordo com a Tabela 2. Armazenar no gelo protegido da luz.
- Corar com anticorpos secundários adicionando 20 μL de solução de anticorpos secundários à câmara inferior e substituindo o volume da câmara superior por 50 μL da solução de anticorpos secundários. Verifique se há bolhas na câmara inferior. Incubar durante 1 h à temperatura ambiente protegida da luz.
- Lave por 3 x 5 min pipetando 20 μL de PBS através da câmara inferior e 100 μL para a câmara superior.
- Faça uma solução de mancha nuclear. Diluir Hoechst 1:10.000 em PBS. Adicionar 20 μL da solução de coloração nuclear à câmara inferior e substituir o volume da câmara superior por 50 μL da solução de coloração nuclear. Verifique se há bolhas na câmara inferior. Incubar durante 3 minutos à temperatura ambiente protegida da luz.
- Remova a mancha adicionando 20 μL de PBS à câmara inferior e substituindo o volume da câmara superior por 100 μL de PBS. Fotografe os dispositivos imediatamente ou armazene-os a 4 °C com a placa de Petri envolvida em parafilme e protegida da luz até estar pronta para a aquisição de imagens.
- Imagem confocal
NOTA: Esta seção descreve a criação de imagens dos dispositivos usando um microscópio confocal de disco giratório invertido com uma objetiva de longa distância de trabalho (LWD) 40x (água, WD 590-610, abertura numérica 1,15) como exemplo. Para distâncias de trabalho e compatibilidade de lentes, consulte material suplementar em McCloskey et al.34. Imagens de toda a área da membrana também são tiradas usando uma objetiva de 10x para garantir que as imagens de 40x sejam representativas de todo o campo. Estes são geralmente tomados em campo amplo.- Ligue o microscópio e abra o software de imagem.
- Ajuste os canais de acordo com as propriedades do anticorpo secundário e da coloração nuclear, usando o Modo de Imagem Confocal. Otimize a potência do laser e o tempo de exposição para garantir que o sinal esteja acima do plano de fundo e reduza os artefatos de imagem.
- Para a coloração nuclear Hoechst, use excitação 405, emissão 450/50 Bandpass (BP), tempo de exposição de 500 ms, potência do laser de 50%. Para rótulos que usam um anticorpo secundário conjugado ao Alexa Fluor (AF) 488, use excitação 488, emissão 525/50BP, tempo de exposição de 500 ms e potência do laser de 50%. Para rótulos que usam um anticorpo secundário conjugado a AF568, use excitação 561, emissão 600/50BP, tempo de exposição de 500 ms e 100% de potência do laser.
- Coloque o dispositivo no suporte do dispositivo de lâmina do microscópio, câmara superior virada para cima e coloque no microscópio usando um suporte de lâmina do microscópio. Ative o Live e selecione o canal para a mancha nuclear. Encontre a membrana usando uma objetiva baixa, certificando-se de que a região transparente da membrana de nitreto de silício esteja centralizada, pois a luz não transmitirá através da região de silicone azul e sólido. Uma vez que o dispositivo esteja devidamente centralizado e a camada celular seja encontrada, mude para a objetiva de 40x, molhe a objetiva e concentre-se na região da membrana usando a coloração nuclear como guia.
- Ative a geração de imagens z-stack e defina o Modo de varredura como Iniciar/Terminar. Defina o tamanho ou a contagem de passos. Usando o botão de ajuste grosseiro no microscópio, ajuste o início do exame para o topo da camada de células endoteliais, usando a coloração nuclear como guia, e a extremidade do exame no fundo da camada de pericitos, usando a coloração nuclear como guia. Verifique todos os canais para garantir que tudo será capturado no campo de imagem.
NOTA: Nós geralmente usamos auto step, que é ~0.2 μm fatias. - Defina o Nome da imagem e pressione Adquirir para iniciar a geração de imagens. Repita em diferentes regiões, conforme necessário.
- Processe as imagens confocais usando ImageJ40 ou Imaris.
- Para processar no Imaris, arraste o arquivo de imagem para o programa a ser aberto. Selecione Seção na barra de menu superior para ver uma imagem 2D do plano x-y com visualizações correspondentes dos planos x-z e y-z. Selecione Visualização 3D na barra de menu superior para ver uma imagem 3D . Clique na imagem e arraste-a para girar. Selecione Instantâneo na barra de menu superior para tirar uma imagem.
4. Ensaio de amostragem da permeabilidade de pequenas moléculas
NOTA: Esta seção descreve uma metodologia para medições quantitativas de propriedades de barreira das culturas de células. O objetivo deste experimento é detectar a concentração de uma pequena molécula fluorescente que passa pelas camadas celulares e entra na câmara inferior da plataforma. Esses dados são então usados para calcular a permeabilidade celular.
- Técnica de amostragem
- Montar os dispositivos de acordo com o protocolo detalhado na seção 1 e cultivar as linhagens celulares desejadas conforme descrito na seção 2. Inclua um dispositivo adicional para servir como um dispositivo de controle revestido e livre de células para medir a permeabilidade do sistema.
NOTA: Recomenda-se um mínimo de três réplicas técnicas por condição; no entanto, apenas uma réplica do controle revestido é necessária. - Antes de iniciar o ensaio de amostragem, substitua o meio na câmara inferior por meio fresco. Verificar ao microscópio a confluência da monocamada endotelial em cada aparelho. Observe quaisquer lacunas nas monocamadas celulares, pois isso afetará a difusão do corante na câmara inferior.
NOTA: Uma cultura endotelial saudável deve ser 100% confluente. - Preparar a solução fluorescente de pequenas moléculas (por exemplo, 150 μg/mL Lucifer Yellow, 457 Da) em meio de cultura celular. Preparar o volume excedente da solução fluorescente de pequena molécula a ser usada para a preparação das soluções-padrão que servem de referência para calcular a concentração da pequena molécula fluorescente amostrada do canal inferior.
NOTA: Recomendamos a preparação de 400 μL de solução excedente para ser usada como a solução padrão com a maior concentração da pequena molécula fluorescente. - Substitua o meio no poço superior por 100 μL da solução fluorescente de pequena molécula.
NOTA: Recomendamos o uso de uma caneta hidrofóbica para desenhar círculos ao redor das portas de amostragem e esperar até que a tinta hidrofóbica seque completamente antes da adição de solução de corante fluorescente. Isto evita a propagação do meio a partir do canal inferior em torno da porta de recolha de amostras no passo 4.1.7. Recomendamos escalonar a adição da solução de pequena molécula fluorescente no poço superior - esperar 2 minutos antes de adicionar a solução fluorescente ao próximo dispositivo, ou trabalhar em grupos de 3 (adicione a solução em três dispositivos ao mesmo tempo e aguarde 5 minutos para adicionar os próximos três dispositivos). - Incubar os dispositivos a 37 °C, 5% CO2 durante 1 h.
- Durante a incubação de 1 h de duração na etapa anterior, prepare soluções-padrão realizando diluições seriadas de 2 vezes a partir da solução fluorescente de pequenas moléculas preparada na etapa 4.1.3. Pipetar 50 μL de cada solução para a placa preta de fundo plano de 96 poços em triplicatas. Use o meio de cultura de células em branco como a solução padrão de linha de base.
NOTA: Para preparar soluções padrão, recomendamos 11 diluições seriadas em um volume final de 200 μL e o uso de meio de cultura celular como branco para medir a intensidade fluorescente basal.- Transferir 200 μL de 400 μL da solução fluorescente de pequenas moléculas em excesso preparada no passo 4.1.3 para um tubo contendo 200 μL de meio, misturar bem e transferir 200 μL desta solução para o tubo seguinte contendo 200 μL de meio. Repita as diluições 1:2 até obter um total de 10 tubos. Pipetar 50 μL da solução-padrão mais concentrada na coluna 1 em triplicatas na placa de 96 poços (B1, C1, D1), a2ª solução mais concentrada na coluna 2 (B2, C2, D2), e assim por diante. Para a12ª coluna da placa, pipetar 50 μL do meio em branco em triplicatas (B12, C12, D12).
- Execute as etapas a seguir para coletar amostras da solução de pequenas moléculas fluorescentes do canal inferior.
- Remova a solução fluorescente de pequenas moléculas do poço para interromper o processo de difusão.
- Coloque uma ponta contendo 50 μL de meio na porta superior para servir como reservatório, inserindo a ponta com 50 μL na porta, levantando o dispositivo e ejetando suavemente a ponta enquanto segura no topo para estabilização. Defina o dispositivo. Certifique-se de que não há bolhas na ponta da pipeta ou ar na ponta da pipeta para evitar a adição de bolhas na câmara inferior durante a amostragem.
- Adicione 50 μL de meio no poço superior para evitar a ruptura da monocamada celular durante a amostragem.
- Para obter a amostragem da solução a partir do canal inferior, empurre um pipetador com uma ponta de pipeta vazia até à sua primeira resistência, introduza a ponta na porta de recolha e inverta a pipetagem para retirar 50 μL da solução a partir do canal inferior. Transfira diretamente para a placa preta de fundo plano de 96 poços que contém as soluções padrão.
NOTA: Recomendamos verificar a monocamada celular sob o microscópio imediatamente após a amostragem. Extrair mídia do canal inferior pode ocasionalmente resultar em ruptura da camada celular no poço superior, o que pode causar medições de permeabilidade inconsistentes. Trabalhar rapidamente ao longo das etapas na 4.1.7 ajudará a evitar isso.
- Meça a intensidade da fluorescência em um leitor de microplacas usando os parâmetros adequados de excitação e comprimento de onda de emissão para a pequena molécula fluorescente usada. Para Lucifer Yellow, use excitação de 428 nm e emissão de 536 nm, com ganho ótimo. A fluorescência é medida a partir do topo da placa. Adicione a placa ao leitor de placas, realce os poços com amostra (incluindo a curva padrão) e selecione Iniciar para ler a placa.
- Montar os dispositivos de acordo com o protocolo detalhado na seção 1 e cultivar as linhagens celulares desejadas conforme descrito na seção 2. Inclua um dispositivo adicional para servir como um dispositivo de controle revestido e livre de células para medir a permeabilidade do sistema.
- Cálculo do valor de permeabilidade (consulte o Modelo do Arquivo Suplementar 1 )
- Subtrair o valor médio de intensidade de fluorescência do meio branco de todos os valores de intensidade de fluorescência medidos.
- Use a equação (1) para calcular a permeabilidade do sistema Ps:
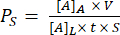 (1º)
(1º)
Onde [A]A é a concentração da pequena molécula fluorescente coletada do canal inferior, V é o volume amostrado e adicionado à placa (0,050 mL), [A]L é a concentração da pequena molécula fluorescente adicionada ao poço superior (por exemplo, 0,15 mg/mL), t é o tempo de incubação (em s ou min, dependendo das unidades desejadas), e S é a área superficial da membrana (0,014cm2).- Calcular [A]A utilizando a equação obtida através da plotagem de uma curva padrão a partir das saídas de intensidade de fluorescência e das concentrações conhecidas das soluções-padrão. Calcular as concentrações (x) das amostras experimentais inserindo seus valores de intensidade de fluorescência (y) na equação.
Observação : use a parte da curva padrão que é linear. Recomendamos medir a área de superfície da membrana a partir de uma imagem da membrana obtida ao microscópio, pois a área da membrana pode variar dependendo do número do lote e pode afetar significativamente os valores de permeabilidade calculados se eles diferirem do controle revestido.
- Calcular [A]A utilizando a equação obtida através da plotagem de uma curva padrão a partir das saídas de intensidade de fluorescência e das concentrações conhecidas das soluções-padrão. Calcular as concentrações (x) das amostras experimentais inserindo seus valores de intensidade de fluorescência (y) na equação.
- Use a equação (2) para calcular a permeabilidade da monocamada celular Pe:
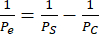 (2º)
(2º)
Onde PS é a permeabilidade do sistema calculada na etapa 4.2.2 e PC é o valor de permeabilidade do sistema do dispositivo de controle revestido e livre de células.
Representative Results
A montagem de um dispositivo de trincheira é mostrada na Figura 1. As luminárias orientam a montagem dos componentes e do chip de membrana. O componente 1 é principalmente acrílico com uma superfície PSA para ligação ao cavaco e uma abertura para a câmara inferior e portas para acesso de pipeta à câmara inferior. O componente 2 é a camada do canal e contém um "triângulo" não adesivo e livre de PSA no canto superior direito para preensão. Os dispositivos de trincheira fornecem uma área plana de crescimento de cultura de células na câmara superior, enquanto os dispositivos de trincheira têm uma superfície plana para cultura de células na câmara inferior.
Foram realizadas monoculturas e co-culturas endoteliais de hCMEC/D3 e HBVPs e de células EECM-BMEC-like derivadas do hiPSC IMR90-4 e BPLCs e imagens de fase adquiridas usando um microscópio de contraste de fase Nikon Eclipse Ts2 e objetiva de 10x (Figura 2). Densidades ótimas de semeadura para cultura de células primárias são mostradas (imagens obtidas 1 dia após a semeadura), bem como HBVPs sub-semeadas (Figura 2A). As imagens finais da fase de cocultura e monocultura (6 dias de cultura de células endoteliais) podem ser difíceis de distinguir (Figura 2C), e a confirmação de co-cultura de células primárias bem-sucedida pode exigir a coloração por imunofluorescência (ver secção 3 do protocolo). Densidades de semeadura BPLC derivadas de hiPSC baixas, altas e ótimas também são ilustradas (Figura 2B). A co-cultura derivada da hiPSC é mais clara de distinguir na imagem de contraste de fase em comparação com as coculturas primárias (Figura 2D). A semeadura baixa da CPPC resulta em baixa cobertura de pericitos e aglomeração de pericitos, enquanto a sobressemeadura resulta na descamação da camada de pericitos da membrana. Além disso, a troca do meio na câmara inferior muito rapidamente pode resultar em perda de pericitos, pois essas células são muito sensíveis ao cisalhamento. A cobertura ótima pelos pericitos é de ~90% para um modelo BBB, sem lacunas na camada endotelial.
Imagens representativas da co-cultura derivada de hiPSC imunomarcada estão ilustradas na Figura 3 (6 dias de cultura de células endoteliais). BPLCs derivadas de IMR90-4 foram coradas para o marcador de pericitos PDGFRβ, e células EECM-BMEC-like derivadas de IMR90-4 foram coradas para o marcador de junção de aderentes VE-caderina. Hoechst foi usado para corar os núcleos. As imagens foram adquiridas em microscópio confocal Spinning Disc com objetiva LWD 40x com cortes de 0,2 μm e processadas com Imaris. Ambas as camadas celulares podem ser visualizadas mesmo que a fina nanomembrana não seja vista.
Realizamos o ensaio de permeabilidade de pequenas moléculas baseado em amostragem usando as mesmas condições experimentais em dois laboratórios fisicamente distantes na Universidade de Berna, Suíça, e na Universidade de Rochester, NY, EUA para demonstrar a reprodutibilidade interlaboratorial dos resultados (Figura 4)34. Células EECM-BMEC-like derivadas do hiPSC IMR90-4 foram cultivadas no aparelho μSiM por 2, 4 ou 6 dias e em filtros transwell por 6 dias. O ensaio foi realizado utilizando-se 150 μg/mL de Lucifer Yellow (457 Da) em ambos os laboratórios. A alta variabilidade na permeabilidade das células endoteliais cultivadas por 2 dias no aparelho indica que 2 dias de cultura foram insuficientes para a maturação da barreira. Não houve diferenças significativas na permeabilidade entre os laboratórios na maturação da barreira a partir de 4 dias. Mostramos também que a permeabilidade das células endoteliais cultivadas em μSiM e filtros transwell por 6 dias coincidiu com aquelas previamente publicadas40.
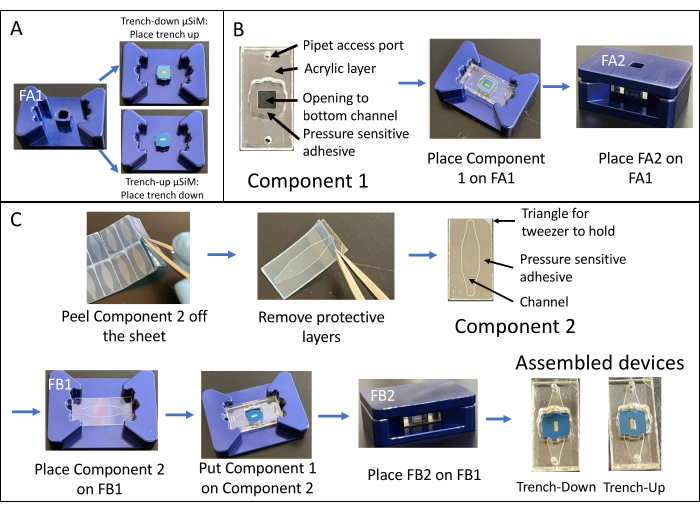
Figura 1: Etapas da montagem μSiM . (A) Prepare o chip colocando-o no acessório A1. Coloque a trincheira de cavacos para cima para um dispositivo final de trincheira. Coloque a trincheira de cavacos para baixo para um dispositivo de trincheira final. (B) Ligue o componente 1 ao chip, removendo as máscaras de proteção do componente 1 e colocando-o virado para baixo em FA1. Colagem aplicando pressão com o acessório A2. (C) Unir o componente 2 e o componente 1, removendo o componente 2 de sua folha e descascando as camadas protetoras superiores. Coloque o canal no acessório B1 e coloque o componente 1 em cima do componente 2 virado para cima. Colagem aplicando pressão com o acessório B2. Abreviações: FAn = fixture An; FBn = acessório Bn. Clique aqui para ver uma versão maior desta figura.
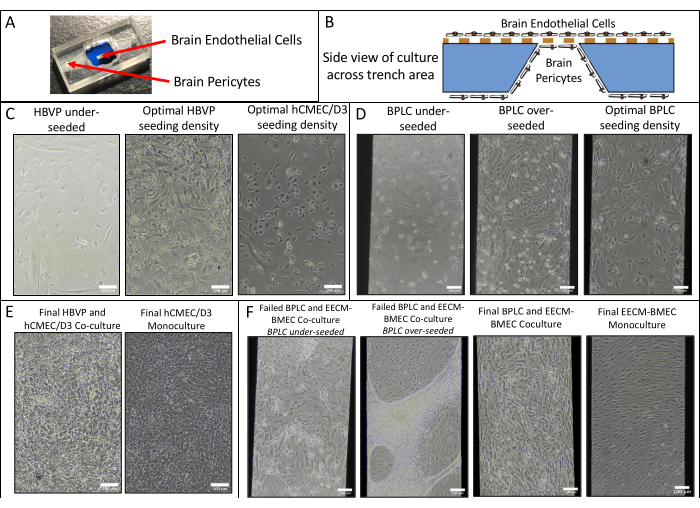
Figura 2: Esquema de cocultura e imagens representativas de contraste de fase de cultura de células em dispositivos. (A) Localização do pericito e semeadura das células endoteliais. (B) Vista lateral esquemática da localização das células através da trincheira do chip de membrana. (C) Imagens representativas de densidades de semeadura baixas e ótimas para HBVP primário e linhagem endotelial cerebral hCMEC/D3. As imagens foram adquiridas 1 dia após a semeadura (HBVP) e 2 h após a semeadura (hCMEC/D3). (D) Imagens representativas de baixas, altas e ótimas densidades de semeadura para células semelhantes a pericitos cerebrais derivadas de hiPSC. As imagens foram adquiridas 1 dia após a semeadura. (E) Imagens representativas da co-cultura final de HBVP e hCMEC/D3 e da monocultura hCMEC/D3. As imagens foram adquiridas 8 dias após a semeadura do HBVP e 7 dias após a semeadura do hCMEC/D3. (F) Imagens representativas de co-cultura de células BPLC e EECM-BMEC-like falhadas e bem-sucedidas e monocultura de células EECM-BMEC-like. As imagens foram adquiridas 7 dias após a semeadura BPLC e 6 dias após a semeadura EECM-BMEC. As culturas de BPLC subsemeadas não têm cobertura suficiente, enquanto as culturas de BPLC sobresemeada crescerão superconfluentes e começarão a se aglomerar/recuar. Barras de escala = 100 μm (C-F). Abreviações: HBVPs = pericitos vasculares cerebrais humanos; hiPSC = células-tronco pluripotentes induzidas por humanos; BPLCs = células semelhantes a pericitos cerebrais derivadas de hiPSC. Clique aqui para ver uma versão maior desta figura.
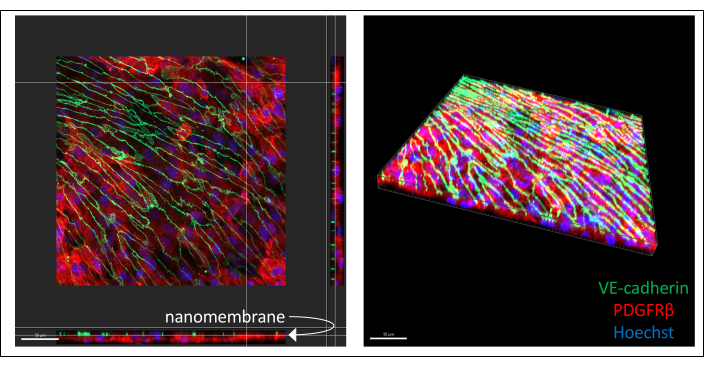
Figura 3: Imagens representativas da co-cultura celular derivada de hiPSC imunocorada em dispositivos. As células foram coradas para o marcador de células endoteliais VE-caderina (verde), marcador de pericitos PDGFRβ (vermelho) e corante nuclear (azul). Duas camadas de células podem ser vistas próximas, separadas apenas por uma fina nanomembrana de nitreto de silício (seta branca marca a localização da membrana na imagem à esquerda). Barra de escala = 50 μm. Abreviações: hiPSC = human induced pluripotent stem cell; PDGFRβ = receptor beta do fator de crescimento derivado de plaquetas. Clique aqui para ver uma versão maior desta figura.
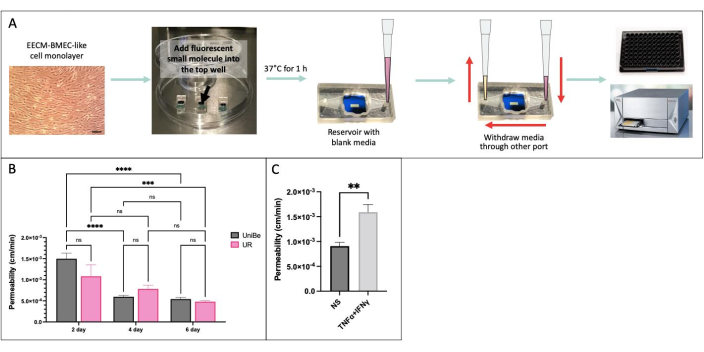
Figura 4: Ensaio de permeabilidade de pequenas moléculas baseado em amostragem. (A) Esquema do fluxo de trabalho experimental. (B) Demonstração da reprodutibilidade interlaboratorial entre dois laboratórios fisicamente distantes da Universidade de Berna (UniBe), Suíça, e da Universidade de Rochester (UR), NY, EUA: células endoteliais derivadas de hiPSC foram cultivadas no aparelho de μSiM por 2, 4 ou 6 dias e em filtros transwell por 6 dias. O ensaio de permeabilidade foi realizado utilizando-se 150 μg/mL de Amarelo Lúcifer (457 Da). A barra vermelha indica os dados de permeabilidade à fluoresceína sódica (376 Da) previamente publicados das mesmas células endoteliais derivadas da hiPSC cultivadas por 6 dias em filtros transwell40. N = 4-16 por grupo. Utilizou-se ANOVA two-way com post hoc de Tukey, e as comparações foram apresentadas apenas para p relevante < 0,05. (C) Demonstração da resposta de citocinas usando células EECM-BMEC-like derivadas de hiPSC cultivadas no μSiM por 2 dias; 0,1 ng/mL de TNFα + 2 UI/mL de IFNγ) ou meio controle (não estimulado, NS) foi adicionado à câmara superior por 20 horas antes do ensaio de permeabilidade usando 150 μg/mL de Lucifer Yellow. N = 3 por grupo. Teste t de Student, p < 0,05. Clique aqui para ver uma versão maior desta figura.
| Área de superfície de semeadura da câmara superior | Volume do poço superior | Área de superfície de semeadura da câmara inferior | Volume do canal inferior |
| ~37 milímetros2 | 100 μL (pode conter ≥115 μL) | ~42 milímetros2 | 10 μL (pipetar 20 μL para evitar bolhas) |
Tabela 1: Área superficial e volumes críticos de μSiM.
| Alvo | Fixador | Solução de bloqueio | Diluição |
| VE-caderina | 4% PFA ou 100% MeOH | 5% GS + 0,4% Tx-100 ou 10% GS + 0,3% Triton X-100 | 1:50 |
| CD31 | 4% PFA ou 100% MeOH | 5% GS + 0,3-0,4% Triton X-100 | 1:100 |
| Claudin-5 | 100% MeOH | 5-10% GS + 0,3% Triton X-100 | 1:200 |
| ZO-1 | 100% MeOH | 5-10% GS + 0,3% Triton X-100 | 1:200 |
| Ocludina | 100% MeOH | 5-10% GS + 0,3% Triton X-100 | 1:50 |
| PDGFRβ | 4% PFA | 5% GS + 0,4% Triton X-100 | 1:100 |
| GN2 | 4% PFA | 5% GS + 0,4% Triton X-100 | 1:100 |
| Cabra α-Mouse IgG Alexa Fluor 488 | 1:200 | ||
| Cabra α-Mouse IgG Alexa Fluor 568 | 1:200 |
Tabela 2: Anticorpos e métodos de coloração validados para imunocitoquímica de co-cultura em dispositivos de μSiM. Abreviações: PFA = paraformaldeído; MeOH = metanol; GS = soro caprino.
Arquivo Suplementar 1: Modelo para cálculo do valor de permeabilidade. Clique aqui para baixar este arquivo.
Discussion
Embora os chips de membrana tenham sido projetados para estabilidade, eles podem trincar ou quebrar se manuseados incorretamente durante a montagem. Assim, é fundamental segurar o chip nos entalhes da pinça do chip e colocá-lo suavemente no acessório. Ao manusear os dispositivos em geral, deve-se tomar cuidado extra para não bater ou soltar os dispositivos. Durante a colagem do chip de membrana ao acessório A1, o chip deve ser colocado plano e centrado no pilar do acessório A1 para evitar rachaduras na membrana durante a colagem ao componente 1. Além disso, qualquer contato com as camadas de PSA expostas deve ser evitado após a remoção das máscaras de proteção. Ao manusear o componente 2 após a remoção das máscaras de proteção, é aconselhável segurá-lo ao longo da borda do componente e usar pinças para agarrar o canto do triângulo que é livre de PSA.
Enquanto protocolos de cultura celular foram descritos para possíveis modelos de BBB, o modelo de co-cultura BMEC/pericyte da BBB aqui descrito pode ser suficiente ou insuficiente, dependendo do contexto fisiológico e das questões de interesse. Por exemplo, o tráfego de células imunes ocorre em grande parte nas vênulas pós-capilares do cérebro41,42. Nessas regiões, um espaço perivascular separa a barreira BMEC/pericitos dos limites gliais estabelecidos pelos astrócitos. Assim, nas vênulas pós-capilares, a unidade neurovascular (NVU) compreende duas barreiras fisicamente separadas em série, e os pés finais astrocitários não entram em contato direto com a BMEC/barreira sanguínea pericitária, o que é bem representado pelo modelo atual. Se o objetivo for um modelo de NVU que explique o impacto dos fatores secretados pelos astrócitos na barreira sanguínea, um compartimento astrócito poderia ser adicionado ao dispositivo que permite a troca de fatores solúveis através do espaço perivascular. Este exemplo foi ilustrado anteriormente 34 e poderia ser estendido para incluir outras células, como a micróglia e neurônios em um compartimento3D "cérebro". A arquitetura modular da plataforma permite que estratégias de montagem simples sejam usadas para alcançar essas reconfigurações de modo que a plataforma seja tão simples ou complexa quanto necessário para abordar as hipóteses em questão. Configuração de cada cultura celular; no entanto, deve ser otimizado para novas linhagens celulares e multiculturas. Por exemplo, devido às propriedades das membranas de nitreto de silício, as soluções de revestimento podem precisar ser ajustadas em comparação com as placas de cultura de tecido. A inclusão de fibronectina tipicamente auxilia na fixação e sobrevivência celular. Além disso, os usuários poderiam cultivar células endoteliais e pericitos em direções opostas. Nesse caso, pode ser necessário modificar, por exemplo, a forma como as medidas de permeabilidade são feitas e interpretadas. Fornecer passos para esse tipo de cultura, no entanto, está além do escopo deste artigo.
Outro desafio que pode ser encontrado durante a cultura celular é a rápida evaporação dos meios, uma vez que os dispositivos podem ser mais sensíveis a alterações no ambiente em comparação com placas e frascos de cultura de tecidos padrão. Se o excesso de evaporação for observado ou o crescimento celular for retardado, todos os parâmetros críticos da incubadora devem ser medidos para garantir ajustes precisos. Mais água pode ser adicionada à tampa do tecido ou à pequena placa de Petri colocada dentro da câmara de cultura celular, ou os meios devem ser trocados com mais frequência. Além disso, as bolhas podem entrar no canal inferior e ficar presas na trincheira para dispositivos de trincheira. Embora eles possam ser removidos, é mais fácil evitar a adição de bolhas em primeiro lugar. Para fazer isso, é importante verificar se não há bolhas na ponta da pipeta ou ar na extremidade da ponta da pipeta antes de pipetar o meio para a câmara inferior. Além disso, a evaporação do meio no canal pode levar a uma lacuna entre a superfície do meio e o topo da porta. Um pequeno volume de mídia pode ser pipetado em uma porta até que a mídia atinja a superfície da porta oposta, após o que a mídia pode ser trocada nessa porta oposta. Enquanto os meios hECSR e E6 + 10% FBS não devem ser aquecidos em banho-maria, outros meios podem ser pré-aquecidos para reduzir a formação de bolhas. Se uma bolha entrar na câmara inferior, ela pode ser removida pipetando rapidamente 100 μL através do canal. No entanto, este método pode levar à contaminação entre câmaras ou meios derramados pela superfície do dispositivo. Também pode interromper as camadas celulares. Alternativamente, a mídia pode ser removida do canal primeiro e depois reintroduzida com um volume de 50 μL. Remover a mídia primeiro, no entanto, pode resultar em mais formação de bolhas no canal. Se uma bolha não estiver diretamente sob a área da membrana, ela pode ser deixada no canal sem efeitos na cultura celular.
A fixação e o crescimento dos pericitos, como demonstrado na Figura 2, podem ser desafiadores. O uso de uma densidade de semeadura otimizada é essencial para a formação de uma camada com uma relação perícito-célula endotelial fisiologicamente relevante. Além disso, como os pericitos são sensíveis ao cisalhamento, todas as trocas de mídia no canal devem ser feitas muito lentamente para proteger as células. Para a cultura de CPPC, uma melhor fixação pode ser obtida revestindo-se a câmara inferior com 800 μg/mL de colágeno tipo IV ou 100 μg/mL de fibronectina.
A imunocitoquímica nos dispositivos aqui descritos permite a análise qualitativa da saúde e função celular. Os métodos de coloração em placas de cultura de tecidos ou outras plataformas devem ser diretamente traduzíveis para a plataforma. Para cultura celular apenas na câmara superior, após a fixação, o PBS pode ser adicionado à câmara inferior e deixado para as etapas restantes, com bloqueio e coloração feitos apenas na câmara superior. Isso minimiza os riscos de quebrar as membranas ou obter bolhas na câmara inferior. Para coloração de cocultura, recomendamos o uso de ambas as câmaras em todas as etapas. É importante notar que a viscosidade do fixador e PBS é diferente da do meio. Assim, pode ser mais fácil adicionar bolhas na câmara inferior, e deve-se tomar cuidado extra para verificar as pontas da pipeta para o ar no final da ponta antes de pipetar para a câmara inferior.
O protocolo descrito para o ensaio de permeabilidade de moléculas pequenas permite a avaliação funcional e quantitativa da função de barreira das células endoteliais cultivadas no aparelho de μSiM. Um problema que pode ser encontrado durante este ensaio é desenhar bolhas de ar na pipeta durante a coleta de amostra do canal inferior na etapa de protocolo 4.1.7.4. Para evitar esse problema, é importante certificar-se de que a ponta esteja selada na porta antes de iniciar a coleta de amostras e que a amostra não deve ser retirada muito rápido. Se isso não resolver o problema, o tamanho das pontas usadas pode ser muito pequeno ou muito grande para caber nas portas; use as dicas listadas na Tabela de Materiais. Se valores de permeabilidade inesperadamente altos forem medidos apesar de uma monocamada confluente de aparência saudável, a integridade da monocamada deve ser verificada quanto à interrupção durante a coleta da amostra. Recomendamos sempre verificar a monocamada ao microscópio imediatamente após a coleta da amostra. Se a monocamada ainda parece intacta e saudável, a amostra pode ser fixada e marcadores biológicos de função de barreira podem ser avaliados, por exemplo, via imunomarcação das proteínas juncionais. Por outro lado, se forem medidos valores de permeabilidade inesperadamente baixos, é importante garantir que 50 μL de meio sejam amostrados do canal inferior sem bolhas de ar. Se o meio sair do porto de amostragem assim que a ponta do reservatório for colocada, esse meio deve ser coletado antes de encaixar a pipeta no porto de amostragem, pois a maior parte da pequena molécula fluorescente estará presente no volume inicial de 10 μL amostrado do canal de fundo. Desenhar círculos ao redor das portas usando uma caneta hidrofóbica ou colocar uma fita hidrofóbica com um orifício ao redor da porta impede que qualquer mídia passivamente bombeada se espalhe. Se as bolhas forem retiradas durante a colheita de amostras ou se a amostra total de 50 μL não for removida, a amostra não deve ser utilizada. Alternativamente, o volume exato pode ser determinado e usado no cálculo da permeabilidade; no entanto, isso só deve ser feito se o volume removido for de ≥40 μL, o que corresponde a ~98-99% de recuperação do corante34.
Disclosures
J.L.M. é co-fundador da SiMPore e detém participação acionária na empresa. A SiMPore está comercializando tecnologias ultrafinas à base de silício, incluindo as membranas usadas neste estudo.
Acknowledgements
J.L.M., B.E., T.R.G., M.C.M., P.K., M.T., K.C. e L.W. foram financiados pelo NIH grant R33 HL154249. J.L.M. foi financiado pela R44 GM137651. M.M. foi financiado pelo Schmidt Program Award Del Monte Institute for Neuroscience, Universidade de Rochester. M.T. foi financiado pela RF1 AG079138. K.C. foi financiado pela International Foundation for Ethical Research.
Materials
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| CD31 Polyclonal antibody | Thermo Fisher Scientific | PA5-32321 | |
| Claudin-5 mouse IgG antibody, 4C3C2 | Thermo Fisher Scientific | 35-2500 | |
| Goat α-Mouse IgG Alexa Fluor 488 | Thermo Fisher Scientific | A11001 | |
| Goat α-Rabbit IgG Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | |
| Hoechst 33342 | Life Technologies | H3570 | |
| NG2, mouse IgG2a, 9.2.27 | Millipore | MAB2029 | |
| Occludin mouse IgG antibody, OC-3F10 | Thermo Fisher Scientific | 33-1500 | |
| PDGFRβ, rabbit IgG antibody, 28E1 | Cell Signaling Technology | 3169 | |
| VE-cadherin mouse IgG2B Clone # 123413 | R&D Systems | MAB9381 | |
| ZO-1 rabbit IgG antibody, polyclonal | Thermo Fisher Scientific | 40-2200 | |
| Chemicals, peptides, and recombinant proteins | |||
| 100% Methanol | VWR | 101443-718 | Can be substituted with similar products |
| 16% Paraformaldehyde | Thermo Fisher Scientific | 28908 | Can be substituted with similar products |
| Accutase | Thermo Fisher Scientific | A1110501 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| B27 supplement | Thermo Fischer Scientific | 17504044 | |
| bFGF | R&D Systems | 233-FB-025 | |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | |
| Collagen, Type I solution from rat tail | Sigma-Aldrich | C3867-1VL | Can be substituted with similar products |
| DMEM/Ham’s F12 | Thermo Fisher Scientific | 11320033 | |
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Essential 6 medium | Thermo Fisher Scientific | A1516401 | |
| Fetal bovine serum (FBS) | Peak Serum | PS-FB1 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | |
| Fibronectin human protein, plasma | ThermoFisher Scientific | 33016015 | Can be substituted with similar products |
| hESFM | Thermo Fisher Scientific | 11111044 | |
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | 861502 | |
| Normal goat serum | Thermo Fisher Scientific | 500627 | Can be substituted with similar products |
| PBS without calcium, magnesium | Cytiva | SH30256.01 | Can be substituted with similar products |
| Pericyte Medium | ScienCell | 1201 | Use complete kit (includes supplements) |
| Poly-L-Lysine, 10 mg/mL | ScienCell | 0413 | |
| Triton X-100 | JT Baker | X198-05 | Can be substituted with similar products |
| UltraPure DNase/RNase-Free Distilled Water | Invitrogen™ | 10977015 | Can be substituted with similar products |
| Experimental models: Cell lines | |||
| Blood-brain barrier hCMEC/D3 cell line | Sigma-Aldrich | SCC066 | |
| Human brain vascular pericytes | ScienCell | 1200 | |
| iPS(IMR90)-4 human induced pluripotent stem cells | WiCell | RRID:CVCL_C437 | |
| Glassware and Plasticware | |||
| 150 mm TC-treated Cell Culture Dish with 20 mm Grid | Falcon | 353025 | |
| Clamps | VWR | MFLX06832-10 | |
| Corning tissue culture plates (6-well) | Corning | 3506 | |
| Flat 96-well non-binding microplates | Greiner Bio-One | 655900 | |
| Microscope Slide Device Holder | SiMPore | USIM-SB | Dimensions compatible with micropscope slide holders |
| Nunc 15 mL Conical Sterile Polypropylene Centrifuge Tubes | Thermo Fischer Scientific | 339651 | |
| Nunc 50 mL Conical Sterile Polypropylene Centrifuge Tubes | Thermo Fischer Scientific | 339653 | Tube caps can be filled with water for cell culture |
| P20-200 pipette tips | VWR | 76322-516 | Alternate brands may not seal as effectively into ports |
| Transwell filters (12 well, 12 mm, 0.4 μm pore size, PC) | CoStar | 3401 | |
| Instruments | |||
| 10X Objective (For Andor) | Nikon Instruments Inc. | MRD00105 | Air; WD: 4 mm; NA 0.45 |
| 10X Objective (For Nikon) | Nikon Instruments Inc. | MRP40102 | Air; WD: 6.2 mm; NA 0.25 |
| 40X Objective (LWD) (For Andor) | Nikon Instruments Inc. | MRD77410 | Water immersion; WD: 590-610 mm; NA 1.15 |
| Andor Spinning Disc Confocal microscope | Oxford Instruments, Andor | ||
| Nikon Eclipse Ts2 Phase Contrast Microscope | Nikon Instruments Inc. | Can be substituted with similar products | |
| TECAN Infinite M200 | TECAN | Can be substituted with similar products | |
| Other | |||
| Advanced PAP Pen | Millipore Sigma | Z672548 | 2 mm tip is recommended |
| Assembly kit with fixtures | SiMPore | USIM-JIGSET | Including fixure A1, A2, B1, and B2 |
| Camera Adapter for Microscopes | AmScope | CA-CAN-SLR Canon SLR / D-SLR | Φ23.2 - Φ30 adapter fits Nikon Eclipse Ts2 |
| Canon EOS Rebel SL3 DSLR Camera | Canon | EOS 250D, BH #CAEDRSL3B, MFR #3453C001 | Can be substituted with similar products |
| Cell strainer, 40 µm | Millipore Sigma (Corning) | CLS431750 | |
| Component 1 | SiMPore | USIM-C1 | |
| Component 2 | SiMPore | USIM-C2 | |
| Membrane chips | SiMPore | NPSN100-1L | Other chips formats are available |
| SMD handling tweezer double angle | Techni-Tool | 758TW003 | "Chip Tweezers" |
| Stainless steel precision type GG tweezer | Techni-Tool | 758TW534 | "Straight Tweezers" |
| Software | |||
| Fiji | ImageJ | For image processing | |
| Fusion | Oxford Instruments, Andor | Instructions for version 2.3.0.44 | |
| i-control | TECAN | Instructions for version 2.0 | |
| Imaris | Oxford Instruments | For image processing. Instructions for version 9.9.0 |
References
- Villabona-Rueda, A., Erice, C., Pardo, C. A., Stins, M. F. The evolving concept of the blood brain barrier (BBB): from a single static barrier to a heterogeneous and dynamic relay center. Frontiers in Cellular Neuroscience. 13, 405 (2019).
- Nation, D. A., et al. Blood-brain barrier breakdown is an early biomarker of human cognitive dysfunction. Nature Medicine. 25 (2), 270-276 (2019).
- Ferrari, C. C., Tarelli, R. Parkinson's disease and systemic inflammation. Parkinsons Disease. 116 (3), 436813 (2011).
- Koch, E. V., Ledwig, V., Bendas, S., Reichl, S., Dietzel, A. Tissue barrier-on-chip: a technology for reproducible practice in drug testing. Pharmaceutics. 14 (7), 1451 (2022).
- Nishihara, H., et al. Intrinsic blood-brain barrier dysfunction contributes to multiple sclerosis pathogenesis. Brain. 145 (12), 4334-4348 (2022).
- Ortiz, G. G., et al. Role of the blood-brain barrier in multiple sclerosis. Archives of Medical Research. 45 (8), 687-697 (2014).
- Orhun, G., et al. Association between inflammatory markers and cognitive outcome in patients with acute brain dysfunction due to sepsis. Archives of Neuropsychiatry. 56 (1), 63-70 (2019).
- Chen, Y., Yang, W., Chen, F., Cui, L. COVID-19 and cognitive impairment: neuroinvasive and blood-brain barrier dysfunction. Journal of Neuroinflammation. 19 (1), 222 (2022).
- Hughes, C. G., et al. Endothelial activation and blood-brain barrier injury as risk factors for delirium in critically ill patients. Critical Care Medicine. 44 (9), e809-e817 (2016).
- Saraiva, C., et al. Nanoparticle-mediated brain drug delivery: Overcoming blood-brain barrier to treat neurodegenerative diseases. Journal of Control Release. 235 (10), 34-47 (2016).
- Jolliet-Riant, P., Tillement, J. P. Drug transfer across the blood-brain barrier and improvement of brain delivery. Fundamental & Clinical Pharmacology. 13 (1), 16-26 (1999).
- Abbott, N. J., et al. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2009).
- Siflinger-Birnboim, A., et al. Molecular sieving characteristics of the cultured endothelial monolayer. Journal of Cellular Physiology. 132 (1), 111-117 (1987).
- Bischoff, I., et al. Pitfalls in assessing microvascular endothelial barrier function: impedance-based devices versus the classic macromolecular tracer assay. Scientific Reports. 6, 23671 (2016).
- van der Helm, M. W., van der Meer, A. D., Eijkel, J. C., van den Berg, A., Segerink, L. I. Microfluidic organ-on-chip technology for blood-brain barrier research. Tissue Barriers. 4 (1), e1142493 (2016).
- Osaki, T., Shin, Y., Sivathanu, V., Campisi, M., Kamm, R. D. In vitro microfluidic models for neurodegenerative disorders. Advanced Healthcare Materials. 7 (2), (2018).
- Girard, S. D., et al. High and low permeability of human pluripotent stem cell-derived blood-brain barrier models depend on epithelial or endothelial features. FASEB Journal. 37 (2), e22770 (2023).
- Vigh, J. P., et al. Transendothelial electrical resistance measurement across the blood-brain barrier: a critical review of methods. Micromachines. 12 (6), 685 (2021).
- Lea, T., et al., Verhoeckx, K., et al. Caco-2 cell line. The Impact of Food Bioactives on Health: in vitro and ex vivo models. , (2015).
- Felix, K., Tobias, S., Jan, H., Nicolas, S., Michael, M. Measurements of transepithelial electrical resistance (TEER) are affected by junctional length in immature epithelial monolayers. Histochemistry and Cell Biology. 156 (6), 609-616 (2021).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- Mossu, A., et al. A silicon nanomembrane platform for the visualization of immune cell trafficking across the human blood-brain barrier under flow. Journal of Cerebral Blood Flow and Metabolism. 39 (3), 395-410 (2019).
- Castro Dias, M., et al. Brain endothelial tricellular junctions as novel sites for T-cell diapedesis across the blood-brain barrier. Journal of Cell Science. 134 (8), jcs253880 (2021).
- Hudecz, D., et al. Ultrathin silicon membranes for in situ optical analysis of nanoparticle translocation across a human blood-brain barrier model. ACS Nano. 14 (1), 1111-1122 (2020).
- Khire, T. S., et al. Microvascular mimetics for the study of lukocyte-endothelial interactions. Cellular and Molecular Bioengineering. 13 (2), 125-139 (2020).
- Salminen, A. T., et al. Endothelial cell apicobasal polarity coordinates distinct responses to luminally versus abluminally delivered TNF-alpha in a microvascular mimetic. Integrative Biology: Quantitative Biosciences from Nano to Macro. 12 (11), 275-289 (2020).
- DesOrmeaux, J. P. S., et al. Nanoporous silicon nitride membranes fabricated from porous nanocrystalline silicon templates. Nanoscale. 6 (18), 10798-10805 (2014).
- Hill, K., et al. Second generation nanoporous silicon nitride membranes for high toxin clearance and small format hemodialysis. Advanced Healthcare Materials. 9 (4), e1900750 (2020).
- Salminen, A. T., et al. Ultrathin dual-scale nano- and microporous membranes for vascular transmigration models. Small. 15 (6), e1804111 (2019).
- Gillmer, S. R., et al. Predicting the failure of ultrathin porous membranes in bulge tests. Thin Solid Films. 631, 152-160 (2017).
- Ishimatsu, R., et al. Ion-selective permeability of ultrathin nanopore silicon membrane as studied using nanofabricated micropipet probes. Analytical Chemistry. 82 (17), 7127-7134 (2010).
- Kim, E., et al. A structure-permeability relationship of ultrathin nanoporous silicon membrane: a comparison with the nuclear envelope. Journal of American Chemical Society. 130 (13), 4230-4231 (2008).
- Snyder, J. L., et al. An experimental and theoretical analysis of molecular separations by diffusion through ultrathin nanoporous membranes. Journal of Membrane Science. 369 (1-2), 119-129 (2011).
- McCloskey, M. C., et al. The modular µSiM: a mass produced, rapidly assembled, and reconfigurable platform for the study of barrier tissue models in vitro. Advanced Healthcare Materials. 11 (18), e2200804 (2022).
- Mansouri, M., et al. The modular microSiM reconfigured: integration of microfluidic capabilities to study in vitro barrier tissue models under flow. Advanced Healthcare Materials. 11 (21), e2200802 (2022).
- Su, S. -. H., et al. A tissue chip with integrated digital immunosensors: In situ brain endothelial barrier cytokine secretion monitoring. Biosensors and Bioelectronics. 224, 115030 (2023).
- Nishihara, H., et al. Differentiation of human pluripotent stem cells to brain microvascular endothelial cell-like cells suitable to study immune cell interactions. STAR Protocols. 2 (2), 100563 (2021).
- Hudecz, D., et al. Ultrathin silicon membranes for in situ optical analysis of nanoparticle translocation across a human blood-brain barrier model. ACS Nano. 14 (1), 1111-1122 (2020).
- Gastfriend, B. D., Stebbins, M. J., Du, F., Shusta, E. V., Palecek, S. P. Differentiation of brain pericyte-like cells from human pluripotent stem cell-derived neural crest. Current Protocols. 1 (1), e21 (2021).
- Nishihara, H., et al. Advancing human induced pluripotent stem cell-derived blood-brain barrier models for studying immune cell interactions. FASEB Journal. 34 (12), 16693-16715 (2020).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- Bechmann, I., Galea, I., Perry, V. H. What is the blood-brain barrier (not). Trends in Immunology. 28 (1), 5-11 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved