Использование барьерной тканевой платформы MicroSiM (μSiM) для моделирования гематоэнцефалического барьера
In This Article
Summary
В этом отчете представлены протоколы сборки, культивирования клеток и анализов на платформе μSiM для построения моделей гематоэнцефалического барьера.
Abstract
microSiM (μSiM) представляет собой мембранную культуральную платформу для моделирования гематоэнцефалического барьера (ГЭБ). В отличие от традиционных мембранных платформ, μSiM предоставляет экспериментаторам новые возможности, включая визуализацию живых клеток, беспрепятственную паракринную передачу сигналов между камерами крови и мозга, а также возможность прямой визуализации иммунофлуоресценции без необходимости извлечения/перемонтажа мембран. В данной работе мы демонстрируем базовое использование платформы для создания монокультурных (эндотелиальные клетки) и кокультуральных (эндотелиальные клетки и перициты) моделей ГЭБ с использованием ультратонких нанопористых мембран из нитрида кремния. Мы продемонстрировали совместимость как с первичными клеточными культурами, так и с культурами индуцированных плюрипотентных стволовых клеток человека (ИПСК). Представлены методы качественного анализа моделей ГЭБ методом иммунофлуоресцентного окрашивания и продемонстрировано использование μSiM для количественной оценки барьерной функции в анализе проницаемости малых молекул. Предоставленные методы должны позволить пользователям создавать свои барьерные модели на платформе, продвигая использование технологии тканевых чипов для изучения тканей человека.
Introduction
Живые ткани разделены специализированными клетками, которые создают и поддерживают барьеры и регулируют, какие клетки и молекулы транспортируются из одного отсека в другой. Неправильная регуляция барьерных функций может быть источником как острых, так и хронических заболеваний. Гематоэнцефалический барьер (ГЭБ) является наиболее рестриктивным тканевым барьером в организме человека1. Дисфункция ГЭБ лежит в основе широкого спектра заболеваний центральной нервной системы (ЦНС), включая болезнь Альцгеймера2, болезнь Паркинсона3,4 и рассеянный склероз 5,6. Повреждение ГЭБ также связано с долгосрочными когнитивными нарушениями в результате острых расстройств, таких как сепсис7, COVID-198 и послеоперационный делирий9. Разработка лекарств с потенциалом для лечения заболеваний головного мозга была удручающе трудной задачей из-за проблемы преднамеренного нарушения ГЭБ для доставки биологически активных молекул к мишенямв мозге. По этим причинам методы изучения функции ГЭБ in vitro имеют первостепенное значение для понимания и лечения заболеваний ЦНС.
Основные методы измерения барьерной функции in vitro включают создание монослоя или кокультуры на полупроницаемой мембране и измерение сопротивления, придаваемого клетками либо диффузии малых молекул, либо небольшим электрическим токам. Несмотря на то, что появление микрофизиологических систем (МПС) привело к обилию вариантов моделирования ГЭБ в 3D15,16, разнообразие геометрий систем затрудняет сравнение измерений проницаемости между МПС или установленными литературными значениями. Установление достоверных исходных значений особенно важно в исследованиях ГЭБ, где из-за обширной барьерной регуляции эндотелиальными клетками сосудов головного мозга значения проницаемости in vitro тщательно изучаются12,17,18. По этим причинам измерения проницаемости в монослоях, установленных на 2D-мембранах, останутся основным элементом исследований ГЭБ в течение многих лет. Это справедливо и для других тканевых барьеров, включая эпителиальные барьеры, где абсолютные значения исходной проницаемости используются для валидации и сравнения моделей in vitro 19,20,21.
С целью создания нового ценного инструмента для исследовательского сообщества BBB, мы представили22 и усовершенствовали 23,24,25,26 микроустройствос платформойSilicon membrane (μSiM) для использования в моделировании барьерных тканей в течение последних 5 лет. Отличительной особенностью платформы является ультратонкая (толщиной <100 нм) мембрана с сотнями миллионов нанопор 27,28 или смесь нанопор и микропор29. Отдельно стоящие мембранные чипы производятся на кремниевом «чипе» размером 300 мкм, который стабилизирует ультратонкие структуры30 и позволяет использовать пинцет для сборки устройства. Из-за своей ультратонкой природы мембраны имеют проницаемость, которая на два порядка выше, чем у обычных мембран с трековым травлением, используемых в коммерческих мембранных установках для культивирования мембран31,32. На практике это означает, что препятствие мембраны для диффузии молекул меньшего размера, чем нанопоры (<60 нм), ничтожно мало33. Таким образом, для клеточных барьеров только клетки и матрицы, которые они депонируют, будут определять скорость транспорта малых молекул из апикальных в базальные компартменты, разделенные мембраной34. Конструкция прибора и ультратонкая природа мембран также обеспечивают множество преимуществ для оптической микроскопии. К ним относятся: 1) возможность наблюдения за живыми культурами с помощью фазового контраста или визуализации яркого поля, 2) способность флуоресцентного окрашивания и изображения in situ без необходимости извлечения и переноса мембраны на покровное стекло, и 3) тот факт, что мембраны тоньше, чем конфокальные «срезы», так что прямые кокультуры имеют более естественное расстояние между типами клеток, чем это может быть достигнуто с помощью мембран толщиной 6-10 мкм с трековым травлением.
Совсем недавно мы перевели платформу в модульный формат, чтобы облегчить быструю сборку34 и настройку35,36. Мы использовали модульный формат для распределения компонентов устройств между нашими биоинженерными и сотрудничающими лабораториями мозгового барьера. Затем мы совместно разработали протоколы для сборки устройств, монокультуры и совместного культивирования, иммунофлуоресцентного окрашивания и проницаемости малых молекул и показали, что эти методы воспроизводимы в разных лабораториях. Используя эти протоколы, мы также показали, что модульная платформа поддерживает валидированный ГЭБ, разработанный с использованием метода расширенного эндотелиального культивирования (EECM) для создания микрососудистых эндотелиальных клеток головного мозга (BMEC) из индуцированных плюрипотентных стволовых клеток человека (ИПСК)37. Цель настоящего отчета состоит в том, чтобы более подробно рассмотреть эти методы и с помощью сопроводительного видео способствовать более широкому внедрению платформы в сообществе BBB.
Protocol
1. Сборка устройства μSiM
ПРИМЕЧАНИЕ: Этот метод описывает сборку устройств. Мембранная стружка имеет траншейную и плоскую стороны, которые могут быть собраны траншей вверх или вниз. Траншейные устройства чаще всего используются для культивирования клеток.
- В стерильной среде (например, в биозащитном колпаке) подготовьте все материалы для сборки, включая монтажные приспособления, компоненты, мембранные чипы и пинцет.
- Поместите мембранный чип в центр приспособления A1 с помощью пинцета для стружки. Плоская поверхность стружки обращена вниз, а область траншеи — вверх для траншейных устройств, и наоборот для траншейных устройств.
ПРИМЕЧАНИЕ: Следующие этапы сборки проиллюстрированы на примере траншейного устройства, которое позволяет создать плоскую зону роста в верхней камере. - Прикрепите компонент 1 к микросхеме. Сначала снимите синие защитные слои с обеих сторон компонента 1 с помощью прямого пинцета и поместите его в приспособление A1 верхней камерой вниз. Осторожно прижмите компонент 1 до тех пор, пока чувствительный к давлению клей (PSA) не коснется чипа.
- Установите приспособление A2 на приспособление A1 и сильно надавите на него в разных углах, чтобы обеспечить плотное прилегание чипа и компонента.
ПРИМЕЧАНИЕ: Следите за тем, чтобы не снимать слой PSA. Это прозрачный и более жесткий слой по сравнению с синими защитными слоями. - Соедините компонент 2 с компонентом 1 с чипом. Сначала подготовьте компонент 2, захватив один угол компонента 2 прямым пинцетом и отклеив его от листа. Затем захватите «треугольную» область компонента 2, не содержащую ПСА, и вместе снимите толстый прозрачный защитный слой и синий слой компонента 2, обнажив поверхность ПСА. Поместите компонент 2 в приспособление B1 стороной PSA вверх.
- Поместите компонент 1 с мембранной стружкой в приспособление B1 верхней камерой вверх.
- Поместите приспособление B2 на компонент 1 и сильно надавите на разные углы приспособления B2.
- Выньте собранное устройство из приспособления и прямым пинцетом выдавите все пузырьки воздуха на нижней стороне устройства и запечатайте края канала, избегая контакта с областью мембраны. Перед использованием для культивирования клеток ультрафиолетовую (УФ) стерилизовать только что собранные устройства в течение 20 минут.
2. Клеточная культура
ПРИМЕЧАНИЕ: Этот метод описывает протоколы для первичных культур и культур, полученных из ИПСК, на платформе. Методы описывают монокультуру эндотелиальных клеток в верхней камере устройства и кокультуру перицитов и эндотелиальных клеток с перицитами в нижней камере и эндотелиальными клетками в верхней камере траншейных собранных устройств. Размеры и объемы камер см. в таблице 1. Это наиболее распространенные форматы; Тем не менее, в зависимости от потребностей пользователя могут использоваться и другие макеты клеточных культур.
- Подготовка камеры для клеточных культур
- Соберите устройства в соответствии с протоколом, описанным в разделе 1.
- Поместите устройства в стерильные хомуты для шлангов. Перед культивированием клеток стерилизуйте зажимы, замочив их в этаноле на ≥20 мин. Повторно стерилизуйте после каждого эксперимента для повторного использования.
- Культивирование приборов в большой стерильной чашке Петри. Для дополнительной влажности добавьте небольшую чашку Петри или крышку конической пробирки объемом 50 мл, наполненную стерильной водой.
- Промойте верхнюю камеру приборов дважды 100 мкл стерильной воды. Для культивирования клеток в нижней камере промойте нижнюю камеру 20 мкл стерильной воды.
- Монокультура клеточной линии hCMEC/D3 (ГЭБ)
- Подготовьте камеру для культивирования клеток в соответствии с разделом 2.1.
- Покройте верхние камеры 25 мкг/см2 коллагена I и 5 мкг/см2 фибронектина человека, смешанного с фосфатно-солевым буфером (PBS). Оставьте на 1-2 часа при 37 °C или на ночь при 4 °C.
- Удалите раствор покрытия и добавьте 100 мкл предварительно подогретой эндотелиальной среды с обедненным фактором роста (пробирной среды) в верхнюю камеру и 20 мкл в нижнюю камеру. Для приготовления среды для анализа смешивают 100 мл эндотелиальной базальной среды + 400 мкл фактора роста фибробластов человека + 40 мкл гидрокортизона + 100 мкл гентамицина сульфата + 2 мл фетальной бычьей сыворотки.
- Прохождение клеток hCMEC/D3 по протоколу производителя; трипсинизацию клеток в инкубаторе с температурой 37 °С в течение 3-5 мин, а затем прекращение трипсинизации путем добавления предварительно подогретой эндотелиальной среды. Суспензию клеток переложить в центрифужную пробирку и центрифугу при 200 × г в течение 5 мин при комнатной температуре. Ресуспендируйте клеточные гранулы в пробирной среде и засевайте клетки в верхних камерах с плотностью 40 000-60 000 клеток/см2. Инкубируют устройства при 37 °C с 5% углекислым газом (СО2) в течение 2-4 ч для облегчения адгезии клеток. Например, для достижения 40 000 клеток/см2 на чипе 0,37см2 добавьте 100 мкл клеточного раствора с концентрацией 150 000 клеток/мл в верхнюю камеру.
ПРИМЕЧАНИЕ: Мы культивируем и пассируем hCMEC/D3 в соответствии с Hudecz et al.38, используя модифицированную формулу эндотелиальной питательной среды-2 (EGM-2) для поддержания клеток и «тестовую среду» со сниженным фактором роста после субкультуры для анализов. Другие составы сред должны быть совместимы с устройствами, хотя мы рекомендуем составы сред от Hudecz et al.38 , если пользователи испытывают проблемы с выживаемостью hCMEC/D3. - Через 2-4 ч для адгезии клеток замените их свежей средой в обеих камерах, чтобы удалить мертвые или неприкрепленные клетки.
- Поддерживайте приборы при температуре 37 °C с 5%CO2, меняя среду анализа в обеих камерах каждые 2-3 дня до начала эксперимента. Анализы обычно проводятся после 2 недель бактериологического исследования.
- Монокультура клеток, полученная из ИПСК EECM-BMEC
- Подготовьте камеру для культивирования клеток в соответствии с разделом 2.1.
- Приготовьте коллаген внутривенно из раствора плаценты человека, добавив 5 мл 0,5 мг/мл уксусной кислоты к 5 мг коллагена внутривенно для создания раствора 1 мг/мл. Оставьте раствор на ≥4 ч при температуре 4 °C для полного восстановления. Раствор стабилен при 4 °C в течение 2 недель.
- Покройте верхние камеры 100 мкл коллагена IV в соотношении 4:1:5, бычьего фибронектина и стерильной воды. Покрывать при температуре 37 °C в течение 2-4 ч.
- Удалите раствор покрытия и добавьте 100 мкл hECSR комнатной температуры в верхнюю камеру и 20 мкл в нижнюю камеру.
- Пассаж EECM-BMEC-подобных клеток по Nishihara et al.37; Добавьте к клеткам смесь ферментов для отделения клеток и перенесите в инкубатор при температуре 37 °C на 5-8 мин. Пипетируют клеточный раствор для выделения и добавления в 4 раза большего объема эндотелиальной среды в центрифужной пробирке. Центрифугу при 200 × г в течение 5 мин при комнатной температуре; ресуспендировать клетки в hECSR и семена в верхних камерах с плотностью 40 000 клеток/см2. Инкубируют устройства при 37 °C с 5% CO 2 в течение2-4 ч для облегчения адгезии клеток. Например, чтобы получить 40 000 клеток/см2, добавьте 100 мкл клеточного раствора из расчета 150 000 клеток/мл.
- Через 2-4 ч для адгезии клеток замените свежим hECSR в обеих камерах, чтобы удалить мертвые или неприкрепленные клетки.
- Поддерживайте приборы при температуре 37 °C с 5% CO 2, меняя hECSR в обеих камерах каждые1-2 дня до начала эксперимента. Анализы обычно проводятся на 6-й день посева.
- Совместное культивирование hCMEC/D3 и первичного сосудистого перицита головного мозга (HBVP)
- Перед сборкой устройства покройте микросхемы мембраны 2 мкг/см2 поли-L-лизина (ФАПЧ), смешанного с PBS. Нанесите 50-80 мкл ФАПЧ в капле только на ту сторону, которая будет обращена вниз в окончательной сборке устройства. Завершите процесс нанесения покрытия либо через 1-2 часа при 37 °C, либо в течение ночи при 4 °C.
- Удалите покрытие раствором. Промойте мембранные чипы стерильной сверхчистой водой и дайте им высохнуть.
- Соберите устройства в соответствии с протоколом, подробно описанным в разделе 1 выше, стороной с покрытием ФАПЧ вниз, и подготовьте камеру для культивирования клеток в соответствии с разделом 2.1.
- Покрыть верхние камеры в соответствии с разделом 2.2.2.
- Добавьте 50 мкл предварительно подогретой перицитарной среды в верхние камеры и добавьте 20 мкл в нижние каналы.
- Прохождение HBVP согласно протоколу производителя; Трипсинизацию клеток в инкубаторе при температуре 37 °С в течение 3-5 мин, затем прекращают трипсинизацию, добавляя предварительно подогретую перицитарную среду. Переложите клеточную суспензию в центрифужную пробирку и центрифугу при 200 × г в течение 5 мин при комнатной температуре. Ресуспендируйте клеточную гранулу в среде перицитов и засейте клетки в нижних камерах с плотностью 14 000-25 000 клеток/см2. Инвертируйте устройства, но сохраняйте воздушный интерфейс с верхними камерами, чтобы облегчить газообмен.
ПРИМЕЧАНИЕ: Воздушный интерфейс, необходимый во время инверсии, может быть достигнут путем переворачивания устройств после помещения их внутрь хомутов для шлангов и нажатия на все углы перед переворачиванием, или путем размещения устройств вверх дном на параллельных полосах акрила или силикона, расположенных на достаточном расстоянии друг от друга, чтобы верхние камеры оставались беспрепятственными. Возможно, потребуется оптимизировать плотность посева для каждого пользователя. Для достижения концентрации 14 000 клеток/см2 добавьте 20 мкл клеточной суспензии при концентрации ~590 000 клеток/мл. Обратите внимание, что 20 мкл пипетируется в нижнюю камеру, чтобы избежать образования пузырьков, но плотность рассчитывается с использованием объема нижней камеры, равного 10 мкл. - Инкубируют клетки при 37 °C с 5%СО2 в течение 2-4 ч в перевернутом положении для облегчения адгезии клеток.
- Через 2-4 ч для адгезии клеток переверните устройства в вертикальное положение и замените их свежей перицитарной средой в обеих камерах, чтобы удалить мертвые или неприкрепленные клетки.
- После засева перицитов высевают hCMEC/D3s в верхнюю камеру, следуя шагам 2.2.4-2.2.5. Переключите обе камеры на пробирную среду.
- Поддерживайте приборы при температуре 37 °C с 5% CO 2, меняя среду анализа в обеих камерах каждые1-2 дня до начала эксперимента. Первичная кокультура клеток обычно поддерживается в течение 6-8 дней перед анализом.
ПРИМЕЧАНИЕ: Если монокультуры HBVP будут сравниваться с монокультурами hCMEC/D3 или кокультурами hCMEC/D3 и HBVP, то через 2-3 дня после посева HBVP замените перицитарную среду средой для анализа.
- Кокультура EECM-BMEC-подобных клеток и перицитоподобных клеток головного мозга (BPLC), полученных из hiPSC,
- Подготовьте камеру для клеточных культур в соответствии с разделом 2.1 и покройте верхние камеры в соответствии с шагами 2.3.2-2.3.3.
- Удалите раствор покрытия и добавьте 50 мкл сыворотки Essential 6 Medium комнатной температуры + 10% фетальной бычьей сыворотки (E6 + 10% FBS) в верхнюю камеру.
- Прохождение БПЛК по Gastfriend et al.39; добавить к клеткам смесь ферментов для отслоения клеток и перенести в инкубатор при температуре 37 °C на 5-15 мин, пока ~90% клеток не округлятся. Пипетируйте клеточный раствор для сингуляризации и добавляйте в 4 раза больше объема DMEM/F12 в центрифужную пробирку объемом 50 мл, используя сетчатый фильтр 40 мкм для фильтрации и полного сингуляризации клеток. Переложить в центрифужную пробирку объемом 15 мл, центрифугировать при 200 × г в течение 5 мин при комнатной температуре, повторно суспендировать гранулы клеток в E6 + 10% FBS и высевать клетки в нижние камеры с плотностью 14 000-25 000 клеток/см2. Инвертируйте устройства, но сохраняйте воздушный интерфейс с верхней камерой для облегчения газообмена.
ПРИМЕЧАНИЕ: Воздушный интерфейс, необходимый во время инверсии, может быть достигнут путем переворачивания устройств после помещения их внутрь хомутов для шлангов и нажатия на все углы перед переворачиванием, или путем размещения устройств вверх ногами на параллельных полосах акрила или силикона, расположенных на достаточном расстоянии друг от друга, чтобы верхние камеры оставались беспрепятственными. Возможно, потребуется оптимизировать плотность посева для каждого пользователя. Для достижения концентрации 14 000 клеток/см2 добавьте 20 мкл клеточной суспензии при концентрации ~590 000 клеток/мл. Обратите внимание, что 20 мкл пипетируется в нижнюю камеру, чтобы избежать образования пузырьков, но плотность рассчитывается с использованием объема нижней камеры, равного 10 мкл. - Инкубируют клетки при 37 °C с 5%СО2 в течение 2-4 ч в перевернутом положении для облегчения адгезии клеток.
- Через 2-4 ч для адгезии клеток переверните устройства в вертикальное положение и замените на свежий E6 + 10% FBS в обеих камерах, чтобы удалить мертвые или неприкрепленные клетки.
- Через сутки после посева перицитов высейте EECM-BMEC-подобные клетки в верхнюю камеру, выполнив шаги 2.3.5-2.3.6. Переключите обе камеры в режим hECSR.
- Выдерживают приборы при температуре 37 °C с 5%СО2, заменяя среду анализа в обеих камерах каждые 1-2 дня до проведения эксперимента. Кокультуру, полученную из ИПСК, обычно поддерживают в течение 7 дней для АЖЖХ и 6 дней для ЭЭКМ-БМЭК-подобных клеток перед анализом.
ПРИМЕЧАНИЕ: Если монокультуры BPLC будут сравниваться с монокультурами EECM-BMEC или кокультурами EECM-BMEC и BPLC, то замените E6 + 10% FBS на hECSR через 1 день после посева BPLC.
3. Иммуноцитохимия
ПРИМЕЧАНИЕ: Этот метод описывает протокол иммуноцитохимического окрашивания и визуализации клеток, культивируемых в верхней и/или нижней части мембраны. Целью этого эксперимента является определение присутствия и расположения ключевых белков, которые должны быть обнаружены в ГЭБ, таких как адгезии и белки плотного соединения, а также белки клеточной идентичности. Альтернативные и живые методы окрашивания также совместимы с платформой.
- Фиксация и окрашивание на приборах
- Поместите первичные антитела на лед, чтобы они оттаяли.
- Приготовьте 4%-ный раствор параформальдегида (PFA) при комнатной температуре (например, разбавьте 16% PFA в 3-кратном объеме PBS) или охладите 100% метанолом при -20 °C.
- Создайте соответствующее решение для блокировки в соответствии с таблицей 2. Хранить на льду.
ПРИМЕЧАНИЕ: Для полного растворения Triton X-100 может потребоваться вихревое растворение. - Зафиксируйте ячейки, пипетируя 20 мкл фиксатора (например, PFA или метанола) в нижнюю камеру и 50 мкл в верхнюю камеру. Инкубируйте устройства в течение 10 мин (PFA) или 2 мин (метанол) при комнатной температуре.
- Промывка в течение 3 x 5 мин путем пипетирования 20 мкл PBS через нижнюю камеру и 100 мкл в верхнюю камеру.
- Блокируйте в течение 30 мин при комнатной температуре, добавляя 20 мкл блокирующего раствора в нижнюю камеру и 50 мкл блокирующего раствора в верхнюю камеру. Проверьте, нет ли пузырьков в нижней камере.
- Приготовьте раствор первичных антител, разбавив антитела (антитела) в блокирующем растворе в соответствии с таблицей 2. Хранить на льду.
- Окрасьте первичными антителами, добавив 20 мкл раствора первичного антитела в нижнюю камеру и заменив объем верхней камеры 50 мкл раствора первичного антитела. Проверьте, нет ли пузырьков в нижней камере. Инкубировать в течение 1 ч при комнатной температуре или в течение ночи при 4 °C.
- Промывка в течение 3 x 5 мин путем пипетирования 20 мкл PBS через нижнюю камеру и 100 мкл в верхнюю камеру.
- Приготовьте раствор вторичных антител, разбавив антитела (антитела) в блокирующем растворе в соответствии с таблицей 2. Хранить на льду в защищенном от света месте.
- Окрашивают вторичными антителами, добавляя 20 мкл раствора вторичных антител в нижнюю камеру и заменяя объем верхней камеры 50 мкл раствора вторичных антител. Проверьте, нет ли пузырьков в нижней камере. Выдерживают в течение 1 ч при комнатной температуре, защищенном от света.
- Промывка в течение 3 x 5 мин путем пипетирования 20 мкл PBS через нижнюю камеру и 100 мкл в верхнюю камеру.
- Приготовьте раствор для ядерной красителя. Разбавьте Hoechst 1:10 000 в PBS. Добавьте 20 мкл раствора ядерного красителя в нижнюю камеру и замените объем верхней камеры 50 мкл раствора ядерного красителя. Проверьте, нет ли пузырьков в нижней камере. Выдерживать 3 мин при комнатной температуре, защищенном от света.
- Удалите пятно, добавив 20 мкл PBS в нижнюю камеру и заменив объем верхней камеры на 100 мкл PBS. Немедленно визуализируйте устройства или храните их при температуре 4 °C в чашке Петри, завернутой в парапленку и защищенной от света до тех пор, пока они не будут готовы к съемке.
- Конфокальная визуализация
ПРИМЕЧАНИЕ: В этом разделе описывается визуализация устройств с помощью конфокального микроскопа с инвертированным вращающимся диском и 40-кратным объективом с большим рабочим расстоянием (LWD) (вода, WD 590-610, числовая апертура 1,15) в качестве примера. Сведения о рабочих расстояниях и совместимости объективов см. в дополнительных материалах McCloskey et al.34. Изображения всей площади мембраны также делаются с помощью 10-кратного объектива, чтобы убедиться, что 40-кратные изображения репрезентативны для всего поля. Обычно их снимают в широкоугольном поле.- Включите микроскоп и откройте программное обеспечение для обработки изображений.
- Настройте каналы в соответствии со свойствами вторичного антитела и ядерного красителя, используя режим конфокальной визуализации. Оптимизируйте мощность лазера и время экспозиции, чтобы гарантировать, что сигнал находится выше фона и уменьшает артефакты изображения.
- Для ядерного окрашивания по Хёхсту используйте возбуждение 405, излучение 450/50 полосы пропускания (BP), время экспозиции 500 мс, мощность лазера 50%. Для меток, использующих вторичное антитело, конъюгированное с Alexa Fluor (AF) 488, используйте возбуждение 488, излучение 525/50BP, время экспозиции 500 мс и мощность лазера 50%. Для меток, использующих вторичное антитело, конъюгированное с AF568, используйте возбуждение 561, излучение 600/50BP, время экспозиции 500 мс и 100% мощность лазера.
- Поместите устройство в держатель предметного стекла микроскопа верхней камерой вверх и установите в микроскоп с помощью держателя предметного стекла микроскопа. Включите Live и выберите канал для ядерного пятна. Найдите мембрану с помощью низкого объектива, убедившись, что прозрачная область мембраны из нитрида кремния находится по центру, так как свет не будет проходить через синюю твердую силиконовую область. После того, как устройство правильно отцентрировано и клеточный слой найден, переключитесь на 40-кратный объектив, смочите объектив и сосредоточьтесь на области мембраны, используя ядерное пятно в качестве ориентира.
- Включите создание образов z-stack и установите для параметра Режим сканирования значение Начало/Окончание. Задайте размер или количество шагов. Используя ручку грубой регулировки на микроскопе, установите начало сканирования в верхней части слоя эндотелиальных клеток, используя ядерный краситель в качестве ориентира, и конец сканирования в нижней части слоя перицита, используя ядерное окрашивание в качестве ориентира. Проверьте все каналы, чтобы убедиться, что все будет зафиксировано в поле визуализации.
ПРИМЕЧАНИЕ: Обычно мы используем автоматический шаг, который составляет ~0,2 мкм срезов. - Задайте имя изображения и нажмите Acquire , чтобы начать создание изображения. При необходимости повторите эти действия для разных областей.
- Обработайте конфокальные изображения с помощью ImageJ40 или Imaris.
- Для обработки в Imaris, перетащите файл изображения в программу, чтобы она открылась. Выберите « Разрез » в верхней строке меню, чтобы увидеть 2D-изображение плоскости x-y с соответствующими видами плоскостей x-z и y-z. Выберите 3D-вид в верхней строке меню, чтобы просмотреть 3D-изображение. Нажмите на изображение и перетащите его, чтобы повернуть. Выберите Снимок в верхней строке меню, чтобы сделать снимок.
4. Анализ проницаемости малых молекул
ПРИМЕЧАНИЕ: В этом разделе описывается методология количественных измерений барьерных свойств клеточных культур. Целью данного эксперимента является определение концентрации флуоресцентной малой молекулы, которая проходит через клеточные слои и попадает в нижнюю камеру платформы. Эти данные затем используются для расчета клеточной проницаемости.
- Методика отбора проб
- Соберите устройства в соответствии с протоколом, подробно описанным в разделе 1, и культивируйте желаемые клеточные линии, как описано в разделе 2. Включите дополнительное устройство, которое будет служить в качестве бесячеечного устройства управления с покрытием для измерения проницаемости системы.
ПРИМЕЧАНИЕ: Рекомендуется минимум три технических повторения для каждого условия; Однако требуется только одна репликация элемента управления с покрытием. - Перед началом анализа проб замените среду в нижней камере свежей средой. Проверьте слияние эндотелиального монослоя в каждом приборе под микроскопом. Обратите внимание на любые зазоры в монослоях клеток, так как это повлияет на диффузию красителя в нижнюю камеру.
ПРИМЕЧАНИЕ: Здоровая эндотелиальная культура должна быть на 100% конфлюированной. - Приготовьте флуоресцентный низкомолекулярный раствор (например, 150 мкг/мл Lucifer Yellow, 457 Da) в питательной среде клеток. Подготовьте избыточный объем флуоресцентного низкомолекулярного раствора, который будет использоваться для приготовления стандартных растворов, служащих эталонами для расчета концентрации флуоресцентной малой молекулы, отобранной из нижнего канала.
ПРИМЕЧАНИЕ: Мы рекомендуем использовать 400 мкл избыточного раствора в качестве стандартного раствора с самой высокой концентрацией флуоресцентной малой молекулы. - Замените среду в верхнем лунке 100 мкл флуоресцентного мелкомолекулярного раствора.
ПРИМЕЧАНИЕ: Мы рекомендуем использовать гидрофобную ручку, чтобы нарисовать круги вокруг портов для отбора проб, и подождать, пока гидрофобные чернила полностью высохнут, прежде чем добавлять раствор флуоресцентного красителя. Это предотвращает распространение среды из нижнего канала вокруг отверстия для отбора проб на этапе 4.1.7. Мы рекомендуем добавлять флуоресцентный раствор малых молекул в верхний колодец, подождать 2 минуты, прежде чем добавлять флуоресцентный раствор в следующее устройство, или работать в группах по 3 штуки (добавлять раствор в три устройства одновременно и ждать 5 минут, чтобы добавить следующие три устройства). - Инкубируют аппараты при 37 °С, 5%СО2 в течение 1 ч.
- В течение 1 ч инкубации на предыдущем этапе готовят стандартные растворы, выполняя 2-кратные последовательные разведения из флуоресцентного низкомолекулярного раствора, приготовленного на стадии 4.1.3. Пипетку по 50 мкл каждого раствора в плоскодонную черную 96-луночную пластину в трех экземплярах. В качестве базового стандартного раствора используйте пустую питательную среду для клеток.
ПРИМЕЧАНИЕ: Для приготовления стандартных растворов мы рекомендуем 11 серийных разведений при конечном объеме 200 мкл и использование питательной среды для клеток в качестве заготовки для измерения базовой интенсивности флуоресценции.- Переносят 200 мкл из 400 мкл избыточного флуоресцентного низкомолекулярного раствора, приготовленного на стадии 4.1.3, в пробирку, содержащую 200 мкл среды, хорошо перемешивают и переносят 200 мкл этого раствора в следующую пробирку, содержащую 200 мкл среды. Повторяйте разведения 1:2 до тех пор, пока не получится 10 пробирок. Пипетку 50 мкл наиболее концентрированного стандартного раствора в колонку 1 в тройках в 96-луночный планшет (В1, С1, Д1),2-й наиболее концентрированный раствор в колонку 2 (В2, С2, Д2) и так далее. Для12-го столбца в пластине пипетку 50 мкл пустой среды в трех экземплярах (B12, C12, D12).
- Выполните следующие действия для отбора проб флуоресцентного раствора малых молекул из нижнего канала.
- Извлеките флуоресцентный мелкомолекулярный раствор из лунки, чтобы остановить процесс диффузии.
- Поместите наконечник, содержащий 50 мкл среды, в верхний порт, который будет служить резервуаром, вставив наконечник с 50 мкл в порт, подняв устройство и осторожно вытолкнув наконечник, держась за верхнюю часть для стабилизации. Отложите устройство. Убедитесь, что в наконечнике пипетки нет пузырьков или воздуха на кончике пипетки, чтобы избежать попадания пузырьков в нижнюю камеру во время отбора проб.
- Добавьте 50 мкл среды в верхний лунку, чтобы предотвратить разрушение монослоя клетки во время отбора проб.
- Для отбора проб раствора из нижнего канала подтолкните пипеттер с пустым наконечником пипетки к первому сопротивлению, вставьте наконечник в отверстие для отбора проб и выдавите 50 мкл раствора из нижнего канала в обратном направлении. Переложите непосредственно в черную 96-луночную пластину с плоским дном, содержащую стандартные растворы.
ПРИМЕЧАНИЕ: Мы рекомендуем проверять монослой клеток под микроскопом сразу после отбора проб. Забор среды из нижнего канала может иногда приводить к нарушению клеточного слоя в верхнем колодце, что может привести к несогласованным измерениям проницаемости. Быстрая работа над шагами в 4.1.7 поможет предотвратить это.
- Измерьте интенсивность флуоресценции в микропланшетном считывателе, используя соответствующие параметры длины волны возбуждения и излучения для используемой флуоресцентной малой молекулы. Для Lucifer Yellow используйте возбуждение 428 нм и излучение 536 нм с оптимальным усилением. Флуоресценцию измеряют от верхней части пластины. Добавьте планшет в считыватель пластин, выделите лунки с образцом (включая стандартную кривую) и нажмите кнопку Начать , чтобы прочитать пластину.
- Соберите устройства в соответствии с протоколом, подробно описанным в разделе 1, и культивируйте желаемые клеточные линии, как описано в разделе 2. Включите дополнительное устройство, которое будет служить в качестве бесячеечного устройства управления с покрытием для измерения проницаемости системы.
- Расчет значения проницаемости (см. Дополнительный файл 1 для шаблона)
- Вычтите усредненное значение интенсивности флуоресценции пустой среды из всех измеренных значений интенсивности флуоресценции.
- Используйте уравнение (1) для вычисления проницаемости системы Ps:
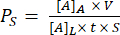 (1)
(1)
где [A]A — концентрация флуоресцентной малой молекулы, собранной из нижнего канала, V — объем, отобранный и добавленный в планшет (0,050 мл), [A]L — концентрация флуоресцентной малой молекулы, добавленной в верхнюю лунку (например, 0,15 мг/мл), t — время инкубации (в с или мин в зависимости от требуемых единиц), а S – площадь поверхности мембраны (0,014см2).- Вычислите [A]A, используя уравнение, полученное путем построения стандартной кривой на основе выходов интенсивности флуоресценции и известных концентраций стандартных растворов. Вычислите концентрации (x) экспериментальных образцов, вставив в уравнение их значения интенсивности флуоресценции (y).
ПРИМЕЧАНИЕ: Используйте линейную часть стандартной кривой. Мы рекомендуем измерять площадь поверхности мембраны по изображению мембраны, полученному под микроскопом, так как площадь мембраны может варьироваться в зависимости от номера партии и может существенно повлиять на расчетные значения проницаемости, если они отличаются от контрольной площади с покрытием.
- Вычислите [A]A, используя уравнение, полученное путем построения стандартной кривой на основе выходов интенсивности флуоресценции и известных концентраций стандартных растворов. Вычислите концентрации (x) экспериментальных образцов, вставив в уравнение их значения интенсивности флуоресценции (y).
- Используйте уравнение (2) для расчета проницаемости монослоя ячейки Pe:
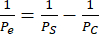 (2) См.
(2) См.
Где PS — это проницаемость системы, рассчитанная на шаге 4.2.2, а PC — значение проницаемости системы бесэлементного устройства управления с покрытием.
Representative Results
Сборка траншейного устройства показана на рисунке 1. Приспособления направляют сборку компонентов и мембранного чипа. Компонент 1 в основном акрил с поверхностью PSA для приклеивания к стружке, отверстием в нижней камере и портами для доступа пипетки к нижней камере. Компонент 2 представляет собой канальный слой и содержит неадгезивный, не содержащий PSA «треугольник» в правом верхнем углу для захвата. Траншейные устройства обеспечивают плоскую зону роста клеточных культур в верхней камере, в то время как траншейные устройства имеют плоскую поверхность для клеточной культуры в нижней камере.
Мы проводили эндотелиальные монокультуры и кокультуры hCMEC/D3 и HBVP, а также EECM-BMEC-подобных клеток и BPLC, полученных из hiPSC IMR90-4, и получали фазовые изображения с помощью фазово-контрастного микроскопа Nikon Eclipse Ts2 и 10-кратного объектива (рис. 2). Показаны оптимальные плотности посева для первичной клеточной культуры (снимки, сделанные через 1 день после посева), а также недосеянных HBVP (рис. 2A). Окончательные изображения фазы кокультуры и монокультуры (6-дневная культура эндотелиальных клеток) могут быть трудно различимы (рис. 2C), и для подтверждения успешной первичной клеточной кокультуры может потребоваться иммунофлуоресцентное окрашивание (см. раздел протокола 3). Также проиллюстрированы низкая, высокая и оптимальная плотность посева ПЖЖХ, полученных из hiPSC (рис. 2B). Кокультуру, полученную из ИПСК, легче различить при фазово-контрастной визуализации по сравнению с первичными кокультурами (рис. 2D). Низкий засев BPLC приводит к плохому покрытию перицитами и слипанию перицитов, в то время как пересев приводит к отслаиванию слоя перицитов от мембраны. Кроме того, слишком быстрый обмен среды в нижней камере может привести к потере перицитов, так как эти клетки очень чувствительны к сдвигу. Оптимальное покрытие перицитами составляет ~90% для модели ГЭБ, без пробелов в эндотелиальном слое.
Репрезентативные изображения иммуноокрашенной кокультуры, полученной из ИПСК, проиллюстрированы на рисунке 3 (6-дневная культура эндотелиальных клеток). ПЖЖК, полученные из IMR90-4, были окрашены для маркера перицитов PDGFRβ, а полученные из IMR90-4 EECM-BMEC-подобные клетки были окрашены для маркера адгезивных соединений VE-кадгерина. Хёхст был использован для окрашивания ядер. Изображения были получены на конфокальном микроскопе с вращающимся диском с использованием 40-кратного объектива LWD со срезами 0,2 мкм и обработаны с помощью Imaris. Оба клеточных слоя могут быть визуализированы, даже если тонкая наномембрана не видна.
Мы провели анализ проницаемости малых молекул на основе выборки с использованием одних и тех же экспериментальных условий в двух физически удаленных лабораториях в Бернском университете, Швейцария, и Университете Рочестера, Нью-Йорк, США, чтобы продемонстрировать межлабораторную воспроизводимость результатов (рис. 4)34. EECM-BMEC-подобные клетки, полученные из hiPSC IMR90-4, культивировали в устройстве μSiM в течение 2, 4 или 6 дней и на трансвелл-фильтрах в течение 6 дней. Анализ проводили с использованием 150 мкг/мл Lucifer Yellow (457 Da) в обеих лабораториях. Высокая вариабельность проницаемости эндотелиальных клеток, культивируемых в течение 2 суток в аппарате, свидетельствует о том, что 2 суток культивирования было недостаточно для барьерного созревания. Существенных различий в проницаемости между лабораториями при созревании барьера – начиная с 4-го дня, не выявлено. Мы также показали, что проницаемость эндотелиальных клеток, культивируемых в μSiM и трансвелл-фильтрах в течение 6 дней, соответствовала ранее опубликованным40 дням.
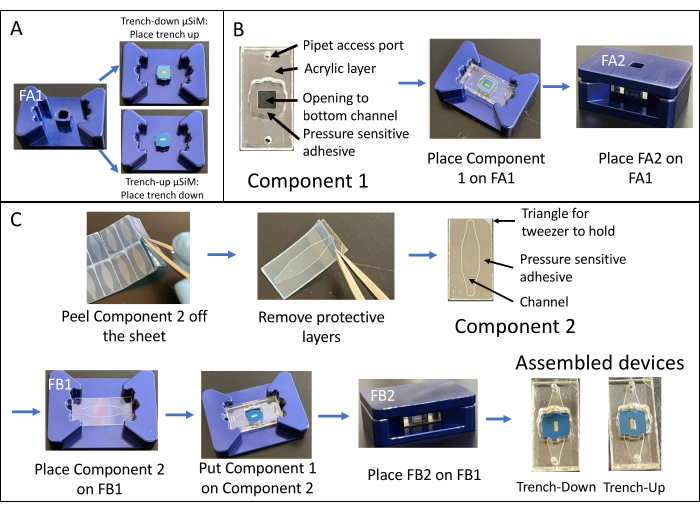
Рисунок 1: Этапы сборки μSiM . (A) Подготовьте микросхему, поместив ее на приспособление A1. Поместите траншею для стружки вверх для окончательного устройства траншейки. Поместите траншею для стружки вниз для окончательного устройства траншейной траншеи. (B) Прикрепите компонент 1 к чипу, сняв защитные маски с компонента 1 и поместив его лицевой стороной вниз в FA1. Склеивайте, оказывая давление с помощью приспособления А2. (C) Соедините компонент 2 и компонент 1, удалив компонент 2 с листа и сняв верхние защитные слои. Поместите канал в приспособление B1 и поместите компонент 1 поверх компонента 2 лицевой стороной вверх. Склеивайте, оказывая давление с помощью приспособления B2. Сокращения: FAn = прибор An; FBn = приспособление Bn. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
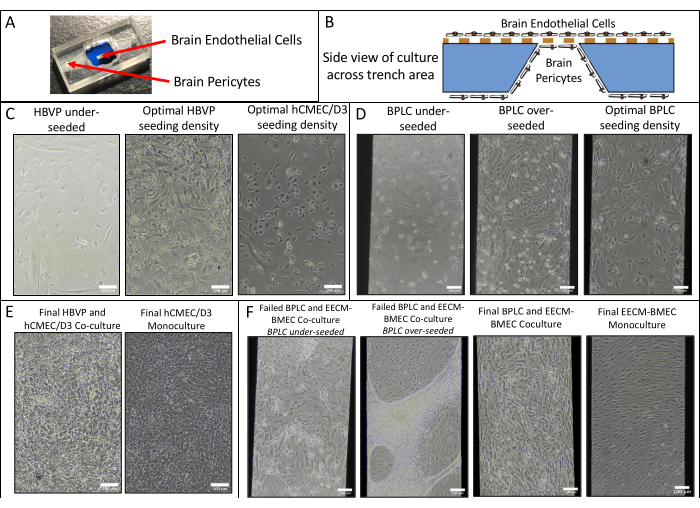
Рисунок 2: Схема кокультуры и репрезентативные фазово-контрастные изображения клеточных культур в устройствах. (А) Расположение посева перицитов и эндотелиальных клеток. (B) Вид сбоку на схему расположения ячеек в траншее мембранного чипа. (C) Репрезентативные изображения низкой и оптимальной плотности посева для первичной линии HBVP и hCMEC/D3 эндотелиальных клеток головного мозга. Изображения были получены через 1 день после посева (HBVP) и через 2 ч после посева (hCMEC/D3). (D) Репрезентативные изображения низкой, высокой и оптимальной плотности посева для перицитоподобных клеток головного мозга, полученных из ИПСК. Изображения были получены через 1 день после посева. (E) Репрезентативные изображения окончательной кокультуры HBVP и hCMEC/D3 и монокультуры hCMEC/D3. Изображения были получены через 8 дней после посева HBVP и через 7 дней после посева hCMEC/D3. (F) Репрезентативные изображения неудачных и успешных BPLC и EECM-BMEC-подобных клеточных культур и EECM-BMEC-подобных клеточных монокультур. Изображения были получены через 7 дней после посева BPLC и через 6 дней после посева EECM-BMEC. Недосеянные культуры АЖЖХ не имеют достаточного покрытия, в то время как культуры с пересевом АЖЖХ будут расти сверхсливающимися и начнут комковаться/отступать. Масштабные линейки = 100 мкм (C-F). Сокращения: HBVPs = перициты сосудов головного мозга человека; hiPSC = индуцированная плюрипотентная стволовая клетка человека; BPLC = перицитоподобные клетки головного мозга, полученные из hiPSC. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
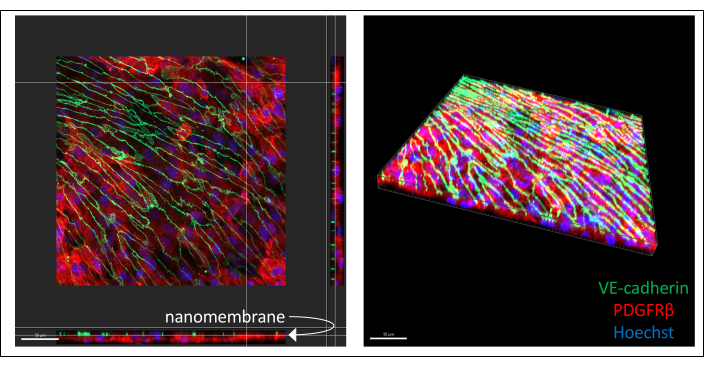
Рисунок 3: Репрезентативные изображения иммуноокрашенных культур клеток, полученных из ИПСК, в устройствах. Клетки окрашивали на эндотелиальный клеточный маркер VE-кадгерин (зеленый), перицитарный маркер PDGFRβ (красный) и ядерный (синий). Два слоя клеток видны в непосредственной близости, разделенные только тонкой наномембраной из нитрида кремния (белая стрелка отмечает расположение мембраны на изображении слева). Масштабная линейка = 50 мкм. Сокращения: hiPSC = индуцированная плюрипотентная стволовая клетка человека; PDGFRβ = рецептор тромбоцитарного фактора роста бета. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
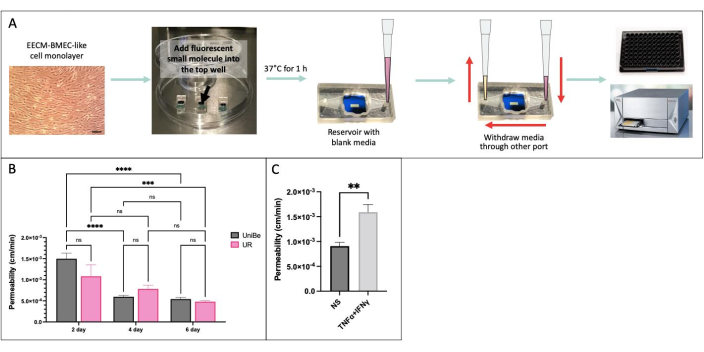
Рисунок 4: Анализ проницаемости малых молекул на основе отбора проб. (A) Схема экспериментального рабочего процесса. (B) Демонстрация межлабораторной воспроизводимости между двумя физически удаленными лабораториями в Бернском университете (UniBe), Швейцария, и Университете Рочестера (UR), Нью-Йорк, США: эндотелиальные клетки, полученные из hiPSC, культивировали в устройстве μSiM в течение 2, 4 или 6 дней и в трансвелл-фильтрах в течение 6 дней. Анализ проницаемости проводили с использованием 150 мкг/мл Lucifer Yellow (457 Da). Красная полоса указывает на ранее опубликованные данные о проницаемости флуоресцеина натрия (376 Да) тех же эндотелиальных клеток, полученных из ИПСК, культивируемых в течение 6 дней в трансвелл-фильтрах40. N = 4-16 на группу. Использовалась двуфакторная дисперсионная дисперсия с post hoc критерием Тьюки, а сравнения отображались только для релевантных p < 0,05. (C) Демонстрация цитокинового ответа с использованием ИПСК-полученных EECM-BMEC-подобных клеток, культивируемых в μSiM в течение 2 дней; 0,1 нг/мл TNFα + 2 МЕ/мл IFNγ) или контроль среды (нестимулированный, NS) добавляли в верхнюю камеру в течение 20 часов перед анализом проницаемости с использованием 150 мкг/мл Lucifer Yellow. N = 3 на группу. t-критерий Стьюдента, p < 0,05. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
| Площадь высевающей поверхности верхней камеры | Объем верхней скважины | Площадь высевающей поверхности нижней камеры | Объем нижнего канала |
| ~37 мм2 | 100 мкл (может вмещать ≥115 мкл) | ~42 мм2 | 10 мкл (пипетка 20 мкл, чтобы избежать пузырьков) |
Таблица 1: Критическая площадь поверхности и объемы мкСиМ.
| Цель | Фиксирующий | Решение для блокировки | Разбавление |
| ВЭ-кадгерин | 4% PFA или 100% MeOH | 5% GS + 0,4% Tx-100 или 10% GS + 0,3% Triton X-100 | 1:50 |
| КД31 | 4% PFA или 100% MeOH | 5% GS + 0,3-0,4% Triton X-100 | 1:100 |
| Клауден-5 | 100% MeOH | 5-10% GS + 0,3% Triton X-100 | 1:200 |
| ЗО-1 | 100% MeOH | 5-10% GS + 0,3% Triton X-100 | 1:200 |
| Окклюдин | 100% MeOH | 5-10% GS + 0,3% Triton X-100 | 1:50 |
| ПДГФРβ | 4% ПФА | 5% GS + 0,4% Triton X-100 | 1:100 |
| НГ2 | 4% ПФА | 5% GS + 0,4% Triton X-100 | 1:100 |
| Козий α-мышиный IgG Alexa Fluor 488 | 1:200 | ||
| Козий α-мышиный IgG Alexa Fluor 568 | 1:200 |
Таблица 2: Антитела и методы окрашивания, валидированные для иммунохимии кокультур в устройствах μSiM. Сокращения: PFA = параформальдегид; MeOH = метанол; GS = козья сыворотка.
Дополнительный файл 1: Шаблон для расчета значения проницаемости. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Discussion
Несмотря на то, что мембранная стружка была разработана для обеспечения стабильности, она может треснуть или сломаться при неправильном обращении во время сборки. Таким образом, очень важно захватить стружку в выемках пинцета для стружки и аккуратно поместить ее в приспособление. При обращении с устройствами в целом необходимо соблюдать особые меры предосторожности, чтобы не ударить и не уронить устройства. Во время приклеивания микросхемы мембраны к приспособлению А1 стружка должна быть уложена ровно и отцентрирована на стойке приспособления А1, чтобы избежать растрескивания мембраны во время присоединения к компоненту 1. Кроме того, после снятия защитных масок следует избегать любого контакта с открытыми слоями PSA. При работе с компонентом 2 после снятия защитной маски рекомендуется держать его вдоль края компонента и пинцетом захватывать треугольник, свободный от PSA.
В то время как протоколы культивирования клеток были описаны для возможных моделей ГЭБ, описанная здесь модель кокультуры ГЭБ BMEC/перицитов может быть достаточной или недостаточной в зависимости от физиологического контекста и интересующих вопросов. Например, транспорт иммунных клеток в основном происходит в посткапиллярных венулах головного мозга41,42. В этих областях периваскулярное пространство отделяет барьер BMEC/перицитов от глиальных ограничителей, устанавливаемых астроцитами. Таким образом, в посткапиллярных венулах нервно-сосудистая единица (НВУ) состоит из двух физически разделенных барьеров, соединенных последовательно, и астроцитарные концевые ножки не контактируют непосредственно с гематобарьером BMEC/перицитами, что хорошо представлено в современной модели. Если целью является модель NVU, учитывающая влияние факторов, секретируемых астроцитами, на гематоэнцеатный барьер, то к устройству можно добавить компартмент астроцитов, который обеспечивает обмен растворимыми факторами через периваскулярное пространство. Этот пример был проиллюстрирован ранее, и его можно было бы расширить, включив в него другие клетки, такие как микроглия и нейроны в трехмерном «мозговом» отсеке. Модульная архитектура платформы позволяет использовать простые стратегии сборки для достижения этих реконфигураций, чтобы платформа была настолько простой или сложной, насколько это необходимо для решения имеющихся гипотез. Настройка каждой клеточной культуры; Тем не менее, он должен быть оптимизирован для новых клеточных линий и мультикультур. Например, из-за свойств мембран из нитрида кремния может потребоваться корректировка растворов для покрытия по сравнению с планшетами для культур тканей. Включение фибронектина, как правило, способствует прикреплению клеток и выживанию. Кроме того, пользователи могли культивировать эндотелиальные клетки и перициты в противоположных направлениях. В этом случае может потребоваться изменение, например, способа выполнения и интерпретации измерений проницаемости. Однако описание шагов для этого типа культуры выходит за рамки данной статьи.
Еще одной проблемой, с которой можно столкнуться при культивировании клеток, является быстрое испарение среды, поскольку устройства могут быть более чувствительны к изменениям в окружающей среде по сравнению со стандартными планшетами и колбами для культивирования тканей. Если наблюдается избыточное испарение или замедление роста клеток, необходимо измерить все критические параметры инкубатора, чтобы обеспечить точные настройки. В тканевый колпачок или маленькую чашку Петри, помещенную внутрь камеры для культивирования клеток, можно добавить больше воды, или заменить среду более часто. Далее пузырьки могут попасть в нижний канал и застрять в траншее для траншейных устройств. Хотя их можно удалить, проще всего избежать добавления пузырьков в первую очередь. Для этого важно убедиться в отсутствии пузырьков в наконечнике пипетки или воздухе на конце наконечника для пипетки перед подачей питательной среды в нижнюю камеру. Кроме того, испарение среды в канале может привести к образованию зазора между поверхностью среды и верхней частью порта. Небольшой объем среды может быть пипетирован в один порт до тех пор, пока среда не достигнет поверхности противоположного порта, после чего среда может быть заменена в этом противоположном порту. В то время как среды hECSR и E6 + 10% FBS не следует нагревать на водяной бане, другие среды можно предварительно нагреть, чтобы уменьшить образование пузырьков. Если пузырь все-таки попадет в нижнюю камеру, его можно удалить, быстро пипетируя 100 мкл через канал. Однако этот метод может привести к загрязнению между камерами или разливу среды по поверхности устройства. Это также может привести к нарушению клеточных слоев. В качестве альтернативы можно сначала удалить среду из канала, а затем снова ввести ее объемом 50 мкл. Однако предварительное удаление носителя может привести к образованию пузырьков в канале. Если пузырь находится не непосредственно под областью мембраны, его можно оставить в канале, не оказывая влияния на культуру клеток.
Прикрепление и рост перицитов, как показано на рисунке 2, может быть сложной задачей. Использование оптимизированной плотности посева имеет важное значение для формирования слоя с физиологически релевантным соотношением перицитов и эндотелиальных клеток. Кроме того, поскольку перициты чувствительны к сдвигу, все обмены средами в канале должны происходить очень медленно, чтобы защитить клетки. Для культуры АЖЖХ улучшенное прикрепление может быть достигнуто путем покрытия нижней камеры коллагеном IV типа 800 мкг/мл или фибронектином 100 мкг/мл.
Иммуноцитохимия в описанных здесь устройствах позволяет качественно анализировать здоровье и функцию клеток. Методы окрашивания в планшетах для культуры тканей или других платформах должны быть непосредственно перенесены на платформу. Для культивирования клеток только в верхней камере, после фиксации, PBS может быть добавлен в нижнюю камеру и оставлен на оставшиеся этапы, при этом блокировка и окрашивание выполняются только в верхней камере. Это сводит к минимуму риски разрыва мембран или попадания пузырьков в нижнюю камеру. Для совместного окрашивания мы рекомендуем использовать обе камеры на всех этапах. Важно отметить, что вязкость фиксатора и PBS отличается от вязкости среды. Таким образом, может быть легче добавлять пузырьки в нижнюю камеру, и перед пипеткой в нижнюю камеру следует проявлять особую осторожность при проверке наконечников дозатора на наличие воздуха на конце наконечника.
Протокол, описанный для анализа проницаемости малых молекул, позволяет функционально и количественно оценить барьерную функцию эндотелиальных клеток, культивируемых в устройстве μSiM. Одной из проблем, с которой можно столкнуться во время этого анализа, является попадание пузырьков воздуха в пипетку во время отбора образца из нижнего канала на этапе протокола 4.1.7.4. Чтобы избежать этой проблемы, важно убедиться, что наконечник запечатан в порту перед началом отбора пробы, и образец не должен быть взят слишком быстро. Если это не решит проблему, размер используемых наконечников может быть слишком маленьким или слишком большим, чтобы поместиться в порты; воспользуйтесь советами, перечисленными в Таблице материалов. Если при измерении неожиданно высоких значений проницаемости наблюдаются неожиданные высокие значения проницаемости, несмотря на то, что монослой выглядит здоровым, необходимо проверить целостность монослоя на предмет нарушения во время отбора пробы. Мы рекомендуем всегда проверять монослой под микроскопом сразу после взятия образца. Если монослой все еще выглядит неповрежденным и здоровым, образец можно зафиксировать и оценить биологические маркеры барьерной функции, например, с помощью иммуноокрашивания соединительных белков. И наоборот, если измеряются неожиданно низкие значения проницаемости, важно убедиться, что из нижнего канала отбирается 50 мкл среды без каких-либо пузырьков воздуха. Если среда выходит из отверстия для отбора проб сразу после установки наконечника резервуара, эта среда должна быть собрана до установки пипетки в отверстие для отбора проб, так как большая часть флуоресцентной малой молекулы будет присутствовать в начальном объеме 10 мкл, отобранном из нижнего канала. Рисование кругов вокруг портов с помощью гидрофобного пера или размещение гидрофобной ленты с отверстием вокруг порта предотвращает распространение пассивно перекачиваемой среды. Если во время отбора проб удаляются пузырьки или не удаляется полная проба объемом 50 мкл, образец не должен использоваться. В качестве альтернативы можно определить точный объем и использовать его при расчете проницаемости; однако это следует делать только в том случае, если удаляемый объем составляет ≥40 мкл, что соответствует ~98-99% извлечения красителя34.
Disclosures
J.L.M. является соучредителем SiMPore и владеет долей участия в компании. SiMPore коммерциализирует ультратонкие технологии на основе кремния, включая мембраны, используемые в этом исследовании.
Acknowledgements
J.L.M., B.E., T.R.G., M.C.M., P.K., M.T., K.C. и L.W. были профинансированы грантом NIH R33 HL154249. J.L.M. финансировался R44 GM137651. M.M. был профинансирован Программой Шмидта Института неврологии Дель Монте Университета Рочестера. M.T. финансировался RF1 AG079138. K.C. финансировался Международным фондом этических исследований.
Materials
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| CD31 Polyclonal antibody | Thermo Fisher Scientific | PA5-32321 | |
| Claudin-5 mouse IgG antibody, 4C3C2 | Thermo Fisher Scientific | 35-2500 | |
| Goat α-Mouse IgG Alexa Fluor 488 | Thermo Fisher Scientific | A11001 | |
| Goat α-Rabbit IgG Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | |
| Hoechst 33342 | Life Technologies | H3570 | |
| NG2, mouse IgG2a, 9.2.27 | Millipore | MAB2029 | |
| Occludin mouse IgG antibody, OC-3F10 | Thermo Fisher Scientific | 33-1500 | |
| PDGFRβ, rabbit IgG antibody, 28E1 | Cell Signaling Technology | 3169 | |
| VE-cadherin mouse IgG2B Clone # 123413 | R&D Systems | MAB9381 | |
| ZO-1 rabbit IgG antibody, polyclonal | Thermo Fisher Scientific | 40-2200 | |
| Chemicals, peptides, and recombinant proteins | |||
| 100% Methanol | VWR | 101443-718 | Can be substituted with similar products |
| 16% Paraformaldehyde | Thermo Fisher Scientific | 28908 | Can be substituted with similar products |
| Accutase | Thermo Fisher Scientific | A1110501 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| B27 supplement | Thermo Fischer Scientific | 17504044 | |
| bFGF | R&D Systems | 233-FB-025 | |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | |
| Collagen, Type I solution from rat tail | Sigma-Aldrich | C3867-1VL | Can be substituted with similar products |
| DMEM/Ham’s F12 | Thermo Fisher Scientific | 11320033 | |
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Essential 6 medium | Thermo Fisher Scientific | A1516401 | |
| Fetal bovine serum (FBS) | Peak Serum | PS-FB1 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | |
| Fibronectin human protein, plasma | ThermoFisher Scientific | 33016015 | Can be substituted with similar products |
| hESFM | Thermo Fisher Scientific | 11111044 | |
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | 861502 | |
| Normal goat serum | Thermo Fisher Scientific | 500627 | Can be substituted with similar products |
| PBS without calcium, magnesium | Cytiva | SH30256.01 | Can be substituted with similar products |
| Pericyte Medium | ScienCell | 1201 | Use complete kit (includes supplements) |
| Poly-L-Lysine, 10 mg/mL | ScienCell | 0413 | |
| Triton X-100 | JT Baker | X198-05 | Can be substituted with similar products |
| UltraPure DNase/RNase-Free Distilled Water | Invitrogen™ | 10977015 | Can be substituted with similar products |
| Experimental models: Cell lines | |||
| Blood-brain barrier hCMEC/D3 cell line | Sigma-Aldrich | SCC066 | |
| Human brain vascular pericytes | ScienCell | 1200 | |
| iPS(IMR90)-4 human induced pluripotent stem cells | WiCell | RRID:CVCL_C437 | |
| Glassware and Plasticware | |||
| 150 mm TC-treated Cell Culture Dish with 20 mm Grid | Falcon | 353025 | |
| Clamps | VWR | MFLX06832-10 | |
| Corning tissue culture plates (6-well) | Corning | 3506 | |
| Flat 96-well non-binding microplates | Greiner Bio-One | 655900 | |
| Microscope Slide Device Holder | SiMPore | USIM-SB | Dimensions compatible with micropscope slide holders |
| Nunc 15 mL Conical Sterile Polypropylene Centrifuge Tubes | Thermo Fischer Scientific | 339651 | |
| Nunc 50 mL Conical Sterile Polypropylene Centrifuge Tubes | Thermo Fischer Scientific | 339653 | Tube caps can be filled with water for cell culture |
| P20-200 pipette tips | VWR | 76322-516 | Alternate brands may not seal as effectively into ports |
| Transwell filters (12 well, 12 mm, 0.4 μm pore size, PC) | CoStar | 3401 | |
| Instruments | |||
| 10X Objective (For Andor) | Nikon Instruments Inc. | MRD00105 | Air; WD: 4 mm; NA 0.45 |
| 10X Objective (For Nikon) | Nikon Instruments Inc. | MRP40102 | Air; WD: 6.2 mm; NA 0.25 |
| 40X Objective (LWD) (For Andor) | Nikon Instruments Inc. | MRD77410 | Water immersion; WD: 590-610 mm; NA 1.15 |
| Andor Spinning Disc Confocal microscope | Oxford Instruments, Andor | ||
| Nikon Eclipse Ts2 Phase Contrast Microscope | Nikon Instruments Inc. | Can be substituted with similar products | |
| TECAN Infinite M200 | TECAN | Can be substituted with similar products | |
| Other | |||
| Advanced PAP Pen | Millipore Sigma | Z672548 | 2 mm tip is recommended |
| Assembly kit with fixtures | SiMPore | USIM-JIGSET | Including fixure A1, A2, B1, and B2 |
| Camera Adapter for Microscopes | AmScope | CA-CAN-SLR Canon SLR / D-SLR | Φ23.2 - Φ30 adapter fits Nikon Eclipse Ts2 |
| Canon EOS Rebel SL3 DSLR Camera | Canon | EOS 250D, BH #CAEDRSL3B, MFR #3453C001 | Can be substituted with similar products |
| Cell strainer, 40 µm | Millipore Sigma (Corning) | CLS431750 | |
| Component 1 | SiMPore | USIM-C1 | |
| Component 2 | SiMPore | USIM-C2 | |
| Membrane chips | SiMPore | NPSN100-1L | Other chips formats are available |
| SMD handling tweezer double angle | Techni-Tool | 758TW003 | "Chip Tweezers" |
| Stainless steel precision type GG tweezer | Techni-Tool | 758TW534 | "Straight Tweezers" |
| Software | |||
| Fiji | ImageJ | For image processing | |
| Fusion | Oxford Instruments, Andor | Instructions for version 2.3.0.44 | |
| i-control | TECAN | Instructions for version 2.0 | |
| Imaris | Oxford Instruments | For image processing. Instructions for version 9.9.0 |
References
- Villabona-Rueda, A., Erice, C., Pardo, C. A., Stins, M. F. The evolving concept of the blood brain barrier (BBB): from a single static barrier to a heterogeneous and dynamic relay center. Frontiers in Cellular Neuroscience. 13, 405 (2019).
- Nation, D. A., et al. Blood-brain barrier breakdown is an early biomarker of human cognitive dysfunction. Nature Medicine. 25 (2), 270-276 (2019).
- Ferrari, C. C., Tarelli, R. Parkinson's disease and systemic inflammation. Parkinsons Disease. 116 (3), 436813 (2011).
- Koch, E. V., Ledwig, V., Bendas, S., Reichl, S., Dietzel, A. Tissue barrier-on-chip: a technology for reproducible practice in drug testing. Pharmaceutics. 14 (7), 1451 (2022).
- Nishihara, H., et al. Intrinsic blood-brain barrier dysfunction contributes to multiple sclerosis pathogenesis. Brain. 145 (12), 4334-4348 (2022).
- Ortiz, G. G., et al. Role of the blood-brain barrier in multiple sclerosis. Archives of Medical Research. 45 (8), 687-697 (2014).
- Orhun, G., et al. Association between inflammatory markers and cognitive outcome in patients with acute brain dysfunction due to sepsis. Archives of Neuropsychiatry. 56 (1), 63-70 (2019).
- Chen, Y., Yang, W., Chen, F., Cui, L. COVID-19 and cognitive impairment: neuroinvasive and blood-brain barrier dysfunction. Journal of Neuroinflammation. 19 (1), 222 (2022).
- Hughes, C. G., et al. Endothelial activation and blood-brain barrier injury as risk factors for delirium in critically ill patients. Critical Care Medicine. 44 (9), e809-e817 (2016).
- Saraiva, C., et al. Nanoparticle-mediated brain drug delivery: Overcoming blood-brain barrier to treat neurodegenerative diseases. Journal of Control Release. 235 (10), 34-47 (2016).
- Jolliet-Riant, P., Tillement, J. P. Drug transfer across the blood-brain barrier and improvement of brain delivery. Fundamental & Clinical Pharmacology. 13 (1), 16-26 (1999).
- Abbott, N. J., et al. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2009).
- Siflinger-Birnboim, A., et al. Molecular sieving characteristics of the cultured endothelial monolayer. Journal of Cellular Physiology. 132 (1), 111-117 (1987).
- Bischoff, I., et al. Pitfalls in assessing microvascular endothelial barrier function: impedance-based devices versus the classic macromolecular tracer assay. Scientific Reports. 6, 23671 (2016).
- van der Helm, M. W., van der Meer, A. D., Eijkel, J. C., van den Berg, A., Segerink, L. I. Microfluidic organ-on-chip technology for blood-brain barrier research. Tissue Barriers. 4 (1), e1142493 (2016).
- Osaki, T., Shin, Y., Sivathanu, V., Campisi, M., Kamm, R. D. In vitro microfluidic models for neurodegenerative disorders. Advanced Healthcare Materials. 7 (2), (2018).
- Girard, S. D., et al. High and low permeability of human pluripotent stem cell-derived blood-brain barrier models depend on epithelial or endothelial features. FASEB Journal. 37 (2), e22770 (2023).
- Vigh, J. P., et al. Transendothelial electrical resistance measurement across the blood-brain barrier: a critical review of methods. Micromachines. 12 (6), 685 (2021).
- Lea, T., et al., Verhoeckx, K., et al. Caco-2 cell line. The Impact of Food Bioactives on Health: in vitro and ex vivo models. , (2015).
- Felix, K., Tobias, S., Jan, H., Nicolas, S., Michael, M. Measurements of transepithelial electrical resistance (TEER) are affected by junctional length in immature epithelial monolayers. Histochemistry and Cell Biology. 156 (6), 609-616 (2021).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- Mossu, A., et al. A silicon nanomembrane platform for the visualization of immune cell trafficking across the human blood-brain barrier under flow. Journal of Cerebral Blood Flow and Metabolism. 39 (3), 395-410 (2019).
- Castro Dias, M., et al. Brain endothelial tricellular junctions as novel sites for T-cell diapedesis across the blood-brain barrier. Journal of Cell Science. 134 (8), jcs253880 (2021).
- Hudecz, D., et al. Ultrathin silicon membranes for in situ optical analysis of nanoparticle translocation across a human blood-brain barrier model. ACS Nano. 14 (1), 1111-1122 (2020).
- Khire, T. S., et al. Microvascular mimetics for the study of lukocyte-endothelial interactions. Cellular and Molecular Bioengineering. 13 (2), 125-139 (2020).
- Salminen, A. T., et al. Endothelial cell apicobasal polarity coordinates distinct responses to luminally versus abluminally delivered TNF-alpha in a microvascular mimetic. Integrative Biology: Quantitative Biosciences from Nano to Macro. 12 (11), 275-289 (2020).
- DesOrmeaux, J. P. S., et al. Nanoporous silicon nitride membranes fabricated from porous nanocrystalline silicon templates. Nanoscale. 6 (18), 10798-10805 (2014).
- Hill, K., et al. Second generation nanoporous silicon nitride membranes for high toxin clearance and small format hemodialysis. Advanced Healthcare Materials. 9 (4), e1900750 (2020).
- Salminen, A. T., et al. Ultrathin dual-scale nano- and microporous membranes for vascular transmigration models. Small. 15 (6), e1804111 (2019).
- Gillmer, S. R., et al. Predicting the failure of ultrathin porous membranes in bulge tests. Thin Solid Films. 631, 152-160 (2017).
- Ishimatsu, R., et al. Ion-selective permeability of ultrathin nanopore silicon membrane as studied using nanofabricated micropipet probes. Analytical Chemistry. 82 (17), 7127-7134 (2010).
- Kim, E., et al. A structure-permeability relationship of ultrathin nanoporous silicon membrane: a comparison with the nuclear envelope. Journal of American Chemical Society. 130 (13), 4230-4231 (2008).
- Snyder, J. L., et al. An experimental and theoretical analysis of molecular separations by diffusion through ultrathin nanoporous membranes. Journal of Membrane Science. 369 (1-2), 119-129 (2011).
- McCloskey, M. C., et al. The modular µSiM: a mass produced, rapidly assembled, and reconfigurable platform for the study of barrier tissue models in vitro. Advanced Healthcare Materials. 11 (18), e2200804 (2022).
- Mansouri, M., et al. The modular microSiM reconfigured: integration of microfluidic capabilities to study in vitro barrier tissue models under flow. Advanced Healthcare Materials. 11 (21), e2200802 (2022).
- Su, S. -. H., et al. A tissue chip with integrated digital immunosensors: In situ brain endothelial barrier cytokine secretion monitoring. Biosensors and Bioelectronics. 224, 115030 (2023).
- Nishihara, H., et al. Differentiation of human pluripotent stem cells to brain microvascular endothelial cell-like cells suitable to study immune cell interactions. STAR Protocols. 2 (2), 100563 (2021).
- Hudecz, D., et al. Ultrathin silicon membranes for in situ optical analysis of nanoparticle translocation across a human blood-brain barrier model. ACS Nano. 14 (1), 1111-1122 (2020).
- Gastfriend, B. D., Stebbins, M. J., Du, F., Shusta, E. V., Palecek, S. P. Differentiation of brain pericyte-like cells from human pluripotent stem cell-derived neural crest. Current Protocols. 1 (1), e21 (2021).
- Nishihara, H., et al. Advancing human induced pluripotent stem cell-derived blood-brain barrier models for studying immune cell interactions. FASEB Journal. 34 (12), 16693-16715 (2020).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- Bechmann, I., Galea, I., Perry, V. H. What is the blood-brain barrier (not). Trends in Immunology. 28 (1), 5-11 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved