Um novo método de injeção de células com invasão mínima
In This Article
Summary
Este método elimina qualquer invasão importante durante as injeções celulares causadas pela solução de suspensão celular.
Abstract
A injeção direta de células nos tecidos é um processo necessário na administração e/ou terapia de reposição celular. A injeção de células requer uma quantidade suficiente de solução de suspensão para permitir que as células entrem no tecido. O volume da solução de suspensão afeta o tecido, e isso pode causar lesão invasiva importante como resultado da injeção de células. Este trabalho relata um novo método de injeção celular, denominado injeção lenta, que visa evitar essa lesão. No entanto, empurrar as células para fora da ponta da agulha requer uma velocidade de injeção suficientemente alta de acordo com a lei de Newton da força de cisalhamento. Para resolver a contradição acima, um fluido não newtoniano, como solução de gelatina, foi utilizado como solução de suspensão celular neste trabalho. A solução de gelatina tem sensibilidade à temperatura, pois sua forma muda de gel para sol a aproximadamente 20 °C. Portanto, para manter a solução de suspensão celular na forma de gel, a seringa foi mantida resfriada nesse protocolo; No entanto, uma vez que a solução foi injetada no corpo, a temperatura corporal converteu-a em um sol. O fluxo de fluido tecidual intersticial pode absorver o excesso de solução. Neste trabalho, a técnica de injeção lenta permitiu que bolas de cardiomiócitos entrassem no miocárdio do hospedeiro e enxertassem sem fibrose circunjacente. Este estudo empregou um método de injeção lenta para injetar cardiomiócitos neonatais de ratos purificados e formados por bola em uma área remota de infarto do miocárdio no coração de ratos adultos. Aos 2 meses após a injeção, os corações dos grupos transplantados apresentaram melhora significativa da função contrátil. Além disso, a análise histológica dos corações injetados lentamente revelou conexões perfeitas entre o hospedeiro e os cardiomiócitos do enxerto através de discos intercalados contendo conexões de junções comunicantes. Este método poderia contribuir para terapias celulares de próxima geração, particularmente na medicina regenerativa cardíaca.
Introduction
A administração e a substituição celular são novas estratégias terapêuticas promissoras para órgãos fortemente lesados. Dentre essas novas estratégias terapêuticas, a medicina regenerativa cardíaca tem atraído considerável atenção. Entretanto, a inflamação causada por lesões medeia a formação de cicatrizes em vários órgãos1,2,3,4. O coração humano é composto por aproximadamente 10a 10 cardiomiócitos; portanto, teoricamente5,6, deve ser tratada com mais de 10a 9 cardiomiócitos. A administração de um grande número de cardiomiócitos pelos métodos tradicionais de injeção pode levar a lesões teciduais significativas7. Este método fornece um novo método de injeção celular com mínima invasão tecidual.
A administração de células no parênquima do órgão requer injeção(ões). No entanto, existe uma discrepância na medida em que a própria injeção pode levar a lesão tecidual. A lesão tecidual causa inflamação local e cicatrizes incuráveis em órgãos e tecidos, além de comprometimento da capacidade regenerativa 8,9,10. O coração de mamíferos tem uma propensão extremamente alta a desenvolver cicatrizes ao invés de se regenerar, pois requer reparo imediato da lesão para suportar a pressão arterial elevada causada por sua função de bombeamento contínuo11. A terapia de ablação utiliza essa alta propensão à formação de cicatrizes e bloqueia o circuito que provavelmente sofrerá formação de cicatriz usando arritmia12. Em estudo anterior, observou-se que o tecido cicatricial isolou os cardiomiócitos injetados no miocárdio do hospedeiro. Assim, este representa o próximo problema alvo que precisa ser superado para se obter melhor eficácia terapêutica na medicina regenerativa cardíaca.
O fluxo de fluido intersticial tecidual desempenha um papel vital no transporte de oxigênio e nutrientes para as células e na remoção dos resíduos excretados das células. A velocidade fisiológica do fluxo de fluido intersticial em cada tecido/órgão é diferente (a faixa é de 0,01-10 μm/s)13. Até onde o autor sabe, não há dados sobre a capacidade de tecidos/órgãos individuais suportarem quantidades extras de líquido sem edema patológico; No entanto, este experimento tenta usar uma velocidade de injeção lenta para possivelmente reduzir a lesão tecidual, e os resultados podem ser usados para determinar a praticidade desse conceito.
Protocol
Os experimentos com animais foram conduzidos de acordo com as diretrizes éticas para experimentos com animais da Kansai-Medical University e foram aprovados pelos comitês de ética (número de aprovação: 23-104). Todos os animais foram criados sob um ciclo claro-escuro constante em um ambiente específico livre de patógenos. Todos os instrumentos cirúrgicos esterilizados, como tesouras, pinças e afastadores, foram autoclavados e secos completamente.
1. Preparo das bolas de cardiomiócitos neonatais de ratos
- Coleção cardíaca neonatal de ratos
- Para a coleta do coração, seguir procedimento semelhante ao descrito em relato anterior7.
- Imergir ratos Sprague-Dawley (SD) neonatais (0-2 dias após o nascimento) em soluções de iodopovidona e etanol a 70% sequencialmente e, em seguida, transferi-los para um estojo hermético preenchido com isoflurano vaporizado (a concentração deve ser superior a 10% v/v) para anestesia profunda.
- Após a confirmação da inconsciência por uma perda de atividade locomotora, decapitar o rato enquanto segura o corpo das costas com a mão e, em seguida, cortar 2-4 mm de tecido do centro frontal da caixa torácica para o caudal e, em seguida, na direção rostral usando tesoura afiada.
- Segure a pele traseira para abrir o corte e empurrar o coração da caixa torácica. Corte os ventrículos usando tesoura e mergulhe-os em solução salina tamponada com fosfato (PBS) sem cálcio ou magnésio (PBS(−)).
- Dispersão dos cardiomiócitos neonatais de ratos
- Picar os ventrículos coletados dispersos em uma quantidade mínima de buffer de Ads (buffer de Ads: NaCl 116 mM, HEPES 20 mM, 12,5 mM NaH2PO 4, 5,6 mM de glicose, 5,4 mM KCl, 0,8 mM MgSO4, pH 7,35) em um vidro côncavo autoclavado em pequenos pedaços (1 mm x 1 mm) usando tesoura curva.
- Transferir os tecidos picados e um agitador micromagnético para um tubo de centrifugação de 50 mL e dispersar os tecidos em células únicas com colagenase a 0,1%, tripsina a 0,1%, DNase I 20 μg/mL e éster metílico de tetrametilrodamina 50 nM em tampão Ads a 37 °C, agitando por 30 min.
- Separe os agregados e as células dispersas através da sedimentação natural, colete apenas as células dispersas em um tubo e digerir os agregados celulares residuais novamente com o mesmo meio de digestão.
- Continue este procedimento até que todas as células estejam completamente dissociadas. Para confirmar a dispersão completa das células, observe os tubos ao microscópio (lente objetiva 4x).
- Coletar as células dispersas usando centrifugação a 150 x g por 5 min e dissociá-las em 1-2 mL de tampão Ads.
- Triagem celular ativada por fluorescência de cardiomiócitos
- Analise as células usando a classificação de células ativadas por fluorescência (FACS) usando filtros passa-banda de 556-601 nm para detectar sinais de fluorescência vermelha.
- Realizar cuidadosamente o pré-confinamento para eliminar as frações duplas14. As configurações do portão para eliminação dupla devem estar de acordo com as instruções do fabricante.
- Defina a dispersão direta no eixo x e o sinal de fluorescência vermelho no eixo y. Três populações foram observadas: uma população mais baixa contendo eritrócitos e células mortas, uma população média contendo não-cardiomiócitos, incluindo fibroblastos e células endoteliais, e uma população superior contendo cardiomiócitos ventricularespuros7.
- Preparação de bolas de cardiomiócitos marcadas com fluorescência vermelha
- Classificar seletivamente os cardiomiócitos e centrifugar por 5 min a 150 x g. Dissolver completamente os pellets celulares em 1 mL de meio essencial mínimo modificado alfa (alfa-MEM) contendo 10% de soro fetal bovino (FBS) inativado pelo calor.
- Medir a concentração celular usando um hemocitômetro e diluir a solução de suspensão celular para 3.000 células/mL com alfa-MEM 10% FBS.
- Distribuí-los em placas celulares não adesivas de 96 poços (100 μL por poço), centrifugar por 5 min a 100 x g e cultura para 2-3 d em incubadora de cultura celular com 5% de CO2 a 37 °C.
- Antes dos experimentos de injeção, colher uma bola de cardiomiócitos de cada poço por aspiração com o meio de cultura usando uma pipeta de 1.000 μL e coletá-la em um tubo de 15 mL.
- Coloração com PKH26 seguindo as instruções do fabricante para rastreamento após a enxertia.
2. Preparações para o método de injeção lenta
- Preparação da solução-mãe de gelatina
- Pesar a gelatina, dissolvê-la em tampão Ads para produzir uma solução a 10% p/v e autoclavá-la.
- Produção de um dispositivo de injeção de células
- Projeto geral do dispositivo: Prepare o aparelho mostrado na Figura 1. Este sistema é combinado com um aparelho de resfriamento de seringa e um aparelho de injeção principal.
- Preparar o aparelho de injeção principal descrito abaixo:
- Para uma injeção neonatal de bola de cardiomiócitos, use uma agulha de 29 G, 50 mm de comprimento equipada com uma seringa.
- Conecte uma seringa de transferência de energia (18G, 1 mL) consecutivamente usando uma seringa de injeção de células (Figura 1). Conecte a agulha da seringa de transferência de energia a um tubo fino de polipropileno com baixa capacidade de expansão do lúmen.
- Em seguida, conecte o outro lado do tubo de transferência de energia à agulha da mesma seringa (18G, 1 mL) e coloque-a em uma bomba de seringa. Encha as duas seringas e tubos de transferência de energia com água sem bolhas de ar.
NOTA: Quando um êmbolo da seringa de transferência de energia é empurrado, a pressão é transferida diretamente para a outra seringa e o êmbolo se projeta.
- Configure o sistema de resfriamento da seringa de injeção conforme descrito abaixo.
- Enrolar firmemente um tubo de cobre (diâmetro externo = 1 mm; diâmetro interno = 0,3 mm; espessura = 0,35 mm) firmemente ao redor da parte que contém a célula da seringa de injeção celular, deixando 10 mm de excesso de tubo em ambas as extremidades.
- Conecte o tubo de cobre a tubos plásticos flexíveis. Além disso, conecte as outras extremidades da tubulação plástica a uma bomba externa, encha a linha com água de resfriamento e resfrie a água imergindo o excesso do tubo de cobre em gelo triturado (Figura 1).
NOTA: Este sistema de arrefecimento mantém a solução de suspensão celular no cilindro a aproximadamente 2 °C.
3. Desenvolvimento de um modelo de infarto do miocárdio em ratos por oclusão obtusa da artéria coronária
- Anestesiar ratos machos imunodeficientes nus (F344/Njcl-rnu/rnu) com ar contendo isoflurano a 3%. Insira uma cânula na traqueia e conecte-a ao respirador.
- Conecte uma cânula a um vaporizador de isoflurano com um controlador para manter uma concentração de isoflurano a 3% e, assim, manter anestesia suficiente. Confirme que não houve resposta a estímulos dolorosos. Aplique pomada veterinária nos olhos para evitar o ressecamento.
- Fixar os membros com fitas cirúrgicas cortadas em uma placa cirúrgica aquecida a 40 °C. Torcer o corpo do rato à direita do eixo do corpo e usar a axila esquerda como campo cirúrgico.
- Retire os pelos no campo cirúrgico usando um creme depilatório e limpe a pele com iodopovidona. Usando tesoura afiada, corte uma incisão de 1,5 cm na pele e no músculo peitoral maior.
- Confirmar o terceiro espaço intercostal e rasgar os músculos intercostais e a pleura costal usando micropinças com pontas rombas. Mantenha o peito aberto usando um afastador. Remova suavemente o pericárdio fino com pinças.
- Para construir um modelo de infarto da parede lateral do coração, encontrar a posição 1 mm caudal à ponta do átrio esquerdo para identificar a artéria coronária obtusa, passar uma sutura de seda 7-0, colher tecido com 2,5 mm de largura e 2,5 mm de profundidade do dorsal para ventral e ligar o tecido firmemente.
- Confirmar o sucesso da ligadura pela contração fraca distal da ligadura. Após a remoção suave do afastador, colocar um fio de seda 5-0 entre o segundo e o quarto espaços intercostais e fechar a toracotomia.
- Diminuir a concentração de isoflurano para 1%. Suture suavemente o músculo e a pele com seda 5-0. Diminuir a concentração de isoflurano para 0% e aguardar aproximadamente 5 min até que a respiração espontânea comece.
- Aplicar topicamente 2 mg/mL de lidocaína em soro fisiológico na incisão. Administrar 1 ml de solução salina por injeção subcutânea. Aplique pomada veterinária topicamente para prevenir infecções.
- Retirar o rato do tubo de intubação e retornar à gaiola do animal; Em seguida, levante os ratos em gaiolas individuais por 1 semana.
- Analisar as alterações na função da bomba sistólica cardíaca por meio da ecocardiografia.
NOTA: A função cardíaca estará reduzida devido ao infarto do miocárdio lateral.
4. Transplante de células percutâneas ecoguiado pelo método de injeção lenta
- Pré-aqueça o caldo de gelatina a 10% a 37 °C até ficar líquido.
- Diluir o caldo de gelatina a 10% com tampão Ads pré-aquecido para obter a solução final injetável de gelatina a 5% p/v (são necessários 100 μL por animal).
- Suspender 96 bolas de cardiomiócitos (total: 28.800 cardiomiócitos/animal) em 100 μL de solução injetável pré-aquecida.
- Carregar a suspensão preparada na etapa 4.3 na seringa de injeção celular, evitando a aspiração do excesso de ar.
- Para eliminar bolhas na seringa, segure-a verticalmente com a agulha para cima, bata na seringa e colete quaisquer bolhas na crista superior da seringa.
NOTA: Durante esta etapa, observe as bolas de cardiomiócitos gradualmente se acomodarem no selo de borracha do êmbolo. - Mantenha a posição vertical da seringa, empurre o êmbolo lentamente e elimine as bolhas e o excesso de solução de suspensão celular até que 20 μL da suspensão celular permaneçam na seringa. Empurre o êmbolo cuidadosamente a uma velocidade constante para que a bola de cardiomiócito permaneça apoiada na vedação de borracha do êmbolo.
- Mergulhe a seringa tampada diretamente em um banho de gelo por 5 min.
- Coloque uma seringa resfriada no aparelho de injeção. Fixe firmemente o aparelho da seringa de injeção instalado em um dispositivo de movimento fino no palco do animal usando uma braçadeira artesanal ajustável em posição X-Y-Z. O dispositivo de movimento fino pode mover a posição da agulha usando os movimentos de deslizamento de 20 mm na direção x, balanço na direção y e curvamento na direção z.
- Anestesiar os ratos em uma caixa selada cheia de ar contendo isoflurano a 3%. Confirmar a anestesia sem resposta aos estímulos dolorosos. Aplique pomada veterinária nos olhos para evitar o ressecamento.
- Fixar os membros com fitas cirúrgicas cortadas em uma placa de eco aquecida a 40 °C. Para manter anestesia suficiente, certifique-se de que o ar inalado contenha uma concentração de aproximadamente 3% de isoflurano.
- Retire o cabelo no campo de injeção (2 cm de diâmetro) e o peito com creme depilatório e limpe a pele com iodopovidona.
- Aplicar eco-gel no tórax e sonda de eco. Colocar o ecoprobe próximo ao tórax ao longo dos eixos cranial e caudal e iniciar a obtenção da ecocardiografia modo B seguindo o manual do fabricante.
- Avançar a ponta da agulha de injeção para o miocárdio na vista frontal (Figura 2 e Vídeo Suplementar 1).
- Para ativar a bomba de seringa principal, pressione o botão Iniciar e gire o mostrador para ajustar a um número predeterminado para uma velocidade de injeção de aproximadamente 0,02 μL/s. Aplique pomada veterinária topicamente ao redor da posição do agulhamento para evitar infecções.
NOTA: É necessário determinar o número de marcação adequado para a velocidade de injeção pretendida utilizando uma solução de injeção. Após a injeção, remova a agulha de injeção usando um sistema de movimento exemplar. - Diminuir a concentração de isoflurano para 0% e aguardar aproximadamente 5 min até que o animal recupere a consciência suficiente para manter a decúbito esternal.
5. Avaliação da função cardíaca
- Anestesiar os ratos em uma caixa selada cheia de ar contendo isoflurano a 3%. Confirmar a anestesia sem resposta aos estímulos dolorosos. Aplique pomada veterinária nos olhos para evitar o ressecamento.
- Aplique creme eletrizante para aquisição de ECG nas pontas dos membros. Fixar os membros com fitas cirúrgicas cortadas em uma placa de eco aquecida a 40 °C. Use um sistema de monitoramento fisiológico para detectar ECG em tempo real e frequência cardíaca.
- De acordo com as instruções do fabricante, primeiro determine o ângulo do eixo longo usando a imagem de eco modo B mostrando o ápice do ventrículo esquerdo para a via de saída e, em seguida, gire o ecoprobe 90° para mudar para o corte de eixo curto.
- Usando apenas o sistema de movimento fino do eixo caudal para rostral do estágio animal, ajuste a visão de eixo curto para o nível do músculo papilar. Em seguida, altere o modo de imagem para o modo M pressionando o botão M-mode e grave um vídeo por 5 s pressionando o botão Cine-loop.
- Para analisar e calcular o encurtamento da fração usando o software, pressione o botão Medir e uma ferramenta de linha vertical para definir as dimensões internas sistólicas e diastólicas finais do ventrículo esquerdo. O software calcula automaticamente a porcentagem de encurtamento da fração (FS).
- Diminuir a concentração de isoflurano para 0% e aguardar aproximadamente 5 min até que o animal recupere a consciência suficiente para manter a decúbito esternal.
6. Imuno-histoquímica
- Fixar o corpo eutanasiado (realizar a eutanásia como no passo 1.1.3) sobre a mesa usando as fitas cirúrgicas cortadas, excisar os corações, lavar com PBS e imergir o coração em paraformaldeído/PBS a 4%.
- Disseque os corações em três seções, mergulhe-os em sacarose a 40% para crioproteção, embuta em um composto de temperatura de corte ideal (OCT) e congele-os a -80 °C.
- Fixar os tecidos criosseccionados (8 μm de espessura) a lâminas de vidro revestidas com aminosilano. Após secagem suficiente usando vento não aquecido gerado por um secador de cabelo geral, mergulhe as lâminas de vidro em solução salina tamponada com tris, contendo 0,2% de Tween-20 (TBS-T).
- Mergulhá-los numa solução de bloqueio durante 30 minutos a 25 °C. Despeje 100 μL da solução de bloqueio contendo anticorpos primários na lâmina e incube durante a noite a 4 °C com selamento em parafina para manter a solução de anticorpos espalhada no tecido.
NOTA: A concentração de anticorpos é mostrada na Tabela de Materiais. - Coloque as lâminas horizontalmente em uma caixa artesanal de alta umidade utilizando o vapor natural do papel molhado para evitar a evaporação. Lave as lâminas três vezes com TBS-T.
- Tratar com o agente bloqueador secundário contendo anticorpos durante 1 h a 25 °C da mesma forma que o anticorpo primário. Após três lavagens, observar os sinais de fluorescência utilizando microscópio de fluorescência e microscópio confocal a laser.
NOTA: A concentração de anticorpos é mostrada na Tabela de Materiais. - Análise estatística: Para a comparação do volume celular, como mostra a Figura 3A, realizar o teste t não pareado; para avaliar a recuperação funcional cardíaca após a administração de cardiomiócitos pelo método de injeção lenta, como mostrado na Figura 4A, use um teste t pareado. Neste trabalho, as diferenças foram consideradas estatisticamente significantes a partir de P <,01. As barras de erro representam o desvio padrão.
Representative Results
Efeitos da injeção lenta na sobrevivência celular e deposição de colágeno
Bolas de cardiomiócitos neonatais marcadas com PKH26 foram injetadas no miocárdio de ratos nude normal usando um método de injeção normal ou lenta. Os resultados mostraram que o método de injeção lenta aumentou significativamente o volume celular enxertado (Figura 3A) e diminuiu significativamente a deposição de colágeno tipo I no local (Figura 3B).
Efeitos da injeção lenta na eficácia do tratamento em modelo de infarto em ratos
O método de injeção lenta guiada por ecocardiógrafo foi usado para injetar bolas de cardiomiócitos neonatais de ratos ou PBS(−) nos corações infartados de ratos modelo. O grupo injetado apenas com células apresentou melhora significativa na função de contração cardíaca após 2 meses (Figura 4A). A análise imuno-histoquímica revelou uma conexão perfeita entre as células enxertadas e os miócitos do hospedeiro através de discos intercalados contendo junções comunicantes (Figura 4B).
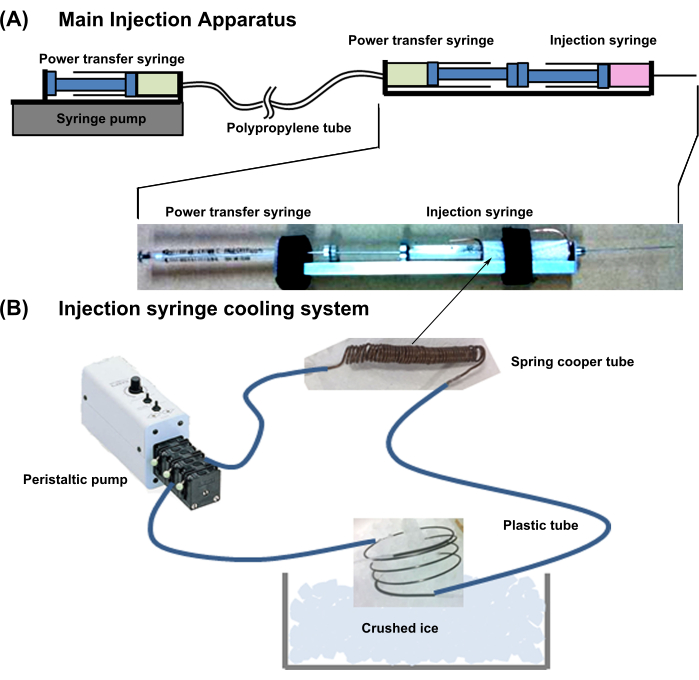
Figura 1: Esquema de todo o sistema de injeção . (A) Aparelho de injeção principal. (B) Sistema de resfriamento da seringa de injeção. Clique aqui para ver uma versão maior desta figura.
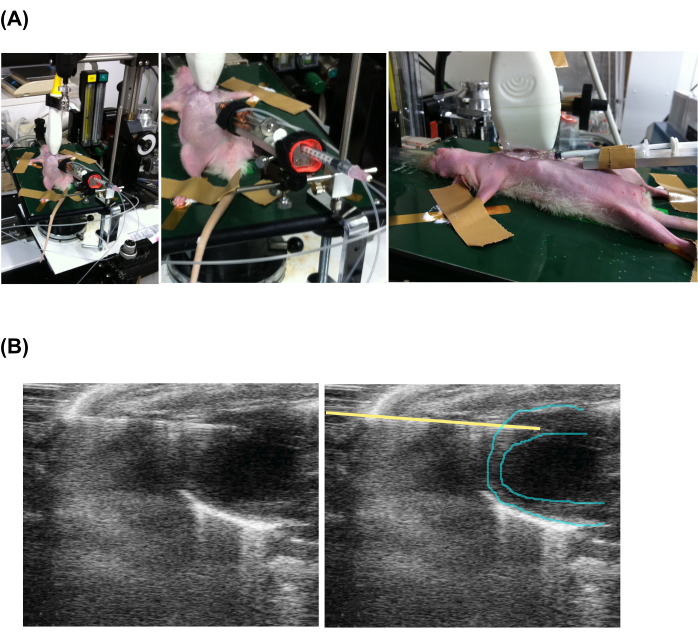
Figura 2: Injeção percutânea lenta guiada por ecocardiograma . (A) Fixação do animal, sonda de eco e aparelho de injeção. (B) Visão ecocardiográfica da seringa injetora e do coração. Observe que as figuras esquerda e direita são as mesmas, mas uma linha amarela foi adicionada para indicar a posição da agulha. Clique aqui para ver uma versão maior desta figura.
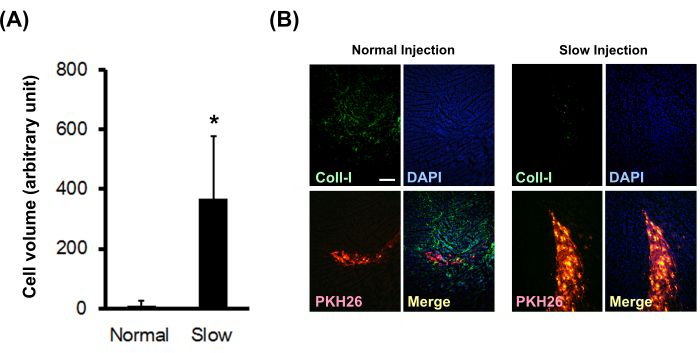
Figura 3: Efeito do método de injeção lenta sobre o volume celular enxertado e deposição de colágeno. (A) Os volumes celulares enxertados (N = 3) foram calculados a partir de cortes seriados. As barras de erro indicam desvios padrão. *P < 0,01 no teste t não pareado. (B) Coloração imunoistoquímica para colágeno tipo I. A barra de escala indica 200 μm. Clique aqui para ver uma versão maior desta figura.
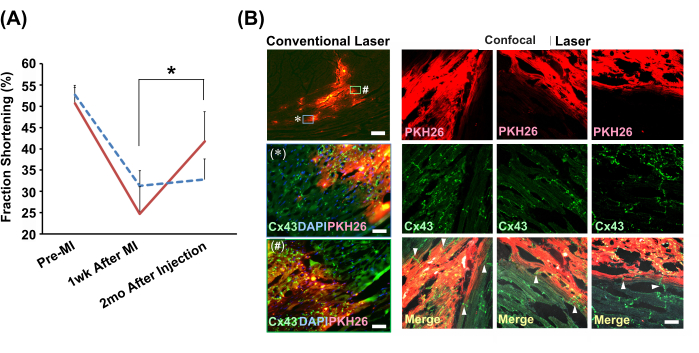
Figura 4: Melhora da função cardíaca e integração histológica com bolas de cardiomiócitos enxertadas pelo método de injeção lenta . (A) Incidências representativas do ecocardiógrafo modo M. O gráfico mostra a transição dos encurtamentos fracionários no grupo transplantado com bola de cardiomiócitos (linha vermelha sólida; N = 4) e grupo veículo (solução de suspensão celular para o método de injeção lenta) (linha azul pontilhada; N = 3). Abreviações: IM = infarto do miocárdio; Cx43 = conexina 43; DAPI = 4',6-diamidino-2-fenilindol; PKH26 = marcação da membrana de células fluorescentes vermelhas. As barras de erro indicam os desvios padrão. *P < 0,01 no teste t pareado. (B) Análise imunoistoquímica da relação entre as bolas de cardiomiócitos enxertadas e os cardiomiócitos do hospedeiro. As observações microscópicas convencionais do laser usando uma lente objetiva 2x são mostradas na coluna da esquerda. Versões ampliadas (usando uma lente objetiva de 20x) de duas áreas mostradas na caixa, rotuladas com * e #, são apresentadas abaixo. Barras de escala: imagem superior = 300 μm; * e # = 30 μm. Imagens microscópicas confocais a laser usando uma lente objetiva de 20x são mostradas ao longo do comaparison. Três posições são mostradas. Nas imagens mescladas, as pontas de seta indicam a existência de junções comunicantes (Cx43) conectando diretamente o enxerto e os cardiomiócitos do hospedeiro. A barra de escala indica 30 μm. Clique aqui para ver uma versão maior desta figura.
Vídeo Suplementar 1: Método de injeção lenta ecoguiada. O ecocardiograma modo B na incidência frontal mostra a ponta da agulha de injeção avançada para o miocárdio. Clique aqui para baixar este arquivo.
Discussion
Um dos pontos críticos no desempenho bem-sucedido do método de injeção lenta é a preparação de um sistema de injeção eficaz usando uma bomba de seringa poderosa e um tubo de transferência de pressão forte. Um sistema de alta pressão é necessário para empurrar o gel para fora da ponta de uma agulha fina. O segundo ponto crítico é a estabilização do coração. O batimento do coração contra uma agulha de injeção avançada no miocárdio pode ferir o tecido. Neste estudo, uma injeção ecoguiada foi conduzida para evitar que os animais sofressem uma segunda lesão torácica aberta e para administrar a injeção de células em um coração estabilizado com os pulmões inflados. Além disso, em algumas aplicações para animais maiores ou humanos, alguns dispositivos de injeção conectados ao coração devem ser considerados como parte do design estratégico da aplicação. Para injeções torácicas abertas no coração de pequenos animais, recomenda-se o uso de uma agulha longa e flexível, dadas as frequências cardíacas mais altas.
Neste trabalho, o método de injeção lenta aumentou significativamente o volume de cardiomiócitos sobrevivente em comparação com o método de injeção normal. A injeção normal causa dano celular via tensão de cisalhamento15. Em contraste, o método de injeção lenta não causa esse estresse teoricamente porque usa uma solução não newtoniana além da injeção lenta.
Em termos de fibrose local, o espaço intersticial ao redor dos cardiomiócitos sobreviventes normalmente injetados mostrou forte e disseminada deposição de colágeno tipo I. Em contraste, os sinais de colágeno tipo I ao redor dos cardiomiócitos enxertados pelo método de injeção lenta foram muito mais fracos e limitados. Isso sugere que o método de injeção lenta causou significativamente menos danos. A injeção lenta de cardiomiócitos neonatais no miocárdio adulto melhorou significativamente a função contrátil do coração infartado. As análises histológicas sugeriram que a enxertia dos cardiomiócitos pelo método de injeção lenta resultou em conexões diretas e acoplamento funcional com os cardiomiócitos do hospedeiro. Esse fenômeno explica o mecanismo de recuperação funcional do miocárdio do hospedeiro. Até onde sabemos, este é o primeiro relato de cardiomiócitos neonatais enxertados com conexões contínuas em larga escala com os cardiomiócitos adultos do hospedeiro. As conexões funcionais com o miocárdio do hospedeiro via acoplamento elétrico e mecânico podem fazer com que os cardiomiócitos enxertados amadureçam e permitam que eles atuem como miócitos funcionais que contribuem para a função cardíaca do hospedeiro. Interações de força física em longo prazo entre o hospedeiro e os cardiomiócitos do enxerto são cruciais para a maturação completa. Portanto, 2 meses após a injeção podem ser necessários para a recuperação funcional do coração infartado. A recuperação tempo-dependente da função cardíaca do paciente pode ser um fenômeno esperado em aplicações terapêuticas, e isso pode ser uma marca do estabelecimento bem-sucedido do acoplamento funcional de novo e da integração entre o hospedeiro e os cardiomiócitos enxertados.
O método de injeção lenta pode ser realizado durante a cirurgia torácica aberta. Além disso, esse método pode ser aplicado em camundongos. Para futuras aplicações em terapia humana, ainda precisamos resolver várias questões. A velocidade de injeção deve ser otimizada considerando-se a capacidade tampão do fluxo de fluido intersticial em cada órgão-alvo humano. Devem ser aplicados materiais livres de xeno, como gelatina humana ou materiais sintéticos biodegradáveis. Devem ser desenvolvidos aparelhos clínicos de injecção lenta de grau GMP, tais como ferramentas descartáveis compactas específicas para órgãos ou um aparelho reutilizável aplicável a órgãos largos.
Disclosures
O autor não tem nada a revelar.
Acknowledgements
Este estudo foi financiado por uma bolsa da JSPS KAKENHI (Grant No. 23390072 e 19K07335) e AMED (Grant No. A-149).
Materials
| Name | Company | Catalog Number | Comments |
| 18-gauge needle & tuberculin, 1 mL | Terumo | NN1838R, SS-01T | |
| 29-gauge 50 mm-long needle | Ito Corporation, Tokyo, Japan | 14903 Type-A | |
| A copper tube | General Suppliers | outer diameter, 1 mm; inner diameter, 0.3 mm; thickness, 0.35 mm | |
| Ads Buffer | Each ingredient was purchased from Fuji Film Wako Chemical Inc., Miyazaki, Japan | Hand made, Composition: 116 mM NaCl, 20 mM HEPES, 12.5 mM NaH2PO4, 5.6 mM glucose, 5.4 mM KCl, 0.8 mM MgSO4, pH 7.35 | |
| alpha-MEM | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 051-07615 | |
| Anti-collagen type I rabbit polyclonal antibody (H+L) | Proteintech | 14695-1-AP | using dilution 1:100 |
| Anti-Connexin-43 rabbit polyclonal antibody (H+L) | Sigma Aldrich | C6219 | using dilution 1:100 |
| Anti-rabbit IgG (H+L) donley polyclonal antibody-AlexaFluo488 | Thermo Scientific | A21206 | using dilution 1:300 |
| blocking solution (Blocking One) | Nacalai Tesque, Kyoto, Japan | 03953-95 | |
| collagenase | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 034-22363 | |
| confocal laser microscope | Carl Zeiss Inc., Oberkochen, Germany | LSM510 META | |
| DNase I | Sigma-Aldrich | DN25 | |
| FACS Aria III | Becton Dickinson, Franklin Lakes, NJ, USA | ||
| fetal bovine serum | BioWest, FL, USA | S1820-500 | |
| fine movement device (Micromanipulator) | Narishige Co., Ltd., Tokyo, Japan | M-44 | |
| fluorescence microscope | Nikon Instruments, Tokyo, Japan | Eclipse Ti2 | |
| gelatin from bovine skin | Sigma-Aldrich | G9382 | dissolving in PBS (-) to 10%, and autoclaving it |
| Neonatal Sprague-Dawley (SD) rats | Japan SLC Inc., Shizuoka, Japan | 0–2 d after birth | |
| non-adhesive 96-well plates (spheloid plate) | Sumitomo Bakelite, Tokyo, Japan | MS-0096S | |
| Optimal Cutting Temperature (OCT) Compound | Sakura Finetek USA, Inc., CA, USA | Tissue-Tek OCT compound | |
| peristaltic pump (for cooling system) | As One Co., Osaka, Japan | SMP-23AS | |
| PKH26 | Sigma-Aldrich | PKH26GL | |
| Stir Bar, Micro, Magnetic, PTFE, Length x Dia. in mm: 5 x 2 | Chemglass life sciences LLC, NJ, USA | CG-2003-120 | |
| syringe | Ito Corporation, Tokyo, Japan | MS-N25 | |
| syringe pump with remote controller | As One Co., Osaka, Japan | MR-1, CT-10 | |
| tetramethylrhodamine methyl ester | Thermo Fisher Scientific, Waltham, MA, USA | T668 | |
| trypsin | DIFCO, Becton Dickinson, Franklin Lakes, NJ, USA | 215240 | |
| Tween-20 | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 167-11515 | |
| veterinarian ointment | Fujita Pharmaceutical Co., Ltd. | Hibikusu ointment #WAK-95832 | |
| Vevo 2100 Imaging System | Fujifilm VisualSonics, Inc., Toronto, Canada | Vevo 2100 | |
| Vevo 2100 Imaging System software version 1.0.0 | Fujifilm VisualSonics, Inc., Toronto, Canada | Vevo 2100 | |
| Weakly curved needle with ophthalmic thread | Natsume Seisakusho Co., Ltd., Tokyo, Japan | C7-70 |
References
- Chavkin, N. W., et al. The cell surface receptors Ror1/2 control cardiac myofibroblast differentiation. Journal of the American Heart Association. 10 (13), e019904 (2021).
- Li, H., et al. The cell membrane repair protein MG53 modulates transcription factor NF-κB signaling to control kidney fibrosis. Kidney International. 101 (1), 119-130 (2022).
- Liu, X., Liu, Y., Khodeiry, M. M., Lee, R. K. The role of monocytes in optic nerve injury. Neural Regeneration Research. 18 (8), 1666-1671 (2023).
- Weber, F., Treeck, O., Mester, P., Buechler, C. Expression and function of BMP and activin membrane-bound inhibitor (BAMBI) in chronic liver diseases and hepatocellular carcinoma. International Journal of Molecular Sciences. 24 (4), 3473 (2023).
- Tohyama, S., et al. Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes. Cell Stem Cell. 12 (1), 127-137 (2013).
- Hattori, F., Fukuda, K. Strategies for replacing myocytes with induced pluripotent stem in clinical protocols. Transplantation Reviews. 26 (3), 223-232 (2012).
- Hattori, F., et al. Nongenetic method for purifying stem cell-derived cardiomyocytes. Nature Methods. 7 (1), 61-66 (2010).
- Fernandes, S., et al. Human embryonic stem cell-derived cardiomyocytes engraft but do not alter cardiac remodeling after chronic infarction in rats. Journal of Molecular and Cellular Cardiology. 49 (6), 941-949 (2010).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538 (7625), 388-391 (2016).
- Wendel, J. S., et al. Functional effects of a tissue-engineered cardiac patch from human induced pluripotent stem cell-derived cardiomyocytes in a rat infarct model. Stem Cells Translational Medicine. 4 (11), 1324-1332 (2015).
- Hattori, F. Technology Platforms for Heart Regenerative Therapy Using Pluripotent Stem Cells. Stem Cells and Cancer Stem Cells, Volume 7: Therapeutic Applications in Disease and Injury. , 33-45 (2012).
- Tao, S., et al. Ablation lesion characterization in scarred substrate assessed using cardiac magnetic resonance. JACC: Clinical Electrophysiology. 5 (1), 91-100 (2019).
- Rutkowski, J. M., Swartz, M. A. A driving force for change: interstitial flow as a morphoregulator. Trends in Cell Biology. 17 (1), 44-50 (2007).
- Hattori, F., Fukuda, K., Yuasa, S. How to purify cardiomyocytes for research and therapeutic purposes. Cardiac Regeneration using Stem Cells. , (2013).
- Li, M., Tian, X., Zhu, N., Schreyer, D. J., Chen, X. Modeling process-induced cell damage in the biodispensing process. Tissue Engineering. Part C, Methods. 16 (3), 533-542 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved