Quantificação rápida de formas oxidadas e reduzidas de glutationa usando orto-ftalaldeído em células de mamíferos cultivadas in vitro
In This Article
Summary
A quantificação das formas oxidada e reduzida de glutationa (GSSG e GSH, respectivamente) foi obtida através do uso de orto-ftalaldeído (OPA). O OPA torna-se altamente fluorescente uma vez conjugado ao GSH, mas é incapaz de conjugar o GSSG até que seja reduzido. Aqui, descrevemos um ensaio multiparamétrico para quantificar ambos usando quantificação de proteínas para normalização.
Abstract
A glutationa tem sido considerada um biomarcador chave para determinar a resposta antioxidante da célula. Portanto, é um marcador primário para estudos de espécies reativas de oxigênio. O método utiliza orto-ftalaldeído (OPA) para quantificar a concentração celular de glutationa(s). O OPA conjuga-se com a glutationa reduzida (GSH) via ligação sulfidrila para formar posteriormente um isoindol, resultando em um conjugado altamente fluorescente. Para obter um resultado preciso de glutationa oxidada (GSSG) e GSH, é necessária uma combinação de agentes mascarantes e redutores, que foram implementados neste protocolo. Os tratamentos também podem afetar a viabilidade celular. Portanto, a normalização via ensaio de proteína é apresentada neste ensaio multiparamétrico. O ensaio demonstra uma faixa de detecção pseudolinear de 0,234 - 30 μM (R2 = 0,9932 ± 0,007 (N = 12)) específica para GSH. O ensaio proposto também permite a determinação de glutationa oxidada com a adição do agente de mascaramento N-etilmaleimida para ligar a glutationa reduzida, e o agente redutor tris (2-carboxietil) fosfina é introduzido para clivar a ligação dissulfeto em GSSG para produzir duas moléculas de GSH. O ensaio é usado em combinação com um ensaio de ácido bicinconínico validado para quantificação de proteínas e um ensaio de adenilato quinase para avaliação de citotoxicidade.
Introduction
As espécies reativas de oxigênio (ROS) são um indutor primário do estresse oxidativo; O estresse oxidativo está bem estabelecido na geração de mutações no DNA, envelhecimento/morte celular, vários tipos de câncer, diabetes, doenças neurológicas (como Parkinson e Alzheimer) e várias outras condições debilitantes da vida 1,2,3,4,5. Uma defesa fundamental contra ROS são os antioxidantes tiólicos não enzimáticos, que são capazes de reduzir oxidantes ou radicais agindo como doadores de prótons 6,7. A glutationa (GSH) e a cisteína são os dois tióis mais prevalentes encontrados em mamíferos8, enquanto existem vários outros tióis de baixo peso molecular (como ergotioneína), GSH e cisteína são os antioxidantes não enzimáticos mais comumente medidos encontrados na literatura 9,10,11 e têm maior relevância no combate às EROs 8,12,13,14.
Quando o GSH é utilizado como antioxidante, duas moléculas de GSH são ligadas covalentemente por meio de uma ligação dissulfeto para produzir dissulfeto de glutationa (GSSG). A depleção de GSH é frequentemente usada como um indicador de estresse oxidativo15,16. Essa avaliação também pode ser combinada com a detecção de GSSG, embora os aumentos de GSSG nas células sejam frequentemente limitados por processos de exportação ativos, uma vez que o GSSG pode ser relativamente reativo nas células, levando à formação de ligações dissulfeto com outros tióis proteicos16.
Os métodos tradicionais de medição de GSH e GSSG não são processos simples e requerem várias etapas, incluindo a extração celular usando reagentes líticos17,18. O protocolo descrito aqui simplifica esses métodos e permite a medição precisa de tióis não enzimáticos e a normalização usando o conteúdo de proteína celular ou a liberação de adenilato quinase. Além disso, é possível medir a viabilidade celular antes da extração de GSH/GSSG. Vários métodos tentaram anteriormente direcionar e quantificar tióis não enzimáticos reduzidos e oxidados de forma eficiente; métodos que incluem o uso de HPLC 19,20,21, ensaio em placa (bioquímico)22,23,24,25 e que usam reagentes comuns para conjugação de tióis, como 5,5-ditio-bis-(ácido 2-nitrobenzóico) (DTNB/reagente de Ellman)19, monoclorobimano (mBCI)26,27,28. Várias empresas também prepararam kits proprietários para a detecção de glutationa; no entanto, eles não publicam incompatibilidades reagentes, o que apresenta questões dependentes dos tratamentos utilizados29.
Este protocolo descreve um ensaio multiparamétrico que detecta tióis reduzidos (como GSH ) por meio da conjugação orto-ftalaldeído (OPA) para produzir um sinal fluorescente detectável em 340/450 Ex/Em, respectivamente. Este ensaio facilita a detecção de GSH e GSSG simultaneamente (em placa), através do uso de agentes de mascaramento (N-etilmaleimida) e agentes redutores de GSSG (fosfina de tris(2-carboxietil)). Este protocolo multi-biomarcador também oferece uma oportunidade durante o estágio de lise celular para quantificar proteínas via ensaio de ácido bicinconínico para a normalização de amostras após a conclusão da medição final ou por meio de um ensaio de adenilato quinase do meio celular. Este ensaio pode ser realizado utilizando vários reagentes prontamente disponíveis na maioria dos laboratórios e requer apenas alguns produtos químicos incomuns adicionais para ser executado. O processo é simples, acessível e pode ser realizado sem etapas trabalhosas em menos de 2 h.
Neste protocolo, foram escolhidos vários nanomateriais que foram previamente mostrados para induzir ROS ou suspeitos de induzir estresse oxidativo30,31. Uma faixa de concentração foi explorada para ver os efeitos da exposição desses nanomateriais em várias linhagens celulares e a eficácia do ensaio na quantificação de tióis antioxidantes.
Protocol
NOTA: O protocolo a seguir foi projetado com a capacidade de ser utilizado em conjunto com um ensaio de proteína de ácido bicinconínico (BCA) e um ensaio de adenilato quinase (AK) para normalizar amostras para tratamentos. Certifique-se de que o operador esteja usando trajes apropriados e equipamentos de segurança necessários, como jaleco Howie, luvas de nitrilo e óculos de segurança classe I, durante a preparação e uso dos materiais. O protocolo é dividido em várias etapas.
1. Preparações de estoque e soluções de trabalho
- Prepare soluções de estoque do padrão GSH 100 mM em HCl 1 mM (preparado a partir de HCl 37% em água bidestilada (ddH2O)).
NOTA: Se diluir de ácido altamente concentrado, como HCl 37%, certifique-se do processo correto de adição de ácido à água em uma capela de classe I. - Preparar uma reserva de OPA 22,35 mM em etanol absoluto. Execute esta etapa em um exaustor classe I. Preparar 25 mM de N-etilmaleimida (NEM) em ddH2O. Executar este passo numa hotte de classe I.
NOTA: Essas três soluções podem ser armazenadas a -20 °C por até 3 meses. - Prepare 0,01 M Tris (2-carboxietil) fosfina (TCEP) para um volume total de 500 μL, necessário para 100 poços. Preparar 100 μL de 1 mM GSH padrão, diluído a partir de 100 mM de stock utilizando ddH2O.
- Use tampão de lise de imunoprecipitação (IP) ou a seguinte formulação: 394 mg de Tris-HCl (concentração final de 25 mM), 877 mg de NaCl (concentração final de 150 mM), 29 mg de EDTA (concentração final de 1 mM), 1 mL de 100% NP-40 ou IGEPAL CA-630 (concentração final de 1% V / V), 5 mL de glicerol (concentração final de 5% V / V), 84 mL de ddH2O. Misture os componentes mexendo suavemente e ajuste o pH para 7,4. Transvasar para um balão volumétrico de 100 ml e adicionar o volume restante de ddH2O até atingir um volume final de 100 ml. Filtrar estéril através de um filtro de 0,22 μm e armazenar a 2-8 °C por até 6 meses.
NOTA: As soluções de lise atuam como contaminantes/interferentes neste ensaio; portanto, as formulações acima são especificadas. - Prepare 1 L de solução salina tamponada com fosfato 0,1 M suplementada com ácido etilenodiamina tetracético (PBS-EDTA) em 3 valores de pH diferentes, especificamente 7,2, 8,5 e 9,0. Use um tampão PBS comercial 0,1 M suplementado com 1 mM EDTA (292,24 mg / L) ou a seguinte formulação 10x (1 L): 80 g NaCl, 2,0 g KCl, 14,4 g Na2HPO4, 2,4 g KH2PO4, 800 mL de ddH2O. Adicione e misture; complete até 1 L. Autoclave a solução para esterilidade e armazene-a por 12 meses em temperatura ambiente. A partir da solução estoque 10x, faça uma solução de trabalho de PBS e complemente-a com EDTA (concentração conforme declarado anteriormente).
NOTA: O pH é de importância crítica; certifique-se de que o pH seja preciso antes de iniciar o protocolo. - Realize diluição serial 1:2 de 1 mM GSH usando ddH2O (1 mM, 500 μM, 250 μM, 125 μM, 62,5 μM, 31,25 μM, 15,625 μM e 7,8125 μM). Adicionar 10 μL de cada concentração aos alvéolos padrão (realizados em duplicado). As amostras serão posteriormente diluídas em tampão de lise; portanto, as concentrações serão 1/5 de sua concentração original posteriormente (200, 100, 50, 25, 12,5, 6,25, 3,125, 1,5625 μM).
NOTA: As concentrações finais para calibração serão de 30 μm, 15 μm, 7.5 μm, 3.75 μm, 1.875 μm, 937.5 nm, 468.8 nm e 234.4 nm.
2. Preparação do ensaio
NOTA: Este protocolo usa linhas de células humanas HepG2, A549 e J774, que foram adquiridas comercialmente da ATCC. Essas linhagens celulares foram utilizadas de acordo com as diretrizes aprovadas descritas pelas leis e regulamentos de cultura animal e de tecidos da Universidade.
- Às 24 h antes do início do ensaio, as células das sementes nas concentrações indicadas no Quadro 1; no entanto, dependendo da linhagem/tipo celular e do tratamento utilizado, ajustar a densidade conforme necessário. Cultive células em meio de crescimento completo (meio essencial modificado por Eagles (EMEM) com 10% de soro fetal de bezerro inativado por calor (HIFS), 1% de Penstrep (10.000U/mL de penicilina/10mg/mL de estreptomicina) e 1% de aminoácidos não essenciais.
- Células de sementes usando métodos convencionais de semeadura celular32. Células de sementes em placas totalmente pretas se não forem usadas por microscopia pós-ensaio. Avalie as células quanto à confluência e saúde geral no frasco T75 antes de usar por microscopia.
- Em uma cabine de segurança biológica de classe II limpa e estéril e seguindo uma técnica asséptica rigorosa, descarte o meio celular, lave suavemente as células com ~ 15 mL de PBS estéril em temperatura ambiente (RT) e descarte.
- Ao balão celular, adicione 5 mL de tripsina 1x estéril, agite suavemente para garantir a cobertura da monocamada celular e coloque em uma incubadora a 37 ° C por 5 min para facilitar o desprendimento da célula.
- Pare a tripsinização pela adição de meio de crescimento contendo soro fetal de bezerro inativado pelo calor (10%), aproximadamente 10 mL.
- Transfira as células para um tubo de centrífuga de 50 mL e pellet a 200 x g por 5 min. Descarte a mídia e substitua-a por 5 mL da mesma mídia. Ressuspenda as células no tubo até que fiquem homogêneas e nenhum aglomerado possa ser observado.
- Remova 20 μL de suspensão celular e coloque em um hemocitômetro para contagem. Uma vez calculado o número de células necessárias, faça uma diluição para fazer uma solução com a densidade celular correta.
- Meios de pipeta contendo células em placas de 96 poços (capacidade de 350 μL), com um volume máximo de 200 μL por poço. Coloque as células em uma incubadora a 37 ° C com 5% de CO2 por 24 h para aderir à superfície da placa.
- Para avaliar a glutationa total e o GSSG, trate as amostras para ambas as condições. Semeie e trate 6 poços para fornecer 2 conjuntos de GSH e GSSG com 3 repetições técnicas (a Figura 1 demonstra o layout).
- Garantir que todos os reagentes estejam adequadamente preparados antes do início do ensaio; certifique-se de que todos os componentes e reagentes do tampão estejam em RT antes de iniciar a construção de tampões ou uso no ensaio, com exceção do pH 7,4 PBS (sem EDTA), que deve ser mantido em gelo/refrigerado até o uso.
NOTA: É de importância crítica que a formação de bolhas seja limitada ao mínimo para permitir que as reações desejadas ocorram dentro do ensaio e permitir uma quantificação precisa via leitor de placas.
| Linhagem celular | Densidade de semeadura (placa de 96 poços) |
| HepG2 | 10.000 células/poço |
| Resposta 549 | 5.000 células/poço |
| J774 | 10.000 células/poço |
Tabela 1: Densidades de semeadura sugeridas para as linhagens celulares escolhidas. São demonstradas diferentes densidades de semeadura para três linhagens celulares diferentes usadas nos dados representados, especificamente A549, J774 e HepG2.
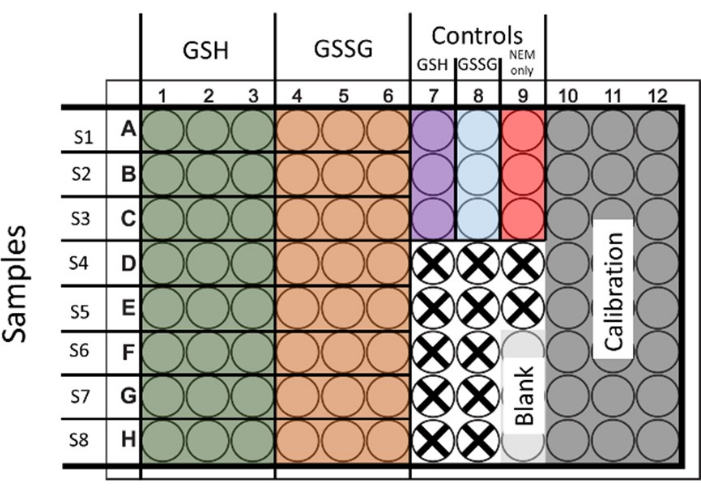
Figura 1: Layout proposto para semeadura de placas de 96 poços para a determinação simultânea de glutationa total e dissulfeto de glutationa. Poços para calibração e controles também são demonstrados. Os poços que não são utilizados são representados com uma cruz. Clique aqui para ver uma versão maior desta figura.
3. Tratamento de nanomateriais
- Pesar nanomateriais (especificamente ZnO, TiO2, CuO e Ag) em uma escala de peso compatível com μg. Efetuar um cálculo para atingir uma concentração inicial de 1 mg/ml por nanomaterial.
- Transferir as soluções de nanomateriais para um sonicador e sonicar durante 16 minutos utilizando um banho de sonicação (38 W) para obter uma solução homogénea. Fazer uma série de diluições para cada nanomaterial a 125, 62,5, 31,25, 15,625 μg/ml.
- Remova as células da incubadora e lave levemente com RT PBS. Depois de garantir que todo o PBS foi removido, adicione 100 μL de tratamentos à placa, com controles (meios de cultura sem HIFS). Após a aplicação do tratamento nas células, incubar com os nanomateriais em uma incubadora a 37 ° C (5% CO2) por 4 h; em seguida, use o protocolo abaixo para quantificar GSH: GSSG, concentração de proteína e liberação de AK.
4. Protocolo do ensaio
- Após a exposição ao tratamento (Figura 2A), avalie a viabilidade por meio da atividade da adenilato quinase (AK) (opcional). Use um kit comercial para este ensaio seguindo as instruções do fabricante.
- Gire as placas em uma centrífuga a 200 x g por 5 min para tratamento leve de pellets e detritos celulares (Figura 2B).
- Remova 20 μL de sobrenadante de meio suavemente de cada amostra e controle o poço (conforme especificado acima) e pipete em uma placa branca adjacente de 96 poços no mesmo formato de layout (Figura 2C).
- Adicione 100 μL de solução de trabalho do kit AK a cada poço, proteja a placa da luz e deixe desenvolver por 10 minutos em temperatura ambiente. Registre a luminescência usando um leitor de placas a 1000 contagens/s.
- Para padrões GSH, adicione 40 μL de tampão glutationa total a cada poço (Figura 2D; opcional, necessário para quantificação).
- Aspire o meio restante da placa e lave 3x com PBS 0,1 M gelado, pH 7,2, descartando cada lavagem (Figura 2E) com exceção dos padrões. Deixe a lavagem final na placa até que a calibração GSH tenha sido carregada na placa.
- Adicione 10 μL de cada concentração de glutationa e branco (ddH2O) em poços em triplicata.
- Remova a lavagem final do PBS e adicione as misturas a cada poço conforme a Tabela 2 para a quantificação desejada (Figura 2E). Calcule os volumes necessários antes de iniciar esta etapa devido à perda de atividade sensível ao tempo com buffers completos. Certifique-se de que essas misturas de reagentes sejam feitas antes de iniciar o processo de ensaio, mas não permita que elas permaneçam por mais de 30 minutos antes do uso.
- Coloque em um agitador de placas orbitais e deixe a placa agitar a 300 RPM por 2 min (Figura 2F).
- Remova do agitador e adicione 5 μL de solução de TCEP 0,01M a cada poço, excluindo o poço de controle NEM. Retorne a placa ao shaker e incube por 10 min (Figura 2F).
- Transfira a placa para a centrífuga e gire a 200 x g por 5 min. Transferir 25 μL de cada poço de amostra para outra placa de 96 poços (transparente); Isso será utilizado para concentração de proteína (consulte a etapa 4.15; Figura 2G). Não transfira padrões ou controles de ensaio.
- Certifique-se de que o volume final de cada poço seja de 30 μL; remova o volume dos controles e padrões para atender a esse requisito (Figura 2H).
- Adicione 170 μL de solução de OPA de trabalho a cada poço, proteja a placa da luz e coloque no agitador por 15 min (Figura 2I).
- Leia a fluorescência usando um leitor de placas em Ex340/Em450 (Figura 2J). Certifique-se de que não haja bolhas durante o estágio de medição; Eles terão um impacto prejudicial tanto na reação quanto na quantificação via leitor de placas.
- Para quantificar o teor de proteína das células lisadas, use um kit de ensaio BCA comercial. Transfira amostras retiradas da etapa 4.12 para uma nova placa de 96 poços (transparente) a 25 μL por poço.
- Use um padrão de albumina de soro bovino (BSA) diluído em tampão de lise IP e adicione à placa em triplicado a 25 μL por alvéolo. As concentrações exatas são definidas no protocolo do kit BCA.
- Prepare uma solução de trabalho consistindo na proporção de 50:1 dos reagentes A e B do kit BCA e adicione 200 μL a cada poço contendo amostra, padrão e controle. Proteja as placas da luz e incube a 37 ° C por 30 min (Figura 2K).
- Remova as amostras da incubadora, deixe equilibrar à temperatura ambiente por 5 min e, em seguida, leia a absorbância via leitor de placas a 562 nm (Figura 2L).
| Mistura de reagentes de lise de concentração total de glutationa | |
| Componente | Volume |
| Tampão de lise | 50μL |
| Volume total / poço | 50μL |
| Mistura de reagentes de lise de concentração de glutationa oxidada | |
| Componente | Volume |
| Tampão de lise | 49,5 μL |
| NEM (25mM) | 0,5 μL |
| Volume total / poço | 50μL |
| USE AMBAS AS SOLUÇÕES DENTRO DE 30 MINUTOS APÓS A COMPOSIÇÃO DA MISTURA | |
| Componente da solução de detecção de OPA | Volume |
| OPA 3mg/mL | 5μL |
| PBS (pH 9,0) | 165μL |
| Volume total / poço | 170μL |
Tabela 2: Volumes de reagentes necessários para a realização do protocolo. Volumes necessários por alvéolo para a determinação da glutationa total, dissulfeto de glutationa e reagente de trabalho necessários. Certifique-se de que os volumes necessários sejam calculados e que um excesso seja incluído para contabilizar a perda de volume por meio da transferência.
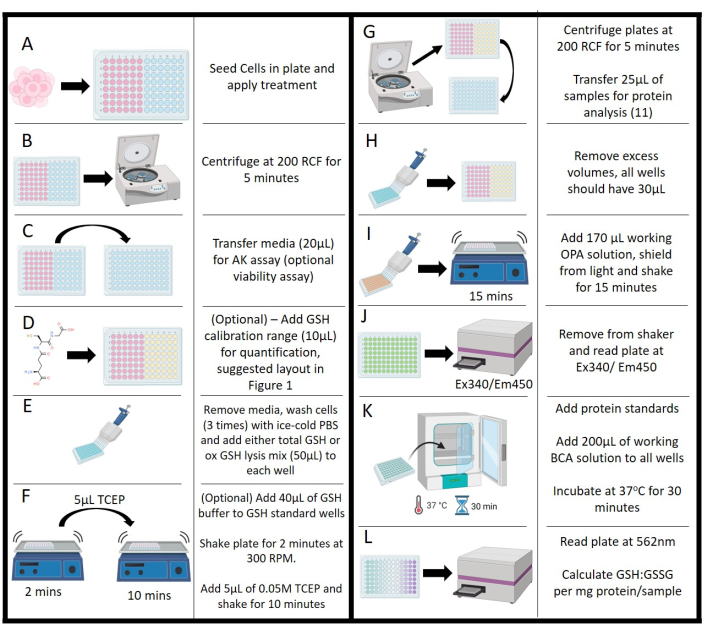
Figura 2: Representação esquemática do protocolo. (A) Semeadura inicial, incubação e tratamento das células. (B) Centrifugação para separar o meio dos sólidos suspensos. (C) Transferência de meio para ensaio de adenilato quinase. (D) Adição de concentrações de glutationa para a faixa de calibração. (E) Estágios de lavagem e adição de reagente de lisagem. (F) Adição de tampão e adição de tris (2-carboxietil) fosfina com passo de agitação. (G) Centrifugação de células lisadas para remoção de meios para análise de proteínas. (H) Remoção de mídia para equalizar o volume em toda a placa. (I) Adição de solução de trabalho orto-ftalaldeído com incubação agitada. (J) Medição da fluorescência do orto-ftalaldeído via leitor de placas. (K) Estágios de incubação para ensaio de ácido bicinconínico para determinação de proteínas. (L) Medição da concentração de proteínas, permitindo a normalização dos valores de glutationa: dissulfeto de glutationa. Clique aqui para ver uma versão maior desta figura.
Representative Results
Seguindo este protocolo, as linhagens celulares A549 e J774 foram semeadas em densidades de 5.000 células/poço e 10.000 células/poço, respectivamente e cultivadas a 37 °C em 5% de CO2 por 48 h. A análise de AK após o tratamento com nanomateriais é mostrada na Tabela Suplementar 1, e a concentração de proteína é mostrada na Tabela Suplementar 2.
Gráfico de calibração
A Figura 3 mostra três calibrações usando a faixa de concentração indicada (concentração final de 0,234 - 30 μM) de três placas separadas de três tipos de células diferentes (embora não deva afetar a calibração) em três dias diferentes e não consecutivos. Enquanto 3 amostras são mostradas, um N de 12 foi observado e demonstrou regressões lineares semelhantes com um valor médio de R2 de 0,9932 ± 0,007.
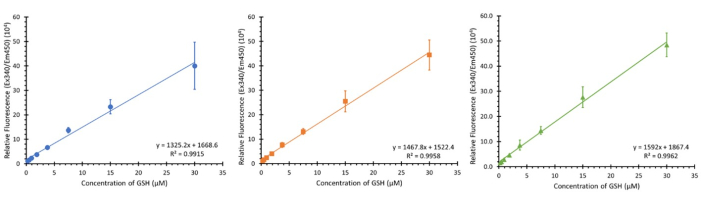
Figura 3: Gráficos de calibração de glutationa para ensaio. Três gráficos de calibração de faixas separadas de calibração de glutationa na placa, cada um realizado com uma semana de intervalo; barras de erro ± SD (n=3, N=12) n=replicados técnicos, N=Replicados biológicos. Clique aqui para ver uma versão maior desta figura.
Resultados de amostra
As células HepG2, A549 e J774 foram utilizadas na avaliação de vários nanomateriais suspeitos de induzir alterações nos mecanismos celulares via estresse oxidativo. Utilizou-se o protocolo de detecção e quantificação descrito.
Os dados recebidos das 3 medições (AK, BCA e GSH/GSSG) foram tratados da seguinte forma. O ensaio AK e BCA foi implementado para normalização; o ensaio AK, usando o kit recomendado, fornecerá os dados mais rápidos e simples para a quantidade de AK liberada no meio celular. Espera-se um aumento nos valores de AK para aumentar a morte celular. Portanto, um controle -ve (Vivo) e +ve (Morto) é necessário. Isso permitirá a normalização com base na porcentagem.
O ensaio BCA é um processo mais longo, mas permitirá que resultados quantificáveis sejam adquiridos por meio da quantificação de proteínas (mg / mL). Isso não requer um controle -ve ou +ve como no AK, mas ainda exigirá um controle -ve geral (células não tratadas) para permitir que a normalização dos valores seja alcançada.
Nesta seção de resultados representativos, verificou-se que o tratamento (nanomateriais) tinha o potencial de causar interferência no ensaio AK. Assim, toda a normalização foi realizada usando os dados do BCA. Portanto, as informações são apresentadas como a concentração das espécies detectadas (GSH ou GSH + GSSG (no entanto, uma subtração da concentração de GSH da concentração total de GSH + GSSG é realizada para obter a concentração de GSSG) por mg / mL de proteína (via ensaio de BCA). Se desejado, isso pode ser convertido em uma proporção para avaliar a mudança no GSH: GSSG do tratamento desejado.
A Figura 4 mostra os dados da razão GSH: GSSG de três linhagens celulares diferentes (A549, J774 e HepG2) adquiridos usando o protocolo OPA e normalizados para expressão de proteínas via BCA (μg / mL), outros dados especificando valores adicionais de GSH e GSSG podem ser encontrados na Figura Suplementar 1.
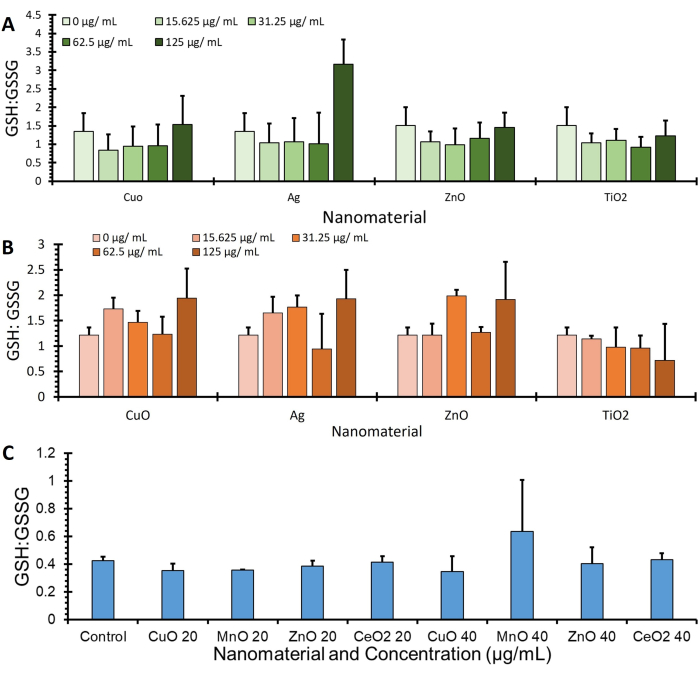
Figura 4: Glutationa: Proporção de dissulfeto de glutationa da realização do ensaio. São mostradas as proporções de glutationa: dissulfeto de glutationa de 3 linhagens celulares, ou seja, (A) A549, (B) J774 e (C) HepG2. As células foram incubadas com tratamentos (vários nanomateriais em meio sem soro) por 4 h. As células foram processadas usando este protocolo para quantificar as alterações na glutationa e no dissulfeto de glutationa e normalizadas por meio de quantificação de proteínas, barras de erro ± SE (n = 3, N = 3) Clique aqui para ver uma versão maior desta figura.
A placa também contém uma série de controles para garantir que o ensaio tenha sido executado corretamente. O NEM é adicionado como um componente individual para demonstrar a falta de interação com o meio de detecção de OPA. O padrão de calibração demonstra um aumento linear com a concentração de GSH, o que demonstra a capacidade efetiva do reagente de detecção de OPA de se ligar efetivamente a concentrações crescentes de GSH.
Deve-se notar que este ensaio visa especificamente grupos sulfidrila livres comumente encontrados em tióis (como GSH, que são comumente considerados antioxidantes). Uma interação potencial é a ligação do OPA aos tióis proteicos, o que resultaria em coleta de dados imprecisa. Portanto, o ensaio de BCA é um estágio crucial para normalizar os dados para proteína e permitir a reflexão precisa do GSH livre.
Figura suplementar 1: Figuras que demonstram glutationa, dissulfeto de glutationa e relação glutationa: dissulfeto de glutationa de 3 linhagens celulares, a saber, (A) A549, (B) J774 e (C) HepG2. As células foram incubadas com tratamentos (vários nanomateriais em meio sem soro) por 4 h. As células foram processadas usando este protocolo para quantificar as alterações na glutationa e no dissulfeto de glutationa e normalizadas por meio de quantificação de proteínas, barras de erro ± SE (n = 3, N = 3) Clique aqui para baixar este arquivo.
Tabela Suplementar 1: Metadados dos valores de adenilato quinase para células A549 e J774. Clique aqui para baixar este arquivo.
Tabela Suplementar 2: Metadados dos valores de ácido bicinconínico com calibração para células A549, J774 e HepG2. Clique aqui para baixar este arquivo.
Discussion
Como afirmado, a necessidade de entender o redox celular, monitorar os estados de estresse oxidativo e a resposta antioxidante sempre foi crucial para entender e prevenir uma miríade de doenças, como câncer e neurodegeneração 33,34. Demonstrado aqui é um meio de melhorar o cenário translacional, aumentando a acessibilidade da detecção precisa de GSH: GSSG com preparação rápida e mínima.
Este protocolo demonstra uma sequência multiparamétrica de ensaios para a determinação de espécies intracelulares de glutationa/tiol (reduzidas e oxidadas), com 2 meios de normalização via ensaio de proteína BCA e/ou ensaio AK. Este ensaio também pode ser modificado para detectar vários outros marcadores através da etapa inicial de extração do mediador e pode ser simplificado de uma maneira que simplesmente forneça uma proporção de tióis oxidados/reduzidos com a exclusão da faixa de calibração.
Ao considerar a avaliação dos analitos, tanto o mBCI quanto o OPA foram explorados e comparados para uso. Embora o mBCl inicialmente tenha demonstrado um bom potencial de sinal, foram descobertas limitações significativas no uso. Primeiramente, o uso de células vivas demonstra o melhor uso de mBCl; no entanto, após a lise celular, o sinal foi extinto e geralmente é diminuído em um formato multipoço em comparação com OPA35. Outra questão é a medição de GSSG via mBCl, a literatura é escassa sobre isso e, por meio da otimização/exploração do protocolo, a detecção precisa de GSSG via mBCl não foi alcançada.
Demonstramos que o ensaio OPA apresenta faixas de calibração significativamente confiáveis, com uma média de R2 de 0,9932 ± 0,007 (N = 12) em uma faixa de concentração de 0,234 - 30 μM de GSH. Essa faixa foi escolhida devido a faixas de referência anteriores encontradas na literatura35. Teoricamente, é possível detectar glutationa fora dessas faixas, mas exigirá modificações na concentração de reagentes, no tempo de incubação e, potencialmente, no equipamento utilizado na detecção. Deve-se notar que cada placa requer sua própria faixa padrão para quantificação; A menor variação no tempo entre as placas realizadas em dias diferentes pode ter um efeito significativo nos valores obtidos durante a medição.
A obtenção de dados precisos e confiáveis deste protocolo depende de várias etapas cruciais serem rigorosamente seguidas. Ao construir os vários tampões necessários no protocolo, é crucial que o pH seja preciso. Portanto, os tampões que requerem um pH de 9 não devem ter desvio além de ± 0,1 desse valor. Isso se deve ao potencial de os componentes do tampão precipitarem da solução no pH errado; Seguir exatamente este protocolo evitará esse problema.
A remoção completa do tratamento e a lavagem precisa antes da lisagem também são essenciais para evitar artefatos e aquisição de dados imprecisos durante o estágio de leitura da placa. Uma vez lisadas as células (etapa 4.8), a remoção do tratamento não é possível e a placa não será recuperável. Devido aos volumes de tampões/reagentes adicionados ao longo do protocolo variando entre amostras e padrões, é fundamental que o usuário esteja ciente dos volumes variados, nas etapas 4.12 e 4.13. O operador do ensaio também é informado desses volumes variados e instruído a garantir que todos os volumes sejam iguais para permitir que uma medição precisa seja alcançada. Como os volumes entre as amostras e os padrões não são visivelmente significativos, pode ser um erro fácil de cometer em relação a ter uma solução em excesso no poço da amostra.
Existem limitações para este protocolo que dependem de etapas cruciais, que são críticas para a aquisição de dados precisos e confiáveis. Os usuários que realizam este ensaio precisam possuir um nível razoável de habilidades laboratoriais para evitar problemas indesejados, como a formação de bolhas. A formação de bolhas tem um impacto drástico tanto na capacidade de ocorrência de reações dentro da microplaca quanto na medição da fluorescência. O agente lisador usado neste protocolo contém um detergente, o que apresenta dificuldade para um pesquisador iniciante que pode ter dificuldade em evitar a formação de bolhas. A centrifugação imediata pode salvar esse erro. O protocolo também é potencialmente limitado em relação ao tipo de célula; As linhagens celulares A549, J774 e HepG2 foram utilizadas para otimizar e produzir dados para este protocolo. Outras linhagens celulares podem exigir diferentes densidades de semeadura e otimização do protocolo para obter dados precisos.
Este protocolo oferece inúmeras vantagens em relação a vários ensaios existentes. Embora a detecção de tióis usando ftalaldeído não seja um conceito novo, a utilização em um formato de ensaio combinado como este, em uma microplaca, com materiais e equipamentos necessários limitados, oferece grande potencial para todos os laboratórios acessarem esse protocolo. A maioria dos kits de tiol / GSH de fornecedores comerciais não divulga a composição de seus reagentes. Portanto, pode ser difícil prever o potencial de incompatibilidades/interferências. Aqui, apresentamos cada componente de todos os reagentes utilizados para limitar esse potencial.
Este protocolo também é realizado rapidamente após a conclusão do período inicial de tratamento. Levando em conta o processamento do usuário entre os estágios de incubação, o aspecto de quantificação de tióis deste protocolo pode ser realizado em menos de 1 h. As amostras são lisadas simultaneamente e ligadas para evitar a auto-oxidação das amostras, o que é ideal para essas espécies de reação. Embora não especificado no protocolo, as amostras podem tecnicamente ser lisadas em uma placa e seladas, permitindo que sejam congeladas para análise futura. No entanto, essa alteração no protocolo não foi explorada.
Disclosures
Os autores declaram não haver conflitos de interesse.
Acknowledgements
Esta pesquisa foi financiada pelos projetos europeus GRACIOUS (GA760840) e SUNSHINE (GA952924). Os autores também gostariam de reconhecer o esforço de todos aqueles que, de alguma forma, ajudaram no desenvolvimento deste protocolo.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22µm filter (optional-For lysis buffer) | Fisher scientific | 12561259 | |
| 100mL volumetric flask | Fisher scientific | 15290866 | |
| 1L Volumetric flask | Fisher scientific | 15230876 | |
| 250mL beaker (optional-For lysis buffer) | Fisher scientific | 15409083 | |
| 8-Channel micropipette (20-200µL) | SLS | FA10011D2 | |
| 8-Channel micropipette (2-20µL) | SLS | B2B06492 | |
| 96 well plates - black with clear bottom, TC treated | Fisher scientific | 10000631 | Preferred plate for seeding and fluoresence, use TC treated clear if unavailable |
| 96 well plates - clear (TC treated and untreated) | Fisher scientific | 10141161 | If black plates with clear bottom is not available/ suitable use TC treated clear |
| 96 well plates - white, Not TC treated | Fisher scientific | 11457009 | |
| A549 (lung carcinoma) cell line | ATCC | CCL-185 | |
| Absolute ethanol | Merck (Sigma-Aldrich) | 1.08543 | |
| Aluminium foil | Fisher scientific | 11779408 | For protecting plates from light |
| BCA Assay Kit | Thermo | 23225 | |
| Benchtop Centrifuge (with 96 plate rotor) | Eppendorf | 5804 | |
| Ethylenediaminetetraacetic acid (EDTA) | Merck (Sigma-Aldrich) | E9884 | |
| Glutathione (GSH) | Merck (Sigma-Aldrich) | G6013 | |
| Glutathione disulfide (GSSG) | Merck (Sigma-Aldrich) | G4501 | |
| Glycerol | Merck (Sigma-Aldrich) | G5516 | |
| HCl, 37% | Merck (Sigma-Aldrich) | 258148 | Dilute to 1mM for GSH stock, pH adjustment also |
| HepG2 (Hepatocarcinoma) cell line | ATCC | HB-8065 | |
| IGEPAL CA-630 | Merck (Sigma-Aldrich) | 18896 | Use either IGEPAL CA-630 or NP-40 for solution, not both |
| IP lysis buffer | Fisher scientific | 11825135 | |
| J774 (monocyte, macrophage) cell line | ATCC | TIB-67 | |
| KCl | Merck (Sigma-Aldrich) | P3911 | |
| KH2PO4 | Merck (Sigma-Aldrich) | P0662 | |
| Micropipette (20-200µL) | SLS | B2B06482 | |
| Micropipette (2-20µL) | SLS | B2B06478 | |
| Microplate shaker | VWR | 444-0041 | |
| Na2HPO4 | Merck (Sigma-Aldrich) | S9763 | |
| NaCl | Merck (Sigma-Aldrich) | S9888 | |
| NaOH, 10M | Merck (Sigma-Aldrich) | 72068 | For pH adjustment only |
| N-Ethylmaleimide (NEM) | Merck (Sigma-Aldrich) | E3876 | |
| NP-40 | Merck (Sigma-Aldrich) | 492016 | Use either IGEPAL CA-630 or NP-40 for solution, not both. NP-40 alternative suggested |
| Ortho -Phthaldialdehyde (OPA) | Merck (Sigma-Aldrich) | P1378 | |
| PBS 0.1M | Merck (Sigma-Aldrich) | P2272 | PBS can either be acquired pre-made or made in house, see notes |
| Plate reader (with fluoresence capacity) | Tecan | SPARK | |
| Stir bar (optional-For lysis buffer) | Fisher scientific | 16265731 | |
| Toxilight bioassay kit (AK assay) | Lonza | LT17-217 | |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP) 0.5M in H2O | Alfa Aesar | H51864 | Can also be purchased crystalised and suspended |
| TRIS-HCl | Merck (Sigma-Aldrich) | 93363 | |
| X100 phosphatase and protease cocktail | Fisher scientific | 10025743 |
References
- Barnham, K. J., Masters, C. L., Bush, A. I. Neurodegenerative diseases and oxidative stress. Nat Rev Drug Discov. 3 (3), 205-214 (2004).
- Arfin, S., et al. Oxidative stress in cancer cell metabolism. Antioxidants. 10 (5), 642 (2021).
- Cooke, M. S., Evans, M. D., Dizdaroglu, M., Lunec, J. Oxidative DNA damage: mechanisms, mutation, and disease. The FASEB Journal. 17 (10), 1195-1214 (2003).
- Ghezzi, P., Jaquet, V., Marcucci, F., Schmidt, H. H. H. W. The oxidative stress theory of disease: levels of evidence and epistemological aspects. Br J Pharmacol. 174 (12), 1784-1796 (2017).
- Bhattacharyya, A., Chattopadhyay, R., Mitra, S., Crowe, S. E. Oxidative stress: An essential factor in the pathogenesis of gastrointestinal mucosal diseases. Physiol Rev. 94 (2), 329-354 (2014).
- Yin, F., Sancheti, H., Cadenas, E. Mitochondrial thiols in the regulation of cell death pathways. Antioxi Redox Sig. 17 (12), 1714-1727 (2012).
- Balcerczyk, A., Bartosz, G. Thiols are main determinants of total antioxidant capacity of cellular homogenates. Free Rad Res. 37 (5), 537-541 (2003).
- McBean, G. J. Cysteine, glutathione, and thiol redox balance in astrocytes. Antioxidants. 6 (3), 62 (2017).
- Nimse, S. B., Pal, D. Free radicals, natural antioxidants, and their reaction mechanisms. RSC Adv. 5 (35), 27986-28006 (2015).
- Nordberg, J., Arnér, E. S. J. Reactive oxygen species, antioxidants, and the mammalian thioredoxin system1. Free Rad Biol Med. 31 (11), 1287-1312 (2001).
- Pham-Huy, L. A., He, H., Pham-Huy, C. Free radicals, antioxidants in disease and health. Int J Biomed Sci. 4 (2), 89 (2008).
- Harris, I. S., DeNicola, G. M. The complex interplay between antioxidants and ROS in cancer. Trend Cell Biol. 30 (6), 440-451 (2020).
- Traverso, N., et al. Role of glutathione in cancer progression and chemoresistance. Oxid Med Cell Longev. 2013, 972913 (2013).
- Day, R. M., Suzuki, Y. J. Cell proliferation, reactive oxygen and cellular glutathione. Dose-Resp. 3 (3), 425-442 (2005).
- Aquilano, K., Baldelli, S., Ciriolo, M. R. Glutathione: new roles in redox signaling for an old antioxidant. Front Pharmacol. 5, 196 (2014).
- Zitka, O., et al. Redox status expressed as GSH: GSSG ratio as a marker for oxidative stress in paediatric tumour patients. Onco Lett. 4 (6), 1247-1253 (2012).
- Childs, S., Haroune, N., Williams, L., Gronow, M. Determination of cellular glutathione: glutathione disulfide ratio in prostate cancer cells by high performance liquid chromatography with electrochemical detection. J Chrom A. 1437, 67-73 (2016).
- Giustarini, D., et al. glutathione disulfide, and S-glutathionylated proteins in cell cultures. Free Rad Biol Med. 89, 972-981 (2015).
- Özyürek, M., et al. Determination of biothiols by a novel on-line HPLC-DTNB assay with post-column detection. Analytica Chimica Acta. 750, 173-181 (2012).
- Zhang, L., Lu, B., Lu, C., Lin, J. Determination of cysteine, homocysteine, cystine, and homocystine in biological fluids by HPLC using fluorosurfactant-capped gold nanoparticles as postcolumn colorimetric reagents. J Sep Sci. 37 (1-2), 30-36 (2014).
- Tsiasioti, A., Georgiadou, E., Zacharis, C. K., Tzanavaras, P. D. Development and validation of a direct HPLC method for the determination of salivary glutathione disulphide using a core shell column and post column derivatization with o-phthalaldehyde. J Chromat B. 1197, 123216 (2022).
- Huang, D., Ou, B., Prior, R. L. The chemistry behind antioxidant capacity assays. J Agri Food Chem. 53 (6), 1841-1856 (2005).
- Berker, K. I., Güçlü, K., Tor, &. #. 3. 0. 4. ;., Demirata, B., Apak, R. Total antioxidant capacity assay using optimized ferricyanide/prussian blue method. Food Anal Meth. 3 (3), 154-168 (2010).
- Rahman, I., Kode, A., Biswas, S. K. Assay for quantitative determination of glutathione and glutathione disulfide levels using enzymatic recycling method. Nat Prot. 1 (6), 3159-3165 (2007).
- Kampa, M., et al. A new automated method for the determination of the Total Antioxidant Capacity (TAC) of human plasma, based on the crocin bleaching assay. BMC Clin Pathol. 2 (1), 3 (2002).
- Fernández-Checa, J. C., Kaplowitz, N. The use of monochlorobimane to determine hepatic GSH levels and synthesis. Anal Biochem. 190 (2), 212-219 (1990).
- Nauen, R., Stumpf, N. Fluorometric microplate assay to measure glutathione S-transferase activity in insects and mites using monochlorobimane. Anal Biochem. 303 (2), 194-198 (2002).
- Stevenson, D., Wokosin, D., Girkin, J., Grant, M. H. Measurement of the intracellular distribution of reduced glutathione in cultured rat hepatocytes using monochlorobimane and confocal laser scanning microscopy. Toxicol in vitro. 16 (5), 609-619 (2002).
- McBeth, C., Stott-Marshall, R. J. Interference of reversible redox compounds in enzyme catalysed assays–Electrochemical limitations. Anal Biochem. 662, 114972 (2023).
- Yu, Z., et al. Reactive oxygen species-related nanoparticle toxicity in the biomedical field. Nanoscale Res Lett. 15 (1), 115 (2020).
- Boyles, M., et al. Development of a standard operating procedure for the DCFH2-DA acellular assessment of reactive oxygen species produced by nanomaterials. Toxicol Mech Meth. 32 (6), 439-452 (2022).
- Segeritz, C. P., Vallier, L. Cell culture: Growing cells as model systems in vitro. Basic Sci Meth Clin Res. , 151-172 (2017).
- Ma, Q. Role of nrf2 in oxidative stress and toxicity. Ann Rev Pharmacol Toxicol. 53, 401-426 (2013).
- Calabrese, V., Cornelius, C., Dinkova-Kostova, A. T., Calabrese, E. J., Mattson, M. P. Cellular stress responses, the hormesis paradigm, and vitagenes: novel targets for therapeutic intervention in neurodegenerative disorders. Antioxid redox Signal. 13 (11), 1763-1811 (2010).
- Ishkaeva, R. A., Zoughaib, M., Laikov, A. V., Angelova, P. R., Abdullin, T. I. Probing cell redox state and glutathione-modulating factors using a monochlorobimane-based microplate assay. Antioxidants. 11 (2), 391 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved