Быстрое количественное определение окисленных и восстановленных форм глутатиона с использованием орто-фтальдегида в культивируемых клетках млекопитающих in vitro
In This Article
Summary
Количественное определение как окисленных, так и восстановленных форм глутатиона (GSSG и GSH соответственно) было достигнуто за счет использования ортофтальдегида (OPA). OPA становится высокофлуоресцентным после конъюгации с GSH, но не может конъюгировать GSSG до тех пор, пока не восстановится. Здесь мы описываем многопараметрический анализ для количественной оценки обоих с использованием количественного определения белка для нормализации.
Abstract
Глутатион долгое время считался ключевым биомаркером для определения антиоксидантного ответа клетки. Следовательно, он является основным маркером для исследований активных форм кислорода. В методе используется орто-фтальдегид (ОФА) для количественного определения клеточной концентрации глутатиона (глутатионов). OPA конъюгирует с восстановленным глутатионом (GSH) через сульфгидрильное связывание с последующим образованием изоиндола, в результате чего получается высокофлуоресцентный конъюгат. Для получения точного результата как окисленного глутатиона (GSSG), так и GSH требуется комбинация маскирующих и восстановительных агентов, которые были реализованы в этом протоколе. Лечение также может повлиять на жизнеспособность клеток. Следовательно, нормализация с помощью анализа белка представлена в этом многопараметрическом анализе. Анализ демонстрирует псевдолинейный диапазон обнаружения 0,234 - 30μМ (R2=0,9932±0,007 (N=12)), специфичный для ГСГ. Предложенный анализ также позволяет определить окисленный глутатион с добавлением маскирующего агента N-этилмалеимида для связывания восстановленного глутатиона, а восстановитель трис(2-карбоксиэтил) фосфин вводится для расщепления дисульфидной связи в GSSG с образованием двух молекул GSH. Анализ используется в сочетании с валидированным анализом бицинхониновой кислоты для количественного определения белка и анализом аденилаткиназы для оценки цитотоксичности.
Introduction
Активные формы кислорода (АФК) являются основным индуктором окислительного стресса; Окислительный стресс хорошо известен в образовании мутаций ДНК, клеточном старении/смерти, различных видах рака, диабете, неврологических заболеваниях (таких как болезнь Паркинсона и Альцгеймера) и некоторых других изнурительных для жизни состояниях 1,2,3,4,5. Ключевой защитой от АФК являются тиолические, неферментативные антиоксиданты, которые способны восстанавливать окислители или радикалы, действуя как доноры протонов 6,7. Глутатион (GSH) и цистеин являются двумя наиболее распространенными тиолами, обнаруженными у млекопитающих8, в то время как существуют различные другие низкомолекулярные тиолы (такие как эрготионеин), GSH и цистеин являются наиболее часто измеряемыми неферментативными антиоксидантами, обнаруженными в литературе 9,10,11 и имеют наибольшее значение для борьбы с АФК 8,12,13,14.
Когда GSH используется в качестве антиоксиданта, две молекулы GSH ковалентно связываются друг с другом через дисульфидную связь с образованием дисульфида глутатиона (GSSG). Истощение GSH часто используется в качестве индикатора окислительного стресса15,16. Эта оценка также может быть объединена с обнаружением GSSG, хотя увеличение GSSG в клетках часто ограничено активными процессами экспорта, поскольку GSSG может быть относительно реакционноспособным в клетках, что приводит к образованию дисульфидных связей с другими белотеолами16.
Традиционные методы измерения GSH и GSSG не являются простыми процессами и требуют многочисленных этапов, включая клеточную экстракцию с использованием литических реагентов17,18. Описанный здесь протокол упрощает эти методы и позволяет точно измерять неферментативные тиолы и нормализовать их с использованием содержания клеточного белка или высвобождения аденилаткиназы. Кроме того, можно измерить жизнеспособность клеток до экстракции GSH/GSSG. В нескольких методах ранее предпринимались попытки нацелить и количественно определить восстановленные и окисленные неферментативные тиолы; методы, включающие использование ВЭЖХ 19,20,21, планшетный анализ (биохимический)22,23,24,25, и в которых используются обычные реагенты для конъюгации тиола, такие как 5,5-дитио-бис-(2-нитробензойная кислота) (DTNB/реагент Эллмана)19, монохлорбиман (mBCI)26,27,28. Несколько компаний также подготовили собственные наборы для обнаружения глутатиона; Тем не менее, они не публикуют несовместимость реагентов, что создает проблемы, зависящие от используемых методов лечения29.
Этот протокол описывает многопараметрический анализ, который обнаруживает восстановленные тиолы (такие как GSH) с помощью конъюгации ортофтальдегида (OPA) для получения флуоресцентного сигнала, обнаруживаемого при 340/450 Ex/Em, соответственно. Этот анализ облегчает одновременное обнаружение GSH и GSSG (в планшете) за счет использования маскирующих агентов (N-этилмалеимида) и восстановителей GSSG (трис(2-карбоксиэтил)фосфин). Этот протокол с использованием нескольких биомаркеров также дает возможность на этапе клеточного лизиса количественно определить белки с помощью анализа бицинхониновой кислоты для нормализации образцов по завершении окончательного измерения или с помощью анализа аденилаткиназы из клеточной среды. Этот анализ может быть выполнен с использованием нескольких реагентов, легко доступных в большинстве лабораторий, и для его выполнения требуется всего несколько дополнительных необычных химических веществ. Процесс прост, доступен и может быть выполнен без трудоемких этапов менее чем за 2 часа.
В этом протоколе были выбраны различные наноматериалы, которые, как было показано ранее, либо предположительно индуцируют окислительный стресс 30,31. Был исследован диапазон концентраций, чтобы увидеть влияние воздействия этих наноматериалов на различные клеточные линии и эффективность анализа в количественном определении антиоксидантных тиолов.
Protocol
ПРИМЕЧАНИЕ: Следующий протокол был разработан с возможностью использования в сочетании с анализом белка бицинхониновой кислоты (БЦА) и анализом аденилаткиназы (АК) для нормализации образцов к лечению. Убедитесь, что оператор одет в соответствующую одежду и использует необходимое защитное оборудование, такое как лабораторный халат Howie, нитриловые перчатки и защитные очки класса I, во время подготовки и использования материалов. Протокол делится на несколько этапов.
1. Заготовка и подготовка рабочих растворов
- Готовят исходные растворы стандарта 100 мМ ГШ в 1 мМ HCl (получают из 37% HCl в воде двойной дистиллированной (ddH2O)).
ПРИМЕЧАНИЕ: При разбавлении высококонцентрированной кислотой, такой как 37% HCl, убедитесь в правильности процесса добавления кислоты в воду в вытяжном шкафу класса I. - Приготовьте запас 22,35 мМ ОПА в абсолютном этаноле. Выполните этот шаг в вытяжном шкафу класса I. Приготовьте 25 мМ N-этилмалеимида (NEM) в ddH2O. Выполните этот этап в вытяжном шкафу класса I.
ПРИМЕЧАНИЕ: Эти три раствора можно хранить при температуре -20 °C до 3 месяцев. - Готовят 0,01 М Трис(2-карбоксиэтил)фосфина (ТЦЭП) до общего объема 500 мкл, необходимого для 100 лунок. Приготовьте 100 мкл 1 мМ стандарта GSH, разведенный из 100 мМ заготовки с использованием ddH2O.
- Используйте либо буфер для лизиса иммунопреципитации (IP), либо следующую формулу: 394 мг Tris-HCl (конечная концентрация 25 мМ), 877 мг NaCl (конечная концентрация 150 мМ), 29 мг ЭДТА (конечная концентрация 1 мМ), либо 1 мл 100% NP-40 или IGEPAL CA-630 (конечная концентрация 1% V/V), 5 мл глицерина (конечная концентрация 5% V/V), 84 мл ddH2O. Смешайте компоненты путем осторожного перемешивания и отрегулируйте pH до 7,4. Сцедите в мерную колбу объемом 100 мл и добавьте оставшийся объем ddH2O до получения конечного объема 100 мл. Стерильно отфильтровать через фильтр 0,22 мкм и хранить при температуре 2-8 °C до 6 месяцев.
ПРИМЕЧАНИЕ: Лизирующие растворы действуют как загрязнитель/интерферент в этом анализе; Следовательно, приведенные выше формулировки конкретизированы. - Приготовьте 1 л 0,1 М фосфатно-буферного физиологического раствора с добавлением этилендиамина тетрауксусной кислоты (PBS-EDTA) при 3 различных значениях pH, а именно 7,2, 8,5 и 9,0. Используйте коммерческий буфер 0,1 М PBS с добавлением 1 мМ ЭДТА (292,24 мг/л) или следующую 10-кратную (1 л) формулу: 80 г NaCl, 2,0 г KCl, 14,4 г Na2HPO4, 2,4 г KH2PO4, 800 мл ddH2O. Добавьте и перемешайте; долить до 1 л. Автоклав раствор на стерильность и хранить его в течение 12 месяцев при комнатной температуре. Из 10-кратного исходного раствора сделайте рабочий раствор PBS и дополните его ЭДТА (концентрация, как указано ранее).
ПРИМЕЧАНИЕ: pH имеет решающее значение; Убедитесь, что pH точен перед началом протокола. - Выполняйте последовательное разведение 1:2 1 мМ GSH с использованием ddH2O (1 мМ, 500 мкМ, 250 мкМ, 125 мкМ, 62,5 мкМ, 31,25 мкМ, 15,625 мкМ и 7,8125 мкМ). Добавляйте по 10 мкл каждой концентрации в стандартные лунки (выполняется в двух экземплярах). Образцы будут дополнительно разбавлены в буфере для лизиса; следовательно, концентрации будут составлять 1/5 от их первоначальной концентрации впоследствии (200, 100, 50, 25, 12,5, 6,25, 3,125, 1,5625 мкМ).
ПРИМЕЧАНИЕ: Конечные концентрации для калибровки будут составлять 30 мкм, 15 мкм, 7,5 мкм, 3,75 мкм, 1,875 мкм, 937,5 нм, 468,8 нм и 234,4 нм.
2. Подготовка к анализу
Примечание: В этом протоколе используются человеческие клеточные линии HepG2, A549 и J774, которые были приобретены на коммерческой основе у ATCC. Эти клеточные линии были использованы в соответствии с утвержденными руководящими принципами, изложенными в законах о культурах животных и тканей и правилах университета.
- За 24 ч до начала анализа затравочные клетки в концентрациях, указанных в таблице 1; Однако, в зависимости от клеточной линии/типа и используемого лечения, при необходимости регулируйте плотность. Выращивайте клетки в полной питательной среде (модифицированная эфирная среда Eagles (EMEM) с 10% инактивированной теплом эмбриональной сыворотки теленка (HIFS), 1% пенстрепа (10 000 ЕД/мл пенициллина / 10 мг/мл стрептомицина) и 1% заменимых аминокислот.
- Семенные клетки с использованием традиционных методов посева клеток32. Затравливайте клетки в полностью черных пластинах, если не использовать пост-анализную микроскопию. Оцените слияние клеток и общее состояние здоровья в колбе T75 перед использованием с помощью микроскопии.
- В чистом, стерильном шкафу биологической безопасности класса II и в соответствии со строгой асептической техникой выбросьте клеточные среды, аккуратно промойте клетки ~15 мл стерильного PBS при комнатной температуре (RT) и выбросьте.
- В клеточную колбу добавьте 5 мл стерильного трипсина 1x, осторожно покачивайте, чтобы обеспечить покрытие монослоя клетки, и поместите в инкубатор при температуре 37 °C на 5 минут, чтобы облегчить отделение клеток.
- Прекращают трипсинизацию добавлением питательной среды, содержащей инактивированную теплом сыворотку плода телят (10%), примерно 10 мл.
- Перенесите ячейки в центрифужную пробирку объемом 50 мл и гранулируйте при плотности 200 x g в течение 5 минут. Выбросьте носитель и замените его 5 мл того же носителя. Ресуспендируйте клетки в пробирке до тех пор, пока они не станут однородными и не будет наблюдаться комкования.
- Удалите 20 мкл клеточной суспензии и поместите в гемоцитометр для подсчета. После того, как количество необходимых клеток было рассчитано, выполните разведение для получения раствора с правильной плотностью клеток.
- Фильтрующий материал для пипетки, содержащий элементы в 96-луночных планшетах (емкостью 350 μл), с максимальным объемом 200 μл на лунку. Поместите клетки в инкубатор с температурой 37 °C с 5%CO2 на 24 часа, чтобы они прилипли к поверхности планшета.
- Чтобы оценить как общий глутатион, так и GSSG, обработайте образцы для обоих состояний. Засейте и обработайте 6 лунок, чтобы получить по 2 комплекта GSH и GSSG с 3 техническими повторами (на рисунке 1 показана схема).
- Убедитесь, что все реагенты надлежащим образом подготовлены до начала анализа; Убедитесь, что все буферные компоненты и реагенты находятся в состоянии RT перед началом создания буферов или использования в анализе, за исключением pH 7,4 PBS (без ЭДТА), который следует хранить на льду / охлаждать до использования.
ПРИМЕЧАНИЕ: Крайне важно, чтобы образование пузырьков было сведено к минимуму, чтобы обеспечить желаемые реакции в анализе и обеспечить точное количественное определение с помощью планшетного ридера.
| Клеточная линия | Плотность засева (96-луночная пластина) |
| ГепГ2 | 10 000 ячеек / скважина |
| А549 | 5 000 ячеек / скважина |
| Дж774 | 10 000 ячеек / скважина |
Таблица 1: Рекомендуемые плотности посева для выбранных клеточных линий. Продемонстрированы различные плотности затравки для трех различных клеточных линий, используемых в представленных данных, а именно A549, J774 и HepG2.
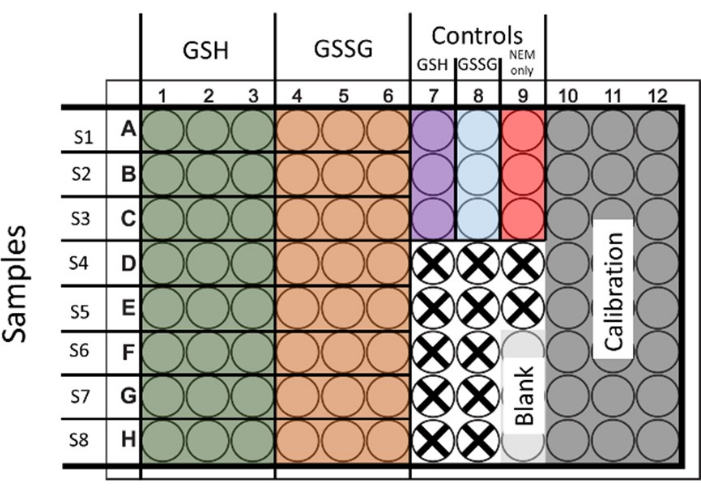
Рисунок 1: Предлагаемая схема засева 96 луночных планшетов для одновременного определения общего глутатиона и дисульфида глутатиона. Также демонстрируются скважины для калибровки и контроля. Скважины, которые не используются, представлены крестом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
3. Обработка наноматериалами
- Взвешивайте наноматериалы (в частности, ZnO, TiO2, CuO и Ag) на весах, способных измерять мкг. Выполните расчет для достижения начальной концентрации 1 мг/мл на наноматериал.
- Перенесите растворы наноматериалов на ультразвуковой аппарат и обрабатывайте ультразвуком в течение 16 минут с помощью ультразвуковой ванны (38 Вт) для получения однородного раствора. Сделайте серию разведений для каждого наноматериала при концентрации 125, 62,5, 31,25, 15,625 мкг/мл.
- Извлеките клетки из инкубатора и слегка промойте с помощью RT PBS. Убедившись, что все PBS удалены, добавьте 100 μл обработок в планшет с контролем (питательные среды без HIFS). После обработки клеток инкубировать с наноматериалами в инкубаторе при температуре 37°C (5%CO2) в течение 4 ч; после этого используйте приведенный ниже протокол для количественной оценки GSH: GSSG, концентрации белка и высвобождения AK.
4. Протокол пробирного анализа
- После воздействия лечения (Рисунок 2A) оцените жизнеспособность с помощью активности аденилаткиназы (AK) (по желанию). Используйте коммерческий набор для этого анализа, следуя инструкциям производителя.
- Вращайте планшеты в центрифуге при давлении 200 x g в течение 5 минут для легкой обработки гранул и клеточного мусора (Рисунок 2B).
- Аккуратно удалите 20 мкл надосадочной жидкости из каждого образца и контрольной лунки (как указано выше) и поместите пипетку в соседнюю 96-луночную белую пластину в том же формате компоновки (рис. 2C).
- Добавьте в каждую лунку по 100 мкл рабочего раствора из набора АК, защитите пластину от света и оставьте на 10 минут для проявления при комнатной температуре. Запишите люминесценцию с помощью планшетного ридера со скоростью 1000 отсчетов/с.
- Для стандартов GSH добавьте 40 мкл общего буфера глутатиона в каждую лунку (рис. 2D; необязательно, требуется для количественного определения).
- Отсадите остатки среды с пластины и промойте 3 раза ледяным 0,1 М PBS, pH 7,2, отбрасывая каждую промывку (рис. 2E), за исключением стандартных. Оставьте окончательную промывку в пластине до тех пор, пока в пластину не будет загружена калибровочная система GSH.
- Добавьте по 10 мкл каждой концентрации глутатиона и болванку (ddH2O) в лунки в трех экземплярах.
- Удалите окончательную промывку PBS и добавьте смеси в каждую лунку, как показано в таблице 2, для количественного определения желаемой цели (рисунок 2E). Рассчитайте необходимые объемы до начала этого шага из-за чувствительных ко времени потерь активности с помощью полных буферов. Убедитесь, что эти смеси реагентов изготовлены перед началом процесса анализа, но не оставляйте их более чем на 30 минут перед использованием.
- Поместите на орбитальный встряхиватель и дайте пластине встряхнуть со скоростью 300 об/мин в течение 2 минут (рисунок 2F).
- Выньте из шейкера и добавьте 5 мкл 0,01М раствора TCEP в каждую лунку, исключая контрольную лунку NEM. Верните тарелку в шейкер и выдерживайте в течение 10 минут (рисунок 2F).
- Переложите планшет в центрифугу и вращайте при давлении 200 x g в течение 5 минут. Переложите 25 мкл из каждой лунки для отбора проб в другую 96-луночную лунку (прозрачную); Это будет использовано для концентрации белка (см. шаг 4.15; Рисунок 2G). Не передавайте стандарты или контрольные анализы.
- Убедитесь, что конечный объем для каждой лунки составляет 30 μл; удалить громкость из элементов управления и стандартов в соответствии с этим требованием (рис. 2H).
- Добавьте в каждую лунку по 170 мкл рабочего раствора OPA, защитите пластину от света и поставьте на шейкер на 15 мин (рис. 2I).
- Считывание флуоресценции с помощью считывателя пластин в точке Ex340/Em450 (рис. 2J). Убедитесь, что на этапе измерения нет пузырьков; Они окажут пагубное влияние как на реакцию, так и на количественное определение с помощью считывателя планшетов.
- Чтобы количественно оценить содержание белка в лизированных клетках, используйте коммерческий набор для анализа BCA. Переложите пробы, взятые с шага 4.12, на новый 96-луночный планшет (прозрачный) с концентрацией 25 мкл на лунку.
- Используйте стандартный бычий сывороточный альбумин (БСА), разведенный в буфере для лизиса IP и добавьте в планшет в трех экземплярах в дозе 25 мкл на лунку. Точные концентрации определены в протоколе набора BCA.
- Приготовьте рабочий раствор, состоящий из реагентов А и В в соотношении 50:1 из набора ВСА и добавьте по 200 мкл в каждую лунку, содержащую образец, эталон и контроль. Защитите планшеты от света и выдерживайте при температуре 37°C в течение 30 минут (рис. 2K).
- Извлеките образцы из инкубатора, дайте сбалансироваться при комнатной температуре в течение 5 минут, затем считайте абсорбцию с помощью планшетного ридера на длине волны 562 нм (рис. 2L).
| Смесь реагентов для лизиса общей концентрации глутатиона | |
| Компонент | Том |
| Буфер для лизиса | 50 мкл |
| Общий объем / скважина | 50 мкл |
| Смесь реагентов для лизиса обогащенного глутатиона | |
| Компонент | Том |
| Буфер для лизиса | 49,5μл |
| NEM (25 мМ) | 0,5 мкл |
| Общий объем / скважина | 50 мкл |
| ИСПОЛЬЗУЙТЕ ОБА РАСТВОРА В ТЕЧЕНИЕ 30 МИНУТ ПОСЛЕ СОСТАВЛЕНИЯ СМЕСИ | |
| Компонент решения для обнаружения OPA | Том |
| ОПА 3 мг/мл | 5μл |
| PBS (pH 9,0) | 165 мкл |
| Общий объем / скважина | 170 мкл |
Таблица 2: Необходимые объемы реагентов для выполнения протокола. Требуемые объемы на лунку для определения общего глутатиона, дисульфида глутатиона и рабочего реагента. Убедитесь, что необходимые объемы рассчитаны и учтен излишек для учета потери объема при переносе.
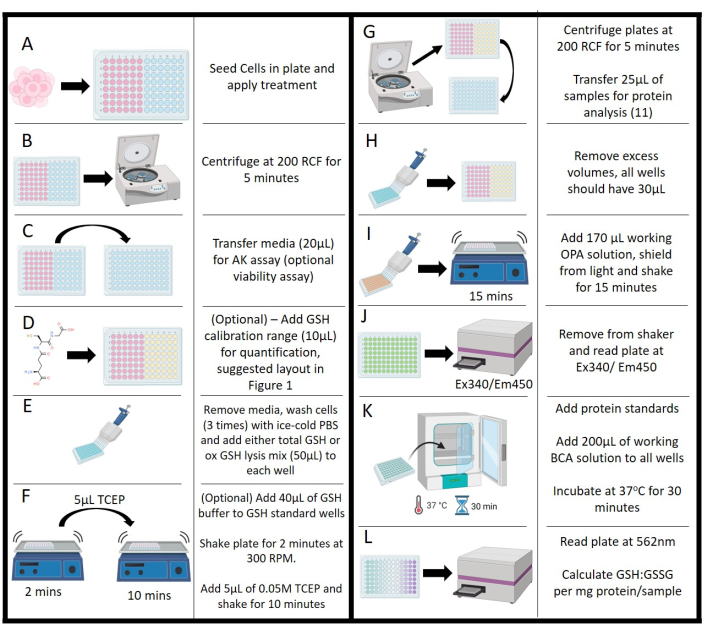
Рисунок 2: Схематическое изображение протокола. (A) Начальный посев, инкубация и обработка клеток. (В) Центрифугирование для отделения сред от взвешенных твердых частиц. (C) Перенос среды для анализа на аденилаткиназу. (D) Добавление концентраций глутатиона для калибровочного диапазона. (E) Стадии промывки и добавление лизирующего реагента. (F) Добавление буфера и добавление трис(2-карбоксиэтил)фосфина со стадией встряхивания. (G) Центрифугирование лизированных клеток для удаления сред для анализа белка. (H) Удаление среды для выравнивания объема по всей пластине. (I) Добавление орто-фталалдегидного рабочего раствора с инкубацией встряхиванием. (J) Измерение флуоресценции орто-фтальдегида с помощью планшетного ридера. (K) Инкубационные стадии для анализа бицинхониновой кислоты для определения белка. (L) Измерение концентрации белка, позволяющее нормализовать значения глутатиона: дисульфида глутатиона. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Representative Results
В соответствии с этим протоколом клеточные линии A549 и J774 высевали при плотностях 5000 клеток/лунку и 10000 клеток/лунку соответственно и культивировали при 37°С в 5%CO2 в течение 48 ч. Анализ АК после обработки наноматериалами приведен в дополнительной таблице 1, а концентрация белка — в дополнительной таблице 2.
График калибровки
На рисунке 3 показаны три калибровки с использованием указанного диапазона концентраций (конечная концентрация 0,234 - 30 мкМ) на трех отдельных планшетах из трех разных типов клеток (хотя это не должно влиять на калибровку) в течение трех разных, не идущих подряд, дней. В то время как показаны 3 выборки, наблюдался N, равный 12, и были продемонстрированы аналогичные линейные регрессии со средним значением R2 0,9932 ± 0,007.
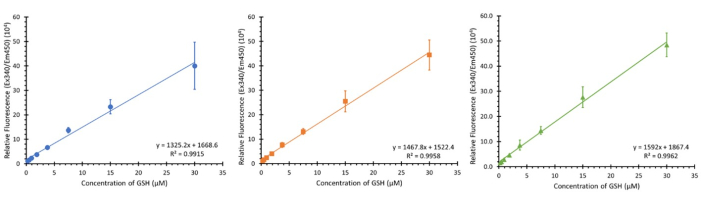
Рисунок 3: Калибровочные графики глутатиона для анализа. Три калибровочных графика из отдельных диапазонов калибровки глутатиона в планшете, каждый из которых выполняется с интервалом в неделю; погрешности ± SD (n=3, N=12) n=технические репликации, N=биологические репликации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Примеры результатов
Клетки HepG2, A549 и J774 были использованы для оценки различных наноматериалов, подозреваемых в том, что они вызывают изменения в клеточных механизмах посредством окислительного стресса. Был использован описанный протокол обнаружения и количественной оценки.
Данные, полученные в результате 3 измерений (AK, BCA и GSH/GSSG), обрабатывались следующим образом. Для нормализации был проведен анализ AK и BCA; Анализ АК, используя рекомендованный набор, даст самые быстрые и простые данные о количестве АК, высвобождаемых в клеточные среды. Ожидается увеличение значений AK для увеличения гибели клеток. Следовательно, требуется управление -ve (Alive) и +ve (Dead). Это позволит провести нормализацию на основе процентов.
Анализ BCA является более длительным процессом, но позволяет получить количественные результаты с помощью количественного определения белка (мг/мл). Для этого не требуется элемент управления -ve или +ve, как в AK, но по-прежнему требуется общий элемент управления -ve (необработанные ячейки) для достижения нормализации значений.
В этом репрезентативном разделе результатов было обнаружено, что обработка (наноматериалы) потенциально может вызывать помехи в анализе AK. Следовательно, вся нормализация проводилась с использованием данных BCA. Таким образом, информация представляется в виде концентрации обнаруженных веществ (GSH или GSH+GSSG (однако для получения концентрации GSSG выполняется вычитание концентрации GSH из общей концентрации GSH+GSSG) на мг/мл белка (с помощью анализа BCA). При желании его можно преобразовать в соотношение для оценки изменения GSH:GSSG от желаемого лечения.
На рисунке 4 представлены данные о соотношении GSH: GSSG из трех различных клеточных линий (A549, J774 и HepG2), полученные с использованием протокола OPA и нормализованные до экспрессии белка через BCA (μг/мл), дополнительные данные, определяющие дополнительные значения GSH и GSSG, можно найти на дополнительном рисунке 1.
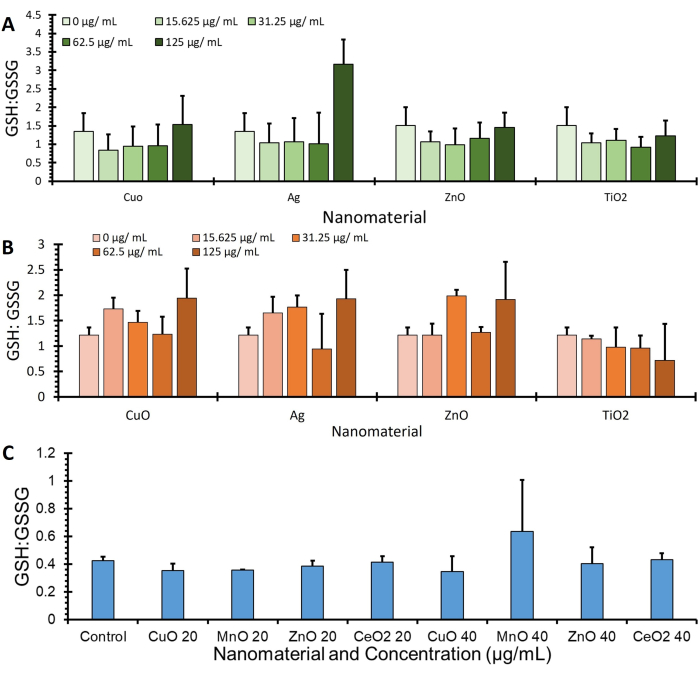
Иллюстрация 4: Глутатион: соотношение дисульфидов глутатиона при проведении анализа. Показаны соотношения глутатиона: дисульфида глутатиона 3 клеточных линий, а именно (A) A549, (B) J774 и (C) HepG2. Клетки инкубировали с помощью обработок (различные наноматериалы в бессывороточных средах) в течение 4 ч. Клетки обрабатывали с использованием этого протокола для количественной оценки изменений глутатиона и глутатиона дисульфида и нормализовали с помощью количественного определения белка, погрешности ± SE (n=3, N=3) Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Пластина также содержит ряд элементов управления, чтобы убедиться, что анализ выполнен правильно. NEM добавляется в качестве отдельного компонента для демонстрации отсутствия взаимодействия со средой обнаружения OPA. Калибровочный стандарт демонстрирует линейное увеличение концентрации GSH, что демонстрирует эффективную способность реагента для детектирования OPA эффективно связываться с возрастающими концентрациями GSH.
Следует отметить, что этот анализ специально нацелен на свободные сульфгидрильные группы, обычно содержащиеся в тиолах (такие как GSH, которые обычно считаются антиоксидантами). Одним из потенциальных взаимодействий является связывание OPA с тиолами белка, что может привести к неточному сбору данных. Следовательно, анализ BCA является важным этапом для нормализации данных по белку и обеспечения точного отражения свободного GSH.
Дополнительный рисунок 1: Рисунки, демонстрирующие глутатион, глутатион дисульфид и глутатион: соотношение глутатиона дисульфида из 3 клеточных линий, а именно: (A) A549, (B) J774 и (C) HepG2. Клетки инкубировали с помощью обработок (различные наноматериалы в бессывороточных средах) в течение 4 ч. Клетки обрабатывали с использованием этого протокола для количественной оценки изменений глутатиона и глутатиона дисульфида и нормализовали с помощью количественного определения белка, погрешности ± SE (n=3, N=3) Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительная таблица 1: Метаданные значений аденилаткиназы для клеток A549 и J774. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительная таблица 2: Метаданные значений бицинхониновой кислоты с калибровкой для клеток A549, J774 и HepG2. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Discussion
Как уже говорилось, необходимость понимания клеточного окислительно-восстановительного потенциала, мониторинга состояний окислительного стресса и антиоксидантной реакции всегда имела решающее значение для понимания и профилактики множества заболеваний, таких как рак и нейродегенерация. Здесь продемонстрированы средства для улучшения трансляционного ландшафта за счет повышения доступности точного определения GSH: GSSG с быстрой и минимальной подготовкой.
Данный протокол демонстрирует многопараметрическую последовательность анализов для определения внутриклеточных форм глутатиона/тиола (восстановленных и окисленных) с 2 способами нормализации с помощью анализа белка BCA и/или анализа AK. Этот анализ также может быть модифицирован для обнаружения различных других маркеров на начальной стадии экстракции медиатора и может быть упрощен таким образом, чтобы просто получить соотношение окисленного/восстановленного тиола с исключением калибровочного диапазона.
При рассмотрении вопроса об оценке аналитов были изучены и сравнены как mBCI, так и OPA для использования. Хотя mBCl первоначально продемонстрировал хороший потенциал сигнала, были обнаружены значительные ограничения в использовании. В первую очередь, использование живых клеток демонстрирует наилучшее использование mBCl; однако после лизиса клеток было обнаружено, что сигнал гаснет и, как правило, уменьшается в многолуночном формате по сравнению с OPA35. Еще одной проблемой является измерение GSSG с помощью mBCl, литература по этому вопросу скудна, и благодаря оптимизации/исследованию протокола, точное определение GSSG через mBCl не было достигнуто.
Мы продемонстрировали, что анализ OPA имеет достаточно надежные калибровочные диапазоны со средним значением R2 0,9932 ± 0,007 (N=12) в диапазоне концентраций 0,234 - 30 мкМ GSH. Этот диапазон был выбран в связи с предыдущими референсными диапазонами, обнаруженными в литературе35. Теоретически возможно обнаружить глутатион за пределами этих диапазонов, но для этого потребуется изменение концентрации реагентов, времени инкубации и, возможно, оборудования, используемого для обнаружения. Следует отметить, что для каждой пластины требуется свой собственный стандартный диапазон для количественной оценки; Малейшее расхождение во времени между пластинами, выполненное в разные дни, может оказать существенное влияние на значения, полученные в ходе измерения.
Получение точных и надежных данных с помощью этого протокола зависит от строгого соблюдения нескольких важных шагов. При создании различных буферов, требуемых в протоколе, крайне важно, чтобы pH был точным. Следовательно, буферы, требующие pH 9, не должны иметь отклонения более ± 0,1 от этого значения. Это связано с тем, что буферные компоненты могут выпадать в осадок из раствора при неправильном pH; Следование этому протоколу как раз и предотвратит эту проблему.
Полное удаление обработок и тщательная промывка перед лизисом также имеют решающее значение для предотвращения артефактов и неточного получения данных на этапе считывания показаний планшета. После того, как клетки были лизированы (шаг 4.8), удаление лечения невозможно, и планшет нельзя будет спасти. В связи с тем, что объемы буферов/реагентов, добавляемых по всему протоколу, варьируются в зависимости от образцов и стандартов, крайне важно, чтобы пользователь знал о различных объемах на этапах 4.12 и 4.13. Оператор пробирной группы также получает информацию об этих различных объемах и должен убедиться, что все объемы одинаковы, чтобы обеспечить точность измерения. Поскольку объемы между образцами и стандартами не являются заметно значительными, может быть легко допустить ошибку в отношении наличия избыточного раствора в лунке для образца.
У этого протокола есть ограничения, которые зависят от критически важных шагов, которые имеют решающее значение для получения точных и надежных данных. Пользователи, выполняющие этот анализ, должны обладать достаточным уровнем лабораторных навыков, чтобы предотвратить нежелательные проблемы, такие как образование пузырьков. Образование пузырьков оказывает значительное влияние как на способность к протеканию реакций внутри микропланшета, так и на измерение флуоресценции. Лизирующий агент, используемый в этом протоколе, содержит моющее средство, что представляет трудности для начинающего исследователя, который может изо всех сил пытаться предотвратить образование пузырьков. Немедленное центрифугирование может исправить эту ошибку. Протокол также потенциально ограничен в отношении типа клеток; клеточные линии A549, J774 и HepG2 использовались как для оптимизации, так и для получения данных для этого протокола. Для получения точных данных для других клеточных линий может потребоваться другая плотность затравки и оптимизация протокола.
Этот протокол имеет множество преимуществ по сравнению с несколькими существующими анализами. Несмотря на то, что обнаружение тиолов с помощью фтальдегида не является новой концепцией, использование в таком комбинированном формате анализа, как этот, в микропланшете, с ограниченным количеством необходимых материалов и оборудования, предлагает большой потенциал для всех лабораторий для доступа к этому протоколу. Большинство наборов Thiol/GSH от коммерческих поставщиков не раскрывают состав своих реагентов. Следовательно, может быть трудно предвидеть возможность несовместимости/интерференции. Здесь мы представляем каждый компонент всех используемых реагентов, чтобы ограничить этот потенциал.
Этот протокол также выполняется довольно быстро по завершении начального периода лечения. Учитывая обработку данных пользователем между стадиями инкубации, количественная оценка тиола в этом протоколе может быть выполнена менее чем за 1 час. Образцы одновременно лизируются и связываются для предотвращения самоокисления образцов, что является оптимальным для этих реакционных веществ. Хотя это не указано в протоколе, образцы технически могут быть лизированы в планшете и запечатаны, что позволяет заморозить их для будущего анализа. Тем не менее, это изменение протокола не изучалось.
Disclosures
Авторы заявляют об отсутствии конфликта интересов.
Acknowledgements
Исследование финансировалось европейскими проектами GRACIOUS (GA760840) и SUNSHINE (GA952924). Авторы также хотели бы выразить признательность всем тем, кто в той или иной степени помог в разработке этого протокола.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22µm filter (optional-For lysis buffer) | Fisher scientific | 12561259 | |
| 100mL volumetric flask | Fisher scientific | 15290866 | |
| 1L Volumetric flask | Fisher scientific | 15230876 | |
| 250mL beaker (optional-For lysis buffer) | Fisher scientific | 15409083 | |
| 8-Channel micropipette (20-200µL) | SLS | FA10011D2 | |
| 8-Channel micropipette (2-20µL) | SLS | B2B06492 | |
| 96 well plates - black with clear bottom, TC treated | Fisher scientific | 10000631 | Preferred plate for seeding and fluoresence, use TC treated clear if unavailable |
| 96 well plates - clear (TC treated and untreated) | Fisher scientific | 10141161 | If black plates with clear bottom is not available/ suitable use TC treated clear |
| 96 well plates - white, Not TC treated | Fisher scientific | 11457009 | |
| A549 (lung carcinoma) cell line | ATCC | CCL-185 | |
| Absolute ethanol | Merck (Sigma-Aldrich) | 1.08543 | |
| Aluminium foil | Fisher scientific | 11779408 | For protecting plates from light |
| BCA Assay Kit | Thermo | 23225 | |
| Benchtop Centrifuge (with 96 plate rotor) | Eppendorf | 5804 | |
| Ethylenediaminetetraacetic acid (EDTA) | Merck (Sigma-Aldrich) | E9884 | |
| Glutathione (GSH) | Merck (Sigma-Aldrich) | G6013 | |
| Glutathione disulfide (GSSG) | Merck (Sigma-Aldrich) | G4501 | |
| Glycerol | Merck (Sigma-Aldrich) | G5516 | |
| HCl, 37% | Merck (Sigma-Aldrich) | 258148 | Dilute to 1mM for GSH stock, pH adjustment also |
| HepG2 (Hepatocarcinoma) cell line | ATCC | HB-8065 | |
| IGEPAL CA-630 | Merck (Sigma-Aldrich) | 18896 | Use either IGEPAL CA-630 or NP-40 for solution, not both |
| IP lysis buffer | Fisher scientific | 11825135 | |
| J774 (monocyte, macrophage) cell line | ATCC | TIB-67 | |
| KCl | Merck (Sigma-Aldrich) | P3911 | |
| KH2PO4 | Merck (Sigma-Aldrich) | P0662 | |
| Micropipette (20-200µL) | SLS | B2B06482 | |
| Micropipette (2-20µL) | SLS | B2B06478 | |
| Microplate shaker | VWR | 444-0041 | |
| Na2HPO4 | Merck (Sigma-Aldrich) | S9763 | |
| NaCl | Merck (Sigma-Aldrich) | S9888 | |
| NaOH, 10M | Merck (Sigma-Aldrich) | 72068 | For pH adjustment only |
| N-Ethylmaleimide (NEM) | Merck (Sigma-Aldrich) | E3876 | |
| NP-40 | Merck (Sigma-Aldrich) | 492016 | Use either IGEPAL CA-630 or NP-40 for solution, not both. NP-40 alternative suggested |
| Ortho -Phthaldialdehyde (OPA) | Merck (Sigma-Aldrich) | P1378 | |
| PBS 0.1M | Merck (Sigma-Aldrich) | P2272 | PBS can either be acquired pre-made or made in house, see notes |
| Plate reader (with fluoresence capacity) | Tecan | SPARK | |
| Stir bar (optional-For lysis buffer) | Fisher scientific | 16265731 | |
| Toxilight bioassay kit (AK assay) | Lonza | LT17-217 | |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP) 0.5M in H2O | Alfa Aesar | H51864 | Can also be purchased crystalised and suspended |
| TRIS-HCl | Merck (Sigma-Aldrich) | 93363 | |
| X100 phosphatase and protease cocktail | Fisher scientific | 10025743 |
References
- Barnham, K. J., Masters, C. L., Bush, A. I. Neurodegenerative diseases and oxidative stress. Nat Rev Drug Discov. 3 (3), 205-214 (2004).
- Arfin, S., et al. Oxidative stress in cancer cell metabolism. Antioxidants. 10 (5), 642 (2021).
- Cooke, M. S., Evans, M. D., Dizdaroglu, M., Lunec, J. Oxidative DNA damage: mechanisms, mutation, and disease. The FASEB Journal. 17 (10), 1195-1214 (2003).
- Ghezzi, P., Jaquet, V., Marcucci, F., Schmidt, H. H. H. W. The oxidative stress theory of disease: levels of evidence and epistemological aspects. Br J Pharmacol. 174 (12), 1784-1796 (2017).
- Bhattacharyya, A., Chattopadhyay, R., Mitra, S., Crowe, S. E. Oxidative stress: An essential factor in the pathogenesis of gastrointestinal mucosal diseases. Physiol Rev. 94 (2), 329-354 (2014).
- Yin, F., Sancheti, H., Cadenas, E. Mitochondrial thiols in the regulation of cell death pathways. Antioxi Redox Sig. 17 (12), 1714-1727 (2012).
- Balcerczyk, A., Bartosz, G. Thiols are main determinants of total antioxidant capacity of cellular homogenates. Free Rad Res. 37 (5), 537-541 (2003).
- McBean, G. J. Cysteine, glutathione, and thiol redox balance in astrocytes. Antioxidants. 6 (3), 62 (2017).
- Nimse, S. B., Pal, D. Free radicals, natural antioxidants, and their reaction mechanisms. RSC Adv. 5 (35), 27986-28006 (2015).
- Nordberg, J., Arnér, E. S. J. Reactive oxygen species, antioxidants, and the mammalian thioredoxin system1. Free Rad Biol Med. 31 (11), 1287-1312 (2001).
- Pham-Huy, L. A., He, H., Pham-Huy, C. Free radicals, antioxidants in disease and health. Int J Biomed Sci. 4 (2), 89 (2008).
- Harris, I. S., DeNicola, G. M. The complex interplay between antioxidants and ROS in cancer. Trend Cell Biol. 30 (6), 440-451 (2020).
- Traverso, N., et al. Role of glutathione in cancer progression and chemoresistance. Oxid Med Cell Longev. 2013, 972913 (2013).
- Day, R. M., Suzuki, Y. J. Cell proliferation, reactive oxygen and cellular glutathione. Dose-Resp. 3 (3), 425-442 (2005).
- Aquilano, K., Baldelli, S., Ciriolo, M. R. Glutathione: new roles in redox signaling for an old antioxidant. Front Pharmacol. 5, 196 (2014).
- Zitka, O., et al. Redox status expressed as GSH: GSSG ratio as a marker for oxidative stress in paediatric tumour patients. Onco Lett. 4 (6), 1247-1253 (2012).
- Childs, S., Haroune, N., Williams, L., Gronow, M. Determination of cellular glutathione: glutathione disulfide ratio in prostate cancer cells by high performance liquid chromatography with electrochemical detection. J Chrom A. 1437, 67-73 (2016).
- Giustarini, D., et al. glutathione disulfide, and S-glutathionylated proteins in cell cultures. Free Rad Biol Med. 89, 972-981 (2015).
- Özyürek, M., et al. Determination of biothiols by a novel on-line HPLC-DTNB assay with post-column detection. Analytica Chimica Acta. 750, 173-181 (2012).
- Zhang, L., Lu, B., Lu, C., Lin, J. Determination of cysteine, homocysteine, cystine, and homocystine in biological fluids by HPLC using fluorosurfactant-capped gold nanoparticles as postcolumn colorimetric reagents. J Sep Sci. 37 (1-2), 30-36 (2014).
- Tsiasioti, A., Georgiadou, E., Zacharis, C. K., Tzanavaras, P. D. Development and validation of a direct HPLC method for the determination of salivary glutathione disulphide using a core shell column and post column derivatization with o-phthalaldehyde. J Chromat B. 1197, 123216 (2022).
- Huang, D., Ou, B., Prior, R. L. The chemistry behind antioxidant capacity assays. J Agri Food Chem. 53 (6), 1841-1856 (2005).
- Berker, K. I., Güçlü, K., Tor, &. #. 3. 0. 4. ;., Demirata, B., Apak, R. Total antioxidant capacity assay using optimized ferricyanide/prussian blue method. Food Anal Meth. 3 (3), 154-168 (2010).
- Rahman, I., Kode, A., Biswas, S. K. Assay for quantitative determination of glutathione and glutathione disulfide levels using enzymatic recycling method. Nat Prot. 1 (6), 3159-3165 (2007).
- Kampa, M., et al. A new automated method for the determination of the Total Antioxidant Capacity (TAC) of human plasma, based on the crocin bleaching assay. BMC Clin Pathol. 2 (1), 3 (2002).
- Fernández-Checa, J. C., Kaplowitz, N. The use of monochlorobimane to determine hepatic GSH levels and synthesis. Anal Biochem. 190 (2), 212-219 (1990).
- Nauen, R., Stumpf, N. Fluorometric microplate assay to measure glutathione S-transferase activity in insects and mites using monochlorobimane. Anal Biochem. 303 (2), 194-198 (2002).
- Stevenson, D., Wokosin, D., Girkin, J., Grant, M. H. Measurement of the intracellular distribution of reduced glutathione in cultured rat hepatocytes using monochlorobimane and confocal laser scanning microscopy. Toxicol in vitro. 16 (5), 609-619 (2002).
- McBeth, C., Stott-Marshall, R. J. Interference of reversible redox compounds in enzyme catalysed assays–Electrochemical limitations. Anal Biochem. 662, 114972 (2023).
- Yu, Z., et al. Reactive oxygen species-related nanoparticle toxicity in the biomedical field. Nanoscale Res Lett. 15 (1), 115 (2020).
- Boyles, M., et al. Development of a standard operating procedure for the DCFH2-DA acellular assessment of reactive oxygen species produced by nanomaterials. Toxicol Mech Meth. 32 (6), 439-452 (2022).
- Segeritz, C. P., Vallier, L. Cell culture: Growing cells as model systems in vitro. Basic Sci Meth Clin Res. , 151-172 (2017).
- Ma, Q. Role of nrf2 in oxidative stress and toxicity. Ann Rev Pharmacol Toxicol. 53, 401-426 (2013).
- Calabrese, V., Cornelius, C., Dinkova-Kostova, A. T., Calabrese, E. J., Mattson, M. P. Cellular stress responses, the hormesis paradigm, and vitagenes: novel targets for therapeutic intervention in neurodegenerative disorders. Antioxid redox Signal. 13 (11), 1763-1811 (2010).
- Ishkaeva, R. A., Zoughaib, M., Laikov, A. V., Angelova, P. R., Abdullin, T. I. Probing cell redox state and glutathione-modulating factors using a monochlorobimane-based microplate assay. Antioxidants. 11 (2), 391 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved