利用 Cell Factory 平台生成高滴度、高质量腺相关病毒载体的简化和标准化程序
In This Article
Summary
随着基因治疗领域的不断发展,对能够应对这些挑战的创新方法的需求越来越大。本文介绍了一种独特的方法,该方法简化了使用 Cell Factory 平台生成高产量和高纯度 AAV 载体的过程,满足 体内 研究的质量标准。
Abstract
临床前基因治疗研究,特别是在啮齿动物和大型动物模型中的研究,需要生产高产量和高纯度的 AAV 载体。研究实验室的传统方法通常涉及广泛使用细胞培养皿来培养HEK293T细胞,这一过程既费力又有问题。本文介绍了一种独特的内部方法,该方法使用特定的细胞工厂(或细胞堆栈,CF10)平台简化了这一过程。聚乙二醇/水性两相分配与碘克沙醇梯度超速离心相结合,提高了所生成 AAV 载体的产量和纯度。AAV 载体的纯度通过 SDS-PAGE 和银染验证,而满颗粒与空颗粒的比率则使用透射电子显微镜 (TEM) 确定。这种方法为高产量生产 AAV 载体提供了一个高效的细胞工厂平台,并结合了改进的纯化方法,以满足 体内 研究的质量要求。
Introduction
腺相关病毒 (AAV) 载体已成为基因治疗研究中不可或缺的工具,为基因递送提供了有效性和安全性的独特组合1。在实验室环境中生成 AAV 的传统方法对于促进我们对基因治疗的理解和应用至关重要2。然而,这些方法虽然是基础方法,但存在一定的局限性和挑战,尤其是在产量、时间效率和所产生载体的质量方面,特别是满颗粒与空颗粒的比率3。
AAV 生产的常规程序主要涉及 HEK293 细胞的转染4。该过程通常在细胞培养皿中进行,需要用含有目标基因的质粒以及辅助质粒和 AAV 衣壳质粒 5,6 转染细胞。转染后,细胞产生 AAV 颗粒,然后收获和纯化 5,6。纯化过程通常涉及超速离心,这是获得高纯度 AAV 载体的关键步骤7。超速离心,特别是使用氯化铯 (CsCl) 或碘克沙醇梯度,是将 AAV 颗粒与细胞碎片和其他杂质分离的标准方法8。这一步对于实现所需的 AAV 载体纯度和浓度至关重要,而 AAV 载体的纯度和浓度会直接影响其基因递送的功效8。尽管传统超速离心法应用广泛,但也有其缺点。例如,这种方法的 AAV 载体产量可能可变且通常很低,当需要大量高滴度载体时,这带来了重大挑战,特别是对于体内研究或大型动物模型9。
AAV 载体质量的另一个关键方面是满颗粒与空颗粒的比率10。AAV 制剂通常含有这些颗粒的混合物;然而,只有完整的颗粒含有治疗性遗传物质。高比例空颗粒的存在会显著降低基因递送的效率10。因此,评估和优化满颗粒与空颗粒的比率是评估 AAV 载体功效的关键参数。传统方法虽然能够制备 AAV 载体,但通常难以一致地控制该比率,从而导致载体效力发生变化10。
本文提出了一种独特的方法,该方法简化了使用细胞工厂平台生成高产量和高纯度 AAV 载体的过程,无需在细胞培养皿中使用劳动密集型HEK293T细胞培养物,将聚乙二醇/水性两相分配与碘克沙醇梯度超速离心相结合。通过 SDS-PAGE 和银染确认 AAV 载体纯度,并使用透射电子显微镜 (TEM) 确定满颗粒与空颗粒的比率,符合 体内 研究的质量标准11。
Protocol
材料 表中列出了研究中使用的试剂、质粒和设备的详细信息。所用缓冲液的成分在 补充文件 1 中提供。
1. 质粒制备
- 转化 大肠杆菌中的质粒 (pAAV-GOI, pHelper, pAAV-Cap)。
注:任何大 肠杆菌 菌株都可用于质粒扩增。对于某些质粒,特殊的感受态细胞(如 NEB 稳定)可以提高质粒产量。该方案中使用的三种质粒是 pAAV-GOI:pAAV-CMV-GFP、pHelper:pAdDeltaF6 和 pAAV-Cap:pAAV-RC6。 - 在 37 °C 下以最佳体积在含有适当选择性抗生素的 LB 培养基中培养细菌 16-18 小时。
注意:当使用 NEB 稳定细胞时,在 30 °C 下培养 18-20 小时。 - 通过离心大 肠杆菌收获质粒 DNA。4000 x g ,4 °C 的培养基,15 分钟。
- 小心地将离心瓶中的上清液倒入废液中,并使用大规模无内毒素质粒纯化试剂盒从沉淀中纯化质粒 DNA。
注意: 确保缓慢倒入,避免飞溅。 - 使用分光光度计测量 DNA 浓度和纯度。
注:通过检查 OD260/OD280 比率来检查 DNA 纯度。纯 DNA 的比率约为 1.8。对于后面的共转染步骤,DNA 浓度应高于 1 μg/μL。通过在冻存管中将 500 μL 过夜培养物添加到 500 μL 50% 甘油中,并在 -80 °C 下储存来制备细菌甘油原液。
2. 制备HEK293T细胞
- 用含有 10% FBS 的 DMEM 高葡萄糖培养基将 HEK293T 细胞接种到 10 层细胞工厂 (CF10) 中,并让细胞在培养箱中生长过夜。
注:293T 细胞的传代次数应少于 10 次,以便为稳健的 AAV 生产提供最佳条件。如果可能,此时不要向培养基中添加抗生素。CF10 的生长表面积约为 150 mm 细胞培养皿的 42 倍。在 150 mm 细胞培养皿中接种相同密度的细胞,以便在显微镜下检查细胞生长。制备 1075 mL 细胞悬液,向 150 mm 培养皿中加入 25 mL 细胞悬液,然后将剩余部分加入 CF10 中。 - 转染前第二天检查细胞汇合度。
注:通过在显微镜下观察,细胞在转染时应达到 80%-90% 汇合度。
3. AAV 质粒的三重转染
- 计算每个质粒(pAAV-GOI、pHelper、pAAV-血清型)所需的量,以达到 1.2:1:1 的摩尔比,每个 CF10 含有 2.5-5 mg 总 DNA。
注:三种质粒的摩尔比可能为最佳转染效果而变化。在移动到此 CF10 设置之前,最好在小规模设置中对其进行测试。以 pAAV-CMV-GFP、pAdDeltaF6 和 pAAV-RC6 为例,用于制造 AAV6-CMV-GFP 病毒。PEI 计算器公式列于 表 1 中。 - 将 350 mL OptiMEM 分装到无菌 500 mL 瓶中。
- 将所有三种质粒 DNA 加入含有 Opti-MEM 的瓶子中。搅拌均匀。
- 加入 15 mL 1 mg/mL 聚乙烯亚胺 (PEI) 溶液(1:3 μg DNA 与 μg PEI 比率)。用力上下摇动 OptiMEM/DNA/PEI 混合物 30 秒。
注意:制作气泡是可以的。 - 将混合物在室温下孵育 10-15 分钟。
注:孵育时间过长会降低转染效率。 - 将 OptiMEM/DNA/PEI 溶液添加到含有 700 mL DMEM 低葡萄糖、10 mM HEPES 和 2% FBS 的 1 L 瓶中。搅拌均匀。
注:在本研究中,DMEM 中的低葡萄糖在共转染后显示出更好的 AAV 载体产生。添加 HEPES 有助于使细胞保持更好的状态。通过缓慢旋转瓶子来混合。避免创建过多的气泡。 - 将 CF10 从培养箱中取出,将培养基吸出到废液容器中。
注意:将 CF10 放在通风橱内的表面上,逐渐向上提起一侧,在不分离细胞的情况下缓慢吸出培养基。 - 小心地将转染混合物添加到 CF10 中。确保所有 10 层都被介质覆盖。
注:向 150 mm 培养皿中加入 25 mL 转染混合物。每天监测细胞,直到收获。缓慢倒入,将剩余的转染混合物添加到 CF10 中。非常小心地旋转 CF10 并确保每层的体积相等。 - 将 CF10 放回培养箱中 72-96 小时。
注:检查 150 mm 监测皿以决定何时收获 AAV 载体。当细胞在满负荷 AAV 后变得非常容易分离时,就该收获了。
4. 收获 AAV 载体
- 转染后 3-4 天,通过剧烈摇动 CF10 收获病毒。将培养基倒入 250 mL 锥形管中,并在 4 °C 下以 4000 x g 的速度旋转病毒 20 分钟。
注:对于本协议中使用的 AAV6 血清型,80% AAV 将主要与沉淀中的细胞材料结合。而 20% 的 AAV 被秘密传播到媒体中。其他 AAV 血清型的这些比例可能不同。 - 用 0.45 μm 过滤装置过滤澄清的上清液并保存以供沉淀。
- 用 500 mL DPBS 1x 缓冲液冲洗 CF10,并在 4 °C 下以 4000 x g 离心 20 分钟。
- 使用真空系统和吸液管弃去上清液。在 -80 °C 下,每个 CF10 加入 20 mL AAV 裂解缓冲液直至纯化。
注:将 AAV 裂解物转移至 50 mL 锥形管中,以便稍后提取 AAV。 - 取出过滤的上清液,加入 40% PEG-2.5 M NaCl 溶液,终浓度为 8% PEG,并在眼眶旋转器上的冷藏室中孵育至少 3 小时或过夜。
注:对于 100 mL 上清液,添加 25 mL 40% PEG-2.5 M NaCl 溶液。 - 通过在 4 °C 下以 4000 x g 离心 30 分钟来沉淀病毒。
注:将混合物转移至 250 mL 锥形管中进行离心。 - 吸出以去除上清液并加入 5-10 mL AAV HEPES 重悬缓冲液以悬浮沉淀。转移到 50 mL 锥形管中以继续下游纯化,或将其储存在 -80 °C 下。
5. AAV 提取
- 用摇床在 37 °C 水浴中解冻病毒沉淀 10-15 分钟。
注:涡旋 AAV 裂解物以完全熔化。 - 在 -80 °C 100% 乙醇浴中冷冻 20-30 分钟。
注意:或者,可以使用冰包围的 100% 冷乙醇烧杯进行冷冻循环。 - 进行冻融 3-4 次,必要时在两者之间涡旋。
注意:此循环可以在冻结步骤中暂停。将 AAV 裂解物储存在 -80 °C 直至下游工作。 - 用摇床在 37 °C 水浴中解冻 AAV 裂解物(来自步骤 5.3)并重悬 AAV(来自步骤 4.7)10-15 分钟,然后涡旋。
注意:确保完全融化并混合。 - 向 AAV 裂解物中加入 Benzonase 核酸酶 (250 单位/μL),并重悬 AAV,最终浓度为 50 单位/mL。涡旋溶液。
- 在 37 °C 水浴中振荡孵育 30 分钟。
注:在水浴中取出 10% 脱氧胆酸钠等分试样,让时间充分溶解、加热和充分混合。 - 加入 10% 脱氧胆酸钠,终浓度为 0.5%,并在 37 °C 下用摇床孵育 30 分钟。
注:脱氧胆酸钠用于增强 AAV 从细胞中释放。 - 将原始 AAV 溶液分布在 2 mL 离心管中,并在 4 °C 下以 14,000 x g 离心 10 分钟。
- 将上清液转移至 50 mL 锥形管中。
注:使用 1 mL 移液器转移上清液。丢弃颗粒。 - 加入等量的氯仿,涡旋 1-2 分钟提取 AAV。
注意:溶液应变为不透明、白色、牛奶状。 - 将乳白色溶液转移到 2 mL 离心管中并均匀分布。在 4 °C 下以 14,000 x g 离心 10 分钟。
- 小心地移出顶部的粉红色层,并将其转移到新的 50 mL 锥形管中。
注意:请勿干扰氯仿/蛋白质层。 - 使用移液器测量最终体积。根据原始 AAV-PEG-硫酸盐体积图(表 2),混合适当体积的 50% (NH4)2SO4 和 40% PEG 溶液。涡旋 2 分钟。
- 将混合物转移到 2 mL 离心管中,使其均匀分布。在 4 °C 下以 14,000 x g 离心 10 分钟
- 使用 22 G 针头和 3 mL 注射器收集底层。将 AAV 收集在 50 mL 锥形管中,并将其储存在 4 °C 下,以便稍后进行碘克沙醇梯度超速离心。
6. 通过碘克沙醇梯度超速离心纯化 AAV
- 在加载 AAV 之前,根据所使用的超速离心管的数量新鲜制备碘克沙醇梯度(表 3)。
注:酚红用于观察各层。 - 使用连接有 16 G 打孔长针的 10 mL 注射器,将每种溶液缓慢覆盖到圆顶聚丙烯超速离心机快速密封管中。避免气泡。
- 用 22 G 注射器在梯度顶部小心地添加至 17 mL 的 AAV 溶液。使用 AAV 透析缓冲液加满试管。
注:通过在超速离心管中将液滴加载到壁上来添加 AAV 溶液。不要打扰渐变图层。 - 用电动密封器密封超速离心管。
注意:在将试管送至超速离心机之前平衡试管,差异为 ±0.2 g。 - 在 4 °C 的 Ti70 转子中以 350,000 x g 离心 2 小时。
- 小心地从转子上取下试管,并将其放入超速离心管架中。
注意:确保梯度不受干扰。 - 按照以下步骤收集 AAV 馏分:
- 将试管稳定在支架上。
- 用连接到 10 mL 注射器的 19 G 针头刺穿略低于 40%-60% 界面的超速离心管。
注意:针的开口应向上,面向 40% 梯度。 - 用 16 G 针在试管顶部打一个孔。
- 每管最多可收集 5 mL。避免在 25%-40% 界面处收集蛋白质污染。
- 对每个超速离心管重复此操作。
注:将 AAV 馏分转移至 50 mL 锥形管中。
7. 第二轮碘克沙醇梯度超速离心
注意:此步骤是可选的。此步骤是为了降低空 AAV 比率,以获得更高质量的完整 AAV 衣壳。
- 用 AAV 透析缓冲液稀释 AAV >1:1。
注:从第一轮超速离心中收集的 AAV 为 40% 碘克沙醇层。应将其稀释至少 50%,以便能够加载到 30% 碘克沙醇层的顶部。 - 使用 16 G 打孔针头将每种溶液(表 4)覆盖到超速离心管中,然后缓慢连接 10 mL 注射器。避免气泡。
- 用 22 G 注射器在梯度顶部小心加入 20 mL 稀释的 AAV 溶液。使用 AAV 透析缓冲液加满试管。
- 重复步骤 6.4 到 6.7。
8. AAV 透析和浓缩
- 使用新的 18 G 针头和 10 mL 注射器将 AAV 病毒转移到透析盒中。将病毒缓慢注入包埋盒中并去除其中的空气。
- 在装有 AAV 透析缓冲液的烧杯中加入搅拌棒,并将其放在搅拌板上。
- 将透析盒放入带有浮标的透析缓冲液中。在 4 °C 下搅拌。 更换 2-3 倍的 AAV 透析缓冲液。
注:使用足够的缓冲液使凝胶盒浮动并执行缓冲液更换。用铝箔盖住烧杯。 - 使用附有 18 G 针头的 10 mL 注射器,将病毒从凝胶盒中收集到离心过滤装置中。
- 在 4 °C 下以 4,000 x g 离心 15-30 分钟。
注意:用 AAV 透析缓冲液冲洗 AAV 2-3 次。浓缩 AAV,直到过滤器顶部剩余 ~200 μL。 - 从过滤器单元中收集浓缩的 AAV。用另外 300 μL AAV 透析缓冲液冲洗过滤器,并将其转移到浓缩的 AAV 中。
- 使用 1 mL 结核菌素鲁尔滑针注射器通过 0.22 μm 注射器过滤器过滤病毒。为确保最小的体积损失,请使用 10 mL 注射器将空气推入过滤器 2-3 次。
- 将纯化的 AAV 病毒暂时储存在 4 °C 进行滴定。
注:滴定病毒,分装,并在 1 周内储存在 -80 °C。
9. AAV 病毒滴定
注:TaqMan 定量聚合酶链反应 (qPCR) 用于滴定纯化的 AAV。
- 用 DNase I 处理 AAV 载体,在 37 °C 下孵育 30 分钟,然后在 95 °C 下孵育 10 分钟。
注:以 10 μL 反应为例,使用 2 μL AAV 病毒样品、1 μL DNase、1 μL DNase 缓冲液和 6 μL H2O。它可以在带有 PCR 管的热循环仪中进行。 - 准备靶向 AAV 插入区域的引物组。
注意:靶标可以是 AAV 构建体中的启动子、转基因和报告基因。引物列于 表 5 中。 - 制备 DNA 质粒标准品(10、1、0.1、0.01、0.001 和 0.0001 pg/μL)和阴性对照(H2O)。
- 根据制造商的说明准备 qPCR 预混液,包括引物。
- 将标准品和样品一式三份放在 PCR 板上。将 qPCR 混合物添加到标准品和样品中。密封板并根据制造商的说明进行 qPCR 反应。
注:反应条件取决于材料/试剂和仪器。快速和常规 PCR 循环适用。 - 计算 AAV 病毒滴度。
注意:该方案中的样品浓度是原始样品的 1/10 稀释。 - 将 AAV 病毒分装在 1.5 mL 试管中,在 4 °C 下储存长达一个月,并在 -80 °C 下长期储存。
注意:避免储存时出现冻融循环。用于 体内 实验时,请勿使用两次等分试样的解冻。
10. AAV 的质量控制
注:使用 SDS-PAGE 凝胶通过 SDS-PAGE 银染表征 AAV 病毒的纯度,并使用市售染色试剂盒染色。
- 用 Laemmli 缓冲液使 3 x 109 vg AAV 病毒样品变性。
注:使用参考 AAV 病毒作为对照。使用 AAV6-CMV-GFP 参考完整衣壳。 - 将变性的 AAV 加载到 4%-20% 梯度的 SDS-PAGE 凝胶上,并在 180 V 下运行 50 分钟。
- 从电泳板中取出凝胶。根据制造商的说明,用银染试剂盒对凝胶进行染色。
- 检查 AAV 衣壳蛋白 VP1、VP2 和 VP3。
注:纯 AAV 病毒仅包含 VP1、VP2 和 VP3 衣壳蛋白。如果不纯,则凝胶上可以看到其他蛋白质条带。
注意:对阴性染色的重组 AAV 病毒粒子进行透射电子显微镜 (TEM) 以评估形态完整性和满/空比。 - 用镊子拿起一个 EM 网格,放在长凳上,网格闪亮的一面朝上。
- 将 5 μL AAV 样品移液到网格上,并使其蒸发干燥。
注意:如果需要,稀释 AAV。1012 vg/mL 是平均滴度。干燥网格可能需要 30-60 分钟。 - 通过移液逐滴清洗网格,将约 200 μL 的 H2O 加入到网格上。
- 将色谱纸慢慢地垂直放在网格旁边,以去除多余的水。
- 将 5 μL 的 2% 乙酸铀酰溶液移液到网格上。如上所述孵育 5 分钟并吸干。让网格干燥。
- 在透射电子显微镜下观察 AAV 颗粒(放大 50,000 倍)。具有病毒基因组的病毒衣壳将显示为均匀的白色六边形,而空衣壳将显示为具有白色边缘但中心较暗的六边形。
- 随机计数至少 100 个粒子,以确定 full 与 .空 AAV 颗粒。
Representative Results
在这个详细的分步方案中,展示了一个标准化平台,可以在大规模研究实验室环境中使用 CF10 制造高滴度和高质量的 AAV 病毒。与传统的细胞培养皿相比,CF10 提供了一种培养大量细胞和产生 AAV 病毒的便捷方法(图 1)。测试了几种培养条件,以确定最佳环境中的细胞是否可以促进病毒生产。补充 10 mM HEPES 和 2% FBS 的低葡萄糖 DMEM 显示出最佳的 AAV 产生。
测试了几种纯化 AAV 的方案。大多数程序的病毒产量低且 AAV 衣壳杂质少。在这里,开发了一种修订后的纯化方案,结合了来自细胞沉淀和培养基的 AAV(图 2)。我们发现 80% 的 AAV 在细胞中,另外 20% 的 AAV 在从细胞分泌的培养基中。AAV 的两部分均用 DNase 处理以去除游离 DNA。脱氧胆酸钠用于进一步从细胞中释放 AAV。然后用氯仿萃取提取 AAV,然后进行水性两相分配。这些步骤可以去除大多数蛋白质污染物。AAV 仍可溶于硫酸铵相。
用不连续的碘克沙醇梯度超速离心去除剩余的污染物(图 3A)。梯度还有助于去除空的 AAV 衣壳,尤其是在第二轮碘克沙醇梯度超速离心中。
通过银染测定 AAV 病毒的纯度。当获得对应于 AAV 衣壳蛋白的三个主要条带 VP1、VP2 和 VP3 时,纯度大于 90%,AAV 病毒适合 体内 使用(图 3B)。通过 TEM 访问 AAV 完整衣壳与空衣壳的比率(图 3C)。只有带有转基因插入片段的完整衣壳才能在目标组织中表达转基因。高比例的空衣壳也可能诱导对 AAV 衣壳的免疫反应。这些质量检查对于使用前生产和纯化的每种 AAV 病毒都是必要的。
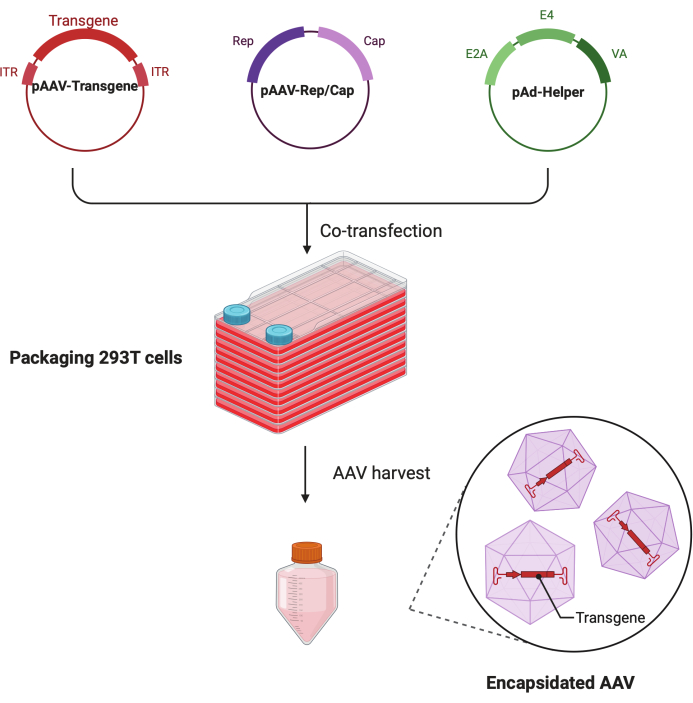
图 1:HEK293T 细胞三重转染法生产 AAV 的示意图。请点击此处查看此图的较大版本。
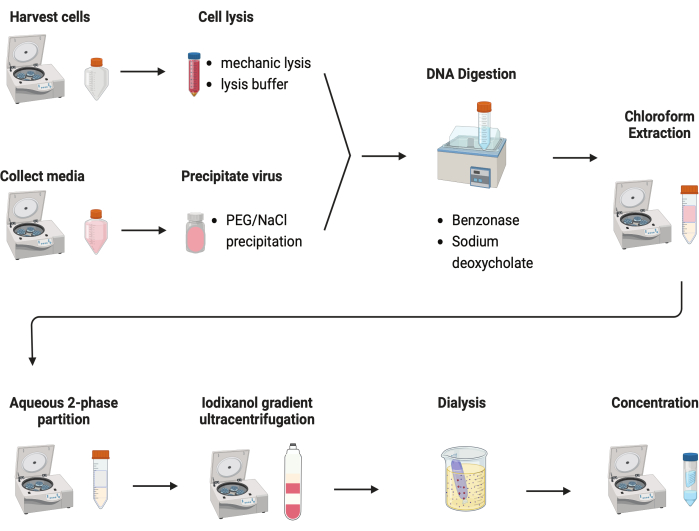
图 2:AAV 纯化示意图。请单击此处查看此图的较大版本。
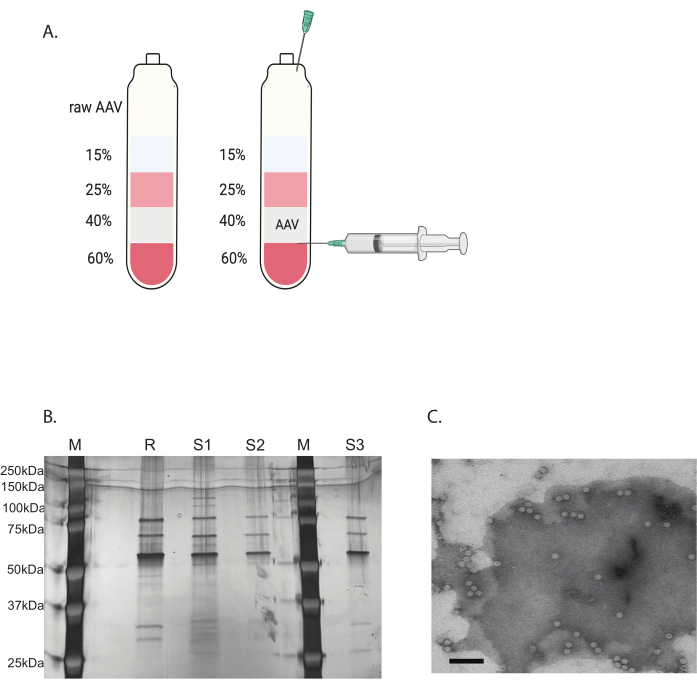
图 3:通过碘克沙醇梯度超速离心和 AAV 病毒纯度验证进行 AAV 纯化。 (A) 碘沙醇梯度层和收获针的位置。(B) 评估衣壳含量和纯度的代表性凝胶。M: 分子标志物;R: 参考 AAV6 完整衣壳;S1:自制的 AAVDJ 衣壳,经过一轮超速离心;S2:内部制造的 AAVDJ 衣壳,经过两轮超速离心;S3:自制 AAV6 衣壳。(C) AAV 的电子显微镜图像。纯化后收集的病毒。包含病毒基因组的病毒衣壳显示为均匀的白色六边形,而空衣壳显示为具有白色边缘但中心较暗的六边形。比例尺:100 nm。 请单击此处查看此图的较大版本。
表 1:AAV 包装的 PEI 计算器。请点击此处下载此表格。
表 2:原始 AAV-PEG-硫酸盐体积图。请点击此处下载此表格。
表 3:碘克沙醇梯度的制备。请点击此处下载此表格。
表 4:第二轮碘克沙醇梯度的制备。请点击此处下载此表格。
表 5:AAV 滴定引物。请点击此处下载此表格。
补充文件 1:用于研究的缓冲液的成分。请点击此处下载此文件。
Discussion
本文介绍了一种技术先进的方案,用于使用细胞工厂平台 (CF10) 大规模生产高滴度和高质量的 AAV 载体,这是对传统细胞培养皿方法的显著改进。细胞工厂的使用简化了大量细胞的培养过程,促进了 AAV 病毒的更高效的生产1。此外,通过优化培养条件,特别是使用补充有 10 mM HEPES 和 2% FBS 的低葡萄糖 DMEM,证实了病毒产量的显著提高,表明细胞环境在病毒产量中起着关键作用。
修订后的纯化方案结合了来自细胞沉淀和培养基的 AAV,解决了许多现有方案中常见的病毒产量低和杂质问题。氯仿萃取和水两相分配步骤可有效去除大多数蛋白质污染物,AAV 仍可溶于硫酸铵相。与传统的梯度超速离心方法相比,使用 PEG/水性两相分配结合碘克沙醇梯度超速离心的 AAV 载体的产量和纯度都有所提高,这可能归因于 PEG/水性双相分配增强的初始分离、碘克沙醇梯度超速离心的纯化纯度以及污染物共纯化的减少12.首先,在超速离心之前引入 PEG/水性两相分配可显著改善 AAV 颗粒与细胞碎片和其他污染物的初始分离。PEG 是一种高分子量聚合物,当与水溶液混合时,会产生两个不同的固定相13。AAV 载体倾向于优先分配到这些相之一(通常是富含 PEG 的相),而许多污染物和杂质则被分配到其他13 个相中。这种选择性分配可有效地浓缩 AAV 颗粒,并在超速离心之前去除大部分杂质,从而提高产量并减少进入超速离心步骤13 的污染物负荷。其次,碘克沙醇梯度超速离心进一步提高了 AAV 载体的纯度。碘沙醇是一种非离子等渗梯度填料,与传统的 CsCl 梯度相比,可实现更温和、更可控的分离14。在这个梯度中,AAV 颗粒迁移到梯度中与其浮力密度14 相对应的位置。重要的是,该过程可有效分离完整的 AAV 衣壳(包含遗传有效载荷)和空衣壳(缺乏遗传物质),这是载体质量的关键决定因素。碘克沙醇的异渗性质也比 CsCl 等高渗剂更能保持 AAV 衣壳的完整性,从而有可能获得更高的完整功能性载体产量14。最后,传统的超速离心方法,尤其是使用 CsCl 梯度的方法,有时可以共纯化与 AAV 载体具有相似浮力密度的污染物15。通过使用 PEG 分配作为初步步骤,在超速离心之前大大降低了此类污染物的负载13。污染物载量的减少意味着碘克沙醇梯度可以更有效地、更选择性地纯化 AAV 载体,从而提高纯度15。
AAV 载体的纯度和质量通过银染和 TEM11 进行严格评估。对对应于 AAV 衣壳蛋白 VP1、VP2 和 VP3 的三个主要条带的观察,纯度超过 90%,表明这些 AAV 载体适合 体内 使用。用于确定完整衣壳与空衣壳比率的 TEM 分析尤为重要,因为高比例的空衣壳会导致基因递送效率和潜在免疫反应降低11。这种质量检查虽然是必不可少的,但会增加程序的复杂性,并且可能需要额外的技术专业知识。
总之,该方案在 AAV 载体的生产方面提供了重大的技术进步,特别是在可扩展性和纯度方面。然而,与纯化过程相关的复杂性以及对专业设备和专业知识的需求可能仍然是其在某些研究环境中应用的一个小限制。这些技术的进一步改进和简化可以使这种方法更容易获得并广泛适用于基因治疗研究领域。
Disclosures
作者声明,该研究是在没有任何可能被解释为潜在利益冲突的商业或财务关系的情况下进行的。
Acknowledgements
TZ 设计了实验。TZ 、 VD 、 SB 和 JP 进行了实验。TZ 和 VD 生成数据并分析数据。TZ 和 YX 写了手稿。TZ 和 GG 修改了手稿。这项工作得到了匹兹堡 UPMC 儿童医院的支持。
Materials
| Name | Company | Catalog Number | Comments |
| 293T/17 cells | ATTC | CRL-11268 | |
| (NH4)2SO4 | Millipore Sigma | 1.01217.1000 | |
| 0.5 M EDTA | MilliporeSigma | 324506-100ml | |
| 1 mL Henke-Ject syringe | Fisher Scientific | 14-817-211 | |
| 10% pluronic F68 solution | Fisher Scientific | 24-040-032 | |
| 10x Tris/Glycine/SDS Buffer | Biorad | 1610732 | |
| 1M HEPES | Fisher Scientific | 15-630-080 | |
| 2% Uranyl Acetate Solution | Electron Microscopy Sciences | 22400-2 | |
| 4%–20% Precast Protein Gels | biorad | 4561094 | |
| 40% PEG solution | Sigma | P1458-50ML | |
| AAV6 reference full capsids | Charles River Laboratories | RS-AAV6-FL | |
| Accutase Cell Detachment Solution | Fisher Scientific | A6964-100ML | |
| Benzonase | Sigma | E1014-25KU | |
| BioLite Cell Culture Treated Dishes 150 mm | Fisher Scientific | 12-556-003 | |
| Centrifugal Filter Unit | MilliporeSigma | UFC905024 | |
| Corning PES Syringe Filters | Fisher Scientific | 09-754-29 | |
| Dialysis Cassettes, 10 K MWCO | Fisher Scientific | PI66810 | |
| Disposable PES Filter Units 1 L 0.2 µm | Fisher Scientific | FB12566506 | |
| Disposable PES Filter Units 1 L 0.45 µm | Fisher Scientific | FB12566507 | |
| Disposable PES Filter Units 500 mL 0.2 µm | Fisher Scientific | FB12566504 | |
| DMEM high glucose | Fisher Scientific | 10-569-044 | |
| DMEM low glucose | Fisher Scientific | 10567022 | |
| DNase | NEB | M0303S | |
| DPBS 1x | Fisher Scientific | 14-190-250 | |
| Fetal Bovin Serum (FBS) | Biowest | S1620 | |
| Formvar/Carbon 300 Mesh, Cu | Electron Microscopy Sciences | FCF300-Cu-50 | |
| glycerol | Sigma | G5516-1L | |
| KCl | Sigma | P9541-500G | |
| LB agar | Sigma | L2897-250G | |
| LB broth | Fisher Scientific | BP9732-500 | |
| MgCL2·6H2O | Sigma | M9272-100G | |
| NEB stable competent cells | NEB | C3040H | |
| Nest Biofactory 10 chamber | MidSci | 771302 | |
| NucleoBond Xtra Maxi EF | Macherey-Nagel | 740424 | |
| Opti-MEM | Fisher Scientific | 31-985-088 | |
| OptiPrep Density Gradient Medium | Millipore Sigma | D1556-250ml | |
| pAAV-CMV-GFP | Addgene | 105530 | |
| pAAV-DJ | Cell BioLab | VPK-420-DJ | |
| pAAV-RC6 | Cell BioLab | VPK-426 | |
| pAdDeltaF6 | Addgene | 112867 | |
| PEG 8000 | Promega | V3011 | |
| PEI Max | Polysciences, Inc | 49553-93-7 | |
| Pen-Strep | Fisher Scientific | 15-140-163 | |
| Phenol red | Millipore Sigma | 1.07242.0100 | |
| Pierce Silver Stain Kit | Thermo Fisher Scientific | 24612 | |
| QuickSeal tube | Fisher Scientific | NC9144589 | |
| Sodium Chloride | Sigma | 1162245000 | |
| sodium deoxycholate | Millipore Sigma | D6750-100G | |
| Taqman Fast Advanced Master Mix | Thermo Fisher Scientific | 4444557 | |
| Type 70 Ti Fixed-Angle Titanium Rotor | Beckman Coulter | 337922 | |
| Western Blotting Substrate | ThermoFisher | 32209 |
References
- Arjomandnejad, M., Dasgupta, I., Flotte, T. R., Keeler, A. M. Immunogenicity of recombinant adeno-associated virus (AAV) vectors for gene transfer. BioDrugs. 37 (3), 311-329 (2023).
- Liu, Y., Siriwon, N., A Rohrs, J., Wang, P. Generation of targeted adeno-associated virus (AAV) vectors for human gene therapy. Curr Pharm Des. 21 (22), 3248-3256 (2015).
- Bilal, A. S., et al. Optimization of large-scale Adeno-Associated Virus (AAV) production. Curr Protoc. 3 (5), e757 (2023).
- Rashnonejad, A., Chermahini, G. A., Li, S., Ozkinay, F., Gao, G. Large-scale production of adeno-associated viral vector serotype-9 carrying the human survival motor neuron gene. Mol Biotechnol. 58, 30-36 (2016).
- Challis, R. C., et al. Systemic AAV vectors for widespread and targeted gene delivery in rodents. Nat Protoc. 14 (2), 379-414 (2019).
- Challis, R. C., et al. Publisher Correction: Systemic AAV vectors for widespread and targeted gene delivery in rodents. Nat Protoc. 14 (8), 2597-2597 (2019).
- Mueller, C., Ratner, D., Zhong, L., Esteves-Sena, M., Gao, G. Production and discovery of novel recombinant adeno-associated viral vectors. Curr Protoc Microbiol. 26 (1), 14 (2012).
- Guo, P., Wiersch, J., Xiao, X., Gittes, G. Simplified purification of AAV and delivery to the pancreas by intraductal administration. Methods Mol Biol. 1950, 373-387 (2019).
- Berns, K. I., Srivastava, A. Next generation of adeno-associated virus vectors for gene therapy for human liver diseases. Gastroenterol Clin North Am. 48 (2), 319-330 (2019).
- Khasa, H., Kilby, G., Chen, X., Wang, C. Analytical band centrifugation for the separation and quantification of empty and full AAV particles. Mol Ther Methods Clin Dev. 21, 585-591 (2021).
- Chen, H. Comparative observation of the recombinant adeno-associated virus 2 using transmission electron microscopy and atomic force microscopy. Microsc Microanal. 13 (5), 384-389 (2007).
- Burnham, B., et al. Analytical ultracentrifugation as an approach to characterize recombinant adeno-associated viral vectors. Hum Gene Ther Methods. 26 (6), 228-242 (2015).
- Kato, M., et al. In situ-formable, dynamic crosslinked poly (ethylene glycol) carrier for localized adeno-associated virus infection and reduced off-target effects. Commun Biol. 6 (1), 508 (2023).
- Sena-Esteves, M., Gao, G. Enrichment of fully packaged virions in column-purified recombinant adeno-associated virus (rAAV) preparations by iodixanol gradient centrifugation followed by anion-exchange column chromatography. Cold Spring Harb Protoc. 2020 (2), 095638 (2020).
- Matsumoto, M., Wangelin, J. R., Murphy, M. L. Purification of avian encephalomyelitis virus by ultracentrifugation in a nonlinear cesium chloride gradient. Avian Dis. 22 (3), 496-502 (1978).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved