Непрерывная жидкостно-жидкостная экстракция среднецепочечных жирных кислот из ферментационного бульона с использованием мембран из полых волокон
In This Article
Summary
Была разработана система жидкостно-жидкостной экстракции (LLE) с использованием мембран из полых волокон для непрерывного и селективного извлечения среднецепочечных жирных кислот (СЦЖК) из ферментационного бульона. Система LLE обеспечивает высокую специфичность MCFA из бульонов, содержащих короткоцепочечные жирные кислоты и спирты. Кроме того, СЦЖК концентрируются в растворе для отпарки для облегчения извлечения продукта.
Abstract
Среднецепочечные жирные кислоты (СЦЖК; длина углерода: C6-C12) являются высокоценными платформенными химическими веществами, которые используются в различных промышленных целях, включая зеленые противомикробные препараты, пищевые ингредиенты, кормовые добавки для животных, косметику, ароматизаторы, фармацевтические препараты и структурированные липиды. В настоящее время большинство СЦЖК производятся из пальмового и кокосового масла, происходящего из Юго-Восточной Азии и Южной Америки. Традиционный подход к сбору плодов пальм и кокосов наносит значительный экологический ущерб в этих регионах. Поэтому исследователи разрабатывают биологические подходы (например, прецизионную ферментацию и ферментацию на открытой культуре) для более устойчивого производства СЦЖК с использованием низкоценных субстратов (например, метанола, этанола, лактата) или органических отходов в качестве сырья. Удлинение микробной цепи (КЭ) представляет собой быстро созревающую платформу для ферментации в открытой культуре, которая преобразует короткоцепочечные жирные кислоты (КЦЖК; длина углерода: C1-C5) в подмножество этих СЦЖК с промышленно значимыми скоростями. Тем не менее, непрерывная экстракция продуктов СЦЖК in situ необходима не только для предотвращения ингибирования продукта, но и для облегчения восстановления СЦЖК в чистом и пригодном для использования виде. Жидкостно-жидкостная экстракция (LLE) с использованием мембран из полых волокон и целевых экстрагентных смесей доказала свою эффективность в качестве надежного подхода к селективной экстракции продуктов MCFA из ферментационных бульонов, содержащих SCFA. В данной работе показано применение LLE для непрерывного удаления MCFA с использованием CE в качестве эталонной ферментационной системы и 3% (w/v) триоктилфосфина оксида в минеральном масле в качестве экстрагентной системы. Жирные кислоты в диапазоне от валериановой кислоты (C5) до каприловой кислоты (C8) выборочно удаляются из бульонов, содержащих SCFA, и концентрируются до высоких титров в полупериодическом растворе для щелочной зачистки для последующей обработки.
Introduction
Среднецепочечные жирные кислоты (СЦЖК) представляют собой высокоценные строительные блоки, содержащие длину цепи от шести (C6) до двенадцати (C12) атомов углерода. СЦЖК имеют промышленное применение в пищевых продуктах, кормах для животных, фармацевтических препаратах, косметике, ароматизаторах, противомикробных агентах и химическом синтезе 1,2,3. В настоящее время большинство СЦЖК получают из пальмового и кокосового масла, поставляемого из Юго-Восточной Азии и Южной Америки 4,5. Серьезный экологический ущерб, связанный с производством пальмового и кокосового масла, хорошо известен заинтересованным сторонам и широкой общественности. Исследователи изучают биологические подходы (например, прецизионную ферментацию и ферментацию на открытой культуре) для более устойчивого производства СЦЖК с использованием низкоценных субстратов или органических отходов в качестве сырья 6,7. Одним из устойчивых способов производства СЦЖК является переработка потоков органических отходов с использованием процесса, называемого удлинением микробной цепи (КЭ). Этот биопроцесс вторичной ферментации похож на анаэробное сбраживание в том, что он использует универсальность анаэробных микробиомов открытых культур, но вместо того, чтобы способствовать образованию метана, системы КЭ намеренно подавляют метаногенный путь. В микробиоме, где углерод не может быть максимально восстановлен доCH4, аH2 поддерживается ниже 10-4 атм с помощью архей, потребляющих водород, реакция окисления β, которая обычно расщепляет карбоксилаты с более длинными цепями до ацетата (например, C6 → C4 → C2), может быть обращена вспять (например, C2 → C4 → C6 и т.д.), при условии, что восстановленное соединение (т.е. донор электронов), такой как этанол или лактат8. В этом метаболизме молекула жирной кислоты, претерпевающая удлинение, служит акцептором электронов. Таким образом, вместо получения продукта с длиной углерода, равной единице (CH4), как при анаэробном сбраживании, в процессе CE образуются СЦЖК с длиной углерода от шести до восьми. Большой и растущий рынок готов принять эти химикаты «зеленой платформы». Тем не менее, до сих пор не было показано, что процесс КЭ приводит к образованию СЦЖК с длиной углерода, превышающей восемь атомов углерода с заметной скоростью.
Эффективная экстракция этих СЦЖК важна не только для восстановления желаемого продукта, но и для предотвращения ингибирования продукта и подталкивания микробиома к производству большего количества СЦЖК1. По мере увеличения концентрации СЦЖК метаболизм СЦЖК ингибируется и становится менее термодинамически благоприятным. Благодаря постоянному удалению СЦЖК производительность поддерживается на высоком уровне. Кроме того, поскольку КЦЖК служат субструктурами для процесса удлинения цепи, их не следует удалять из ферментационного бульона. Целевые экстрагентные смеси должны селективно экстрагировать продукты СЦЖК из ферментационных бульонов, содержащих КЦЖК.
В данной работе продемонстрирован надежный и практичный подход к непрерывному извлечению СЦЖК из ферментационного бульона, содержащего КЦЖК, с использованием системы жидкостно-жидкостной экстракции (LLE), включающей гидрофобный полипропиленовый мембранный экстрактор из полых волокон, селективный раствор органического экстрагента (оксид триоктилфосфина [TOPO]9,10,11) и обратному экстрактору из полых волокон. Перед системой LLE устанавливается защитный фильтр для клеток для удержания биомассы и уменьшения загрязнения мембраны. СЦЖК в их протонированной форме экстрагируются в их протонированной форме из водного ферментационного бульона (обычно с заданным значением pH <5,8) в раствор органического экстрагента (т.е. 3% TOPO (w/v) в минеральном масле), а затем обратно экстрагируются в щелочной раствор для отпаривания (pH = 9), где они депротонируют и концентрируются до высоких титров для последующей обработки. Конкретные заданные значения pH имеют важное значение, поскольку они определяют градиент концентрации между каждой фазой процесса LLE, обеспечивая чистый перенос СЦЖК из ферментационного бульона в раствор для отпаривания. LLE с использованием мембран прямой и обратной экстракции достигают высоких скоростей экстракции при минимизации коэкстракции спиртов и КЦЖК. Адъювант органических растворителей, TOPO, позволяет формировать комплексы MCFA. Эти комплексы лучше растворимы в органических фазах, чем в воде, что обуславливает высокую селективность СЦЖК. Процесс LLE также позволяет избежать многих недостатков, связанных с существующими подходами, которые будут обсуждаться в разделе «Обсуждение». Долгосрочная реализация с использованием этого подхода LLE была продемонстрирована в многочисленных исследованиях 9,10,11. В то время как этот подход особенно подходит для применений, связанных с получением СЦЖК путем удлинения микробной цепи, он также полезен в других приложениях, требующих селективного разделения соединений, обладающих аналогичными химическими свойствами, поскольку система органического экстрагента может быть адаптирована по индивидуальному заказу.
Protocol
Реагенты, расходные материалы и оборудование, использованные в данном исследовании, перечислены в таблице материалов.
1. Создание и интеграция биореактора и системы жидкостно-жидкостной экстракции
- Приготовьте раствор для экстракции в органической фазе и резервуар.
- Приготовьте 2 л раствора для экстракции в органической фазе, растворив 60 г оксида триоктилфосфина (ТОПО) в минеральном масле с помощью магнитной мешалки и мешалки.
- Добавьте раствор для экстракции в стеклянный резервуар объемом 2 л (т. е. в бутылку Шотта).
- Поместите резервуар на магнитную пластину для перемешивания (рис. 1A). Рекомендуемая скорость смешивания при непрерывной работе LLE составляет 150-250 об/мин.
- Подготовьте трехпортовую крышку для резервуара для экстракционного раствора.
- Прикрепите погружную трубку к первому отверстию, которая будет служить выходным отверстием, подающим раствор для экстракции на мембрану прямой экстракции (МКЭ) (рис. 1B).
- Прикрепите второй порт, который будет служить в качестве обратного порта для экстракционного раствора из мембраны обратной экстракции (BEM) (Рисунок 1C).
- Добавьте третье отверстие, открытое для атмосферы, чтобы гасить колебания давления, вызванные мембранным насосом.
- Подсоедините мембранный насос к вытяжным мембранам.
- Поместите привод насоса с частотой вращения 100 об/мин, оснащенный мембранной головкой насоса из политетрафторэтилена (ПТФЭ), рядом с резервуаром (Рисунок 1D).
- Подсоедините выходное отверстие резервуара для экстракционного раствора (рис. 1A) к входу мембранного насоса, а затем выходное отверстие мембранного насоса к входному отверстию со стороны кожуха в основании МКЭ (рис. 1B) с помощью гибкой трубки насоса (например, размер 16, 18).
- Соедините выпускное отверстие со стороны кожуха в верхней части МКЭ с входным отверстием со стороны кожуха в основании МКЭ (рис. 1C) с помощью гибких трубок насоса (например, размер 18).
- Подсоедините выпускное отверстие со стороны кожуха в верхней части БЭМ к обратному отверстию на резервуаре для экстракционного раствора (рис. 1A) с помощью гибкой трубки насоса (например, размер 16, 18).
ПРИМЕЧАНИЕ: Этот компонент системы переносит СЦЖК, извлеченные из ферментационного бульона в МКЭ, в отпарной раствор в МКЭ.
- Приготовьте раствор для отпары в водной фазе и резервуар.
- Приготовьте 3,25 л водно-фазного раствора для стриппинга, взяв 0,5 М раствора борной кислоты и доведя его до pH 9 с помощью NaOH.
- Налейте раствор в стеклянный резервуар объемом 3,5 л с магнитной мешалкой.
- Поместите резервуар на магнитную пластину для перемешивания (рисунок 1E).
- Подготовьте четырехпортовую крышку для резервуара для отпарного раствора.
- К первому отверстию прикрепите погружную трубку, которая будет служить выходным отверстием, подающим раствор для отпаривания в BEM.
- Прикрепите второй порт, содержащий Y-образный фитинг, к (1) функции порта обратного потока отпарного раствора из BEM и (2) к потоку уноса для добавок NaOH из системы контроля pH.
- Добавьте третий порт, открытый для выхода в атмосферу, чтобы учесть увеличение объема, вызванное добавлением NaOH и накоплением MCFA.
- Предусмотрите четвертый порт для размещения датчика pH контроллера pH.
- Установите систему pH-контроля в резервуаре для отпарного раствора.
- Интегрируйте систему контроля pH с заданным значением pH 9 с резервуаром для отпарного раствора (Рисунок 1F). Используйте 5 М NaOH в качестве базового раствора с регулятором pH для противодействия собранным СЦЖК.
- Вставьте датчик pH через отверстие резервуара для отпарного раствора и подвесьте его в отпарном растворе.
ПРИМЕЧАНИЕ: Эта система контроля pH не требует раствора кислоты.
- Подготовьте соединительные отверстия биореактора.
- Обозначьте два порта, порт отвода и порт обратного потока, в биореакторе для подключения к системе экстракции жидкость-жидкость (LLE) (рис. 1G,H).
- Подсоедините погружную трубку к выпускному отверстию. Бульон, богатый СЦЖК, будет перекачиваться из биореактора в порту оттока в систему LLE.
ПРИМЕЧАНИЕ: Бульон сначала поступает в мембранный фильтр из полых волокон, а затем на экстракционные мембраны для удаления клеток и других твердых частиц для предотвращения загрязнения. - Вставьте тройник в порт обратного потока, чтобы получить: (1) обедненный MCFA-бульон, переработанный из МКЭ, и (2) клеточный ретентат из мембранного фильтра из полых волокон.
- Установите мембранный фильтр из полых волокон.
- Разместите привод насоса с регулируемой частотой вращения 300 об/мин рядом с биореактором (рис. 1I).
- Прикрепите гидрофильную мембрану из полых волокон (рис. 1J) к кольцевой подставке над перистальтическим насосом.
- Установите две перистальтические головки насоса на привод насоса: большую (например, размер 17) и маленькую (например, размер 16).
ПРИМЕЧАНИЕ: Увеличенная головка насоса соединена с мембранным фильтром из полых волокон, чтобы скорость потока пермеата была больше, чем скорость потока, подаваемого в FEM. Если бы это было не так, пермеат потреблялся бы быстрее, чем он производится, вызывая образование вакуума. - Соедините выпускное отверстие в биореакторе с большим входным отверстием головки насоса с помощью гибкой трубки насоса (например, размера 17).
- Соедините большое выпускное отверстие головки насоса с гидрофильным мембранным фильтром из полых волокон на входе со стороны трубки в основании фильтра с помощью гибкой трубки насоса (например, размера 17).
- Закройте крышкой верхнее отверстие фильтра со стороны корпуса, чтобы предотвратить приток воздуха.
ПРИМЕЧАНИЕ: Богатый MCFA бульон (содержащий клетки) будет течь вверх по трубкам с полыми волокнами и возвращаться в биореактор. Прозрачный бульон (без клеток) проходит через мембрану из гидрофильного полиэфирсульфона (ПЭС) размером 0,2 мкм и собирается на стороне оболочки фильтра.
- Подключите МКЭ.
- Прикрепите первый модуль гидрофобной мембраны из полых волокон (FEM) к кольцевой подставке над насосом (Рисунок 1B).
- Подсоедините гидрофильный мембранный фильтр из полых волокон (рис. 1J) на выходе со стороны кожуха к маленькому входному отверстию насоса с помощью гибкой трубки насоса (например, размера 16, 18).
- Подсоедините небольшой выпускной патрубок насосной головки к МКЭ на входе со стороны трубки в основании модуля с помощью гибкой трубки насоса (например, размера 16, 18).
- Подсоедините манометр (Рисунок 1K) и клапан ограничения потока (Рисунок 1L) к выходному отверстию МКЭ со стороны трубы с помощью соединительного фитинга и тройника.
- Подсоедините выходное отверстие МКЭ со стороны трубы к обратному порту в биореакторе с помощью гибкой трубки насоса (например, размера 18).
ПРИМЕЧАНИЕ: Этот компонент системы переносит СЦЖК из прозрачного ферментационного бульона в экстракционный раствор, а затем возвращает прозрачный бульон в биореактор.
- Подключите БЭМ.
- Разместите привод насоса с регулируемой скоростью вращения 300 об/мин, оснащенный перистальтической головкой насоса (например, типоразмера 16), рядом с биореактором (рис. 1M).
- Прикрепите второй модуль гидрофобной мембраны из полых волокон к кольцевой подставке над перистальтическим насосом (Рисунок 1C).
- Подсоедините выходное отверстие резервуара для отпарного раствора к входу перистальтического насоса, а выходное отверстие насоса к входному отверстию со стороны трубки в основании БЭМ с помощью гибкой трубки насоса (например, размера 16, 18).
- Подсоедините манометр и клапан ограничения потока к выходному отверстию БЭМ со стороны трубы с помощью соединительного фитинга и тройника.
- Подсоедините выпускное отверстие со стороны трубки в верхней части BEM к отпарному отстойному отверстию резервуара с помощью гибкой насосной трубки (например, размера 16, 18).
ПРИМЕЧАНИЕ: Этот компонент системы переносит СЦЖК из экстракционного раствора в отпарной раствор в BEM, а затем возвращает отпарной раствор в его резервуар.
2. Инициирование работы системы экстракции жидкость-жидкость
- Загрунтуйте и циркулируйте водные фазовые линии.
- Включите перистальтический насос для отпарного раствора/БЭМ (рис. 1M) и установите скорость насоса для достижения постоянной скорости потока в диапазоне 25–250 мл·мин-1. БЭМ может работать в относительно большом диапазоне скоростей потока. Начните с консервативно высокого расхода, чтобы обеспечить достаточную экстракцию СЦЖК. Расход может быть постепенно снижен в дальнейшем в процессе эксплуатации для продления срока службы насосного оборудования и трубок.
ПРИМЕЧАНИЕ: Скорость потока не должна быть настолько низкой, чтобы допускать накопление СЦЖК в бульоне биореактора (см. Репрезентативные результаты). - Медленно закройте игольчатый клапан на выходном отверстии БЭМ со стороны кожуха (Рисунок 1C), чтобы создать противодавление ~5 фунтов на кв. дюйм изб.
- Включите перистальтический насос биореактора/FEM (рис. 1I) и установите скорость насоса для достижения постоянной скорости потока в диапазоне 25–250 мл·мин-1. МКЭ может работать в относительно большом диапазоне скоростей потока. Начните с консервативно высокого расхода, чтобы обеспечить достаточную экстракцию СЦЖК. Расход может быть постепенно снижен в дальнейшем в процессе эксплуатации для продления срока службы насосного оборудования и трубок.
ПРИМЕЧАНИЕ: Скорость потока не должна быть настолько низкой, чтобы обеспечить накопление СЦЖК в бульоне биореактора (см. раздел «Репрезентативные результаты»). - Медленно закройте игольчатый клапан на выходе из корпуса МКЭ (Рисунок 1B), чтобы создать противодавление ~5 фунтов на кв. дюйм изб.
- Визуально проверьте линии обратного потока, чтобы убедиться в постоянном потоке и в том, что линии были заправлены.
- Убедитесь, что прозрачный бульон собран со стороны оболочки мембранного фильтра из полых волокон (рисунок 1J).
ПРИМЕЧАНИЕ: Потребуется несколько часов, чтобы заполнить МКЭ и установить устойчивый поток между мембранным фильтром из полых волокон и МКЭ. Скорость потока не должна быть настолько низкой, чтобы обеспечить накопление СЦЖК в бульоне биореактора (см. раздел «Репрезентативные результаты»).
- Включите перистальтический насос для отпарного раствора/БЭМ (рис. 1M) и установите скорость насоса для достижения постоянной скорости потока в диапазоне 25–250 мл·мин-1. БЭМ может работать в относительно большом диапазоне скоростей потока. Начните с консервативно высокого расхода, чтобы обеспечить достаточную экстракцию СЦЖК. Расход может быть постепенно снижен в дальнейшем в процессе эксплуатации для продления срока службы насосного оборудования и трубок.
- Загрунтовать и циркулировать органические фазовые линии.
- Включите мембранный насос для раствора для экстракции в органической фазе (рис. 1D) и установите скорость насоса для достижения постоянной скорости потока в диапазоне 5,0–50 мл·мин-1. Начните с консервативно низкого расхода, чтобы свести к минимуму давление при экстракции в органической фазе и свести к минимуму риск перехода. При необходимости скорость потока может быть постепенно увеличена позже во время работы для повышения эффективности экстракции
- Подождите, пока МКЭ и БЭМ будут заполнены.
- Визуально проверьте отверстие обратного потока в резервуаре для вытяжного раствора, чтобы обеспечить постоянный поток.
- Убедитесь, что раствор органической фазы не проникает в линии отпаривания или ферментационного бульона. Если происходит пересечение, можно увидеть мелкие капельки органической фазы. В этом случае уменьшите частоту вращения мембранного насоса и немного увеличьте противодавление на МКЭ или БЭМ, в зависимости от ситуации. Не превышайте 10 фунтов на кв. дюйм изб.
ПРИМЕЧАНИЕ: Чтобы предотвратить пересечение мембраны, важно установить расход и противодавление в линиях водной фазы перед грунтовкой линий органической фазы.
- Непрерывное извлечение СЦЖК из биореактора.
- Система LLE должна быть полностью работоспособной. Обеспечьте непрерывную работу системы во время работы биореактора.
- Ежедневно измеряйте концентрацию СЦЖК в биореакторе, чтобы обеспечить достаточную экстракцию СЦЖК. Если в биореакторе возникают повышенные концентрации СЦЖК, это обычно указывает на недостаточную скорость потока ферментационного бульона через МКЭ. Это также может указывать на снижение мембранного потока из-за загрязнения и необходимости технического обслуживания (см. шаг 2.6).
ПРИМЕЧАНИЕ: Концентрации КЦЖК и СЦЖК могут быть измерены с помощью газовой хроматографии в соответствии с методом, описанным в Ge et al.11.
- Контролируйте накопление СЦЖК в резервуаре отпарного раствора.
- Измеряйте концентрацию СЦЖК в отпаривающем растворе ежедневно в течение периодического цикла. Система LLE непрерывно переносит MFCA из биореактора в отпарной раствор, увеличивая концентрацию MCFA с течением времени. Процесс может выполняться в течение длительных периодов времени для получения высоких титров СЦЖК. Объемная скорость производства СЦЖК (мМ C·L-1·d-1) может быть оценена с помощью уравнения 111.
ПРИМЕЧАНИЕ: Объемная норма производства =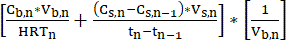 (уравнение 1)
(уравнение 1)
где:
Cb,n= концентрация СЦЖК в ферментационном бульоне на день n, мМ С
Cs,n= концентрация СЦЖК в отпаривающем растворе на день n, мМ C
Cs,n-1= концентрация СЦЖК в отпаривающем растворе на сутки n-1, мМ С
Vs,n= Объем отпарного раствора в день n, L
Vb,n= Объем ферментационного бульона (объем биореактора) в день n, л
HRTn = Время гидравлического удержания биореактора в день n, d
Tn= День n, d
Tn-1= День n-1, d - Для обеспечения стабильной работы периодически рассчитывайте скорость экстракции (мМ C·d-1) системы LLE путем измерения изменения концентрации СЦЖК между временными точками измерения и применения уравнения 211.
ПРИМЕЧАНИЕ: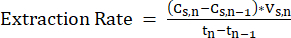 (Уравнение 2)
(Уравнение 2)
где:
Cs,n= концентрация СЦЖК в отпаривающем растворе на день n, мМ C
Cs,n-1= концентрация СЦЖК в отпаривающем растворе на сутки n-1, мМ С
Vs,n= Объем отпарного раствора в день n, L
Tn= День n, d
Tn-1= День n-1, d - Для поддержания адекватной скорости переноса из экстракционного раствора замените отпарной раствор свежей партией до того, как концентрация СЦЖК достигнет 80% насыщения.
ПРИМЕЧАНИЕ: Максимальная растворимость n-капроновой кислоты составляет 10,3 г· L-1 при 25 °C, а N-каприловой кислоты составляет 0,67 г· L-1 при 25 °C.
- Измеряйте концентрацию СЦЖК в отпаривающем растворе ежедневно в течение периодического цикла. Система LLE непрерывно переносит MFCA из биореактора в отпарной раствор, увеличивая концентрацию MCFA с течением времени. Процесс может выполняться в течение длительных периодов времени для получения высоких титров СЦЖК. Объемная скорость производства СЦЖК (мМ C·L-1·d-1) может быть оценена с помощью уравнения 111.
- Замените раствор для снятия изоляции.
- Выключите мембранный насос (рисунок 1D).
- Выключите перистальтический насос для отпаривания раствора (рис. 1M).
- Используйте хомуты для шланга для зажима входного отверстия со стороны трубы и выходного отверстия BEM.
- Выключите систему контроля pH и снимите крышку резервуара для отпарного раствора, не снимая с них соединения портов (если это возможно).
- Снимите резервуар для отпарного раствора (рисунок 1E).
- Замените резервуар для отпарного раствора свежей партией водного 0,5 М раствора борной кислоты, отрегулированного до pH 9 с использованием NaOH (см. шаг 1.4). Снова прикрепите колпачок к резервуару.
- Снимите хомуты шланга с впускного отверстия со стороны трубки и со стороны трубки выпускного отверстия BEM.
- Включите перистальтический насос для отпаривания раствора (Рисунок 1M), а затем мембранный насос (Рисунок 1D). Работа системы восстановлена.
- Уход за мембраной.
- Извлекайте МКЭ и БЭМ из системы LLE один раз в три месяца для очистки. Три месяца – это консервативная предполагаемая периодичность уборки.
ПРИМЕЧАНИЕ: В зависимости от области применения, пользователи могут очищать мембраны чаще или реже. Признаки снижения производительности мембраны описаны в разделе «Репрезентативные результаты». Во время технического обслуживания насосы и регулятор pH должны быть выключены. Инструкции по очистке должны быть предоставлены производителем мембраны. - Слейте жидкости из системы LLE в отдельные емкости, начиная с линий экстракции в органической фазе, затем линий ферментационного бульона и линий отпарного раствора.
- После того, как мембраны будут очищены и снова установлены, верните жидкости в соответствующие резервуары.
- Повторите запуск системы LLE с использованием описанного выше подхода (см. шаги 2.1-2.2).
- Извлекайте МКЭ и БЭМ из системы LLE один раз в три месяца для очистки. Три месяца – это консервативная предполагаемая периодичность уборки.
Representative Results
На положительные результаты экстракции СЦЖК указывает устойчивое накопление продуктов СЦЖК в щелочном водно-фазном растворе для отпаривания (рис. 2) и относительно стабильные концентрации СЦЖК в ферментационном бульоне (данные не показаны). На рисунке 2 показаны три полупериодических цикла отпарного раствора при непрерывной работе LLE. Цикл состоит из двух стадий: стадия замещения партии (Рисунок 2: День 24, День 46 и День 68) и стадия накопления СЦЖК (Рисунок 2: Дни 0-24, Дни 25-46, Дни 47-68). Для этой конкретной системы ферментации и LLE продолжительность цикла составляла примерно 20-24 дня. Однако продолжительность цикла будет варьироваться в зависимости от применения, поскольку она зависит от множества факторов, включая объем биореактора, биологическую производительность, объем отпарного раствора, площадь мембраны из полых волокон и скорость рециркуляции жидкости в системе LLE. В течение периодического цикла отпаривающий раствор может менять цвет с прозрачного на желтовато-коричневый из-за низкой степени совместной экстракции различных мелких органических кислот (например, гуминовой кислоты, фульвовых кислот), присутствующих в ферментационном бульоне (рис. 3). Отрицательные исходы экстракции СЦЖК проявляются в медленном накоплении продуктов СЦЖК в отпарном растворе и повышенных концентрациях СЦЖК в ферментационном бульоне по сравнению с заранее установленным исходным уровнем.
Биологическая продуктивность капроата обычно выше, чем каприлата во время этих процессов брожения; Таким образом, капроат обычно накапливается с более высокой скоростью в отпарном растворе по сравнению с каприлатом. Кроме того, для КЦЖК, таких как ацетат и бутират, нормально накапливаться в отпаривающем растворе в меньших количествах, как показано на рисунке 2. ТОПО в минеральном масле имеет более высокое сродство к СЦЖК, чем к КЦЖК, что приводит к избирательному удалению СЦЖК. Исследования Saboe et al.12, Kaur et al.13, Carvajal-Arroyo et al.14 и Ge et al.11 продемонстрировали высокую селективность TOPO по отношению к жирным кислотам в различных областях применения с использованием водных растворов. Соотношение секционирования СЦЖК и КЦЖК во время второго цикла обработки показано на рисунке 4. Можно ожидать соотношения секционирования MCFA:SCFA более 40:1 через несколько дней в пакетном цикле. Соотношение разбиения MCFA:SCFA будет стабилизироваться по мере приближения процесса экстракции к псевдостационарному состоянию. Если соотношения >40 не могут быть достигнуты через несколько дней, это говорит о том, что экстрагент TOPO деградировал или элюировал. Если это произошло, следует приготовить новый раствор для экстракции (см. шаг 1.1). Если отношение уменьшается после фазы плато, это говорит о том, что СЦЖК накопились выше 80% от своей точки насыщения. В этом случае следует приготовить новый раствор для снятия изоляции (см. шаг 1.4)
Низкая эффективность экстракции СЦЖК может быть вызвана недостаточным расходом в системе ЛЛЭ. На рисунке 5 скорость откачки была снижена в линии циркуляции ферментационного бульона и отпарного раствора, чтобы проиллюстрировать влияние снижения скорости рециркуляции жидкости на эффективность экстракции СЦЖК. Эффективность экстракции определяется как процентное содержание СЦЖК, экстрагированных в отпарном растворе, по отношению к общему количеству СЦЖК, произведенных биореактором, плюс СЦЖК, извлеченных с помощью НЛЭ. Можно ожидать, что эффективность экстракции превысит 85% при нормальной эксплуатации (Рисунок 5, День 1-14). При низкой частоте вращения насоса (Рисунок 5, День 14) эффективность вытяжки снижается. Когда достаточная скорость насоса восстанавливается, для восстановления эффективности вытяжки может потребоваться несколько дней. Это может быть вызвано снижением установившейся концентрации СЦЖК в экстракционном растворе, вызванным разницей в скоростях экстракции отпарного раствора (выше) по сравнению с ферментационным бульоном (ниже).
Снижению эффективности экстракции могут способствовать и другие факторы, в том числе (1) загрязнение мембраны, (2) ограничение потока жидкости на каждой стадии системы LLE из-за засорения, (3) образование газовых карманов в мембранных контакторах и (4) приближение концентраций СЦЖК в отпарном растворе к точкам насыщения. На загрязнение мембраны указывает уменьшение мембранного потока с течением времени относительно исходных условий. Хотя образование биопленки в МКЭ маловероятно, загрязнение может произойти из-за накопления клеточного мусора и других взвешенных твердых частиц. Кроме того, несмотря на то, что БЭМ является асептическим, поток может быть затруднен из-за осаждения солей жирных кислот внутри мембранного контактора или трубки с течением времени. Тем не менее, регулярное техническое обслуживание и очистка мембранных контакторов (см. шаг 2.6) должны предотвратить образование проблем с загрязнением и выпадением солей. Из-за неправильного расположения на верхней стороне оболочки мембранных контакторов иногда образуются газовые карманы. Мембранные контакторы должны быть слегка наклонены от вертикали, чтобы выпускное отверстие со стороны корпуса находилось в самой высокой точке, позволяя образующемуся газу выходить из контактора. Поток жидкости в системе LLE настроен таким образом, чтобы течь снизу вверх от подрядчиков, чтобы помочь промыть газовые карманы. Наконец, перенос СЦЖК из экстракционного раствора в отпарной раствор в БЭМ уменьшается при очень высоких концентрациях СЦЖК в отпарном растворе. Эту проблему можно устранить, заменяя раствор для снятия изоляции чаще.
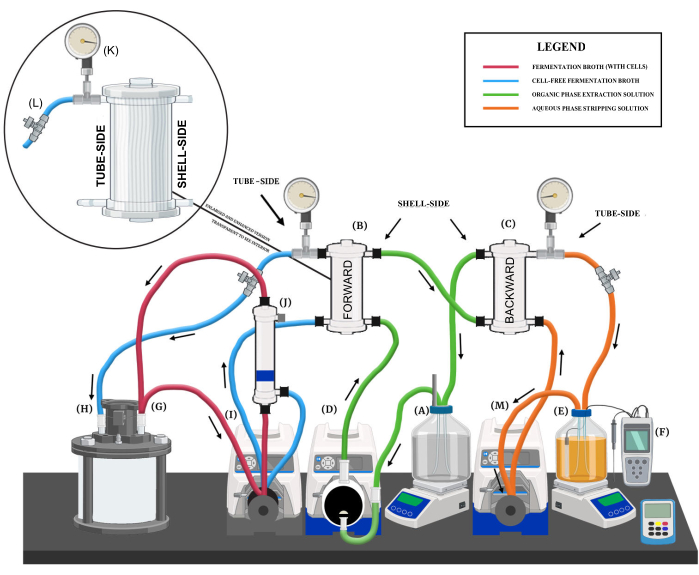
Рисунок 1: Обзор системы экстракции жидкость-жидкость. Диаграмма, показывающая основные компоненты системы, различные контуры жидкости и направления потока. Основные компоненты системы обозначены следующим образом: (A) резервуар для раствора для экстракции в органической фазе, (B) мембрана прямого обмена, (C) мембрана обратного обмена, (D) мембранный насос для экстракционного раствора, (E) резервуар для отпарного раствора в водной фазе, (F) система контроля pH, (G) выходное отверстие биореактора, (H) обратное отверстие биореактора, (I) перистальтический насос с мембраной прямого обмена и мембранным фильтром из полых волокон, (J) мембранный фильтр из полых волокон, (K) манометр, (L) игольчатый клапан и (M) перистальтический насос для отпарного раствора. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
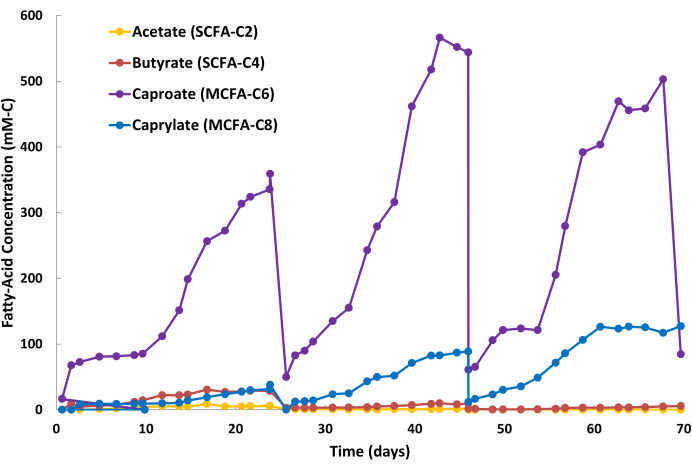
Рисунок 2: Накопление жирных кислот в отпарном растворе. Данные, показывающие концентрации короткоцепочечных жирных кислот и среднецепочечных жирных кислот в течение трех периодических циклов отпарного раствора во время непрерывной операции жидкостно-жидкостной экстракции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Изменение цвета отпаривающего раствора после экстракции. Фотография, показывающая изменение цвета раствора для отпаривания в водной фазе до (т.е. предварительного замеса) и после (т.е. после замеса) цикла замеса. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
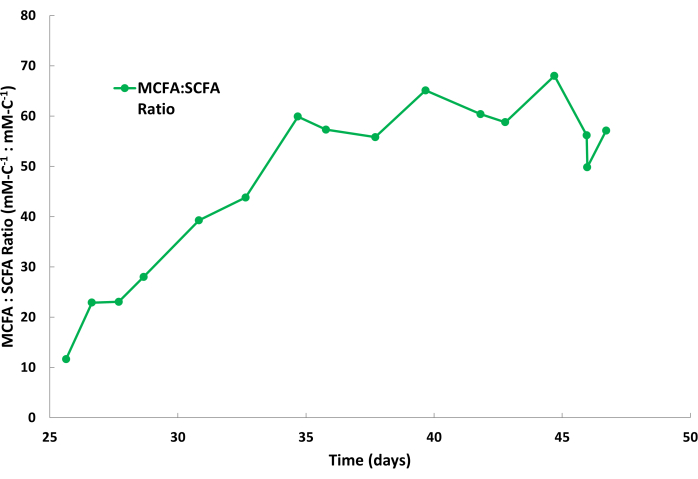
Иллюстрация 4: Соотношения жирных кислот в отпарном растворе. Данные, показывающие соотношение среднецепочечных жирных кислот к короткоцепочечным жирным кислотам во время периодического цикла отпарного раствора во время непрерывной операции жидкостно-жидкостной экстракции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
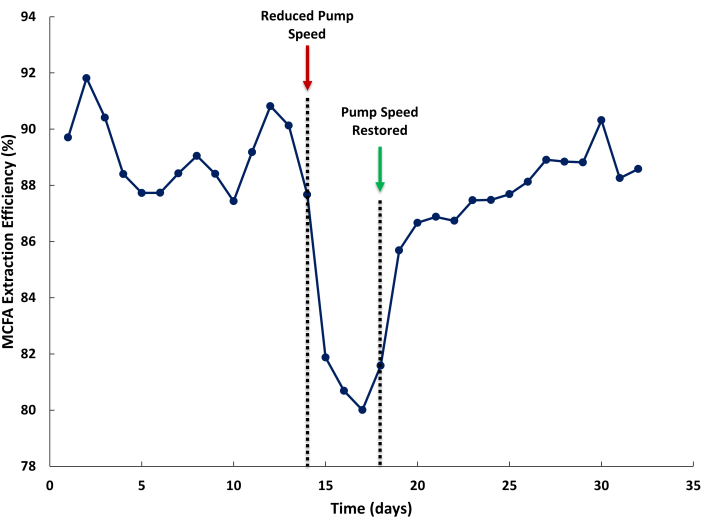
Иллюстрация 5: Влияние скорости мембранного потока на эффективность экстракции. Данные, показывающие влияние недостаточной скорости потока через прямую и обратную обменную мембрану на эффективность экстракции среднецепочечных жирных кислот во время работы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Discussion
Биологически произведенные СЦЖК обычно встречаются в смесях наряду с различными органическими соединениями, включая СЦЖК и спирты2. Следовательно, для их восстановления и эффективного использования необходим процесс селективного разделения. Разработанная здесь система LLE селективно экстрагирует СЦЖК из этих смесей непрерывно, сохраняя при этом КЦЖК и спирты. Эта функциональность делает систему LLE особенно подходящей для ферментации, такой как удлинение микробной цепи, где MCFA, SCFAs и спирты являются основными метаболитами8. В частности, система LLE позволяет протекать процессу удлинения цепи путем удаления СЦЖК, предотвращая ингибирование продукта1, в то же время оставляя КЦЖК и реагенты алкоголя в ферментационном бульоне для последующей биологической конверсии. Система LLE может быть адаптирована для других применений путем модификации конкретного решения для экстракции. Например, непрерывная экстракция КЦЖК, образующихся во время ферментации, может быть достигнута с использованием той же системы LLE путем удаления TOPO из смеси растворов экстрагента.
Таким образом, значение метода LLE заключается в том, что он обеспечивает более надежную технику экстракции MCFA для этих биотехнологических и биотехнологических приложений по сравнению с другими методами. Двухфазная экстракция in situ с несмешивающимися жидкостями является еще одним подходом к извлечению СЦЖК из ферментационного бульона15. Однако такой подход относительно неэффективен. Слои эмульсии образуются между водной фазой (т.е. ферментационным бульоном) и органической фазой, что сильно ограничивает скорость массообмена. Минимальное перемешивание межфазной жидкости между фазовыми слоями также ограничивает массоперенос. Еще одним недостатком является то, что микробные клетки находятся в непосредственном контакте с органической фазой, вызывая увлечение, ингибированиеи гибель клеток. Наконец, двухфазная экстракция in situ требует частого обслуживания для удаления и замены органической фазы.
Применение высоких скоростей разбавления в биореакторе является еще одним методом предотвращения ингибирования продукта16. Высокая скорость разбавления позволяет достичь высокой производительности за счет поддержания высоких концентраций реагентов в биореакторе. Однако этот подход является невыгодным, поскольку он способствует вымыванию биомассы, образованию больших объемов сточных вод и высоким потерям субстрата (т.е. КЦЖК и спиртов), что приводит к низкой урожайности. Эти недостатки могут быть смягчены с помощью рециркуляции иммобилизованной биомассы и сточных вод, но эти вмешательства усложняют систему17. Наконец, концентрация СЦЖК в потоке продукта разбавляется, что делает СЦЖК неэффективной и дорогостоящей.
Новый подход к экстракции может включать в себя непрерывную дистилляцию СЦЖК с помощью одной мембраны прямой экстракции, которая физически разделяет органическую и водную фазы, тем самым сохраняя и защищая микробную биомассу. СЦЖК будут селективно экстрагироваться в органическую фазу, а затем дистиллироваться. Рафинат может непрерывно перерабатываться в экстракционную мембрану. Непрерывная дистилляция, однако, является технически сложной задачей, особенно в лабораторных условиях, и может привести к ухудшению или потере химического экстрагента при длительной эксплуатации. Дистилляция может также вызывать термическую деградацию органической фазы и продуктов СЦЖК18.
Процесс LLE позволяет избежать многих недостатков, связанных с этими альтернативными подходами, за счет включения нескольких критически важных функций и этапов обработки. Во-первых, гидрофильный мембранный фильтр из полых волокон выполняет двойную функцию: защищает клетки биомассы (биокатализаторы) от воздействия экстрагентного раствора в FEB, обеспечивая при этом прозрачный фильтрат, богатый MCFA, который снижает загрязнение и накопление твердых частиц в системе LLE. Во-вторых, чтобы предотвратить пересечение жидкости, мы предусмотрели игольчатые клапаны для создания обратного давления со стороны трубки каждого мембранного контактора. Эта мера предосторожности поддерживает небольшой трансмембранный градиент давления, предотвращая нежелательную утечку гидрофобного органического растворителя со стороны оболочки на сторону водной трубки в МКЭ и МЭМ. Кроме того, потоки жидкости сконфигурированы таким образом, чтобы течь параллельно от основания к верхней части МКЭ и МКЭ, чтобы предотвратить попадание пузырьков газа, которые могут собираться внутри мембранных модулей, снижая эффективность переноса и вызывая унос. Кроме того, в этом методе используется мембранный насос с химически стойкой головкой из ПТФЭ для перекачивания коррозионного экстрагентного раствора, содержащего MCFA, что защищает систему от коррозии и поломок, которые могут поставить под угрозу процесс экстракции. Наконец, раствор для щелочной отпарки с контролем pH поддерживает градиент pH, который обеспечивает непрерывный перенос СЦЖК через систему LLE с высокой скоростью из биореактора в резервуар для отпарного раствора, где СЦЖК депротонируют и накапливаются до высоких титров, способствуя извлечению продукта на последующих этапах.
Данный метод ЛЛЭ подходит для непрерывной экстракции СЦЖК из биореакторов лабораторного масштаба (до 6 л рабочего объема) и был валидирован для длительной эксплуатации в нескольких исследованиях 1,9,11,19. Метод LLE также может быть применен для более крупномасштабныхприменений14 (т.е. для экспериментальных биореакторов), но для этого требуются пропорционально масштабируемые мембраны и оборудование для работы с флюидами. Тем не менее, метод имеет некоторые ограничения, в основном в области обслуживания и сложности системы. Поскольку процесс рассчитан на непрерывную работу, мембранные модули и насосы необходимо часто обслуживать, что приводит к значительным простоям. Еще одним недостатком является то, что для отпаривания требуется относительно большое количество NaOH и борной кислоты. Кроме того, СЦЖК являются коррозионными и вызывают износ некоторых компонентов системы ЛЛЭ с течением времени. Например, пластиковые разъемы и корпус мембраны могут стать хрупкими, требуя замены в процессе эксплуатации. Наконец, сеть работы с жидкостями в системе LLE является сложной, включающей множество точек подключения, которые могут привести к утечкам. Однако большинство из этих ограничений и недостатков типичны для процессов непрерывного мембранного разделения, и их следует ожидать.
В целом, этот протокол LLE предлагает надежный и эффективный подход к селективной экстракции MCFA, что имеет значение для продвижения исследований в различных областях. Метод может найти множество актуальных применений в области прецизионной ферментации для восстановления in-situ продуктов внеклеточного метаболизма во время ферментации. LLE может быть более дешевой альтернативой традиционным методам последующей обработки (DSP), таким как центрифугирование после запуска, микро- и ультрафильтрация или экстракция растворителем, выполняемая партиями. Действительно, DSP часто представляет собой основной фактор затрат в промышленных процессах ферментации. Непрерывная экстракция продукта с использованием LLE также может обеспечить непрерывную ферментацию, значительно повышая производительность операций и эффективность работы по сравнению с традиционными подходами с периодической подачей. Кроме того, в будущих исследованиях могут быть изучены экстрагентные среды, отличные от органических растворителей, такие как глубоководные эвтектические растворители или ионные жидкости. Наконец, система LLE, описанная в настоящем протоколе, предназначалась для экспериментальных целей в лабораторных условиях; Таким образом, все еще существуют значительные возможности для оптимизационных исследований для снижения энергопотребления, площади мембраны, а также общего выхода и скорости экстракции.
Disclosures
Конфликта интересов нет.
Acknowledgements
Авторы выражают признательность за техническую и финансовую поддержку, оказанную Сельскохозяйственной опытной станцией при Университете Джорджии. Кроме того, авторы хотят поблагодарить Сэмюэля Огундипе, доктора Рональда Пегга и доктора Джун Хёк Су за помощь в анализе технологических образцов.
Materials
| Name | Company | Catalog Number | Comments |
| 10 L Media Bottle | Duran | 218018658 | |
| 3.5 L Media Bottle | Duran | 218016957 | |
| Boric acid, 99.5%, | ThermoScientific (Fisher Scientific) | 327132500 | |
| Hydrophilic MINIKROS 20CM 0.2UM PES 1MM 1.5TC X 3/4TC | Repligen | N02-P20U-10-N | |
| L/S Variable-Speed Pump Drive; 100 rpm | MasterFlex (VWR) | MFLX07528-10 | |
| L/S Variable-Speed Pump Drive; 300 rpm | MasterFlex (VWR) | MFLX07528-20 | |
| Light Mineral Oil, NF (4 Liters) (CAS: 8042-47-5) | Thomas Scientific | C761Z18 | |
| Liqui-Cel 2.5x8 X50 membrane CO2, PP Housing Viton O-rings (0.5-3 gpm (0.1-0.7 m3/h)), 1/4-in FNPT connections | 3M | LC-02508X50-G453 | |
| Magnetic Stirrer, 20 L Capacity, 110 V | Cole-Parmer | EW-04661-29 | |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 14 | MasterFlex (VWR) | MFLX06402-14 | Specific tubing size will depend on application. |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 16 | MasterFlex (VWR) | MFLX06402-16 | Specific tubing size will depend on application. |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 17 | MasterFlex (VWR) | MFLX06402-17 | Specific tubing size will depend on application. |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 18 | MasterFlex (VWR) | MFLX06402-18 | Specific tubing size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 14, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07014-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 14, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07014-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 16, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07016-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 17, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07017-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 18, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07018-20 | Specific pump head size will depend on application. |
| MasterFlex PTFE-diaphragm pump head, 10 to 100 mL/min | MasterFlex (VWR) | MFLX07090-62 | |
| Oakton 220 pH/ORP/Temperature Controller, 1/8 DIN | Spectrum Laboratory Products | 664-12595-E1 | |
| Oakton 220 pH/ORP/Temperature Controller, 1/8 DIN | Spectrum Laboratory Products | 664-12595-E1 | |
| Oakton Female BNC-to-Stripped Wire Adapter | Spectrum Laboratory Products | 664-12592-E1 | |
| pH Probe with BNC Connector | ThermoScientific | 10010-788 | Any pH probe with a BNC connector will suffice. |
| Precision Flow-Adjustment Valve, White Polypropylene, 1/4 NPT Male x Male | McMaster-Carr | 7792K57 | |
| ProConnex Fittings Kits - A | Repligen | ACPX-KT2-01N | Compatible with Hydrophilic MINIKROS Filter |
| ProConnex Fittings Kits - B | Repligen | ACPX-KT1-01N | Compatible with Hydrophilic MINIKROS Filter |
| Sodium Hydroxide Pellets for Analysis | Sigma Aldrich | 1.06498 | |
| Stainless-Steel Pressure Gauge 0-60 psi Stainless Steel 1/4" NPT 2.5" Face Dial | NA | XJ-219 | Any comparable pressure gauge covering 0-60 psig range will suffice. |
| Trioctylphosphine oxide (TOPO) | Sigma-Aldrich | 346187-100G |
References
- Palomo-Briones, R., et al. Near-neutral ph increased n-caprylate production in a microbiome with product inhibition of methanogenesis. Chem Eng J. 446, 137170 (2022).
- Wang, J., Yin, Y. Biological production of medium-chain carboxylates through chain elongation: An overview. Biotechnol Adv. 55, 107882 (2022).
- Watanabe, S., Tsujino, S. Applications of medium-chain triglycerides in foods. Front Nutr. 9, 802805 (2022).
- Meijaard, E., et al. The environmental impacts of palm oil in context. Nat Plants. 6 (12), 1418-1426 (2020).
- Meijaard, E., Abrams, J. F., Juffe-Bignoli, D., Voigt, M., Sheil, D. Coconut oil, conservation and the conscientious consumer. Curr Bio. 30 (13), R757-R758 (2020).
- Angenent, L. T., Magdalena, J. A., Jeon, B. S., Usack, J. G. Eco-mimicry opens new doors for bioprocess engineers. Joule. 4 (10), 2074-2077 (2020).
- Shahab, R. L., et al. A heterogeneous microbial consortium producing short-chain fatty acids from lignocellulose. Science. 369 (6507), eabb1214 (2020).
- Magdalena, J. A., Angenent, L. T., Usack, J. G. The measurement, application, and effect of oxygen in microbial fermentations: Focusing on methane and carboxylate production. Fermentation. 8 (4), 138 (2022).
- Agler, M. T., Spirito, C. M., Usack, J. G., Werner, J. J., Angenent, L. T. Development of a highly specific and productive process for n-caproic acid production: Applying lessons from methanogenic microbiomes. Water Sci Technol. 69 (1), 62-68 (2013).
- Gildemyn, S., et al. Upgrading syngas fermentation effluent using Clostridium kluyveri in a continuous fermentation. Biotechnol Biofuels. 10 (1), 83 (2017).
- Ge, S., Usack, J. G., Spirito, C. M., Angenent, L. T. Long-term n-caproic acid production from yeast-fermentation beer in an anaerobic bioreactor with continuous product extraction. Env Sci Technol. 49 (13), 8012-8021 (2015).
- Saboe, P. O., et al. In situ recovery of bio-based carboxylic acids. Green Chem. 20 (8), 1791-1804 (2018).
- Kaur, G., et al. Reactive extraction for in-situ carboxylate recovery from mixed culture fermentation. Biochem Eng J. 160, 107641 (2020).
- Carvajal-Arroyo, J. M., et al. Production and extraction of medium-chain carboxylic acids at a semi-pilot scale. Chem Eng J. 416, 127886 (2021).
- Choi, K., et al. In situ biphasic extractive fermentation for hexanoic acid production from sucrose by Megasphaera elsdenii NCIMB 702410. Appl Biochem Biotechnol. 171 (5), 1094-1107 (2013).
- Grootscholten, T., Steinbusch, K., Hamelers, H., Buisman, C. Improving medium chain fatty acid productivity using chain elongation by reducing the hydraulic retention time in an upflow anaerobic filter. Bioresour Technol. 136, 735-738 (2013).
- Grootscholten, T., Dal Borgo, F. K., Hamelers, H., Buisman, C. Promoting chain elongation in mixed culture acidification reactors by addition of ethanol. Biomass Bioenergy. 48, 10-16 (2013).
- Cermak, S. C., Evangelista, R. L., Kenar, J. A. Distillation of natural fatty acids and their chemical derivatives. Distillation-Advances from Modeling to Applications Chapter. 5, 109-142 (2012).
- Agler, M. T., Spirito, C. M., Usack, J. G., Werner, J. J., Angenent, L. T. Chain elongation with reactor microbiomes: Upgrading dilute ethanol to medium-chain carboxylates. Energy Environ Sci. 5 (8), 8189-8192 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved