14.10 : Küçük x Varsayımı
Bir tepkimenin denge sabiti küçükse, denge konumu reaktanlardan yanadır. Bu tür reaksiyonlarda, reaktanların başlangıç konsantrasyonları yüksekse ve Kc değeri küçükse, konsantrasyonda ihmal edilebilir bir değişiklik meydana gelebilir. Bu gibi durumlarda, denge konsantrasyonu yaklaşık olarak başlangıç konsantrasyonuna eşittir. Bu tahmin, bazı denge konsantrasyonlarının başlangıç konsantrasyonlarına eşit olduğu varsayılarak denge hesaplamalarını basitleştirmek için kullanılabilir. Ancak, bu varsayımı yapmak için, zayıf bir asit veya bazın konsantrasyonundaki değişiklik, yani x, başlangıç konsantrasyonunun %5'inden az olmalıdır. x %5'ten fazlaysa, denge denklemini çözmek için ikinci dereceden formül kullanılmalıdır.
Cebirsel Sadeleştirme Varsayımı Kullanılarak Denge Konsantrasyonlarının Hesaplanması
0,15 M HCN çözeltisinin dengesindeki konsantrasyonlar nelerdir?
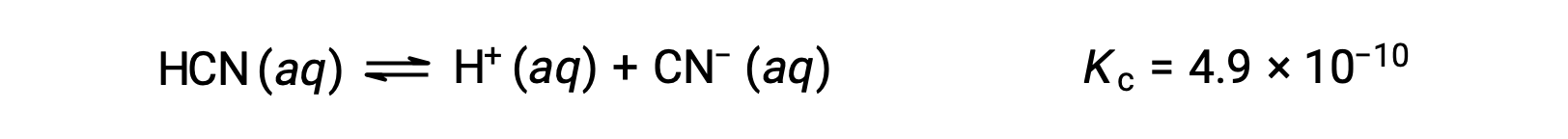
Dengedeki her bir ürünün konsantrasyonlarını açıklamak için x’in kullanılması şu ICE tablosunu verir.
| HCN (aq) | H+ (aq) | CN− (aq) | |
| Başlangıç Konsantrasyonu (M) | 0,15 | 0 | 0 |
| Değişim (M) | −x | +x | +x |
| Denge Konsantrasyonu (M) | 0,15 − x | x | x |
Denge konsantrasyonu terimlerini Kc ifadesiyle değiştirin
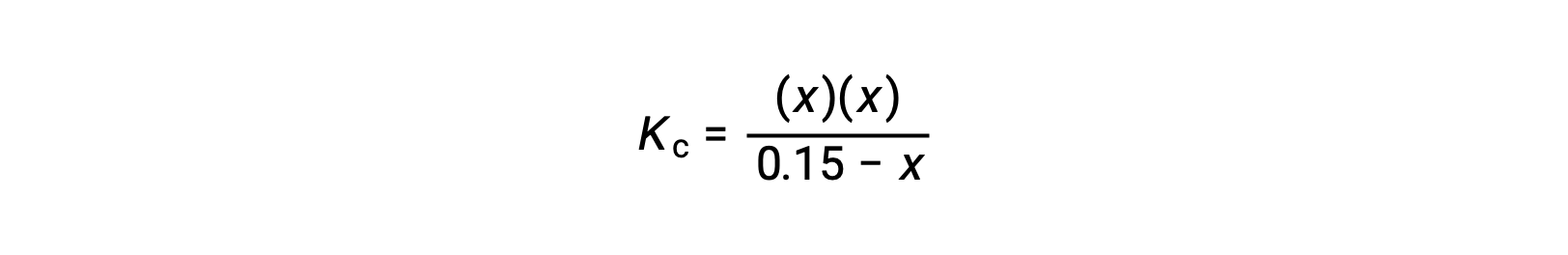
kuadratik formu yeniden düzenleyin ve x’i çözün.
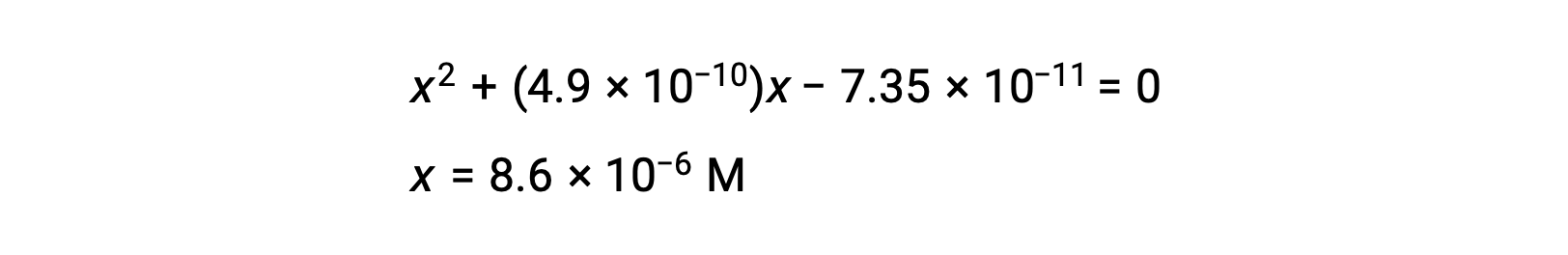
Bu yüzden, [H+] = [CN–] = x = 8,6 × 10–6 M and [HCN] = 0,15 – x = 0,15 M.
Bu durumda konsantrasyondaki değişikliğin ilk konsantrasyondan önemli ölçüde daha az olduğuna (küçük K'nin bir sonucu) ve dolayısıyla ilk konsantrasyonun ihmal edilebilir bir değişiklik yaşadığına dikkat edin:

Bu yaklaşım, ikinci dereceden bir denklemin köklerini çözme ihtiyacını ortadan kaldıran hesaplamaya daha uygun bir matematiksel yaklaşım sağlar:
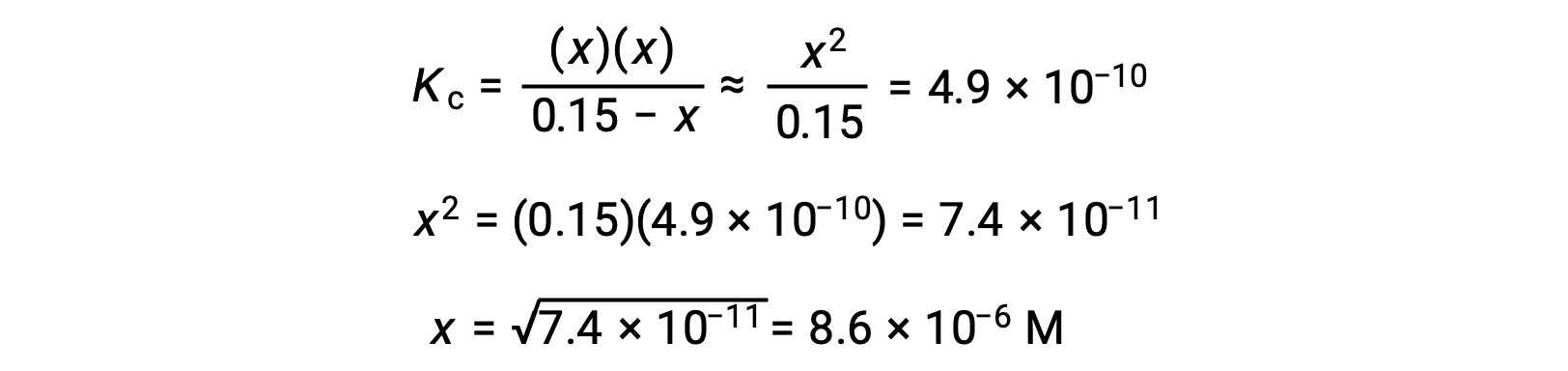
Hesaplanan x değeri gerçekten de başlangıç konsantrasyonundan çok daha azdır
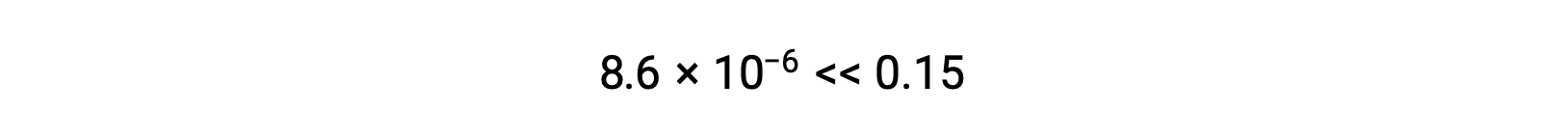
ve böylece yaklaşım doğrulanmış olur. Bu basitleştirilmiş yaklaşım, x için yaklaşımı doğrulamayan bir değer verecek olsaydı, hesaplamanın yaklaşım yapılmadan tekrarlanması gerekirdi.
Bu metin bu kaynaktan uyarlanmıştır: Openstax, Chemistry 2e, Section 13.4 Equilibrium Calculations.
Bölümden 14:

Now Playing
14.10 : Küçük x Varsayımı
Kimyasal Denge
45.9K Görüntüleme Sayısı

14.1 : Dinamik Denge
Kimyasal Denge
50.4K Görüntüleme Sayısı

14.2 : Denge Sabiti
Kimyasal Denge
46.7K Görüntüleme Sayısı

14.3 : Gazlı Reaksiyonlar ve Heterojen Reaksiyonlar için Denge
Kimyasal Denge
24.6K Görüntüleme Sayısı

14.4 : Denge Sabitinin Hesaplanması
Kimyasal Denge
31.0K Görüntüleme Sayısı

14.5 : Reaksiyon Katsayısı
Kimyasal Denge
48.1K Görüntüleme Sayısı

14.6 : Denge Konsanstrasyonlarını Hesaplama
Kimyasal Denge
47.5K Görüntüleme Sayısı

14.7 : Le Chatelier Prensibi: Konsantrasyon Değiştirme
Kimyasal Denge
57.6K Görüntüleme Sayısı

14.8 : Le Chatelier Prensibi: Hacim (Basınç) Değiştirme
Kimyasal Denge
34.3K Görüntüleme Sayısı

14.9 : Le Chatelier Prensibi: Sıcaklık Değiştirme
Kimyasal Denge
29.2K Görüntüleme Sayısı
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır