14.10 : 작은 x 가정
반응에 일정한 작은 평형이있는 경우 평형 위치는 반응제를 선호합니다. 이러한 반응에서, 반응제의 초기 농도가 높고 Kc 값이 작으면 농도의 무시할 수 있는 변화가 발생할 수 있다. 이러한 상황에서 평형 농도는 초기 농도와 거의 동일합니다. 이러한 추정은 일부 평형 농도가 초기 농도와 동일하다고 가정하여 평형 계산을 단순화하는 데 사용될 수 있다. 그러나, 이러한 가정을 하기 위해, 약한 산 또는 염기의 농도의 변화, 즉 x,초기 농도의 5% 미만이어야 한다. x가 5% 이상인 경우 이차 수식을 사용하여 평형 방정식을 해결해야 합니다.
대수 단순화 가정을 사용하여 평형 농도 계산
HCN의 0.15 M 용액의 평형농도는 무엇입니까?
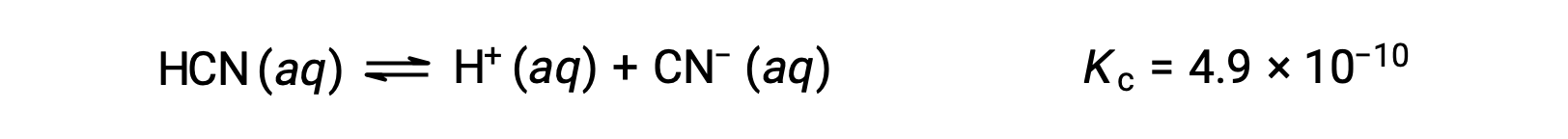
x를 사용하여 평형에서 각 제품의 농도를 나타내면 이 ICE 테이블이 제공됩니다.
| HCN(아크) | H+ (아크) | CN- (아크) | |
| 초기 농도(M) | 0.15 | 0 | 0 |
| 변경(M) | -x | +x | +x |
| 평형 농도 (M) | 0.15 - x | Ⅹ | Ⅹ |
평형 농도 용어를 Kc 식으로 대체
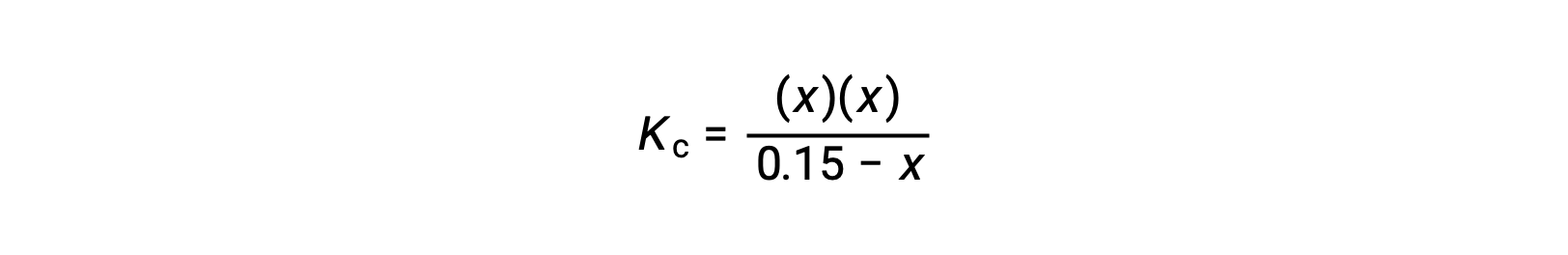
이차 형태로 재배열하고 x를 위해 해결
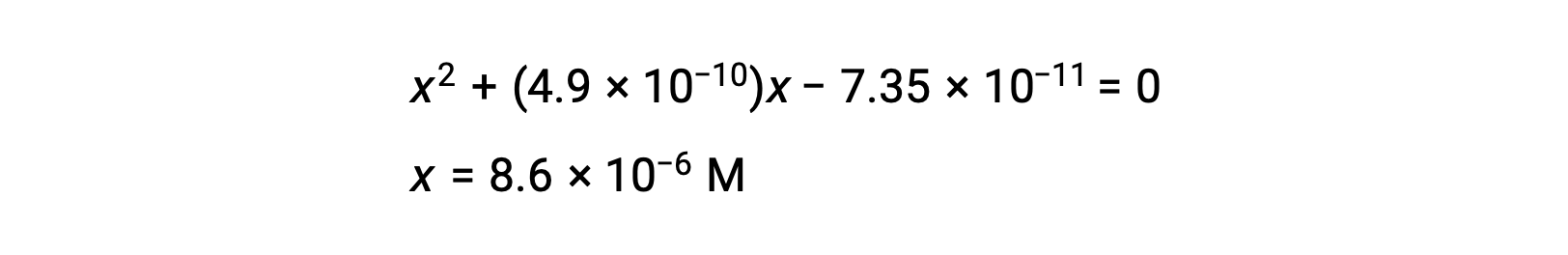
따라서 [H+]= [CN–] = x = 8.6 × 10-6 M 및 [HCN] = 0.15 – x = 0.15 M.
이 경우 농도의 변화는 초기 농도(작은 K의결과)보다 현저히 적기 때문에 초기 농도는 무시할 수 있는 변화를 경험합니다.

이 근사치를 통해 이차 방정식의 뿌리를 해결할 필요가 없도록 계산에 대한 보다 편리한 수학적 접근 방식을 허용합니다.
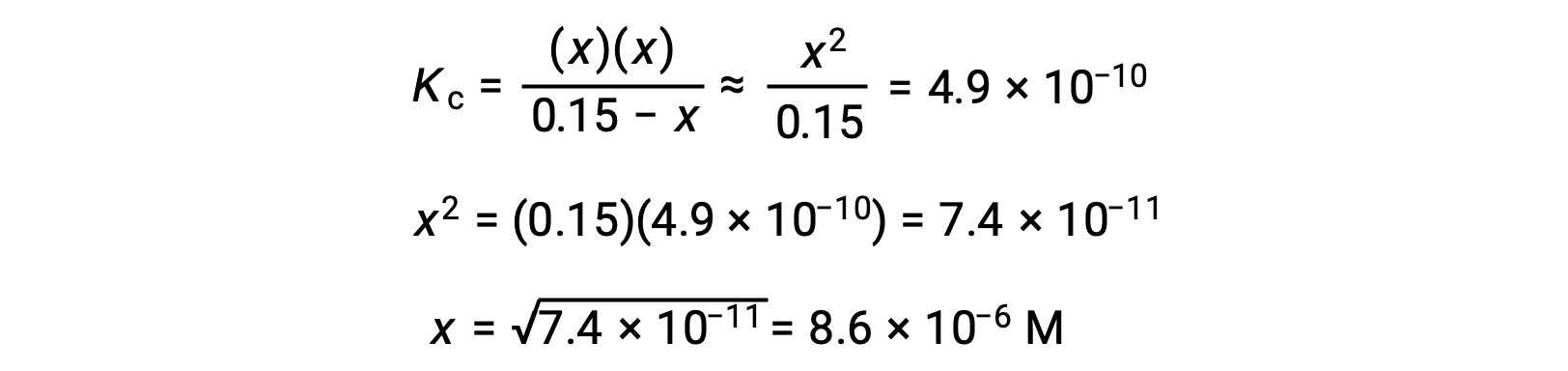
계산된 x의 값은 실제로 초기 농도보다 훨씬 적습니다.
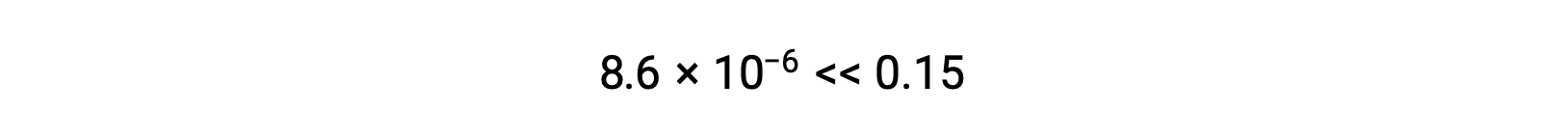
그래서 근사치가 정당화되었다. 이 단순화된 접근 방식이 근사치를 정당화하지 않는 x에 대한 값을 산출하는 경우 근사치를 만들지 않고 계산을 반복해야 합니다.
장에서 14:

Now Playing
14.10 : 작은 x 가정
화학 평형
45.8K Views

14.1 : 동적평형
화학 평형
49.9K Views

14.2 : 평형상수
화학 평형
46.3K Views

14.3 : 기체 반응과 불균일계 반응의 평형
화학 평형
24.4K Views

14.4 : 평형상수 계산
화학 평형
30.7K Views

14.5 : 반응지수
화학 평형
47.9K Views

14.6 : 평형 농도 계산
화학 평형
47.2K Views

14.7 : 르샤틀리에의 원리: 농도 변화
화학 평형
57.2K Views

14.8 : 르샤틀리에의 원리: 부피 변화 (압력 변화)
화학 평형
33.9K Views

14.9 : 르샤틀리에의 원리: 온도 변화
화학 평형
28.9K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유